带鱼Trichiurus lepturus[1]为暖水性中下层鱼类,广泛分布于印度洋、大西洋和西太平洋的温、亚热带、热带海域[2]。迄今为止,关于带鱼生物学的研究多集中在年龄与生长[3-5]、种群结构[6]、摄食习性[7-8]、性腺成熟度、肛长与体质量的关系[9-10]等方面,研究海域包括中国海[11-13]、缅甸安达曼海域[1]、印尼阿拉弗拉海域[9]、印度芒格洛尔海域[10]、印度西海岸[7-8]和巴西海域[14-19]等。
据FAO统计,带鱼是伊朗专属经济区的重要渔获品种[20],也是中国带鱼渔获量的重要来源之一,但国内外学者对阿曼湾海域的带鱼生物学特性罕有研究。本文中根据现场采集的数据,研究了带鱼的繁殖特性、摄食等级、生长特性、肛长与体质量分布等生物学特性,旨在为带鱼种群的区划和资源评估奠定基础。
1 材料与方法
1.1 材料
研究数据来自2017年7月—8月及2018年5月—7月期间阿曼湾(25°21′~25°41′ N、57°01′~57°53′ E)海域(图1),使用3艘相同类型的底拖网渔船(汉荣118号、汉荣126号、汉荣127号)采集的带鱼生物学数据,包括带鱼性别、性腺成熟度、摄食等级、体质量和肛长。受现场条件的限制,性腺成熟度与摄食等级采用目测法,性腺成熟度及胃充满度的分级标准分别采用中国普遍使用的海洋鱼类六期分类标准和鱼类胃含物充满度的五级分类标准[21-22]。肛长使用测量尺测量,精度为1 mm;体质量使用电子秤称量,精度为1 g。
1.2 方法
1.2.1 性腺成熟度与摄食等级 对不同摄食等级及性腺成熟个体肛长进行协方差分析和卡方检验[1,9],显著性水平设为0.05。
1.2.2 肛长与体质量 群体肛长与体质量组成分析采用频率分布法,组距分别为50 mm和200 g。肛长与体质量的关系采用幂函数曲线进行拟合,表达式为[11,23]
W=aLb。
(1)
其中:W为带鱼体质量(g);L为带鱼肛长(mm);a为系数;b为指数。
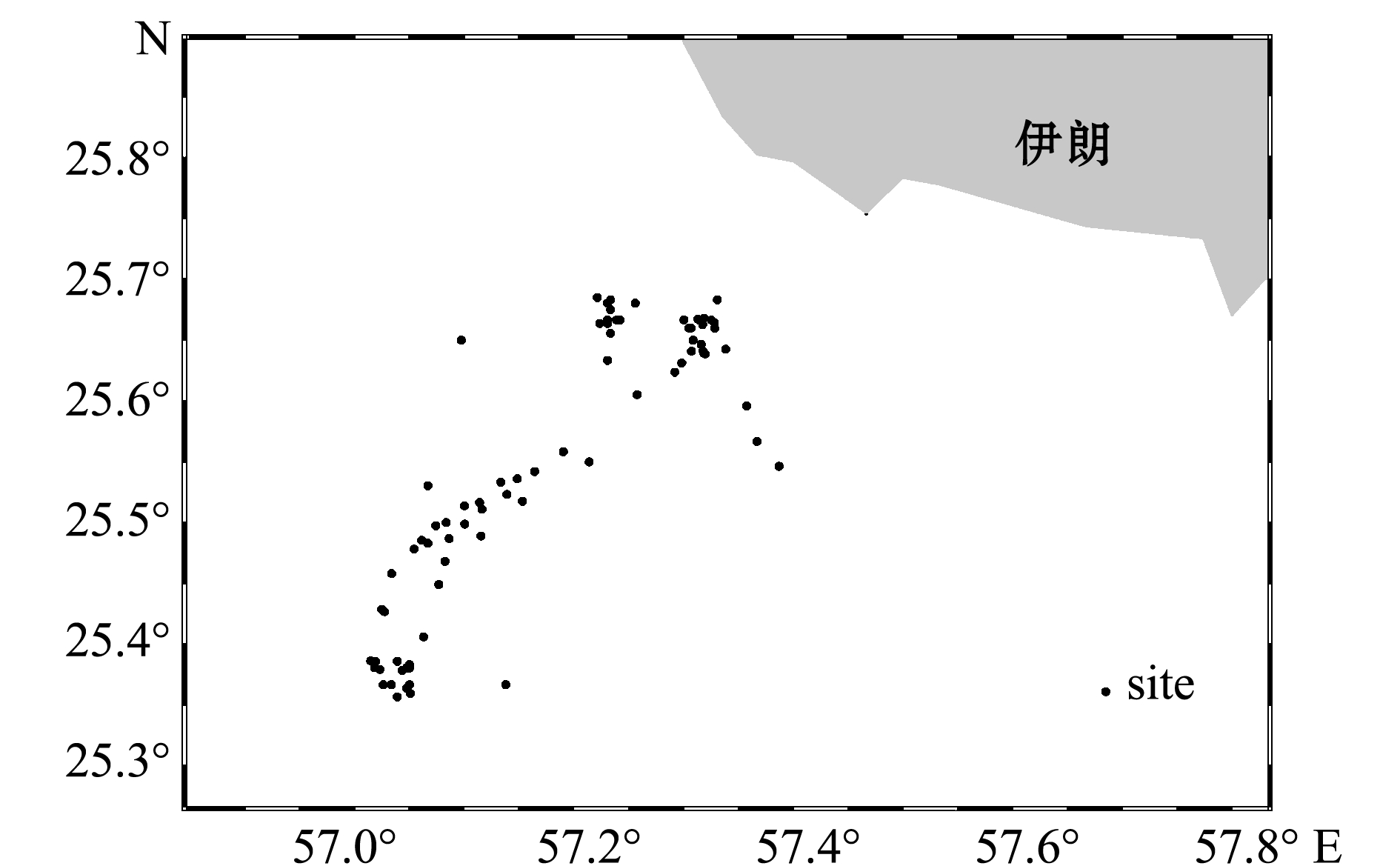
图1 带鱼样本采集站点
Fig.1 Sampling sites of silvery hairtail fish Trichiurus lepturus
1.2.3 初次性成熟肛长 以20 mm为间距,利用不同肛长组内性腺成熟个体所占百分比拟合Logistic曲线,推算带鱼的初次性成熟肛长公式,表达式[24-25]为
pi=1/[1+e-(x+yLi)] ,
(2)
LM50%=-x/y。
(3)
其中:pi为肛长组内性成熟个体占该肛长组内样本的百分比;Li为各组肛长(mm);LM50%为初次性成熟肛长(mm);x、y均为指数。
1.2.4 带鱼Von Bertalanffy生长方程 将年龄与肛长及年龄与体质量进行线性回归,拟合年龄与肛长、年龄与体质量的Von Bertalanffy生长方程[26-27]为
(4)
(5)
通过生长方程式中L∞、W∞、k及t0的参数值,拟合肛长生长速度、体质量增加速度及体质量增加速度拐点年龄方程,其表达式为
![]()
(6)
![]()
(7)
(8)
其中:L(t)为理论某一年龄的肛长(mm);W(t)为理论某一年龄的体质量(g);L∞为极限肛长(mm);W∞为极限体质量(g);t为年龄(a);t0为理论生长起点年龄(a);k为相对生长指标;b为同一瞬时相对体质量增长率与相对肛长生长率之比[26];dL/dt为肛长生长速度;dW/dt为体质量增加速度;tw为体质量增加速度曲线拐点年龄(a)。
2 结果与分析
2.1 繁殖特性
2.1.1 雌雄性比 两年共采集带鱼1670尾,雌雄性比为1.30∶1.00。其中,2017年采集250尾带鱼,雌雄性比为1.29∶1.00,2018年采集1420尾带鱼,雌雄性比为1.31∶1.00。
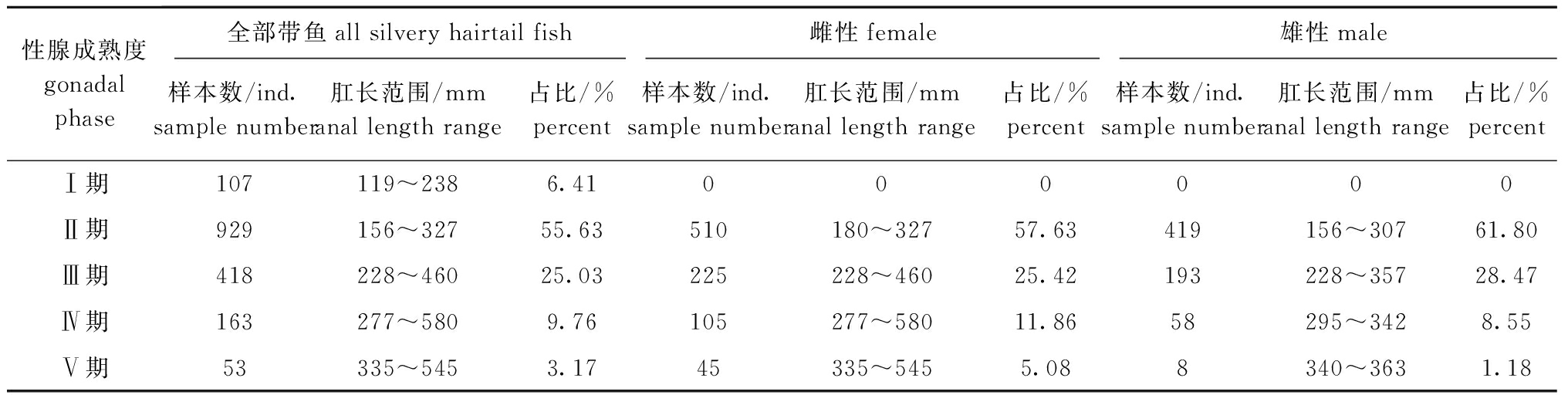
2.1.2 性腺成熟度与肛长 从图2可见,平均肛长随着性腺成熟度呈上升趋势,且Ⅳ、Ⅴ期平均肛长上升趋势加快,雌性Ⅳ、Ⅴ期的平均肛长大于雄性, Ⅱ、Ⅲ期平均肛长差异较小。从表1可见:性腺成熟度以Ⅱ期和Ⅲ期为主,占样本总量的80.66%;雌性Ⅱ期肛长范围为180~327 mm,雄性为156~307 mm;雌性Ⅲ期肛长范围为228~460 mm,雄性为228~357 mm;雌性Ⅳ期肛长范围为277~580 mm,雄性为295~342 mm;雌性Ⅴ期肛长范围为335~545 mm,雄性为340~363 mm。
表1 不同性成熟阶段带鱼的肛长范围及分布
Tab.1 Anal length range and profile of silvery hairtail fish Trichiurus lepturus at different mature stages
性腺成熟度gonadal phase全部带鱼all silvery hairtail fish雌性female雄性male样本数/ind.sample number肛长范围/mmanal length range占比/%percent样本数/ind.sample number肛长范围/mmanal length range占比/%percent样本数/ind.sample number肛长范围/mmanal length range占比/%percentⅠ期107119~2386.41000000Ⅱ期929156~327 55.63510180~32757.63419156~30761.80Ⅲ期418228~46025.03225228~46025.42193228~35728.47Ⅳ期163277~5809.76105277~58011.8658295~3428.55Ⅴ期53335~5453.1745335~5455.088340~3631.18
2.2 摄食等级
从图3可见,阿曼湾海域带鱼的总体摄食等级不高,以1~2级为主,占总体的67.50%,其次为0级,占总体的16.64%,且雌雄带鱼的摄食等级具有高度相似性(P>0.05)。
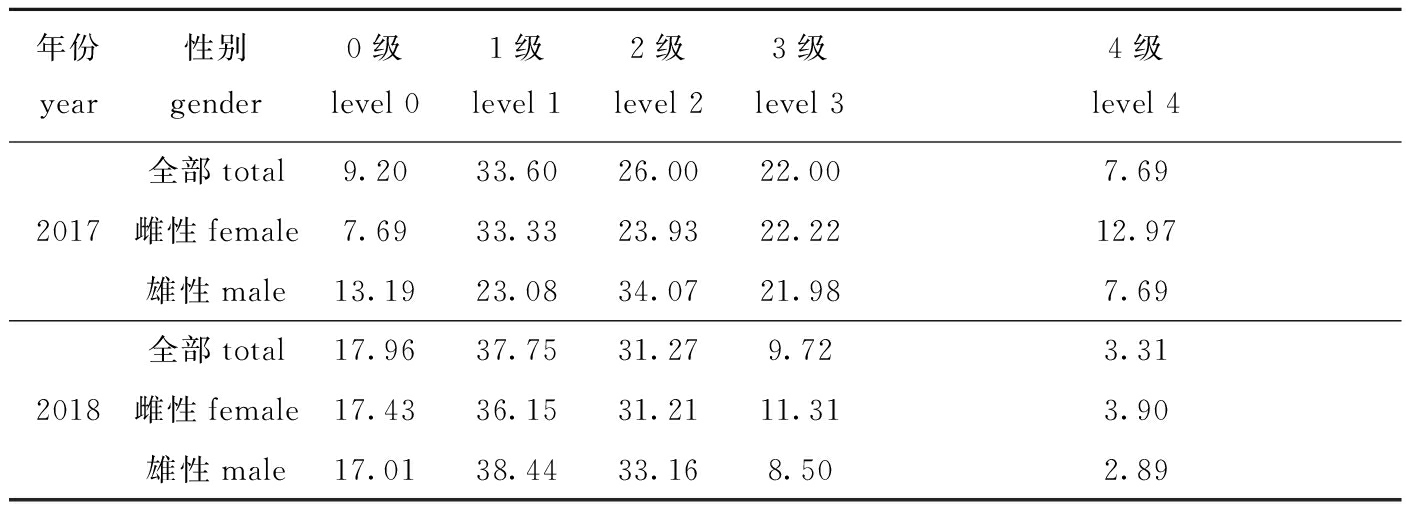
从表2可见:两年间摄食等级有显著性差异(P<0.05),摄食等级为0级、1级、2级的带鱼2017年总体分别比2018年低8.76%、4.15%、5.27%;摄食等级为3级、4级的带鱼2017年总体分别比2018年高12.28%、4.38%。

图2 带鱼各期性腺成熟度的平均肛长
Fig.2 Average anal length of silvery hairtail fish Trichiurus lepturus with various developmental phases of gonad
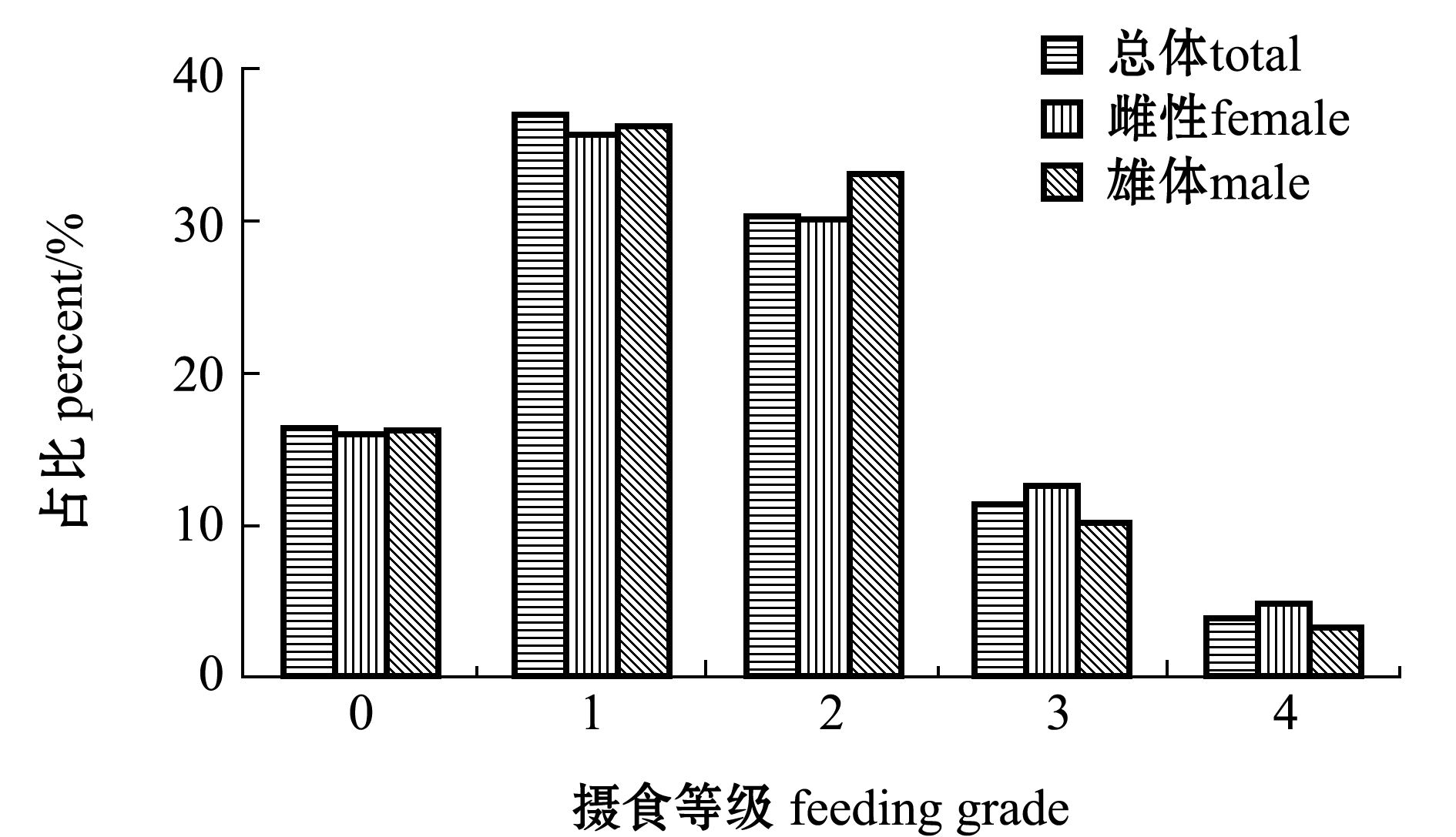
图3 带鱼摄食等级占比
Fig.3 Proportion of various feeding grades in silvery hairtail fish Trichiurus lepturus
表2 带鱼的摄食等级分布
Tab.2 Feeding intentsity range of silvery hairtail fish Trichiurus lepturus%
年份year性别gender0级level 01级level 12级level 23级level 34级level 4全部total9.2033.6026.0022.007.692017雌性female7.6933.3323.9322.2212.97雄性male13.1923.0834.0721.987.69全部total17.9637.7531.279.723.312018雌性female17.4336.1531.2111.313.90雄性male17.0138.4433.168.502.89
2.3 生长特性
从图4、图5可见:阿曼湾海域带鱼的肛长范围为119~580 mm,优势肛长组为160~209 mm,占总数的46.11%,优势肛长组平均肛长为(181±13)mm;体质量范围为15.4~1909.2 g,优势体质量组为10~209 g,占总数的72.51%,优势体质量组平均体质量为(95±45)g;雌雄带鱼优势肛长组都是160~209 mm,分别占雌雄样本总数的44.02%和47.28%,其优势肛长组平均肛长分别为(182±14) mm和(180±13) mm;优势体质量组都是10~209 g,分别占雌雄样本总数的67.49%和74.82%,其优势体质量组平均体质量分别为(98±43)g和(100±48)g。
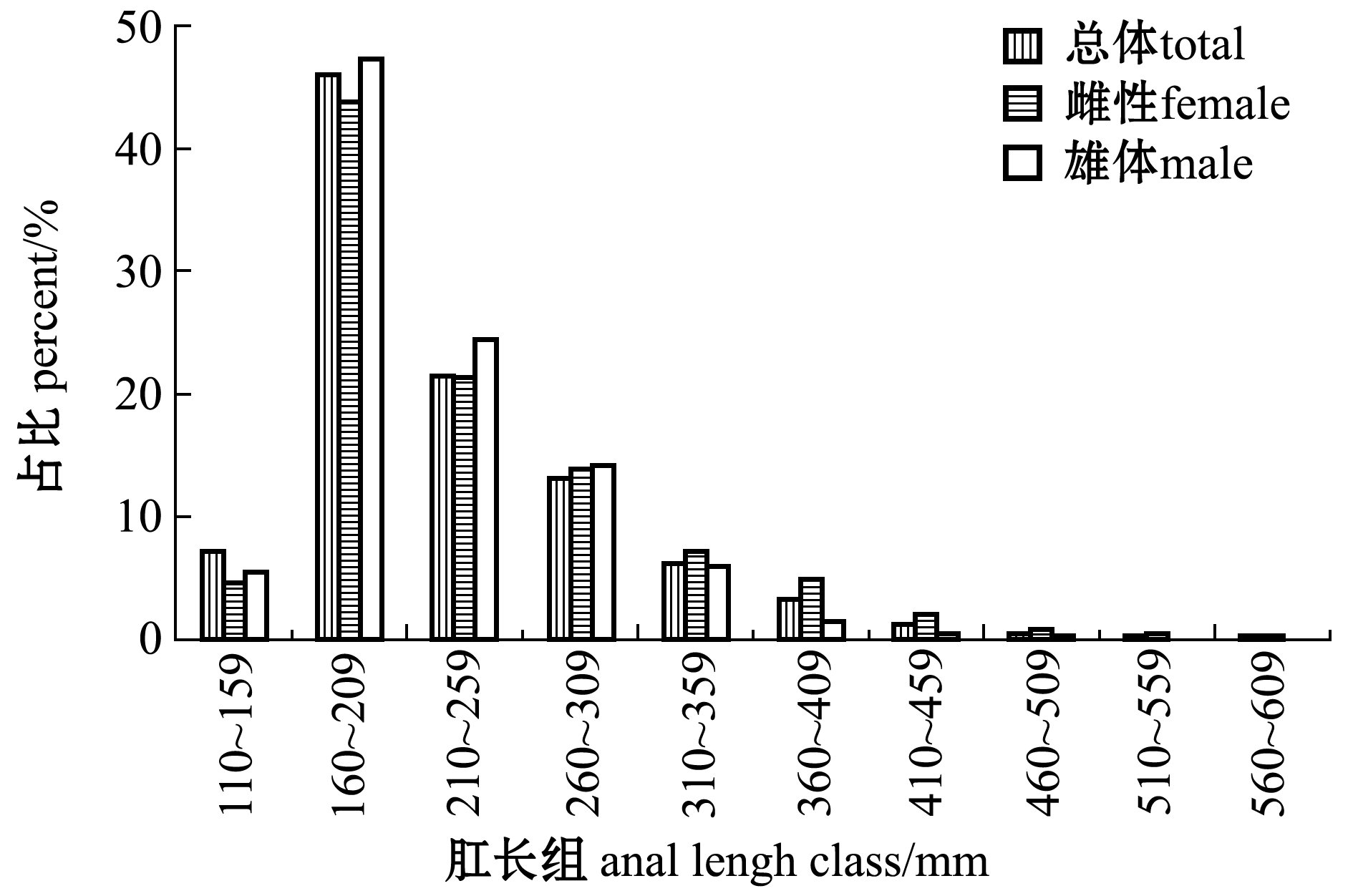
图4 带鱼肛长组成
Fig.4 Anal length profile of silvery hairtail fish Trichiurus lepturus
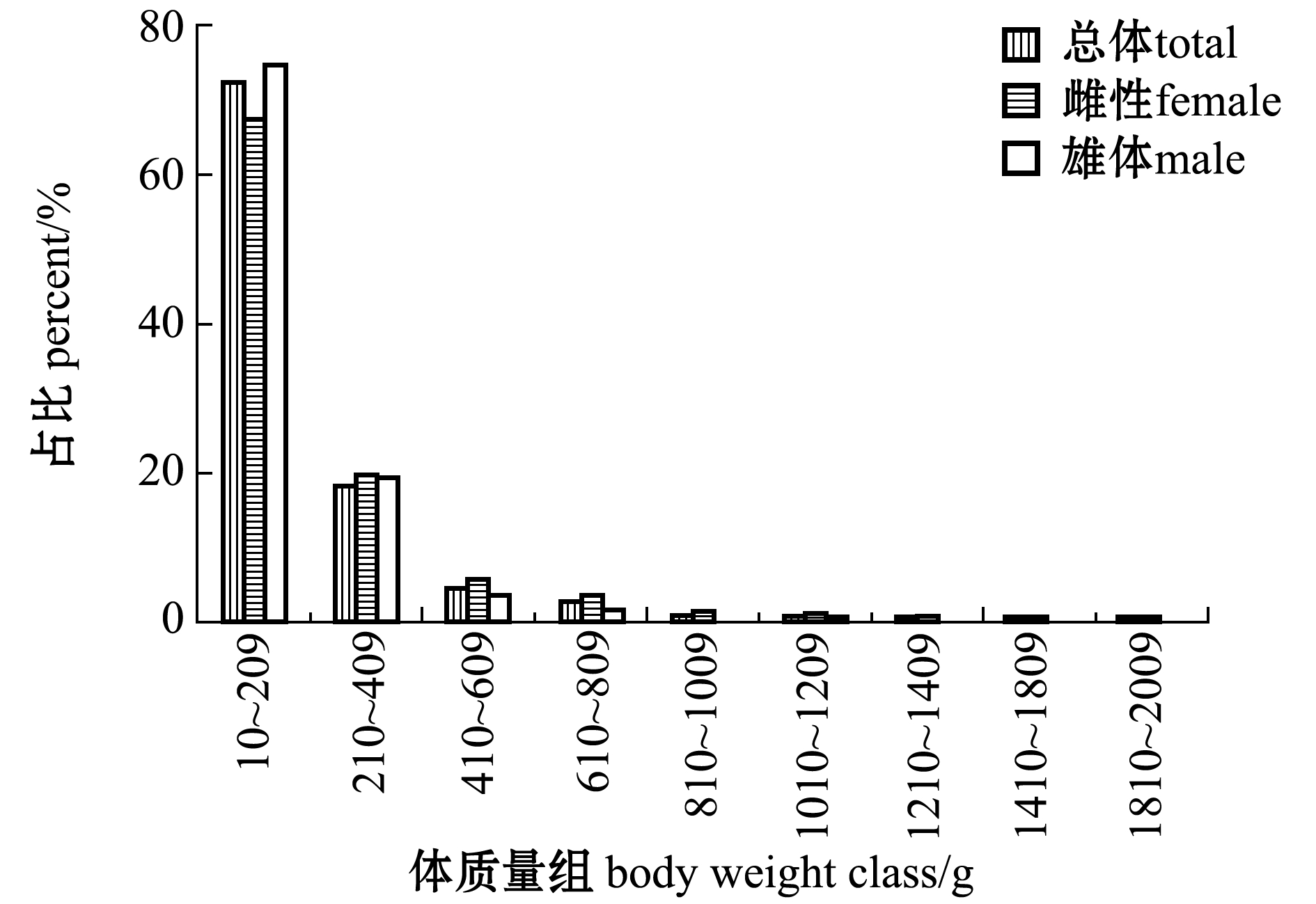
图5 带鱼体质量组成
Fig.5 Body weight profile of silvery hairtail fish Trichiurus lepturus
2.4 肛长与体质量的关系
对2017—2018年肛长与体质量数据进行卡方检验,表明两年间肛长与体质量数据无显著性差异(P>0.05),因此,将两年中肛长与体质量的数据一起分析,带鱼肛长与体质量的关系如图6所示。
带鱼总体、雌性和雄性肛长与体质量的关系式分别为
W总=2.0010×10-5L2.9138, R2=0.9678, n=1670,
(9)
W雌=2.3166×10-5L2.8872, R2=0.9728, n=886,
(10)
W雄=2.0079×10-5L2.9152, R2=0.9563,n=679。
(11)
其中:W为带鱼体质量(g);L为带鱼肛长(mm);n为带鱼数量(ind.)。
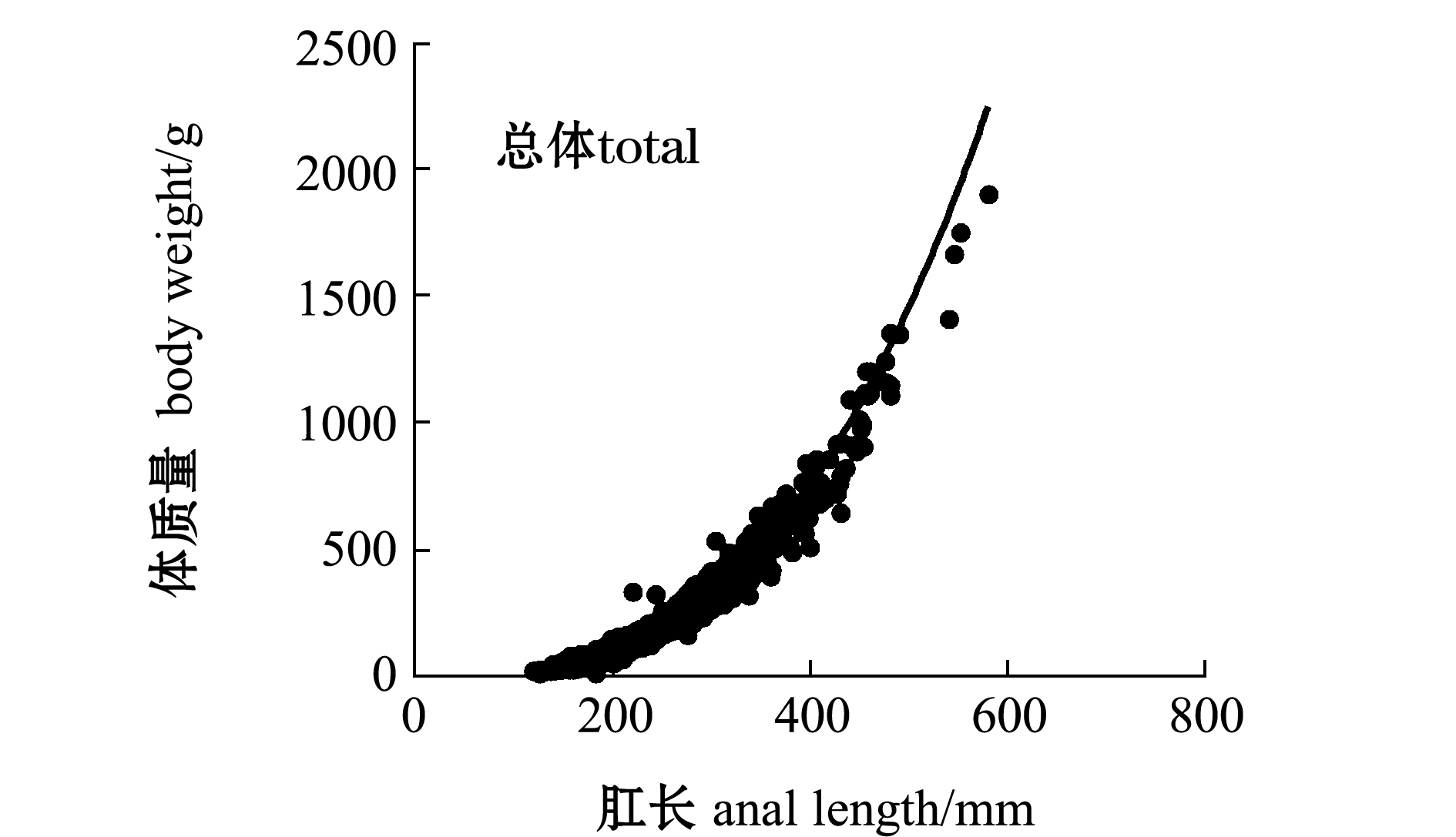
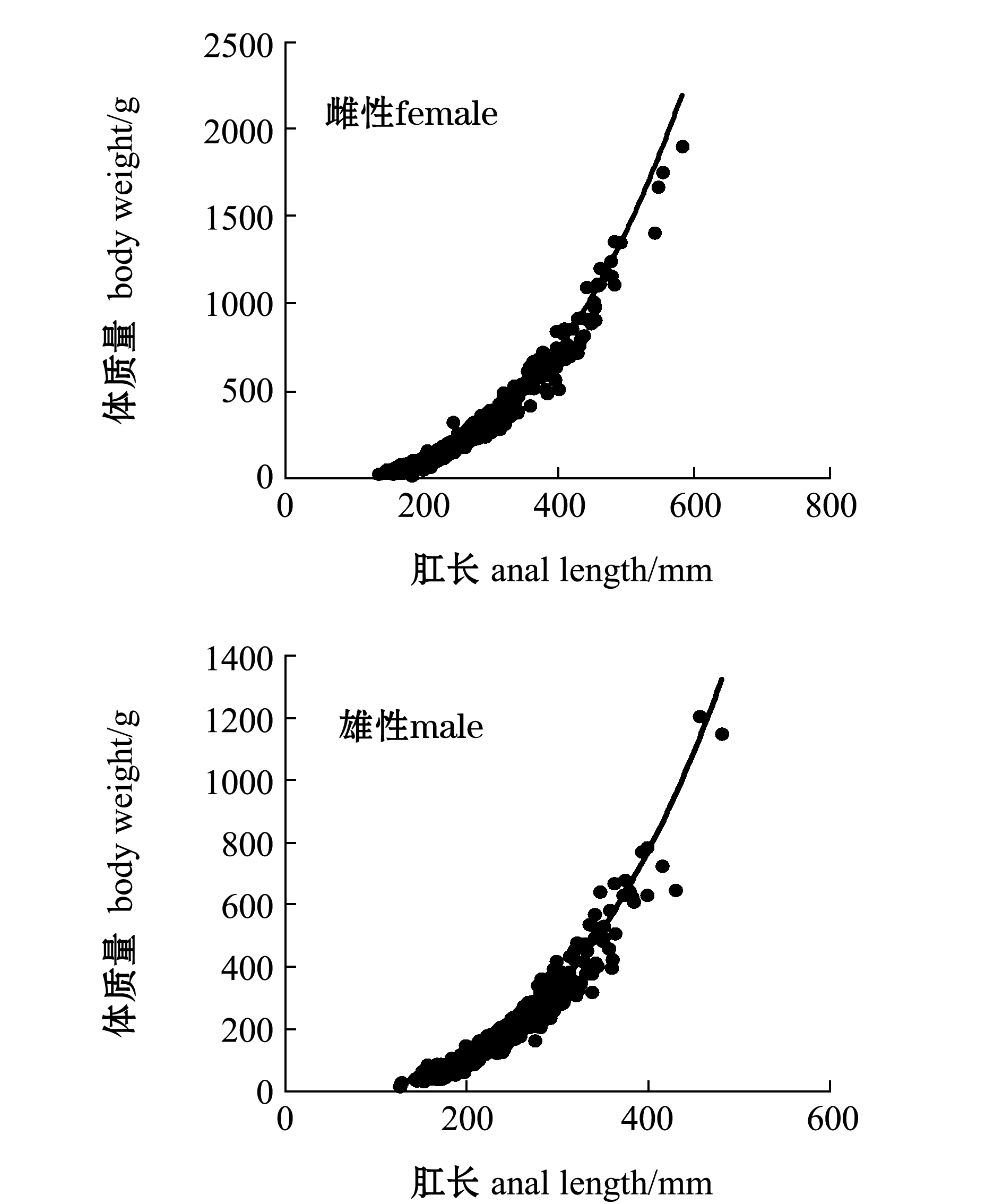
图6 带鱼肛长与体质量的关系
Fig.6 Relationship between anal length and body weight of silvery hairtail fish Trichiurus lepturus
2.5 初次性成熟肛长
通过表3推算出总体带鱼和雌雄带鱼的初次性成熟肛长公式,Logistc曲线如图7所示。
带鱼的初次性成熟肛长Logistc方程为
![]()
(12)
因此,带鱼初次性成熟肛长LM50%=242.3 mm。
雌性和雄性带鱼的初次性成熟肛长Logistc方程分别为
(13)
![]()
(14)
因此,雌性带鱼初次性成熟肛长LM50%=242.1 mm,雄性带鱼初次性成熟肛长LM50%=242.9 mm。
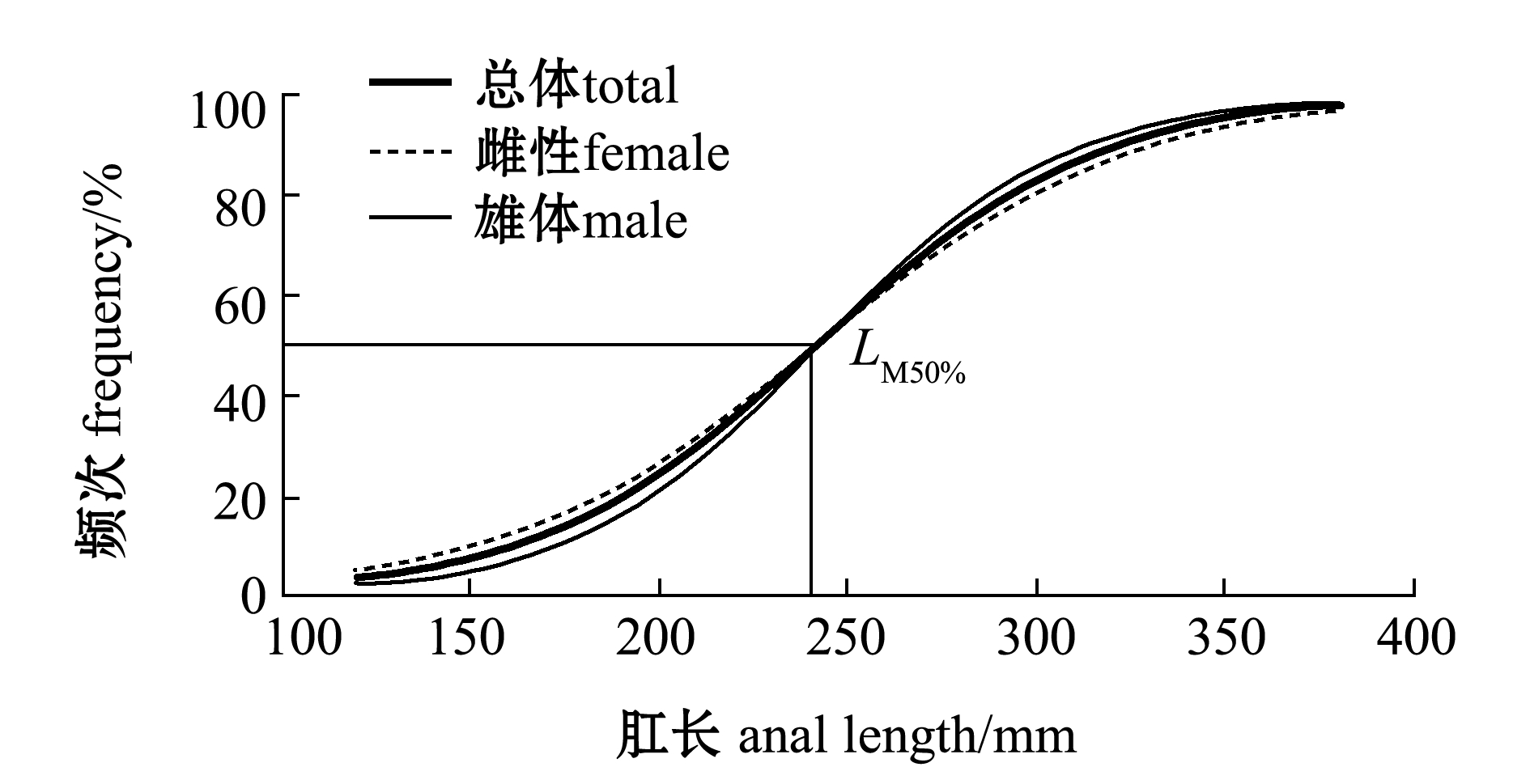
图7 带鱼初次性腺成熟度肛长
Fig.7 Anal length of silvery hairtail fish Trichiurus lepturus at first maturity
2.6 带鱼Von Bertalanffy生长方程
对131组带鱼年龄数据组进行分析,拟合出肛长与体质量幂函数方程为
表3 肛长组内性腺成熟个体占比
Tab.3 Proportion of mature individuals in the anal length groups
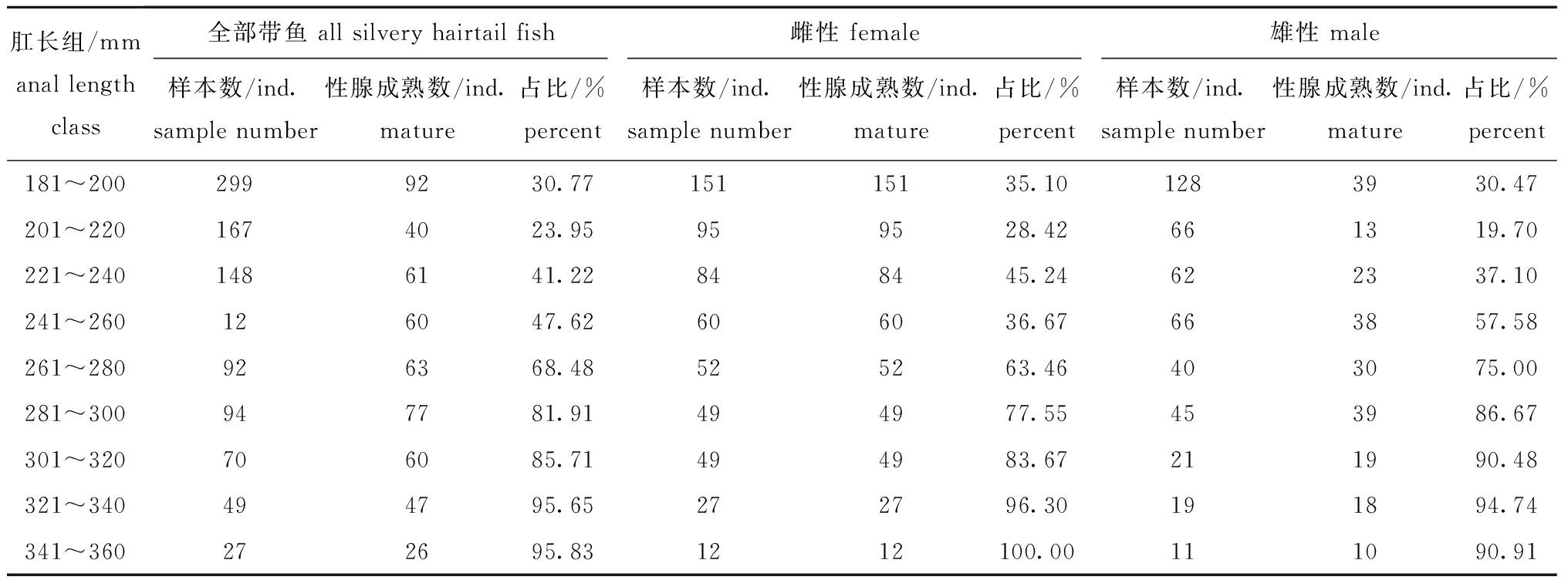
肛长组/mmanal length class全部带鱼 all silvery hairtail fish雌性 female雄性 male样本数/ind.sample number性腺成熟数/ind.mature占比/%percent样本数/ind.sample number性腺成熟数/ind.mature占比/%percent样本数/ind.sample number性腺成熟数/ind.mature占比/%percent181~2002999230.7715115135.101283930.47201~2201674023.95959528.42661319.70221~2401486141.22848445.24622337.10241~260126047.62606036.67663857.58261~280926368.48525263.46403075.00281~300947781.91494977.55453986.67301~320706085.71494983.67211990.48321~340494795.65272796.30191894.74341~360272695.831212100.00111090.91
W=4.1130×10-5L2.7959, R2=0.97, n=131。
(15)
通过对表4中数据进行拟合,推算出年龄与肛长、年龄与体质量的Von Bertalanffy生长方程为
(16)
(17)
通过生长方程式中L∞、W∞、k及t0的参数值,推算得到肛长生长速度、体质量增加速度方程为
(18)
(19)
经计算,带鱼的极限肛长为610.4 mm,极限体质量为1996.3 g。从图8、图9可见,带鱼的肛长与体质量随年龄的增大一直在增加,但其肛长生长速度一直在下降,体质量增加速度呈先增加后减小的趋势,并推算出体质量增加速度曲线拐点的带鱼年龄为4.07龄。
表4 各年龄段内肛长与体质量平均值
Tab.4 Average anal length and body weight in all age groups
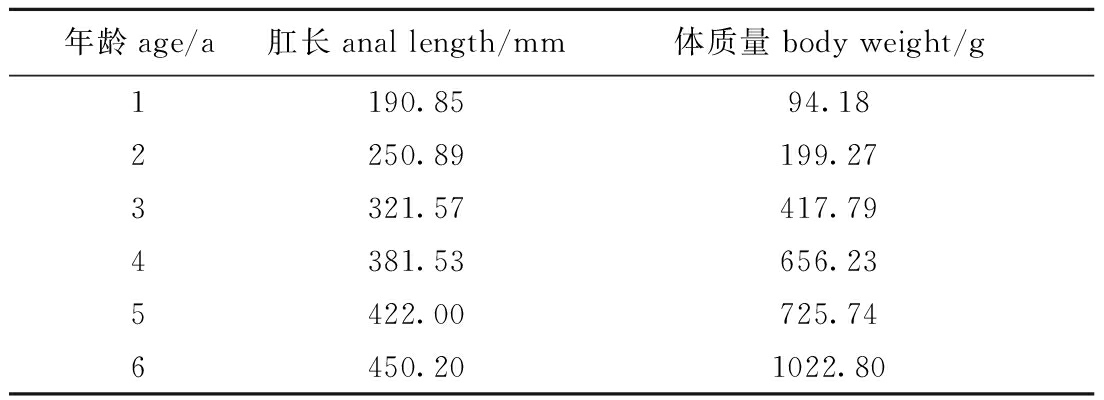
年龄age/a肛长anal length/mm体质量body weight/g1190.8594.182250.89199.273321.57417.794381.53656.235422.00725.746450.201022.80
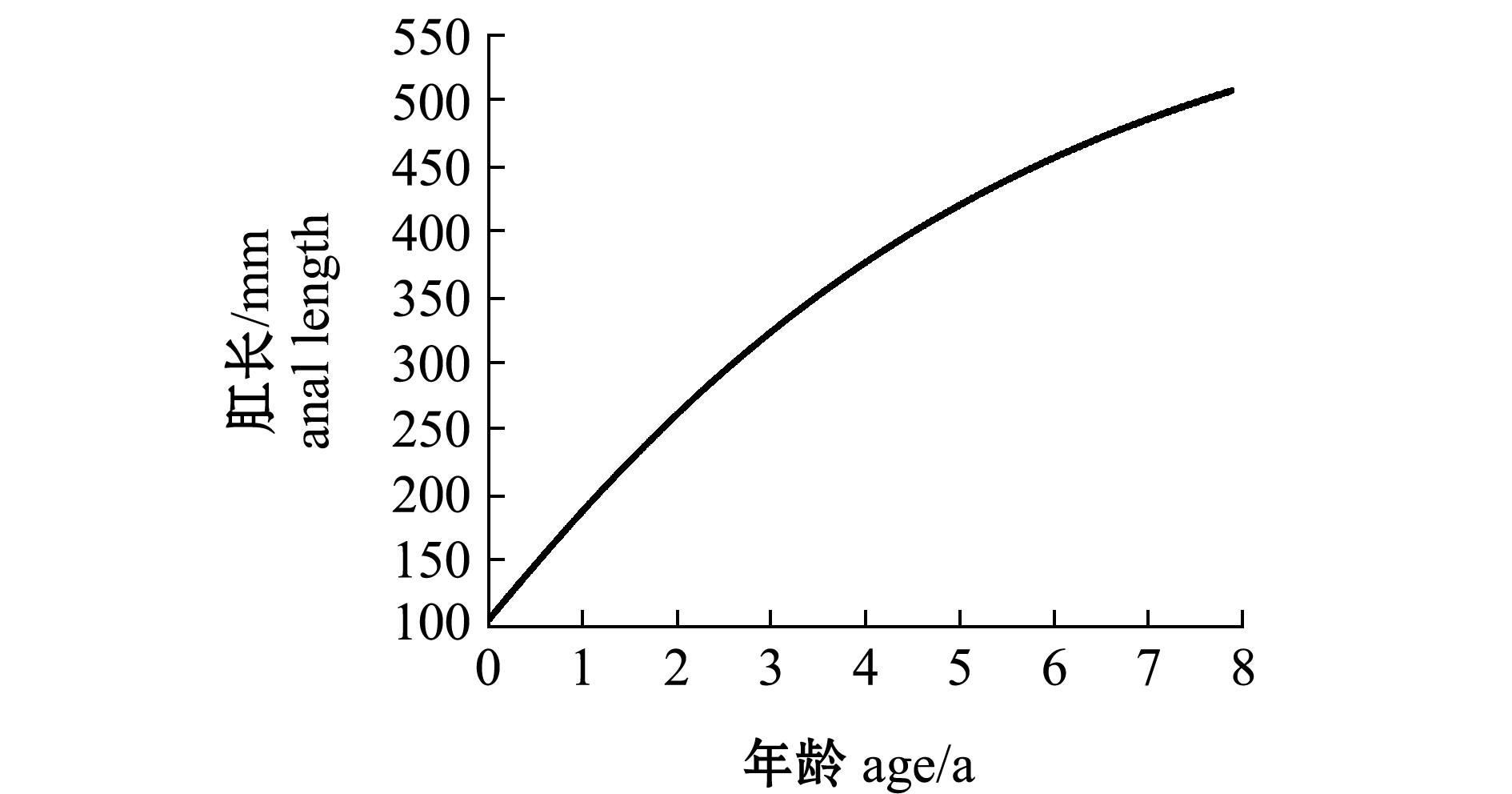
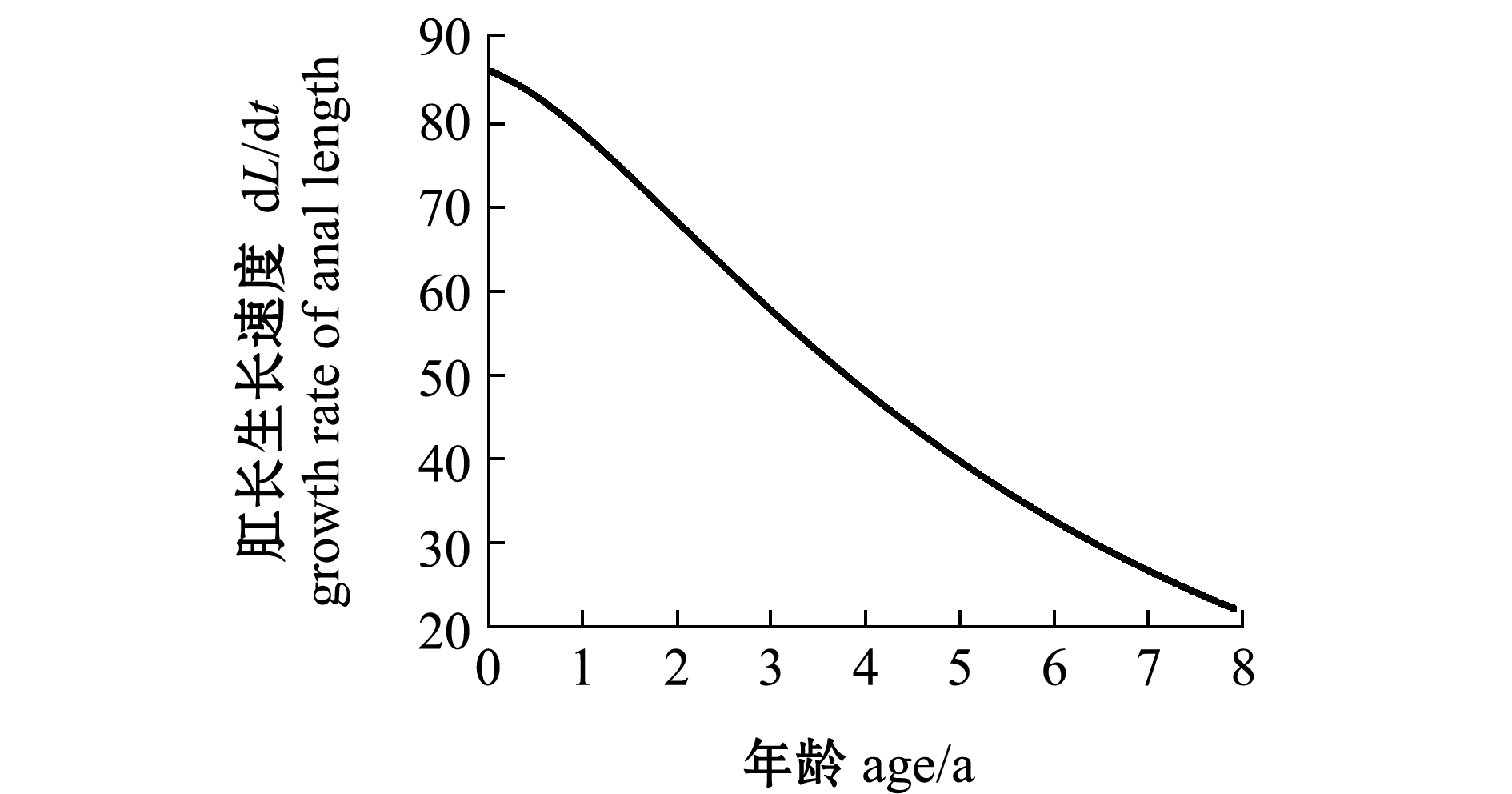
图8 年龄与肛长的生长方程及肛长生长速度
Fig.8 Growth equation of age and anal length and growth rate of anal length
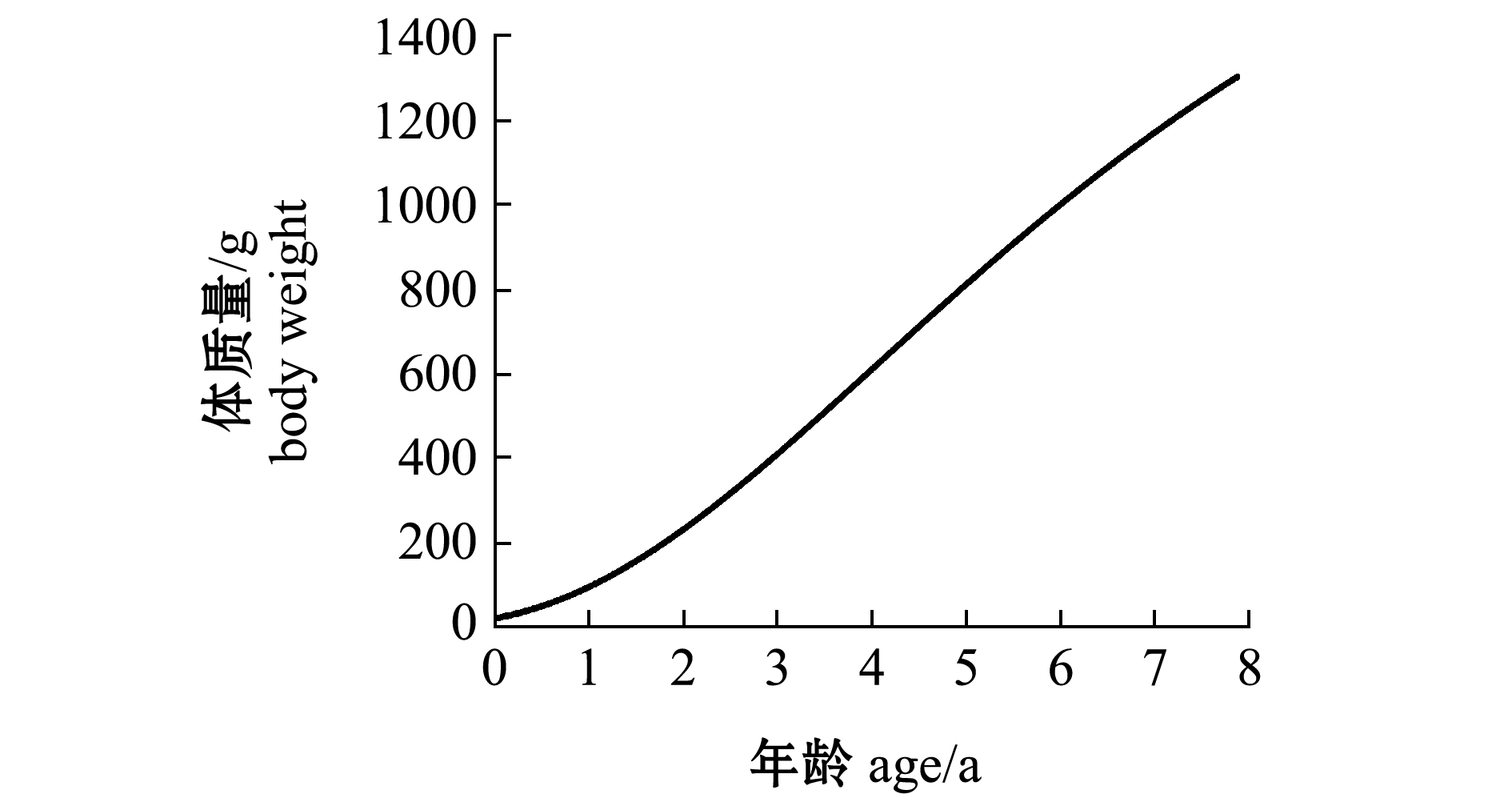
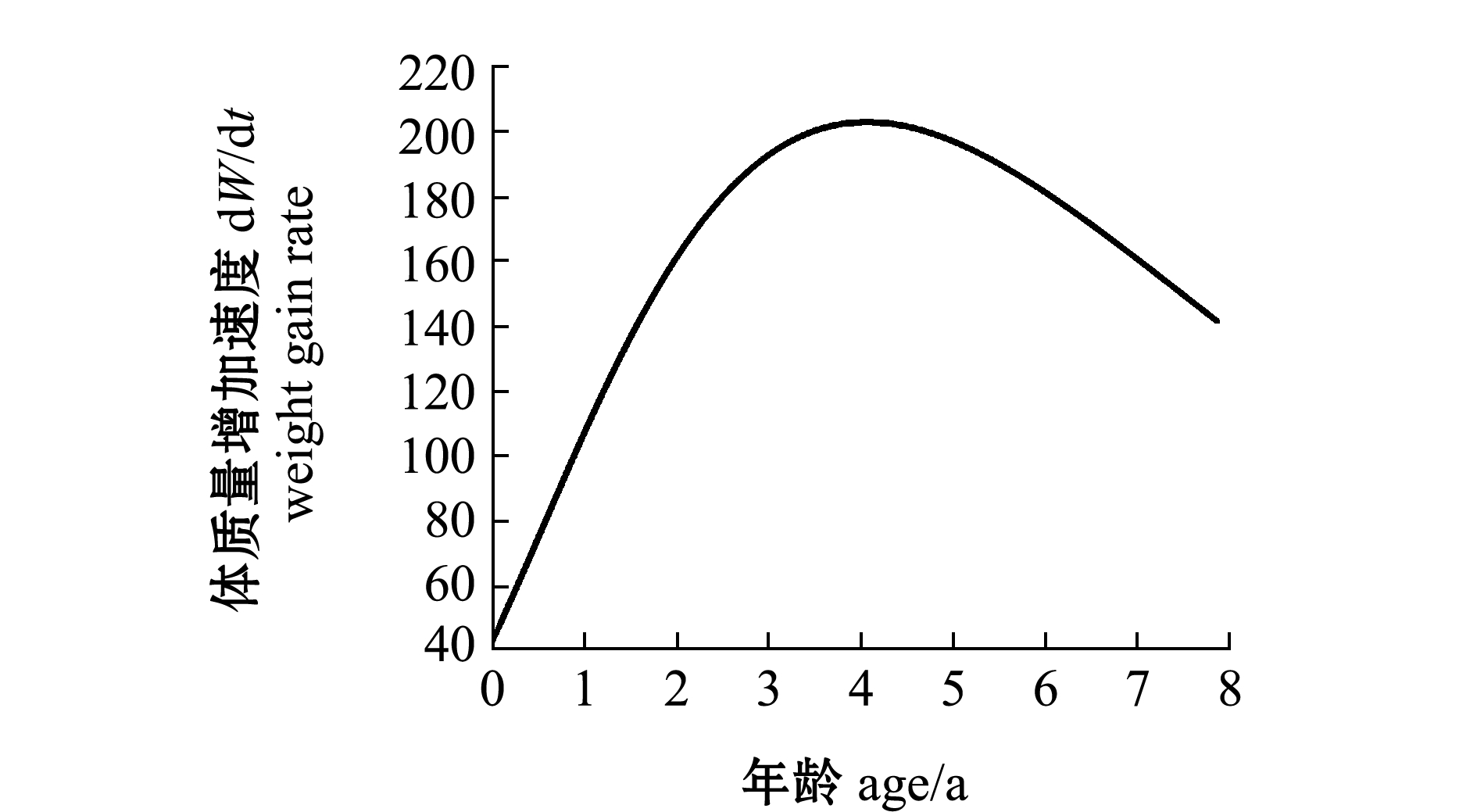
图9 年龄与体质量的生长方程及体质量增加速度
Fig.9 Growth equation of age and body weight and weight gain rate
3 讨论
3.1 初次性成熟肛长与摄食习性
初次性成熟肛长(LM50%)是渔业管理中重要的生物学参考点,董炳秀[9]推算出不同海域带鱼初次性成熟肛长,印尼阿拉弗拉海域雌雄分别为346.0、368.0 mm,缅甸安达曼海域雌雄分别为242.7、227.9 mm;张壮丽等[28]推算出,台湾浅滩邻近海域为280.0 mm,与阿曼湾海域带鱼初次性成熟肛长(雌、雄分别为242.1、242.9 mm)相比有显著性差异(P<0.05),表明带鱼初次性成熟肛长与其生长所处的地理位置有关。据FAO统计,带鱼在2龄左右性腺成熟[20],与本研究中通过年龄与肛长的Von Bertalanffy生长方程(16),推算出阿曼湾海域带鱼性成熟时的年龄在1.7~1.8龄之间相吻合。
对带鱼摄食习性的研究发现,印尼阿拉弗拉海[9]带鱼摄食等级主要为0~1级,缅甸安达曼海域[1]带鱼摄食等级以1~2级为主,与本研究(1~2级)结果相差不大,摄食等级都相对偏低。本研究中发现,阿曼湾海域带鱼两年间的摄食等级差异较大,分析其原因可能是采集样本的时间不同,或取样的偶然性,或底层水温的异常变化,抑制了个体的发育或摄食,以便降低消耗[29]。
3.2 肛长、体质量分布特性
影响鱼类生长的因素除遗传因子外,还与其生长过程中遇到的各种环境条件有关,因此,同一物种的生长会随该物种地理分布的不同而产生差异[25]。从表5发现,阿曼湾海域带鱼肛长和体质量范围与其他海域差距较大,结合探捕海域地理环境等因素分析,由于不同海域中水温、饵料、捕捞压力和种间竞争压力等环境因子相差较大,使得不同海域中带鱼的肛长与体质量范围存在一定差异。
肛长与体质量的关系式为 W=aLb,常数a的变化受指数b的影响显著[30],鱼类的生活环境与指数b有关[31],并且同一种群由于生活环境不同会造成b值的不同。本研究中发现,阿曼湾海域带鱼的参数b为2.91,海州湾[32]带鱼的参数b为2.78,缅甸安达曼海域[1]带鱼的参数b为 2.75,印尼阿拉弗拉海[9]带鱼的参数b为2.42,对比不同海域发现,阿曼湾海域的参数b大于其他海域,从一定程度上说明阿曼湾海域的饵料基础丰富,水文条件优越[1]。
表5 不同海域肛长、体质量范围
Tab.5 Anal length and body weight ranges of silvery hairtail fish in different waters

海域waters肛长范围/mmanal length range体质量范围/gbody weight range阿曼湾海域Aman119~58015.4~1902.2台湾浅滩邻近海域Taiwan[29]185~632110~2550安达曼海域Andaman[1]101~42220~950阿拉弗拉海域Alafu[9]123~44490~1415闽东渔场Mindong[33]92~32611~470
3.3 Von Bertalanffy生长方程
带鱼的生长特征可以通过von Bertalanffy生长方程参数和用这些参数确定的生长曲线、生长速度曲线来反映[4]。现将不同海域带鱼生长方程的L∞、W∞及tw 3个生长方程参数进行t检验(表6),结果发现P<0.05,表明不同海域带鱼生长特征具有显著性差异。吴鹤洲等[34]研究认为,同种鱼类因栖息水域生活环境的不同,会形成具有生态、形态相对稳定差异的种下群,带鱼生长特征差异明显地表现在亚热带、温带海区之间。通过分析表6中不同海域所处维度,发现L∞、W∞及tw 3个生长方程参数具有随维度增加而减小的趋势,这表明,带鱼的这3个生长方程参数与生长所处地理位置的维度呈负相关性。
表6 不同海域生长方程参数
Tab.6 Growth function parameters of silvery hairtail fish in different waters
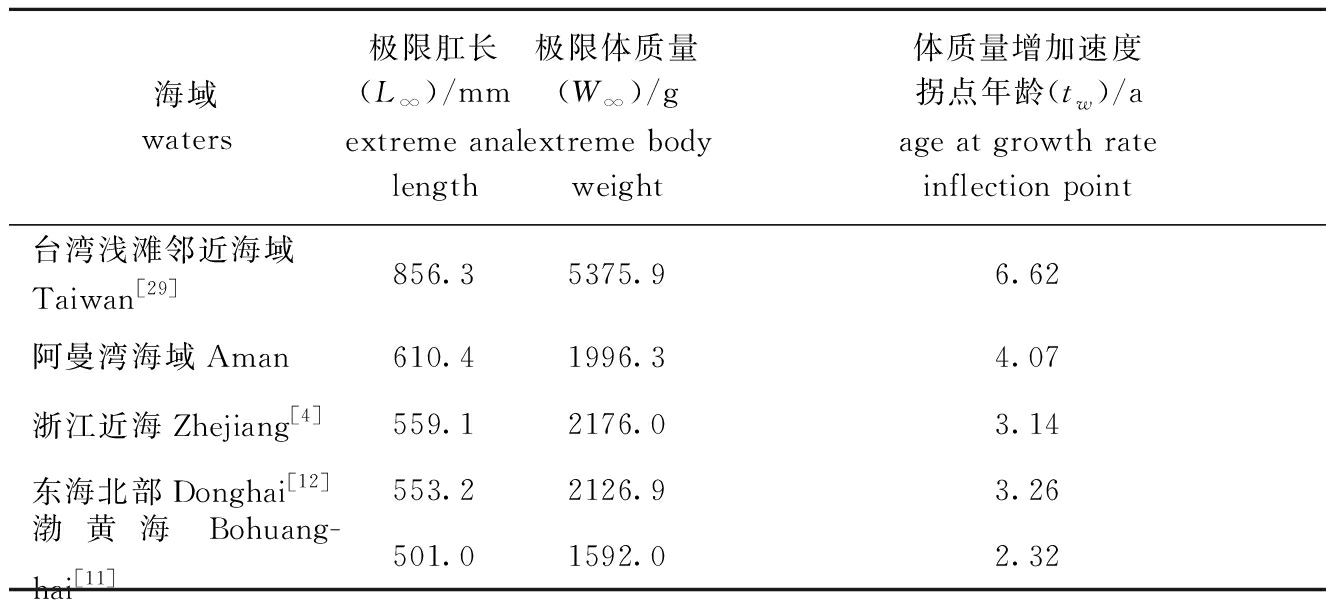
海域waters极限肛长(L∞)/mmextreme anal length极限体质量(W∞)/gextreme body weight体质量增加速度拐点年龄(tw)/aage at growth rate inflection point台湾浅滩邻近海域Taiwan[29]856.35375.96.62阿曼湾海域Aman610.41996.34.07浙江近海Zhejiang[4]559.12176.03.14东海北部Donghai[12]553.22126.93.26渤黄海Bohuang-hai[11]501.01592.02.32
本研究中所采样品时间较短,生物学特性的研究不能充分描述阿曼湾海域带鱼的形态和生态,对带鱼的种群分布、产卵时间和产卵路线等问题难以做出准确的结论。今后,进一步的研究需要以大量不同海域和不同时期的生物为基础。
[1] 金鑫.缅甸外海大西洋带鱼渔业生物学及其产量分布初步研究[D].上海:上海海洋大学,2014.
[2] 成庆泰,郑葆珊.中国鱼类系统检索[M].北京:科学出版社,1987.
[3] 严利平,胡芬,李建生,等.东海带鱼年龄与生长的研究[J].海洋渔业,2005,27(2):139-142.
[4] 吴家骓.浙江近海渔场带鱼的年龄和生长[J].浙江水产学院学报,1985,4(1):9-23.
[5] 洪秀云.渤、黄海带鱼年龄与生长的研究[J].水产学报,1980,4(4):361-370.
[6] 罗秉征,卢继武,黄颂芬.中国近海带鱼耳石生长的地理变异与地理种群的初步探讨[C]//海洋与湖沼论文集.北京:科学出版社,1981:181-194.
[7] Portsev P I.Feeding of the cutlass fish,Trichiurus lepturus L.(Pisces,Trichiuridae)[J].Voprosy Ikhtiologii,1978,185:872-878.
[8] Portsev P I.The feeding of the cutlass fish,Trichiurus lepturus (Trichiuridae),off the west coast of India[J].Journal of Ichthyology,1980,20(5):60-65.
[9] 董炳秀.印尼阿拉弗拉海大西洋带鱼生物学特性[D].上海:上海海洋大学,2010.
[10] James P S B R,Chendrasekhar Gupta T R,Shanbhogue S L.Some aspects of the biology of the ribbon fish,Trichiurus lepturus (Linnaeus)[J].Journal of Marine Biology,1978,290:120-137.
[11] 林景祺,张铭棣.黄、渤海带鱼生长特性的研究[J].海洋水产研究,1981(2):41-56.
[12] 王跃中,邱永松.东海带鱼渔获量变动原因分析[J].南方水产,2006,2(3):16-24.
[13] 朱江峰,邱永松.南海北部带鱼生长死亡与参数动态综合模式[J].海洋学报,2005,27(6):93-99.
[14] Swain P K.On the length-weight relationships and condition factor in the ribbon fish Trichiurus lepturus Linnaeus from Gopalpur (Orissa)[J].Mahasagar,1993,26(2):133-138.
[15] Reuben S,Vijayakumaran K,Achayya P,et al.Biology and exploitation of Trichiurus lepturus Linnaeus from Visakhapatnam waters[J].Indian Journal of Fisheries,1997,44(2):101-110.
[16] Haimovici M,Martins A S,de Figueiredo J L,et al.Demersal bony fish of the outer shelf and upper slope of the southern Brazil subtropical convergence ecosystem[J].Marine Ecology Progress Series,1994,108(2):59-77.
[17] Nair P N R,Kurian A,Muthiah C,et al.Occurrence of ribbonfish in the Indian EEZ[C]//Proceedings of the 2nd Workshop on Scientific Results of FORV.Sagar Sampada:FORV,1996:429-436.
[18] Narasimham K A.Fishery and population dynamics of the ribbonfish Trichiurus lepturus Linnaeus off Kakinada[J].Journal of Marine Biological Association India,1994,36(1-2):23-27.
[19] Martins A S,Haimovici M,Palacios R.Diet and feeding of the cutlassfish Trichiurus lepturus in the subtropical convergence ecosystem of southern Brazil[J].Journal of the Marine Biological Association of the UK,2005,85(5):1223-1229.
[20] FAO Yearbook.Fishery and aquaculture statistics 2016[DB/OL].2018.http://www.fao.org/fishery/statistics/en.
[21] 国家海洋局.GB/T 12763.1-7-1991海洋调查规范[S].北京:中国标准出版社,1991.
[22] 朱清澄,孙栋,花传祥,等.西非近海真鲷生物学特征的初步研究[J].大连海洋大学学报,2015,30(6):686-691.
[23] 于亚群,田涛,陈勇,等.獐子岛深水人工鱼礁区大泷六线鱼生长特性研究[J].大连海洋大学学报,2016,31(2):205-210.
[24] Lysack W.1979 Lake Winnipeg fish stock assessment program[R].Manitoba:Department of Natural Resources,1980:118.
[25] 徐东坡,张敏莹,周彦锋,等.长江常熟江段似鳊的生长特征及形态特性[J].大连海洋大学学报,2014,29(4):397-402.
[26] 李星颉,陈赛斌.鱼类生长的数学描述[J].浙江水产学院学报,1983(1):29-39,4.
[27] 王崇懿,刘建勇.九孔鲍选育群体生长规律的研究[J].大连海洋大学学报,2019,34(1):21-26.
[28] 张壮丽,叶孙忠,叶泉土.台湾浅滩邻近海域南海带鱼渔业生物学研究[J].福建水产,1998(3):13-19.
[29] 张波.东、黄海带鱼的摄食习性及随发育的变化[J].海洋水产研究,2004,25(2):6-12.
[30] 林斌,徐青.大亚湾鱼类体重和体长的相关关系[J].热带海洋,1989,8(4):93-99.
[31] 黄真理,常剑波.鱼类体长与体重关系中的分形特征[J].水生生物学报,1999,23(4):330-336.
[32] 林景祺.带鱼[M].北京:农业出版社,1985.
[33] 颜尤明.福建海区带鱼生物学特征与资源变化的研究[J].南方水产,2005,1(3):32-36.
[34] 吴鹤洲,成贵书,周建魁,等.带鱼生长的研究[J].海洋与湖沼,1985,16(2):156-168.