铜藻Sargassum horneri隶属于褐藻门Phaeophyta墨角藻目Fucales马尾藻科Sargassaceae马尾藻属Sargassum,广泛分布于中国黄渤海低潮带的深沼中、大干潮线下深至4 m的岩石上。铜藻生长速度快、植株高大、枝叶繁茂,可为海洋动物提供避敌、索饵、产卵场所,对潮间带及潮下带生态系统起到调节和保护作用,是浅海生态修复的良好种类[1-4]。
近年来,由于环境污染及海水养殖业快速发展,使中国铜藻资源衰退、藻场萎缩严重[5],同时漂浮铜藻呈暴发性增长,有形成“金藻潮”的趋势。为了恢复铜藻藻场资源,应对漂浮铜藻造成的危害,研究适合铜藻生长的生态因子意义重大。目前,有关铜藻研究主要集中在其种苗培育[6-9]、遗传多样性分析[10-12]、有性繁殖苗种的人工栽培[13]及生态学[14-26]等,但有关环境生态因子对断枝铜藻幼苗生长的影响尚末见报道。研究断枝铜藻生长适宜的环境条件,可为了解海上漂浮铜藻的生长规律、铜藻场的人工修复及漂浮铜藻暴发性的生态条件提供理论参考。
1 材料与方法
1.1 材料
2018年3月20日从大连旅顺盐场海区采集挂缠于海带筏子上的铜藻,采集时海水温度为3.4 ℃,盐度为31。选取生长良好的铜藻8棵,平均质量1.1 kg,平均长度1.8 m,立即用低温采集箱运回实验室。
1.2 方法
1.2.1 培养与管理 铜藻用沙滤海水冲洗后暂养于实验室水槽中,充气培养,温度、光照及光周期为自然条件,营养盐为KNO3 60 mg/L、KH2PO4 20 mg/L。铜藻在室内暂养一周后,截取5 cm、2 cm长的次侧枝,用灭菌海水冲洗后,在室内培养箱中恢复培养15 d以上,培养条件及营养盐同暂养期间,试验前一天换水不加营养盐。截枝时从顶部生长点往下量取,5 cm截枝幼苗具10~13个叶片,2 cm具6~8个叶片。试验前用灭菌海水冲洗藻体次,用1%聚维酮碘浸泡3 min,再用灭菌海水冲洗3次,去除杂质和菌类污染。试验海水为经二级沙滤处理,煮沸后使用,培养基为PESI。
1.2.2 试验设计 生长试验分幼苗长5 cm、2 cm两组进行试验,每组试验设置温度、光强及营养盐配比3个影响因素,温度设为10 (仅5 cm组)、15、20、25 ℃,光照强度为4500、8900、11 000,营养盐配比NH4NO3∶Na2HPO4设为5∶1、8∶1、10∶1、16∶1(mg∶mg)。将消毒处理后的截枝幼苗置于1 L烧杯中,每个烧杯中放置5棵幼苗,测量初始藻体的长度和质量。5 cm组长度为(5.76±0.28)cm,质量为(0.19±0.03)g;2 cm组长度为(2.25±0.08)cm,质量为(0.05±0.004)g。 5、2 cm组各设置48、36个组,每个烧杯中添加1 L含有不同比例营养盐的培养液,在智能型光照培养箱中通气培养,光周期为12 L∶12 D,每隔3 d(5 cm组)或5 d (2 cm组) 更换相同成分的培养液,生长试验共进行20 d。
1.2.3 数据测量及计算 试验过程中,每5 d测量一次铜藻的体长和质量并观察藻体发育情况,藻体长度用直尺测量,藻体质量用天平测量,每次测量前用灭菌滤纸吸收藻体表面水分。试验结束后,按下式计算质量和长度特定生长率[26]:
特定生长率=(lnm1-lnm0)/t×100%。
其中:m0为藻体初始质量(g)或初始长度(cm);m1为试验t时的藻体质量(g)或长度(cm);t为试验时间(d)。
1.3 数据处理
采用SPSS 20.0软件对所得试验数据进行单因素方差(One-way ANOVA)分析,比较温度、光强和营养盐配比对幼苗长度、质量特定生长率的影响,显著性水平设为0.05和0.01。
2 结果与分析
2.1 培养条件对铜藻5 cm组断枝幼苗生长的影响
试验过程中,随着幼苗长度、质量的增长,侧枝、气囊逐渐增多,培养10 d后在温度20 ℃以上且光强8900 lx以上培养组,试验液颜色逐渐变黄,幼苗从基部开始腐烂,先是叶腐烂,然后侧枝腐烂,藻体长度、质量呈负增长,故5 cm组幼苗培养10 d后的生长率未进行计算,鉴于篇幅所限培养10 d时不同培养条件下的生长率未详细列出。
从表1可见:培养10 d时,温度对藻体长度和质量增长均有极显著性影响(P<0.01),光强和营养盐配比均无显著性影响(P>0.05);3因素对幼苗长度、质量特定生长率的影响顺序均为温度>光强>营养盐配比。
受3因素共同影响,5 cm组幼苗长度特定生长率最大为5.06%/d,生长条件为温度25 ℃、光强8900 lx及营养盐配比8∶1,最小为0.34%/d,生长条件为温度10 ℃、营养盐配比10∶1和光强4500 lx,最大生长率为最小生长率的14.9倍;质量特定生长率最大为14.06%,生长条件为温度15 ℃、光强8900 lx及营养盐配比16∶1,最小为1.34%,生长条件为10 ℃、营养盐配比8∶1、光强11 000 lx,最大生长率为最小生长率的10.5倍。
培养10 d时,温度对5 cm幼苗生长率的影响见表2,其中,温度对幼苗长度特定生长率的影响依次为20 ℃>25 ℃>15 ℃>10 ℃,温度对幼苗质量特定生长率的影响依次为20 ℃>15 ℃>25 ℃>10 ℃,温度15 ℃以上时幼苗生长显著快于10 ℃(P<0.05)。试验期间,营养盐配比对5 cm幼苗生长无显著性影响(P>0.05),营养盐配比在5∶1时长度增长最大, 在8∶1时质量增长最大。
表1 5 cm铜藻培养10 d时长度和质量特定生长率的单因素方差分析
Tab.1 One-way ANOVA of the specific growth rates in body length and body weight of 5 cm long sea weed Sargassum horneri for 10 days
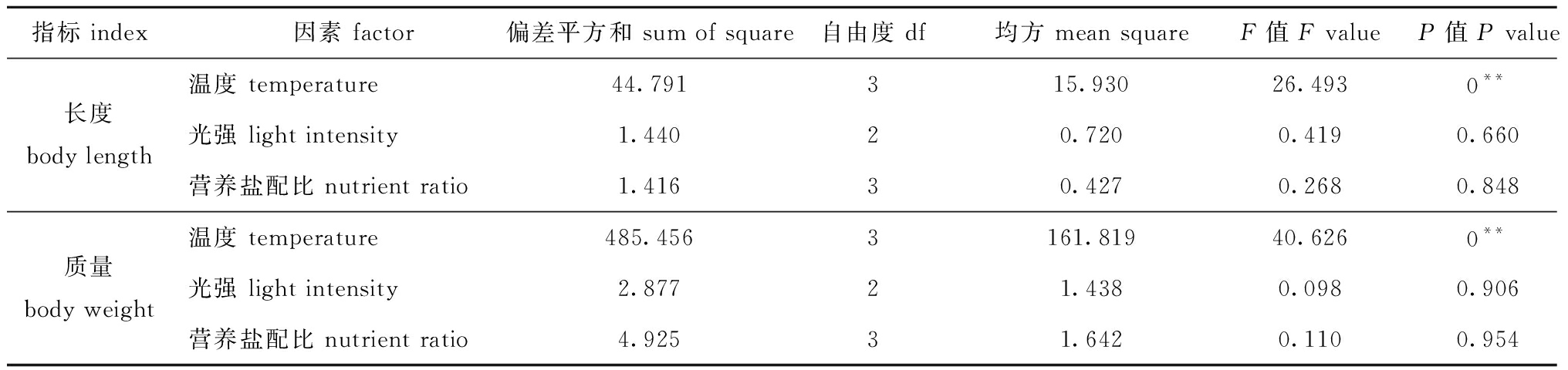
指标 index因素 factor偏差平方和 sum of square自由度 df均方 mean squareF值 F valueP值 P value长度body length温度 temperature44.791315.93026.4930**光强 light intensity1.44020.7200.4190.660营养盐配比 nutrient ratio1.41630.4270.2680.848质量body weight温度 temperature485.4563161.81940.6260**光强 light intensity2.87721.4380.0980.906营养盐配比 nutrient ratio4.92531.6420.1100.954
注:*表示有显著性影响(P<0.05),**表示有极显著性影响(P<0.01),下同
Note: *means significant effect(P<0.05),** means very significant effect(P<0.01),et sequentia
表2 5 cm铜藻培养10 d时温度对长度和质量特定生长率的影响
Tab.2 Effects of temperature on specific gwowth rates in body length and body weight of 5 cm long sea weed Sargassum horneri for 10 days %/d
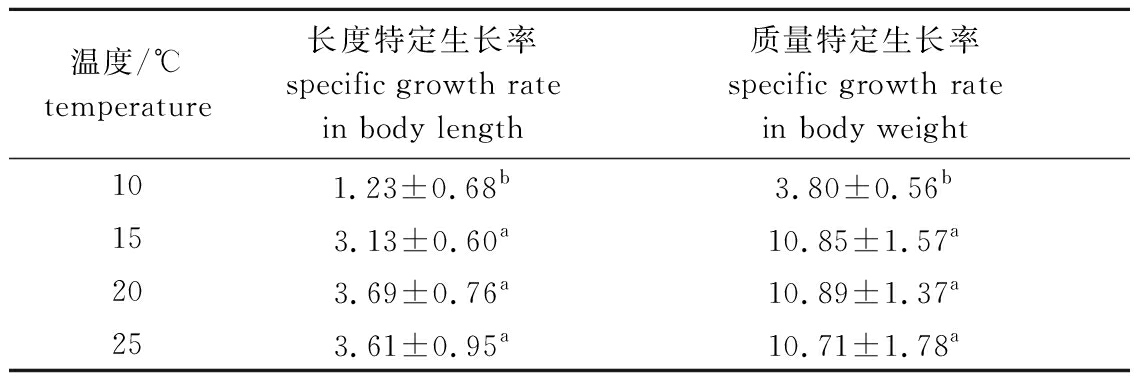
温度/℃temperature长度特定生长率specific growth rate in body length质量特定生长率specific growth rate in body weight101.23±0.68b3.80±0.56b153.13±0.60a10.85±1.57a203.69±0.76a10.89±1.37a253.61±0.95a10.71±1.78a
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letters within the same column are not significant differences
2.2 培养条件对2 cm组断枝铜藻幼苗生长的影响
从表3可见:培养10 d时,温度对2 cm幼苗长度增长有极显著性影响(P<0.01),20 ℃时幼苗生长最快,但营养盐配比及光强对长度增长均无显著性影响(P>0.05),3因素的影响顺序依次为温度>光强>营养盐配比;光强对幼苗质量增长有极显著性影响(P<0.01),但温度和营养盐配比均无显著性影响(P>0.05),3因素的影响顺序依次为光强>温度>营养盐配比。
表3 2 cm铜藻培养10 d时长度和质量特定生长率的单因素方差分析
Tab.3 One-way ANOVA of the specific growth rates in body length and body weight of 2 cm long sea weed Sargassum horneri for 10 days
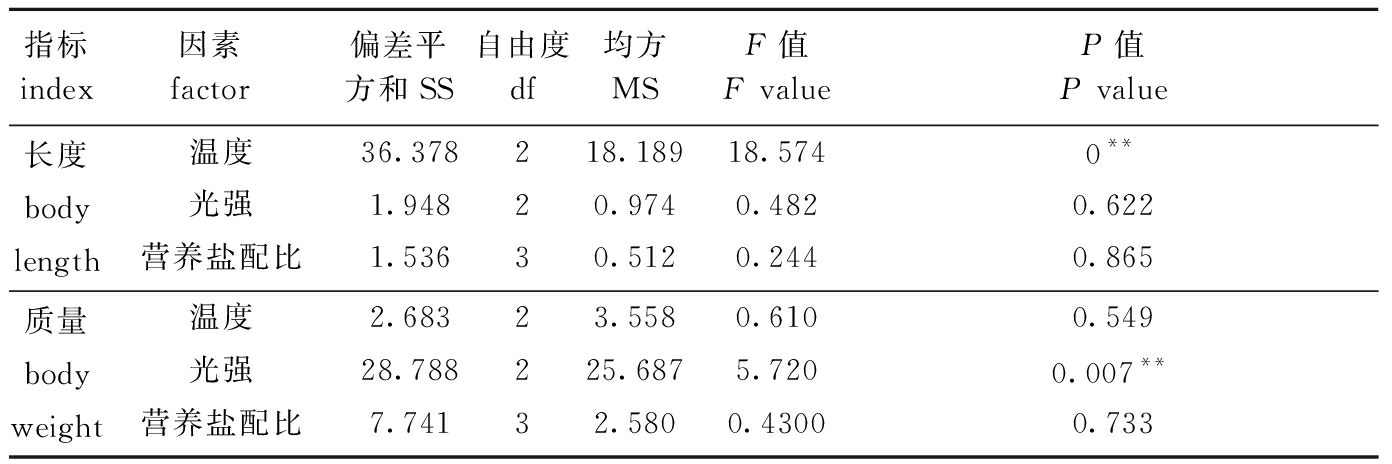
指标 index因素 factor偏差平方和SS自由度df均方MSF值 F valueP值P value长度body length温度36.378218.18918.5740**光强1.94820.9740.4820.622营养盐配比1.53630.5120.2440.865质量body weight温度2.68323.5580.6100.549光强28.788225.6875.7200.007**营养盐配比7.74132.5800.43000.733
培养10 d时,2 cm组幼苗受3因素共同影响,长度特定生长率最大为11.04%/d,生长条件为温度20 ℃、光强8900 lx及营养盐配比8∶1,最小为5.76%/d,生长条件为温度15 ℃、营养盐配比5∶1和光强为4500 lx,最大生长率为最小生长率的1.9倍;质量特定生长率最大为21.79%/d,生长条件为温度20 ℃、光强11 000 lx及营养盐配比16∶1,最小为11.33%/d,生长条件为温度25 ℃、营养盐配比8∶1、光强4500 lx,最大生长率为最小生长率的1.9倍(表4)。
从表5可见:培养20 d时,温度对2 cm铜藻幼苗长度增长有极显著性影响(P<0.01),其他两因子均无显著性影响(P>0.05),3因素对2 cm幼苗长度特定生长率的影响依次为温度>营养盐配比>光强;3因素对幼苗质量增长均无显著性影响(P>0.05),但光强影响最大,3因素对质量特定生长率的影响依次为光强>营养盐配比>温度。
培养20 d 时,受3因素共同影响,2 cm组幼苗长度特定生长率最大为9.55%/d,生长条件为温度20 ℃、光强4500 lx及营养盐配比5∶1,最小为4.75%/d,生长条件为温度25 ℃、营养盐配比5∶1和光强11 000 lx,最大生长率为最小生长率的2.0倍;质量特定生长率最大为15.56%/d,生长条件为温度20 ℃、光强11 000 lx及营养盐配比16∶1,最小为9.41%,生长条件为温度20 ℃,营养盐10∶1、光强4500 lx,最大生长率为最小生长率的1.7倍(表4)。
整个试验期间,2 cm组温度对幼苗平均长度增长的影响及光强对幼苗平均质量增长的影响如图1所示,其中,温度对铜藻长度增长影响最大,光强对质量增长影响最大;其中在10、15、20 d时,20 ℃组铜藻幼苗长度增长最快且显著快于其他温度组(P<0.05),光强为11 000 lx时幼苗质量增长最快且显著快于低光强4500 lx(P<0.05)。
3 讨论
3.1 铜藻繁殖方式
铜藻繁殖可分为有性和无性繁殖(图2),在自然条件下,其有性繁殖是伴随水温升高,藻体小枝腋间逐渐形成生殖托,成熟后排放精卵形成合子,发育成幼孢子体。铜藻的营养繁殖分两种,一种是枝叶脱落后保留假根的残枝行营养繁殖[1,5,20],另外一种是铜藻生长到一定长度后,在风浪的作用下长枝条断掉,漂浮于海面或挂缠于绳、筏上等,这些枝条行营养繁殖,也可成熟生成生殖托行有性繁殖。由于海面光照充足,浮于海面铜藻常比海底有性繁殖的孢子体生长更快,条件适宜时可大片漂浮于水面,漂到航道上阻碍船只行驶,漂到近岸海滩影响旅游业。
3.2 不同体长铜藻幼苗生长比较
本研究铜藻培育20 d的试验中,2 cm组幼苗正常生长,5 cm组幼苗培育10 d后先后腐烂,并且生长愈快腐烂愈早,这与张鹏等[14]认为密度大影响铜藻幼苗生长的结果相一致。在自然海区采集5 cm鼠尾藻Sargassum thunbergii、海黍子Sargassum miyabei幼苗,在相同培养规格和密度下,室内培养可正常生长30 d[27-28]。比较相同温度(15、20、25 ℃)条件下培养10 d时5 cm铜藻、鼠尾藻幼苗总平均特定生长率,结果显示,铜藻的长度特定生长率(3.42%/d)、质量特定生长率(10.82%/d)分别是鼠尾藻长度特定生长率(2.33%/d)、质量特定生长率(7.01%/d)的1.47、1.54倍[27],说明铜藻生长明显快于鼠尾藻。本试验中不同体长铜藻幼苗生长结果显示,培养10 d后相同试验温度(15、20、25 ℃)条件下,2 cm幼苗总平均长度、质量特定生长率分别是5 cm幼苗的2.3、1.6倍,这表明体长小的幼苗具有明显的生长速度优势。在相同生物量下是否是幼苗越小生长越快还需进一步试验证明。
表4 不同培养条件对2 cm铜藻幼苗生长的影响
Tab.4 Effects of different culture conditions on growth of sea weed Sargassum horneri with body length of 2 cm
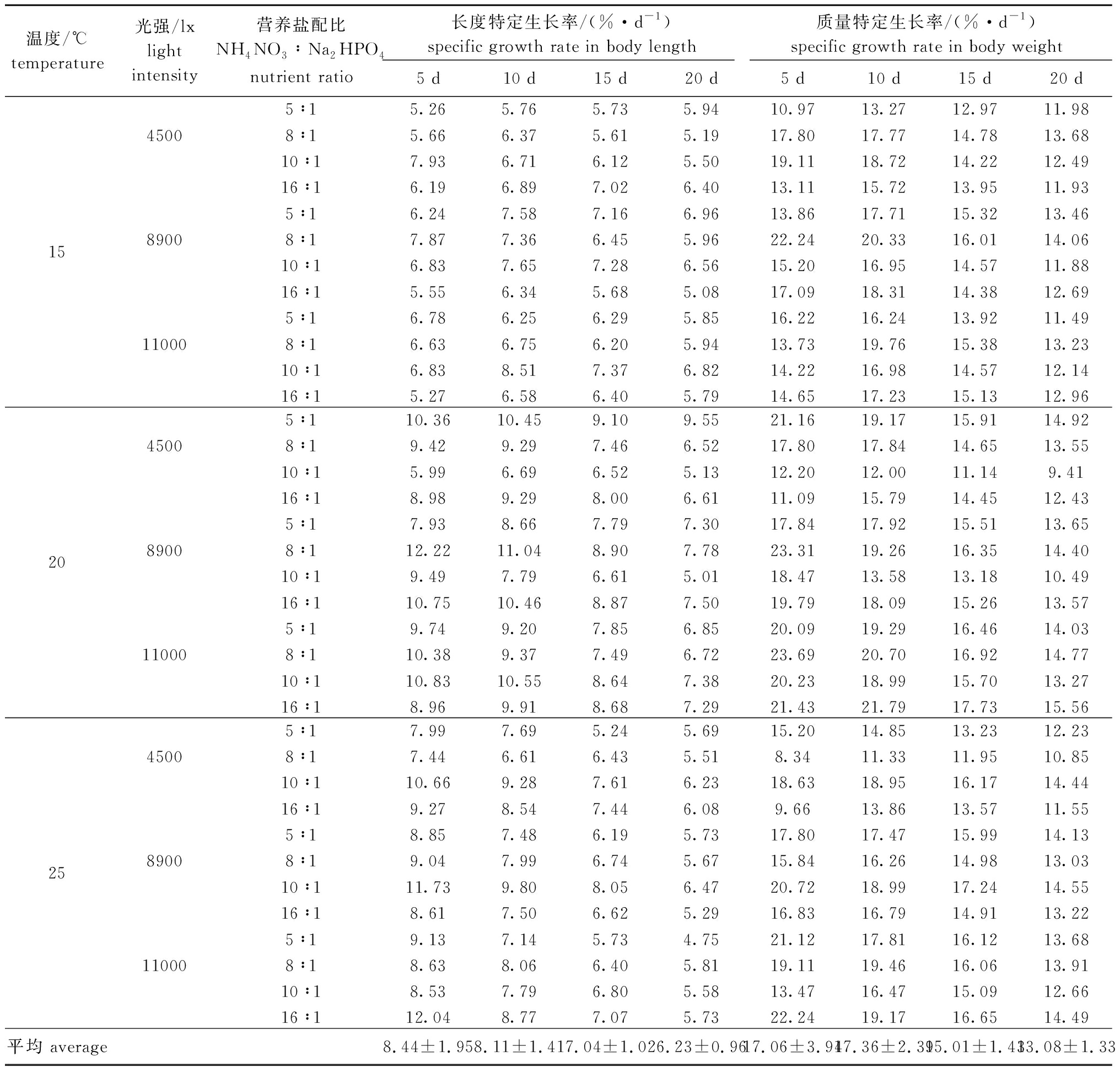
温度/℃temperature光强/lxlight intensity营养盐配比NH4NO3∶Na2HPO4nutrient ratio长度特定生长率/(%·d-1)specific growth rate in body length质量特定生长率/(%·d-1)specific growth rate in body weight5 d10 d15 d20 d5 d10 d15 d20 d155∶15.265.765.735.9410.9713.2712.9711.9845008∶15.666.375.615.1917.8017.7714.7813.6810∶17.936.716.125.5019.1118.7214.2212.4916∶16.196.897.026.4013.1115.7213.9511.935∶16.247.587.166.9613.8617.7115.3213.4689008∶17.877.366.455.9622.2420.3316.0114.0610∶16.837.657.286.5615.2016.9514.5711.8816∶15.556.345.685.0817.0918.3114.3812.695∶16.786.256.295.8516.2216.2413.9211.49110008∶16.636.756.205.9413.7319.7615.3813.2310∶16.838.517.376.8214.2216.9814.5712.1416∶15.276.586.405.7914.6517.2315.1312.96205∶110.3610.459.109.5521.1619.1715.9114.9245008∶19.429.297.466.5217.8017.8414.6513.5510∶15.996.696.525.1312.2012.0011.149.4116∶18.989.298.006.6111.0915.7914.4512.435∶17.938.667.797.3017.8417.9215.5113.6589008∶112.2211.048.907.7823.3119.2616.3514.4010∶19.497.796.615.0118.4713.5813.1810.4916∶110.7510.468.877.5019.7918.0915.2613.575∶19.749.207.856.8520.0919.2916.4614.03110008∶110.389.377.496.7223.6920.7016.9214.7710∶110.8310.558.647.3820.2318.9915.7013.2716∶18.969.918.687.2921.4321.7917.7315.56255∶17.997.695.245.6915.2014.8513.2312.2345008∶17.446.616.435.518.3411.3311.9510.8510∶110.669.287.616.2318.6318.9516.1714.4416∶19.278.547.446.089.6613.8613.5711.555∶18.857.486.195.7317.8017.4715.9914.1389008∶19.047.996.745.6715.8416.2614.9813.0310∶111.739.808.056.4720.7218.9917.2414.5516∶18.617.506.625.2916.8316.7914.9113.225∶19.137.145.734.7521.1217.8116.1213.68110008∶18.638.066.405.8119.1119.4616.0613.9110∶18.537.796.805.5813.4716.4715.0912.6616∶112.048.777.075.7322.2419.1716.6514.49平均 average8.44±1.958.11±1.417.04±1.026.23±0.9617.06±3.9417.36±2.3915.01±1.4313.08±1.33
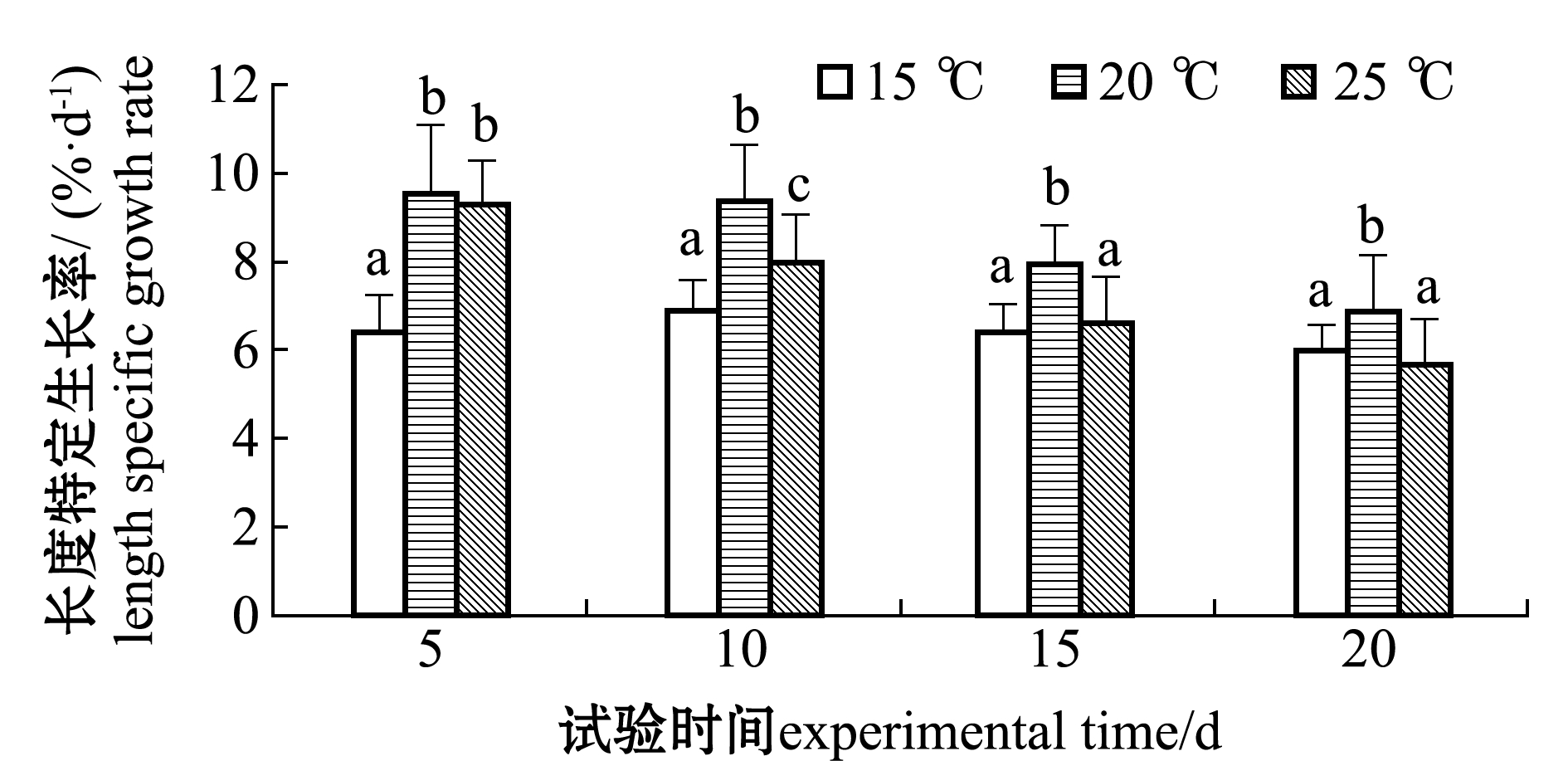
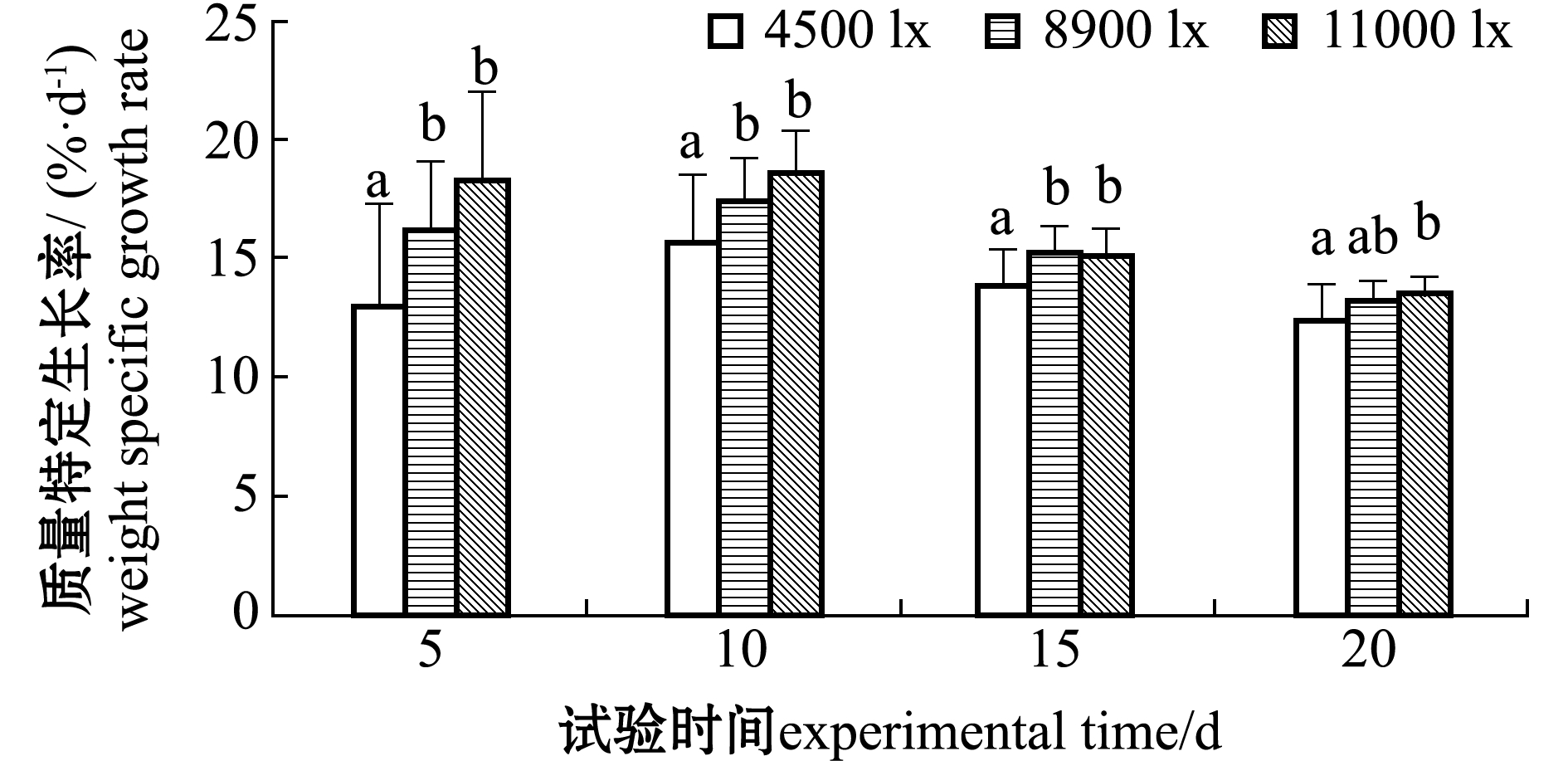
注:标有不同字母者表示同一时间下不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note: The means with different letters in same time are significant differences in different groups at the 0.05 probability level, and the means with the same letter are not significant differences in groups
图1 温度对2 cm组铜藻平均长度增长及光照强度对铜藻平均质量增长的影响
Fig.1 Effect of temperature on length growth and effect of light intensity on weight gain rate of 2 cm long sea weed Sargassum horneri
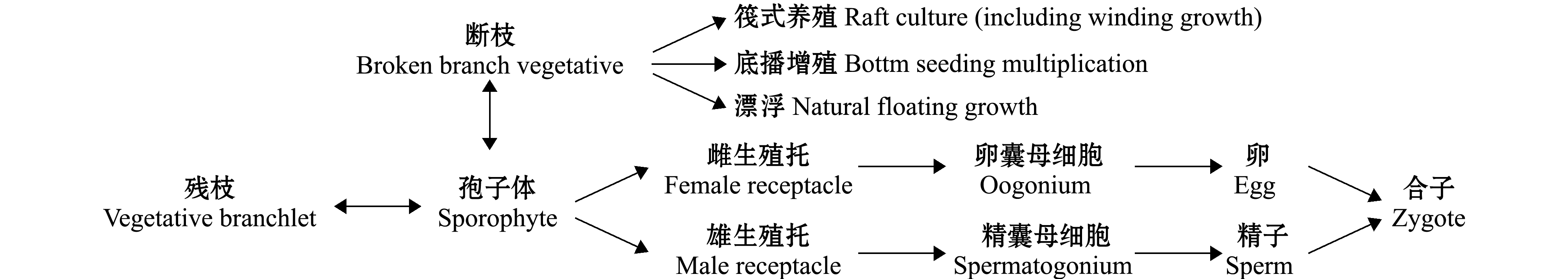
图2 铜藻在自然界的种群演替
Fig.2 Suggested life cycle of sea weed Sargassum horneri in wild
表5 2 cm铜藻培养20 d时长度和质量特定生长率的单因素方差分析
Tab.5 One-way ANOVA of specific growth rates in body length and body weight of 2 cm long sea weed Sargassum horneri for 20 days
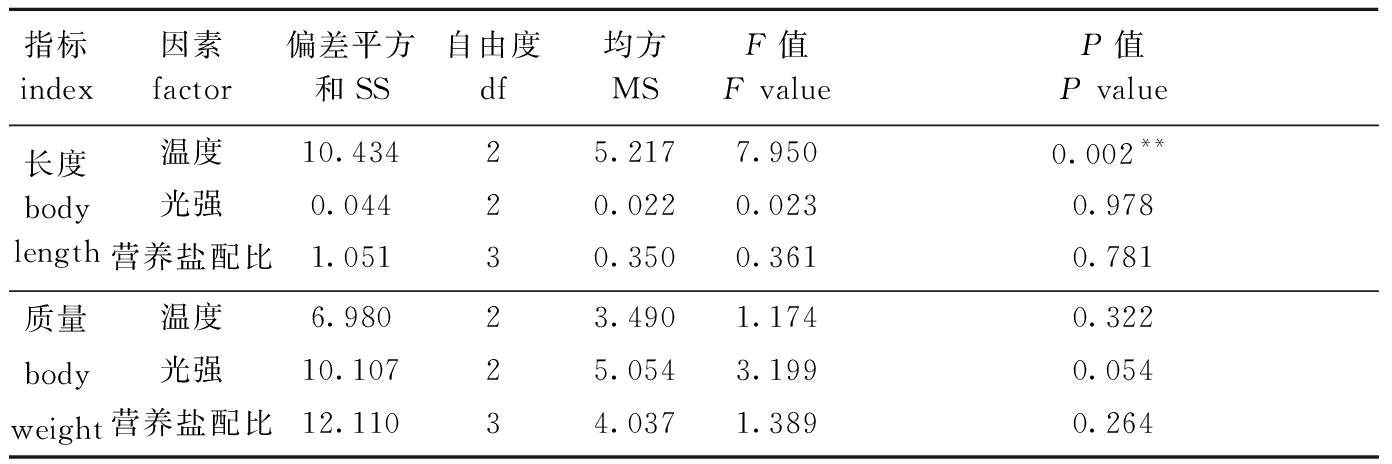
指标 index因素 factor偏差平方和SS自由度 df均方MSF值 F valueP值P value长度body length温度10.43425.2177.9500.002**光强0.04420.0220.0230.978营养盐配比 1.05130.3500.3610.781质量body weight温度 6.98023.4901.1740.322光强10.10725.0543.1990.054营养盐配比12.11034.0371.3890.264
3.3 温度对铜藻幼苗生长的影响
张玉荣等[22]对人工培育具4~6片叶片幼苗生长环境因子胁迫试验表明,最适生长温度为22~24 ℃。孙建璋等[1]对南麂列岛铜藻实地调查认为,铜藻的生长和繁殖适温为11~16 ℃,繁殖盛期水温为16~20 ℃。杨安强等[18]研究在高CO2及20 ℃条件下铜藻吸收氮磷营养盐速率最快。本试验中2 cm组幼苗培养5 d时,20、25 ℃组幼苗长度增长明显高于15 ℃组,与张鹏等[14]的结果一致,而2 cm幼苗培养10、15、20 d及5 cm幼苗培养10 d时,温度20 ℃条件下幼苗长度增长显著快于其他温度组,与杨安强等[18]、南春荣[23]等得出20 ℃时铜藻吸收营养盐速率最快的观点一致,即营养盐吸收速率快相应的幼苗生长速率就快。
3.4 光强对铜藻幼苗生长的影响
对有性繁殖的铜藻幼苗生长来说,普遍认为3 500~6100 lx是最适光强[14,17-18]。而本试验中发现,光强越大藻枝段增重越快,中、高光照8900、11 000 lx条件下断枝幼苗增重显著快于光照4500 lx,说明断枝铜藻幼苗比有性繁殖幼苗适应更强光照。孙建璋等[13]在铜藻人工栽培试验中,有性繁殖培育苗夹苗后有30 d左右停滞生长期,认为可能是夹苗伤害和光强变化适应调节。而本试验中幼苗断枝后停滞生长期很短,一周后就明显生长,可能由于漂浮铜藻本是海底藻折断后漂于海面行营养繁殖,因长期生长于强光下,幼苗已适应强光照,减少了恢复时间。因此,断枝铜藻漂浮到海面后可以快速生长,这就解释了为何浮于海面铜藻能很快成片的原因。
[1] 孙建璋,陈万方,庄定根,等.中国南麂列岛铜藻Sargassum horneri实地生态学的初步研究[J].南方水产,2008,4(3):58-63.
[2] 杨宇峰,费修绠.大型海藻对富营养化海水养殖区生物修复的研究与展望[J].青岛海洋大学学报,2003,33(1):53-57.
[3] 葛长字.大型海藻在海水养殖系统中的生物净化作用[J].渔业现代化,2006(4):11-13.
[4] Terawaki T,Yoshikawa K,Yoshida G,et al.Ecology and restoration techniques for Sargassum beds in the Seto Inland Sea,Japan[J].Marine Pollution Bulletin,2003,47(1-6):198-201.
[5] 毕远新,张亚洲,丰美萍,等.渔山列岛海藻场空间分布格局及成因分析[J].浙江海洋大学学报,2017,36(5):373-378.
[6] 孙建璋,庄定根,陈万方,等.铜藻Sargassum horneri繁殖生物学及种苗培育研究[J].南方水产,2008,4(2):6-14.
[7] Pang Shaojun,Liu Feng,Shan Tifeng,et al.Cultivation of the brown alga Sargassum horneri:sexual reproduction and seedling production in tank culture under reduced solar irradiance in ambient temperature[J].Journal of Applied Phycology,2009,21(4):413-422.
[8] 张婧,严兴洪,章守宇,等.铜藻受精卵的早期发生与幼孢子体发育观察[J].水产学报,2012,36(11):1706-1716.
[9] 李大鹏,李慧,张桂军,等.铜藻繁殖发育过程的研究[J].海洋科学,2018,42(5):40-45.
[10] 蔡永超,孙彬,马家海,等.我国南黄海海域漂浮铜藻的分子生物学鉴定[J].海洋渔业,2014,36(2):102-106.
[11] 陈军,王寅初,余秋瑢,等.绿潮暴发期间我国青岛漂浮铜藻的分子鉴定[J].生物学杂志,2016,33(1):39-42.
[12] 蔡一凡,张鹏,王铁杆,等.基于5.8S rDNA-ITS序列的我国浙江沿海铜藻群体遗传多样性分析[J].热带亚热带植物学报,2013,21(2):147-154.
[13] 孙建璋,庄定根,孙庆海,等.铜藻人工栽培的初步研究[J].南方水产,2009,5(6):41-46.
[14] 张鹏,王铁杆,谢起浪,等.培养条件对铜藻幼苗生长发育的影响[J].上海海洋大学学报,2014,23(2):200-207.
[15] 庞云龙,刘正一,丁兰平,等.山东半岛漂浮铜藻和底栖铜藻气囊及生殖托的形态学比较分析[J].海洋科学,2018,42(3):84-91.
[16] 毕远新,章守宇,吴祖立.沉积物对潮下带岩礁上铜藻早期定居阶段的影响[J].应用生态学报,2013,24(5):1439-1445.
[17] 包楠欧,史定刚,关万春,等.CO2及光强对南麂列岛铜藻生长的影响[J].浙江农业学报,2014,26(3):649-655.
[18] 杨安强,史定刚,陈少波,等.高CO2条件下温度和光照对铜藻吸收N、P的短期影响[J].浙江农业科学,2017,58(2):303-307.
[19] Flores-Molina M R,Thomas D,Lovazzano C,et al.Desiccation stress in intertidal seaweeds:effects on morphology,antioxidant responses and photosynthetic performance[J].Aquatic Botany,2014,113:90-99.
[20] 陈亮然,章守宇,陈彦,等.枸杞岛马尾藻场铜藻的生命史与形态特征[J].水产学报,2015,39(8):1218-1229.
[21] 李慧,丁刚,辛美丽,等.不同氮、磷浓度及配比对铜藻(Sargassum horneri)幼苗生长的影响[J].海洋与湖沼,2017,48(2):368-372.
[22] 张玉荣,刘峰,单体锋,等.利用叶绿素荧光技术揭示人工培育的铜藻幼苗对胁迫温度、光照和盐度的反应[J].南方水产,2009,5(2):1-9.
[23] 南春容,王铁杆,张鹏,等.南麂列岛铜藻氮磷吸收特征研究[J].上海海洋大学学报,2014,23(5):706-711.
[24] 关万春,陈亨,王铁杆,等.阳光紫外辐射对铜藻的生长及荧光参数的影响[J].水产学报,2016,40(1):83-91.
[25] 吕方,詹冬梅,郭文,等.重金属镉对铜藻生长及其生物活性成分积累的影响[J].大连海洋大学学报,2017,36(4):531-537.
[26] 彭雍博,汪秋宽,任丹丹,等.铜藻主要活性物质的提取及其功能[J].水产科学,2017,36(4):531-537.
[27] 王丽梅,李世国,柴雨,等,鼠尾藻幼苗的室内培养及有性生殖同步化[J].水产学报,2011,35(3):395-404.
[28] 柴雨,王丽梅,宋广军,等.海黍子新生枝条的室内培养及有性生殖同步化[J].海洋渔业,2012,34(4):422-428.