苯并(a)芘[benzo(a)pyrene, B(a)P]是一类广泛存在于水体中的环境污染物,来源于石油海上开采和运输过程中的泄露,以及生活污水和工业污水的排放等。B(a)P的亲脂性使其极易进入水生生物体内,引起组织损伤和氧化应激反应,目前,在贝类、鱼类等多种水生生物中已有相关报道,如栉孔扇贝Chlamys farreri 暴露于10 μg/L B(a)P 20 d后,其鳃丝上皮细胞膜出现破裂,表现出明显的细胞损伤[1];鲤暴露于含有0.1~1.0 μg/L B(a)P的水体30 d后,其肝、肾组织的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽酶(GSH)活性均降低,并出现组织损伤[2];极地鳕Boreogadus saida 连续投喂含20.3 μg/g B(a)P的饲料14 d后,其肝脏中检测出B(a)P生物转化关键产物[3-hydroxybenzo(a)pyrene,3-OH-BaP]的存在,表明B(a)P诱导极地鳕鱼肝脏产生氧化应激反应[3]。B(a)P进入生物体内可通过芳香烃受体(aryl hydrocarbon receptor, AHR)介导调控通路对机体产生氧化应激反应,近期研究发现,包括B(a)P在内的多环芳烃(Polycyclic Aromatic Hydrocarbons, PAHs)的芳香烃分子结构含有G蛋白偶联受体(G Protein-Coupled Receptors, GPCRs)配体,推测G蛋白偶联受体介导的信号调控通路也可能参与调控多环芳烃对机体的毒性效应[4-8]。
G蛋白偶联受体介导的信号调控通路通过外源及内源性刺激信号与GPCRs的识别,活化G蛋白,从而影响细胞内包括cAMP(Cyclic adenosine 3′,5′-monophosphate)信号通路在内的多种信号调控通路。cAMP信号通路也称PKA系统(Protein kinase A system, PKA),当外界信号刺激或细胞内代谢条件发生变化,Gɑ亚基的首要效应酶——腺苷酸环化酶(adenylate cyclase,AC)的表达随之发生变化,致使胞内内环腺苷3′,5′-单磷酸腺苷(cAMP)水平发生变化,从而引起细胞反应[9-10]。有报道表明,水溶性毛喉素类似物NKH 477(water-soluble forskolin analogue)(0.1~150 μm)会刺激蜜蜂Apis mellifera AC2t、AC8基因的荧光强度呈剂量依赖性增加,促进机体cAMP的生成[11]。注射吗啡后,短时间内小鼠AC活性及cAMP水平会有所降低,但随着时间的延长,小鼠AC活性和cAMP水平逐渐升高[12]。目前,关于AC的研究多集中在脊椎动物中,而对其他无脊椎动物的相关报道相对较少。
多毛类动物生活在沿海的沉积质中,属于底栖无脊椎动物[13],是海洋生态系统物质循环中的重要组成成员。目前,关于持久性有机污染物对多毛类的毒性效应研究大多集中于解毒代谢及抗氧化相关调控因子方面,关于持久性有机污染物对多毛类G蛋白偶联受体介导的信号调控通路的研究较少。本实验室前期克隆获得了双齿围沙蚕Perinereis aibuhitensis G蛋白α亚基(Gα)和GPCR基因,并发现双酚A(bisphenol A,BPA)或 B(a)P可诱导Gα和GPCR基因的表达,随暴露时间的延长,两个基因的mRNA转录水平升高,推断G蛋白偶联受体介导的信号调控通路可能参与外源物质对沙蚕的毒性效应[14-15]。为了进一步探讨G蛋白偶联受体介导调控通路在双齿围沙蚕对有机污染物毒性响应中的作用,本研究中以 B(a)P为特征污染物,在获得AC基因cDNA全长序列的基础上,分析了B(a)P诱导下双齿围沙蚕AC基因表达及AC酶活性变化,旨在为深入研究B(a)P对多毛类动物的毒性效应机制提供数据支持。
1 材料与方法
1.1 材料
试验用双齿围沙蚕购自辽宁省大连市黑石礁小夏渔具店,其体质量为1.5~2.5 g,挑选有活力的完整个体于实验室暂养一周,控制水温为(18±0.5)℃,盐度为31~32,pH值为8.25±0.10,每24 h换水一次。
试验试剂:RNAisoTM Plus、PrimeScriptTM RT-PCR Kit、Premix Ex TaqTM Hot Start Version、SMARTer®RACE(rapid amplification of cDNA ends) 5′/3′Kit、PrimeScript® RT reagent Kit With gDNA Eraser(Perfect Real Time)、SYBR® Premix Ex TaqTM II (Tli RNaseH Plus)购自TaKaRa公司;Trans 5α感受态细胞和pEASY-Blunt Cloning Vector购自全式金生物技术(大连)有限公司;TIANGEN®琼脂糖凝胶DNA回收试剂盒,购自天根生化科技(北京)有限公司;腺苷酸环化酶(AC)酶联免疫分析(enzyme linked immunosorbent assay,ELISA)试剂盒购自上海科兴商贸有限公司;苯并(a)芘(纯度≥96%)购自 Sigma 公司;丙酮(纯度≥99.5%)购自天津市凯信化学工业有限公司。
1.2 方法
1.2.1 总RNA的提取 将沙蚕整体用液氮进行研磨,称取0.1 g样品,用RNAisoTM Plus试剂提取总RNA,用10 g/L琼脂糖凝胶电泳检测RNA完整性,用微量紫外分光光度计测定RNA的浓度,样品于-80 ℃下保存备用。
1.2.2 双齿围沙蚕AC cDNA全长序列的克隆 根据本实验室双齿围沙蚕转录组文库中已经验证的AC中间片段序列,利用Primer Premier 5.0 软件设计RACE特异性引物,RACE引物如表1所示。利用SMARTer® RACE 5′/3′ Kit,以“1.2.1”节中获得的RNA为模板,合成3′ RACE 和5′RACE cDNA,以3′RACE cDNA 为模板进行AC 3′RACE扩增,试验采用巢式PCR方法。
表1 试验用引物信息
Tab.1 Primers used in the study

引物primer序列 sequence(5'-3')用途 usageAC-F1ATGTCTCACGAAGG-GAAGTCTGTGG3'RACEAC-F2GCCCAGCAGTGGCAGGAGT-TAT3'RACEAC-R1GCTGCTTTCCGTCCCACCA-CAT5'RACEUPM LongCTAATACGACTCACTAT-AGGGC-AAGCAGTGGTATCAACG-CAGAGTuniversal primerUPM ShortCTAATACGACTCACTAT-AGGGCuniversal primerβ-actin-RCGAAGTCCAGAGCAACAT-AGCAhousekeeping geneβ-actin-FGGGCTACTCCTTCACCACCAhousekeeping geneAC-R3CATACAATGGCGGGAGGCquantitative PCRAC-F3GATGCGGGAGTAGATGAGGCquantitative PCR
Outer PCR(Polymerase Chain Reaction)反应体系(共50 μL)包括:PCR-Grade Water 15.5 μL,2×SeqAmp Buffer 25.0 μL,SeqAmp DNA Polymerase 1.0 μL,3′RACE cDNA 2.5 μL,10×UPM(Universal Primer A Mix)5.0 μL,AC-F1(10 μmol/L)1.0 μL。
Outer PCR反应程序:94 ℃下循环变性30 s,61.9 ℃下退火30 s,72 ℃下延伸3 min,共进行35个循环。取 5.0 μL Outer PCR 产物加入245 μL TE缓冲液(Tris-EDTA buffer solution),取5.0 μL稀释后的Outer PCR 产物进行 Inner PCR。
Inner PCR反应体系(共50 μL)包括:Outer PCR 反应液 5.0 μL,PCR-Grade Water 17.0 μL,2×SeqAmp Buffer 25.0 μL,SeqAmp DNA Polymerase 1.0 μL,Universal Primer Short (10 μmol/L)1.0 μL,AC-F2(10 μmol/L)1.0 μL。
Inner PCR反应条件:94 ℃下循环变性30 s,68 ℃下退火30 s,72 ℃下延伸3 min,共进行20个循环。采用普通PCR方法进行AC 5′RACE扩增,反应体系同Quter PCR。
5′RACE反应程序同Outer PCR(退火温度为68 ℃)。取扩增产物进行10 g/L琼脂糖凝胶电泳,对目的条带切胶回收、转化链接,选取阳性克隆送至宝生物工程(大连)有限公司测序。将3′和5′RACE扩增序列进行拼接获得AC全长序列,进行生物信息学分析。
1.2.3 AC序列分析 利用BioEdit软件进行拼接分析,得到AC cDNA全长序列。利用NCBI ORF Finder程序寻找双齿围沙蚕AC基因的开放阅读框,并翻译成相应的氨基酸序列,利用ProtParam 软件进行蛋白质理化性质分析,利用PSORTⅡ软件预测蛋白在细胞内的位置,利用ScanProsite 软件对氨基酸序列修饰位点进行分析,利用TMHMM 软件进行蛋白质跨膜区的分析,利用SWISS-MODEL软件预测氨基酸序列的二级和三级结构。利用Clustal软件对双齿围沙蚕多重序列进行比对,利用MEGA 5.0软件采用NJ(Neighbor-Joining)法构建系统进化树,自检重复为 1000 次。
1.2.4 B(a)P诱导试验 试验设4个B(a)P浓度,分别为0.5、5.0、10.0、50.0 μg/L,另设置丙酮溶剂对照组(100 μL/L)和海水空白对照组,每个浓度组设4个平行。将0.05 g B(a)P粉末定容于100 mL丙酮中,配制成0.5 g/L的母液备用。诱导试验在玻璃烧杯(2 L)中进行,在各浓度组烧杯中注入1 L海水后,分别加入1、10、20、100 μL B(a)P母液混匀,配制试验溶液。每个平行随机挑选10条沙蚕进行试验。试验期间不投饵,每24 h更换一次海水。于试验第4、7、14天时取样,每次从每个烧杯中随机取3条沙蚕,剪取体壁保存用于后续检测。
1.2.5 实时荧光定量PCR 总RNA的提取方法同“1.2.1”节。利用PrimeScript® RT reagent Kit With gDNA Eraser进行样品反转录。根据实验室前期研究结果[13],选取β-actin作为内参基因,引物信息见表1。使用SYBR GreenⅠ染料法进行荧光定量PCR,反应体系(共20 μL)包括:SYBR Premix Ex Taq Ⅱ(Tli RNaseH Plus)10 μL,正、反向引物(10 μmol/L)各0.8 μL,ROX Reference DyeⅡ(50×)0.4 μL,cDNA 2.0 μL,ddH2O 6.0 μL。PCR反应程序:95 ℃下预变性 30 s;95 ℃下变性 5 s,60 ℃下退火34 s,共进行 40 个循环。反应结束后对扩增产物进行溶解曲线分析以确保特异性扩增。每个样品设置3个重复,采用ABI 7500 Real-Time PCR仪(Applied Biosystems,美国)进行分析。实时荧光定量数据以2-ΔΔCt法进行计算。
1.2.6 AC酶活性测定 将沙蚕整体用液氮进行研磨,称取0.1 g样品,加入0.9 mL PBS(phosphate buffer saline)(pH 7.4)缓冲液,用匀浆器将样品充分混匀,于4 ℃下离心20 min(2500 r/min),吸取上清液,制成10%组织匀浆,冷冻备用。采用ELISA试剂盒测定AC酶活性,计算方法和原理均参照试剂盒说明书。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,对试验数据采用SPSS 17.0软件进行单因素方差分析(One-way ANOVA),用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 AC基因cDNA序列特征分析
经克隆获得双齿围沙蚕AC序列全长为4900 bp,其中,5′端非编码区为127 bp,3′端非编码区为1536 bp,开放阅读框为3237 bp,编码1078个氨酸(GenBank登录号:KX792262.1)。该氨基酸序列具有两个保守的环化酶同源结构域(Cyclase homology domains,CHDs),分别位于274~458 aa和843~1040 aa(图1),在两个环化酶催化结构域(Cyclase catalytic domain,CYCc)中分别具有保守的核酸结合位点——金属结合位点和多肽结合位点。预测该蛋白相对分子质量为122 595.92,理论等电点(pI)为8.70。使用 PSORTⅡ软件对AC进行细胞内定位预测,结果显示,该蛋白位于细胞质膜上的概率最高为69.6%,推测该蛋白存在于细胞质膜上。对AC蛋白序列进行跨膜结构分析显示,该蛋白具有2个明显的跨膜区域,每个跨膜区域包括6个跨膜区(Transmembrane helixs,TM),分别位于49~71、81~98、105~127、137~156、161~183、189~211、586~608、613~635、648~670、709~729、731~753、763~785 aa,这与细胞内定位预测的结果相一致,表明该蛋白属于膜蛋白。使用SOPMA软件对该蛋白二级结构进行预测,结果显示,该蛋白由47.03% α-螺旋、9.83% β-转角、22.63%无规则卷曲和20.50%延伸链组成。使用SWISS-MODEL软件进行蛋白三级结构预测,该蛋白包含由两个βαββαβ二级结构基序组成的掌状结构域(见电子版附图1)。

注:红色方框内为起始密码子、终止密码子;阴影区域为环化酶同源结构域;红色字体为核酸结合位点;蓝色方框为金属离子结合位点;绿色方框为多肽结合位点
Notes: Initiation codon and termination codon are in the red box; the CHDs are indicated by shadow; the nucleotidyl binding sites are highlighted by red; the metal binding sites are shown in blue box; the polypeptide binding site are shown in green box
图1 双齿围沙蚕腺苷酸环化酶(AC)基因序列及推导的氨基酸序列
Fig.1 Nucleotide sequence and deduced amino acid sequence of AC gene in clam worm Perinereis aibuhitensis
2.2 AC氨基酸多重序列比对及系统进化分析
将双齿围沙蚕与其他物种AC氨基酸序列进行多重比对,结果显示,双齿围沙蚕AC氨基酸序列在保守的环化酶催化结构域部分与其他物种同源性较高,在其他区域同源性较低(见电子版附图2)。双齿围沙蚕AC序列与软体动物门的福寿螺Pomacea canaliculata、长牡蛎Crassostrea gigas AC1的一致性最高,为47%,与虾夷扇贝 Mizuhopecten yessoensis AC的一致性为46%,与节肢动物门的天牛 Anoplophora glabripennis、温带臭虫 Cimex lectularius、鲎 Limulus polyphemus、赤拟谷盗 Tribolium castaneum、温室拟肥腹蛛 Parasteatoda tepidariorum、果蝇 Drosophila ficusphila、家蚕 Bombyx mori 和南美白对虾 Penaeus vannamei AC序列的一致性为41%~45%,与高等脊椎动物大刺鳅Mastacembelus armatus、大西洋鲱Clupea harengus、青鳉Oryzias latipes、白喉带鹀Zonotrichia albicollis、大山雀Parus major和鼹鼠Fukomys damarensis AC序列的一致性为34%~37%,稍低于无脊椎动物。
对双齿围沙蚕AC氨基酸序列进行系统进化分析(图2),其中,无脊椎动物与脊椎动物分为两大支,双齿围沙蚕AC在无脊椎动物分支中首先与软体动物聚为一支,后与节肢动物聚为一大支。

图2 基于AC氨基酸序列的双齿围沙蚕系统进化树
Fig.2 Phylogenetic tree of clam worm Perinereis aibuhitensis based on AC amino acid sequences
2.3 B(a)P诱导下AC基因的表达
从图3可知:试验过程中,丙酮溶剂对照组与空白对照组相对表达量均无显著性差异(P>0.05),表明丙酮作为溶剂对试验结果无影响;随着诱导时间的延长,各B(a)P浓度组双齿围沙蚕AC基因相对表达量呈不同的变化趋势,0.5、10 μg/L浓度组呈先升高后下降,而5、50 μg/L浓度组则持续升高;暴露第4天时,0.5、5、10、50 μg/L浓度组双齿围沙蚕AC表达量较对照组升高,分别为空白对照组的1.46、3.01、3.17和1.36倍,且与空白对照组均无显著性差异(P>0.05);暴露第7天时,各B(a)P浓度组AC表达量较第4天时均有升高,分别为空白对照组的5.30、5.03、3.65和2.23倍,0.5、10 μg/L浓度组AC表达量达到最大值,其中,仅0.5 μg/L浓度组与空白对照组有显著性差异(P<0.05);暴露第14天时,5、50 μg/L浓度组AC表达量较第7天时有所升高并达到最大值,分别为空白对照组的5.45和2.89倍,仅5 μg/L浓度组与空白对照组有显著性差异(P<0.05),而0.5、10 μg/L浓度组AC表达量与第7天时相比略有下降。
2.4 B(a)P诱导下AC酶活性的变化
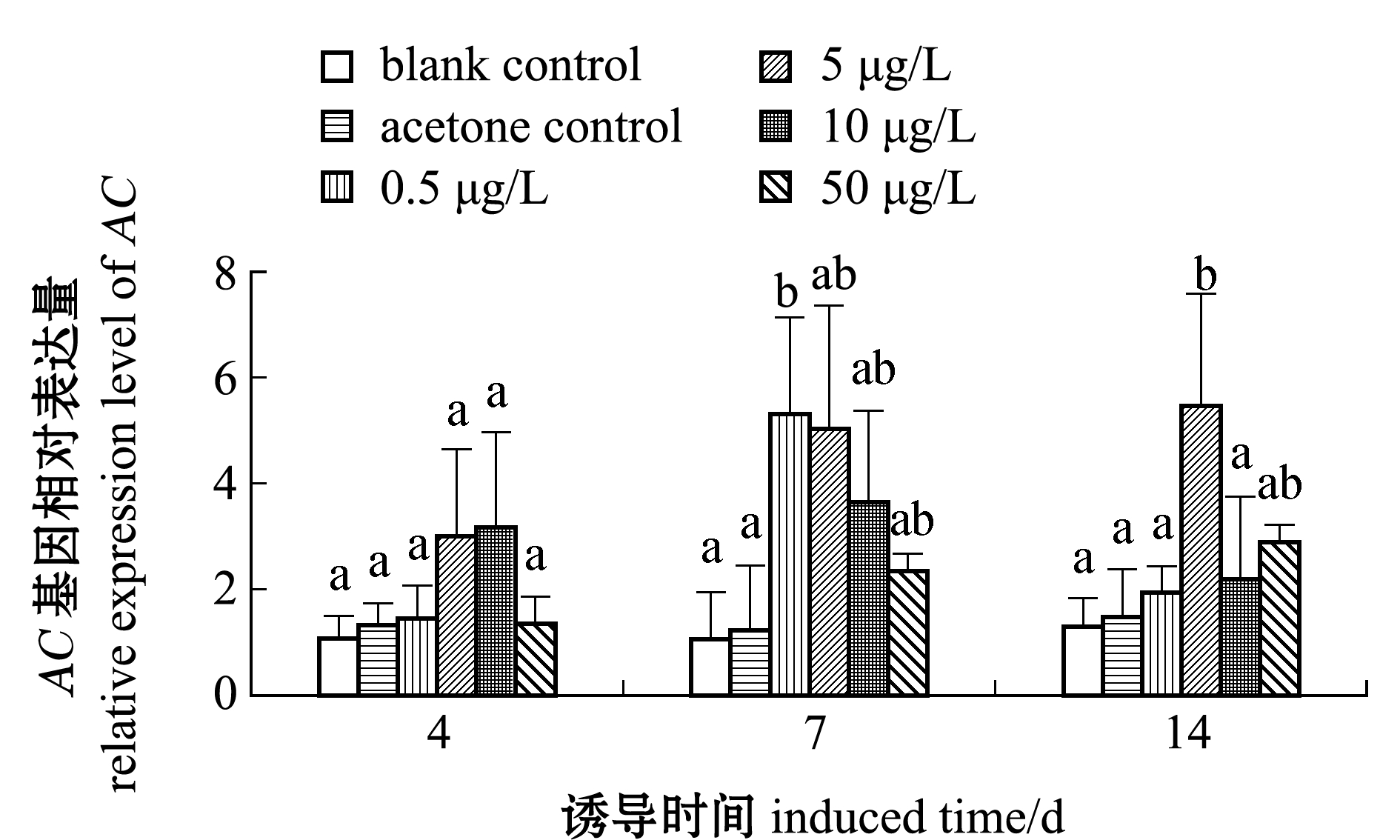
注:标有不同字母者表示同一时间下不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same time are significantly differences in the groups at the 0.05 probability level, and the means with the same letter are not significant differences among groups, et sequentia
图3 不同浓度 B(a)P诱导双齿围沙蚕AC基因表达量的变化
Fig.3 Expression pattern of AC gene transcript in clam worm Perinereis aibuhitensis exposed to different concentrations of B(a)P
从图4可见:各B(a)P浓度组双齿围沙蚕AC酶活性随诱导时间的延长呈波动变化趋势;暴露第4天时,0.5、5、50 μg/L浓度组AC酶活性与空白对照组相比升高,并达到最大值,各浓度组分别为36.18、35.22、30.16 U/L,其中,0.5 μg/L浓度组与空白对照组有显著性差异(P<0.05),为空白对照组的1.28倍,而10 μg/L浓度组较空白对照组有所抑制,酶活性为25.40 U/L;暴露第7天时,各浓度组AC酶活性均高于空白对照组(P>0.05),而10 μg/L浓度组AC酶活性较第4天时有所升高并达到最大值,为29.38 U/L;暴露第14天时,0.5、5 μg/L浓度组AC酶活性较第7天时有所升高,10、50 μg/L浓度组AC酶活性与第7天相比呈下降趋势,但各浓度组AC酶活性与空白对照组均无显著性差异(P>0.05)。
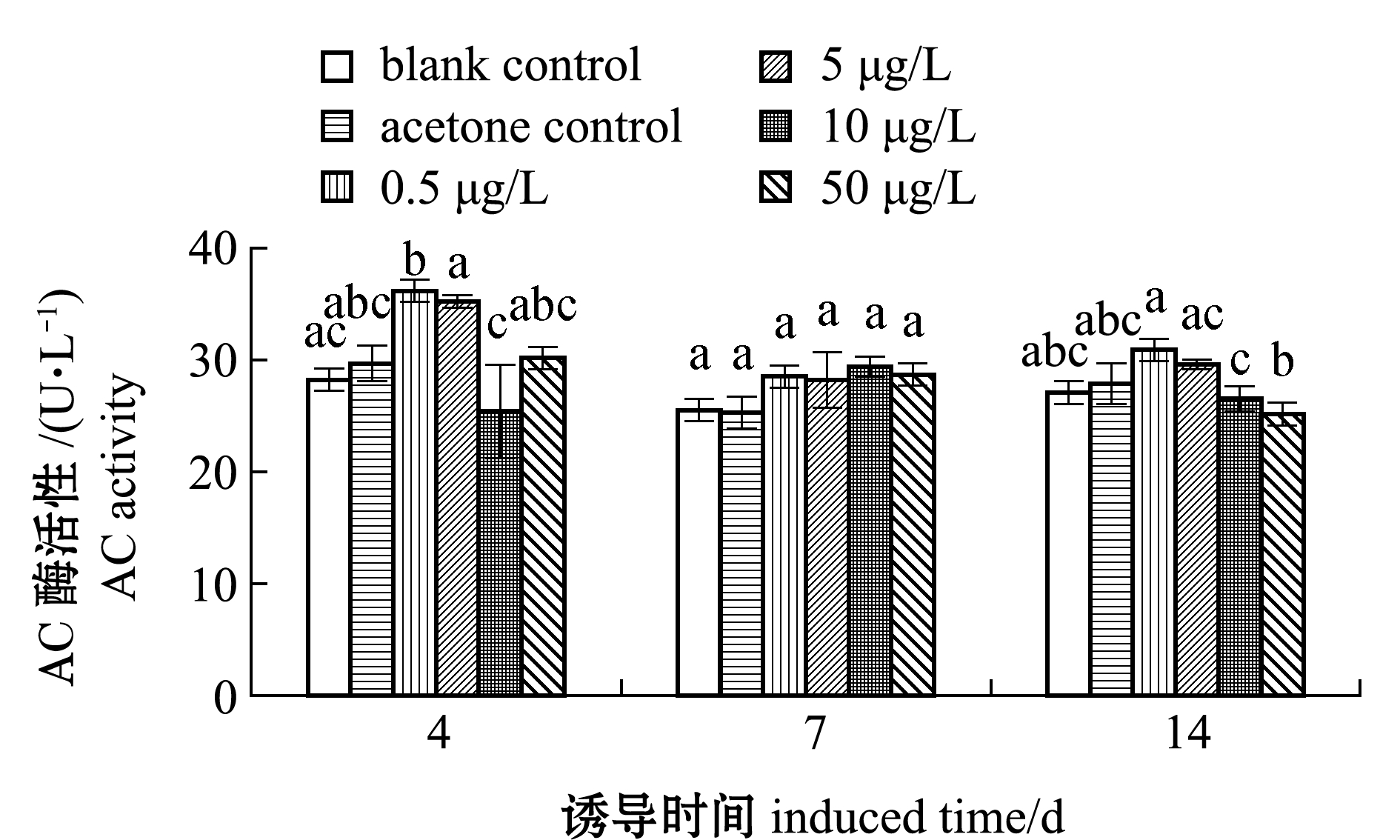
图4 不同浓度 B(a)P 诱导双齿围沙蚕AC酶活性变化
Fig.4 Changes in enzyme actitivy of AC in clam worm Perinereis aibuhitensis exposed to different concentrations ofB(a)P
3 讨论
3.1 AC基因的序列分析
腺苷酸环化酶(AC)是一类广泛存在于生物体内的重要信号分子,在外界信号刺激和细胞内代谢变化的情况下,AC催化三磷酸腺苷(adenosine triphosphate,ATP)分解生成第二信使cAMP。在正常情况下,细胞内cAMP的浓度≤10-6 mol/L,当AC被激活后,cAMP水平急剧增加,将信号传导至下游调节各种生理过程,使靶细胞产生快速应答机制[16]。目前,在哺乳动物中已发现了10种AC异构体(isoforms),其中,AC1~AC9是跨膜AC(transmembrane ACs,tmACs)亚家族,其活性主要通过细胞外激素和神经递质激活G蛋白耦连受体后,由异体G蛋白调节[17];AC10属于可溶性AC(soluble,sAC),由AC10基因编码[18],其游离于细胞质及其包含的亚细胞器中[19-20]。在蛋白结构特征中所有AC均含有2个高度同源的环化酶同源结构域CHDs和2个由跨膜α-螺旋组成的整合结构域(TM1-TM6和TM7-TM12),这些结构交错排列形成CHD-TM结构单元。AC的催化结构域位于胞质区,有高度相似的三级结构,进而形成一个对称的界面(pseudosymmerical interface),并在界面上由两者的互补残基共同参与构成了AC催化活性位点。对本研究中克隆得到的双齿围沙蚕AC进行基因结构分析发现,该氨基酸序列同样含有两个保守的CHDs,分别位于274~458 aa和843~1040 aa,证实获得的氨基酸序列属于AC。在该蛋白序列的保守CHD1中还发现,存在于其他物种氨基酸序列的两个保守金属离子结合位点Asp288和Asp332,该位点在催化过程中通过结合作为辅助因子的Mg2+或Mn2+启动催化反应。
同源序列比对显示,双齿围沙蚕AC氨基酸序列与其他物种的一致性为34%~47%,其中,在环化酶同源区域同源性较高,而在其他区域同源性较低。环化酶同源区域的高同源性表明,AC氨基酸主要功能区域在不同物种中相对比较保守,而在其他区域的低同源性可能与不同物种AC功能的差异存在一定的相关性。研究表明,不同亚型跨膜ACs保留在细胞质中的肽链N-端和C-端的序列和长度差别比较明显,这些区域的差别可能与不同亚型跨膜AC的靶向定位及寡聚化的差别有关[21]。本研究中得到的双齿围沙蚕AC氨基酸与其他物种AC氨基酸序列在其他区域的差别表明,其在双齿围沙蚕中的功能可能与其他物种存在一定差异。多重序列比对显示,该蛋白序列与软体动物门AC序列的同源性较高,基因结构分析亦显示,蛋白序列中具有多个钙调蛋白(CaM)共识位点。哺乳动物中已鉴定的9种AC亚型,根据AC各个膜型的调节特点可分为4组,其中,AC1、AC3和AC8属于第1组,它们可以由钙活化的CaM诱导激活[22]。由此推测,本研究发现的双齿围沙蚕AC蛋白可能亦属于第1组AC。而不同物种AC1到AC8在结构上具有较高相似性,肽链N-端和C-端序列及长度的差别会造成其功能的差异性,故需通过进一步相关AC功能验证分析来最终确定AC蛋白的类别。
3.2 污染物胁迫对双齿围沙蚕AC基因及AC酶活性表达的影响
AC是cAMP信号通路的主要调控因子,AC活性的改变会影响细胞内cAMP的水平,从而调节机体生理过程。有研究表明,在贝类应对污染物及环境因子等胁迫时AC/cAMP调控通路能够发挥重要作用[23]。如Li等[24]发现,酸化会激活牡蛎Pinctada fucata体内cAMP信号通路中AC、cAMP和PKA等的表达,以此应对机体化学平衡的变化。Fabbri等[25]发现,紫贻贝Mytilus galloprovincialis暴露于10 ng/L Cr6+和5 μg/L Cu2+ 7 d后,其鳃组织中AC酶活性及cAMP含量升高。同贝类一样,本研究中,B(a)P胁迫下的双齿围沙蚕AC基因表达及酶活性均出现不同程度的升高,在一定程度上可以说明有机污染物会引起多毛类体内AC/cAMP调控通路发生改变。但本研究中B(a)P浓度组双齿围沙蚕AC基因及酶活性变化与对照组无显著性差异,分析引起这一现象的原因可能与试验个体对持久性有机污染物耐受性差异有关。有学者研究表明,重金属污染严重地区的沙蚕种群对污染物具有异常的适应性和高度耐性[26],故作者认为多毛类能够对AC的变化表现出较强的适应性和耐性。
此外,本研究结果显示,50 μg/L B(a)P浓度组双齿围沙蚕AC基因表达在诱导前7 d低于其他3个浓度组,AC酶活性在诱导第4天和第14天时低于0.5、5 μg/L B(a)P浓度组。这与很多关于重度逆境胁迫会导致机体抗氧化酶和解毒代谢酶基因表达、酶活性均降低的研究结果相似,如多齿围沙蚕在B(a)P诱导下CYP3A基因在 50 μg/L B(a)P浓度组的表达量显著低于2.5 μg/L B(a)P浓度组[27];菲和芘单一污染会胁迫蚯蚓Eisenia foetida SOD活性表现为低剂量激活、高剂量抑制[28]。由此推测,双齿围沙蚕在高浓度B(a)P诱导下会对机体造成损伤,致使AC基因表达和AC酶活性变化相较于低浓度B(a)P诱导呈抑制现象。
对比本研究中AC基因表达和AC酶活性变化的结果可以看出,10 μg/L浓度组双齿围沙蚕AC酶活性的变化规律与AC基因表达变化趋势相同,而0.5、5、50 μg/L浓度组AC酶活性与AC基因表达呈现不同的变化趋势。B(a)P诱导下双齿围沙蚕AC mRNA表达量变化与酶活性变化呈现出不一致性,推测可能是因为包括mRNA转录后调控、翻译后修饰等因素都会影响蛋白表达,这可能造成酶活性变化与mRNA表达水平的不一致[29];亦或者是因为受到污染后AC活性最先被诱导,随后基因被诱导表达,呈现出时间上的差异。关于双齿围沙蚕AC酶活性与基因编码调控间的相互作用机制,今后将进行更深入的研究。
4 结论
(1)本研究中首次克隆获得了双齿围沙蚕AC基因全长序列,该基因全长4900 bp,编码1078个氨基酸,该序列属于第1组AC。
(2)B(a)P诱导可以上调双齿围沙蚕AC基因表达并激活AC酶活性,而高浓度B(a)P会对双齿围沙蚕产生重度胁迫。本研究表明,持久性有机污染物B(a)P会引起多毛类动物体内AC/cAMP调控通路发生改变,从而促进多毛类动物对环境变化的适应。
[1] 苗晶晶,潘鲁青,王静.苯并[a]芘对栉孔扇贝(Chlamys farreri)组织显微和超微结构的影响[J].环境科学学报,2007,27(9):1497-1503.
[2] 陈剑杰,曹谨玲,贺鑫晋,等.苯并芘(BaP)对鲤鱼肝、肾抗氧化、非特异性免疫能力及组织结构的影响[J].核农学报,2019,33(3):623-630.
[3] Song You,Nahrgang J,Tollefsen K E.Transcriptomic analysis reveals dose-dependent modes of action of benzo(a)pyrene in polar cod (Boreogadus saida)[J].Science of the Total Environment,2019,653:176-189.
[4] Le Ferrec E, vrevik J.G-protein coupled receptors (GPCR) and environmental exposure.Consequences for cell metabolism using the β-adrenoceptors as example[J].Current Opinion in Toxicology,2018,8:14-19.
vrevik J.G-protein coupled receptors (GPCR) and environmental exposure.Consequences for cell metabolism using the β-adrenoceptors as example[J].Current Opinion in Toxicology,2018,8:14-19.
[5] Bainy A C D.Nuclear receptors and susceptibility to chemical exposure in aquatic organisms[J].Environment International,2007,33(4):571-575.
[6] Nadal A,Ropero A B,Laribi O,et al.Nongenomic actions of estrogens and xenoestrogens by binding at a plasma membrane receptor unrelated to estrogen receptor α and estrogen receptor β[J].Proceedings of the National Academy of Sciences of the United States of America,2000,97(21):11603-11608.
[7] Alonso-Magdalena P,Laribi O,Ropero A B,et al.Low doses of bisphenol A and diethylstilbestrol impair Ca2+ signals in pancreatic α-cells through a nonclassical membrane estrogen receptor within intact islets of Langerhans[J].Environmental Health Perspectives,2005,113(8):969-977.
[8] Mayati A,Levoin N,Paris H,et al.Induction of intracellular calcium concentration by environmental benzo(a)pyrene involves a β2-adrenergic receptor/adenylyl cyclase/Epac-1/inositol 1,4,5-trisphosphate pathway in endothelial cells[J].Journal of Biological Chemistry,2012,287(6):4041-4052.
[9] Gancedo J M.Biological roles of cAMP:variations on a theme in the different kingdoms of life[J].Biological Reviews,2013,88(3):645-668.
[10] 徐如强,Watts V J.Gαi/o偶联受体介导的腺苷酸环化酶“超敏化”研究进展[J].药学学报,2016,51(9):1349-1355.
[11] Balfanz S,Ehling P,Wachten S,et al.Functional characterization of transmembrane adenylyl cyclases from the honeybee brain[J].Insect Biochemistry and Molecular Biology,2012,42(6):435-445.
[12] 方芳,汪青,曹清,等.吗啡依赖小鼠脑组织cAMP系统的变化及腺苷酸环化酶磷酸化调节[J].中国医学科学院学报,2000,22(1):14-19.
[13] 赵欢,赵新达,岳宗豪,等.苯并(a)芘对双齿围沙蚕抗氧化酶活性和细胞色素P450基因表达的影响[J].大连海洋大学学报,2014,29(4):342-346.
[14] Zhao Huan,Zhou Yibing,Li Ying,et al.Molecular cloning and expression of the gene for G protein alpha subunit induced by bisphenol A in marine polychaete Perinereis aibuhitensis[J].Environmental Toxicology and Pharmacology,2014,37(2):521-528.
[15] Huang Yi,Sun Jia,Han Ping,et al.Molecular characterization of G-protein-coupled receptor (GPCR) and protein kinase A (PKA) cDNA in Perinereis aibuhitensis and expression during benzo(a)pyrene exposure[J].Peer J,2019,7:e8044.
[16] Steegborn C.Structure,mechanism,and regulation of soluble adenylyl cyclases—similarities and differences to transmembrane adenylyl cyclases[J].Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease,2014,1842(12):2535-2547.
[17] Sunahara R K,Taussig R.Isoforms of mammalian adenylyl cyclase:multiplicities of signaling[J].Molecular Interventions,2002,2(3):168-184.
[18] Kamenetsky M,Middelhaufe S,Bank E M,et al.Molecular details of cAMP generation in mammalian cells:a tale of two systems[J].Journal of Molecular Biology,2006,362(4):623-639.
[19] Lefkimmiatis K,Leronni D,Hofer A M.The inner and outer compartments of mitochondria are sites of distinct cAMP/PKA signaling dynamics[J].Journal of Cell Biology,2013,202(3):453-462.
[20] Zippin J H,Chadwick P A,Levin L R,et al.Soluble adenylyl cyclase defines a nuclear cAMP microdomain in keratinocyte hyperproliferative skin diseases[J].Journal of Investigative Dermatology,2010,130(5):1279-1287.
[21] 郭艳辉,梁秀银,于双营,等.哺乳动物腺苷酸环化酶的表达调控与功能[J].中国细胞生物学学报,2018,40(3):426-438.
[22] Patel T B,Du Ziyun,Pierre S,et al.Molecular biological approaches to unravel adenylyl cyclase signaling and function[J].Gene,2001,269(1-2):13-25.
[23] Fabbri E,Capuzzo A.Cyclic AMP signaling in bivalve molluscs:an overview[J].Journal of Experimental Zoology Part A:Ecological Genetics and Physiology,2010,313A(4):179-200.
[24] Li Shiguo,Liu Chuang,Huang Jingliang,et al.Transcriptome and biomineralization responses of the pearl oyster Pinctada fucata to elevated CO2 and temperature[J].Scientific Reports,2016,6:18943.
[25] Fabbri E,Capuzzo A.Adenylyl cyclase activity and its modulation in the gills of Mytilus galloprovincialis exposed to Cr6+ and Cu2+[J].Aquatic Toxicology,2006,76(1):59-68.
[26] Zhou Qixing,Rainbow P S,Smith B D.Tolerance and accumulation of the trace metals zinc,copper and cadmium in three populations of the polychaete Nereis diversicolor[J].Journal of the Marine Biological Association of the United Kingdom,2003,83(1):65-72.
[27] 王振.多齿围沙蚕(Periereis nuntia Savigy)对苯并(a)芘的毒性响应[D].汕头:汕头大学,2010.
[28] 吴尔苗,王军良,赵士良,等.菲和芘单一及复合污染对蚯蚓抗氧化酶活性和丙二醛含量的影响[J].环境科学学报,2011,31(5):1077-1085.
[29] Mathews M B,Sonenberg N,Hershey J W B.Translational Control in Biology and Medicine[M].New York:Cold Spring Harbor Laboratory Press,2007:534-546.