丙酮酸激酶(Pyruvate kinase,PK)是生物体糖酵解途径(Glycolytic pathway)中一个重要的限速调节别构酶,负责将磷酸烯醇式丙酮酸(Phosphoenolpyruvate)上的高能磷酸基团转移至二磷酸腺苷(ADP)生成三磷酸腺苷(ATP),同时生成丙酮酸(Pyruvate acid),其中,ATP是机体生命活动的能量“货币”,而丙酮酸既是糖酵解途径的终产物,也是机体糖代谢及多种物质相互转化的重要中间体[1]。丙酮酸激酶有PKL、PKR、PKM1和PKM2 4种同工酶,按照编码基因不同可将其分为PKL、PKR和PKM1、PKM2两大亚类,亚类同工酶的分类按照基因转录时产生的mRNA不同而进行区分[2]。有研究显示,与健康人类相比,肿瘤患者血液中PKM2含量会明显升高[3],而且PKM2的检测灵敏度要明显高于传统的癌症标记物——癌胚抗原(Carcinoembryonic antigen,CEA)[4],因此,可将PKM2作为一种癌症标记物辅助提高人类癌症早期的筛查效率[3]。
目前,对水产动物PK的研究较少。有研究表明,水产动物PK的酶活性易受到外源环境因子或环境胁迫影响:高浓度亚硝酸氮会严重抑制刺参Apostichopus japonicus体腔液、体壁和肌肉中的PK活性,影响刺参体内的糖代谢过程[5];淡水或较高盐度会导致半滑舌鳎Cynoglossus semilaevis肝脏内的PK活性降低,从而降低其肝脏内糖酵解的速度,影响其能量代谢过程[6]。
海水酸化(seawater acidification)是因海洋富集并溶解了过量的二氧化碳气体(CO2)而导致的海水pH降低的一种环境问题[7]。大量研究证实,海水酸化不仅可通过影响藻类[8-9]、珊瑚[10]、贝类[11]和棘皮类[12-14]等海洋生物的生物矿化作用破坏海洋碳循环,还可影响海洋生物的繁殖、生长、发育和免疫防御等生理生化过程[15-17],进而降低海洋生物多样性,导致整个海洋生态系统的失衡[18]。海胆是典型的海洋浅海代表生物之一,也是研究海水酸化对海洋系统影响的重要模式生物。研究证实,海水酸化不仅能影响成体海胆的耗氧率和排氨率[19],也会造成海胆早期胚胎分裂延迟、囊胚孵化率降低,以及四腕浮游幼体存活率降低、钙化骨针外露和对称性缺失等问题[20-21]。
中间球海胆Strongylocentrotus intermedius俗称虾夷马粪海胆,具有棘刺短、性腺品质良好和生长发育快的特点,目前已成为中国海水增养殖业重要的经济品种。本课题组前期研究发现,与自然海水条件相比,不同海水酸化条件下,成体中间球海胆多个组织中的乳糖脱氢酶(LDH)基因的相对表达量及其总酶活力均发生明显变化[22]。由于LDH的催化底物丙酮酸的产生速度可由PK直接调控,因此,猜测中间球海胆的丙酮酸激酶面对海水酸化的胁迫也有响应。本研究中,利用分子生物学技术克隆获得了中间球海胆PK基因(SiPK)的cDNA全长序列,并利用生物信息学手段对其序列结构和进化特点进行分析,比较了不同海水酸化条件下,成体中间球海胆不同组织中PK基因的相对表达量及总PK酶活性的变化情况,旨在探明中间球海胆PK基因的序列信息、结构特点、进化地位和总PK酶活性,以及对海水酸化的响应方式。
1 材料与方法
1.1 材料
试验用中间球海胆购自辽宁省大连市旅顺龙王塘养殖场。正式试验前将海胆于农业农村部北方海水增养殖重点实验室暂养两周,将海胆置于1000 L循环海水槽中,持续通气以保持水体溶氧充足,并投喂新鲜海带Saccharina japonica,每两天全部换水一次。试验海水来自大连市黑石礁海区(经过滤处理),暂养期间水温为(20±2)℃,盐度为31.26±0.09,pH为8.10±0.03。
1.2 方法
1.2.1 海水酸化胁迫试验 根据政府间气候变化专门委员会预测结果[23],本试验中设置自然海水(对照组)、ΔpH=-0.3(SA1)、ΔpH=-0.4(SA2)、ΔpH=-0.5(SA3)4组(ΔpH表示与自然海水pH的差值),每组设3个平行。试验选取120只健康且规格均一的成体中间球海胆,其壳径为(4.80±0.10)cm,体质量为(55.27±3.56)g,随机分配至各试验组(每个平行10只),进行为期60 d的海水酸化胁迫试验。
酸化海水制备按照李莹莹等[24]描述的方法进行。试验所用合成气体均购自大连大特气体有限公司。试验期间,每天投喂海带一次,每天换水量为总水量的1/2,每2 d全量换水一次,其中,酸化组所换海水需经相应的酸化处理,以保持各试验组海水pH的相对稳定,换水时及时清除残饵及粪便。为避免海水pH的剧烈波动,换水前后需进行海水参数检测,以确保各试验组海水参数的稳定。
试验期间,使用pH计(HI 9124,HANNA,意大利)和水质仪(YSI6920,美国)实时监测各试验组海水的pH、温度和盐度,测得各组水温为(20±2)℃、盐度为31.26±0.09;依据Mehrbach等[25]描述的pH滴定法测定总碱度(TA);利用SWCO2软件(http://neon.otago.ac.nzresearch/mfc/ people/keith_hunter/software/software.hm)计算各组二氧化碳的浓度ρ(CO2)(表1)。
表1 海水酸化期间各试验组的海水参数
Tab.1 Seawater parameters during the acidification experiment
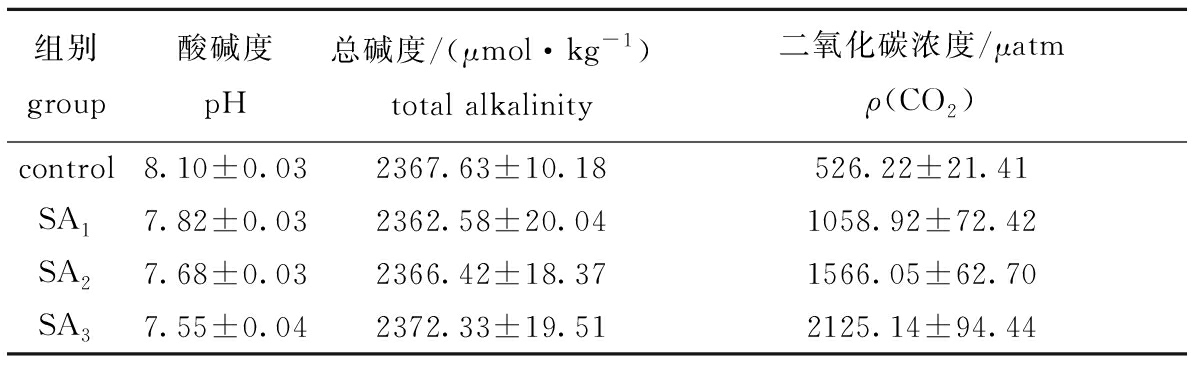
组别group酸碱度pH总碱度/(μmol·kg-1)total alkalinity二氧化碳浓度/μatmρ(CO2)control8.10±0.032367.63±10.18526.22±21.41SA17.82±0.032362.58±20.041058.92±72.42SA27.68±0.032366.42±18.371566.05±62.70SA37.55±0.042372.33±19.512125.14±94.44
1.2.2 样品的收集
(1) SiPK基因的克隆、组织表达和总PK酶活性检测样品的收集。从对照组选择健康、活力好的中间球海胆3只,置于冰上分别取其体腔液、管足、性腺和肠组织,一部分样品立即用液氮冷冻后存放于冰箱(-80 ℃)中,用于PK基因的克隆和组织表达规律检测;另一部分样品直接冻存于冰箱(-80 ℃)中,用于总PK酶活性测定。
(2) 海水酸化胁迫试验样品的收集。酸化试验结束后,将各组海胆禁食48 h后,从每个组随机挑选5只海胆进行样品收集。收集方法同上。
1.2.3 SiPK cDNA全长序列克隆
(1)总RNA的提取、cDNA反转录及5′/3′末端模板合成。用动物组织总RNA提取试剂盒[天根生化科技(北京)有限公司]提取中间球海胆管足、肠、性腺和体腔液4种组织的总RNA,使用核酸蛋白检测仪(SimpliNano)测定RNA的浓度和纯度,用10 g/L琼脂糖凝胶电泳检测RNA的完整性。对检测合格的总RNA,使用PrimeScriptTM RT reagent Kit(Perfect Real Time)[宝生物工程(大连)有限公司]进行反转录获得第一条链cDNA模板;使用SMARTer RACE 5′/3′试剂盒[宝生物工程(大连)有限公司]将中间球海胆体腔液中的总RNA合成5′/3′末端RACE cDNA模板;将得到的第一条链cDNA模板和5′/3′末端RACE cDNA模板保存于-20 ℃冰箱,备用。
(2)SiPK核心片段的克隆。根据中间球海胆转录组文库中筛选出的PK片段,设计5对特异性引物用于SiPK核心片段的克隆(表2),设计引物完成后将引物序列送往生工生物工程(上海)股份有限公司进行引物合成。基因克隆参照柳林等[26]描述的方法。
(3)SiPK的5′/3′末端片段克隆。将所获得的5段核心片段序列进行拼接后于NCBI数据库中进行比对,最终确定其为SiPK的核心片段,随后以此为模板,设计5′和3′RACE特异性外侧和内侧引物(表2),然后以cDNA为模板分别进行5′/3′ 末端片段的扩增,具体参照李蒙等[27]的方法。
表2 试验用PCR引物序列
Tab.2 PCR primers used in this study

引物primer序列sequence(5'-3')用途 applicationPK-F1PK-R1ACCTGTTTCTCGTAGCGTTGACACCCTTGTCTTTCTCTGAGAGTGCSiPK-1PK-F2PK-R2TTATCAATGGAGGTATGCTAGGCAGGATTGGGGCAAGAGGACG-GAASiPK-2PK-F3PK-R3TTCCGTCCTCTTGCCCCAATCCTGTCCAATGCTCACAGAACTGCTGSiPK-3PK-F4PK-R4GAGCAATCATCCTATACAGTACGAAGCACCTTGACTTGAGTGGGCASiPK-4PK-F5PK-R5GATGGTATCAACATGCCCACTCAAAATCTGGCAGTCTCTATCGCACSiPK-5PK-5-outGTACGCACCTGGGTCAGACGCCT5'RACEPK-5-inTGTCAACGCTACGAGAAACAGGT5'RACEPK-3-outAAGTTTCTGCTTTGGCACATCCC3'RACEPK-3-inATTGATGTTGCATACCAGGCCCA3'RACEUMPCTAATACGACTCACTAT-AGGGCAAGCAGTGGTAACAACG-CAGAGTRACENUPCTAATACGACTCACTATAGGGCRACEPK-FAGGAGAAGGAACGCAACTGGqPCRPK-RGCCATCCAGTCACCACGATAqPCRβ-actin-FACAGGGAAAAGATGGCACAGAqPCRβ-actin-RAGAGGCGTAGAGGGAAAGCACqPCR
(4) SiPK序列的生物信息学分析。对SiPK cDNA全长序列进行生物信息学分析,按崔东遥等[22]的方法进行。采用Blastx进行序列相似性分析,采用DNAMAN 6.0软件进行多重序列比对,采用MEGA 7.0软件构建系统进化树。
1.2.4 实时荧光定量PCR 采用Primer Premier 5.0软件设计SiPK基因的实时荧光定量引物(表2),选取β-actin为内参基因,并对引物的特异性和扩增效率进行检测。使用ABI 7500荧光定量PCR仪(ABI,美国应用生物系统公司)和SYBR® Premix ExTaq TM ⅡKit[宝生物工程(大连)有限公司]进行qRT-PCR试验,反应体系及反应程序均参照江东能等[28]方法。采用2-ΔΔCt法计算SiPK基因的相对表达量。
1.2.5 中间球海胆组织总PK酶活性的测定 取0.5~1.0 g组织样品经液氮研磨后,按质量与体积比为1∶9(g∶mL)加入无菌海水,低温离心(4 ℃,430×g)10 min后取上清液,按照丙酮酸激酶(PK)测试盒(A076-1,南京建成生物工程有限公司)说明书步骤测定总PK酶活性。使用Epoch酶标仪(Biotek,美国腾仪器有限公司)测定反应底物吸光度。
1.3 数据处理
采用SPSS 22.0软件对试验数据进行整理和统计,所有数据均以平均值±标准差(mean± S.D.)表示。对试验数据进行单因素方差分析(One-way ANOVA)及Duncan多重比较,显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 SiPK基因的cDNA全长序列
SiPK基因的cDNA序列全长为3616 bp,其中,5′非编码区长度为91 bp,3′非编码区长度为1911 bp,具有一个长度为1614 bp(包含终止密码子)、编码537个氨基酸的开放阅读框(ORF)(图1),原子组成为C4051H6467N1137O1215S46,推测该基因编码的PK蛋白相对分子质量为58 740,理论等电点为6.62。二级结构预测结果显示,SiPK蛋白包含42个无规则卷曲、22个延伸链和19个α-螺旋(见电子版附图1)。以人PK蛋白(PDB登陆号:3srf.1.A)为模板构建SiPK蛋白的三维结构模型,结果显示,二者的一致性为63.88%(见电子版附图2)。采用在线分析软件对SiPK氨基酸序列分析显示,该蛋白为非跨膜、温和疏水蛋白且无信号肽结构。

注:方框内为起始密码子(ATG);*为终止密码子(TAA);下划线为PK基因编码的氨基酸序列;阴影标注为加尾信号(AATAA)
Note:The starting codon (ATG) is shown in the box;the asterisk (*) indicates the terminating codon (TAA);the amino acid sequence encoded by the PK is underlined;shadow indicates tailing signal (AATAA)
图1 中间球海胆丙酮酸激酶PK基因的核苷酸序列及其编码的氨基酸序列
Fig.1 Nucleotide sequence and deduced amino acid sequence of PK gene in sea urchin Strongylocentrotus intermedius
2.2 SiPK多重序列比对及系统进化分析
多序列比对结果显示,14种生物PK氨基酸序列的平均一致性为60.21%(见电子版附图3),其中,中间球海胆与人类Homo sapiens、小鼠Mus musculus、白鱀豚Lipotes vexillifer、非洲爪蟾Xenopus laevis、斑马鱼Danio rerio、青鳉Oryzias latipes、红鳍东方鲀Takifugu rubripes、虾夷扇贝Patinopecten yessoensis、长棘海星Acanthaster planci、刺参Apostichopus japonicus和紫球海胆Strongylocentrotus purpuratus PK的一致性均大于50%,与南美白对虾Penaeus vannamei、美洲牡蛎Crassostrea virginica PK的一致性则均小于50%;中间球海胆与其他3种棘皮动物的PK氨基酸序列比较,其中,与长棘海星PK的一致性最高,达66.26%,与刺参PK的一致性为65.25%,与紫球海胆PK的一致最低,为61.27%。系统进化树分析显示,中间球海胆与紫球海胆、刺参的PK聚为一支(图2)。

图2 中间球海胆与其他13种生物PK氨基酸序列的系统进化树
Fig.2 Neighbor-joining phylogenetic tree of PK amino acid sequence from sea urchin Strongylocentrotus intermedius and other 13 species
2.3 SiPK基因及总PK酶活性的组织表达规律
从图3-A可见,中间球海胆PK基因在管足、肠、性腺和体腔液中均有表达,且均存在显著性差异(P<0.05),各组织的相对表达量依次为性腺>管足>体腔液>肠。
从图3-B可见,中间球海胆各组织的总PK酶活性依次为管足>性腺>体腔液>肠,其中,管足中总PK酶活性最高且显著高于其他3种组织(P<0.05),性腺组织中总PK酶活性显著高于肠和体腔液(P<0.05),而肠与体腔液中总PK酶活性无显著性差异(P>0.05)。
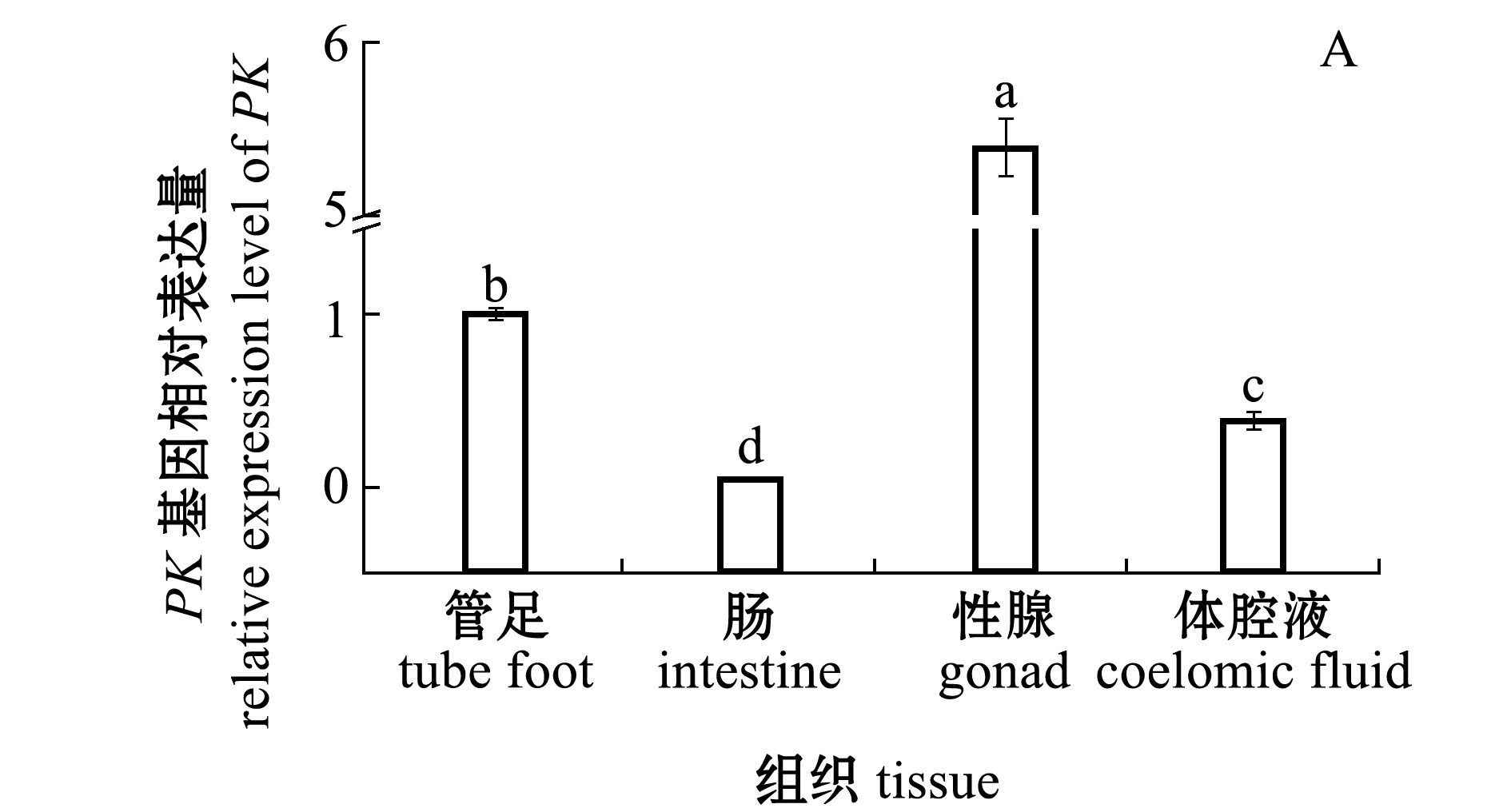
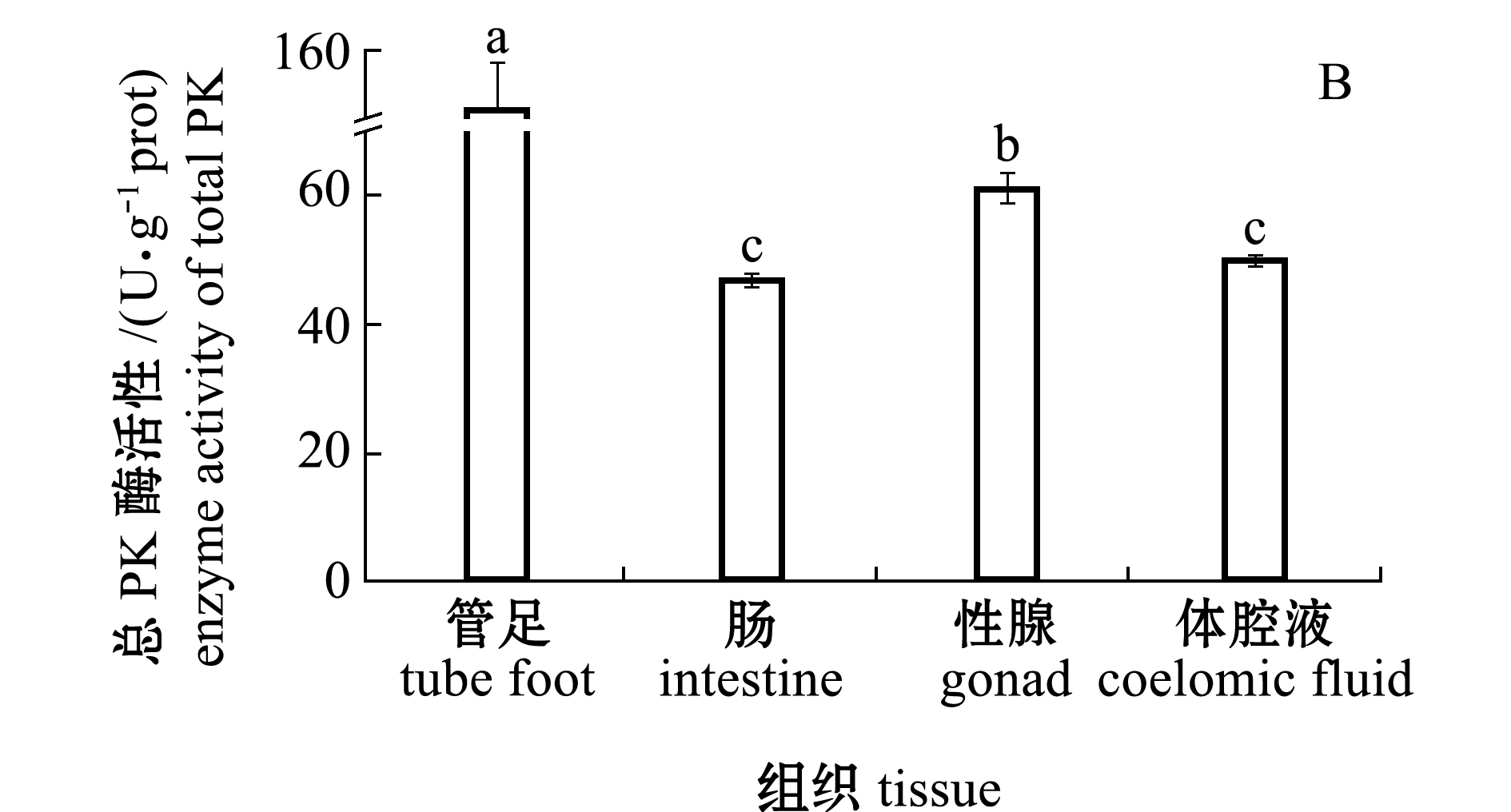
注:标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letter are not significant differences
图3 中间球海胆不同组织中PK基因的相对表达量及总PK酶活性
Fig.3 Relative expression level of PK gene and total PK activity in different tissues of sea urchin Strongylocentrotus intermedius
2.4 海水酸化对各组织中PK基因表达及总PK酶活性的影响
从图4-A可见:与对照组相比,经过60 d 海水酸化胁迫后,中间球海胆管足、肠、性腺和体腔液中PK基因的相对表达量均呈现不同程度的变化;随着酸化程度的加重,管足、性腺和体腔液中PK基因的相对表达量均呈极显著下降趋势(P<0.01),其中管足和性腺中基因表达量下降幅度更大;肠组织中,当海水pH降低0.3个单位时(SA1),PK基因表达量极显著低于对照组(P<0.01),当海水pH降低0.4个单位时(SA2),基因表达量略低于对照组(P>0.05),当海水pH降低0.5个单位时(SA3),基因表达量则极显著高于对照组(P<0.01)。
从图4-B可见:与对照组相比,经过60 d海水酸化胁迫处理后,各酸化组中间球海胆管足、肠、性腺和体腔液中总PK酶活性均呈一定的组织特异性变化;随着酸化程度的加重,管足组织中总PK酶活性呈极显著下降的趋势(P<0.01),肠组织总PK酶活性呈极显著上升的趋势(P<0.01),性腺中总PK酶活性呈先升高后降低的趋势(P<0.05),体腔液中总PK酶活性则呈显著下降的趋势(P<0.05)。
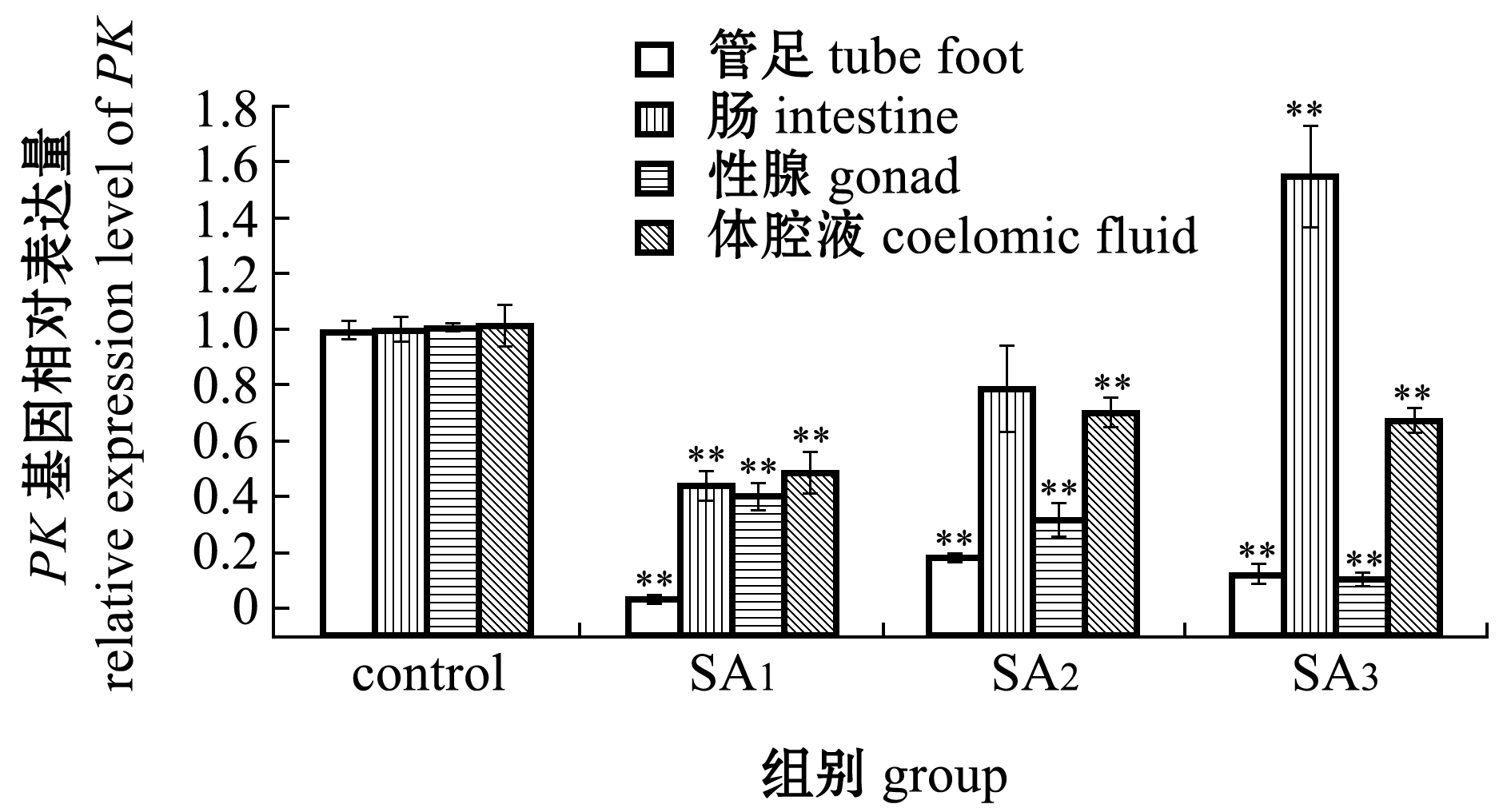
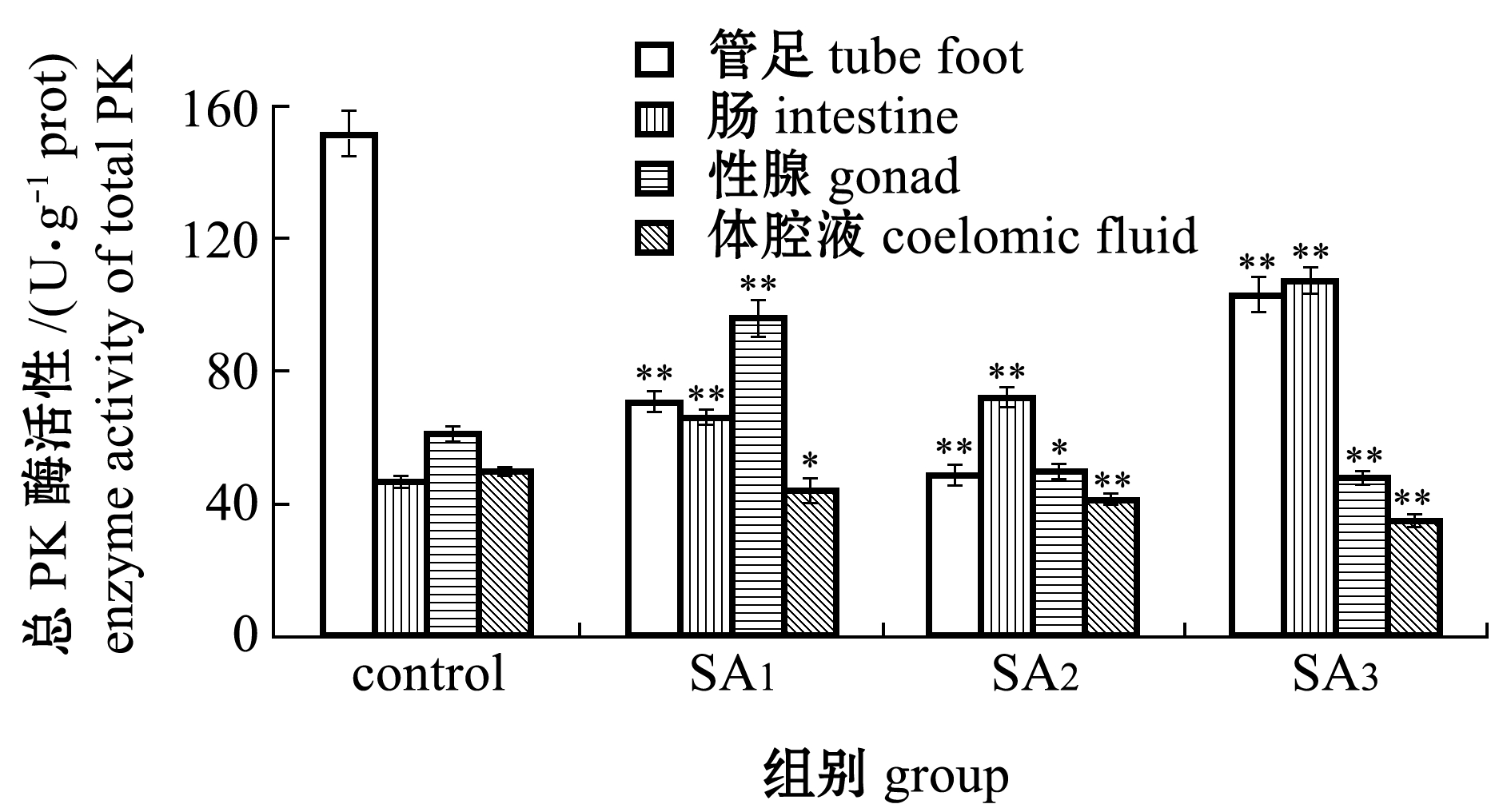
注:*表示与对照组有显著性差异(P<0.05);**表示与对照组有极显著性差异(P<0.01)
Note: *means significant difference compared with the control (P<0.05);**means very significant difference compared with the control(P<0.01)
图4 不同海水酸化条件下中间球海胆各组织中PK基因的相对表达量及总PK酶活性
Fig.4 Relative expression level of PK gene and total PK activity in different tissues of sea urchin Strongylocentrotus intermedius under different seawater acidification conditions
3 讨论
3.1 中间球海胆PK基因的序列特征
本研究中利用cDNA末端快速扩增(RACE)技术首次获得了中间球海胆PK基因的cDNA全长(NCBI登录号:MN_240486),经生物信息分析发现,中间球海胆PK核苷酸序列与紫球海胆的相似度最高,为97.82%;而多重序列比对结果显示,中间球海胆PK二级结构与长棘海星最相近,中间球海胆、紫球海胆和长棘海星虽栖居于同一类型的环境,但中间球海胆与长棘海星的栖息温度相似且不同于紫球海胆。这与邓小弓等[29]研究中长期生活在地下的裸鼹鼠Heterocephalus glaber和高原鼢鼠Eospalax baileyi的氨基酸序列会产生一定程度的趋同进化(Convergent evolution)结果相似,因此,笔者猜测,中间球海胆和长棘海星PK间可能存在趋同进化。比较中间球海胆与刺参、紫球海胆和长棘海星PK蛋白二级结构发现,中间球海胆与长棘海星、刺参PK蛋白的二级结构相似度较高,而与紫球海胆PK相似度最低,推测中间球海胆PK在二级结构形成上具有一定的种属特异性。蛋白质三维结构分析显示,中间球海胆PK与亲缘关系较远的哺乳动物人类PK的一致性为63.88%,二者在三维结构上差异性较小,这表明中间球海胆PK的空间结构和生物学功能在进化过程中具有较高的保守性。系统进化分析结果显示,中间球海胆PK与同属于棘皮动物的紫球海胆、刺参的PK聚为一支,符合其进化及分类地位。
3.2 中间球海胆PK基因及总PK酶活性的组织表达规律及其对海水酸化的响应方式
本研究表明,中间球海胆PK基因相对表达和总PK酶活性均具有显著而鲜明的组织特异性。其中,管足和性腺是PK基因相对表达和总PK酶活性较高的两种组织。管足是海胆的运动器官,也是能量消耗的主要器官,较高水平的PK基因表达和总PK酶活性也进一步反映了海胆管足组织中的糖酵解过程较为活跃,此外,Lawrence等[30]发现,中间球海胆在繁殖期会将其用于壳径和体质量增长的能量降至最低水平,而将更多的能量分配给性腺组织,优先发育性腺组织以保证繁殖的正常进行。本研究中取样时间正处于中间球海胆繁殖期,在性腺组织中检测到较高水平的PK基因表达和总PK酶活性,这一结果也印证了Lawrence等的观点。
海水酸化胁迫试验结果显示,不同海水酸化条件下,中间球海胆管足、肠、性腺和体腔液组织中的PK基因表达量和总PK酶活性各不相同,这说明中间球海胆PK基因和PK酶在应答不同海水酸化胁迫的策略上具有一定的组织特异性。海胆的管足是一种高度特化的器官,可附着于基底[31],是海胆主要的运动器官和触觉器官,本研究中发现,与对照组相比,不同海水酸化胁迫条件下中间球海胆管足中的PK基因的相对表达量和总PK酶活性均处于极显著降低趋势。值得注意的是,与其他3种组织相比,不同海水酸化胁迫条件下,中间球海胆管足组织中PK基因的相对表达量最低,这与本课题组前期研究海水酸化会对中间球海胆多个组织中LDH造成影响具有一定的相似性[22],由此,笔者推测,中间球海胆为了应对海水酸化的胁迫可能会通过降低运动器官的无氧代谢水平,节省能量消耗,并将其主要能量用于调节体内外酸碱平衡。
肠道是海胆主要的消化器官,是海胆吸收、转化和代谢营养物质的主要场所。本研究结果显示,与对照组相比,中间球海胆肠组织中PK基因的相对表达量随海水pH降低呈先极显著降低(SA1组)后极显著升高的趋势(SA3组),而中间球海胆肠组织中总PK酶活性在不同海水酸化胁迫条件下却呈极显著升高的趋势。研究表明,大西洋鳕Atlantic cod会通过增加肠道中![]() 的分泌速度应对海水酸化[32],因此推测,中间球海胆可能通过上调PK催化的反应速度从而在短时间内为机体提供更多能量,以便加快其肠道内的离子转运速度,调节体内碳酸盐平衡。
的分泌速度应对海水酸化[32],因此推测,中间球海胆可能通过上调PK催化的反应速度从而在短时间内为机体提供更多能量,以便加快其肠道内的离子转运速度,调节体内碳酸盐平衡。
海胆性腺是海胆主要的食用部分[33],本研究中发现,与对照组相比,不同海水酸化胁迫条件下中间球海胆性腺组织中PK的表达量均处于极显著降低趋势,由此推测,海水酸化可能通过降低中间球海胆性腺组织中的能量代谢相关基因的表达,而削弱其用于性腺发育的能量,这一结果与海水酸化导致紫海胆Anthocidaris crassispina[34]、马粪海胆Hemicentrotus pulcherrimus[35]和加州红海胆Strongylocentrotus franciscanus[36]能量代谢水平降低、性腺发育缓慢的结果具有一定的相似之处。而中间球海胆的性腺组织中总PK酶活性随着海水酸化程度的加重呈先极显著升高(SA1组)后逐渐降低的趋势(SA2、SA3组),笔者猜测,当海水酸化程度较低时,中间球海胆可能先通过提高其PK酶的催化效率而补偿海水酸化对其能量产生的影响,以便其性腺能够有足够的能量进行发育,而伴随着海水酸化程度的不断加重和性腺中PK基因表达产物的减少,中间球海胆性腺组织中的总PK酶活性被严重抑制,进而对其性腺的正常发育成熟乃至繁殖造成影响,但就其背后的细胞应激机制及分子响应策略仍需进一步研究和探讨。
海胆体腔液中存在多种非特异性的免疫因子,其与脊椎动物的淋巴液功能相似,可直接抵抗入侵的病原体,是海胆进行免疫防御的重要组织[37]。此外,海胆体腔液也为调节体内外渗透压平衡和气体交换提供了场所。本研究中发现,不同海水酸化胁迫条件下,中间球海胆体腔液中PK基因的相对表达量和总PK酶活性均显著低于对照组,且与其他3种组织相比,体腔液中的PK基因的相对表达及总PK酶活性下降趋势较小。而Collard等[38]研究发现,海水pH的降低会使海胆体腔液的缓冲能力提高,因此,笔者猜测,中间球海胆可能将体内大部分能量转移至体腔液,以提高体腔液的代谢能力和缓冲能力,应对海水酸化胁迫。
[1] 朱圣庚,徐长法,王镜岩,等.生物化学:下册[M].4版.北京:高等教育出版社,2017:49-76.
[2] 邵明川.丙酮酸激酶同工酶研究进展[J].生命的化学(中国生物化学会通讯),1983(3):16-18.
[3] 詹成,时雨,王群.丙酮酸激酶M2型应用于肿瘤诊断与治疗的研究进展[J].中华肿瘤防治杂志,2013,20(13):1043-1046.
[4] Thomson D M P,Krupey J,Freedman S O,et al.The radioimmunoassay of circulating carcinoembryonic antigen of the human digestive system[J].Proceedings of the National Academy of Sciences of the United States of America,1969,64(1):161-167.
[5] 陈芸燕.刺参(Apostichopus japonicus Selenka)对亚硝酸氮胁迫的生理生态学响应及其机制研究[D].青岛:中国海洋大学,2013.
[6] 房子恒.不同盐度对半滑舌鳎幼鱼生长的影响及其生理生态学机制的研究[D].青岛:中国海洋大学,2013.
[7] Caldeira K,Wickett M E.Oceanography:anthropogenic carbon and ocean pH[J].Nature,2003,425(6956):365.
[8] Hervé V,Derr J,Douady S,et al.Multiparametric analyses reveal the pH-dependence of silicon biomineralization in diatoms[J].PLoS One,2012,7(10):e46722.
[9] Gao K,Aruga Y,Asada K,et al.Calcification in the articulated coralline alga Corallina pilulifera,with special reference to the effect of elevated CO2 concentration[J].Marine Biology,1993,117(1):129-132.
[10] Hall-Spencer J M,Rodolfo-Metalpa R,Martin S,et al.Volcanic carbon dioxide vents show ecosystem effects of ocean acidification[J].Nature,2008,454(7200):96-99.
[11] Kurihara H,Kato S,Ishimatsu A.Effects of increased seawater ρCO2 on early development of the oyster Crassostrea gigas[J].Aquatic Biology,2007,1(1):91-98.
[12] Dupont S,Ortega-Martínez O,Thorndyke M.Impact of near-future ocean acidification on echinoderms[J].Ecotoxicology,2010,19(3):449-462.
[13] 胡婉彬,李家祥,段立柱,等.两种海水酸化模式对马粪海胆(Hemicentrotus pulcherrimus)胚胎早期发育的影响[J].中国农业科技导报,2016,18(3):177-183.
[14] 孙景贤,刘敏博,李家祥,等.两种海水酸化模式对中间球海胆早期发育及存活的影响[J].水产科学,2017,36(4):429-435.
[15] Hauton C,Tyrrell T,Williams J.The subtle effects of sea water acidification on the amphipod Gammarus locusta[J].Biogeosciences,2009,6(1):1479-1489.
[16] Lebrato M,Iglesias-Rodríguez D,Feely R A,et al.Global contribution of echinoderms to the marine carbon cycle:CaCO3 budget and benthic compartments[J].Ecological Monographs,2010,80(3):441-467.
[17] Zhang Guofan,Fang Xiaodong,Guo Ximing,et al.The oyster genome reveals stress adaptation and complexity of shell formation[J].Nature,2012,490(7418):49-54.
[18] Maas E W,Law C S,Hall J A,et al.Effect of ocean acidification on bacterial abundance,activity and diversity in the Ross Sea,Antarctica[J].Aquatic Microbial Ecology,2013,70(1):1-15.
[19] Stumpp M,Trübenbach K,Brennecke D,et al.Resource allocation and extracellular acid-base status in the sea urchin Strongylocentrotus droebachiensis in response to CO2 induced seawater acidification[J].Aquatic Toxicology,2012,110-111:194-207.
[20] Zhan Yaoyao,Hu Wanbing,Duan Lizhu,et al.Effects of seawater acidification on the early development of sea urchin Glyptocidaris crenularis[J].Journal of Oceanology and Limnology,2018,36(4):1442-1454.
[21] Zhan Yaoyao,Hu Wanbin,Zhang Weijie,et al.The impact of CO2-driven ocean acidification on early development and calcification in the sea urchin Strongylocentrotus intermedius[J].Marine Pollution Bulletin,2016,112(1-2):291-302.
[22] 崔东遥,任丽媛,邢冬飞,等.中间球海胆乳酸脱氢酶基因克隆及其对海水酸化的响应[J].水产学报,2019,43(6):1423-1437.
[23] Orr J C,Fabry V J,Aumont O,et al.Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms[J].Nature,2005,437(7059):681-686.
[24] 李莹莹,崔东遥,常亚青,等.光棘球海胆(Mesocentrotus nudus)TGF-β基因克隆及其对海水酸化的响应[J].生物技术通报,2019,35(2):116-128.
[25] Mehrbach C,Culberson C H,Hawley J E,et al.Measurement of the apparent dissociation constants of carbonic acid in seawater at atmospheric pressure[J].Limnology and Oceanography,1973,18(6):897-907.
[26] 柳林,张宝警,李莹莹,等.中间球海胆smad2/3基因克隆、组织表达及其脂多糖刺激响应[J].大连海洋大学学报,2019,34(3):345-354.
[27] 李蒙,王金凤,黄骞,等.三疣梭子蟹含硒谷胱甘肽过氧化物酶基因克隆及其表达分析[J].海洋与湖沼,2019,50(1):149-158.
[28] 江东能,彭友幸,奥马尔·法鲁克·穆斯塔法,等.金钱鱼Dmrt4基因的克隆及表达分析[J].广东海洋大学学报,2019,39(1):7-13.
[29] 邓小弓,王堃,张守栋,等.利用转录组数据分析高原鼢鼠和裸鼹鼠基因的趋同进化[J].兽类学报,2014,34(2):129-137.
[30] Lawrence J M,Cao Xuebin,Chang Yaqing,et al.Temperature effect on feed consumption,absorption,and assimilation efficiencies and production of the sea urchin Strongylocentrotus intermedius[J].Journal of Shellfish Research,2009,28(2):389-395.
[31] Santos R,Flammang P.Is the adhesive material secreted by sea urchin tube feet species-specific?[J].Journal of Morphology,2012,273(1):40-48.
[32] Hu M Y,Michael K,Kreiss C M,et al.Temperature modulates the effects of ocean acidification on intestinal ion transport in Atlantic cod,Gadus morhua[J].Frontiers in Physiology,2016,7:198.
[33] 徐华,王云鹏,杨德孟,等.两种海胆性腺营养成分分析及评价[J].营养学报,2018,40(3):307-309.
[34] Wang Guining,Yagi M,Yin Rui,et al.Effects of elevated seawater CO2 on feed intake,oxygen consumption and morphology of Aristotle’s lantern in the sea urchin Anthocidaris crassispina[J].Journal of Marine Science and Technology,2013,21(S1):192-200.
[35] Kurihara H,Yin Rui,Nishihara G N,et al.Effect of ocean acidification on growth,gonad development and physiology of the sea urchin Hemicentrotus pulcherrimus[J].Aquatic Biology,2013,18(3):281-292.
[36] Reuter K E,Lotterhos K E,Crim R N,et al.Elevated pCO2 increases sperm limitation and risk of polyspermy in the red sea urchin Strongylocentrotus franciscanus[J].Global Change Biology,2011,17(7):2512.
[37] 张颖.虾夷马粪海胆体腔液免疫因子及吞噬细胞活性的研究[D].大连:大连海洋大学,2014.
[38] Collard M,Laitat K,Moulin L,et al.Buffer capacity of the coelomic fluid in echinoderms[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2013,166(1):199-206.