许氏平鲉Sebastes schlegelii隶属于硬骨鱼纲Osteichthyes鲉形目Scorpaeniformes平鲉科Sebastidae平鲉属Sebastes,原名黑鲪,俗称黑头、黑寨鱼、黑石鲈等,是一种近海岩礁底栖鱼类。主要分布在中国渤、黄海和东海海域,以及朝鲜半岛东西两岸、日本北海道周边海域和鄂霍次克海南部水域[1]。因其肉质鲜美,现已成为中国北方沿海网箱养殖的重要经济鱼类之一。许氏平鲉为体内受精的卵胎生鱼类。雄性性成熟后,11月份左右与雌鱼交尾,精子贮存在雌鱼体内,待次年4月卵细胞成熟时完成受精。鉴于许氏平鲉卵胎生的繁殖生物学特性,其成熟精子在雌性许氏平鲉体内贮存时间约为5个月[2-3]。因此,了解其精子形态及其生物学特性,可为阐明卵胎生许氏平鲉体内受精过程及探究精子在雌鱼体内贮存位置提供理论基础。
目前,学界已有一些关于卵生鱼类精子超低温冷冻的相关报道,精子经过超低温液氮(-196 ℃)保存,代谢停滞,生命活动静止,能够保证其形态学和内部结构的完整性,在此情况下可保存数年之久,在一定条件下激活,与卵子进行正常受精[4]。目前,该技术在水产养殖及种质资源保护中发挥了重要作用,并主要在卵生经济鱼类中研究与应用较多,包括青、草、鲢、鳙[5]“四大家鱼”,以及兴国红鲤[6]、西伯利亚鲟Acipenser baerii、美洲鲥Alosa sapidissima、暗纹东方鲀Takifugu obscurus[7]、点带石斑鱼Epinephelus malabaricus[8]等。然而超低温冷冻也会对精子的形态结构产生较大损伤,影响精子的激活率和受精能力,如“四大家鱼”精子经冷冻后部分细胞膜受损,激活后受精率大幅下降[5],大黄鱼多数精子的质膜出现膨胀,核膜破裂,染色质松散,线粒体嵴减少,使精子失去受精能力[9]。
许氏平鲉作为体内受精的卵胎生鱼类,雌鱼体内通常会贮存多尾雄鱼精子,以保证物种多样性。这一现象在鱼类育种中对保持优良种质具有较大影响,此外,雌雄鱼性腺成熟不同步,精液超低温冷冻技术将有助于许氏平鲉的人工受精及种质保存。因此,探究超低温冷冻对许氏平鲉精子超微结构的影响,研究其限制激活率和受精率的因素,有利于超低温冷冻技术的改进。本研究中通过扫描电镜和透射电镜观察,对精子变态过程、形态结构进行了详细描述,并配制有效的精液稀释液和保护液,按比例混合后冷冻保存精液,观察冷冻后精子的超微结构,旨在为许氏平鲉繁殖生物学、品种改良及资源增殖等提供理论和技术支撑。
1 材料与方法
1.1 材料
试验用许氏平鲉取自山东蓬莱人工养殖群体,选取3龄性成熟雄鱼9尾,体质量为500~750 g。采样前,将试验鱼暂养在体积为0.5 m3圆柱形塑料桶(直径80 cm,高100 cm)中,暂养期间每天换水两次,停止投喂,连续充气,水温为(18±4)℃,pH 为7.8~8.1,溶氧为(7.5±0.59)mg/L,光照模拟自然光周期14L∶10D。
1.2 方法
1.2.1 精子石蜡组织切片、H.E染色 使用MS-222(200 mg/L)将试验鱼麻醉,解剖取出精巢,使用4%中性多聚甲醛(4% PFA,溶于1×PBS,pH 7.4)浸泡12 h固定。经梯度酒精脱水、二甲苯透明、浸蜡,石蜡包埋,用切片机(LEICA-RM 201,Germany)连续切片,切片厚度为4~5 μm,40~42 ℃温水展片,37 ℃下烘箱烘干。烘干后对切片脱蜡复水,用Lillie-Mayer苏木精-醇溶伊红Y染色(H.E染色),中性树脂封片、晾干,置显微镜(Olympus,Japan)下观察并拍照。
1.2.2 精子采集固定、涂片制作及电镜样品制备
许氏平鲉为体内受精鱼类,即使雄鱼性成熟时精液量也极少(约100 μL/尾),难以通过挤压腹部的方法获得精液。采用解剖法从输精管中获取精液,用牙签蘸取少量精液在载玻片上涂匀后镜检;用碱性PBS(0.01 mol/L,pH 7.8)稀释后再次镜检观察,可观察到激活后的精子形态及运动状态。
取10 μL新鲜精液于1.5 mL离心管中,加入1 mL 1×PBS充分洗涤,离心(300 g,10 min)沉淀精子,弃上清;同样方法再洗涤一次,弃去上清后加入1 mL 4% PFA,固定20 min,将带有精子的固定液上下颠倒混匀,吸取一滴平涂于氨基防脱载玻片上吸附30 s,用蒸馏水冲去多余固定液,使用铁苏木精-0.5% 醇溶伊红(I.H.E)染精核、线粒体鞘、染细胞质和精子尾部。
同样的方法洗涤鲜精,弃上清后,于2.5% 戊二醛(1×PBS,pH 7.4)中混匀,固定24 h,使用0.1 mol/L的磷酸缓冲液和蒸馏水分别冲洗3次,经梯度酒精脱水、醋酸异戊酯置换及在CO2临界点干燥仪中干燥后用扫描电镜(JSM-840)观察并拍照;另取10 μL鲜精,固定于2.5% 戊二醛12 h,用0.1 mol/L的磷酸缓冲液冲洗,1%锇酸固定2 h,再经0.1 mol/L的磷酸缓冲液冲洗两次,梯度酒精脱水、包埋、切片,随后用醋酸铀和柠檬酸铅染色,置于透射电镜(H-7000)下观察并拍照。
1.2.3 精子超低温冷冻 在1 L蒸馏水中加入氯化钠3.775 g、葡萄糖10 g、牛血清白蛋白10 g、土霉素5 g,渗透压300 mOsmol/kg,pH 7.7,配制精液稀释液,将其与冷冻保护液(在精液稀释液中加入10%的二甲基亚砜DMSO)混合,取精液加入混合液中,按1∶20~1∶25(精液与混合液的体积比)混匀,取5 μL精液加入到100 μL混合液中,4 ℃下平衡20 min后置于液氮面上方10 cm,平衡12 min,液氮面平衡6 min,投入液氮(-196 ℃)中冷冻保存。
2 结果与分析
2.1 精子变态过程
精子变态过程的观察见图1、图2。光镜下可见由精细胞向精子变态过程中,精细胞核首先转化为半月形(图1-B),随后转化为月牙状(图1-E),成熟精子精核由弯变直,尾部鞭毛逐渐形成,含有成熟精子的精小囊,即将向小叶腔释放精子(图1-F)。透射电镜下可见正在变态的精子精核呈月牙形,细胞质浓缩,成熟精子精核曲度减少,由月牙形转变为直的长片状(图2-F);精子发生过程中,细胞核的核质高度浓缩,由最初的颗粒状浓缩为粗纤维状,最后形成短粗纤维状的致密结构;部分远端中心粒形成鞭毛的基体,与精子头部植入窝连接并向后形成轴丝,逐渐延伸,形成鞭毛(图2-D)。在鞭毛发生过程中,线粒体首先围绕在细胞核周围,随后向鞭毛基部迁移,最终有规律地排列在鞭毛基部周围。成熟精子细胞质极少,精子头部无顶体,头部几乎全部被精核占据(图2-F)。
2.2 许氏平鲉精子形态及精子超微结构
许氏平鲉精液呈乳白色黏稠膏状半流体,用pH为7.8的弱碱性PBS可有效激活许氏平鲉的精子,稀释后光镜下可观察到精子剧烈运动(图3-A)。精子经H.E染色后,精核呈蓝色,线粒体鞘和鞭毛呈浅粉红色(图3-B);经I.H.E染色后,清晰可见精核呈蓝黑色,线粒体鞘呈深黑色,尾部呈浅黑色(图3-C)。可见,用铁苏木精比常规的铝苏木精具有更强的染色效果。
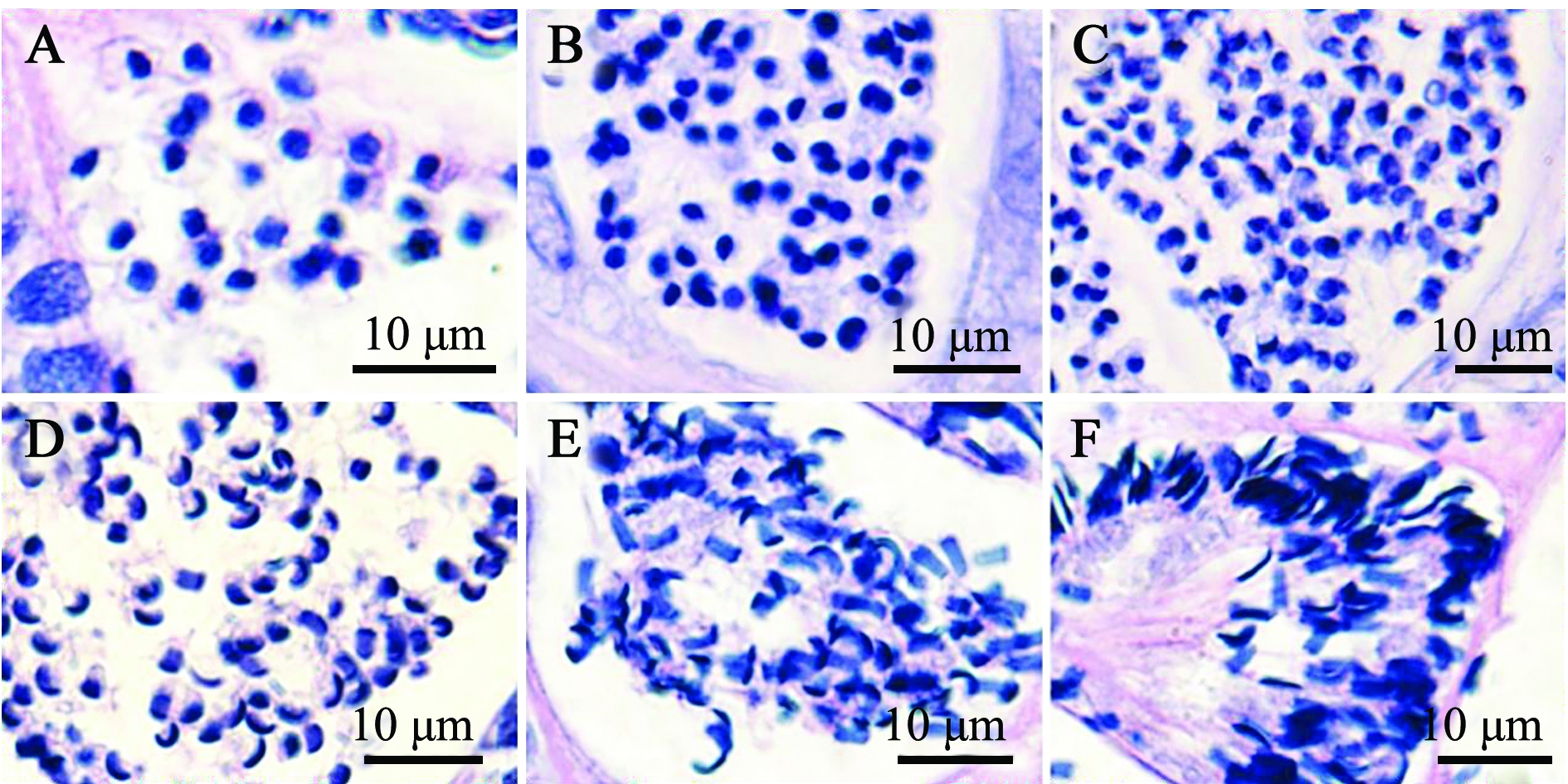
注:A为精细胞;B~E为变态中的精子;F为精子
Note: A, spermatid; B-E, spermatozoa during metamorphosis; F, spermatozoa
图1 许氏平鲉精细胞和变态中的精子(H.E染色)
Fig.1 Spermatid and metamorphosis spermatozoa in black rockfish Sebastes schlegelii(H.E staining)
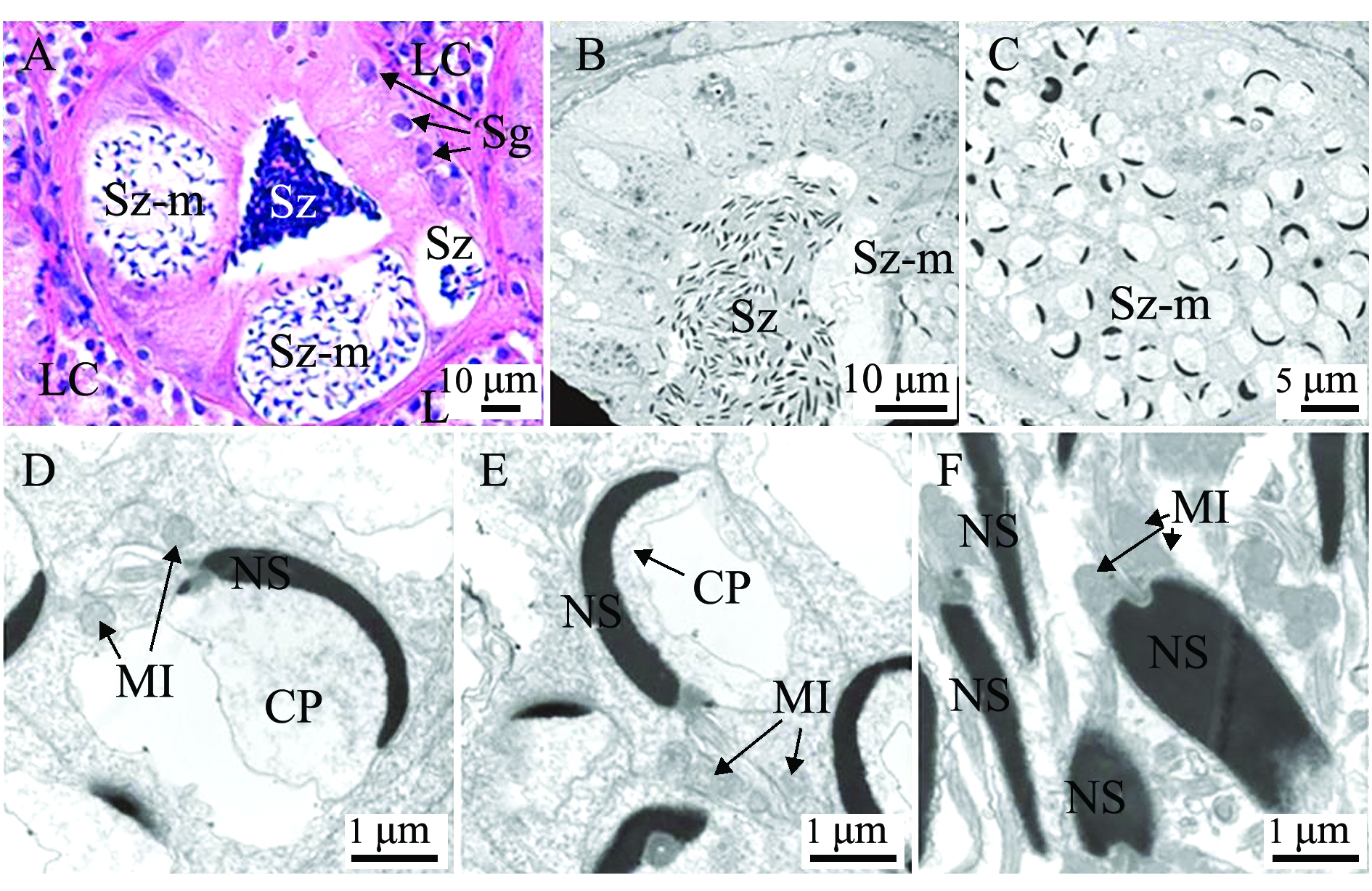
注:A为H.E染色切片;B~F为透射电镜;C为精小囊,内含正在变态的精子;D、E为正在变态的精子头部;F为成熟精子头部。Sz为精子;Sz-m为正在变态的精子;LC为Leydig细胞;MI为线粒体;NS为精核; CP为精细胞质;Sg为精原细胞
Note: A, histological section with H.E staining;B-F, transmission electron microscopy (TEM); C,spermatogenic cyst; D and E, spermatozoa in metamorphosis phase; F, head of mature spermatozoa. Sz, spermatozoa; Sz-m, spermatozoa in metamorphosis phase; LC, Leydig cell; MI,mitochondrion; NS, nucleus of sperm; CP, cytoplasm of spermatid; Sg,spermatogonia
图2 许氏平鲉Ⅴ期初期精巢
Fig.2 Testis with early stage V in black rockfish Sebastes schlegelii
电镜下可观察到精子头部为长片状,正面观为长椭圆形,侧面观为薄片状。精子头部长为(3.93±0.24)μm,尾部长为(23.02±0.57)μm,全长为(28.51±0.91)μm。精子线粒体鞘突出(图3-F),在核的后端可见一明显的植入窝,与尾部基部嵌合且为不对称嵌套形成袖套腔,在袖套腔内分布着12~15个线粒体和一些囊泡化的细胞器,在透射电镜下观察精子核为黑色,染色质致密,鞭毛基部可见基体(中心粒的衍化产物)。精子尾部(鞭毛)横切可见经典的“9+2”结构,即由2条中心轴丝和外围较粗的9条二联体微管构成,且细胞膜包围维管束,并形成左右两个侧鳍(图3-I)。
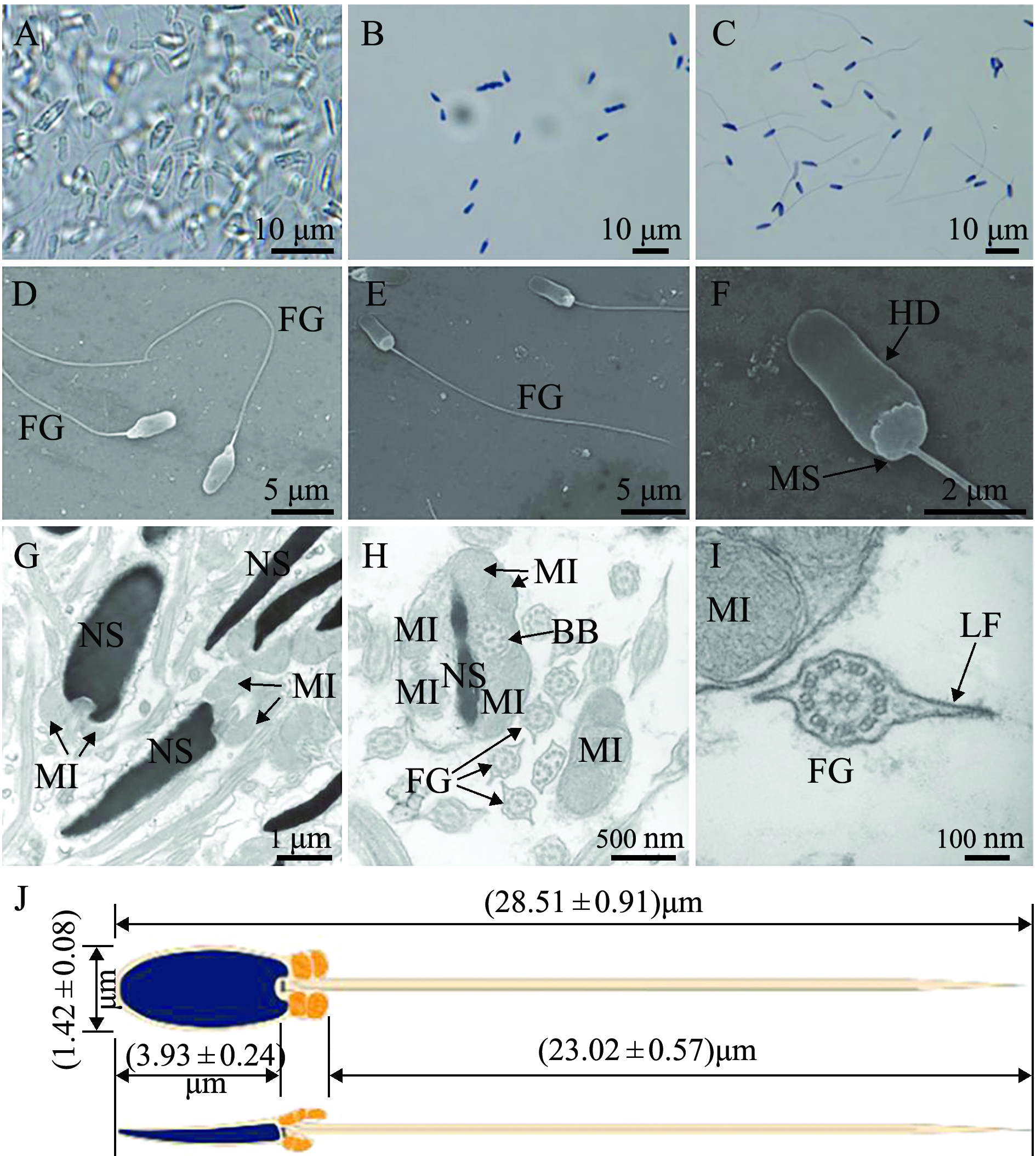
注:A为活体精子;B为精子涂片(H.E染色);C为精子涂片(I.H.E染色);D~F为扫描电镜;G-I为透射电镜。G为精子头部、线粒体鞘;H为精子线粒体鞘截面;I为精子鞭毛横截面;J为许氏平鲉精子模式图。BB为基体;FG为鞭毛;HD为精子头部;MS为线粒体鞘;NS为精核;MI为线粒体;LF为侧鳍
Note: A, living spermatozoa; B, sperm smear (H.E staining); C, sperm smear (I.H.E staining); D-F,scanning electron microscopy (SEM); G and I, transmission electron microscopy (TEM) . G, head and mitochondrial sheath of spermatozoa; H,cross section of mitochondrial sheath; I, cross section of flagellum; J, spermatozoa pattern. BB, basal body; FG, flagellum; HD, head of sperm; MS, mitochondrial sheath;NS, nucleus of sperm; MI, mitochondrion; LF, lateral fin
图3 许氏平鲉精子形态
Fig.3 Morphology of spermatozoa in black rockfish Sebastes schlegelii
2.3 冷冻精子超微结构变化
许氏平鲉精子冷冻后,少部分形态完整,结构正常,但多数出现尾部断裂现象(图4-B),经电镜观察,发现大部分精子细胞膜受损,质膜出现膨胀,不能与细胞核紧密接触,部分精子头部细胞核裸露且核内染色质松散;线粒体鞘劈裂或膨胀,少数线粒体丢失,内膜嵴减少或消失,线粒体呈空泡状,基体中轴丝分布混乱,失去鲜精基体中轴丝清晰可见的“9+2”结构(图4-C、D、E);鞭毛的侧鳍出现弯曲(图4-F),由此推测,多数冷冻精子激活后受精能力减弱或失去受精能力。
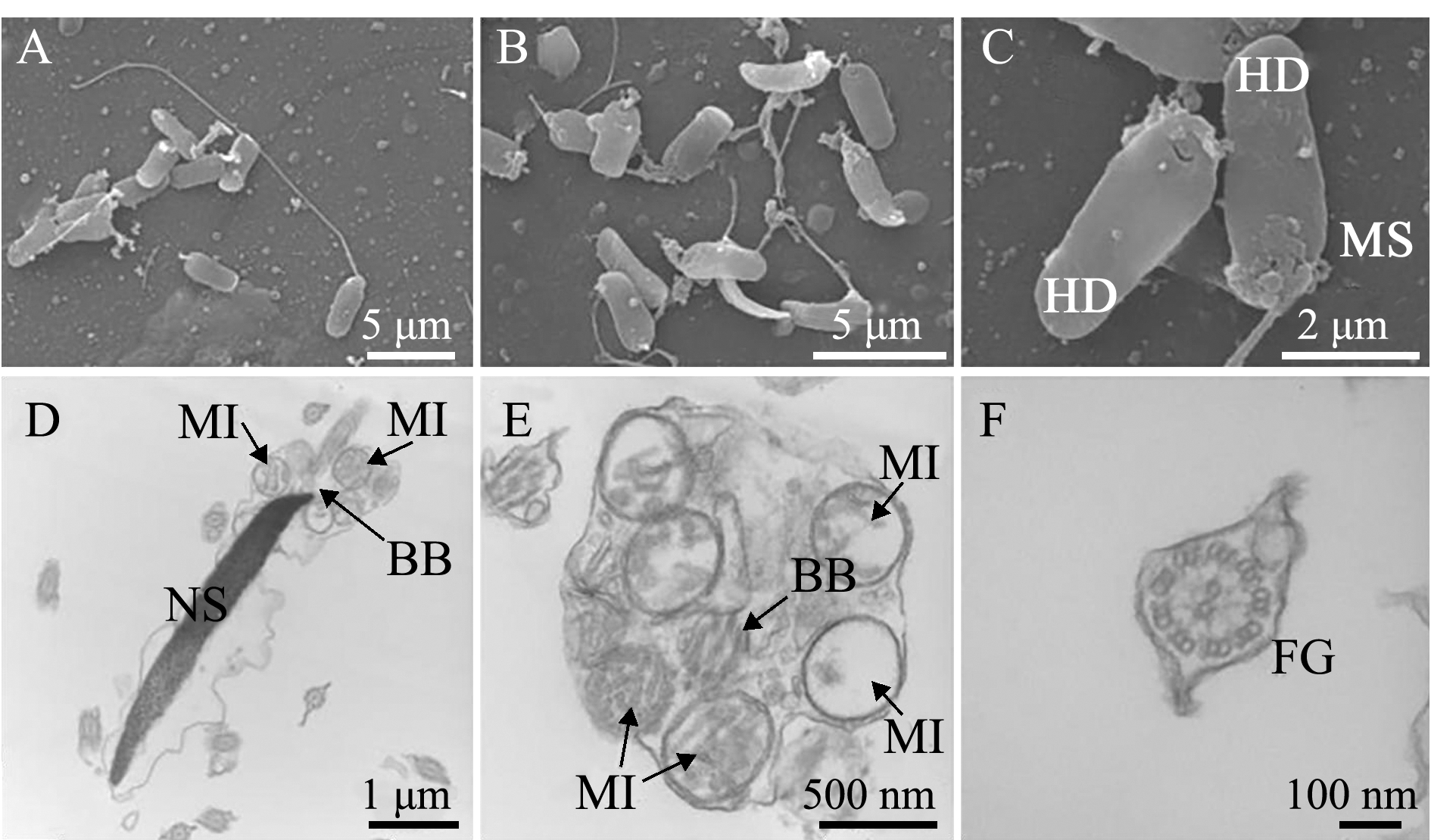
注:A~C为扫描电镜;D~F为透射电镜。HD为精子头部;MS为线粒体鞘;BB为基体;NS为精核;MI为线粒体;FG为鞭毛
Note: A-C, scanning electron microscopy (SEM); D-F, transmission electron microscopy (TEM).HD, head of sperm; MS, mitochondrial sheath; BB, basal body; NS, nucleus of sperm; MI, mitochondrion; FG, flagellum
图4 许氏平鲉冷冻精子形态
Fig.4 Morphology of frozen sperm in black rockfish Sebastes schlegelii
3 讨论
3.1 许氏平鲉鲜精形态结构
精子的超微结构是检验精子质量好坏、揭示精子入卵机制的重要依据。在许氏平鲉精子的超微结构中发现,其头部不具有顶体结构,与其他硬骨鱼类结论一致[10]。这是由于硬骨鱼类的卵细胞具有独特的受精孔,不需要通过顶体反应防止多精入卵。许氏平鲉精子头部呈长片状,线粒体集中在基体周围,形成精子的中段部分,线粒体鞘中含有12~15个线粒体。线粒体为精子尾部的运动提供能量,许氏平鲉作为卵胎生鱼类,精子需进入雌鱼生殖道内约一个月时间才能够受精,其头部细长,线粒体数量远高于卵生硬骨鱼类,这可能是为满足精子在输卵管中运动及需要较长时间贮存所消耗的能量进化而来。卵生硬骨鱼的精子头部通常为球形或接近卵圆型,如香鱼Plecoglossus altivelis和大泷六线鱼Hexagrammos otakii头部呈子弹形或钝顶锥形,含线粒体1~2个[11-12],在黑鲷Sparus macrocephalus中,线粒体鞘内线粒体呈分层分布,共包含6~8个线粒体[13],同为鲉形目的卵生鱼花彩圆鳞鲉Parascorpaena picta、花斑短鳍蓑鲉Dendrochirus zebra、毒鲉Synanceia horrida精子头部均为球形,线粒体数少于10个[14];而卵胎生的孔雀鱼Poecilia reticulata和褐菖鲉Sebastiscus marmoratus的精子头部细长,线粒体多达30~40个[15-16]。另外,许氏平鲉的精子尾部与孔雀鱼相似[15],存在翅膀状的侧鳍结构,而在其他卵生硬骨鱼类如黄颡鱼Pelteobagrus fulvidraco[17]、四川华鳊鱼Sinibrama taeniatus[18]中也存在类似结构,但泥鳅Misgurnus anguillicaudatus[19]、斑点叉尾鮰Ictalurus punctatus[20]的精子尾部未见此结构,该侧鳍的功能还需要进一步探究。
3.2 许氏平鲉冻精超微结构
本试验中配制适宜冷冻剂将精子冻存,冷冻后的精子经电镜观察,虽有部分形态结构正常,但多数结构受损。人类精子冷冻保存结果表明,其顶体的完整率与正常精子相比显著下降且精子头部出现破损,导致精子的受精率降低[21]。小鼠精子冷冻保存后,质膜受损,采用流式细胞仪对其DNA和染色体完整性进行分析,发现DNA断裂现象且体外受精率下降[22]。在硬骨鱼类中,精子冷冻技术在人工授精、遗传育种中具有广泛的应用前景,但冻精同样出现形态结构受损现象,限制激活率和受精率。虹鳟Oncorhynchus mykiss的精子经冷冻保存后,质膜受损,线粒体肿胀,具有完整膜和功能性线粒体的精子仅占18%[23]。帕达绚鲶Ompok pabda的精子经冷冻后受精率和孵化率与鲜精相比出现显著下降[24]。在鲤科鱼类中,陈松林等[5]报道,冷冻精子受精率不足70%,且与冷冻前鲜精活性息息相关,冷冻处理使精子细胞膜大幅受损,冻精的数量为鲜精数量的10倍以上才能达到一致的受精效果。精子结构的损伤可能是由于在持续降温过程中形成细小冰晶或冷冻剂的渗透压所致。许氏平鲉作为卵胎生鱼类,精子在雌鱼体内贮存时间长,激活后需要更多的能量维持精子运动,因此,结构的完整及能量的提供对雌鱼成功受精尤为重要,在未来应用中,需加大冻精数量以保证受精效果。此外,本试验中采用三步冷冻法保存许氏平鲉精子,可能导致形成较多的冰晶并对精子结构造成损伤,Flores等[25]提出,与温度持续降低冷冻方法相比,精子活力在快速冷冻下大幅度下降,因此,本试验中若采用程序化降温法或优化冷冻精液配方等都可能会提高精子活力。
[1] 陈大刚,叶振江,段钰,等.许氏平鲉繁殖群体的生物学及其苗种培育的初步研究[J].海洋学报,1994,16(3):94-101.
[2] 杨艳平,温海深,何峰,等.许氏平鲉精巢的形态结构与发育组织学[J].大连海洋大学学报,2010,25(5):391-396.
[3] 史丹,温海深,杨艳平.许氏平鲉卵巢发育的周年变化研究[J].中国海洋大学学报,2011,41(9):25-30.
[4] 陈健,杨壮志,李良玉,等.鱼类精液保存技术研究进展与前景展望[J].渔业致富指南,2018(8):22-24.
[5] 陈松林,刘宪亭,鲁大椿,等.鲢、鲤、团头鲂和草鱼精液冷冻保存的研究[J].动物学报,1992,38(4):413-424.
[6] 丁淑燕,严维辉,郝忱,等.兴国红鲤精液超低温冷冻保存及效果分析[J].江苏农业科学,2016,44(2):277-279.
[7] 王明华,钟立强,陈友明,等.3种长江珍稀鱼类精子超低温冷冻保存的初步研究[J].中国农学通报,2015,31(5):55-58.
[8] 王小刚,骆剑,尹绍武,等.点带石斑鱼精子超低温冷冻保存研究[J].海洋科学,2014,38(9):13-19.
[9] 林丹军,尤永隆,陈炳英.大黄鱼精子冷冻复苏后活力和超微结构的变化[J].福建师范大学学报:自然科学版,2006,22(3):71-76.
[10] Abascal F J,Medina A,Megina C,et al.Ultrastructure of Thunnus thynnus and Euthynnus allettevatus spermatozoa[J].Journal of Fish Biology,2002,60(1):147-153.
[11] 郑学斌,张清科,乐韵,等.香鱼(Plecoglossus altivelis)精子的超微结构及其与鲤形目及鲑形目其他鱼类精子结构的比较研究[J].海洋与湖沼,2018,49(4):866-872.
[12] 李莉,胡发文,王雪,等.大泷六线鱼精子的超微结构观察[J].水产科技情报,2016,43(6):287-290,297.
[13] 刘雪珠,石戈,王日昕.黑鲷精子发生过程中的超微结构变化[J].海洋科学,2005,29(10):48-53.
[14] Pavlov D A,Emel’Yanova N G.Comparative analysis of spermatozoa morphology in three fish species from the suborder Scorpaenoidei[J].Journal of Ichthyology,2018,58(2):226-238.
[15] 郭明申,刘龙,穆淑梅,等.孔雀鱼精子发生的显微与超微结构[J].河北大学学报:自然科学版,2006,26(6):653-658.
[16] 林丹军,尤永隆.褐菖鲉精细胞晚期的变化及精子结构研究[J].动物学研究,1998,19(5):359-366.
[17] 刘文彬,张轩杰.黄颡鱼精巢发育和周年变化及精子的发生与形成[J].湖南师范大学自然科学学报,2004,27(1):66-70.
[18] 尹敏,解崇友,金丽,等.四川华鳊精子发生显微及超微结构观察[J].淡水渔业,2019,49(2):27-32.
[19] 胡雨,高胜涛,刘亚秋,等.泥鳅精子和卵子结构及受精过程的细胞学观察[J].水生生物学报,2016,40(5):942-950.
[20] Poirier G R,Nicholson N.Fine structure of the testicular spermatozoa from the channel catfish,Ictalurus punctatus[J].Journal of Ultrastructure Research,1982,80(1):104-110.
[21] Mahadevan M M,Trounson A O.Relationship of fine structure of sperm head to fertility of frozen human semen[J].Fertility and Sterility,1984,41(2):287-293.
[22] Yildiz C,Ottaviani P,Law N,et al.Effects of cryopreservation on sperm quality,nuclear DNA integrity,in vitro fertilization,and in vitro embryo development in the mouse[J].Reproduction,2007,133(3):585-595.
[23] De Baulny B O,Le Vern Y,Kerboeuf D,et al.Flow cytometric evaluation of mitochondrial activity and membrane integrity in fresh and cryopreserved rainbow trout (Oncorhynchus mykiss) spermatozoa[J].Cryobiology,1997,34(2):141-149.
[24] SarderM R I,Saha S K,Sarder M F M.Cryopreservation of sperm of an indigenous endangered fish,pabda catfish Ompok pabda[J].North American Journal of Aquaculture,2013,75(1):114-123.
[25] Flores E,Taberner E,Rivera M M,et al.Effects of freezing/thawing on motile sperm subpopulations of boar and donkey ejaculates[J].Theriogenology,2008,70(6):936-945.