双齿围沙蚕Perinereis aibuhitensis隶属于环节动物门Annelids多毛纲Polychaete游走目Erranlia沙蚕科Nereidae围沙蚕属Perinereis[1],分布于中国、菲律宾、印度尼西亚、印度沿岸[2],生活在潮间带的泥滩、泥沙滩和沙滩中,自然资源量依次为泥滩(34 g/m2)>泥沙滩(15.4 g/m2)>沙滩(2.8 g/m2)[3]。
双齿围沙蚕具有较高的营养价值和药用价值。粗蛋白质含量占干质量的60%以上[4],富含人体必需氨基酸、呈味氨基酸(Asp、Glu、Ala)和多种不饱和脂肪酸(包括人体必需的多不饱和脂肪酸EPA、DHA),还含有纤溶酶、纤维酶原激活物、胶原酶等物质,能有效降低血脂、消除血栓,因此,沙蚕具有预防和治疗脑血栓、心肌梗死等疾病的功效[5]。双齿围沙蚕中呈味氨基酸含量占氨基酸总量的48.34%[6] ,鲜味强烈,是优质天然饵料,也常作为水产养殖业配合饲料的成分。
由于人类的过度利用和沿海的污染,双齿围沙蚕的自然资源量逐年下降[7],而对双齿围沙蚕的需求量持续增长,因此,要加强对双齿围沙蚕研究,促进其人工养殖业的发展,提高其产量,为人类提供更多优质的食物、药物,以及为水产养殖业提供饵料或配合饲料的原料。
目前,国内沿海已经发展起沙蚕人工养殖业[8-15],且有关双齿围沙蚕的生活史、早期胚胎发育、胚后发育、配子发生、异沙蚕体形态的研究已有许多报道[16-18],但很多研究不够深入,而且彼此间有些数据相差较大,因此,加深对双齿围沙蚕生活史的研究十分必要。本研究中,通过人工培育双齿围沙蚕,观察其胚胎、幼虫发育全过程及成体变态特征,旨在为其养殖业发展提供基础数据。
1 材料与方法
1.1 材料
试验用成体双齿围沙蚕取自湛江腾飞实业有限公司沙蚕养殖基地,用于成体变态过程观察和人工授精培育。
1.2 方法
1.2.1 成体变态过程形态特征观察 在养殖基地现场每日对双齿围沙蚕成体进行观察,比较变态过程中虫体形态特征的变化,由于其眼部和疣足结构太小,需要解剖分离出来,并在Nikon e100双目显微镜下观察,对虫体的形态特征用数码相机拍照记录。
在观察过程中,由于虫体的运动会对观察造成影响,需要对虫体进行麻醉。把虫体浸泡于30%的酒精中5 min,使虫体失去活动能力。麻醉前后形态不会发生变化,不影响观察。在约10 min后虫体会逐渐恢复活动能力,需要再次麻醉。
1.2.2 成体变态过程配子发生观察 在虫体变态过程中,每日取变态较快的虫体剪开体壁,取体腔液于显微镜下观察配子的形态,用数码相机拍照记录。
1.2.3 人工授精 将变态后的雌雄亲本带回广东海洋大学甲壳类遗传育种实验室进行繁殖。采用湿法人工授精,在直径为40 cm的塑料圆盆中,盛一半消毒海水。选取10条活力较强的雌性异沙蚕体(含青色卵液)和6条活力较强的雄性异沙蚕体(含乳白色精液),剪开雌虫体壁,把卵挤到圆盆中,同样的方法把精子挤到圆盆中,轻轻搅拌5 min,静置20 min后收集受精卵,转移到直径为1 m的圆盆中加氧培养。
1.2.4 胚胎发育观察 用吸管吸取沙蚕胚胎,滴在载玻片上,用吸水纸吸去多余的水分,固定于显微镜载物台上,于显微镜下观察,并用数码相机拍照记录胚胎发育过程。
1.2.5 担轮幼虫、疣足幼虫、稚沙蚕观察 取幼虫于显微镜下观察,用数码相机拍照记录幼虫发育的过程和典型的形态特征,由于幼虫活动能力较强,因此,需要用30%酒精对其进行麻醉。
1.2.6 胚胎及幼体大小的测量 使用显微镜目微尺和台微尺测量胚胎及幼体的形态结构大小。
2 结果与分析
2.1 双齿围沙蚕成体的形态结构及其在变态过程中的变化
2.1.1 变态前成体沙蚕的形态特征 双齿围沙蚕成体在变态前体型细长,呈长圆柱状,体壁柔软,前端略粗,后端细,背腹略扁(图1-A)。体长平均为17 cm,体宽平均为0.5 cm,体质量平均为2.4 g。在其背部有一条明显的血管,红色的血液在血管内流动。体色分淡红和深绿色两种,变态前的体色与性别无关,变态后体腔内充满灰绿色的卵或乳白色的精液,使得体色略有改变。身体分节明显,呈同律分节,体节数目不恒定,生长发育良好的沙蚕约160个体节。头部由口前叶和围口节构成,口前叶位于围口节背部前端,在口前叶背部有两对深红色晶体状的眼,呈前后排列,前端有一对较细的口前叶触手,在触手两侧有一对较粗的触须。围口节包围着口,捕食时咽部能翻出形成吻,吻分两节,其外表面有许多细小的几丁质小齿,吻的前端第一节内有一对几丁质大颚,大颚内侧呈锯齿状。在围口节背部、口前叶两侧各有4条细长的围口节触手。
除头部围口节和尾节外,其余体节形态相似,每一体节两侧长有一对疣足。疣足是体壁向外延伸形成的叶状结构,疣足从背腹方向分开呈刺状,共6瓣,背腹各3瓣,靠近背腹两侧的一瓣较小,分别称为背须、腹须,背部和腹部其余2瓣称为背叶、腹叶,背叶、腹叶上各有一束刚毛(图1-F)。前段体节较宽大,后段体节略小。尾节无疣足,有一对较长的肛须。此时双齿围沙蚕营底栖生活。
2.1.2 变态过程中沙蚕形态结构的改变 沙蚕开始变态的明显特征是腹部由半透明转为灰白色(图1-D)。疣足开始变薄且透光性更好,并且有更加丰富的毛细血管,在显微镜下疣足呈现淡红色(图1-G)。此时的沙蚕常见有前半段身躯离开底面,在水中自发摆动的现象。沙蚕变态完全后,形态特征发生明显的变化,整体缩短为原来的1/2~1/3(图1-A),但体节数目保持不变,躯体变得更加扁平。前26体节变化不大,仍然具有较强的爬行能力,称为匍匐部,本试验中的50条异沙蚕体中未观察到匍匐部体节数目在个体间的差异。之后的体节与前26体节大不相同,体节缩短,疣足形态发生明显变化(图1-I),由原本刺状变薄变宽,背叶末端扩展为扇形,新生刚毛长在扇面内起支持作用,形态与鱼鳍相似,称为游泳部。疣足上的刚毛在变态过程中经历了断裂重塑的过程。变态前的刚毛末端节主要为镰刀形,刀刃侧为锯齿状,而变态过程中刚毛的末端节断开,重新形成桨状薄片。
刚毛在变态前后数目没有发生变化,变态前后平均数目均为32根。体腔内消化道消失,充满生殖细胞,疣足内和口前叶内也包含有生殖细胞。口前叶触手、触须退化,4个眼变大,50条双齿围沙蚕变态前其眼直径最小为185 μm,最大为380 μm,平均为287 μm(图1-J),50条沙蚕变态后眼的直径最小为456 μm,最大为635 μm,平均为505 μm(图1-L),眼睛增大非常明显。采用SPSS 22.0独立样本t检验,雌雄眼睛直径无统计学上的差异(P=0.838>0.05)。双齿围沙蚕的变态周期从腹部变为灰白、疣足充血开始,到体长明显缩短、能够游泳结束,最短7日,整个群体从开始出现变态到全部变态需要3周左右。

注:A,变态过程的比较(左1为变态前,左2为变态中,左3为雄性异沙蚕体,左4为雌性异沙蚕体);B,异沙蚕体(左雄右雌); C, 变态前的躯体局部(左背右腹,后同);D, 变态中的躯体局部;E,异沙蚕体的躯体局部;F, 变态前的疣足;G, 变态中的疣足;H,异沙蚕体的匍匐足;I,异沙蚕体的游泳足;J, 变态前的眼;K, 变态中的眼;L,异沙蚕体的眼
Note:A,process of metamorphosis in clam worm (left 1, before metamorphosis,left 2, metamorphosing, left 3, male heteronereis, and left 4, female heteronereis); B,heteronereis(male in the left, and female in the right); C,partial body of clam worm before metamorphosis(dosal in the left,and ventral in the right,et sequentia); D,partial body of metamorphosing clam worm; E,partial body of heteronereis; F,parapodium of clam worm before metamorphosis; G,parapodium of metamorphosing in clam worm; H,creeping parapodium of heteronereis; I,swimming parapodium of heteronereis; J,eyes of clam worm before metamorphosis; K,eyes of metamorphosing clam worm; L,eyes of heteronereis
图1 双齿围沙蚕成体的形态结构及其在变态过程中的变化
Fig.1 Morphological structure and changes of adult clam worm Perinereis aibuhitensis during metamorphosis
2.2 卵的生长成熟
双齿围沙蚕通过变态达到性成熟,卵的发生早于变态,卵的成熟贯穿于变态的过程,变态完成后,卵也发育为可受精的成熟期初级卵母细胞。卵母细胞和卵巢的分期参考范广钻等[19]、杨威等[20]和杨大佐等[21]的分期方法。
2.2.1 第Ⅰ时相:卵原细胞期 第Ⅰ时相的卵主要存在于双齿围沙蚕变态前,此时卵处于卵原细胞时期,卵原细胞在体腔内成团存在,其内的卵原细胞形状为不规则多边形或近似圆形,单个卵原细胞直径为8~15 μm,此时的卵原细胞较透明,几乎不含油球和卵黄物质(图2-A)。3个到37个卵原细胞同许多不定形、体积较小的间质细胞共同构成沙蚕球状分散型卵巢,间质细胞较不透明,内含营养物质丰富。几乎每一体节的体腔中都分布有这种球状卵巢。球状卵巢中卵原细胞通过有丝分裂扩大卵原细胞数目,同时卵巢也相应变大。增殖期卵巢增大到125~150 μm后便不再增长,缢裂出一个直径约35 μm内含3~4个卵原细胞的小卵巢。体腔内的卵以卵原细胞为主的卵巢为Ⅰ期卵巢。
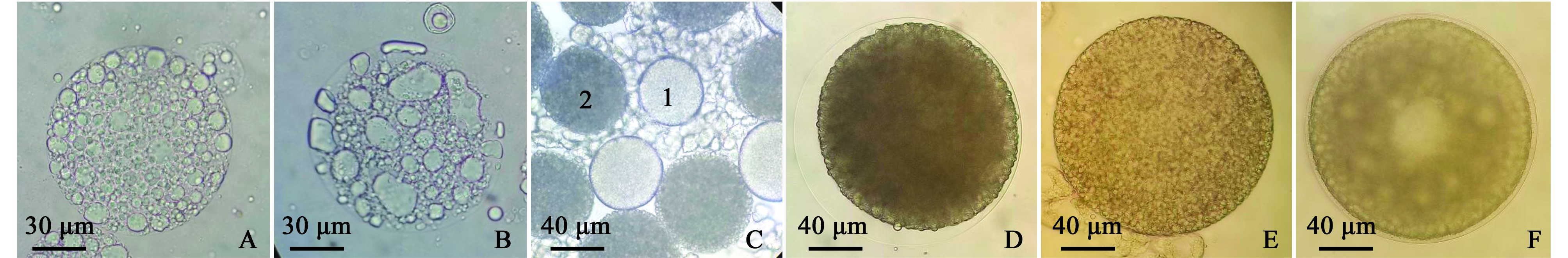
注:A,卵原细胞; B,小生长期初级卵母细胞; C,1为卵黄形成前期初级卵母细胞,2为卵黄形成中期初级卵母细胞; D,卵黄形成后期初级卵母细胞; E,胶膜形成前期初级卵母细胞; F,胶膜形成后期的初级卵母细胞
Note:A,oogonia; B,Niche long-term primary oocyte; C,1 pro-vitellogenesis primary oocyte; 2 mid-vitellogenesis primary oocyte; D,post-vitellogenesis primary oocyte; E,precolloidal membrane primary oocyte; F,postcolloidal menbrance primary oocyte
图2 双齿围沙蚕卵的生长成熟
Fig.2 Growth and maturation of eggs in clam worm Perinereis aibuhitensis
2.2.2 第Ⅱ时相:小生长期 第Ⅱ时相的卵主要存在于变态前和双齿围沙蚕开始变态时(腹部由半透明变为灰白色),原有的卵原细胞停止增殖,体积增大,转变为初级卵母细胞。生长期的初级卵母细胞直径为25~38 μm,形状为多边形或近似球形,较为透明,细胞内不含卵黄颗粒和油球(图2-B)。体腔内的卵以小生长期初级卵母细胞为主的卵巢为Ⅱ期卵巢。
2.2.3 第Ⅲ时相:大生长期 双齿围沙蚕体长逐步缩短,体内的消化道等结构开始溶解,此时的卵主要处于第Ⅲ时相,为大生长期的初级卵母细胞,由原有的小生长期初级卵母细胞开始积累卵黄而使体积显著变大而来。此时期又可细分为卵黄形成前期(Ⅲ1)、卵黄形成中期(Ⅲ2)和卵黄形成后期(Ⅲ3)。Ⅲ1的卵母细胞直径为40~70 μm,卵黄含量较低,透光性相对较好(图2-C-1);Ⅲ2的卵母细胞直径为70~120 μm,卵黄含量中等,透光性中等(图2-C-2);Ⅲ3的卵母细胞直径为120~230 μm,透光性较差,卵黄含量高(图2-D)。卵黄形成前期和中期仍然处于间质细胞的紧密包围中,卵黄形成后期的卵母细胞周围的间质细胞相对较少。体腔内的卵以大生长期初级卵母细胞为主的卵巢为Ⅲ期卵巢。
2.2.4 第Ⅳ时相:成熟期初级卵母细胞 双齿围沙蚕完成变态,体腔内已经没有球状卵巢的存在,此时存在的是第Ⅳ时相的成熟初级卵母细胞。第Ⅳ时相的成熟初级卵母细胞又可细分为胶膜形成前期(Ⅳ1)和胶膜形成后期(Ⅳ2),Ⅳ1初级卵母细胞已经完成卵黄等营养物质的积累,细胞体积不再明显增大,直径保持在180~230 μm之间(图2-E);Ⅳ2初级卵母细胞质膜外表面开始形成一层胶膜,在细胞核与细胞膜之间的皮层区域,存在许多黄绿色的油球(图2-F)。体腔内的卵以成熟期初级卵母细胞为主的卵巢为Ⅳ期卵巢。
2.2.5 卵的排出和受精后卵的发育 初级卵母细胞在沙蚕体腔内成熟后,伴随着沙蚕群浮和婚舞的行为排出体外。卵液为灰绿色,单个卵肉眼可见,为半透明或淡蓝色球形小颗粒,在显微镜下,卵为球形,直径为180~230 μm,内部充满淡黄色的卵黄,看不见细胞核,在卵中心到卵质膜之间的皮层区域,富含绿色的油球,高倍镜下还可以观察到卵外有一层薄的胶膜。卵在海水中自然下沉,为沉性卵,具有黏性,可黏附在底质中。卵受精刺激后才开始减数分裂,减数第一次分裂产生次级卵母细胞和一个约10 μm的第一极体,次级卵母细胞减数第二次分裂为卵细胞和第二极体,第一极体分裂产生第三极体。排空的卵巢为Ⅴ期卵巢。
上述卵的发育阶段与沙蚕的变态时期并非严格一致,会受环境和营养条件的影响。部分个体卵的成熟较早,在变态开始时已经完全成熟,可在一周左右完成变态周期。
2.3 胚胎发育
发育条件:温度为27.8~32.5 ℃,盐度为29.0,pH为7.57。
受精卵:双齿围沙蚕成熟的卵在人工授精后,发生一系列的反应。卵膜外表面的胶膜逐步向外扩张,形成类似细菌的荚膜状结构,此为受精膜,颜色接近透明,直径接近1.5 mm,其上可以观察到很多被黏着的精子,精子被黏着后只能在原位置颤动,无法再接近卵(图3-B)。受精后,卵细胞膜下的皮层细胞质发生运动,其运动方向不明显,顺着一定方向运动一定幅度后,又会换一个方向或沿着原来的反方向运动,运动时间持续到第一极体出现之前,运动使卵呈现富含油球的植物极和不含油球的动物极。人工授精43 min后,初级卵母细胞完成第一次减数分裂,产生一个很小的第一极体和次级卵母细胞(图3-C),第一极体直径约10 μm。人工授精1 h 8 min后,完成第二次减数分裂,次级卵母细胞产生一个第二级体和卵细胞,第一极体分裂产生第三极体(图3-D)。
卵裂期:双齿围沙蚕卵裂方式为螺旋式卵裂,纬裂(分裂线与动物极、植物极分界线平行)、经裂和左旋(从动物极方向观察为逆时针)、右旋相互交替,平均50 min卵裂一次。第一次卵裂为纬裂,形成大小不等的2个卵裂球(图3-E);第二次卵裂为经裂,呈约45°倾斜左旋分裂形成4个细胞(图3-F);第三次卵裂右旋形成8个细胞(图3-G),植物极细胞出现较大的油球;16细胞期大油球更加明显(图3-H);32细胞期动物极细胞更加小,细胞之间的界限也不易辨别(图3-I)。
囊胚期:人工授精5 h 6 min后,胚胎在完成第六次卵裂,进入囊胚期。囊胚为实心,含64个细胞,囊胚体积大小与受精卵相当。动物极细胞很小,颜色相对较浅,植物极细胞很大,颜色相对较深,富含卵黄,细胞内有一个大油球(图3-J)。
原肠期:人工授精5 h 24 min后,动物极小细胞开始向下外包植物极大细胞(图3-K),外包为原肠运动开始的标志,随着动物极的外包,最终动物极小细胞把植物极大细胞和中胚层细胞包含在内(图3-L),形成内胚层在内、外胚层在外、中胚层位于内胚层和外胚层之间的三胚层原肠胚,为胚胎的进一步发育做好准备。
2.4 担轮幼虫期
前担轮幼虫期:授精23 h后,胚胎进入前担轮幼虫期,形状也由球形拉长为梨形,前端大、后端小,长为205~253 μm,宽为162~186 μm。此时胚胎前端形成纤毛环,中部和后端也局部形成纤毛,纤毛摆动可以使胚胎在膜内转动(图4-A)。
后担轮幼虫期:胚胎进一步发育,使胚胎进一步长大并拉长,授精30 h后胚胎进入后担轮幼虫期,头部色素环变淡,在头部形成一对眼点。前端形成明显可见的口,口后端形成原始的消化道,消化道是原肠期内胚层发育而来,呈漏斗状,靠近口部分较大,接近胚胎后端较小,肛门尚未形成,内含丰富的卵黄和2~4个大油球,颜色较绿,而胚胎四周则呈淡黄色。在胚胎左右两侧长出三对疣足原基,在原基内部形成数根刚毛,此时幼虫开始挣扎出膜(图4-B)。
2.5 疣足幼虫
3刚节疣足幼虫:授精45 h后幼虫躯体开始分为3个刚节,刚节之间有节间沟。每个刚节有一对疣足,疣足分背腹两叶,背肢和腹肢各有一束刚毛。头部一对眼分裂成两对,前端长出口前触手原基,其上有数根较短的感觉纤毛。幼虫后端长出一对肛须,肛门位于两肛须之间(图4-C)。3刚节幼虫常趴在底部不动,或疣足摆动爬行,伴随着头部左右摇摆。幼虫头部和疣足基部仍有纤毛,使幼虫有时可以依靠纤毛的摆动在水中游动。随着3刚节幼虫的生长,开始长出触须和第一对围口触手原基。3刚节疣足幼虫后期咽部开始长出一对较小的大颚(图4-D),消化道油球快消耗完时,幼虫摄食海水中的单细胞藻类,可以观察到其消化道内颗粒样的藻类。3刚节疣足幼虫的疣足基部和头部出现红色斑块。此时幼虫的体长为343~375 μm, 在3刚节疣足幼虫中观察到位于幼虫头部、眼的前方有一对比眼稍大、比眼的颜色略浅的红斑(图5-D)。
4刚节疣足幼虫:随着3刚节疣足幼虫的生长,授精5 d后第三刚节之后开始出现乳突状的第四对疣足原基,授精6 d后进一步发育为第四刚节。咽部大颚变大,长出3个侧齿。此时幼虫体长为380~460 μm(图4-E)。
5刚节疣足幼虫:授精9 d后,幼虫长出第5对疣足,体长达630~750 μm。幼虫长出第二对围口触手原基,第一对围口触手和肛须变长。疣足在背部和腹部也长出两根纤细棒状结构,即背须和腹须,此时幼虫疣足与成虫疣足形态相接近。第一对疣足退化,刚毛数量变少,与其他疣足相比变短,随后变细,背肢变长(图4-F)。此时幼虫常钻进有机碎屑中或细沙下。
6刚节疣足幼虫:授精11 d后,幼虫长出第6对疣足,体长约1 mm。第一对疣足只剩一根较短的刚毛或无刚毛,背肢变得更加细长,末端开始长出感觉纤毛,位置向前移动,接近第一、第二围口触手,开始变为幼虫的第三对围口触手(图4-G)。
7刚节疣足幼虫:授精12 d后,幼虫长出第7对疣足,体长为1.1 mm,第三围口触手完全靠近第一、第二围口触手,刚毛消失,体型变得更为细长(图4-H)。
2.6 稚沙蚕的发育
授精14 d后,幼虫出现第14对疣足原基(图4-I),此时,幼虫开始长出第四对围口触手,同时形成背血管和疣足毛细血管。口前叶与围口节分界明显,咽部大颚形成6个侧齿,消化道可分口、咽、食道、胃、前中肠、直肠和肛门(图5-J、K、L)。从第7刚节起,每一刚节形成一对肾管(图5-H),排泄系统开始形成。此时幼虫形态结构与成体相似,开始进入稚沙蚕阶段,往后的发育主要是体节的增加和个体的长大(图4-J、K、L)。在接近一年的生长后,稚沙蚕长大变态为异沙蚕体,群浮产卵受精后死亡,完成一个生活史周期。
3 讨论
3.1 异沙蚕体的结构与功能
双齿围沙蚕成体变态为异沙蚕体,标志着个体达到性成熟,双齿围沙蚕采取体外受精的方式进行生殖,在泥沙中是不利于精子和卵的结合的,在海水表面进行产卵排精,能使卵充分分散并有利于和精子的结合,达到生殖的最好效果。因此,异沙蚕体的大部分结构都是充分适应游泳生活的,扁平的体型使身体不易下沉,扁平宽大的疣足更有利于划动水流,疣足中更加丰富的毛细血管,能从海水中获得更多的氧气,为剧烈的游泳运动提供充足的氧气。变态前沙蚕营底栖生活,眼睛不发达。异沙蚕体营游泳生活,环境中的光学信息更加复杂多变,因此,需要更发达的视觉器官,异沙蚕体的大眼睛使其能够对海水中复杂多变的光学信息适应。孙瑞平[22]认为,异沙蚕体的形态结构和生理都是为群浮和婚舞做充足的准备。
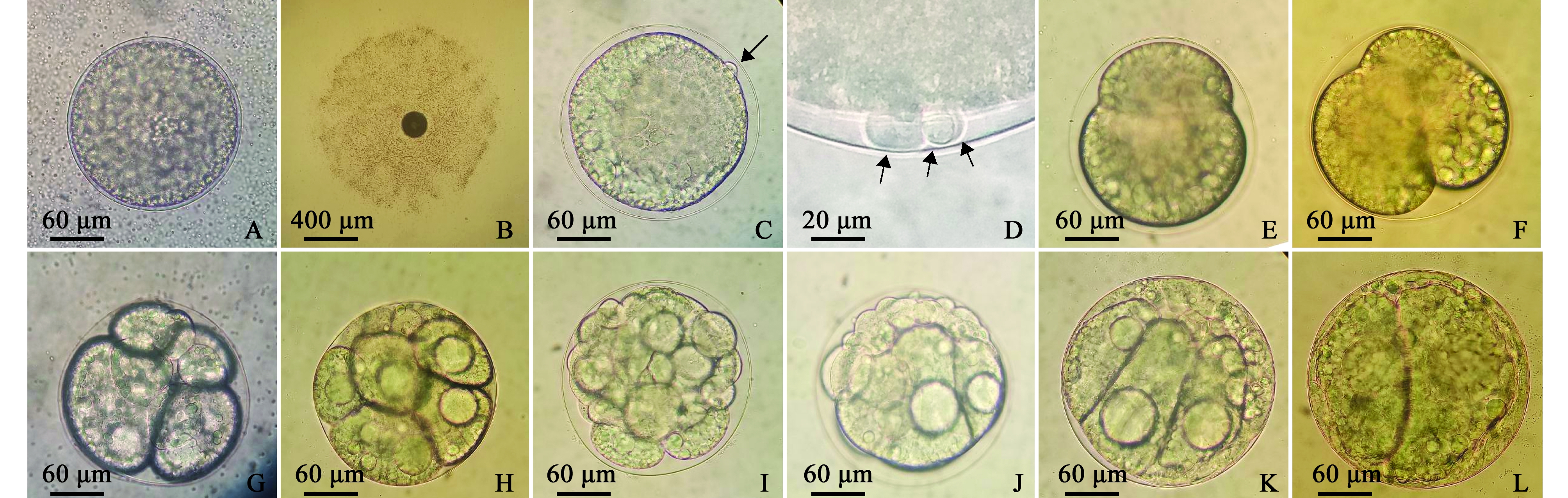
注:A,受精卵;B,受精卵的受精荚膜;C,第一极体;D,三个极体;E,2细胞期;F,4细胞期;G,8细胞期;H,16细胞期;I,32细胞期;J,囊胚期;K,原肠胚早期;L,原肠胚晚期
Note:A,fertilized egg; B,fertilized capsule of fertilized egg; C, first polar body; D,three polar bodies; E, 2 cell phase; F, 4 cell phase; G,8 cell phase; H,16 cell phase; I,32 cell phase; J, blastula; K,early gastrula; L,later gastrula
图3 双齿围沙蚕的胚胎发育
Fig.3 Embryonic development of clam worm Perinereis aibuhitensis

注:A,前担轮幼虫期;B,后担轮幼虫期;C, 3刚节疣足幼虫早期;D, 3刚节疣足幼虫晚期;E、F、G、H、I、J、K、L分别为4、5、6、7、14、18、20、40刚节疣足幼虫
Note:A, protrochophora; B, metatrochophora; C, early 3 setigger juvenile; D, later 3 setiger juvenile;E,F,G,H,I,J,K and L, 4,5,6,7,14,18,20, and 40 setiger juvenile,respectively
图4 双齿围沙蚕幼虫的发育
Fig.4 Larval development of clam worm Perinereis aibuhitensis
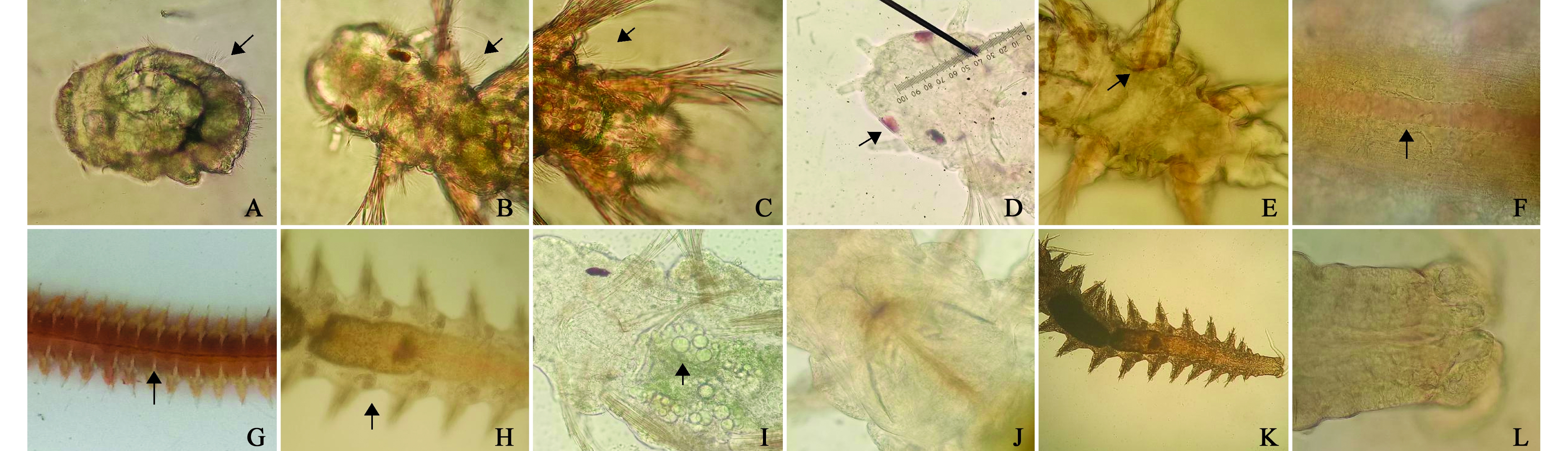
注:A~C,幼虫的纤毛;D,幼虫头部的红斑;E,幼虫躯体中的红斑;F,14刚节幼虫的背血管;G,成体的背血管;H, 14刚节幼虫的肾管;I,幼虫消化道中的油球;J~L,幼虫的消化道
Note:A-C, cilium of larva; D, red fleck in the head of larva; E, red fleck in the body of larva; F, dosal blood vessel of 14 setiger juvenile; G, dosal blood vessel of mature clam worm; H, kidney canals of 14 setiger juvenile; I, oil globules in larval digestive tract; J-L, larval digestive tract
图5 双齿围沙蚕幼虫发育过程中的细节
Fig.5 Details of larval development of clam worm Perinereis aibuhitensis
3.2 双齿围沙蚕成熟卵及成熟的同步性
双齿围沙蚕的成熟卵究竟是初级卵母细胞还是次级卵母细胞,这一问题不同研究者的观点也有所不同。一部分研究者认为,在体内成熟的卵为初级卵母细胞,排出体外再进行成熟分裂[19-20];另一部分研究者则认为,体腔内成熟的卵为次级卵母细胞[21]。本试验中在人工授精后观察到第一极体和第二极体的出现,说明体腔内成熟的卵排出体外后,需要进行减数第一次分裂和减数第二次分裂,因此,本文作者认为体腔生殖期的卵为初级卵母细胞。
双齿围沙蚕卵的成熟同步性是较低的,Ⅱ期卵巢中小生长期初级卵母细胞的大小有明显差异,Ⅲ期卵巢中大生长期初级卵母细胞的体积大小、透明程度、卵黄含量也是存在明显区别。关于双齿围沙蚕卵子成熟的同步性,周一兵等[23]就卵径的差异做过论述,认为卵在发育过程中不同步,本研究中也观察到双齿围沙蚕卵在成熟过程中存在不同步发育的现象,但其他有关双齿围沙蚕卵巢的研究中对卵成熟的同步性鲜有提及。
3.3 双齿围沙蚕生态对策
双齿围沙蚕栖息于水位、温度、盐度等生态因子多变的潮间带,难以有效保护后代,因此,双齿围沙蚕在种群的生态对策上选择了r-对策,充分发挥内禀增长率(在理想条件下,种群的最大增长率)。双齿围沙蚕充分发挥内禀增长率的方式是变态成异沙蚕体和螺旋型卵裂。双齿围沙蚕在变态过程中,体长缩短,体内的消化道等结构分解营养物质,从而能为生殖细胞的形成提供更多的营养物质,孙瑞平[22]也认为,变态溶解体节隔膜和消化道等结构有利于为生殖细胞提供更宽阔的空间和更多的营养物质。而螺旋型卵裂能以较少数量的卵裂球进入原肠运动,选择这种卵裂能以较少的营养物质形成较多的卵,从而形成更多的后代。
3.4 幼虫的发育过程中出现的结构和功能
在5刚节疣足幼虫期之前,幼虫尚未具备适应底栖生活的结构,主要营浮游生活,担轮幼虫期还未形成疣足,是完全营浮游生活的,依靠全身纤毛摆动获得微弱的运动能力,此外,纤毛还具有抵御敌害的作用,纤毛的摆动可以把凑近的纤毛虫赶走,防止纤毛虫的侵害。在头部有一对红斑,能够感受光线变化,幼虫具有趋光性,在幼虫的眼睛发育完善后,这对红斑消失不见。此时幼虫消化道中的油球和卵黄颗粒为幼虫提供营养,油球一般在4刚节幼虫期消耗完消失,有研究指出,油球内存储着丰富的嘌呤核苷酸,为胚胎发育和尚未开口的幼虫提供嘌呤核苷酸,确保发育顺利进行[24-26]。当幼虫形成疣足后,幼虫开始匍匐在底质面上,但仍具有游动的能力,游动时一般不摆动疣足,这说明幼虫的疣足并没有游动能力,主要作用是匍匐爬行和钻沙。口前触手、口前触须和围口触手的出现,增强了幼虫的化感能力,加强了幼虫对底栖生活的适应。到5刚节幼虫期后,幼虫的消化道进一步发育,形成咽部和几丁质大颚,开始捕食小型的底栖动物,此时幼虫不再进行游动,纤毛开始退化,幼虫开始钻进底质中生活。随着幼虫体积的增长,对体内营养物质运输和废物排泄的要求进一步增加,在14刚节期时,幼虫开始形成背、腹主血管和疣足中的毛细血管,同时在第7刚节之后的每个体节中形成一对肾管。
3.5 沙蚕第三极体的发现
本试验中,在第二次减数分裂后观察到了沙蚕第三极体的存在。目前,在沙蚕早期胚胎发育的相关研究中少有关于第三极体的描述,梁伍气等[27]对双齿围沙蚕的第二极体有所描述,曾忠汉等[28]对腺带沙蚕的第二极体有描述,黄凤鹏等[29]对日本刺沙蚕的第一极体有描述。第三极体仅在部分物种的胚胎发育中存在,部分物种在雌性生殖细胞的减数分裂过程中不形成第三极体,如人类,第一次减数分裂结束后第一极体会被排出,紧接着开启程序性凋亡[30],因此,不存在第三极体。
[1] 吴宝铃,孙瑞平,杨德渐.中国近海沙蚕科研究[M].北京:海洋出版社,1981.
[2] 洪秀云,谭克非.双齿围沙蚕的研究——生活史及异沙蚕体形态研究[J].水产学报,1982,6(2):165-171.
[3] 曹启猛,刘清兵,于跃芹,等.山东沿海养殖和野生双齿围沙蚕营养成分比较及饵料安全性评价[J].中国水产科学,2016,23(5):1164-1172.
[4] 曹启猛.养殖双齿围沙蚕营养成分分析及其纤溶酶的分离纯化[D].青岛:青岛科技大学,2016.
[5] 林涛,杨寅,王素敏,等.双齿围沙蚕的营养成分与食用安全[J].应用海洋学学报,2016,35(3):412-417.
[6] 蒋霞敏,林少珍,王春琳.双齿围沙蚕营养成分分析[C]//全国首届海洋生物化学与分子生物学学术会议暨全国第五届海洋生命活性物质与天然生化药物学术研讨会论文集.宜昌:中国生物化学与分子生物学会,2004:250-254.
[7] 宋淑梅,马睿霄,金枫清,等.双齿围沙蚕化学成分及其浸膏抗肿瘤活性的研究[J].河北渔业,2015(11):4-7,41.
[8] 贾盈露,丁国芳,杨最素,等.双齿围沙蚕多肽的制备及其抗肺癌A549细胞活性[J].食品科学,2017,38(12):27-35.
[9] 马睿霄,裴晨红,金枫清,等.双齿围沙蚕浸膏生物活性的研究[J].河北渔业,2015(9):4-6.
[10] 丁国芳,郑媛媛,杨最素,等.一种双齿围沙蚕抗凝血肽及其用途:中国,CN106632602A[P].2017-05-10.
[11] 丁国芳,贾盈露,杨最素,等.一种双齿围沙蚕抗肺癌多肽及其用途:中国,CN106632634A[P].2017-05-10.
[12] 李娓,陈山乔,王旭,等.添加入双齿围沙蚕的免疫增强型肠内营养制剂对严重烫伤病人的恢复作用[C]//中国食品科学技术学会第十三届年会论文集.北京:中国食品科学技术学会,2016:78-79.
[13] 黄猛,陈百尧,龚琪本.不容忽视的海水增养殖资源——沙蚕[J].中国渔业经济,2002(1):44-45.
[14] 洪秀云,谭克非.双齿围沙蚕人工育苗生态环境的研究[J].水产科学,1988(1):12-16.
[15] 程宝平.双齿围沙蚕人工育苗初步研究[J].河北渔业,2001(2):16-17,20.
[16] 郑岩,刘乃更,王金梅,等.双齿围沙蚕室内全人工育苗试验[J].水产科学,2006,25(8):405-407.
[17] 周一兵,杨大佐,管兆成,等.双齿围沙蚕人工育苗和虾池养殖技术研究[J].水产科学,2007,26(3):150-153.
[18] 蒋霞敏,林少珍,王春琳,等.双齿围沙蚕的人工育苗技术研究[J].海洋科学,2006,30(2):16-20.
[19] 范广钻,郑佩玉,钟惠英,等.双齿围沙蚕Perinereis aibuhitensis Grube雌性生殖腺发育的组织学研究[J].浙江水产学院学报,1983(2):105-113,4.
[20] 杨威,陈康,李活,等.以江蓠为栖息环境养殖的双齿围沙蚕性腺发育[J].广东海洋大学学报,2012,32(1):17-23.
[21] 杨大佐,周一兵,寇娜.双齿围沙蚕配子发生的组织学观察[J].大连水产学院学报,2010,25(1):29-33.
[22] 孙瑞平.沙蚕的有性生殖[J].生物学通报,1990(9):21-22.
[23] 周一兵,王宏.大连湾双齿围沙蚕(Perinereis aibuhiteris)卵子生成周期及其与温度和光照时间的关系[J].大连水产学院学报,1995,10(2):9-17.
[24] Hoeger U,Märker C,Geier G.Adenylate storage,metabolism and utilization in coelomic cells of the polychaete Nereis virens (Annelida,polychaeta)[J].Experientia,1996,52(5):481-486.
[25] Hoeger U,Dunn J,Auml M,et al.Adenylate compartmentation and storage in coelomic cells of the polychaete Nereis virens[J].Journal of Experimental Biology,1995,198:2079-2085.
[26] Hoeger U,Rebscher N,Geier G.Metabolite supply in oocytes of Nereis virens:role of nucleosides[J].Hydrobiologia,1999,402:163-174.
[27] 梁伍气,唐龙,吴明灿,等.双齿围沙蚕工厂化育苗及养殖技术研究[J].海洋湖沼通报,2014(2):103-109.
[28] 曾忠汉,杨淼林,王子贤.腺带刺沙蚕的早期发育[J].热带海洋,1995,14(2):83-88.
[29] 黄凤鹏,丘建文,吴宝铃,等.日本刺沙蚕Neanthes japonica (Iznka)大规模育苗的初步研究[J].黄渤海海洋,2001,19(4):76-80.
[30] Choi T,Fukasawa K,Zhou R,et al.The Mos/mitogen-activated protein kinase (MAPK) pathway regulates the size and degradation of the first polar body in maturing mouse oocytes[J].Proceedings of the National Academy of Sciences of the United States of America,1996,93(14):7032-7035.