日本真海带Laminaria japonica隶属于褐藻门褐藻纲海带科,其自然分布于太平洋沿岸,主产于中国辽宁、山东和福建沿海,其营养物质丰富,是中国主要的褐藻资源,平均年产量为1.4×106 t[1]。褐藻聚糖硫酸酯(fucoidan)是褐藻细胞壁外层含有的特殊藻胶,为结构复杂的杂环糖,富含由岩藻糖结合成的含硫酸基团的水溶性细胞间聚糖,其单糖主要组成为岩藻糖、半乳糖、葡萄糖醛酸、阿拉伯糖[2]。该多糖具有抗氧化、降血糖、抗血栓、抗病毒、抗肿瘤、增强机体免疫力等生物活性[3-8],近年来已成为相关领域的研究热点。
高脂血症(俗称高血脂)是血脂代谢障碍所致的疾病,是威胁人类健康的重要因素之一,由血脂过高而诱发的动脉粥样硬化、冠心病等心脑血管疾病已成为全球人类健康“第一杀手”[9]。近年来,褐藻聚糖的降血脂作用受到国内外学者的广泛关注,Huang等[10]研究发现,从海带中提取的褐藻聚糖硫酸酯在高脂血症大鼠体内不仅可以显著降低血清总胆固醇(TC)、血清甘油三酯(TG)、低密度脂蛋白(LDL-C)浓度,还可提高高密度脂蛋白(HDL-C)、脂蛋白酯酶(LPL)、肝脂酶(HL)、卵磷脂胆固醇脂酰基转移酶(LCAT)活性。谌素华等[11]从马尾藻中提取褐藻聚糖硫酸酯发现,高、中、低3个剂量组的降血脂效果均优于脂必妥药品对照的降血脂效果,且以高剂量的降血脂效果最佳,能够极显著地降低TC、LDL-C、TG含量,显著提高HDL-C含量,且效果高于空白组,并能显著降低动脉硬化指数。刘承颖[12]从半叶马尾藻中提取褐藻聚糖硫酸酯,结果表明,不同剂量的半叶马尾藻褐藻聚糖硫酸酯均具有调节血脂的作用,能显著降低血清TC、TG及LDL-C水平,并可提高HDL-C水平。目前,有关褐藻聚糖硫酸酯降血脂作用研究报道较多,但对其调节血脂的机理研究尚较少[13-14]。王慧铭等[15]研究了海带多糖(TLP)对大鼠减肥、降血脂的作用及其机制,结果显示,TLP同时能降低血清甘油三酯和总胆固醇,并提高血清HDL-C水平,其作用与降脂药洛伐他汀相类似,分析其作用机制,可能与增强LCAT、LPL、人胰脂肪酶(PL)等酶活性有关。
本研究中以真海带褐藻聚糖硫酸酯(LF)为原料,比较了不同剂量LF对高脂血症Wistar大鼠的降血脂作用,并结合大鼠肝组织胆固醇代谢、脂质合成与分解等相关基因表达、肝脏组织切片分析阐述了其降血脂机理,旨在为利用日本真海带开发新型降血脂保健食品或药品提供数据资料。
1 材料与方法
1.1 材料
Wistar大鼠150只(体质量150.0 g±10.0 g)购自大连医科大学SPF实验动物中心,动物生产证许可号No:SYXK-2013-0006。所有使用的动物程序均符合中国国家研究院关于实验室动物的护理和使用的指导方针。
试验用日本真海带褐藻聚糖硫酸酯(LF)由国家海藻加工技术研发分中心(大连)提取[16]并提供。丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒均购自南京建成生物工程研究所;HDL-C、LDL-C、TC、TG测定试剂盒均购自北京北化康泰临床试剂有限公司;动物组织总RNA提取试剂盒购自天根生化科技(北京)有限公司;Prime ScriptTMRT reagent、SYBR Premix Ex TaqTMⅡ(Perfect Real Time)购自TaKaRa公司。
1.2 方法
1.2.1 总糖含量和硫酸基含量测定 以标准糖(L-岩藻糖∶D-半乳糖=3∶1)含量(mg)为横坐标,吸光度为纵坐标,绘制标准曲线,采用苯酚-硫酸法[17]测定总糖含量。以硫酸钾为标准采用盐酸水解-硫酸钡重量法测定硫酸根含量[18]。
1.2.2 褐藻聚糖硫酸酯的单糖组成分析 采用高效液相色谱法(HPLC)分析单糖成分。色谱条件:色谱柱为Agela-Venusil XBP-C18液相色谱柱,波长为250 nm,柱温为30 ℃,流速为1 mL/min,进样体积为20 μL;流动相,溶剂A为15%乙腈+50 mmol/L磷酸盐缓冲液(KH2PO4-NaOH,pH 6.0),溶剂B为40%乙腈+50 mmol/L磷酸盐缓冲液(KH2PO4-NaOH,pH 6.0),梯度洗脱时间为100%~92% A/9 min、92%~80% A/26 min、80%~75% A/10 min、75%~100% A/10 min,总运行时间为55 min[19]。
1.2.3 褐藻聚糖硫酸酯的红外光谱分析 将干燥的样品与KBr压制成片,使用Nicolet-Nexus 470傅立叶变换红外光谱仪,扫描4000~400 cm-1波长范围的光谱吸收值。
1.2.4 LF在高脂血症大鼠中的降血脂活性试验 将Wistar大鼠150只置于25 ℃恒温环境中,适应性喂养一周后随机分为5组,每组30只,每日投饲一次、灌胃一次,投喂饲料及灌胃计量见表1,试验周期为12周。每隔4周检测一次指标,每次从每组取10只试验动物,末次给药后,大鼠禁食不禁水24 h后,称重用乙醚麻醉,将已麻醉的大鼠固定,从腹主动脉取血,静置30 min,以3000 r/min离心15 min,取上清液,用试剂盒测定血清TC、TG、LDL-C、HDL-C水平;取肝脏的相同部位约0.3 g,置于4 ℃生理盐水中匀浆,制成10%肝组织匀浆液,用试剂盒测定MDA含量及GSH-Px、SOD活性,剩余肝脏于-80 ℃下保存,采用PT-PCR法检测3-羟基-3-甲基戊二酰辅A(HMG-CoA)、卵磷脂胆固醇酯酰基转移酶(LCAT)、固醇调节元件结合蛋白(SREBP-1c)、硬脂酰CoA去饱和酶(SCD1)、过氧化物酶体增殖物激活型受体α(PPARα)、过氧化物酶体增殖物激活型受体γ(PPARγ)等基因mRNA表达量。
1.2.5 RT-PCR检测目的基因的相对表达量 所使用的各目的基因的mRNA引物序列如表2所示。采用动物组织总RNA提取试剂盒从肝脏组织中提取总RNA(TIANGEN,China),以OD260 nm/OD280 nm值确定RNA的纯度和含量。用甲醛变性琼脂糖凝胶电泳确定RNA的完整性和污染情况。以提取的总RNA为模板进行反转录。反应条件为:37 ℃下反应15 min,85 ℃下反应5 s,4 ℃下保温。以逆转录所得cDNA为模板,RT-PCR反应程序为:95 ℃下预变性30 s;95 ℃下变性5 s,60 ℃下退火30 s,共进行40个循环。RT-PCR延伸反应程序为:95 ℃下退火15 s,60 ℃下循环延伸1 min,95 ℃下退火延伸15 s,60 ℃下中止延伸15 s。
表1 大鼠分组
Tab.1 Grouping of mice
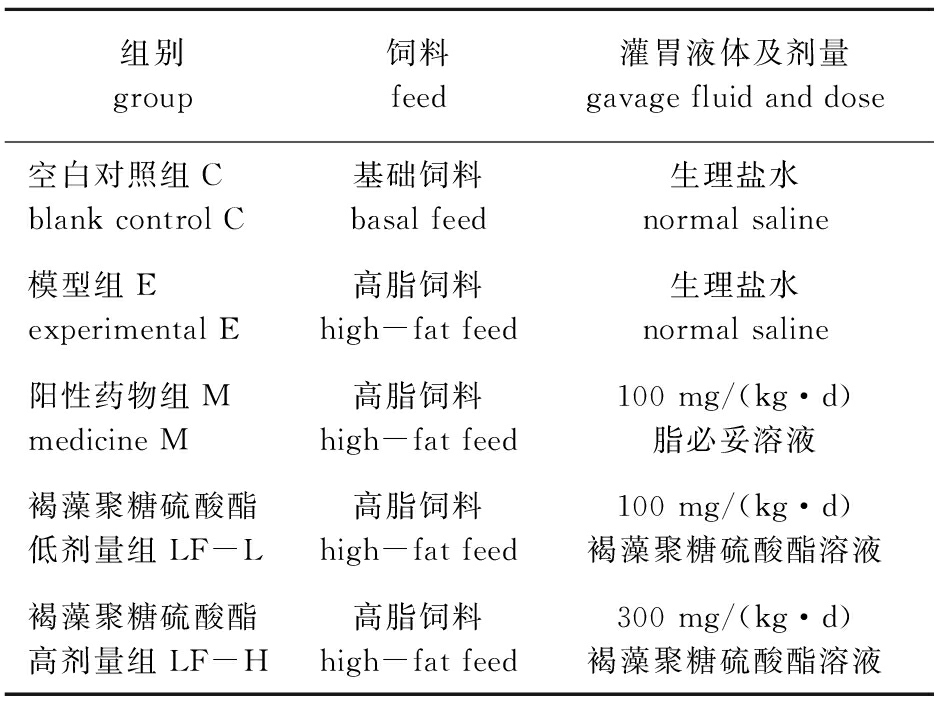
组别group饲料feed灌胃液体及剂量gavage fluid and dose空白对照组Cblank control C基础饲料basal feed生理盐水normal saline模型组Eexperimental E高脂饲料high-fat feed生理盐水normal saline阳性药物组Mmedicine M高脂饲料high-fat feed100 mg/(kg·d)脂必妥溶液褐藻聚糖硫酸酯低剂量组LF-L高脂饲料high-fat feed100 mg/(kg·d)褐藻聚糖硫酸酯溶液褐藻聚糖硫酸酯高剂量组LF-H高脂饲料high-fat feed300 mg/(kg·d)褐藻聚糖硫酸酯溶液
注:基础饲料由大连医科大学SPF实验动物中心提供;高脂饲料组成为87.5%的基础饲料、10%猪大油、2%胆固醇、0.5%猪胆盐
Note: The basic feed is provided by the SPF Laboratory Animal Center of Dalian Medical University;High-fat feed is composed of 87.5% basal feed, 10% pork fat, 2% cholesterol, and 0.5% pig bile salt
表2 目标基因的引物序列
Tab.2 Sequences of PCR primers

基因gene引物序列primer sequence(5'-3')产物长度/bpproduct lengthβ-actionF:GCAGATGTGGATCAGCAAGCR:GTCAAAGAAAGGGTGTA-AAACG111HMG-CoAF:ACGCAACCTCTACATCCGR:GTGCTTTCTCCGTACCCT83LCATF:TTTCCCTACAAAGACCCGR:TGAGATGATCTGTCCCATTC145SREBP-1cF:CGCTACCGTTCCTCTATCAAR:TTCGCAGGGTCAGGTTCTC166SCD1F:GAAAGTGAAGCGAGCAACR:CTCATTTCAGGACGGATG178PPARαF:GAAGCAGATGACCTG-GAAAGTR:AGCCTGGACAGCTCCCTAA144PPARγF:GACCACTCCCATTCCTTTR:GCTCTACTTTGATCGCACT166
1.2.6 肝脏组织微观结构分析 分别于试验的第4、8、12周处死大鼠,从每组取1只大鼠的肝脏左叶组织相同位置,用生理盐水洗净,滤纸吸干,用10%中性甲醛溶液固定肝组织,石蜡包埋切片,苏木精-伊红染色,于光学显微镜下(×400)进行病理学观察。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,采用SPSS 17.0软件进行单因素方差分析,用Duncan法进行多重比较,显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 LF组成分析
经测定,LF中的总糖含量为(75.27±1.88)%,硫酸基含量为(19.58±1.16)%。高效液相色谱法测定的LF单糖组成包括岩藻糖(Fuc)、半乳糖(Gal)、甘露糖(Man)、葡萄糖(Glu)、木糖(Xyl)和葡萄糖醛酸(Glu-UA),含量分别为41.61%、24.90%、7.65%、1.08%、2.53%、8.33%,其中以岩藻糖和半乳糖为主。
2.2 傅立叶变换红外光谱分析
LF的红外光谱分析结果表明:主要吸收峰为3449~3471 cm-1,为O-H伸缩振动,为糖类所共有;2941~2943 cm-1附近为C-H伸缩振动峰,为岩藻糖中甲基的吸收峰;1636~1639 cm-1附近为酰胺基N-H变角震动;1416~1424 cm-1附近为糖类C-H变角振动;在1250.80 cm-1处有较强的吸收峰,说明其含有硫酸基;在836.63 cm-1处的吸收峰,表明其硫酸基在C-4位置(图1)。
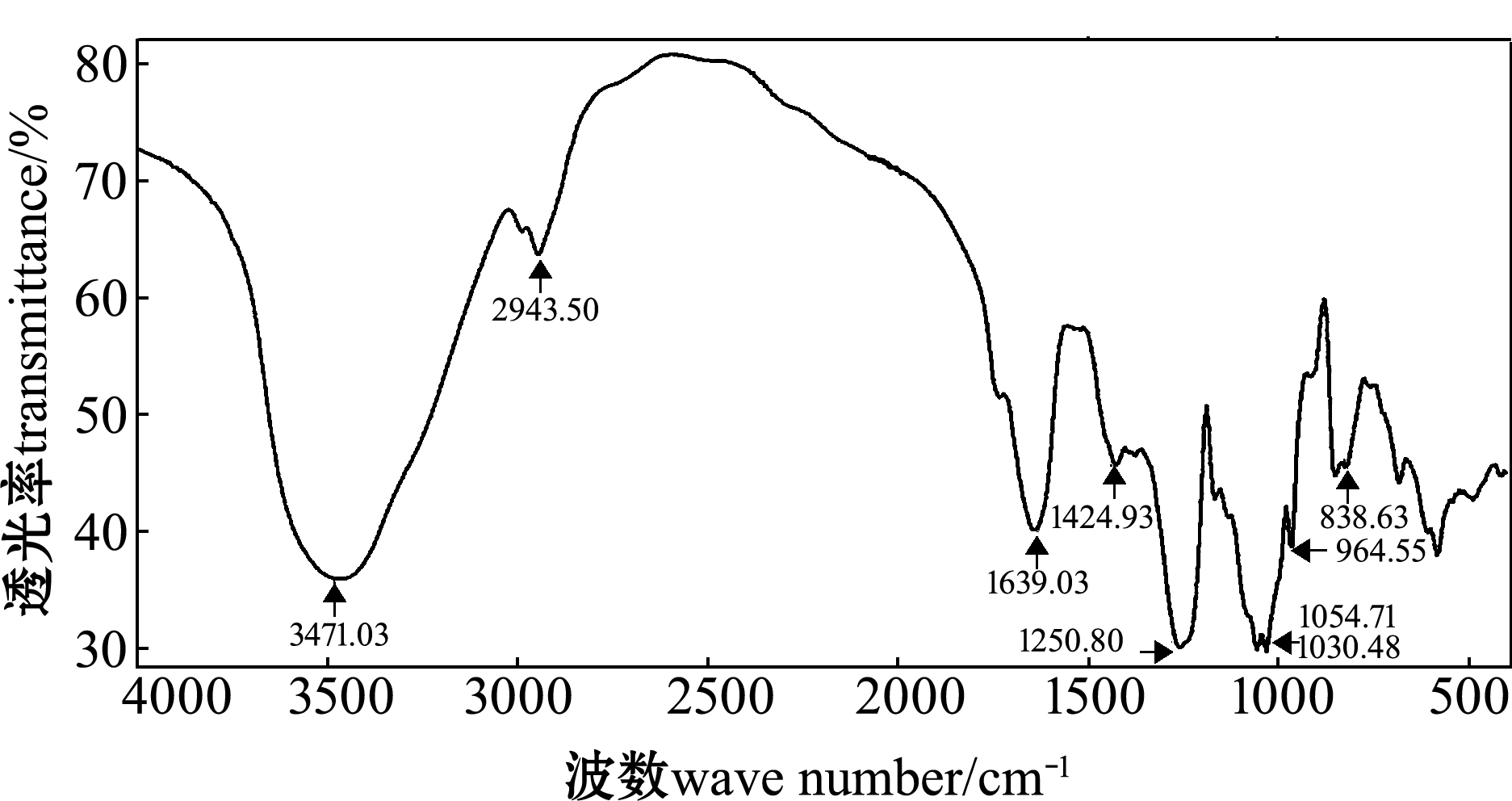
图1 LF红外光谱图谱
Fig.1 Infrared spectrum of fucoidan of kelp Laminaria japonica(LF)
2.3 LF的降血脂作用分析
从表3可见:随着灌胃时间的延长,空白对照组大鼠的TC水平未发生明显变化,而饲喂高脂饲料的模型组大鼠的TC值较空白对照组均有极显著升高(P<0.01);灌胃至8周时,LF低剂量组大鼠的TC值均显著低于模型组(P<0.05),灌胃至12周时,LF低、高剂量组TC水平分别较模型组显著下降38.42%、32.48%(P<0.05)。灌胃LF 4、8和12周后,大鼠血清的TG水平较空白对照组均有降低,TG水平的降低随灌胃时间的延长呈正相关关系,灌胃至12周时,低、高剂量组TG水平分别较模型组显著下降40.00%、31.43%(P<0.05)。
经4、8和12周的灌胃饲养,LF低剂量组大鼠的HDL-C含量较模型组有显著提升(P<0.05);灌胃LF 4、8周时,LF高剂量组HDL-C水平较模型组表现出极显著提升(P<0.01),而灌胃12周时未检测出显著性差异,这可能是同组大鼠试验差异较大导致的结果误差。高脂饲料对LDL-C的影响也较大,模型组相比于空白对照组大鼠的LDL-C水平极显著升高(P<0.01),灌胃至12周时,灌胃LF的低、高剂量组大鼠血清LDL-C水平均显著低于模型组(P<0.05)(表3)。
从表3可见:大鼠经过8周的灌胃,LF低、高剂量组肝组织的MDA含量较模型组极显著下降(P<0.01),经过12周的灌胃,LF高剂量组表现为极显著下降(P<0.01),这表明LF能减少促氧化物的生成,减轻试验大鼠的氧化应激;高脂饲料使大鼠肝脏的SOD活性较空白组极显著降低(P<0.05),而灌胃LF的低、高剂量组SOD活性在各时间点均极显著高于模型组(P<0.01);LF低剂量组大鼠肝组织的GSH-Px活性较模型组极显著升高(P<0.01),LF高剂量组在灌胃8周和12周时GSH-Px活性显著升高(P<0.05)。
总体上看,各时间点LF组与阳性药物组大鼠血脂指标水平及肝脏酶活力较为接近且均无显著性差异(P>0.05),表明LF的降血脂效果与脂必妥药物相当,灌胃12周时效果最佳。
表3 褐藻聚糖硫酸酯对大鼠血清脂质指标及肝脏抗氧化指标的影响(n=10)
Tab.3 Effect of fucoidan on serum lipid index and liver antioxidant index in rats(n=10)
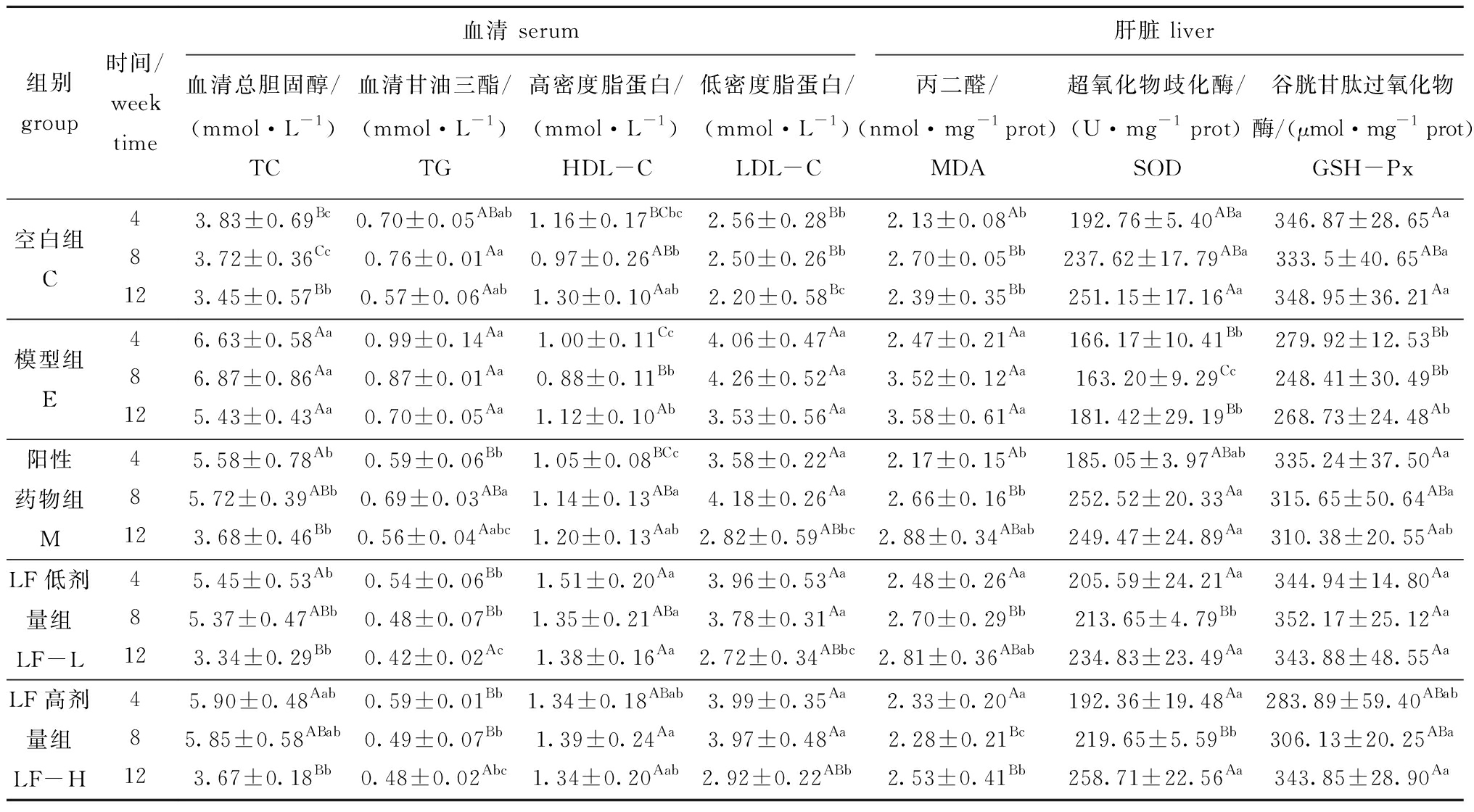
组别group时间/weektime血清 serum肝脏 liver血清总胆固醇/(mmol·L-1)TC血清甘油三酯/(mmol·L-1)TG高密度脂蛋白/(mmol·L-1)HDL-C低密度脂蛋白/(mmol·L-1)LDL-C丙二醛/(nmol·mg-1prot)MDA超氧化物歧化酶/(U·mg-1 prot)SOD谷胱甘肽过氧化物酶/(μmol·mg-1 prot)GSH-Px空白组C43.83±0.69Bc0.70±0.05ABab1.16±0.17BCbc2.56±0.28Bb2.13±0.08Ab192.76±5.40ABa346.87±28.65Aa83.72±0.36Cc0.76±0.01Aa0.97±0.26ABb2.50±0.26Bb2.70±0.05Bb237.62±17.79ABa333.5±40.65ABa123.45±0.57Bb0.57±0.06Aab1.30±0.10Aab2.20±0.58Bc2.39±0.35Bb251.15±17.16Aa348.95±36.21Aa模型组E46.63±0.58Aa0.99±0.14Aa1.00±0.11Cc4.06±0.47Aa2.47±0.21Aa166.17±10.41Bb279.92±12.53Bb86.87±0.86Aa0.87±0.01Aa0.88±0.11Bb4.26±0.52Aa3.52±0.12Aa163.20±9.29Cc248.41±30.49Bb125.43±0.43Aa0.70±0.05Aa1.12±0.10Ab3.53±0.56Aa3.58±0.61Aa181.42±29.19Bb268.73±24.48Ab阳性药物组M45.58±0.78Ab0.59±0.06Bb1.05±0.08BCc3.58±0.22Aa2.17±0.15Ab185.05±3.97ABab335.24±37.50Aa85.72±0.39ABb0.69±0.03ABa1.14±0.13ABa4.18±0.26Aa2.66±0.16Bb252.52±20.33Aa315.65±50.64ABa123.68±0.46Bb0.56±0.04Aabc1.20±0.13Aab2.82±0.59ABbc2.88±0.34ABab249.47±24.89Aa310.38±20.55AabLF低剂量组LF-L45.45±0.53Ab0.54±0.06Bb1.51±0.20Aa3.96±0.53Aa2.48±0.26Aa205.59±24.21Aa344.94±14.80Aa85.37±0.47ABb0.48±0.07Bb1.35±0.21ABa3.78±0.31Aa2.70±0.29Bb213.65±4.79Bb352.17±25.12Aa123.34±0.29Bb0.42±0.02Ac1.38±0.16Aa2.72±0.34ABbc2.81±0.36ABab234.83±23.49Aa343.88±48.55AaLF高剂量组LF-H45.90±0.48Aab0.59±0.01Bb1.34±0.18ABab3.99±0.35Aa2.33±0.20Aa192.36±19.48Aa283.89±59.40ABab85.85±0.58ABab0.49±0.07Bb1.39±0.24Aa3.97±0.48Aa2.28±0.21Bc219.65±5.59Bb306.13±20.25ABa123.67±0.18Bb0.48±0.02Abc1.34±0.20Aab2.92±0.22ABb2.53±0.41Bb258.71±22.56Aa343.85±28.90Aa
注: 4、8、12分别代表灌胃周数;标有不同大写字母者表示同指标同周期不同组间有极显著性差异(P<0.01);标有不同小写字母者表示组间有显著性差异(P<0.05);标有相同小写字母者表示组间无显著性差异(P>0.05),下同(图、表)
Note: 4, 8, and 12 denote the number of weeks of gastric administration; Means with the same index and periods marked with different capital letters are very significant difference between the groups (P<0.01); Means with different letters are significant differences between the groups (P<0.05); Means with the same letter are no significant differences between the groups (P>0.05),et sequentia(in Figure and Table)
2.4 LF对肝脏胆固醇代谢相关基因表达的影响
从图2可见:高脂饲料引起了大鼠肝脏HMG-CoA mRNA表达量的上调、LCAT mRNA表达量的下调;灌胃LF 4、8、12周后,LF低、高剂量组与模型组相比,HMG-CoA基因表达量极显著下调、LCAT基因表达量极显著上调(P<0.01),说明大鼠肝脏胆固醇的合成受到了限制,促进TC逆转运,但均未呈现与时间有效应关系。
2.5 LF对肝脏脂质合成相关基因表达的影响
从图3-A可见:高脂饲料能引起大鼠肝脏SREBP-1c mRNA表达量增强,导致脂肪酸代谢失衡,甘油三酯(TG)合成增多;相比于模型组,经4周灌胃,LF组SREBP-1c表达量变化不大,随着灌胃时间的延长,灌胃至8、12周时,LF低、高剂量均极显著抑制SREBP-1c表达(P<0.01)。
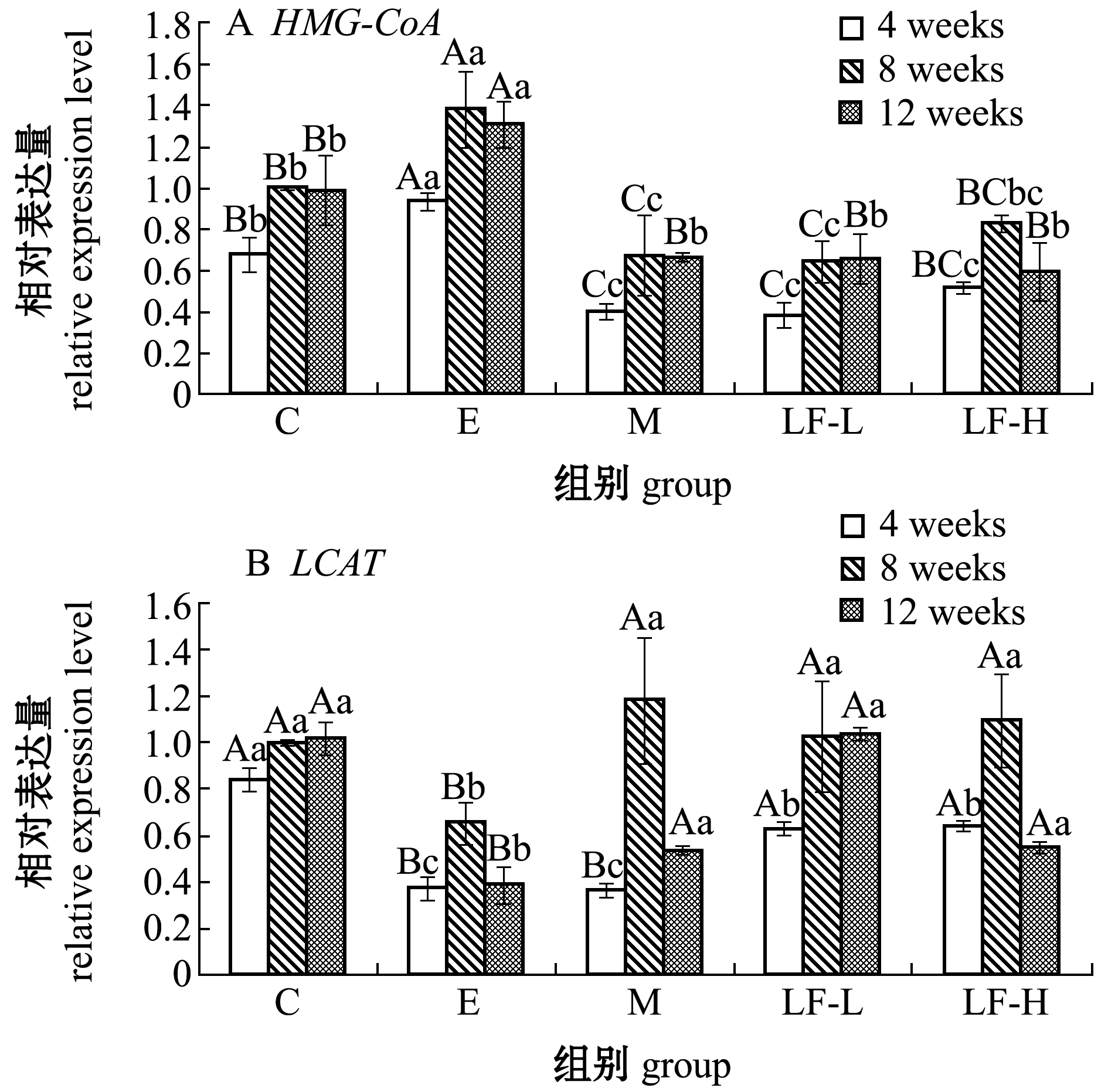
图2 胆固醇分解代谢相关基因mRNA表达的变化
Fig.2 Changes in mRNA expression of genes involved in cholesterol catabolism

图3 脂肪合成相关基因mRNA表达的变化
Fig.3 Changes in mRNA expression of genes involved in lipid synthesis
从图3-B可见:高脂饲料引起大鼠肝脏SCD1 mRNA的表达量下调,促使脂肪在肝脏内蓄积形成非酒精性脂肪肝,同时加重氧化应激对肝细胞的打击和肝脏的炎症反应;相比于模型组,灌胃至4周时,LF低剂量组SCD1的表达呈极显著上调(P<0.01),随着灌胃时间的延长,灌胃至8周和12周时,LF低、高剂量组SCD1的表达量均表现为极显著上调(P<0.01)。
2.6 LF对肝脏脂质分解相关基因表达的影响
从图4-A可见:高脂饲料引起大鼠肝脏PPARα 相对表达量下调;经4周的灌胃,LF低、高剂量组大鼠肝脏中的PPARα 表达量较模型组无显著性变化(P>0.05),随着灌胃时间的延长,灌胃8周时,LF低、高剂量组的PPARα表达量较模型组极显著上调(P<0.01),灌胃12周时,LF低剂量组的PPARα表达量较模型组极显著上调(P<0.01),由此可见,LF可改善PPARα途径,促进脂肪酸的氧化分解。
从图4-B可见:与对照组相比,高脂饲料下调了大鼠肝脏中PPARγ的表达,经过4、8周灌胃,LF低、高剂量组均未上调PPARγ 的表达,随着灌胃时间的延长,灌胃12周时,LF低、高剂量组PPARγ 的表达量较模型组极显著上调(P<0.01),这表明LF可调节PPARγ 途径。
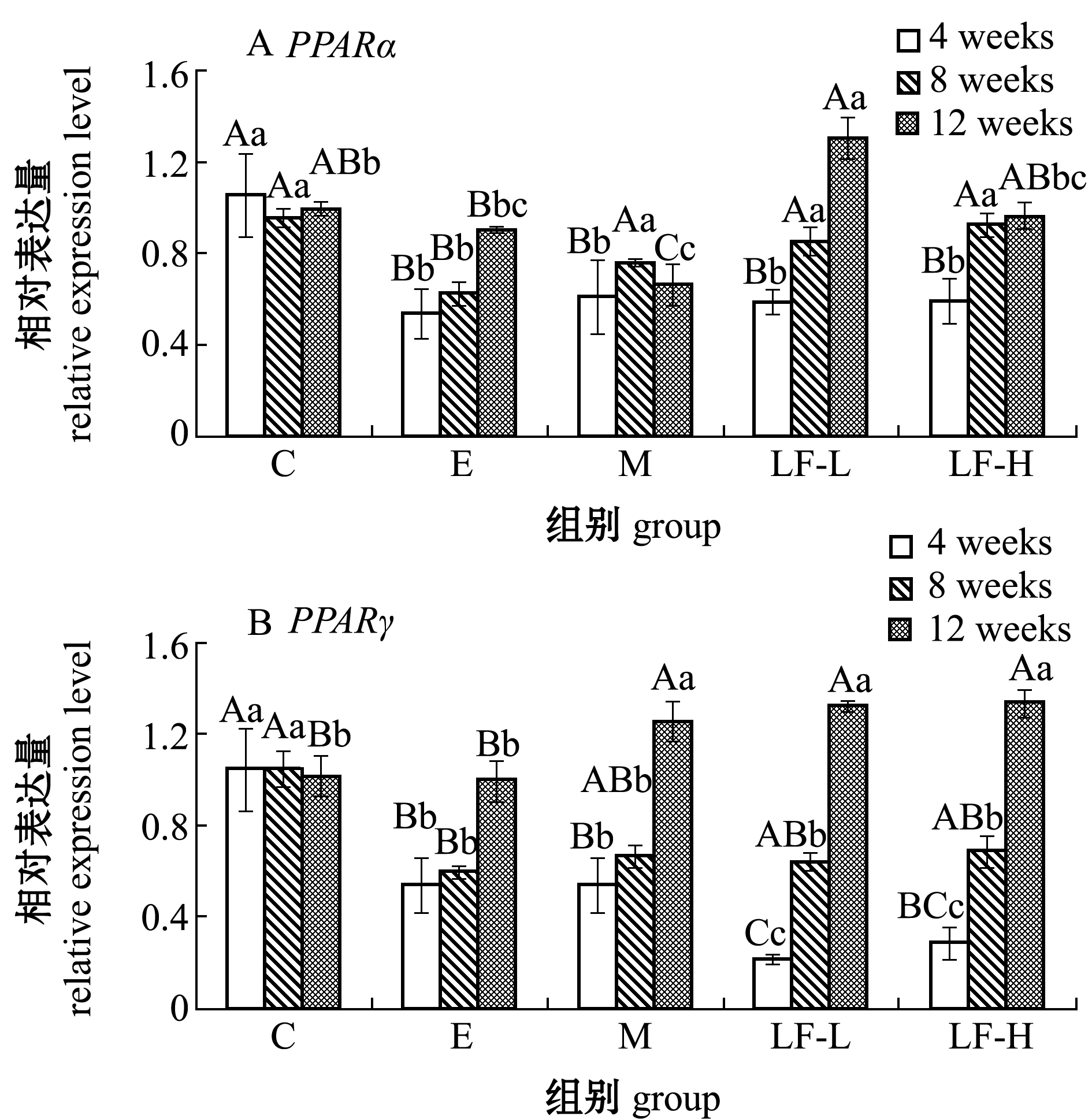
图4 脂肪分解代谢相关基因mRNA表达的变化
Fig.4 Changes in mRNA expression of genes involved in lipid catabolism
2.7 肝脏组织切片观察
从图5可见:对照组在灌胃不同时段(图5-A~C)时,肝脏在光镜下肝小叶清晰可见,结构正常;肝组织的形态表现正常;模型组(图5-D~F)是一直饲喂高脂饲料的大鼠肝脏切片,肝组织出现了弥漫性肝细胞脂肪变性,肝细胞变大,胞浆内的脂滴多为大泡型,细胞核被挤向细胞周边,随着时间的延长几乎100%脂肪化,这是因为血浆中的胆固醇和甘油三酯含量增高时,肝细胞中的脂滴也相应增加,而肝脏中高脂肪含量会损伤肝脏的组织结构[20];与模型组相比,喂食LF的低、高剂量组的大鼠肝脏脂肪化显著降低,这表明LF能更有效抑制高脂饲料所致的脂肪肝发展。

图5 不同试验组大鼠肝脏组织切片
Fig.5 Histological sections of rat liver in different groups
3 讨论
3.1 褐藻聚糖硫酸酯组成
本研究表明,真海带褐藻聚糖硫酸酯(LF)的总糖含量为75.27%、硫酸基团含量为19.58%。高效液相色谱分析显示,LF的单糖组成主要为岩藻糖和半乳糖,还含有甘露糖、葡萄糖醛酸、葡萄糖和木糖。红外光谱分析显示,LF在1250 cm-1处有较强的吸收,这表明其含有硫酸基团,且硫酸基团在C-4位置。这与刘舒[21]得出的日本真海带褐藻聚糖硫酸酯单糖组成及红外光谱分析结果一致。
3.2 LF的降血脂作用及抗氧化活性
本研究表明,LF对高脂饲料引起的TC、TG和LDL-C水平上升有明显的抑制作用,说明LF不仅能降低高脂血症大鼠的TC、TG和LDL-C水平,还能使HDL-C水平显著上升,LF组血脂各指标均已达到药物组水平,且灌胃12周时降血脂效果最佳。
MDA是脂质过氧化的终产物,是反映机体脂质过氧化水平的重要指标。SOD是清除氧自由基的主要酶系,GSH-Px是机体内广泛存在的一种重要的催化过氧化氢分解酶,可起到保护细胞膜结构和功能完整的作用。SOD和GSH-Px活力高低反映了机体抗氧化能力的强弱[22]。高胆固醇血症状态下,脂质水平升高,抗氧化能力下降,表现为严重的脂质过氧化及动脉粥样硬化(AS)发生的高危险性[23]。高脂饮食能诱导氧化损伤和脂代谢紊乱[24],本试验中饲喂高脂饲料的模型组大鼠肝脏MDA含量均极显著高于对照组,表明高脂饲料会增加机体的氧化应激反应。LF低、高剂量组经灌胃8周时MDA水平较模型组极显著降低,表明LF能减少促氧化物的生成,减轻试验大鼠的氧化应激。SOD、GSH-Px协同作用对减少活性氧的产生、防止脂质过氧化及其中间代谢产物对机体的损害具有十分重要的作用。本研究表明,灌胃LF的各剂量组SOD和GSH-Px水平较模型组均显著或极显著升高,这说明LF能明显提高大鼠肝脏SOD、GSH-Px活力,且灌胃12周时,肝脏MDA、SOD、GSH-Px水平还可恢复至空白对照水平。
3.3 LF对肝组织胆固醇代谢相关基因表达的影响
HMG-CoA还原酶是胆固醇合成过程中的限速酶,其表达量的高低可以直接反映生物体胆固醇合成的能力。LCAT是催化胆固醇与不饱和脂肪酸进行酯化的一种酶,在HDL-C代谢和TC逆转运中起着重要的作用,其表达量的高低决定HDL-C的生成量,影响胆固醇的消除过程。当LCAT mRNA表达降低时,血脂代谢紊乱,造成胆固醇积累,促使动脉粥样硬化的形成和发展。本试验中利用RT-PCR技术,检测LF对胆固醇代谢、脂肪酸合成和β-氧化过程关键因子基因表达的影响,结果表明,LF低、高剂量组均能显著下调HMG-CoA mRNA表达,上调LCAT mRNA表达,并抑制肝脏胆固醇合成,促进TC逆转运。Jun等[25]研究表明,精油通过下调HMG-CoA mRNA的表达,能够起到降血脂的作用。由此也表明,LF能明显提高高脂大鼠血清HDL-C的水平,本研究结果进一步表明,LF是通过上调LCAT mRNA表达以促进HDL清除胆固醇的过程,从而有利于动脉粥样硬化和冠心病的防治。梁婧婧[26]研究甘薯水溶性糖蛋白的提取纯化及降血脂机理时表明,甘薯糖蛋白通过抑制胆固醇合成关键性限速酶(HMG-CoA)的活性,提高卵磷脂胆固醇酞基转移酶(LCAT)的活性,从而达到降血脂的作用。
3.4 LF对肝脏脂质合成及分解相关基因表达的影响
SREBPs蛋白可参与脂肪的代谢调节过程。SREBP-1c是固醇调节元件结合蛋白的一个亚型,直接参与调控有关脂肪酸、TG合成和葡萄糖代谢相关酶基因的表达[27]。SCD是单不饱和脂肪酸生物合成的限速酶,SCD1在脂质代谢、体质量控制和能量生成中起关键作用[28]。本研究显示,LF能显著抑制了SREBP-1c mRNA的表达、上调SCD1 mRNA的表达,说明LF减缓了脂质合成。机体内的脂肪一方面来源于外界摄入,另一方面是体内自身合成。除了控制脂肪的消化吸收,抑制体内脂肪合成也是改善脂质代谢的一条重要途径[29]。
PPAR可分为α、β、γ 3种类型,其主要功能是参与肝脏脂肪代谢。本研究表明,随着灌胃时间的延长,LF低、高剂量组PPARα、PPARγ mRNA表达量均有显著提升。高脂饲料能干扰PPARγ途径,降低机体调节脂质代谢能力。褐藻聚糖硫酸酯的摄入有效地保护了这一途径免受损伤,从而起到保护肝功能的作用,促进脂肪的分解代谢。因此,真海带褐藻聚糖硫酸酯主要是通过抑制胆固醇的合成并加速脂肪酸的氧化降解,从而达到降血脂作用。
4 结论
(1)真海带褐藻聚糖硫酸酯(LF)总糖含量为75.27%、硫酸基含量为19.58%,其主要由岩藻糖(41.61%)和半乳糖(24.90%)单糖组成,含有的硫酸基团主要在C-4位置。
(2)用LF灌胃Wistar大鼠后,可显著降低血清TC、TG、LDL-C水平且显著提升HDL-C水平,显示了LF对高脂饲料大鼠的降血脂作用且降血脂效果与降血脂药物相当;LF可显著降低MDA水平且显著提升SOD和GSH-Px活性,证明了LF具有降低促氧化物的生成及试验大鼠氧化应激的作用。
(3)LF能下调大鼠肝脏HMG-CoA表达量和上调LCAT表达量,表明了LF降血脂作用是通过控制胆固醇和脂肪酸的合成实现的,LF抑制肝脏脂肪合成相关酶基因SREBP-1c、上调SCD1 mRNA表达量,表明LF能减缓脂质合成,PPARα、PPARγ 基因上调,表明LF增加脂质分解速度,这进一步阐明了其降血脂机理。
(4)灌胃LF大鼠肝组织的显微结构观察进一步证明了灌胃LF对高血脂大鼠的降血脂作用。
[1] Zha Xueqiang,Xue Lei,Zhang Hailin,et al.Molecular mechanism of a new Laminaria japonica polysaccharide on the suppression of macrophage foam cell formation via regulating cellular lipid metabolism and suppressing cellular inflammation[J].Molecular Nutrition & Food Research,2015,59(10):2008-2021.
[2] 金维华.褐藻中酸性多糖的结构分析及神经保护活性研究[D].青岛:中国科学院研究生院(海洋研究所),2014.
[3] 谌素华,王维民.褐藻岩藻聚糖硫酸酯生物活性研究进展[J].食品工业科技,2009,30(6):371-374.
[4] 赵建强,李飞箭,高国瑞,等.海带岩藻聚糖硫酸酯的研究进展[J].安徽农业科学,2009,37(3):932-934.
[5] Lin Lin,Lv Shun,Li Bafang.Angiotensin-I-converting enzyme (ACE)-inhibitory and antihypertensive properties of squid skin gelatin hydrolysates[J].Food Chemistry,2012,131(1):225-230.
[6] 张全斌,于鹏展,周革非,等.海带褐藻多糖硫酸酯的抗氧化活性研究[J].中草药,2003,34(9):824-826.
[7] 李鸶鸶,汪秋宽,何云海,等.多肋藻岩藻聚糖硫酸酯的提取及其降血脂作用研究[J].大连海洋大学学报,2013,28(1):94-98.
[8] 程忠玲.海带中褐藻糖胶研究进展[J].食品研究与开发,2010,31(4):181-184.
[9] 王鸿,张甲生,严银春,等.褐藻岩藻多糖生物活性研究进展[J].浙江工业大学学报,2018,46(2):209-215.
[10] Huang Ling,Wen Kewei,Gao Xuan,et al.Hypolipidemic effect of fucoidan from Laminaria japonica in hyperlipidemic rats[J].Pharmaceutical Biology,2010,48(4):422-426.
[11] 谌素华,王维民,刘辉,等.马尾藻岩藻聚糖硫酸酯纯化及降血脂功能研究[J].食品与发酵工业,2010,36(5):28-31.
[12] 刘承颖.半叶马尾藻中岩藻聚糖硫酸酯的提取纯化及降血脂功能研究[D].湛江:广东海洋大学,2008.
[13] Qi Huimin,Huang Liye,Liu Xiaolei,et al.Antihyperlipidemic activity of high sulfate content derivative of polysaccharide extracted from Ulva pertusa (Chlorophyta)[J].Carbohydrate Polymers,2012,87(2):1637-1640.
[14] Wang Jing,Jin Weihua,Zhang Wenjing,et al.Hypoglycemic property of acidic polysaccharide extracted from Saccharina japonica and its potential mechanism[J].Carbohydrate Polymers,2013,95(1):143-147.
[15] 王慧铭,孙炜,黄素霞,等.昆布多糖对大鼠减肥及降血脂作用的实验研究[J].中国现代应用药学,2008,25(1):16-19.
[16] Wang Qiukuan,Song Yuefan,He Yunhai,et al.Structural characterisation of algae Costaria costata fucoidan and its effects on CCl4 -induced liver injury[J].Carbohydrate Polymers,2014,107:247-254.
[17] 张惟杰.复合多糖生化研究技术[M].上海:上海科学技术出版社,1987:6-7.
[18] 张惠芬,李宝才,范家恒,等.盐酸水解—硫酸钡重量法测定硫酸酯化多糖硫酸基含量方法考察[J].食品科学,2002,28(5):107-111.
[19] 邢丽红,祝纯静,孙伟红,等.柱前衍生—高效液相色谱法测定岩藻多糖的单糖及糖醛酸含量[J].中国渔业质量与标准,2011,1(1):64-69.
[20] 蔡璐.不同分子量马尾藻岩藻聚糖硫酸酯的制备及降血脂机理的初步研究[D].湛江:广东海洋大学,2014.
[21] 刘舒.三种褐藻中岩藻聚糖硫酸酯的纯化及结构分析[J].大连:大连海洋大学,2013.
[22] 王尊文,华玉琴,李国平,等.羊栖菜多糖对高血脂模型大鼠血脂和抗氧化功能的影响[J].中国海洋药物杂志,2008,27(6):13-15.
[23] Yokota T,Nomura K,Nagashima M,et al.Fucoidan alleviates high-fat diet-induced dyslipidemia and atherosclerosis in ApoEshl mice deficient in apolipoprotein E expression[J].The Journal of Nutritional Biochemistry,2016,32:46-54.
[24] Yang Ruili,Le Guowei,Li Anlin,et al.Effect of antioxidant capacity on blood lipid metabolism and lipoprotein lipase activity of rats fed a high-fat diet[J].Nutrition,2006,22(11-12):1185-1191.
[25] Jun H J,Chung M J,Dawson K,et al.Nutrigenomic analysis of hypolipidemic effects of Agastache rugosa essential oils in HepG2 cells and C57BL/6 mice[J].Food Science and Biotechnology,2010,19(1):219-227.
[26] 梁婧婧.甘薯水溶性糖蛋白的提取纯化及降血脂机理的研究[D].沈阳:沈阳农业大学,2009.
[27] Li J,Liu X,Ran X,et al.Sterol regulatory element-binding protein-1c knockdown protected INS-1E cells from lipotoxicity[J].Diabetes Obesity and Metabolism,2010,12(1):35-46.
[28] Ahmad S,Beg Z H.Hypolipidemic and antioxidant activities of thymoquinone and limonene in atherogenic suspension fed rats[J].Food Chemistry,2013,138(2-3):1116-1124.
[29] Peng Yongbo,Wang Yafang,Wang Qiukuan,et al.Hypolipidemic effects of sulfated fucoidan from Kjellmaniella crassifolia through modulating the cholesterol and aliphatic metabolic pathways[J].Journal of Functional Foods,2018,51:8-15.