单细胞蛋白(single cell protein,SCP)是指细菌、真菌、微藻等单细胞微生物所产生的胞内蛋白质,又称微生物蛋白或生物菌体蛋白,其蛋白含量通常在40%~80%,还含有脂肪、碳水化合物、核酸、维生素、无机盐等,可谓营养丰富[1]。近年来,随着生物工程技术的发展,生物活性药物及原料的规模化发酵生产已日渐成熟[2]。其中,维生素C(VC)二步混菌发酵是中国首创且唯一应用于工业化生产的生物制药方法[3],然而,相关研究中对于微生物发酵后所产生发酵废液的无害化处理报道较少,尚缺乏规范化的方案。生产过程中如何处理这些含有丰富单细胞蛋白的发酵废液,在减少污染的同时,实现其资源化利用成了新的课题[4]。
水产品作为人类优质蛋白供给的重要来源,其产业发展的可持续性很大程度上依赖于鱼粉替代品的获得[5]。轮虫等浮游动物食物链等级低、增殖迅速、培养工艺简单,已成为水产苗种培育中广泛使用的重要生物饵料[6]。规模化生产中,一般采用小球藻Chlorella spp.、微拟球藻Nannochloropsis spp.等微藻类或酵母、细菌等饵料培养轮虫,其中普遍认为,微藻培养的轮虫质量与使用效果较好[7-8]。然而,培养微藻要求人力物力投入,成本较高,而藻类生长还受环境条件影响,其生产不稳定性与营养单一等问题也使其应用具有局限性[9]。另外,相关研究中也有使用鸡粪和发酵菜籽粕培养轮虫的报道[10-11],但使用鸡粪会增加病原生物引入及抗生素、重金属等有害物质残留的风险,而其他原料又会增加一些生产成本。因此,开发更加适合轮虫摄食生长而又成本低廉的新型饵料具有重要的应用价值[11-14]。
本试验中选择药厂制备维生素C(VC)所产生的发酵废液、微拟球藻Nannochloropsis spp.、裂殖壶藻Thraustochytrium spp.及其不同的饵料组合,投喂海水培养的褶皱臂尾轮虫Brachionus plicatilis,测定种群密度变化,以及水体氨氮、亚硝酸盐、硝酸盐和pH等指标,探讨了发酵废液用于培养轮虫的可行性与合适的投喂方案,旨在为生物制药发酵废液的资源化利用,以及微生物单细胞蛋白应用于水产生物饵料培养提供数据参考。
1 材料与方法
1.1 材料
发酵废液为某商业化药厂制备维生素C(VC)的过程产物冷藏贮运至实验室后于-20 ℃下冷冻备用。发酵废液固型物的分离采用5000 r/min离心,去上清液后,冷冻保存。经测定,其中含水分、粗蛋白质、粗灰分、粗脂肪、粗纤维、钙、总磷含量分别为12.9%、49.1%、6.7%、3.3%、0.8%、3.2%、0.76%。
冷冻微拟球藻膏由盘锦光合蟹业有限公司提供,细胞密度为(400±50)×108 cells/g,使用前称取,置于纯净水中解冻、稀释。裂殖壶藻由大连理工大学微藻课题组保种,本实验室自行培养,冷冻保存。L-型褶皱臂尾轮虫由农业农村部北方海水增养殖重点实验室提供,培养于盐度为23.0±1.1的过滤海水中,试验前投喂微拟球藻暂养。
1.2 方法
1.2.1 试验分组与投喂 试验设置微拟球藻(A)、发酵废液(B)、裂殖壶藻(C)、微拟球藻+发酵废液(D)、微拟球藻+裂殖壶藻(E)、微拟球藻+发酵废液+裂殖壶藻(F)、微拟球藻+发酵废液固型物(G)7种饵料投喂处理组,每个处理组设3个平行。养殖容器为15 L的玻璃缸,其中,加入盐度为23.0±1.1的海水10 L。用水族箱加热器控制温度为(29.0±1.4)℃。轮虫接种时,用150目筛绢网过滤收集,接种密度为20 ind./mL,全程不间断微充气培养。每日8:00进行吸污、换水,换水量为水体的1/3。每日投喂4次,发酵废液与裂殖壶藻的投喂量参考酵母培养轮虫的操作[12-13],为1.5 g/(106 ind.·d)(以干质量计)。微拟球藻投喂密度为50×104 cells/mL。各混合组的投喂量按饵料种类数,以各组分相同质量平均配比。
1.2.2 水质指标测定 将轮虫培养缸中的水虹吸至200 mL烧杯中,用0.22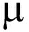 m孔径的滤膜过滤水样。采用纳氏试剂法、重氮-偶氮光度法和锌-镉还原法分别测定总氨氮(TAN)、亚硝酸盐
m孔径的滤膜过滤水样。采用纳氏试剂法、重氮-偶氮光度法和锌-镉还原法分别测定总氨氮(TAN)、亚硝酸盐![]() 和硝酸盐
和硝酸盐![]() 含量,采用便携式pH计(PHB-3,上海)测量pH值。
含量,采用便携式pH计(PHB-3,上海)测量pH值。
1.2.3 轮虫密度测定 每日15:00时取样,将轮虫在缸内均匀分散,在缸中不同位置各取1 mL水样至玻璃凹面皿上,然后置于生物解剖镜下观察计数,以3次计数的平均值为最终记录数据。各生长指标计算公式为
轮虫抱卵率=抱卵轮虫数/轮虫总数×100%,
增长倍数=结束时轮虫数量/轮虫接种数量,
日增长量=Nt-Nt-1,
日均增长量=(Nt-N0)/t,
日均增长率=(lnNt-lnN0)/t×100%。
其中: N0和Nt分别为试验开始和结束时轮虫种群密度(ind./mL);t为试验时间(d)。
1.3 数据处理
水质指标、轮虫种群密度等试验数据均以平均值±标准差(mean±S.D.)表示,采用SPSS 20.0软件对试验数据进行单因素方差分析和Tukey多重比较,以0.05作为差异显著性水平。
2 结果与分析
2.1 投喂不同饵料对轮虫密度的影响
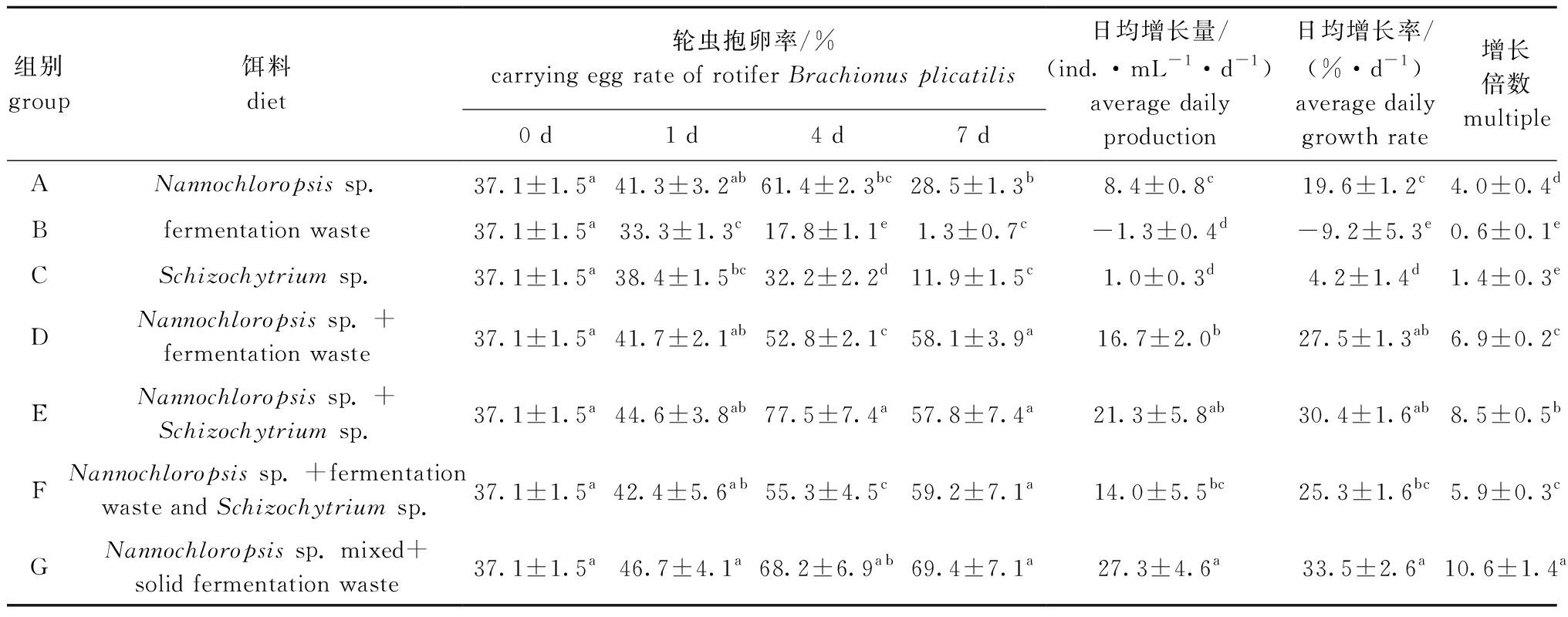
投喂不同饵料的各组轮虫接种密度均为20 ind./mL,连续培养7 d。从表1可见:D、E、F、G各组间轮虫抱卵率均无显著性差异(P>0.05),但均显著高于A、B、C组(P<0.05);B和C组间轮虫的日均增长量无显著性差异(P>0.05),但均显著低于其他组 (P<0.05);A、B、C组轮虫的日均增长率显著低于其他组(P<0.05);G组轮虫抱卵率全程最高,日均增长量为27.3 ind./(mL·d),日均增长率为33.5%/d,增长倍数达到了10.6倍,且显著高于其他组(P<0.05)。
至采收时,仅投喂发酵废液的B组轮虫密度最低,为11 ind./mL,投喂微拟球藻+发酵废液固型物的G组轮虫密度最高,为211 ind./mL,微拟球藻+裂殖壶藻混合投喂的E组次之,为169 ind./mL,除B组外其余各组轮虫密度均有增长(图1)。除B组和仅投喂裂殖壶藻的C组外,其余各组轮虫的日增长量均在第4天时达到峰值,其中G组最高,为65 ind./mL(图2)。
2.2 投喂不同饵料对水质的影响
从图3可见:试验开始前2天,各组总氨氮浓度升高速度较快,之后由于进行换水操作,其趋势发生变化;至试验结束时,B、D和G组上升明显,其中,仅投喂发酵废液的B组氨氮浓度上升最快,试验结束时达到最高值(13.81 mg/L);而C、E和F组氨氮浓度均呈现先上升后下降的波动趋势。
表1 不同饵料对轮虫种群密度的影响
Tab.1 Effects of different diets on the population density of rotifer
组别group饵料diet 轮虫抱卵率/% carrying egg rate of rotifer Brachionus plicatilis0 d1 d4 d7 d日均增长量/(ind.·mL-1·d-1)average daily production日均增长率/(%·d-1)average daily growth rate增长倍数multipleANannochloropsis sp.37.1±1.5a41.3±3.2ab61.4±2.3bc28.5±1.3b8.4±0.8c19.6±1.2c4.0±0.4dBfermentation waste37.1±1.5a33.3±1.3c17.8±1.1e1.3±0.7c-1.3±0.4d-9.2±5.3e0.6±0.1eCSchizochytrium sp. 37.1±1.5a38.4±1.5bc32.2±2.2d11.9±1.5c1.0±0.3d4.2±1.4d1.4±0.3eDNannochloropsis sp. + fermentation waste37.1±1.5a41.7±2.1ab52.8±2.1c58.1±3.9a16.7±2.0b27.5±1.3ab6.9±0.2cENannochloropsis sp. +Schizochytrium sp.37.1±1.5a44.6±3.8ab77.5±7.4a57.8±7.4a21.3±5.8ab30.4±1.6ab8.5±0.5bFNannochloropsis sp. +fermentation waste and Schizochytrium sp.37.1±1.5a42.4±5.6ab55.3±4.5c59.2±7.1a14.0±5.5bc25.3±1.6bc5.9±0.3cGNannochloropsis sp. mixed+solid fermentation waste37.1±1.5a46.7±4.1a68.2±6.9ab69.4±7.1a27.3±4.6a33.5±2.6a10.6±1.4a
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences
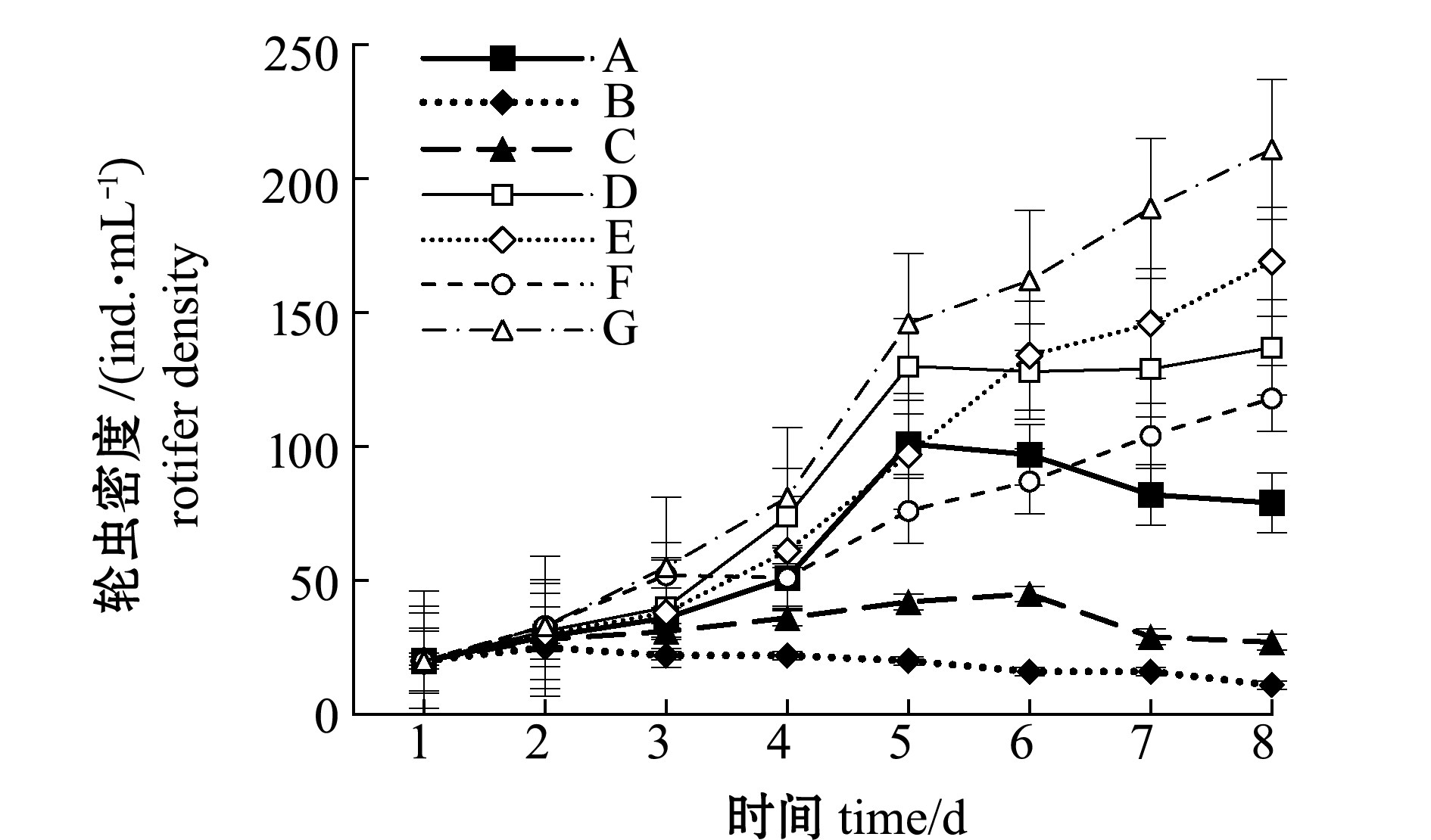
图1 不同饵料投喂组轮虫密度的变化
Fig.1 Changes in rotifer density in different diet groups
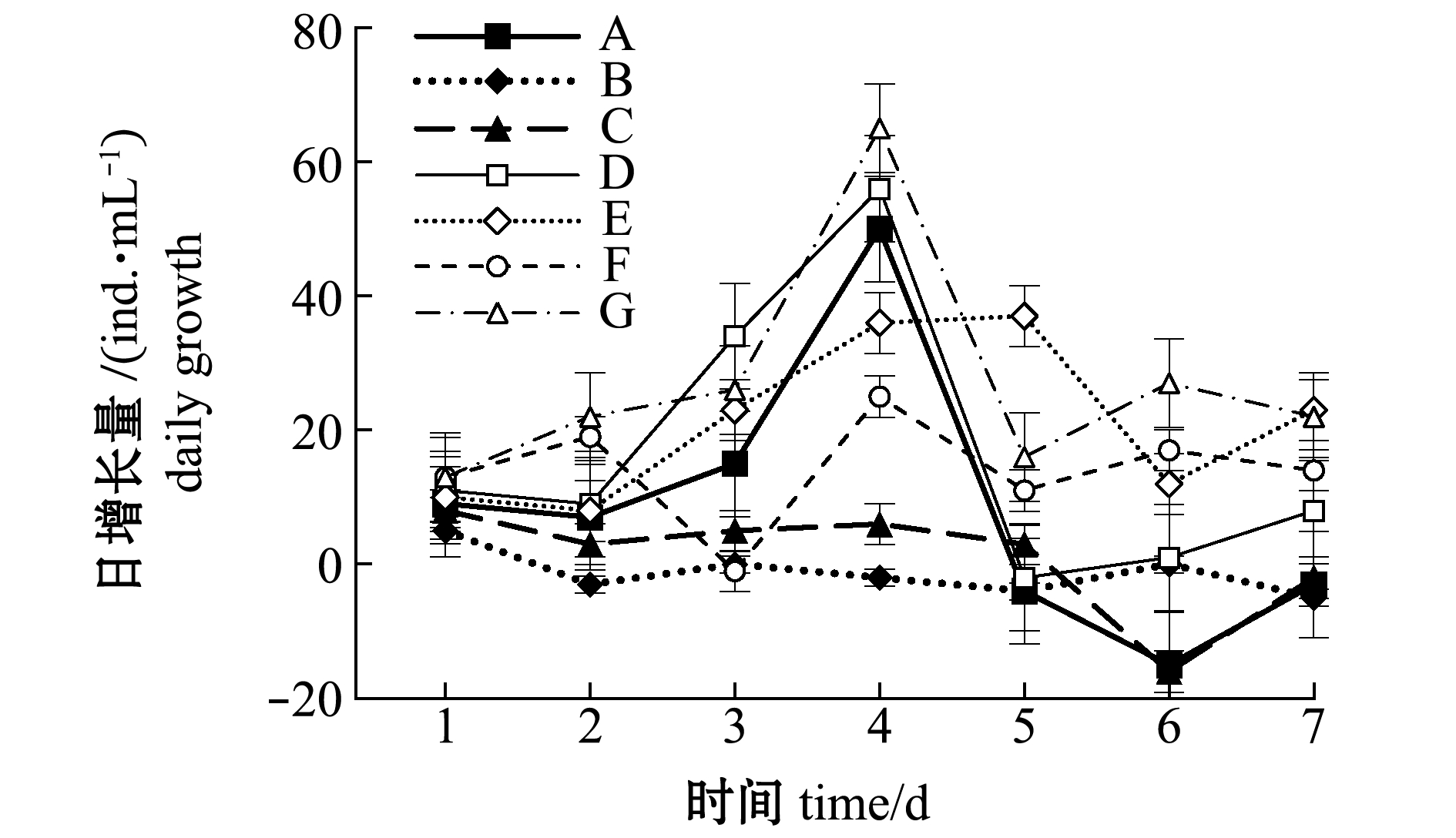
图2 不同饵料投喂组轮虫日增长量的变化
Fig.2 Changes in daily growth of rotifer density in different diet groups
从图4可见:试验期间,A、B、D和G组水体的亚硝酸盐含量随培养时间延长均有升高,其中D组最为显著,试验结束时达到最高值0.43 mg/L;除D、G组外,其余各组的亚硝酸盐随培养时间的延长均呈先升后降趋势,C、E、F组于试验后期趋近于0。
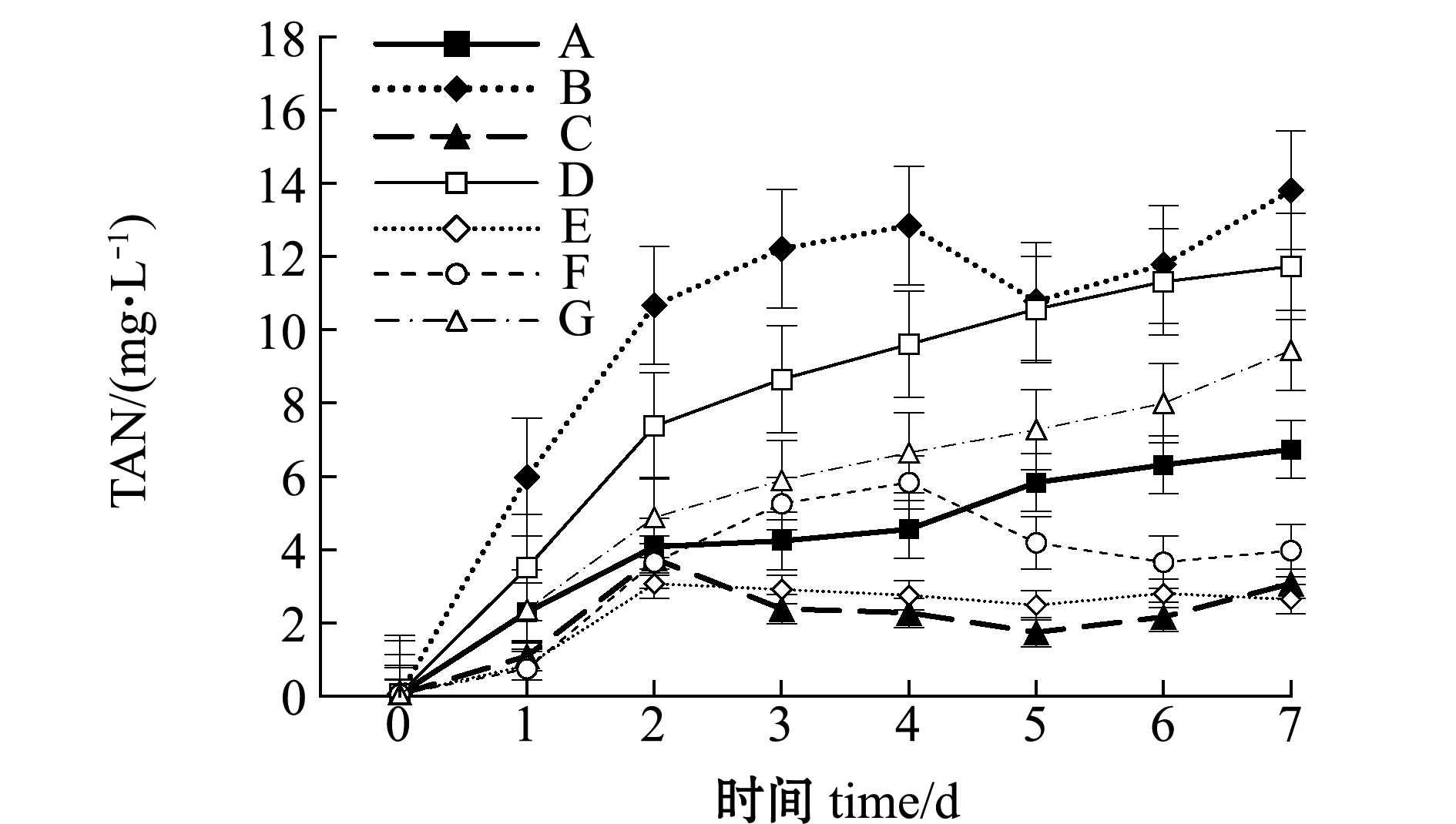
图3 不同饵料投喂组水体总氨氮的变化
Fig.3 Changes in TAN level in different diet groups
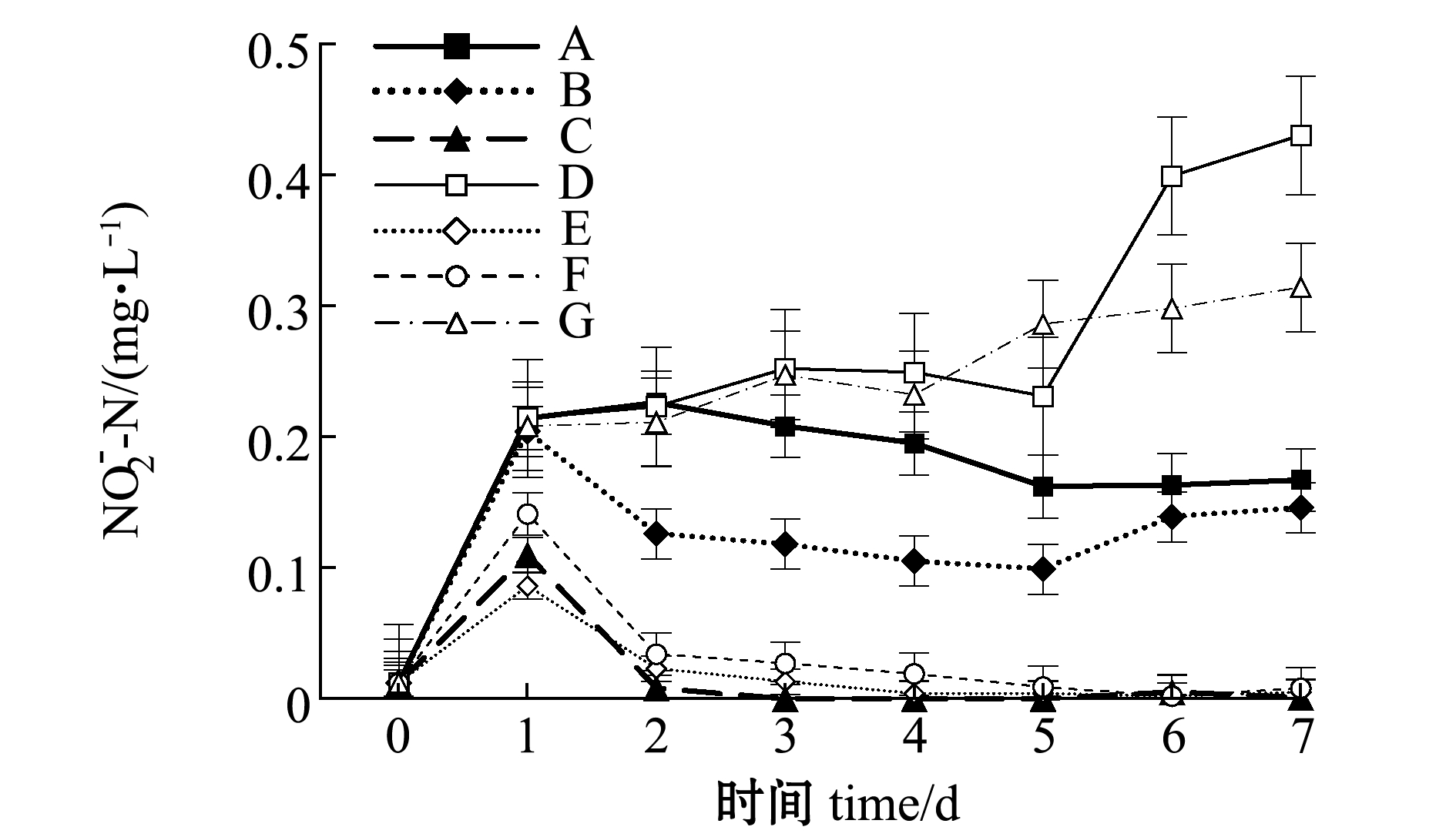
图4 不同饵料投喂组水体亚硝酸盐的变化
Fig.4 Changes in ![]() level in different diet groups
level in different diet groups
从图5可见:试验期间,A、B、D、G组水体硝酸盐含量随培养时间的延长上升明显,尤其D、G组明显高于其他组,其中D组在第6天时出现最高值,为10.81 mg/L;而C、E、F组呈现波动变化趋势,至试验结束时硝酸盐含量无明显升高。
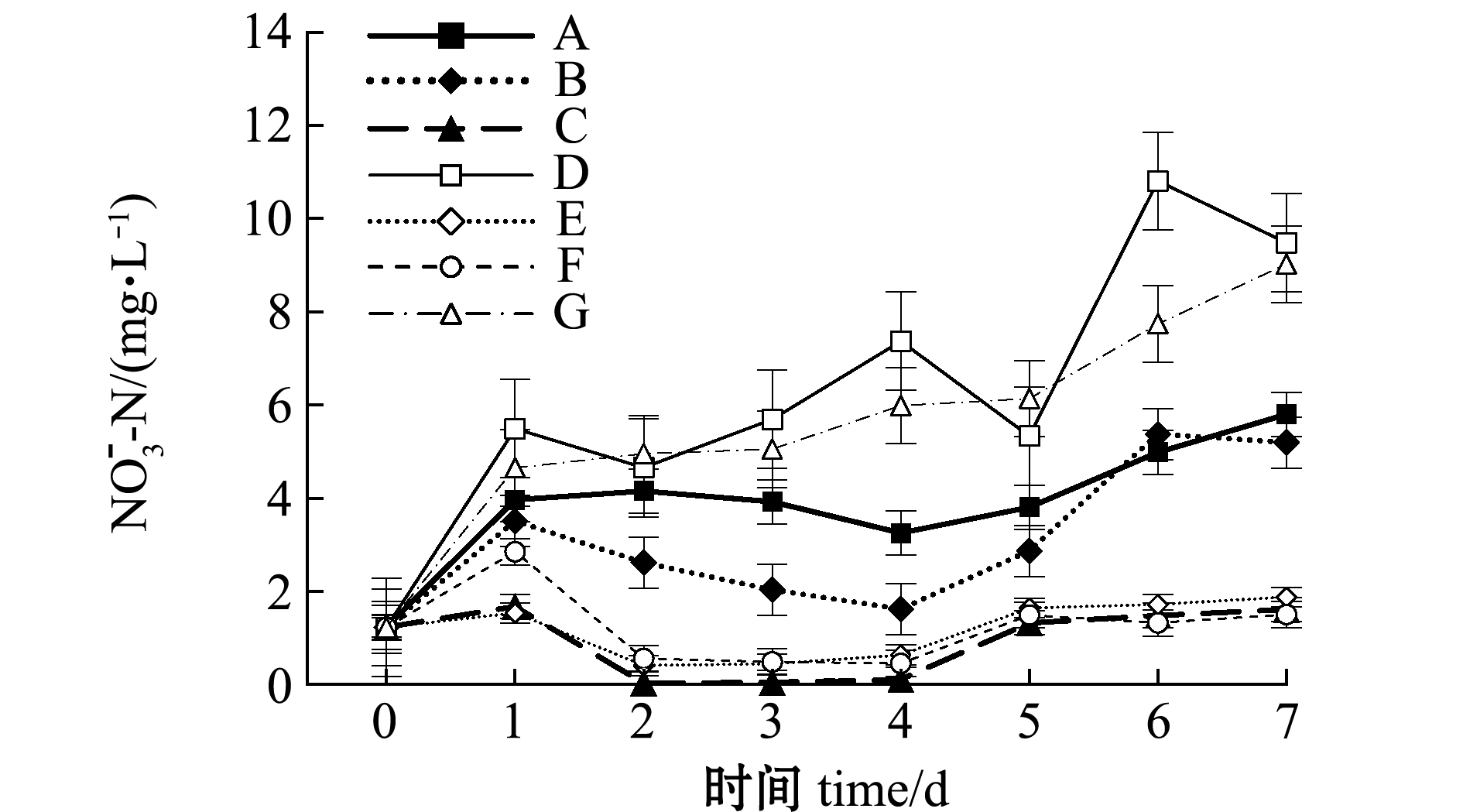
图5 不同饵料投喂组水体硝酸盐的变化
Fig.5 Changes in ![]() level in different diet groups
level in different diet groups
从图6可见,试验期间,除C组外,其余各组pH随培养时间的延长均呈现不同程度的下降趋势,尤其以B组和D组最为明显,试验结束时分别降至7.13、7.17。
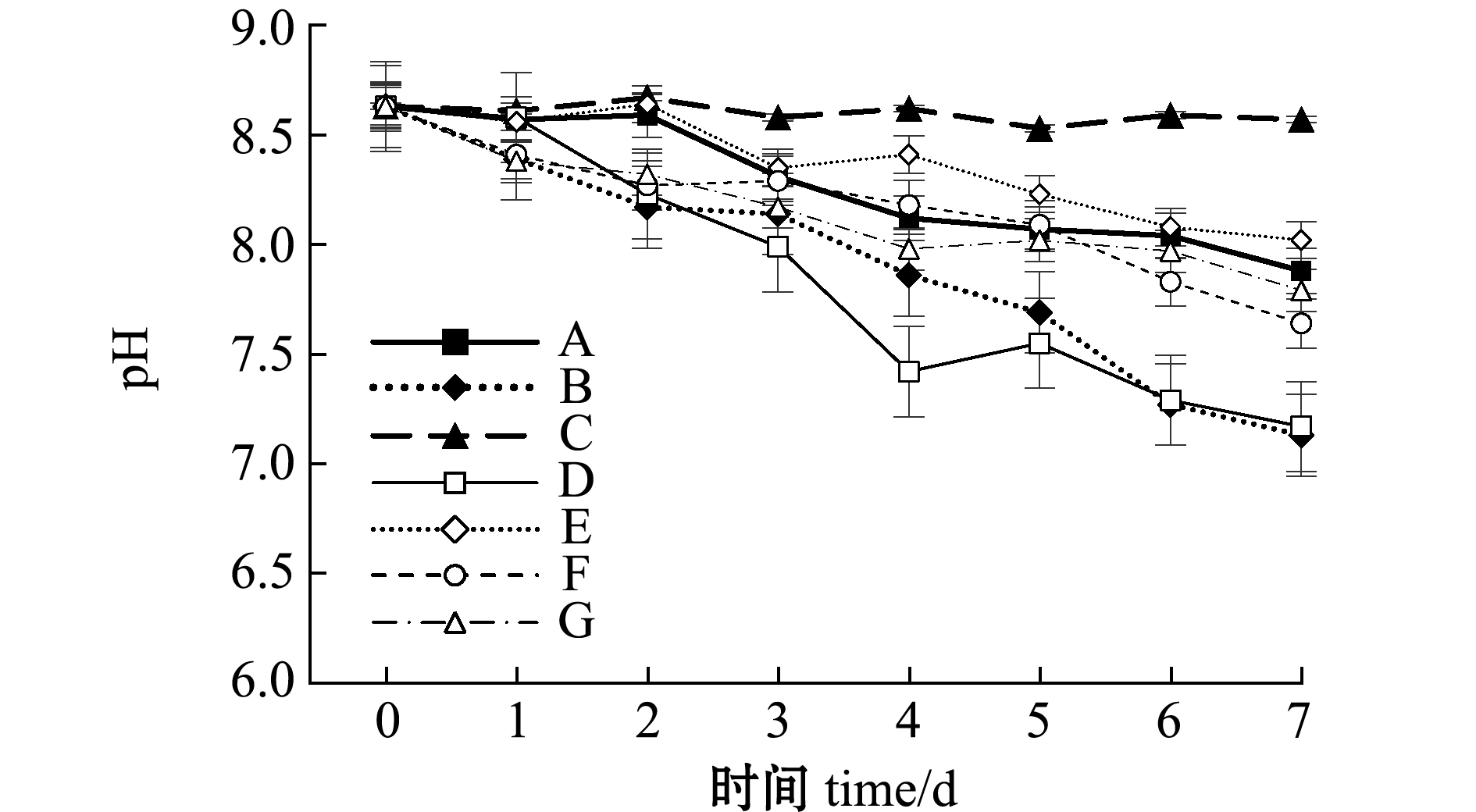
图6 不同饵料投喂组水体pH的变化
Fig.6 Changes in pH in different diet groups
3 讨论
3.1 投喂不同饵料对水质及轮虫密度的影响
关于水质对轮虫生长与繁殖影响的研究较多,氨氮、pH等均为主要因素[15-16]。本试验中,投喂不同饵料的各组轮虫其最终种群密度差异较大,其中,以微拟球藻+发酵废液固型物混合投喂的G组轮虫全程抱卵率及最终密度均为最高,而仅投喂发酵废液的B组轮虫全程的抱卵率及最终密度均为最低。对比各组水体的氨氮变化可见,B组水体氨氮浓度在所有试验组中上升最快,至试验结束时氨氮浓度也最高。根据邓平等[17]报道,褶皱臂尾轮虫对氨氮耐受范围为6~10 mg/L,生活环境中的非离子氨不超过1 mg/L。而本试验中所用发酵废液中氨氮含量为129 mg/L,投喂轮虫后第1天,水体氨氮浓度便达到6 mg/L,第4天时超过12 mg/L,这应是B组轮虫抱卵率及种群密度最低的主要原因。此外,从投喂发酵废液的B组、微拟球藻+发酵废液混合的D组、微拟球藻+发酵废液固型物混合的G组轮虫密度及水质指标对比也可以看出,发酵废液中菌体等固型废物在水中会继续分解,表现为氨氮、亚硝酸盐、硝酸盐升高,pH下降。研究表明,低pH对轮虫的生长与繁殖均有不利影响[18-19]。另外,pH和氨氮的交互作用也可能是造成轮虫密度减少的原因[20]。不同饵料自身特性及其水环境中微生物的差异应是导致所测水质指标不同的原因。环境条件一致时,投喂不同饵料是否会产生特异的菌群,进而影响水质及轮虫的生长则有待深入研究。
本试验中以微拟球藻+发酵废液固型物混合投喂的G组在投喂前将发酵废液离心,去上清液,再将固型物重新分散,如此处理后明显改善了水质,该组轮虫生长也优于其他各组。考虑到各组水质会因投喂及轮虫自身代谢导致恶化过快,本试验中于第2天开始对各组进行换水操作,一定程度上改善了水质。但从G组氨氮、亚硝酸盐、硝酸盐等指标能够明显看出,随着轮虫繁殖,密度的增加,水质也会逐渐变差。这说明在轮虫培养过程中,其自身代谢与饵料对水质污染具有叠加和累积效应。因此,培养轮虫时,水质管理及调控操作的核心是找到饵料投入、轮虫数量及采收或换水时间间的平衡关系,使投入产出达到理想水平。
3.2 饵料营养对轮虫密度的影响
研究表明,饵料的单一会直接影响轮虫的增殖[21]。周立斌等[22]报道,以酵母+微拟球藻混合投喂轮虫,7 d后轮虫密度可由30 ind./mL增长至155 ind./mL,单独投喂酵母组次之,而二者均优于投喂微拟球藻组。另有研究发现,仅以酵母投喂轮虫时,其种群密度过早进入平台期,之后较难再增长,表现出营养缺乏的现象[23]。Hirayama等[24]以淡水小球藻Chlorella vulgaris(k-22)添加维生素 B12培养轮虫,效果明显优于不添加的对照组,表明维生素等微量元素可能是投喂单一饵料时的营养限制因子。本试验中,分别投喂微拟球藻与裂殖壶藻、发酵废液、发酵废液固型物的E、F、G组轮虫密度增长要高于单一饵料投喂的各组,表明饵料多样化有利于轮虫繁殖。仅投喂微拟球藻的A组轮虫密度呈先升后降趋势,而所监测的水质指标相对较好,排除不良水质的影响,可看出其应存在营养不足的问题。值得注意的是,A组轮虫的抱卵率在第4天时也处于较高水平,随后密度下降,表明微拟球藻的营养可以维持轮虫存活及繁殖,但可能影响其卵与幼体的质量,导致幼体发育受阻或抗逆性差,以及最终成活率下降。
裂殖壶藻富含二十二碳六烯酸(DHA),也是轮虫培养过程中常用的营养强化饵料[25]。宋晓金等[26]以80 mg/L的裂殖壶藻干粉强化褶皱臂尾轮虫12 h,结果表明,轮虫体内DHA/FA值为13.4%,干燥轮虫粉中DHA含量比只投喂绿球藻的对照组高出132%,且轮虫密度也明显增加。本试验中,单独投喂裂殖壶藻的C组轮虫抱卵量及最终密度均处于较低水平,与上述报道不一致,推测原因可能是两项研究所用饵料性状(前者为冻干粉,本试验为冷冻藻液)及培养时长(前者12 h,本试验7 d)不同。与A组结果类似,仅投喂裂殖壶藻其营养不足的问题有可能会随着时间累积,最终表现出轮虫密度降低。除此之外,臂尾轮虫摄食粒径上限应在10 μm以内,适合粒径为4.5 μm[27]。本试验中所用裂殖壶藻的粒径多在10 μm以上,而微拟球藻多在5 μm以内,两种饵料粒径不同也会影响轮虫的摄食,表现为种群密度的差异。本试验表明,单一的微藻饵料很难满足轮虫的高密度培养,这与已有的报道相一致[21-23],表明轮虫培养过程中饵料多样化及组合投喂的重要性。
3.3 发酵废液用于轮虫规模化培养的可行性
褶皱臂尾轮虫是多数海水虾蟹类和鱼类育苗优质而不可或缺的生物饵料。小球藻、微拟球藻等微藻含有较丰富的蛋白质、脂肪,尤其是二十二碳五烯酸(EPA)等不饱和脂肪酸含量较高,加之其大小合适,培养技术相对成熟,对水质污染少,已被广泛应用于轮虫培养[7-8]。实际生产中必须考虑到大量培养微藻的成本因素,一般少有全程使用微藻培养轮虫,而其多用于投喂前的营养强化。中华绒螯蟹等种类的池塘生态育苗需要大量的轮虫,通常要用多于育苗池塘面积几倍的室外土池塘定向培养微拟球藻,即便如此,藻类仍较难满足需求,轮虫产量仍然是限制蟹苗产量的最主要因素。为了保证轮虫产量,生产中通常使用发酵鸡粪,其分解的有机物能直接被轮虫利用,另一方面鸡粪也能作为肥料促进藻类及微生物的生长,进一步转化为轮虫的食物。根据本试验结果,从营养角度分析,发酵鸡粪增加了饵料的多样性,对轮虫生长及其自身营养组成有益。但使用未经处理或处理方法不当的粪肥有可能引入病原生物,给轮虫培养及后续苗种生产造成了生物安全隐患,尤其粪肥中时有抗生素、重金属等有害物质,致使水产品中有害物残留风险增加[28]。因此,寻找培养轮虫的适合饵料对产业具有重要的应用价值。
本试验中对维生素C生产过程产生的发酵废液及其与不同饵料组合投喂褶皱臂尾轮虫的效果进行了评价,认为该发酵废液具有较好的营养价值,但在室温下易污染、分解,性状不稳定,对水质产生较大影响,不应直接施用。建议将发酵废液进行固液分离,其中,固型物可配合微藻投喂轮虫,液相部分可作为液体肥料培养藻类,以藻养虫。然而,因药厂生产条件各异,发酵废液性状多样,现阶段也无标准储运的方法,这些均可能影响其使用效果。另外,在使用过程中,发酵废液与微藻等其他饵料的配比对轮虫生长、繁殖及营养组成的影响,以及发酵废液是否能进行进一步的发酵后使用,均有待深入研究。
总之,将此发酵废液用于水产生物饵料培养是一举多得且可行的方案,但其中仍然有大量的研究工作需要开展。
[1] Ritala A,Häkkinen S T,Toivari M,et al.Single cell protein—state-of-the-art,industrial landscape and patents 2001-2016[J].Frontiers in Microbiology,2017,8:2009.
[2] 冯美卿.生物技术制药[M].北京:中国医药科技出版社,2016.
[3] 吕淑霞,赵朔,杨宇,等.混合菌发酵L-山梨糖生产Vc前体2-酮基-L-古龙酸研究进展[J].生物技术通报,2011(5):50-54.
[4] Ozyurt M,Deveci U D.Conversion of agricultural and industrial wastes for single cell protein production and pollution potential reduction:a review[J].Fresenius Environmental Bulletin,2004,13(8):693-699.
[5] Tacon A G J,Metian M.Global overview on the use of fish meal and fish oil in industrially compounded aquafeeds:trends and future prospects[J].Aquaculture,2008,285(1-4):146-158.
[6] 李永涵.水产饵料生物学[M].大连:大连出版社,2002.
[7] 张继红,任丹丹,姜玉声,等.微藻营养价值及其在水产生物营养强化中的应用[J].食品工业科技,2016,37(20):371-376.
[8] 窦雅秋,李晓东.臂尾轮虫的饵料基础研究进展[J].水产科学,2002,21(3):31-33.
[9] Lubzens E,Zmora O,Barr Y.Biotechnology and aquaculture of rotifers[J].Hydrobiologia,2001,446(1):337-353.
[10] 陈炜,白永安,李晓东,等.春夏季辽宁盘锦地区土池培养的小球藻总脂肪含量和脂肪酸的组成分析[J].大连海洋大学学报,2013,28(6):585-588.
[11] 艾桃山,余姣龙,邓平,等.不同配比的发酵鸡粪和发酵菜粕对轮虫的饲喂效果[J].当代水产,2014(1):83,85.
[12] 王金秋,李德尚,曹吉祥.5种淡水浮游藻对萼花臂尾轮虫饵料效果的比较研究——藻的最适投喂密度及轮虫相应的种群增长[J].海洋与湖沼,1998,29(1):15-21.
[13] 王鸿鹄,吴灶和,廖永岩.用酵母高密度培养褶皱臂尾轮虫[J].水产科学,2009,28(4):225-228.
[14] Tamaru C S,Murashige R,Lee C S,et al.Rotifers fed various diets of baker's yeast and/or Nannochloropsis oculata and their effect on the growth and survival of striped mullet (Mugil cephalus) and milkfish (Chanos chanos) larvae[J].Aquaculture,1993,110(3-4):361-372.
[15] 赵文.盐水轮虫的生物学及海水培养利用[M].北京:科学出版社,2015.
[16] 殷旭旺,牛翠娟.pH对5种臂尾轮虫后代存活率和混交雌体率及种群内禀增长率的影响[J].水生生物学报,2009,33(2):342-347.
[17] 邓平,喻运珍,艾桃山,等.轮虫的培育条件和饵料基础研究进展[J].安徽农业科学,2014,42(26):9054-9056.
[18] 刘青.日本高密度培养轮虫的现状与展望[J].大连水产学院学报,2007,22(4):299-305.
[19] 邹京京,赵文.褶皱臂尾轮虫抗逆性作用机制研究进展[J/OL].大连海洋大学学报:1-9(2020-01-17)[2020-03-23].https://doi.org/10.16535/j.cnki.dlhyxb.2019-244.
[20] 张舒,牛翠娟,殷旭旺.pH与氨的交互作用对壶状臂尾轮虫(Brachionus urceolaris)种群增长、繁殖及存活的影响[J].生态学报,2008,28(10):4815-4822.
[21] 耿瑞静,陈健安,王卫民.不同饵料对褶皱臂尾轮虫生长繁殖的影响[J].水产科技情报,2018,45(2):103-107.
[22] 周立斌,周桂英.2种饵料及其混合物对L-型褶皱臂尾轮虫生长繁殖的影响[J].惠州学院学报,2014,34(6):8-12.
[23] Rehberg-Haas S,Meyer S,Lippemeier S,et al.A comparison among different Pavlova sp.products for cultivation of Brachionus plicatilis[J].Aquaculture,2015,435:424-430.
[24] Hirayama K,Maruyama I,Maeda T.Nutritional effect of freshwater Chlorella on growth of the rotifer Brachionus plicatilis[J].Hydrobiologia,1989,186:39-42.
[25] Yamasaki T,Aki T,Mori Y,et al.Nutritional enrichment of larval fish feed with thraustochytrid producing polyunsaturated fatty acids and xanthophylls[J].Journal of Bioscience and Bioengineering,2007,104(3):200-206.
[26] 宋晓金,张学成,朱路英,等.用富含DHA的裂殖壶菌对轮虫进行营养强化的研究[J].海洋科学,2007,31(12):43-46.
[27] Baer A,Langdon C,Mills S,et al.Particle size preference,gut filling and evacuation rates of the rotifer Brachionus ‘Cayman’ using polystyrene latex beads[J].Aquaculture,2008,282(1-4):75-82.
[28] 聂湘平,王翔,陈菊芳.水产养殖与有毒有害污染物残留及其环境影响[J].环境科学与技术,2007,30(4):106-110.