中国是世界第一水产养殖大国,水产养殖总产量占世界养殖总产量的60%以上。2018年,中国渔业产值为12 815.41亿元,约占农业总产值的21%,水产品总产量为6457.66万t,其中,养殖产量为4991.06万t,捕捞产量为1466.60万t,养殖产量远超捕捞产量[1]。
在自然界中,许多环境因素对水生动物的生长、发育和繁殖等有重要影响[2],如气候、季节、溶氧、光照等。“万物生长靠太阳”,光被认为是影响水生生物生长、发育和生存的关键环境因素之一[2-3]。水生生物在其不同的生长发育阶段,以及应对不同的生产要求时,需要构建不同的光照调控策略,然而目前对水生生物的光生物效应(包括生物钟、光合作用、生物光谱、光化学、光敏化作用、光感受、光视觉、光运动等)及其变化规律还存在认识不足[4-5]。近年来,随着水产养殖业的快速发展,人工光源(金卤灯、白炽灯、碘钨灯、荧光灯和LED灯)虽越来越多地应用于生产中,但仍存在光照(光谱、光照强度和光周期)的精准调控技术和光配方尚未建立,生产中的光环境调控多依赖操作人员的经验,未形成养殖过程不同阶段的精准光环境调控体系等问题。
随着光电技术的发展,发光二极管(Light-emitting diode,LED)作为第四代新型照明光源,不仅节能环保、光电转换效率高、寿命长、发热低、冷却负荷小[2],还具有光照强度、光质、频谱组合可调节等优点。其兼具光、电、热等多种优良特性(高光效、低功耗、低发热等)及结构方面的优势(如体积小、重量轻、安全性高等)[3],使之在各领域的应用中逐步取代传统光源的地位,具有广泛的应用前景[2-3]。随着中国水产养殖业的转型升级、绿色发展和捕捞业的技术进步,对LED光源的需求日益增加。本文综述了近年来LED照明技术在渔业中的研究与应用现状,以期为LED技术在渔业领域的应用提供理论参考和实践指导。
1 LED技术的发展现状
LED从投入市场到现在已有40多年的历史,目前LED技术指标大幅提升,应用进入了一个繁荣成熟的新时期[4]。2018年,中国半导体照明产业产值达7374亿元(http://it.chinairn.com/news/20200228/115127752.html,2020.2.28),关键技术并跑国际,创新应用技术长足进步,主要体现在: (1)功率型白光LED光效超过200 lm/W,与国际水平持平,LED批量制造水平的光效约150 lm/W,远超传统光源[5]; (2)自主知识产权的硅基LED技术全球领先,功率型硅基LED芯片产业化光效达到170 lm/W,硅基黄光(565nm@20A/cm2)电光转换功率效率达到26.7%(“硅基金黄光LED”项目落户赣江新区, 经济晚报2019.07.31); (3)在高品质、全光谱LED技术方面,当前已有双蓝光+多色荧光粉混色的生产应用,最大程度让LED接近太阳光谱;(4)显示驱动技术不断创新,LED小间距显示及Mini LED蓝绿显示芯片外延尺寸及优良率方面均有较大水平提升,达到产业化需求; (5)在元器件方面,开发了SMD0606/0404、COB和四合一封装技术,四合一封装采用倒装工艺,能够最大程度地提供LED芯片的有效发光面积和散热面积,进一步提升产品光学特性和可靠性; (6)UVC-LED核心高铝组分材料技术取得突破,通过纳米图形蓝宝石衬底,实现位错密度降低3倍以上。武汉光电国家研究中心应用单片集成技术获得了国际上UVC-LED芯片最高电光转换效率值21.6%,为实现高效深紫外LED提供了新思路。随着研发投入的加大和生产应用的不断扩大,LED技术正呈现加速进步的态势,同时成本的快速降低,为LED照明技术在水产养殖领域应用迎来更广阔的发展空间。
2 LED技术在渔业中的研究应用
2.1 光照对水产动物生长发育的影响及作用
光照是影响水生生物生长与行为最重要的环境因子之一,也是其内源节律的启动因子[6]。适宜的光照环境(光谱、光强、光周期)对水生动物的生长和发育具有重要促进作用,而不适的光照环境会造成养殖动物的生长阻滞、畸形、胁迫甚至死亡[7]。由于不同波长的光在水体中传播能力存在差异,造成自然水域中的光环境十分复杂,水生动物经过亿万年进化适应,已形成了独特的感光系统,如鱼类通过视网膜与松果体的光感受器接收光信号[8],而贝类除头足纲类具有复杂结构的眼外,通常无头、眼,或具有简单的眼部结构[9]。
2.1.1 光谱 不同波长的光在自然水体中的传播能力不同,长波长和紫外线光在水体中很快被吸收或被散射,而短波长光在水体中具有较强的穿透力,因此,形成了上层水体中长波长、中波长、短波长光均存在,而底层以短波长为主的光谱环境[10]。由于不同水生生物在自然界中所处的光环境不同,其适宜生长的光环境亦存在差异[10],如在鱼类中,条斑星鲽Verasper moseri在绿光下的生长速度显著快于红光[8];虹鳟Oncorhynchus mykiss在蓝光下生长速率显著降低,肝脏总脂、血糖含量降低,大脑多巴胺能和五羟色胺能神经元活性升高[9];大菱鲆Scophthalmus maximus仔稚鱼最适光谱具有阶段特异性,随着变态过程的进行,最适光谱逐渐由全光谱向短波长的蓝光迁移[7];雄性罗非鱼Oreochromis niloticus在蓝光下的繁殖行为,如清除砂砾和建筑巢穴的能力加强[10]。在贝类中,蓝光和绿光能显著提高皱纹盘鲍Haliotis discus hannai Ino幼体的孵化率和变态率,并且随光强的增加而减少,而红光和橙光显著增加担轮幼虫畸形率和变态所需时间,且随光强的增加有显著升高的趋势[11]。在甲壳类中,绿光能显著增加红壳色中华绒螯蟹Eriocheir sinensis仔蟹的生长,而黄光则对正常壳色仔蟹更为有利[12]。
2.1.2 光照强度 光照强度在水体中随水深的变化改变较大,表层水光强较高,而底层水光强较弱,在长期的进化适应中,不同水层生物的光感受器结构存在较大差异,以适应各自栖息地的光环境[13]。以鱼类为例,半滑舌鳎仔鱼早期阶段视网膜会聚程度低、视敏度较高且光感受细胞为高密度的单锥细胞,适应于表层强光环境,而变态后,视网膜会聚程度增加,视敏度下降,视杆细胞密度增大,适应于底栖弱光环境[14];光强对生物的生长影响显著,高强度蓝光会引起大西洋鲑Salmo salar的急性应激反应[15];银鲫Carassius auratus gibelio幼鱼生长的最佳光强为0.03~1.08 μmol/(m2·s),其在黑暗环境中易发生肝胰脏氧化应激,而当光照强度增加到9.46 μmol/(m2·s)时,血浆皮质醇、葡萄糖和乳酸含量会显著升高[16];皱纹盘鲍在蓝、绿光下,随着光强的增加,壳长、壳宽和特定生长率均有下降趋势,而在白光下当光强达到40 μmol/(m2·s)时,幼虫变态规格显著减小[17];三疣梭子蟹Portunus trituberculatus在1500 lx光强下受到较少胁迫,表现出较高代谢水平[18]。
2.1.3 光周期 水生动物生存的水体环境是动态的,昼夜交替和季节交替是自然环境的重要特点,为了适应这种变化,鱼类进化出了内源性计时机制,即生物钟[19],如斑马鱼幼体在孵化后5 d就表现出运动行为的昼夜节律,对应于主动游泳行为和觅食活动的开始[20]。在硬骨鱼类中,光信号被视觉或非视觉感受器接收后,通过神经信号转导及激素信号传递等过程,传递至松果体,影响褪黑素分泌,并最终对鱼类生长、发育和行为产生重要影响[20],如黑线鳕Melanogrammus aeglefinus在短光照(<12L)条件下,孵化期显著延长[21];条纹婢Latris lineata在24L∶0D和18L∶6D光周期下,生长率显著高于12L∶12D时,且18L∶6D的光周期能显著提高仔鱼开鳔后的活力[22]。光周期对甲壳类和软体动物的生长也有重要影响,如在红光下,4L∶20D和8L∶16D是促进皱纹盘鲍摄食和生长、减少氧化应激的最佳光周期,但当光照时间超过12 h时,淀粉酶、纤维素酶、胃蛋白酶活力均受到显著抑制[17];红螯螯虾Cherax quadricarinatus在12L∶12D和18L∶6D光周期下生长速度最快,蜕壳频率最高,而在18L∶6D和24L∶0D光周期下成活率最高[23]。主要水产养殖种类的光环境调控参数示例如表1所示。
表1 主要水产养殖种类的光环境参数调控示例
Tab.1 Examples of light environment regulation parameters in main farmed aquatic animal species
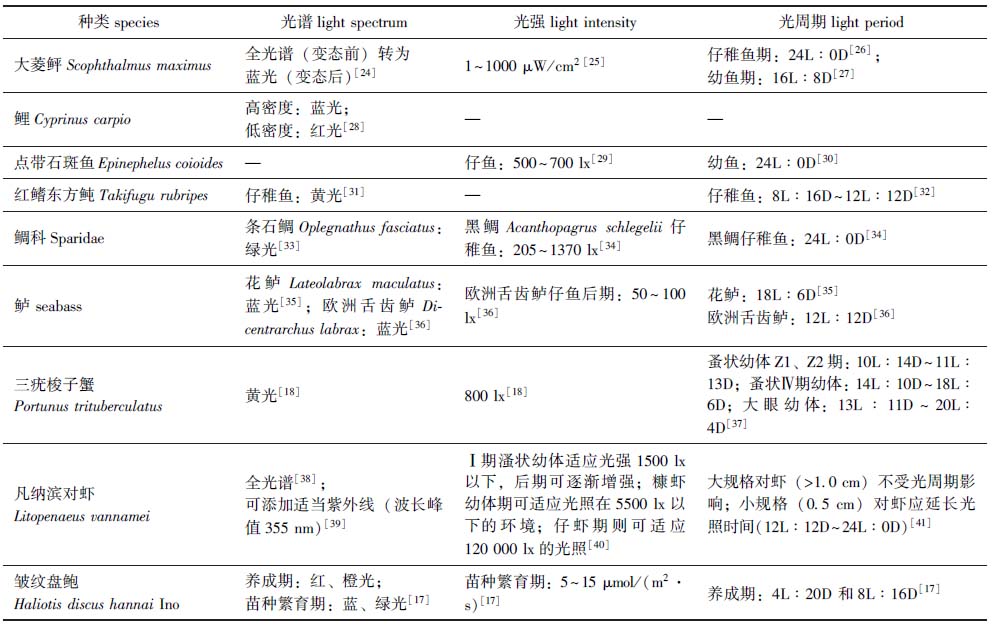
种类species光谱light spectrum光强light intensity 光周期light period大菱鲆Scophthalmus maxi-mus全光谱(变态前)转为蓝光(变态后)[24]1~1000 μW/cm2 [25]仔稚鱼期:24L∶0D[26];幼鱼期:16L∶8D[27]鲤Cyprinus carpio高密度:蓝光;低密度:红光[28]——点带石斑鱼Epinephelus co-ioides—仔鱼:500~700 lx[29]幼鱼:24L∶0D[30]红鳍东方鲀Takifugu ru-bripes仔稚鱼:黄光[31]—仔稚鱼:8L∶16D~12L∶12D[32]鲷科Sparidae条石鲷Oplegnathus fascia-tus:绿光[33]黑鲷Acanthopagrus schlegelii仔稚鱼:205~1370 lx[34]黑鲷仔稚鱼:24L∶0D[34]鲈 seabass花鲈Lateolabrax macula-tus:蓝光[35];欧洲舌齿鲈Dicentrarchus labrax:蓝光[36]欧洲舌齿鲈仔鱼后期:50~100 lx[36]花鲈:18L∶6D[35]欧洲舌齿鲈:12L∶12D[36]三疣梭子蟹Portunus trituberculatus黄光[18]800 lx[18]蚤状幼体Z1、Z2期: 10L∶14D~11L∶13D;蚤状Ⅳ期幼体: 14L∶10D~18L∶6D;大眼幼体: 13L∶11D~20L∶4D[37]凡纳滨对虾Litopenaeus vannamei全光谱[38];可添加适当紫外线(波长峰值355 nm)[39]Ⅰ期溞状幼体适应光强1500 lx以下,后期可逐渐增强;糠虾幼体期可适应光照在5500 lx以下的环境;仔虾期则可适应120 000 lx的光照[40]大规格对虾(>1.0 cm)不受光周期影响;小规格(0.5 cm)对虾应延长光照时间(12L∶12D~24L∶0D)[41]皱纹盘鲍Haliotis discus hannai Ino养成期:红、橙光;苗种繁育期:蓝、绿光[17]苗种繁育期:5~15 μmol/(m2·s)[17]养成期:4L∶20D 和8L∶16D[17]
2.2 LED技术在水产杀菌消毒中的应用
随着水产养殖业的快速发展,污染导致的养殖环境恶化和病害时有发生。养殖生产中主要病害生物有病毒、细菌、真菌、寄生虫及其他一些病原。2018年,全国水产技术推广总站共监测到水产养殖动物发病种类66种,各类主要疾病38种,因病害造成的经济损失约450亿元,其中弧菌属引起的9种细菌疾病造成南美白对虾损失117.8亿元[42]。产业急需高效无污染的有害微生物物理灭活处理技术与产品,目前生产中多采用广谱安全高效的紫外线消毒技术。传统的紫外汞光源灯管在水中破碎易造成严重污染,发光效率与寿命受温度与电压波动影响大,而且360度发光,光学设计需要较大的空间;2017年中国批准加入的《关于汞的水俣公约》正式生效[43],禁汞步伐正加快推进。而半导体固体材料的紫外发光二极管(UV- LED)具有节能、环保和体积小巧等优点,在杀菌消毒和生化检测等领域具有广阔的应用空间。近年来,UV-LED技术在水产领域的研发应用逐渐增多。紫外(Ultra Violet,UV)光通常分为UVA(315~400 nm)、UVB(280~315 nm)、UVC(200~280 nm)及VUV(10~200 nm)[44]。UVC 波段波长短、能量高,紫外光子的吸收导致DNA和RNA结构发生变化,失去复制能力,从而导致细胞死亡[45],达到直接杀灭或抑制病原微生物繁殖的作用。UV-LED是一种极具替代汞紫外线灯潜力的新型紫外光源,其具有不含汞、节能环保、寿命长、高速开关可控制、光源形状封装可定制、光输出角度小、形状易设计等特点,随着UV-LED外量子效率的不断提升,有望在生产中全面取代低压紫外杀菌汞灯。
2.2.1 UV对养殖水体病原微生物的杀灭作用 传统UV辐射消毒光源可短时间有效杀灭细菌、病毒、霉菌、线虫卵等,且具有连续处理大量水体的能力,已被广泛应用于大规模的水产育苗和养殖生产中。用UV消毒处理养殖水环境,能使美国红鱼Sciaenops ocellatus育苗成活率由对照组的28.1%提高到32.7%[46];用253.7 nm的紫外线杀菌灯照射50 min,对中华鳖和乌鳢体表致病菌有较好的杀灭效果[47];将253.7 nm的紫外线管灯安装在水处理工艺的后端,能使半滑舌鳎Cynoglossus semilaevis的特定增长率从对照组的0.99%提高到21.71%,而且亚硝酸氮平均浓度降低 21.6%[48];用剂量为1188 J/m2的UV(253.7 nm)辐照水中大西洋鲑Salmo salar胰腺坏死病毒(IPNV),显示灭活量达到3 log(减少量为99.9%)[49];用剂量约为0.1 J/cm2的UV辐照附着在鲑鱼体表的海虱,灭活率可达99%[50];使用10支30 W的“黑光灯”,经142 d生产试验,池塘平均增产820 kg/hm2[51]。消毒作为水产养殖生产的必要水处理环节,UV或UV结合臭氧已成为生产中对水体病原微生物进行杀灭的必要设备,如中科院海洋所和大连海洋大学分别为大西洋鲑、红鳍东方鲀的循环水养殖企业设计78套(120 W汞灯,45盏/套)、18套封闭管道式系统(120 W汞灯,18盏/套),安装在生物滤池后端,系统运行和水体微生物杀灭效果均良好。
2.2.2 UV-LED对养殖水体的消毒应用 用UVA波段灯光诱虫,增加鱼类饲料动物蛋白的研究报道较多,并且增产效益显著,但实际使用的都是紫外汞灯(波长330~400 nm,俗称“黑光灯”)[52-53]。养殖基地大多在野外远离电网的偏僻地方,波长为360~400 nm的UVA-LED,外量子效率与蓝光LED水平接近,达到46%~76%[54]。目前,国内尚未见UVB对水产动物新陈代谢机理影响的研究报道,国外报道显示,很少量的UVB可诱发剑尾鱼Xiphophorus hellerii皮质醇的反应[55],UVB水平的增加对三刺鱼Gasterosteus aculeatus雄鱼交配后适应度相关性状有影响[56]。气体放电低压汞灯,其总气体压力为100~1000 Pa,主发射波长为UVC波段253.7 nm,功率为5~100 W,辐射效率在30%左右,寿命可接近1万h[57]。
2.3 LED技术用于微藻培养
微藻是双壳贝类育苗的饵料,也是鱼虾育苗生产中轮虫、卤虫等次级饵料的最初食物,还可用作饲料添加剂,提高水产动物免疫力,提升水产品品质。此外,微藻还具有移除水中氨氮、净化水质、提供氧气等重要作用,因此,微藻对维持优质养殖水环境、增加天然饵料供给、减少养殖尾水排放、构建生态健康养殖模式意义重大[58]。
微藻培养经常受天气影响,因此,微藻生产需考虑人工补光。若将微藻生物质用作高价值产品(例如食物或饲料添加剂,如类胡萝卜素和多不饱和脂肪酸)时,人造光源在经济上也是可行的[59]。人造光源可以更好地调节微藻生产中的光照强度、光周期和光谱,以提高微藻生物量产率和光合效率,目前主要微藻品种受光环境调控的研究进展如表2所示。作为最重要的人造光源,LED将在微藻培养中得到广泛应用。应用LED光源时,理论上微藻光合效率可达17%[60], 但目前所能达到实际值还比较有限[59,61], 是产业应用的重要瓶颈。究其原因,在于光能从供给侧(光源)到需求侧(微藻细胞)的传递过程中大部分以热的形式损失。
2.3.1 光照强度 微藻通过光合作用合成与呼吸作用消耗的物质达到平衡时的光照强度称为光补偿点(light compensation point,LCP)。超过光补偿点后,光合速率随光照强度线性增加,超过某个阈值,就会发生光饱和,此时光照强度即光饱和点(light satuvation point,LSP)。光抑制是光能超过光合系统所能利用的数量时,光合功能下降的现象,光抑制主要发生在光系统(photosystem I,PSI),是微藻细胞本身的保护性反应[62]。目前已有大量试验研究了光照强度对微藻光合作用及色素积累的影响,表明高光强可以诱导微藻中功能性色素的大量积累[63-64],同时,对微藻光合系统的高光强胁迫所导致活性氧的产生机制及防御与保护机制也进行了研究[65];此外,光照强度对碳分配和储能物质合成影响的研究表明,提高光强度可以增加微藻细胞中脂质含量[66-67]。
2.3.2 光谱 不同微藻光合作用系统中含有不同色素,不同色素会吸收不同波长的光,而类胡萝卜素等色素会阻碍某一波长范围光的吸收,所以不同光谱光源造成不同的生物学效应,其影响机理非常复杂。已有试验表明,LED不同光谱对微藻生长、形态、光合作用效率和次级代谢产物积累等均具有重要的调节作用:利用红色LED可使小球藻Chlorella vulgaris的光合效率提高118%[68];通过增加红光比例,可将莱茵衣藻的光合效率提高14%[58];微拟球藻在红光下的生物质产率是蓝光的3倍,但相比红光,在蓝光下脂质含量可以提高20%[69-70];红光更能促进蔷薇藻β-胡萝卜素的积累[71]。目前,对多光谱的研究主要集中在红蓝单色光和红蓝双色混合光方面,对于包括紫外线在内的其他多谱光质的研究较少,而多谱混合光质可能产生协同作用,更有利于微藻的生长和物质合成[72]。
表2 主要微藻品种受光环境调控示例
Tab.2 Examples of light environment regulation of main microalgae species
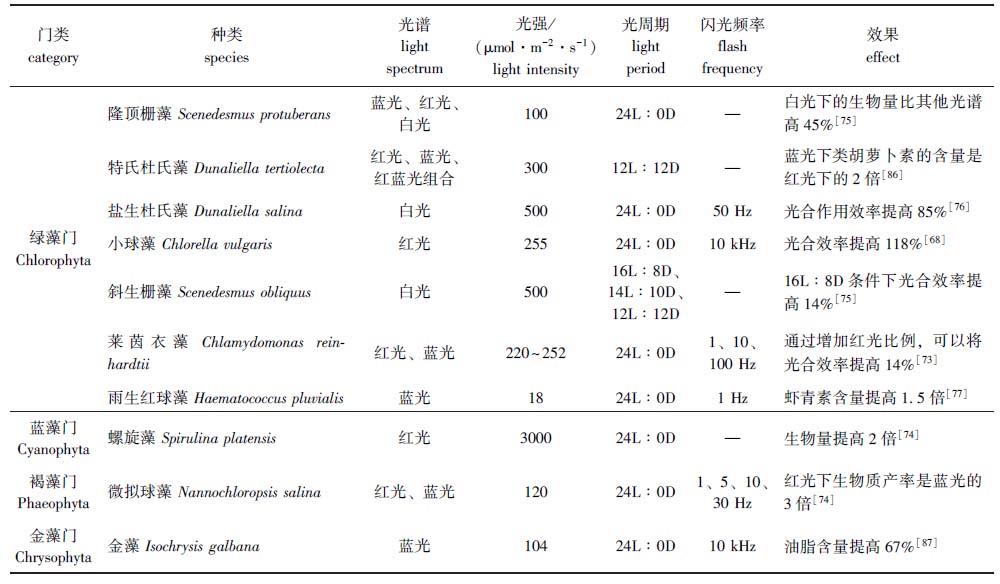
门类category种类species光谱light spectrum光强/(μmol·m-2·s-1)light intensity光周期light period闪光频率flash frequency效果effect绿藻门Chlorophyta隆顶栅藻 Scenedesmus protuber-ans蓝光、红光、白光10024L∶0D—白光下的生物量比其他光谱高45%[75]特氏杜氏藻 Dunaliella tertiolecta红光、蓝光、红蓝光组合30012L∶12D—蓝光下类胡萝卜素的含量是红光下的2倍[86]盐生杜氏藻 Dunaliella salina白光50024L∶0D50 Hz光合作用效率提高85%[76]小球藻 Chlorella vulgaris红光25524L∶0D10 kHz光合效率提高118%[68]斜生栅藻 Scenedesmus obliquus白光50016L∶8D、14L∶10D、12L∶12D—16L∶8D条件下光合效率提高14%[75]莱茵衣藻 Chlamydomonas rein-hardtii红光、蓝光220~25224L∶0D1、10、100 Hz通过增加红光比例,可以将光合效率提高14%[73]雨生红球藻 Haematococcus plu-vialis蓝光1824L∶0D1 Hz虾青素含量提高1.5倍[77]蓝藻门Cyanophyta螺旋藻 Spirulina platensis红光300024L∶0D—生物量提高2倍[74]褐藻门Phaeophyta微拟球藻 Nannochloropsis salina红光、蓝光12024L∶0D1、5、10、30 Hz红光下生物质产率是蓝光的3倍[74]金藻门Chrysophyta金藻 Isochrysis galbana蓝光10424L∶0D10 kHz油脂含量提高67%[87]
2.3.3 频闪光 相比连续光照,高强度但照射时间极短的频闪光可以减少光在生物反应器中的衰减,而且可避免连续强光照射引起的微藻光合作用系统损伤和抑制[73]。频闪光可以减少光衰减,是提高光合效率的有力手段。相比连续光照,使用频闪光能使莱茵衣藻生物质产率提高40%[58],小球藻[74]和螺旋藻[75]中的生物质产率提高,栅藻中的生物量产率提高3倍[75];与连续光照相比,弱连续背景光加频闪光可使盐生杜氏藻光合效率增加85%[76],频闪光能使雨生红球藻最终虾青素含量和生物量浓度提高,将虾青素单位产量能耗降低70%[77];另有研究表明,在1 Hz频闪光下虾青素含量(干重)比连续光照高1.5倍[78]。
频闪效应不仅可以通过改变光源实现,还可通过反应器中流体混合实现光暗循环,即微藻因为流体运动在反应器中实现光区和暗区的循环。研究表明,提高光暗循环频率可以显著改善微藻生物质产率[79];在开放池内部增设挡板来提高其混合效果,可将光暗循环频率循环一次的时间从12 s提高到1 s(即1 Hz),微藻生产效率提高了32.6%[79];在平板反应器中增设挡板,可将光暗循环频率循环一次的时间从17.8 s提高到4.6 s,相应生物质产率提高了70%[80];特殊设计的光生物反应器中,通过提高光暗循环频率最高可将生物质产率提高到原来的2倍,而且实现了高密度培养[81]。以上研究初步显示了频闪LED在微藻培养方面的巨大潜力,但还有许多问题亟待解决,例如,理论上来说,把闪光频率提高到生物响应时间范围内,飞秒(fs)至皮秒(ps)级别,可能会极大提高光合效率,但由于技术原因,目前尚未能进行试验验证[73,82]。
2.3.4 光周期 与其他生物一样,微藻也受生物钟调节,自然界中微藻很好地适应了光暗周期。如有些微藻细胞分裂生殖发生在暗周期,而细胞生长在光周期,在细胞分裂过程中即使提供光照,光能也被浪费,导致光合作用效率降低[83]。光暗周期还导致微藻细胞中蛋白质、碳水化合物、脂质等成分变化,而这也会影响生物质产率[81]。研究表明,微拟球藻、三角褐指藻在24 h连续光照下生长最快,但金藻在18L∶6D的光照模式下生长最快,微拟球藻、三角褐指藻在连续光照条件下总脂肪酸含量最高,而金藻在18L∶6D的光照模式下总脂肪酸含量最高[84-85];在富油新绿藻的研究中,14L∶10D光照条件下光合效率是连续光照条件下的2倍,但是不同光周期对细胞组成成分没有显著性影响[83];在盐藻积累胡萝卜素的研究中,发现14L∶10D的光暗周期且光强度遵循正弦波变化条件下,β-胡萝卜素的产量比连续光照提高30%[81]。
2.4 LED技术在远洋捕捞渔业中的应用
2.4.1 不同种类鱼群的趋光性 光照是影响鱼类行为的重要环境因子之一。通过对视网膜组织研究发现,鱼对各色光有辨别能力,行为学试验进一步研究证明了鱼对不同光色的趋光特点。如通过测试15种海产鱼类对紫外光(337、368 nm)的反应,结果发现有11种鱼有反应,组织学分析显示,鱼眼中央单锥状细胞对紫外光敏感[88]; 鳜鱼苗对5 种颜色光表现出不同程度的趋光性和选择性, 对黄色光和白光的趋光反应最强, 趋光率分别为89.75%和81.82%, 最大可达到93.75%和90.91%[89];眼斑拟石首鱼Sciaenops ocellatus和曼氏无针乌贼Sepiella maindroni对光色和光强均有反应,眼斑拟石首鱼对中强度的橙光和红光表现为正趋性,对其他光强和光色均表现出负趋性,而曼氏无针乌贼对光色和光强均表现出正趋性,对于同一光强下的4种光照颜色,曼氏无针乌贼对红光和绿光的趋光率较高[90-91];奥利亚罗非鱼Oreochromisco aureus在不同单色光同一照度下的趋光率差异显著,在蓝光、绿光下的趋光率高于红光、黄光[92]。
2.4.2 不同光谱LED灯的集鱼效果 LED集鱼灯正快速应用用渔业捕捞中,但不同光谱LED集鱼灯的集鱼效果明显不同。如对5个不同波长单色LED及白光的光效进行比较发现,采用波长为480~505 nm的LED集鱼灯可以引诱多种鱼类,获得最大光效,节能效果更好[93];对白光(偏绿光)LED水下灯和蓝紫光水下灯集鱼效果试验发现,白光LED灯对蓝圆鲹Decapterus maruadsi的光诱效果显著优于蓝紫光LED灯,白光LED灯对竹筴鱼的光诱效果极显著优于蓝紫光LED灯[94];通过分析国产300 W型LED集鱼灯和绿光集鱼灯的光学特性, 并与1、1.5、2 kW型金属卤化物集鱼灯进行比较发现,LED集鱼灯水中穿透性良好,能够满足渔业生产需要[95]。
2.4.3 不同灯具集鱼效果比较 新型LED集鱼灯具集鱼效果良好。通过对3种LED集鱼灯与1种传统金卤灯的生产对比试验发现,LED集鱼灯的渔获率均高于金卤灯,其中LED白光灯渔获率优势明显[96];通过LED集鱼灯替代弧光集鱼灯的实船试验发现,LED集鱼灯的经济效益较为可观[97]。
3 存在问题及展望
3.1 LED技术用于水产养殖生产
从经济成本角度出发,LED光电转化率远高于传统光源,且使用寿命更长,从长远来看,其成本更低,且LED光源配合智能控制系统更加有利于光谱、光强、光周期的精准调控。未来随着工厂化养殖业的快速发展,对光环境调控的需求将急速上升,LED光源应用前景广阔。粗略估计,中国LED灯具增长潜力约为2.95亿元/年。
水产养殖动物种类繁多,对光照需求各异,LED光源对养殖生物的作用和影响机制仍知之甚少。水产养殖车间(尤其是海水养殖车间)高盐高湿易腐蚀的环境特点极大地缩短了传统灯具的使用寿命,而且灯具形状和功率也直接关系到养殖池光线明暗和均匀度,因此,LED技术在养殖生产中的研究应用需关注以下几个方面: (1) 主要养殖品种的光生物效应数据库、光照影响水生生物生长发育的途径与机理、光调控鱼类性腺发育和性别分化机制等基础性研究工作。(2) 水产专用LED灯具研发,包括提高LED灯具的防水性和耐腐蚀性,延长使用寿命。(3) 研发设计不同形状、用途的水产LED灯具,以满足不同养殖时期和养殖操作的光照需求,如苗种繁育期、养成期、促熟期等。(4) 光环境精准调控技术,针对某一物种制定相应的专用灯具和光环境控制策略,从而实现光生物环境效应的精准调控。
3.2 LED技术用于水产杀菌消毒
目前,UVC-LED的外量子效率低,普遍在10%以下,商业化大批量产品光效在3%~5%[98],只有低压紫外汞灯的十分之一左右,主要是材料限制了发光效率,包括外延材料质量差、电注入效率低、光提取效率低等;而单位电功率的价格为低压汞灯的几十倍,所以要获得相同的辐射功率,深紫外LED的成本目前还不能为市场接受。
针对上述UVC-LED存在的问题和水产业杀菌消毒方面的应用需要在以下几方面开展研究:(1)加强在氮化铝外延材料质量的制备攻关,同时提升芯片透明电极、热管理、封装等各个方面的技术,力争不远的将来紫外LED的外量子效率达到25%,期间寿命达到1万小时[99]。(2)加强紫外剂量对水产病原微生物杀灭机理的研究;开展水体颗粒物和水溶物形成的浊度条件下,光的水体透射率的研究;开展水体辐射剂量与透射率测定方法的研究。(3)加强UV-LED在微小环境的应用研发。据预测,UV-LED的市场年增长率平均接近30%,并将加速增长[99]。目前,市场已经开发出便携移动式的碗橱、空气清新柜及扫地机器人等电子消毒器,应加强在水产保鲜运输箱、运输车、销售柜、加工线等狭小空间的产品开发应用。
3.3 LED技术用于微藻培养
尽管利用LED光源培养微藻方面的研究取得了很大进展,但要实现产业上的大规模应用,还有一些问题亟待解决。首先,光源光照强度并不代表着微藻细胞微环境的光照强度,光在反应器中是不断衰减的,但目前研究主要考虑入射光源强度,很少关心平均光强度,而后者才是真正决定微藻利用光能效率的最直接因素,因此,需要有针对性地进行光强度优化。其次,目前对于光谱影响微藻生长的分子机制还不明确,而掌握不同光谱对微藻生长影响的具体分子机制可以对光谱与微藻生长及产物积累进行更精确调控。第三,目前的研究很少将光谱与频闪光结合起来对微藻培养进行研究,而这些研究将显著提高微藻的光合效率及经济效益。频闪光可以诱导微藻生产高含量色素、脂肪酸等代谢产物, 但诱导不同目标产物的最佳闪光灯设置参数尚不清楚,其诱导机制也有待明确。而且,培养过程中混合所造成的光暗循环是否能与频闪光实现叠加效应,如果得以实现,在多大程度上可以进一步提高光合作用效率,这些都需进行深入研究和验证。另外,目前研究光周期变化时,整个光周期一般采取恒定光强度,但在户外培养时太阳光强度遵循正弦波变化,故室内试验结果难以有效指导户外大规模微藻培养。未来研究时,可采用正弦波形式和光暗周期来模拟户外培养条件[83-84],预期将对微藻培养进行人工补光提供重要指导。
针对目前研究和产业应用中存在的上述问题,需要在以下几方面开展研究:(1) 研发能模拟太阳光照射强度和完整光谱的LED光源,详细研究各类微藻中各种色素含量,并考察其光谱的应答情况,从而深入解析光谱控制藻类生长和代谢的机制[100],确定不同微藻生长的最适光谱条件,据此开发相应的理想光源。(2) 研究频闪光源频率、占空比、光照强度等因素对微藻生长和代谢影响,针对不同微藻确定相应的理想条件,为开发理想光源提供依据,并进行实际验证和产业应用。(3) 优化光生物反应器结构和操作条件,减少光传播损失,提高光暗循环频率,从而大幅度提高光的利用效率。(4) 研究光传递与反应器中微藻细胞的碳供应、温度等各要素之间的高效协同机制,据此进行优化控制,提高光合作用效率,实现高密度微藻培养,大幅度提高微藻生物质产率。(5) 结合光照周期、光谱、光强度等研究,优化微藻培养LED人工补光方案,并进行过程放大,在水产饵料微藻培养中开展大规模示范研究。
3.4 LED技术用于远洋捕捞渔业
近年来,中国在大洋渔业方面建造了大量围网、秋刀鱼舷提网等光诱作业渔船,由于企业间的盲目竞争,造成渔船主机功率和灯光功率持续加大,这使得生产成本大大提高,而渔获量未有明显提升。LED集鱼灯因其较好的节能效果,具有良好的发展潜力,建议在以下几方面开展研究工作:(1)加强LED的水下光场特点和鱼类趋光习性研究;加强LED集鱼灯的空间布置(灯架结构和安装角度)研究,在增大有效集鱼面积的同时在海水中形成稳定光场。(2) 加大远洋渔业专用LED集鱼灯研发,目前生产中应用的LED集鱼灯,尚存在散热性不够好、稳定性不高等问题,通过科学的散热方式,降低LED灯的温度,减少在使用过程中的光衰,是目前LED集鱼灯能否取代金卤灯、白炽灯等现有光源的关键。
致谢:李贤、宋昌斌、迟占有、邢斌斌等老师参与了本文的写作!
[1] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2019中国渔业统计年鉴[M].北京:中国农业出版社,2019.
[2] 张云,吕镇城,徐良雄,等.LED红蓝光对植物生长发育和光合特性影响的研究进展[J].惠州学院学报,2019,39(6):33-40.
[3] 徐永,林魁.LED光调控技术在设施农业中的应用研究进展[J].农业工程技术,2017,37(13):10-15,20.
[4] 宋昌斌.LED灯具在工厂化水产养殖的应用情况[J].照明工程学报,2018,29(2):3-4.
[5] 刘岩,敬刚,潘国顺.高性能大功率LED研究进展:973计划“高性能LED制造与装备中的关键基础问题研究”项目成果简介[J].中国基础科学,2016,18(4):1-17.
[6] Villamizar N,Blanco-Vives B,Migaud H,et al.Effects of light during early larval development of some aquacultured teleosts:a review[J].Aquaculture,2011,315(1-2):86-94.
[7] Wu Lele,Han Mingming,Song Zongcheng,et al.Effects of different light spectra on embryo development and the performance of newly hatched turbot (Scophthalmus maximus) larvae[J].Fish & Shellfish Immunology,2019,90:328-337.
[8] Yamanome T,Mizusawa K,Hasegawa E I,et al.Green light stimulates somatic growth in the barfin flounder Verasper moseri[J].Journal of Experimental Zoology Part A:Ecological Genetics and Physiology,2009,311(2):73-79.
[9] Karakatsouli N,Papoutsoglou S E,Pizzonia G,et al.Effects of light spectrum on growth and physiological status of gilthead seabream Sparus aurata and rainbow trout Oncorhynchus mykiss reared under recirculating system conditions[J].Aquacultural Engineering,2007,36(3):302-309.
[10] Volpato G L,Duarte C R A,Luchiari A C.Environmental color affects Nile tilapia reproduction[J].Brazilian Journal of Medical and Biological Research,2004,37(4):479-483.
[11] Gao Xiaolong,Zhang Mo,Li Xian,et al.Effects of light quality and intensity on the growth,survival and metamorphosis of Haliotis discus hannai Ino larvae[J].Aquaculture Research,2017,48(7):3369-3382.
[12] 左炳楠,李晓东,姜玉声,等.光色对红壳色中华绒螯蟹生长、摄食及体色的影响[J].中国渔业质量与标准,2018,8(3):26-33.
[13] Mark M D,Donner M,Eickelbeck D,et al.Visual tuning in the flashlight fish Anomalops katoptron to detect blue,bioluminescent light[J].PLoS One,2018,13(7):e0198765.
[14] 马爱军,王新安,庄志猛,等.半滑舌鳎仔、稚鱼视网膜结构与视觉特性[J].动物学报,2007,53(2):354-363.
[15] Migaud H,Cowan M,Taylor J,et al.The effect of spectral composition and light intensity on melatonin,stress and retinal damage in post-smolt Atlantic salmon,Salmo salar[J].Aquaculture,2007,270(1-4):390-404.
[16] Wei Hui,Li Handong,Xia Yu,et al.Effects of light intensity on phototaxis,growth,antioxidant and stress of juvenile gibel carp (Carassius auratus gibelio)[J].Aquaculture,2019,501:39-47.
[17] 高霄龙.光照对皱纹盘鲍生长、行为、生理的影响及其机制研究[D].青岛:中国科学院研究生院(海洋研究所),2016.
[18] 王馨.光照对三疣梭子蟹行为、呼吸代谢和生长影响的研究[D].青岛:中国海洋大学,2014.
[19] Peirson S N,Halford S,Foster R G.The evolution of irradiance detection:melanopsin and the non-visual opsins[J].Philosophical Transactions of the Royal Society B,2009,364(1531):2849-2865.
[20] Vallone D,Lahiri K,Dickmeis T,et al.Start the clock!Circadian rhythms and development[J].Developmental Dynamics,2007,236(1):142-155.
[21] Downing G,Litvak M K.Effects of light intensity,spectral composition and photoperiod on development and hatching of haddock (Melanogrammus aeglefinus) embryos[J].Aquaculture,2002,213(1-4):265-278.
[22] Trotter A J,Battaglene S C,Pankhurst P M.Effects of photoperiod and light intensity on initial swim bladder inflation,growth and post-inflation viability in cultured striped trumpeter (Latris lineata) larvae[J].Aquaculture,2003,224(1-4):141-158.
[23] 吴志新,陈孝煊,刘小玲,等.不同光周期对红螯螯虾繁殖及生长的影响[J].淡水渔业,2000,30(3):4-5.
[24] Wu Lele,Wang Yunong,Han Mingming,et al.Growth,stress and non-specific immune responses of turbot (Scophthalmus maximus) larvae exposed to different light spectra[J].Aquaculture,2020,520:734950.
[25] Champalbert G,Le Direach-Boursier L.Influence of light and feeding conditions on swimming activity rhythms of larval and juvenile turbot:Scophthalmus maximus L.:an experimental study[J].Journal of Sea Research,1998,40(3-4):333-345.
[26] Puvanendran V,Brown J A.Foraging,growth and survival of Atlantic cod larvae reared in different light intensities and photoperiods[J].Aquaculture,2002,214(1-4):131-151.
[27] Imsland A K,Folkvord A,Stefansson S O.Growth,oxygen consumption and activity of juvenile turbot (Scophthalmus maximus L.) reared under different temperatures and photoperiods[J].Netherlands Journal of Sea Research,1995,34(1-4):149-159.
[28] Karakatsouli N,Papoutsoglou E S,Sotiropoulos N,et al.Effects of light spectrum,rearing density and light intensity on growth performance of scaled and mirror common carp Cyprinus carpio reared under recirculating system conditions[J].Aquacultural Engineering,2010,42(3):121-127.
[29] 陈凯,乔振国.光照条件和开口饵料对点带石斑鱼仔鱼培育成活率的影响[J].现代渔业信息,2011,26(2):25-27.
[30] 逯尚尉.不同饵料、密度和光周期对点带石斑鱼(Epinephelus malabaricus)幼鱼的影响[D].南京:南京农业大学,2010.
[31] 魏平平,李鑫,费凡,等.光谱对红鳍东方鲀仔稚鱼生长及相关基因表达量的影响[J].大连海洋大学学报,2019,34(5):668-673.
[32] 魏平平,李鑫,刘鹰,等.光周期对红鳍东方鲀脑组织中GH和SS基因表达水平和昼夜表达模式的影响[J].大连海洋大学学报,2020,35(1):108-113.
[33] 周光正.温度、光周期和换水率对黑鲷卵、鱼苗的影响[J].海洋信息,1994(1):21.
[34] Choi J Y,Kim T H,Choi Y J,et al.Effects of various LED light spectra on antioxidant and immune response in juvenile rock bream,Oplegnathus fasciatus exposed to bisphenol A[J].Environmental Toxicology and Pharmacology,2016,45:140-149.
[35] Hou Zhishuai,Wen Haishen,Li Jifang,et al.Effects of photoperiod and light spectrum on growth performance,digestive enzymes,hepatic biochemistry and peripheral hormones in spotted sea bass (Lateolabrax maculatus)[J].Aquaculture,2019,507:419-427.
[36] Villamizar N,García-Alcazar A,Sánchez-Vázquez F J.Effect of light spectrum and photoperiod on the growth,development and survival of European sea bass (Dicentrarchus labrax) larvae[J].Aquaculture,2009,292(1-2):80-86.
[37] 王吉桥,李君峰,康凯,等.不同温度和光周期对三疣子蟹幼体成活度的影响[J].北京水产,2004(1):8-10.
[38] 秦菲.凡纳滨对虾(Litopenaeus vannamei)工厂化养殖光照环境优化技术研究[D].青岛:青岛理工大学,2018.
[39] Fei Fan,Liu Baoliang,Gao Xiaoqiang,et al.Effects of supplemental ultraviolet light on growth,oxidative stress responses,and apoptosis-related gene expression of the shrimp Litopenaeus vannamei[J].Aquaculture,2020,520:735013.
[40] 欧黄思,梁华芳.光照对凡纳滨对虾幼体变态发育的影响[J].海洋科学,2017,41(3):55-60.
[41] Sanudin N,Tuzan A D,Yong A S K.Feeding activity and growth performance of shrimp post larvae Litopenaeus vannamei under light and dark condition[J].Journal of Agricultural Science,2014,6(11):103-109.
[42] 农业农村部渔业渔政管理局.2019中国水生动物卫生状况报告[M].北京:中国农业出版社,2019.
[43] 寇江泽.《关于汞的水俣公约》生效[N].人民日报海外版,2017-08-17(02).
[44] Khan A,Balakrishnan K,Katona T.Ultraviolet light-emitting diodes based on group three nitrides[J].Nature Photonics,2008,2(2):77-84.
[45] Nyangaresi P O,Qin Yi,Chen Gguolong,et al.Comparison of the performance of pulsed and continuous UVC-LED irradiation in the inactivation of bacteria[J].Water Research,2019,157:218-227.
[46] 颜阔秋.紫外线水处理技术在水产苗种生产上的应用效果[J].北京水产,2002(4):10-11.
[47] 金宏,金燮理,肖克宇,等.紫外线杀灭中华鳖和乌鳢体表4种致病菌的研究[J].内陆水产,1999(4):2-3,27.
[48] 周游,黄滨,吴凡,等.紫外线位置对循环水养殖半滑舌鳎水环境及生长影响[J].中国工程科学,2014,16(9):78-85.
[49] Øye A K,Rimstad E.Inactivation of infectious salmon anaemia virus,viral haemorrhagic septicaemia virus and infectious pancreatic necrosis virus in water using UVC irradiation[J].Diseases of Aquatic Organisms,2002,48(1):1-5.
[50] Barrett L T,Bui S,Oppedal F,et al.Ultraviolet-C light suppresses reproduction of sea lice but has adverse effects on host salmon[J].Aquaculture,2020,520:734954.
[51] 陈乃武.“黑光灯”诱虫喂鱼增产研究报告[J].渔业致富指南,2005(3):55-56.
[52] 邢湘臣.“灯光诱虫”在渔业生产中的应用[J].水利渔业,1989(3):51.
[53] 崔学贵,张立青,王建法,等.灯光诱虫及专用设备杀虫灯问题研究综述[J].现代农业科技,2011(23):224-226,231.
[54] 薛斌,王军喜,曾一平,等.氮化物紫外LED研究与应用[J].照明工程学报,2020,31(1):1-7.
[55] Contreras A J,Boswell M,Downs K P,et al.Cortisol release in response to UVB exposure in Xiphophorus fish[J].Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology,2014,163:95-101.
[56] Vitt S,Mehlis-Rick M,Bakker T C M,et al.Enhanced ambient UVB radiation affects post-mating,but not pre-mating sexual traits in a fish[J].Oecologia,2019,190(2):355-366.
[57] Masschelein W J.紫外光在水和废水处理中的应用[M].张彭义,译.北京:机械工业出版社,2014:11-13.
[58] Blanken W,Cuaresma M,Wijffels R H,et al.Cultivation of microalgae on artificial light comes at a cost[J].Algal Research,2013,2(4):333-340.
[59] Carvalho A P,Silva S O,Baptista J M,et al.Light requirements in microalgal photobioreactors:an overview of biophotonic aspects[J].Applied Microbiology and Biotechnology,2011,89(5):1275-1288.
[60] Schulze P S C,Barreira L A,Pereira H G C,et al.Light emitting diodes (LEDs) applied to microalgal production[J].Trends in Biotechnology,2014,32(8):422-430.
[61] Zhao Yongjun,Wang Juan,Zhang Hui,et al.Effects of various LED light wavelengths and intensities on microalgae-based simultaneous biogas upgrading and digestate nutrient reduction process[J].Bioresource Technology,2013,136:461-468.
[62] Kong Bo,Shanks J V,Vigil R D.Enhanced algal growth rate in a Taylor vortex reactor[J].Biotechnology and Bioengineering,2013,110(8):2140-2149.
[63] Yang Zongbo,Cheng Jun,Xu Xiaodan,et al.Enhanced solution velocity between dark and light areas with horizontal tubes and triangular prism baffles to improve microalgal growth in a flat-panel photo-bioreactor[J].Bioresource Technology,2016,211:519-526.
[64] Cheng Jun,Yang Zongbo,Ye Qing,et al.Enhanced flashing light effect with up-down chute baffles to improve microalgal growth in a raceway pond[J].Bioresource Technology,2015,190:29-35.
[65] de Winter L,Cabanelas I T D,Martens D E,et al.The influence of day/night cycles on biomass yield and composition of Neochloris oleoabundans[J].Biotechnology for Biofuels,2017,10:104.
[66] Goold H D,Cuiné S,Legeret B,et al.Saturating light induces sustained accumulation of oil in plastidal lipid droplets in Chlamydomonas reinhardtii[J].Plant Physiology,2016,171(4):2406-2417.
[67] Lamers P P,Janssen M,de Vos R C H,et al.Exploring and exploiting carotenoid accumulation in Dunaliella salina for cell-factory applications[J].Trends in Biotechnology,2008,26(11):631-638.
[68] Fu Wenqi,Gudmundsson O,Feist A M,et al.Maximizing biomass productivity and cell density of Chlorella vulgaris by using light-emitting diode-based photobioreactor[J].Journal of Biotechnology,2012,161(3):242-249.
[69] Das P,Lei Wang,Aziz S S,et al.Enhanced algae growth in both phototrophic and mixotrophic culture under blue light[J].Bioresource Technology,2011,102(4):3883-3887.
[70] Lee C G,Palsson B ∅.High-density algal photobioreactors using light-emitting diodes[J].Biotechnology and Bioengineering,1994,44(10):1161-1167.
[71] Cuaresma M,Janssen M,Vílchez C,et al.Horizontal or vertical photobioreactors? How to improve microalgae photosynthetic efficiency[J].Bioresource Technology,2011,102(8):5129-5137.
[72] Abu-Ghosh S,Fixler D,Dubinsky Z,et al.Continuous background light significantly increases flashing-light enhancement of photosynthesis and growth of microalgae[J].Bioresource Technology,2015,187:144-148.
[73] Vejrazka C,Janssen M,Streefland M,et al.Photosynthetic efficiency of Chlamydomonas reinhardtii in attenuated,flashing light[J].Biotechnology and Bioengineering,2012,109(10):2567-2574.
[74] Vadiveloo A,Moheimani N R,Kosterink N R,et al.Photosynthetic performance of two Nannochloropsis spp. under different filtered light spectra[J].Algal Research,2016,19:168-177.
[75] McGee D,Archer L,Fleming G T A,et al.Influence of spectral intensity and quality of LED lighting on photoacclimation,carbon allocation and high-value pigments in microalgae[J].Photosynthesis Research,2020,143(1):67-80.
[76] Abu-Ghosh S,Fixler D,Dubinsky Z,et al.Flashing light in microalgae biotechnology[J].Bioresource Technology,2016,203:357-363.
[77] Katsuda T,Shiraishi H,Ishizu N,et al.Effect of light intensity and frequency of flashing light from blue light emitting diodes on astaxanthin production by Haematococcus pluvialis[J].Journal of Bioscience and Bioengineering,2008,105(3):216-220.
[78] Katsuda T,Shimahara K,Shiraishi H,et al.Effect of flashing light from blue light emitting diodes on cell growth and astaxanthin production of Haematococcus pluvialis[J].Journal of Bioscience and Bioengineering,2006,102(5):442-446.
[79] Liao Qiang,Li Lin,Chen Rong,et al.A novel photobioreactor generating the light/dark cycle to improve microalgae cultivation[J].Bioresource Technology,2014,161:186-191.
[80] Schulze P S C,Guerra R,Pereira H,et al.Flashing LEDs for microalgal production[J].Trends in Biotechnology,2017,35(11):1088-1101.
[81] Nwoba E G,Parlevliet D A,Laird D W,et al.Light management technologies for increasing algal photobioreactor efficiency[J].Algal Research,2019,39:101433.
[82] Vadiveloo A,Moheimani N R,Cosgrove J J,et al.Effect of different light spectra on the growth and productivity of acclimated Nannochloropsis sp. (Eustigmatophyceae)[J].Algal Research,2015,8:121-127.
[83] Glemser M,Heining M,Schmidt J,et al.Application of light-emitting diodes (LEDs) in cultivation of phototrophic microalgae:current state and perspectives[J].Applied Microbiology and Biotechnology,2016,100(3):1077-1088.
[84] He Qiaoning,Yang Haijian,Wu Lei,et al.Effect of light intensity on physiological changes,carbon allocation and neutral lipid accumulation in oleaginous microalgae[J].Bioresource Technology,2015,191:219-228.
[85] Mettler T,Mühlhaus T,Hemme D,et al.Systems analysis of the response of photosynthesis,metabolism,and growth to an increase in irradiance in the photosynthetic model organism Chlamydomonas reinhardtii[J].Plant Cell,2014,26(6):2310-2350.
[86] Pereira S,Otero A.Effect of light quality on carotenogenic and non-carotenogenic species of the genus Dunaliella under nitrogen deficiency[J].Algal Research,2019,44:101725.
[87] Yoshioka M,Yago T,Yoshie-Stark Y,et al.Effect of high frequency of intermittent light on the growth and fatty acid profile of Isochrysis galbana[J].Aquaculture,2012,338-341:111-117.
[88] Miyagi M,Kawamura G.L-response to UV stimulus and UV sensitive cones in marine fishes[J].Nippon Suisan Gakkaishi,2000,66(2):195-199.
[89] 魏开建,张海明,张桂蓉.鳜鱼苗在光场中反应行为的初步研究[J].水利渔业,2001,21(1):4-6.
[90] 王萍,吴常文,童懿宏.光照对曼氏无针乌贼行为习性的影响[J].河北渔业,2009(11):3-6.
[91] 王萍,桂福坤,吴常文,等.光照对眼斑拟石首鱼行为和摄食的影响[J].南方水产,2009,5(5):57-62.
[92] 肖炜,李大宇,杨弘,等.奥利亚罗非鱼在光场中的行为反应研究[J].中国农学通报,2012,28(26):105-109.
[93] 李妤,郑伟波,崔钊.通过LED集鱼灯光效标准确定最佳光色[J].湖北农业科学,2017,56(13):2536-2539.
[94] 陈清香,熊正烨,谭中明,等.2种LED灯光诱蓝圆鲹和竹筴鱼的渔获比较[J].南方水产科学,2013,9(3):80-84.
[95] 钱卫国,陈新军,钱雪龙,等.300 W型LED集鱼灯光学特性及其节能效果分析[J].海洋渔业,2011,33(1):99-105.
[96] 李杰,晏磊,杨炳忠,等.4种集鱼灯在灯光罩网作业中的渔获效果分析[J].上海海洋大学学报,2018,27(5):773-780.
[97] 张伟信,崔雪亮.LED集鱼灯替代弧光集鱼灯的实船试验[J].中国水运,2013,13(5):9-10,27.
[98] 闫建昌,孙莉莉,王军喜,等.紫外发光二极管发展现状及展望[J].照明工程学报,2017,28(1):2-4.
[99] 宋昌斌,仇登高,王军喜,等.LED光源在封闭循环水养殖业的应用分析[J].照明工程学报,2013,24(S1):127-132.
[100] León-Saiki G M,Martí T G,van der Veen D,et al.The impact of day length on cell division and efficiency of light use in a starchless mutant of Tetradesmus obliquus[J].Algal Research,2018,31:387-394.