长期以来,以铜绿微囊藻Microcystis aeruginosa为主体的蓝藻水华给淡水养殖造成了巨大危害,已成为限制淡水养殖业健康发展的主要瓶颈之一[1-2],尤其是对缺水较为严重的北方地区淡水养殖业危害更大[3]。自然状态下,微囊藻包括产毒微囊藻和非产毒微囊藻两种生态型,产毒微囊藻可产生一类化学性质稳定的原发性肝癌毒素——微囊藻毒素(Microcystins,简称MCs)[4],化学结构见图1,其中以MC-LR和MC-RR两种异构体最为常见且毒性较大[5]。产毒微囊藻正常生长过程中MCs主要储积于藻细胞内[6],藻细胞死亡后胞内毒素就会释放至水体中[7]。蓝藻水华暴发盛期,水体中MCs含量最高可达到10 μg/L[8]。MCs对水生动物有较强的毒害作用,可以显著抑制其胚胎发育、生长及繁殖,严重时甚至导致其大规模死亡[9-10],同时储积在养殖动物体内的MCs又威胁着水产品质量安全[11],造成淡水养殖经济效益严重受损,故实际养殖生产中多会使用杀藻剂应急抑杀蓝藻。
以往养殖生产中,采用硫酸铜或螯合铜应急抑杀水华蓝藻效果虽佳,但极易造成养殖水域重金属离子的二次污染,由此不仅对养殖动物生存造成严重胁迫,还威胁着水产品质量安全[12]。
硫氰酸红霉素(Erythromycin thiocyanate)对细菌等原核生物具有很好的抑杀效应,在水产养殖业中已广泛使用[13-14],其化学结构见图1。已有研究表明,当硫氰酸红霉素含量大于10 μg/L时,水体中微囊藻细胞受到明显损伤[15-16]。因此,若在养殖生产中采用硫氰酸红霉素应急抑杀蓝藻可能会造成蓝藻大量死亡,而短时间内大量释放出来的MCs严重威胁着养殖鱼类的存活。底泥界面是MCs主要归趋场所[17],在受到搅动及水化学指标变化时[18],沉积于底泥中MCs又会被释放至上覆水中[19],因此,明确底泥表层MCs含量将对评估养殖水体中MCs含量及其危害具有重要意义。
本研究中,拟以硫氰酸红霉素作为应急杀藻剂,开展硫氰酸红霉素原位杀藻的生态学效应研究,分析硫氰酸红霉素作用下生态围隔内的蓝藻丰度、底泥MCs含量及关键水化学指标的动态变化规律,以期摸索出兼顾杀藻效果与MCs释放量的最优杀藻技术流程,这将对科学使用杀藻剂及避免由杀蓝藻所诱发的MCs对养殖动物的危害具有非常重要的实际意义。
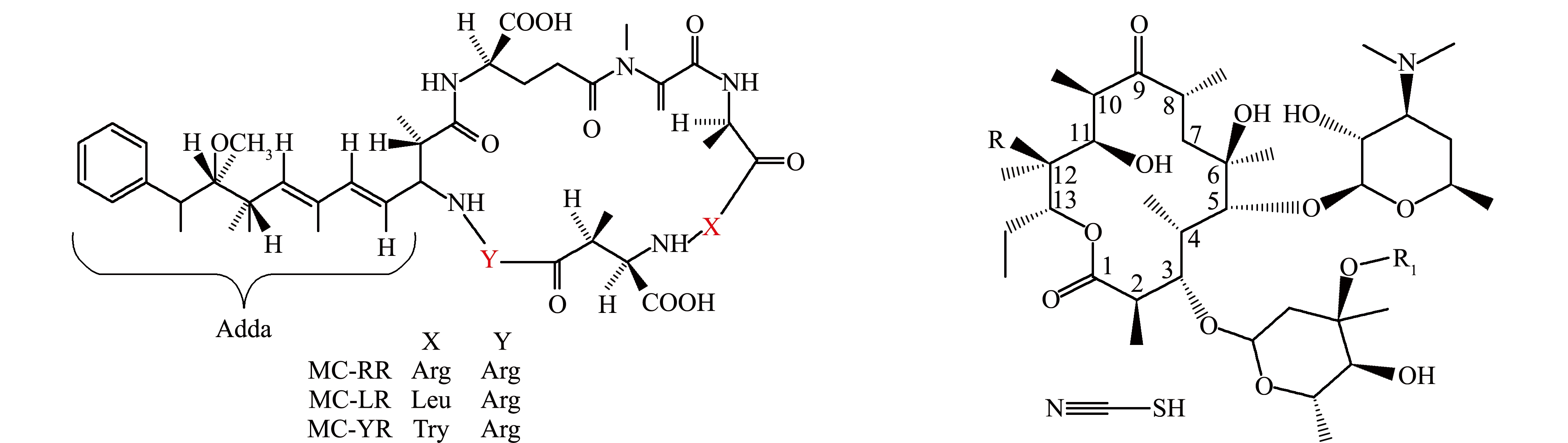
图1 微囊藻毒素(左)与硫氰酸红霉素(右)的化学结构图
Fig.1 Chemical structure of microcystins(left)and erythromycin thiocyanate(right)
试验选址在常年频繁暴发蓝藻的淡水鱼类养殖尾水循环渠中,以高密度不透水帆布为分隔材料、以不锈钢铁架和钢管为支架,搭建底面直径1.2 m、高2 m的圆柱体生态围隔,生态围隔上面高出水面20~30 cm,下部伸入到底泥,试验共建立15个生态围隔(图2)。
硫氰酸红霉素(分析纯)购自天津鼎正药业公司,MC-RR、MC-LR标准品为白色粉末,纯度为95%;三氟乙酸(分析纯)购自济南化工科技公司。
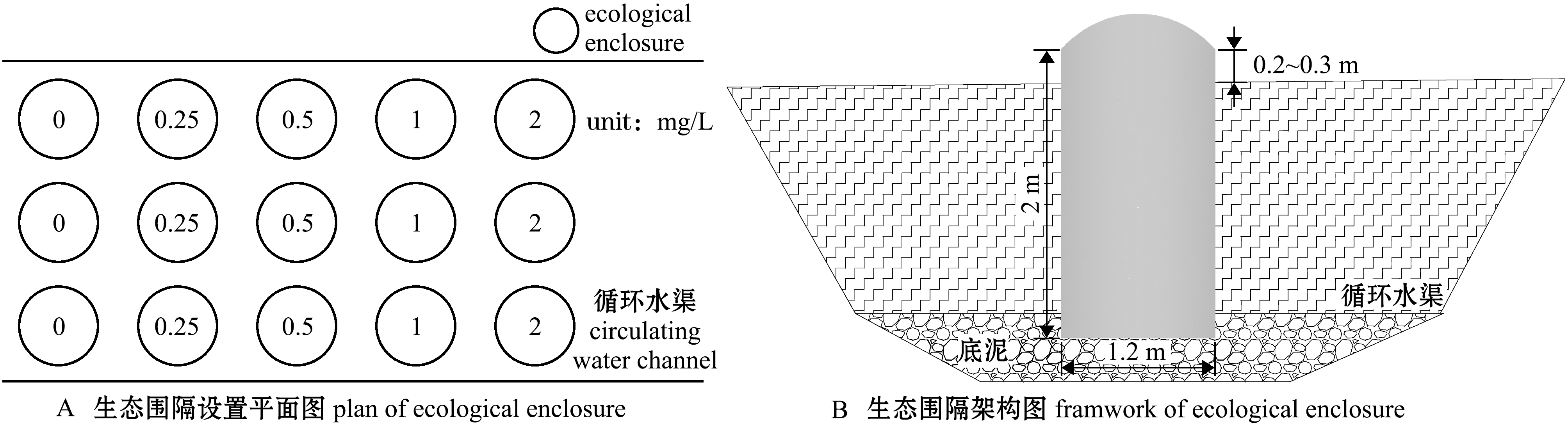
图2 生态围隔搭建示意图
Fig.2 Sketch diagram of the ecological enclosure
1.2.1 试验设计 试验设置0.25、0.5、1、2 mg/L 4个浓度的硫氰酸红霉素杀藻剂处理组和1个未添加杀藻剂的对照组,每组设3个平行,试验共进行10 d,每隔2 d检测生态围隔内蓝藻、微囊藻丰度,底泥中MC-LR与MC-RR含量,以及水体中亚硝酸盐 ![]() 硝酸盐
硝酸盐![]() 氨氮
氨氮![]() 活性磷酸盐
活性磷酸盐![]() 和化学耗氧量(CODMn)等关键水化学指标的变化规律。
和化学耗氧量(CODMn)等关键水化学指标的变化规律。
1.2.2 浮游植物和水化学指标的测定 参照《水生生物学》[20]中的方法定量测定浮游植物,参照胡鸿均等[21]的方法进行分类鉴定。采用纳氏试剂分光光度法测定![]() 含量,用重氮—偶氮比色法测定
含量,用重氮—偶氮比色法测定![]() 含量,用锌镉还原法测定
含量,用锌镉还原法测定![]() 含量,采用钼酸铵分光光度法测定
含量,采用钼酸铵分光光度法测定![]() 含量,采用碘化钾-碱性高锰酸钾法测定CODMn含量。
含量,采用碘化钾-碱性高锰酸钾法测定CODMn含量。
1.2.3 微囊藻毒素的测定
(1)微囊藻毒素标准曲线的制备。标准品MC-RR、MC-LR母液的制备参照国标法(GB/T 20466—2006)[22],取适量母液加超纯水稀释成浓度为0.5、1.0、2.0、3.0、4.0、5.0 μg/mL。使用安捷伦 1260 Infinity II 高效液相色谱仪测定峰面积及确定每种毒素的出峰时间。测定条件为:进样量20 μL,色谱柱温为40 ℃,紫外可见光检测器波长为238 nm,流动相为0.05%三氟乙酸和60%甲醇(色谱纯)。
(2)底泥样品采集及微囊藻毒素的萃取。底泥中MCs测定方法参照樊洁等[23]的方法。使用彼得逊采泥器取表层底泥沉积物,冷冻后带回实验室。于-80 ℃下反复冻融5次后混匀、真空冻干,用90%的甲醇反复萃取3次,取上清液减压蒸发浓缩,采用预先活化的C18小柱进行毒素的富集,用20%甲醇溶液淋洗,再用含0.1%三氟乙酸的甲醇溶液洗脱,洗脱液在40 ℃减压浓缩至近干,用甲醇溶液定容至1 mL,过0.22 μm微孔滤膜后进行HPLC检测,检测条件同(1)。
(3)微囊藻毒素回收率的测定。回收率是评价MCs萃取过程中的一个重要指标,测定方法采用加标-回收法,具体为在适量底泥样品中加入0.1 mL毒素标准品(MC-RR和MC-LR)充分混匀,随后按照(2)中的方法测定微囊藻毒素浓度。回收率计算公式如下:
底泥回收率=(加标底泥样品测定值-底泥样品测定值)/加标量×100%。
试验数据以平均值±标准差表示,采用SPSS 19.0对试验数据进行单因素方差分析,用LSD法进行组间多重比较。
试验期间围隔中出现10个属(种)的蓝藻,分别为微囊藻Microcystis、细小平裂藻Merismopedia minima、色球藻Chroococcus minutus、颤藻Oscillatoria sp.、优美平裂藻Merismopedia elegans、席藻Phormidium sp.、尖头藻Raphidiopsis sp.、隐球藻Aphanocapsa sp.、螺旋藻Spirulina sp.。
从图3可见:硫氰酸红霉素对蓝藻有较强的杀灭作用,且呈现出明显的浓度效应,试验结束时,所有硫氰酸红霉素处理组对蓝藻杀灭率均达99%以上;微囊藻的丰度和生物量与蓝藻的变化趋势相似,到试验结束时,硫氰酸红霉素作用下微囊藻丰度为(0~1.32)×106cells/L,生物量为0~0.66 mg/L。整体上来看,在满足杀藻效果基础上,浓度为0.25、0.5 mg/L的硫氰酸红霉素杀藻性能相对缓和些。
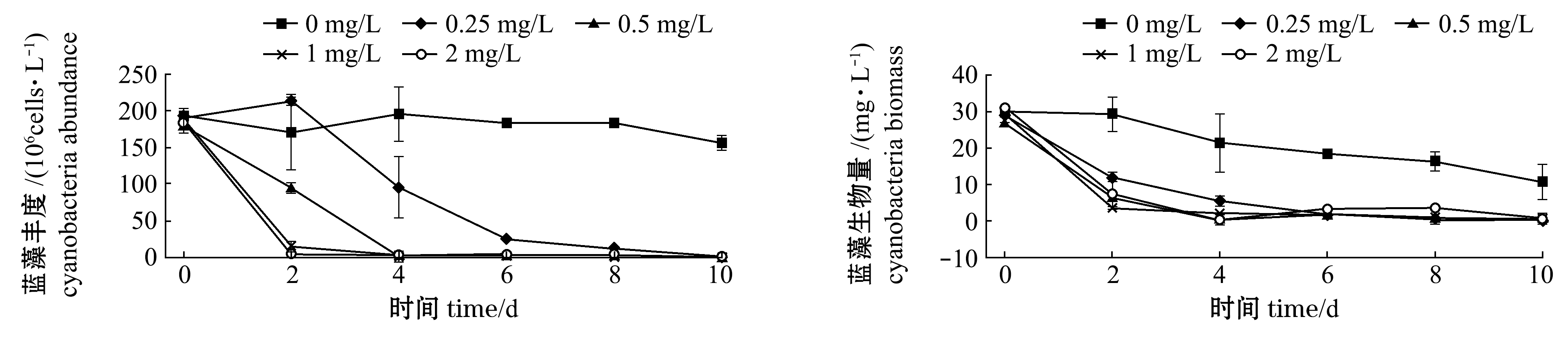
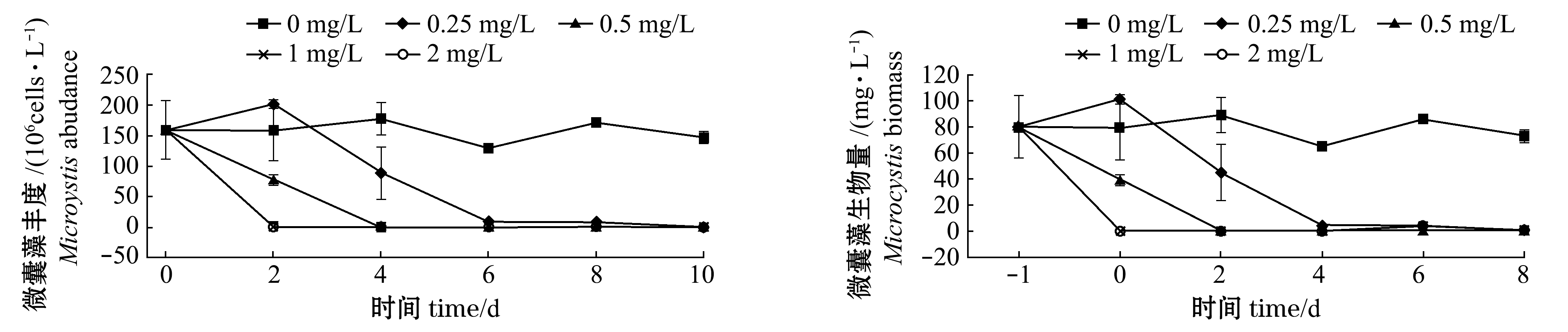
图3 硫氰酸红霉素作用下蓝藻、微囊藻丰度和生物量的变化
Fig.3 Changes in abundance and biomass of cyanobacteria and Microcystis under the effects of erythromycin thiocyanate
微囊藻毒素标准品MC-RR与MC-LR浓度与对应峰面积的线性回归方程分别为y=23.872x-7.6868(R2=0.999)和y=26.741x+2.9529(相关系数R2=0.999),均显示出良好的线性关系,且有较宽的微囊藻毒素浓度检测范围。进一步检测表明,本研究中底泥MC-RR和MC-LR的萃取回收率分别为16.8%和30.1%。
从图4可见:在硫氰酸红霉素作用下,底泥中MC-RR和MC-LR含量均呈现短时间内(2 d)有明显升高趋势,其中MC-LR含量增高趋势较MC-RR明显,MC-RR和MC-LR含量最高时分别达(2.58±0.99)、(3.39±0.23)μg/g;随后多数硫氰酸红霉素处理组MC-RR和MC-LR含量呈现明显下降趋势,直至试验结束时,MCs仍高于对照组;结合蓝藻及微囊藻丰度动态变化规律可知,在硫氰酸红霉素作用下短时间内藻细胞大量破裂死亡,释放出来的藻毒素大量储积在底泥表层沉积物中。依据硫氰酸红霉素作用下底泥表层沉积物中MCs含量变化规律,建议采用≤0.25 mg/L硫氰酸红霉素应急杀灭蓝藻,以降低藻毒素对养殖动物的毒害效应。

注:标有不同字母者表示同一时间下不同浓度组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters at same time are significantly different in the various concentration groups at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图4 硫氰酸红霉素作用下底泥中微囊藻毒素含量的变化
Fig.4 Changes in content of microcystins in sediment under the effects of erythromycin thiocyanate
从图5可见:在硫氰酸红霉素作用下,初期水体中![]() 含量总体小幅振荡升高,维持在0.01 mg/L水平,试验结束时
含量总体小幅振荡升高,维持在0.01 mg/L水平,试验结束时![]() 含量明显升高,而对照组
含量明显升高,而对照组![]() 含量则在试验期间逐步降低,最终降至0.01 mg/L以下,0.25 mg/L 硫氰酸红霉素组
含量则在试验期间逐步降低,最终降至0.01 mg/L以下,0.25 mg/L 硫氰酸红霉素组![]() 含量波动较其他处理组相对较小,变化范围为0.009~0.019 mg/L;试验结束时,各硫氰酸红霉素处理组水体中的
含量波动较其他处理组相对较小,变化范围为0.009~0.019 mg/L;试验结束时,各硫氰酸红霉素处理组水体中的![]() 较对照组均有不同程度的升高,且表现出一定的剂量依赖性;水体中
较对照组均有不同程度的升高,且表现出一定的剂量依赖性;水体中![]() 含量则在硫氰酸红霉素作用下呈现出先快速升高后逐步降低的总体趋势,试验结束时所有试验组
含量则在硫氰酸红霉素作用下呈现出先快速升高后逐步降低的总体趋势,试验结束时所有试验组![]() 含量变化范围为0.505~0.651 mg/L;总体上来看,对照组
含量变化范围为0.505~0.651 mg/L;总体上来看,对照组![]() 含量在试验期间有所升高,而在硫氰酸红霉素作用下,除2 mg/L试验组外,其余硫氰酸红霉素浓度组
含量在试验期间有所升高,而在硫氰酸红霉素作用下,除2 mg/L试验组外,其余硫氰酸红霉素浓度组![]() 含量变化幅度不大;在硫氰酸红霉素作用下,各试验组CODMn含量在短时间内(2 d时)呈现出明显的上升趋势,与对照组有显著性差异(P<0.05),且呈现出较强的剂量依赖效应。为降低应急杀藻时养殖动物的应激反应,综合考量硫氰酸红霉素作用下水质指标的变化规律,尤其是考量对养殖动物具有较强毒性效应的
含量变化幅度不大;在硫氰酸红霉素作用下,各试验组CODMn含量在短时间内(2 d时)呈现出明显的上升趋势,与对照组有显著性差异(P<0.05),且呈现出较强的剂量依赖效应。为降低应急杀藻时养殖动物的应激反应,综合考量硫氰酸红霉素作用下水质指标的变化规律,尤其是考量对养殖动物具有较强毒性效应的![]() 与
与![]() 变化特征,建议采用≤0.25 mg/L硫氰酸红霉素应急杀灭蓝藻。
变化特征,建议采用≤0.25 mg/L硫氰酸红霉素应急杀灭蓝藻。
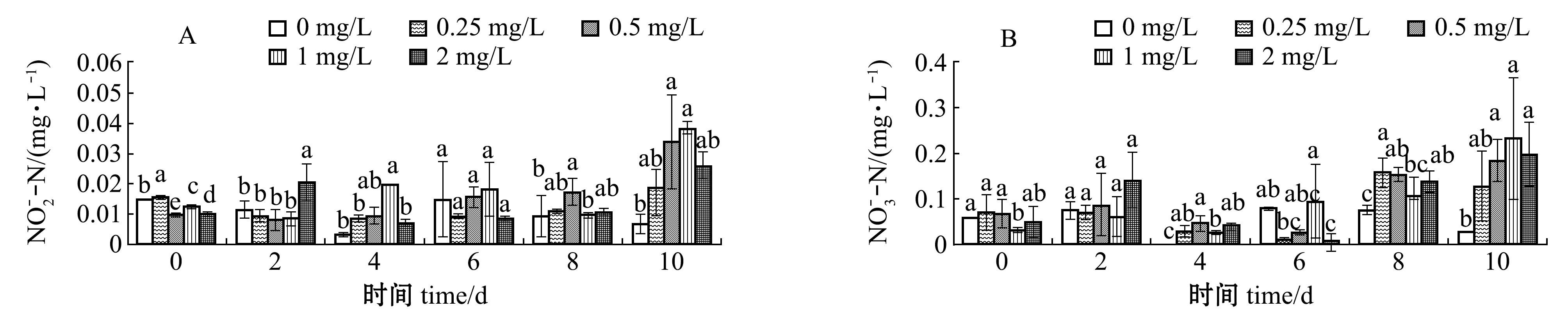
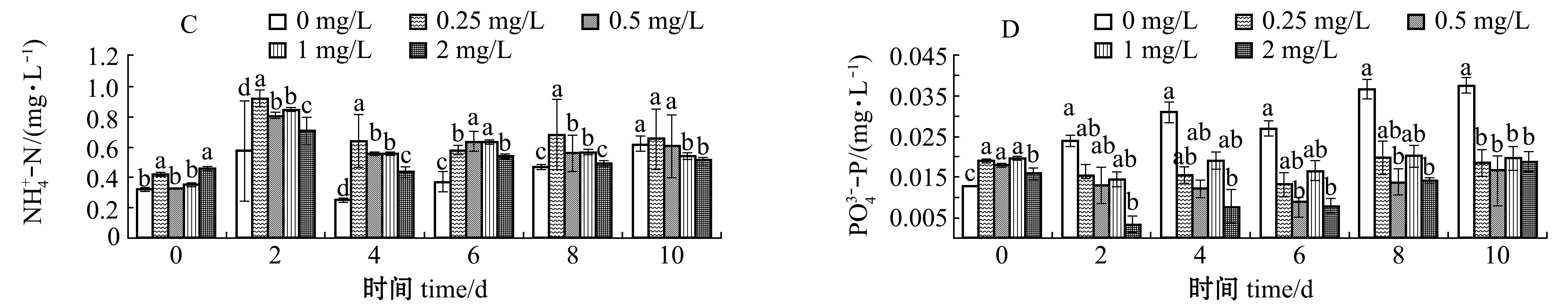

图5 硫氰酸红霉素作用下水化学指标的变化
Fig.5 Changes in hydrochemical indices under the effects of erythromycin thiocyanate
硫氰酸红霉素属大环内酯类抗生素,是红霉素的硫氰酸盐,既降低了红霉素的毒副作用,又保留了红霉素对原核生物的杀灭活性,是中国农业农村部允许使用的水产药剂,在水产养殖中已得到广泛应用[24]。已有试验表明,硫氰酸红霉素可有效抑制微囊藻可溶性蛋白的合成,从而达到杀藻效果,96 h EC50为48.2 μg/L[15]。本试验中各浓度硫氰酸红霉素对蓝藻及微囊藻都有很好的杀灭效果,且呈现出明显的剂量依赖效应,试验结束时对蓝藻及微囊藻杀灭率均达99%以上。可见硫氰酸红霉素在应急防控养殖水域蓝藻水华方面具有明显的优势。
底泥是MCs在养殖水体中储积的主要场所,生物降解是MCs环境归趋的主要途径,底泥中细菌对MCs生物降解起着至关重要的作用[8]。田大军等[25]研究指出,正常蓝藻暴发时,底泥中MC-RR含量最高可达到0.802 μg/g,樊洁等[23]研究表明,自然水体下底泥中MC-LR含量最大值为0.28 μg/g,MC-RR最大含量为0.32 μg/g。本试验表明,暴发蓝藻水壶的生态围隔中加入硫氰酸红霉素后底泥中MC-RR含量最高达2.58 μg/g,MC-LR最高为3.39 μg/g,其藻毒素含量明显高于自然水体中底泥的含量,究其原因可能是在硫氰酸红霉素作用下蓝藻细胞破裂死亡,短时间内释放出大量MCs储积在生态围隔底泥中,远远超过底泥环境中MCs降解微生物的降解负荷。当硫氰酸红霉素浓度为0.25 mg/L时,短时间内储积在底泥中MCs总量较小,且杀藻效果完全满足实际生产需要,可以考虑在实际养殖生产中应用该浓度硫氰酸红霉素应急防控蓝藻水华,但仍需提前使用VC等高效解毒剂,以降低杀藻给养殖动物带来的次生伤害。
养殖动物对水化学指标变化十分敏感,水化学指标急剧变化会使养殖生物免疫力降低,直至诱发疾病。实际养殖生产中快速杀灭蓝藻容易造成![]() 等水体水化学指标剧烈震荡,导致养殖动物由杀藻带来的次生伤害。因此,应急抑杀水华蓝藻前必须掌握杀藻过程中水化学指标的变化规律。本研究表明,硫氰酸红霉素抑杀蓝藻时,蓝藻细胞大量破裂死亡,胞内有机内容物短时间内大量释放至水环境中,导致
等水体水化学指标剧烈震荡,导致养殖动物由杀藻带来的次生伤害。因此,应急抑杀水华蓝藻前必须掌握杀藻过程中水化学指标的变化规律。本研究表明,硫氰酸红霉素抑杀蓝藻时,蓝藻细胞大量破裂死亡,胞内有机内容物短时间内大量释放至水环境中,导致![]() 及CODMn短时间内均有不同程度地提高,其中尤以
及CODMn短时间内均有不同程度地提高,其中尤以![]() 与CODMn升高较为明显。CODMn快速升高导致水体溶解氧下降,使水体硝化与反硝化作用失衡,进而导致
与CODMn升高较为明显。CODMn快速升高导致水体溶解氧下降,使水体硝化与反硝化作用失衡,进而导致![]() 快速升高。刘璐等[26]研究表明,采用化感物质——盐酸小檗碱应急抑杀养殖池塘蓝藻后定期泼洒微生态制剂,可有效降低
快速升高。刘璐等[26]研究表明,采用化感物质——盐酸小檗碱应急抑杀养殖池塘蓝藻后定期泼洒微生态制剂,可有效降低![]() 及CODMn含量,以避免由应急抑杀蓝藻造成的次生伤害。因此,结合硫氰酸红霉素作用下蓝藻(微囊藻)丰度、底泥沉积物中MCs储积量及关键水化学指标的动态变化规律,建议养殖生产中使用≤0.25 mg/L硫氰酸红霉素应急杀灭蓝藻,并在使用硫氰酸红霉素抑杀蓝藻后及时增氧及补充微生态制剂。
及CODMn含量,以避免由应急抑杀蓝藻造成的次生伤害。因此,结合硫氰酸红霉素作用下蓝藻(微囊藻)丰度、底泥沉积物中MCs储积量及关键水化学指标的动态变化规律,建议养殖生产中使用≤0.25 mg/L硫氰酸红霉素应急杀灭蓝藻,并在使用硫氰酸红霉素抑杀蓝藻后及时增氧及补充微生态制剂。
硫氰酸红霉素对养殖水体中水华蓝藻具有较强的杀灭作用,0.25 mg/L硫氰酸红霉素在6 d内对生态围隔中蓝藻杀灭率达99%以上;硫氰酸红霉素作用下短时间内底泥中MC-RR与MC-LR含量均有升高,尤以MC-LR升高幅度较大;![]() 及CODMn在硫氰酸红霉素作用下短时间内均有不同程度地提高,其中尤以
及CODMn在硫氰酸红霉素作用下短时间内均有不同程度地提高,其中尤以![]() 与CODMn升高较为明显。综合考虑杀藻效果、底泥中MCs储积量及关键水化学指标变化规律,建议养殖生产中使用≤0.25 mg/L硫氰酸红霉素应急杀灭蓝藻,并在应急抑杀蓝藻后及时增氧、泼洒解毒剂及微生态制剂。
与CODMn升高较为明显。综合考虑杀藻效果、底泥中MCs储积量及关键水化学指标变化规律,建议养殖生产中使用≤0.25 mg/L硫氰酸红霉素应急杀灭蓝藻,并在应急抑杀蓝藻后及时增氧、泼洒解毒剂及微生态制剂。
[1] 于瑾,朱允刚,胡金春,等.水产养殖池塘蓝藻的防治方法[J].科学养鱼,2016(6):60-61.
[2] 李永锋.池塘蓝藻的发生、危害及控制方法[J].海洋与渔业,2012(5):66-67.
[3] 沈涛.北方池塘养殖蓝藻水花的危害及控制技术[J].渔业致富指南,2008(19):34-35.
[4] Ding W X,Shen H M,Zhu H G,et al.Genotoxicity of microcystic cyanobacteria extract of a water source in China[J].Mutation Research/Genetic Toxicology and Environmental Mutagenesis,1999,442(2):69-77.
[5] Dawson R M.The toxicology of microcystins[J].Toxicon,1998,36(7):953-962.
[6] 李嗣新.微囊藻毒素的生态学和毒理学研究[D].武汉:中国科学院研究生院(水生生物研究所),2007.
[7] 李大命,周军,唐晟凯,等.河蟹养殖池塘微囊藻水华毒性及其光合作用活性特征[J].湖泊科学,2015,27(1):113-118.
[8] 宋立荣,陈伟.水华蓝藻产毒的生物学机制及毒素的环境归趋研究进展[J].湖泊科学,2009,21(6):749-757.
[9] Ernst B,Hitzfeld B,Dietrich D.Presence of Planktothrix sp.and cyanobacterial toxins in Lake Ammersee,Germany and their impact on whitefish(Coregonus lavaretus L.)[J].Environmental Toxicology,2001,16(6):483-488.
[10] Deblois C P,Aranda-Rodriguez R,Giani A,et al.Microcystin accumulation in liver and muscle of tilapia in two large Brazilian hydroelectric reservoirs[J].Toxicon,2008,51(3):435-448.
[11] 高鸽,周游,王小林,等.夏秋季太湖4个控藻区鳙体内微囊藻毒素累积分析[J].大连海洋大学学报,2017,32(3):334-341.
[12] 宋波澜,张华.Cu离子浓度对杂交鲟幼鱼行为、血液指标和抗氧化酶的影响[J].大连海洋大学学报,2014,29(3):241-245.
[13] 张水波.安全根治虾池蓝藻的方法[J].渔业致富指南,2013(10):56-57.
[14] 张晓琴,舒立新,李绪兴.绿色食品养殖鱼类用药之浅见[J].水产学杂志,1997,10(2):1-10.
[15] 杨弯弯,武氏秋贤,吴亦潇,等.恩诺沙星和硫氰酸红霉素对铜绿微囊藻的毒性研究[J].中国环境科学,2013,33(10):1829-1834.
[16] 万禁禁.淡水微藻对几种抗生素胁迫的响应研究[D].泉州:华侨大学,2014.
[17] Chen W,Li L,Gan N Q,et al.Optimization of an effective extraction procedure for the analysis of microcystins in soils and lake sediments[J].Environmental Pollution,2006,143(2):241-246.
[18] 张维昊,方涛,徐小清.滇池水华蓝藻中藻毒素光降解的研究[J].中国环境科学,2001,21(1):1-3.
[19] 苟婷,马千里,王振兴,等.龟石水库夏季富营养化状况与蓝藻水华暴发特征[J].环境科学,2017,38(10):4141-4150.
[20] 赵文.水生生物学[M].北京:中国农业出版社,2005:499-507.
[21] 胡鸿钧,李尧英,魏印心,等.中国淡水藻类[M].上海:上海科学技术出版社,1979.
[22] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 20466-2006 水中微囊藻毒素的测定[S].北京:中国标准出版社,2007.
[23] 樊洁,邓南圣,刘碧波,等.滇池沉积物中微囊藻毒素的HPLC检测[J].云南环境科学,2005,24(3):18-20.
[24] 毛培学,陈葵,纪利俊,等.硫氰酸红霉素在酸性溶液中的稳定性研究[J].中国抗生素杂志,2013,38(3):218-222.
[25] 田大军,郑唯韡,韦霄,等.淮河流域某县水体富营养化及水体、底泥微囊藻毒素污染状况研究[J].卫生研究,2011,40(2):158-162.
[26] 刘璐,张树林,张达娟,等.小檗碱复合物和微生态制剂控制池塘有害蓝藻[J].水产科学,2017,36(4):443-448.