肿瘤坏死因子α(Tumor necrosis factor,TNF-α)是一种主要由巨噬细胞和单核细胞产生的促炎症细胞因子,在介导炎症反应、调控免疫应答、抗病毒感染及诱导细胞凋亡等方面发挥了重要作用[1-2]。由于TNF-α具有广泛生物学活性及在免疫调控中的重要作用,故备受关注。目前已在多种鱼类中证实了TNF-α基因的存在。Hirono等[3]采用EST技术首次从牙鲆Paralichthys olivaceus中克隆到TNF-α基因。Laing等[4]应用同源基因克隆技术从虹鳟Oncorhynchus mykiss中克隆到两个结构相近的TNF-α基因。Rhee等[5]通过构建鲫鱼多个组织的cDNA文库,证实鲫鱼体内存在TNF-α基因。这些工作为研究TNF-α在鱼类免疫中的作用奠定了基础。
有研究表明,三聚体形式的TNF-α可与细胞膜上的肿瘤坏死因子受体(TNFR)结合形成复合物,募集接头分子并将信号传递到下游,进而诱导细胞凋亡和NF-κB信号通路的激活,最终发挥广泛的生物学作用[6]。正常情况下,机体中TNF-α的分泌水平较低,但是当细胞受损(特别是病原体感染)时,在短时间内感染部位的TNF-α的表达量会迅速升高,进而诱发炎症反应并调节早期免疫应答[7]。Lee等[8]用鲤疱疹病毒Ⅲ型(CyHV-3)攻毒锦鲤Cyprinus carpio后,通过高通量测序技术分析脾脏中免疫基因的表达水平,发现TNF-α的表达量上调了4.15倍,提示TNF-α在抵抗疱疹病毒感染中也发挥了重要作用。此外,TNF-α是细胞内自由基产生的重要诱导剂,当细胞接受TNF-α刺激后会导致NADPH氧化酶的活化和ROS的积累,过量的ROS可直接导致DNA损伤或通过激活JNK通路介导细胞凋亡[9]。
异育银鲫Carassius auratus gibelio是以方正银鲫为母本(♀)、兴国红鲤为父本(♂),经人工授精和异精雌核发育得到的子代[10-11],具有生长快速、抗逆性强、肉质好等优点,深受人们的喜爱。但随着养殖规模和集约化程度不断扩大,病害问题也日益突出,其中以鲤疱疹病毒Ⅱ型引发的异育银鲫造血器官坏死症为甚,目前尚缺少控制该病暴发的有效措施或药物。本研究中,采用大肠杆菌表达系统对异育银鲫TNF-α蛋白进行重组表达,通过Ni柱亲和层析和尿素浓度梯度透析法对rTNF-α蛋白进行纯化和复性,最后采用Hoechst 33258染色和Real time PCR技术分析rTNF-α蛋白的促凋亡活性,以期为后续研究TNF-α蛋白的抗病毒作用奠定基础。
1 材料与方法
1.1 材料
异育银鲫(体质量15 g±1 g)购自江苏省大丰某养殖场,规格均一、健康无伤。鲫鱼鳍条细胞(CAF)由盐城工学院水产动物免疫与疾病防控研究室保藏。
试验用限制性内切酶BamH Ⅰ和Sal Ⅰ、Taq DNA聚合酶及SYBR® Premix ExTaqTM Kit均购自TaKaRa(大连)公司;胶回收试剂盒、质粒小提试剂盒购自天根生物技术有限公司;TRIzol试剂、M-MLV First strand Kit购自Invitrogen(上海)公司;Anti-His Tag Antibody购自博士德生物工程有限公司;Hoechst 33258染液购自碧云天生物技术有限公司;His·Bind Purification Kit购自Novagen(上海)公司。序列测序和引物合成由生工生物工程(上海)股份有限公司完成。
1.2 方法
1.2.1 异育银鲫TNF-α基因的扩增 用TRIzol法提取异育银鲫脾脏的总RNA, 用M-MLV First strand Kit合成cDNA。根据前期异育银鲫脾脏转录组测序获得TNF-α编码区序列,利用Primer Premier 5.0软件设计特异性引物,上游![]() 3′,下游
3′,下游![]() 3′,其中下划线碱基分别为限制性内切酶BamH Ⅰ和SalⅠ 识别序列。使用异育银鲫脾脏cDNA为模板,采用PCR法扩增异育银鲫TNF-α基因的编码区部分片段。PCR反应程序为:95 ℃下预变性5 min;95 ℃下变性45 s,56 ℃下退火45 s,72 ℃下延伸1 min,共32个循环;最后在72 ℃延伸10 min。PCR 产物经纯化后,连接pMD18-T载体(TaKaRa,大连)并转化至大肠杆菌DH5α感受态细胞中。转化子经PCR筛选后, 送交生工生物工程(上海)股份有限公司进行测序。
3′,其中下划线碱基分别为限制性内切酶BamH Ⅰ和SalⅠ 识别序列。使用异育银鲫脾脏cDNA为模板,采用PCR法扩增异育银鲫TNF-α基因的编码区部分片段。PCR反应程序为:95 ℃下预变性5 min;95 ℃下变性45 s,56 ℃下退火45 s,72 ℃下延伸1 min,共32个循环;最后在72 ℃延伸10 min。PCR 产物经纯化后,连接pMD18-T载体(TaKaRa,大连)并转化至大肠杆菌DH5α感受态细胞中。转化子经PCR筛选后, 送交生工生物工程(上海)股份有限公司进行测序。
1.2.2 重组表达质粒的构建 使用质粒小提试剂盒提取阳性转化子的质粒,并对其进行限制性内切酶BamH Ⅰ和Sal Ⅰ双酶切,酶切产物经胶回收后,用T4 DNA连接酶将其连接入pET28a(+)载体中,16 ℃下连接过夜。将连接产物转化至大肠杆菌DH5α感受态细胞中,挑选单菌落进行菌液PCR。测序鉴定后,将测序正确的重组质粒命名为pET28a-TNF-α。
1.2.3 异育银鲫TNF-α蛋白的表达分析 挑取单菌落接种于含卡那霉素(Kan+,50 μg/mL)的新鲜LB培养基中,37 ℃下震荡培养过夜。次晨以1∶100比例转接至5 mL新鲜培养基中,在37 ℃恒温培养箱中培养至细菌对数生长期(OD600 nm=0.6~0.8),加入IPTG至终浓度为1 mmol/L后继续培养5 h诱导表达。随后取出1 mL培养菌液,弃掉离心后的上清液,用100 μL 2×上样缓冲液重悬菌体沉淀。收集剩余菌体,用适量PBS重悬。将菌液置于超声波破碎仪下进行破碎,分别取破碎上清液与沉淀,制样后进行SDS-PAGE电泳,进行重组蛋白的表达分析。
1.2.4 重组TNF-α蛋白的纯化与复性 对重组表达菌进行大量表达,使用His·Bind Purification Kit依照说明书进行蛋白纯化。菌体用Binding Buffer(100 mmol/L Na2HPO4、10 mmol/L Na2HPO4、500 mmol/L NaCl、8 mol/L尿素、40 mmol/L 咪唑,pH 7.4)重悬后,冰浴超声破碎。将破碎后的菌液在4 ℃下以12 000 r/min离心30 min,取上清经0.45 μm滤膜过滤。上柱后洗涤5个柱体积,然后用Elution Buffer(100 mmol/L NaH2PO4、10 mmol/L NaH2PO4、500 mmol/L NaCl、8 mol/L尿素、500 mmol/L 咪唑,pH 7.4)洗脱蛋白。将蛋白浓度调整至1 mg/mL后,分别在含4、3、2、1、0.5 moL/L尿素的复性缓冲液(50 mmol/L Tris、0.5 mmol/L EDTA、50 mmol/L NaCl、10%甘油、1%精氨酸,pH 8.0)中进行梯度透析复性,每6 h更换1次透析液,最后在Tris-HCl 缓冲液中透析过夜。采用SDS-PAGE电泳检测复性蛋白的纯度,用BCA 蛋白定量试剂盒(上海碧云天生物技术有限公司)测定蛋白浓度。
1.2.5 Western-blot 采用湿法转印,将rTNF-α蛋白转移到NC膜上,并用1% BSA于4 ℃下封闭过夜。次晨用含0.02%吐温的PBS(PBST)洗涤3次,加入用0.01 mol/L PBS稀释的抗His单抗(1∶1000)于37 ℃下孵育1 h;用PBST洗涤3次后,加入用0.01 mol/L PBS稀释的羊抗鼠IgG(1∶3000),于37 ℃下孵育45 min;再用PBST洗涤3次,每次5 min,最后加入NBT-BCIP 显色液,避光显色约10 min,水洗终止反应,观察显色条带。
1.2.6 Hoechst 33258染色 将鲫鱼鳍条细胞接种于含细胞爬片的24孔细胞培养板中,加入含10%胎牛血清的M199培养基,置于28 ℃的培养箱内,待细胞长至90%汇合时,加入终浓度为100 ng/mL rTNF-α蛋白,同时设置未添加组作为对照。处理24 h后吸弃孔内培养基,用PBS洗涤一次后,再加入终浓度为5 mg/L的Hoechst 33258避光染色10 min,用PBS缓冲液洗涤3次后封片。于倒置荧光显微镜下观察细胞核的染色情况。
1.2.7 荧光定量PCR 在25 cm2细胞培养瓶中培养鲫鱼鳍条细胞,待细胞汇合至90%时,加入终浓度为100 ng/mL的rTNF-α蛋白,于加入后的第0、6、12、24、48 h时收集细胞,采用TRIzol法提取细胞总RNA,采用PrimeScriptTM RT reagent Kit合成cDNA的第一链。以β-actin为内参基因,采用荧光定量PCR分析经rTNF-α处理鲫鱼鳍条细胞后Caspase 3和Caspase 8的表达水平变化。所用引物序列如下:内参β-actin引物,上游5′CTCCCCTCAATCCCAAAGCCAA 3′,下游5′ACACCATCACCAGAATCCATCA 3′;Caspase 8引物,上游5′CAAGCAGATGCCTGAGGTTCG 3′,下游5′CCAGTGTTTTGGTTAGAGTGTAGCG 3′;Caspase 3引物,上游5′AGAGCGAGAAGACGGTCAAAGA 3′,下游5′CGACAAGCCTGAATGAGGAAGA 3′。
荧光定量PCR反应体系如下:SYBR® Premix Ex TaqTM(2×)12.5 μL,正、反向引物各0.5 μL,DNA模板2 μL,用ddH2O补足至25 μL。反应程序为:95 ℃下预变性30 s;95 ℃ 下变性5 s,60 ℃下退火 30 s,共进行40个循环。每个样品设置3个重复。扩增结束后进行融解曲线分析,以确定产物的特异性。采用公式2-△△Ct计算基因的相对表达量。
2 结果与分析
2.1 重组表达载体的构建
提取异育银鲫脾脏总RNA,经反转录后采用PCR扩增TNF-α编码区,用10 g/L琼脂糖进行凝胶电泳,结果显示,在约627 bp处出现了扩增条带,与预期分子量大小一致(图1)。将编码区基因连接到原核表达载体pET28a中,构建重组表达质粒pET28a-TNF-α。挑选阳性菌株送交测序鉴定,测序结果与TNF-α基因序列相同且无碱基缺失、移码等突变,表明异育银鲫TNF-α基因已成功克隆到原核表达载体pET28a(+)中,能够用于后续试验。

注: M,DNA ladder;1,TNF-α基因扩增
Note:M, DNA ladder; 1, amplification of TNF-α gene
图1 异育银鲫TNF-α基因的扩增
Fig.1 Amplification of TNF-α gene in allogynogenetic silver crucian carp
2.2 重组TNF-α蛋白的诱导表达
阳性表达菌株经IPTG诱导后收集菌体,取诱导前后的菌体,煮沸后进行SDS-PAGE电泳,结果如图2所示,与未诱导样品相比,诱导产物在相对分子质量约23 000处出现了明显的蛋白条带,与预期蛋白分子量大小相符。进一步将诱导产物超声裂解,煮沸后进行SDS-PAGE电泳,结果表明,目的蛋白主要存在于裂解沉淀中,表明重组TNF-α蛋白以包涵体的形式存在。
2.3 重组TNF-α蛋白的纯化及鉴定
收集大量诱导阳性表达菌株,超声破碎后上柱纯化,结果如图3所示,纯化产物在相对分子质量约23 000处出现了明显的条带,利用Image J软件对纯化蛋白条带进行灰度计算,测得蛋白纯度在90%以上。通过尿素浓度梯度透析对其进行复性,采用Western-blot对纯化的目的蛋白进行鉴定。如图3所示,纯化后的rTNF-α与抗His单抗在相对分子质量约23 000处出现了明显的反应条带,表明异育银鲫TNF-α蛋白成功实现了纯化。

注:M,Marker;1,未诱导的菌体总蛋白;2,诱导后的菌体总蛋白;3,诱导后菌体蛋白上清;4,诱导后菌体蛋白沉淀
Note:M, Marker; 1, uninduced total bacterial protein; 2, induced total bacterial protein; 3, supernatants of induced bacterial protein; 4, precipitations of induced bacterial protein
图2 异育银鲫TNF-α重组蛋白的表达分析
Fig.2 Expression analysis of recombinant TNF-α protein of allogynogenetic silver crucian carp
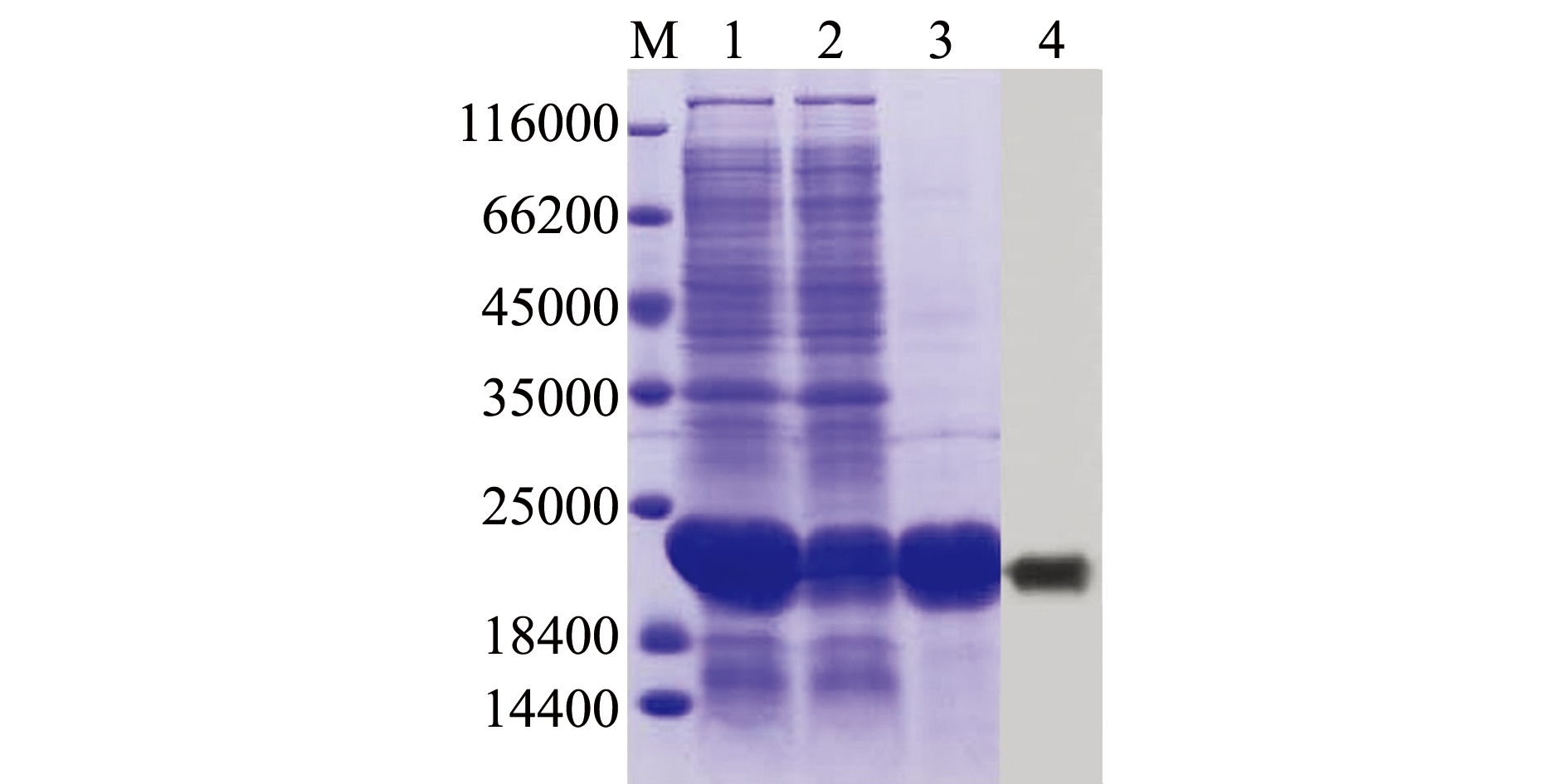
注:M,Marker;1,破碎后处理样品;2,流出样品;3,纯化蛋白;4,Western-blot
Note:M, Marker; 1, samples after crushing;2, outflow of the samples; 3, purified protein; 4, Western-blot
图3 重组TNF-α蛋白的纯化及Western-blot分析
Fig.3 Purification and Western-blot analysis of recombinant TNF-α protein
2.4 Hoechst 33258染色结果
用rTNF-α蛋白处理鲫鱼鳍条细胞,刺激24 h后收集细胞并进行Hoechst 33258染色,结果如图4所示,在荧光显微镜下,与未处理细胞相比,经rTNF-α蛋白处理后鲫鱼鳍条细胞的细胞核发生明显的变化,细胞核染色加深,呈碎块状致密浓染,表现为细胞核模糊、弥散且边界不清,表明用rTNF-α蛋白处理能够诱导鲫鱼尾鳍细胞发生凋亡。
2.5 凋亡相关基因的表达变化
为进一步研究rTNF-α蛋白对凋亡相关基因表达水平的影响,用rTNF-α蛋白处理鲫鱼鳍条细胞,于刺激后不同时间点收集细胞,采用荧光定量PCR检测Caspase 3和Caspase 8基因的表达水平,如图5所示。从图5可见:用 rTNF-α蛋白处理后,Caspase 3和Caspase 8基因均发生上调表达;随着处理时间的延长,这两个基因的表达呈现先上升后下降的趋势,其表达量从处理后6 h开始上升,处理24 h后达到表达高峰,随后开始下降直至试验结束。
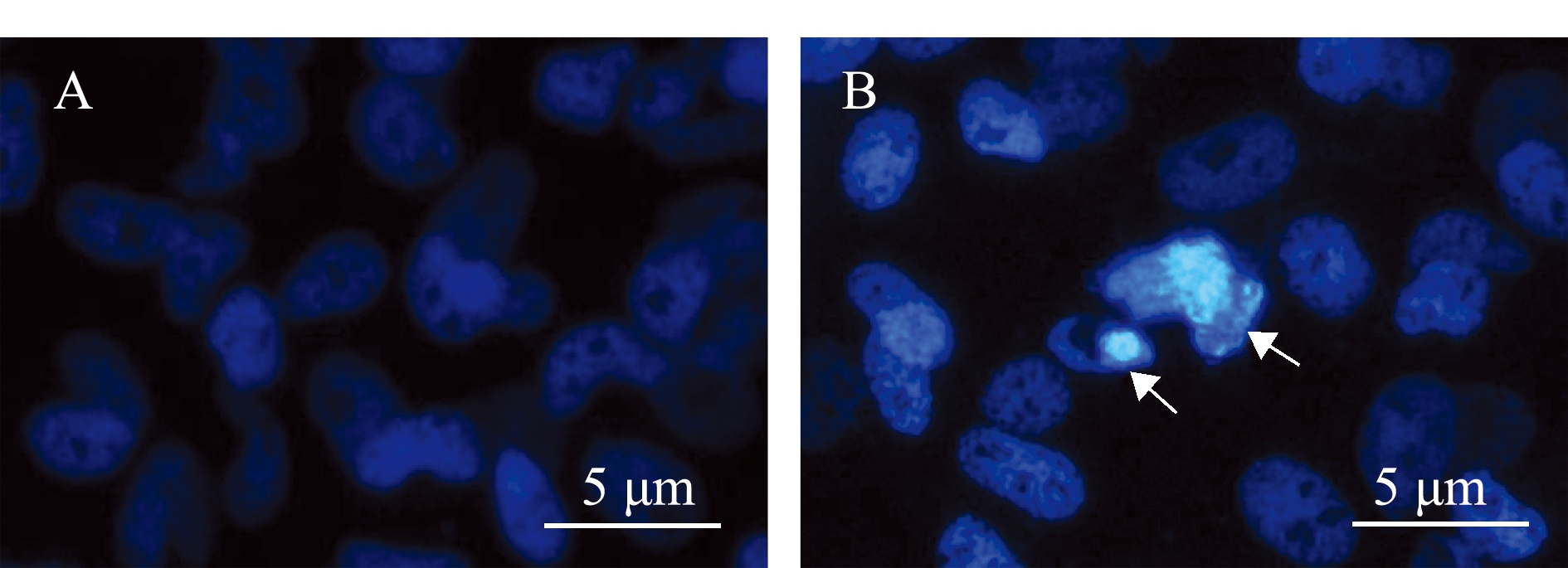
注:A,未处理组;B,rTNF-α处理组
Note:A, untreated group; B, rTNF-α treated group
图4 重组TNF-α蛋白处理鳍条细胞后的Hoechst 33258染色结果
Fig.4 Hoechst 33258 staining results of crucian carp fin(CAF)cells treated with recombinant TNF-α protein

图5 rTNF-α蛋白处理鲫鱼鳍条细胞后凋亡相关基因的表达变化
Fig.5 Expression changes in apoptosis-related genes in CAF cells treated with rTNF-α protein
3 讨论
3.1 异育银鲫TNF-α的扩增及重组表达
TNF-α作为一种重要的促炎症细胞因子,在鱼类抵御异物入侵、维持机体稳定等方面发挥着重要的作用。特别是当病毒感染鱼体后,TNF-α常会大量分泌,并诱导机体进入抗病毒状态[12]。鉴于TNF-α主要由巨噬细胞和单核细胞分泌,这些细胞主要存在于鱼类的脾脏或头肾等免疫器官中,因此,本文中提取了异育银鲫脾脏的RNA,经反转录后进行TNF-α扩增,琼脂糖凝胶电泳显示,在约627 bp处出现了特异性的扩增条带,这与异育银鲫TNF-α蛋白的预期分子量大小一致。
大肠杆菌表达系统是目前最常用的外源蛋白表达系统之一,其具有目的基因表达量高、制备周期短、便于纯化、成本相对低等特点[13],是大多数外源蛋白重组表达的首选系统。在鱼类中,杨智景等[14]获得了香鱼Plecoglossus altivelis TNF-α基因全长cDNA 序列,采用大肠杆菌表达系统进行了重组表达并制备抗TNF-α多抗,发现香鱼TNF-α的表达与病原体感染密切相关。相似地,陈丹燕等[15]采用大肠杆菌表达系统进行了草鱼Ctenopharyngodon idellus TNF-α的重组表达,利用重组TNF-α蛋白刺激草鱼头肾白细胞后,Real-time PCR分析显示,rgc TNF-α能明显诱导NF-κB信号通路中相关因子的mRNA表达水平。本研究中,采用大肠杆菌表达系统进行了异育银鲫TNF-α的重组表达,SDS-PAGE电泳显示,在相对分子质量约为23 000处出现了明显的蛋白条带,这与异育银鲫TNF-α蛋白的理论分子量一致,提示成功实现了异育银鲫TNF-α的重组表达。
由于利用大肠杆菌表达系统进行表达时,重组蛋白常以包涵体形式存在[16],其蛋白构象和抗体表位与天然蛋白相去甚远,所以需对重组蛋白进行复性。目前,常用的复性方法一般为浓度梯度复性,即通过尿素或者盐酸胍等变性剂将错误折叠的多肽链打开,然后利用蛋白自身的特点,恢复其天然构象[17-18]。本研究中,采用尿素浓度梯度法对rTNF-α蛋白进行了复性,将复性后的蛋白进行Western-blot鉴定(图3),纯化后的蛋白与抗His单抗在相对分子质量约23 000处出现了明显的反应条带,这与异育银鲫TNF-α蛋白的预期分子量大小一致,说明获得了正确的rTNF-α复性蛋白。
3.2 重组TNF-α蛋白能诱导鲫鱼细胞发生凋亡
细胞凋亡是细胞在遭遇不利刺激后采取的一种主动的、受基因调控启动的有序死亡方式,在维持机体细胞正常发育、动态平衡和免疫应答等过程中发挥重要作用[19]。本研究中,采用Hoechst 33258染色法观察rTNF-α蛋白对鲫鱼细胞的影响(图4),经rTNF-α蛋白处理鲫鱼鳍条细胞后,在处理后24 h时,处理组细胞的细胞核出现弥散、边界不清等典型的细胞凋亡变化,说明复性后的rTNF-α具有一定的促细胞凋亡活性。
在哺乳动物中,TNF-α能够与细胞表面的TNFR受体结合进而募集凋亡相关酶,启动细胞凋亡的发生,这一过程伴随着Caspase信号通路的激活及相关基因的表达[20]。本试验中,用rTNF-α蛋白处理鳍条尾鳍细胞,选取处理后不同时间点的样品进行凋亡相关基因表达分析,结果表明,Caspase 8和Caspase 3基因的表达水平在6 h后开始上调,到24 h时达到高峰,随后逐渐下降。相似地,Lu等[21]采用大肠杆菌表达系统重组表达了草鱼TNF-α蛋白,将其刺激CIK细胞后发现TRADD、Caspase 8等表达水平显著上升,这与本试验中TNF-α处理后鲫鱼尾鳍细胞的凋亡变化规律一致,表明异育银鲫rTNF-α蛋白能够通过激活Caspase信号通路进而诱导鲫鱼鳍条细胞发生凋亡。
4 结论
本研究中扩增了异育银鲫TNF-α基因,并构建了原核表达载体pET28a-TNF-α。在IPTG诱导下,TNF-α蛋白在大肠杆菌BL21(DE3)中实现了高效表达,经Ni柱亲和层析法纯化、尿素浓度梯度透析复性,获得了高浓度的异育银鲫重组TNF-α蛋白。Western-blot显示,rTNF-α蛋白能够与抗His单抗发生特异性反应。Hoechst 33258染色和荧光定量PCR表明,rTNF-α蛋白能够使鲫鱼鳍条细胞发生凋亡,并使Caspase 3和Caspase 8 mRNA表达水平上升,这表明rTNF-α蛋白具有一定的促细胞凋亡活性。异育银鲫TNF-α蛋白的表达将为后续研究TNF-α蛋白的抗病毒作用奠定基础。
[1] Jiang Nan,Xu Jin,Ma Jie,et al.Histopathology and ultrastructural pathology of cyprinid herpesvirus II(CyHV-2)infection in gibel carp,Carassius auratus gibelio[J].Wuhan University Journal of Natural Sciences,2015,20(5):413-420.
[2] 王友含,黄云芳.鱼类肝胆综合症的防治[J].农家致富,2007(14):43-44.
[3] Hirono I,Nam B H,Kurobe T,et al.Molecular cloning,characterization,and expression of TNF cDNA and gene from Japanese flounder Paralychthys olivaceus[J].The Journal of Immunology,2000,165(8):4423-4427.
[4] Laing K J,Wang Tiehui,Zou Jun,et al.Cloning and expression analysis of rainbow trout Oncorhynchus mykiss tumour necrosis factor-α[J].European Journal of Biochemistry,2001,268(5):1315-1322.
[5] Rhee J S,Jeong C B,Kim D H,et al.Immune gene discovery in the crucian carp Carassius auratus[J].Fish & Shellfish Immunology,2014,36(1):240-251.
[6] 钟应佳,王霞,郑雪莲,等.热休克蛋白90抑制剂对TNFα诱导肿瘤细胞凋亡和调控NF-κB信号通路的影响[J].四川大学学报:医学版,2011,42(3):303-307.
[7] Garlet G P.Destructive and protective roles of cytokines in periodontitis:a re-appraisal from host defense and tissue destruction viewpoints[J].Journal of Dental Research,2010,89(12):1349-1363.
[8] Lee X,Yi Yang,Weng Shaoping,et al.Transcriptomic analysis of koi(Cyprinus carpio)spleen tissue upon cyprinid herpesvirus 3(CyHV3)infection using next generation sequencing[J].Fish & Shellfish Immunology,2016,49:213-224.
[9] Woo C H,Kim T H,Choi J A,et al.Inhibition of receptor internalization attenuates the TNFα-induced ROS generation in non-phagocytic cells[J].Biochemical and Biophysical Research Communications,2006,351(4):972-978.
[10] 徐文斌,孙晓波.异育银鲫的生物学特性及其在我省的增养殖前景[J].黑龙江水产,1993(2):38-39.
[11] 陆宏达,张连义,王建国,等.患上皮瘤病异育银鲫几种免疫相关酶活性的变化[J].大连海洋大学学报,2010,25(4):343-347.
[12] 邱丽华,张汉华,吴进锋.鱼类肿瘤坏死因子基因和受体的研究进展[J].中国水产科学,2004,11(5):482-487.
[13] 卢晟晔,王丽颖.大肠杆菌中外源蛋白高效表达的影响因素及策略研究的新进展[J].中国实验诊断学,2006,10(9):1100-1103.
[14] 杨智景,李长红,张浩,等.香鱼(Plecoglossus altivelis)肿瘤坏死因子-α(TNF-α)基因的分子克隆、鉴定及免疫相关性表达[J].海洋与湖沼,2015,46(6):1380-1389.
[15] 陈丹燕.草鱼TNF-α和IFNγ2的克隆鉴定、重组表达及生物学功能的研究[D].成都:电子科技大学,2012.
[16] 余波,程安春,汪铭书.大肠杆菌中重组蛋白可溶性表达的研究进展及展望[J].黑龙江畜牧兽医,2008(10):19-21.
[17] 于瑞嵩,黄建珍,李震.尿素浓度梯度复性重组牛白细胞介素-2[J].上海农业学报,2006,22(4):33-36.
[18] 冯小黎.重组包涵体蛋白质的折叠复性[J].生物化学与生物物理进展,2001,28(4):482-485.
[19] 李卫中.细胞凋亡与免疫活性细胞的研究进展[J].陕西医学杂志,2006,35(4):467-468.
[20] 凌波,严亨秀.阿司匹林抑制NF-κB对人卵巢癌TNF-α诱导细胞凋亡的增敏作用及机制研究[J].华西药学杂志,2014,29(4):374-377.
[21] Lu Jianfei,Li Yan,Shen Zhaoyuan,et al.TNF-α is involved in apoptosis triggered by grass carp reovirus infection in vitro[J].Fish & Shellfish Immunology,2016,55:559-567.