为了预防水产动物病害,抗生素在近海的集约化水产养殖过程中被普遍施用[1-2]。截至2016年,据农业农村部统计,每年在水产养殖业施用的抗生素超过20万t,并且使用量还呈逐渐增加的趋势[3]。有研究显示,养殖过程中大量施用的抗生素不能被养殖的水产动物完全吸收,其中大部分以母化合物和代谢物的形式在水环境中残留,呈现出“假持久性”[4-5]。因而,有超过20种抗生素及其代谢物(如氟喹诺酮类、磺胺类和氯霉素类)在中国近海的水产养殖主产区普遍检出[6-8]。如在渤海养殖区附近的海水中有21种抗生素被检出,其总浓度高达7722 ng/L[6-7];在中国南方水产养殖主产区,有11种抗生素的平均浓度范围为72~480 ng/L[8]。随着对水产养殖区抗生素残留的关注,人们逐渐认识到养殖环境中抗生素抗性基因(antibiotic resistance genes, ARGs)的存在和散布,可能对人类健康产生更严重的威胁[9-10]。ARGs具有不易消亡,可复制或传播,能够在环境中长期存在的特征,对环境生态和人类健康造成巨大的潜在威胁。因此,水环境中的ARGs已成为人们关注的新兴环境污染物[11-12]。
水产养殖环境已经是世界公认的ARGs储存库[13-14]。研究显示,有多种ARGs已在水产养殖环境及其受纳水体中被普遍检出[14-19]。如山东东营养殖区周围的沉积物中17种ARGs的丰度显著高于非养殖区[16];中国南方养殖主产区海水中9种四环素类、磺胺类抗生素ARGs和2种整合子持久存在[8];在珠江三角洲沿岸的养殖虾池中,氟喹诺酮类、磺胺类、氯霉素ARGs和2种整合子普遍检出,且发现ARGs可在养殖过程中不断增殖、传播[15]。越来越多的研究显示,即使在缺乏抗生素筛选压力的条件下,ARGs仍可在水产养殖环境中持续检出[17-20]。如在无抗生素使用的珠江沿岸生态鱼塘的沉积物中发现,高丰度的磺胺类ARGs持续存在,家禽粪便是ARGs增殖的重要原因[17];四环素、磺胺类耐药细菌和ARGs被发现于无抗生素施用历史的鱼场,这可能与养殖活动中投喂的鱼粉或其他外源输入有关[18-19]。Han等[20]研究了养殖水环境中添加鱼粉对沉积物中ARGs的影响,揭示鱼粉中包含的大量氮磷改变了沉积物的细菌族群组成,间接促进了沉积物中ARGs的增殖。Zhao等[16]和He等[21]的研究显示,养殖环境中重金属和营养盐也对ARGs的存在和散布具有协同筛选影响。可见,养殖环境中影响ARGs存在、分布和传播的因素非常复杂。因此,针对不同养殖模式/养殖品种的水产养殖区,ARGs污染水平及其环境影响因素的相关研究仍需进一步开展,以便更好地了解和评价养殖水环境中ARGs的存在和散布风险。
近海滩涂养殖区是海洋系统中最易受到人类活动污染的区域之一[22-23]。近年来,典型滩涂养殖沉积物中重金属和抗性细菌的污染已有报道[18,24],但目前仍缺乏针对典型滩涂养殖区中ARGs污染情况的报道。本研究中,选取大连皮口的典型滩涂养殖区为研究区域,对15种ARGs和2种整合子的存在和丰度进行评价,同时考察了该养殖区沉积物中抗生素、重金属和理化指标(盐度、溶解性有机质和营养盐)对ARGs的影响,以期为养殖水环境中ARGs的生态环境风险评估提供科学依据。
1 材料与方法
1.1 调查区域及样品的采集
2016年3月、6月、9月和11月四个季节,选取黄海北部大连皮口的典型滩涂贝类养殖区作为研究区域(122°40′39″~122°44′04″E、39°39′59″~39°41′08″N),研究区域内设置4个采样点(C1、C2、C3和C4(图1)。从每个采样点采集沉积物3份,共计48个样品,将所采集的沉积物样品(100 g)用已灭菌的铝箔纸包好放到无菌自封袋中,于4 ℃下保存(用冰块降温)并带回大连海洋大学水环境化学实验室。用于DNA提取的沉积物样品,运回实验室后保存于-80 ℃冰箱中;用于抗生素和其他理化指标测定的沉积物样品,用无菌自封袋分装后于4 ℃下避光保存。
1.2 方法
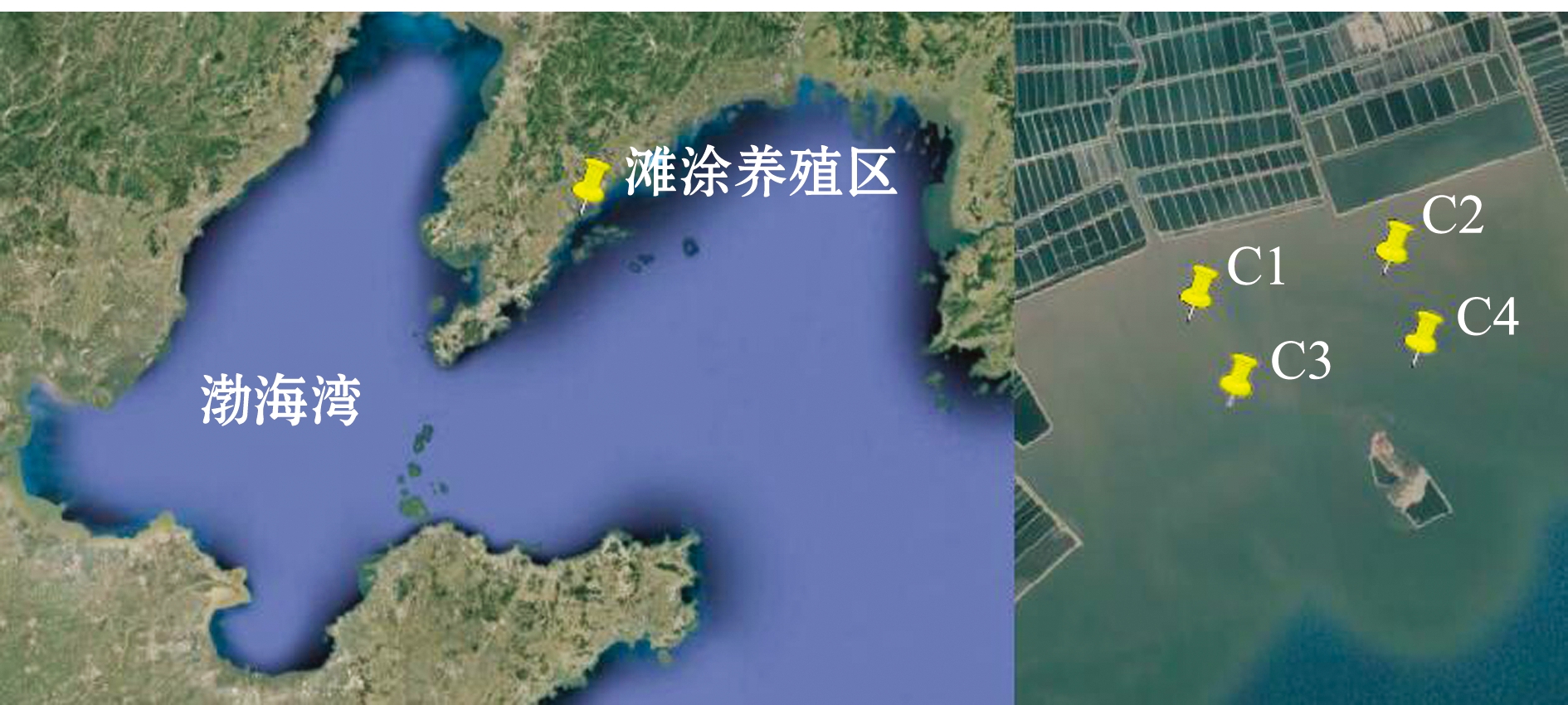
图1 研究区域及采集位置
Fig.1 Sampling sites in the test area
1.2.1 DNA提取 采用Fast DNA SPIN Kit for Soil(MP Biomedical,美国)试剂盒,按照说明书对保存的沉积物样品进行DNA提取,最终得到体积为40 μL的DNA样品。提取后的DNA通过10 g/L的琼脂糖凝胶电泳(Bio-Rad, 美国)检测其完整性,于-20 ℃下保存。采用超微量分光光度计(Nanodrop, ND1000, Thermo, 美国)对DNA进行浓度和纯度的检测。最后,配制每个样品的部分DNA提取物为终浓度40 ng/μL,用于后续的ARGs定性和定量分析。
1.2.2 沉积物中ARGs的定性和定量分析 利用9902 普通PCR仪(ABI,美国)对15种ARGs(qnrA、qnrB、qnrC、qnrD、qnrS、qepA、aac(6′)-Ib、su11、su12、su13、cmlA、floR、fexA、fexB、cfr)、2 种整合子(int1、int2)和16S rRNA基因进行定性分析。PCR反应体系(25 μL)包括:DNA 提取物模板2.5 μL,正、反向引物各2.5 μL,dNTPs 2 μL,10× Ex Taq buffer(Mg2+ Plus)2.5 μL,qTaq DNA 聚合酶1.25 μL,无菌水11.75 μL。本研究中所用引物详细信息见表1。PCR反应程序:95 ℃下预变性5 min;95 ℃变性30 s,退火30 s,退火温度见表1,72 ℃延伸30 s,共进行40个循环;最后在72 ℃延伸1 min,采用15 g/L琼脂糖凝胶电泳验证PCR产物的大小和特异性。验证后的PCR产物经过切胶回收并纯化后连接至pMD-18T载体(TaKaRa,日本),转化至E.coli DH5α感受态细胞中进行克隆。克隆成功后,应用SanPrep柱式质粒DNA小量抽提试剂盒(TaKaRa,日本)对包含目的基因的质粒进行提取。提取的质粒送生工生物工程(上海)股份有限公司测序,所得的序列与NCBI网站中的目的基因序列进行同源性比对(一致性高于98%)。至此,经生物公司验证含有目的基因的质粒可作为质粒标准品,质粒标准品浓度为1.23×1013~7.82×1013 copies/μL,稀释标准质粒为102~1013。应用质粒外标法制备18个目的基因标准曲线,对沉积物样品中ARGs进行定量分析。
表1 PCR定量抗性基因表达引物序列与扩增参数
Tab.1 Primer sequences and amplification parameters for PCR quantitative expression of antibiotic resistance genes(ARGs)
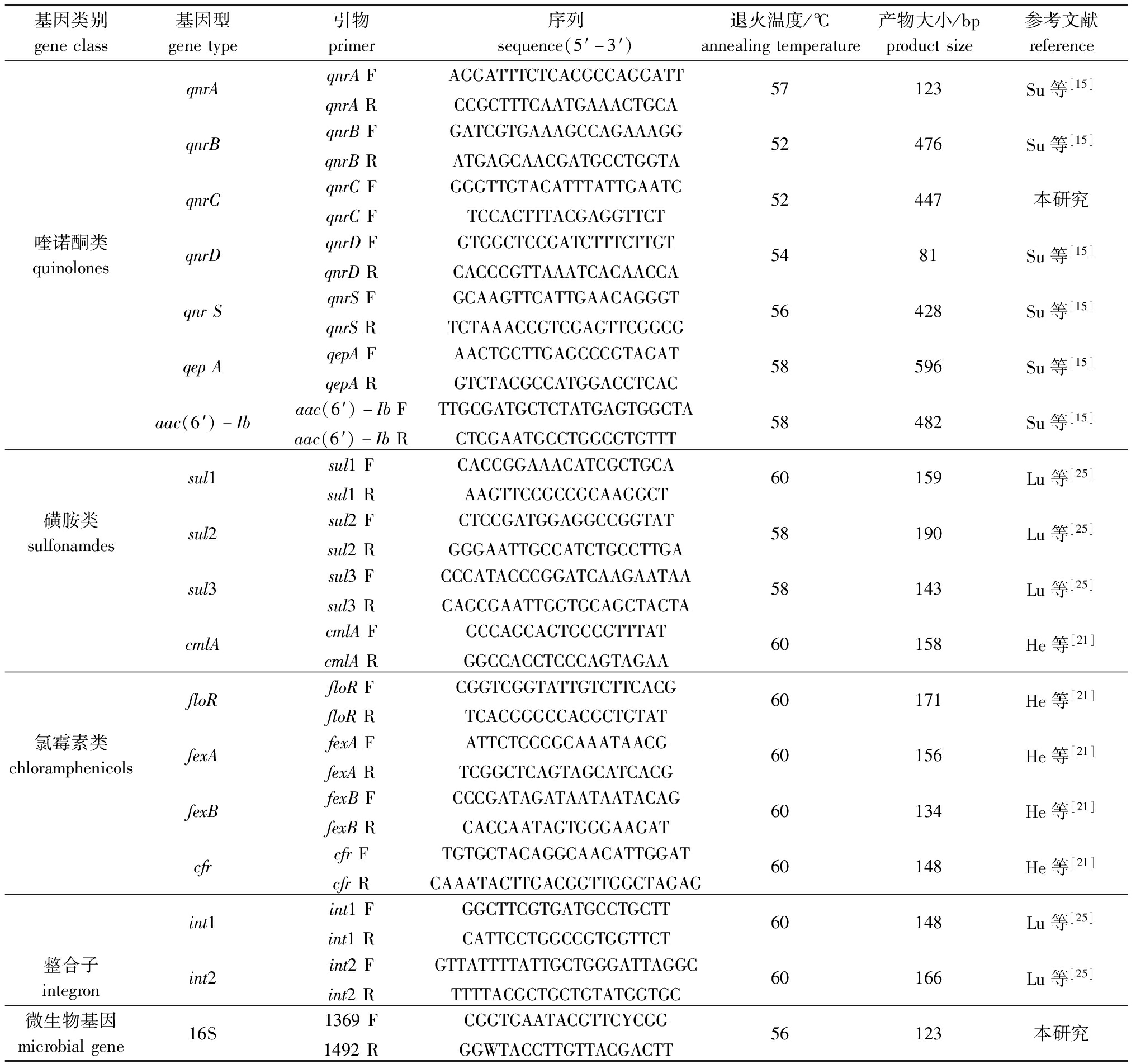
基因类别geneclass基因型genetype引物primer序列sequence(5′-3′)退火温度/℃annealingtemperature产物大小/bpproductsize参考文献referenceqnrAqnrAFAGGATTTCTCACGCCAGGATTqnrARCCGCTTTCAATGAAACTGCA57123Su等[15]qnrBqnrBFGATCGTGAAAGCCAGAAAGGqnrBRATGAGCAACGATGCCTGGTA52476Su等[15]qnrCqnrCFGGGTTGTACATTTATTGAATCqnrCFTCCACTTTACGAGGTTCT52447本研究喹诺酮类quinolonesqnrDqnrDFGTGGCTCCGATCTTTCTTGTqnrDRCACCCGTTAAATCACAACCA5481Su等[15]qnrSqnrSFGCAAGTTCATTGAACAGGGTqnrSRTCTAAACCGTCGAGTTCGGCG56428Su等[15]qepAqepAFAACTGCTTGAGCCCGTAGATqepARGTCTACGCCATGGACCTCAC58596Su等[15]aac(6′)-Ibaac(6′)-IbFTTGCGATGCTCTATGAGTGGCTAaac(6′)-IbRCTCGAATGCCTGGCGTGTTT58482Su等[15]sul1sul1FCACCGGAAACATCGCTGCAsul1RAAGTTCCGCCGCAAGGCT60159Lu等[25]磺胺类sulfonamdessul2sul2FCTCCGATGGAGGCCGGTATsul2RGGGAATTGCCATCTGCCTTGA58190Lu等[25]sul3sul3FCCCATACCCGGATCAAGAATAAsul3RCAGCGAATTGGTGCAGCTACTA58143Lu等[25]cmlAcmlAFGCCAGCAGTGCCGTTTATcmlARGGCCACCTCCCAGTAGAA60158He等[21]floRfloRFCGGTCGGTATTGTCTTCACGfloRRTCACGGGCCACGCTGTAT60171He等[21]氯霉素类chloramphenicolsfexAfexAFATTCTCCCGCAAATAACGfexARTCGGCTCAGTAGCATCACG60156He等[21]fexBfexBFCCCGATAGATAATAATACAGfexBRCACCAATAGTGGGAAGAT60134He等[21]cfrcfrFTGTGCTACAGGCAACATTGGATcfrRCAAATACTTGACGGTTGGCTAGAG60148He等[21]int1int1FGGCTTCGTGATGCCTGCTTint1RCATTCCTGGCCGTGGTTCT60148Lu等[25]整合子integronint2int2FGTTATTTTATTGCTGGGATTAGGCint2RTTTTACGCTGCTGTATGGTGC60166Lu等[25]微生物基因microbialgene16S1369FCGGTGAATACGTTCYCGG1492RGGWTACCTTGTTACGACTT56123本研究
利用7500快速荧光定量PCR仪(ABI, 美国)测定沉积物中ARGs的绝对浓度。定量PCR反应体系(20 μL)包括:DNA提取物模板2 μL,正、反向引物各0.6 μL,SYBR Premix Dimer Eraser 10 μL,无菌水6.8 μL。定量PCR运行的程序设置条件与普通PCR一致,定量PCR仪所附带的程序在扩增后自动进行溶解曲线分析。所得标准曲线的R2值均超过0.971,定量PCR的效率为92.0%~106.0%。为了保证沉积物样品测定的有效性,每组试验均设置阴性对照,且每组样品进行3次平行扩增。仅当每组3次均出现阳性扩增时,认为沉积物样品中的目的基因被有效检测。普通PCR、定量PCR的反应体系和琼脂糖凝胶电泳所用试剂均购于日本TaKaRa。
1.2.3 化学分析 采用pH计和电导盐度计(Thermo, P310/EC500, 美国)分别测定沉积物样品中的pH值和盐度;采用显色法测定沉积物样品中的总氨氮(TAN)、总氮(TN)和总磷(TP)含量;应用元素分析仪(Elementar, 德国)测定沉积物样品中的总有机碳(TOC)含量;应用电感耦合等离子体质谱仪(ICP-MS 7500, Agilent, 美国)测定沉积物样品中的重金属铜(Cu)、锌(Zn)、镉(Cd)、铬(Cr)、汞(Hg)和铅(Pb)含量。所有的检测过程均参照GB 17378.5—2007《海洋检测规范》第五部分:沉积物分析方法和Lu等[25]报道的方法。
采用HPLC-MS/MS质谱联用法(Agilent,6470, 美国)对三大类抗生素进行分析,包括:6种氟喹诺酮类抗生素FQs(诺氟沙星NOR、环丙沙星CIP、恩诺沙星EFC、洛美沙星LFC、氧氟沙星(OFC)和沙氟沙星SFC);13种磺胺类抗生素(SAs)(磺胺醋酰SAAM、磺胺地索辛SDM、磺胺多辛SDX、磺胺嘧啶SDZ、磺胺异噁唑SIX、磺胺对甲氧嘧啶SM、磺胺二甲氧嘧啶SM2、磺胺间甲氧嘧啶SMM、磺胺甲氧哒嗪SMP、磺胺甲基嘧啶SMR2、磺胺甲噁唑SMZ、磺胺甲噻二唑SMTZ和磺胺噻唑STZ);2种氯霉素类抗生素(CAPs)(氯霉素CAP、氟苯尼考FF)。将上述待测抗生素的标准品用甲醇制成质量浓度为1 g/L的标准储备液,保存于-20 ℃冰箱中。所有标准品及溶剂乙腈均购于德国Dr.Ehrenstorfer公司。
样品的前处理依据杜娟等[26]的方法并进行优化。沉积物样品经冷冻干燥后过孔径为0.3 mm筛,准确称取1.0 g,加入回收率标准品氘代磺胺甲恶唑50 ng,在暗处静置1 h后,加入10 mL甲醇∶乙腈(体积比为1∶1,下同)的提取液。以200 r/min振荡20 min,然后超声15 min,重复两次合并提取液,并用盐酸调节其pH至2.5。选取Oasis HLB SPE小柱(500 mg/6 mL)作为萃取柱进行富集。上样前,SPE柱依次用30 mL的甲醇、9 mL的超纯水和9 mL的盐酸溶液(pH 2.5)活化,上样流速为10 mL/min,然后用10 mL超纯水进行淋洗,用氮气吹5 min,最后用100%甲醇洗脱。洗脱液经过40 ℃水浴并旋蒸至近干,用甲醇∶乙腈提取液溶解残渣,定容至1 mL,过0.22 μm有机滤膜,待测。以0.1%甲酸∶1 g/L甲酸铵水溶液和甲醇∶乙腈体系分别作为流动相A和流动相B,经过梯度洗脱对待测的抗生素含量进行定性定量分析。仪器检测方法、精度及质量控制均依照叶赛等[27]和Ye等[28]的方法进行。所有样品的抗生素定量范围均在0.05~0.20 ng/L。每种沉积物样品的前处理和抗生素检测均设置3组平行。甲醇和乙腈(色谱级)购自美国Sigma公司,甲酸和甲酸铵(分析纯)购自天津市科密欧化学试剂有限公司。
1.3 数据处理
采用SPSS 18.0软件进行ARGs丰度与沉积物环境指标的相关性分析,以及不同沉积物样品间ARGs的丰度差异分析;采用Canoco 4.5对沉积物样品进行典范对应分析(CCA)。
2 结果与分析
2.1 大连皮口典型滩涂养殖区沉积物中ARGs检出种类和浓度
从图2可见:除qnrC和fexB外,13种ARGs和2种整合子在养殖区沉积物中普遍存在,其中包括6种喹诺酮类ARGs、3种磺胺类ARGs和4种氯霉素类ARGs;qnrS和sul1是4个站位沉积物中最常检出的ARGs,检出频率为100%,其他ARGs检出频率依次为sul2、floR(95%)>qnrA、qnrB、qepA、fexA、int1(83.3%)>aac(6′)-Ib、cmlA、sul3、int2(60%)>qnrD(50%)>cfr(25%);沉积物中ARGs浓度范围的对数[lg(copies/g),下同]为1.57~5.94;在检出的ARGs中,qnrS的平均浓度最高,其对数值达到5.27,其次是sul1,平均浓度的对数值为5.15,cfr浓度最低,平均浓度的对数值仅为2.03。另外,本研究中对沉积物中细菌族群的总浓度(16S rRNA)也进行了测定,结果显示,其年季浓度范围的对数值为5.80~6.87。为了更准确地评价ARGs的丰度水平,避免细菌总丰度变化引起环境因素对ARGs的影响,后续研究中ARGs丰度均采用经16S rRNA标准化后的常用对数值来表示。图3为大连皮口典型滩涂养殖区沉积物中ARGs的年季分布热图,其中ARGs丰度范围的对数[lg(copies/g)]为-5.08~-1.22,qnrA、qnrB、qnrS、sul1、sul2、floR和fexA是沉积物中优势的ARGs类型。
2.2 大连皮口典型滩涂养殖区沉积物的理化特征、重金属和抗生素的年季含量
从表2可见:2016年,沉积物年季的pH和盐度范围分别为8.10~8.69和24.7~26.7,pH和盐度的平均值在春季(3月)和冬季(11月)显著高于夏季(6月)和秋季(9月)(P<0.05);沉积物中年季的TN、TP、TAN和TOC的浓度范围分别为8.602~10.580、0.335~0.482、1.659~1.792、16.447~16.666 g/kg,且TP、TAN和TOC含量各季节均无统计学差异(P>0.05),但夏季和秋季的TN含量显著高于春季和冬季(P<0.05),表明夏季和秋季滩涂养殖区的水产养殖活动对沉积物中TP、TAN和TOC含量的影响很小,但对TN含量的影响显著。
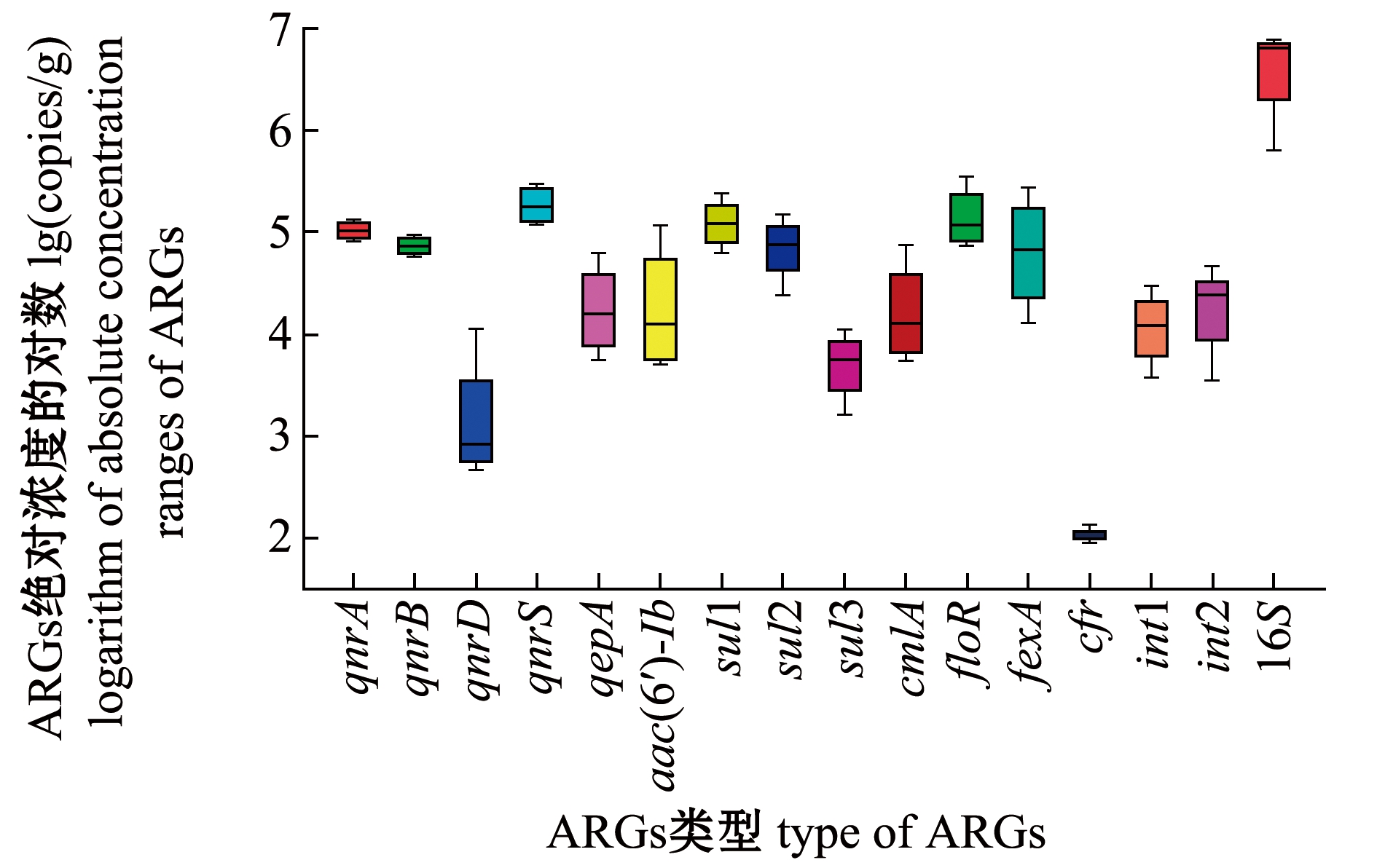
图2 大连皮口典型滩涂养殖区沉积物中ARGs的检出种类和范围
Fig.2 Annual tested types and range of ARGs in sediments at Pikou typical intertidal mudflat culture areas in Dalian
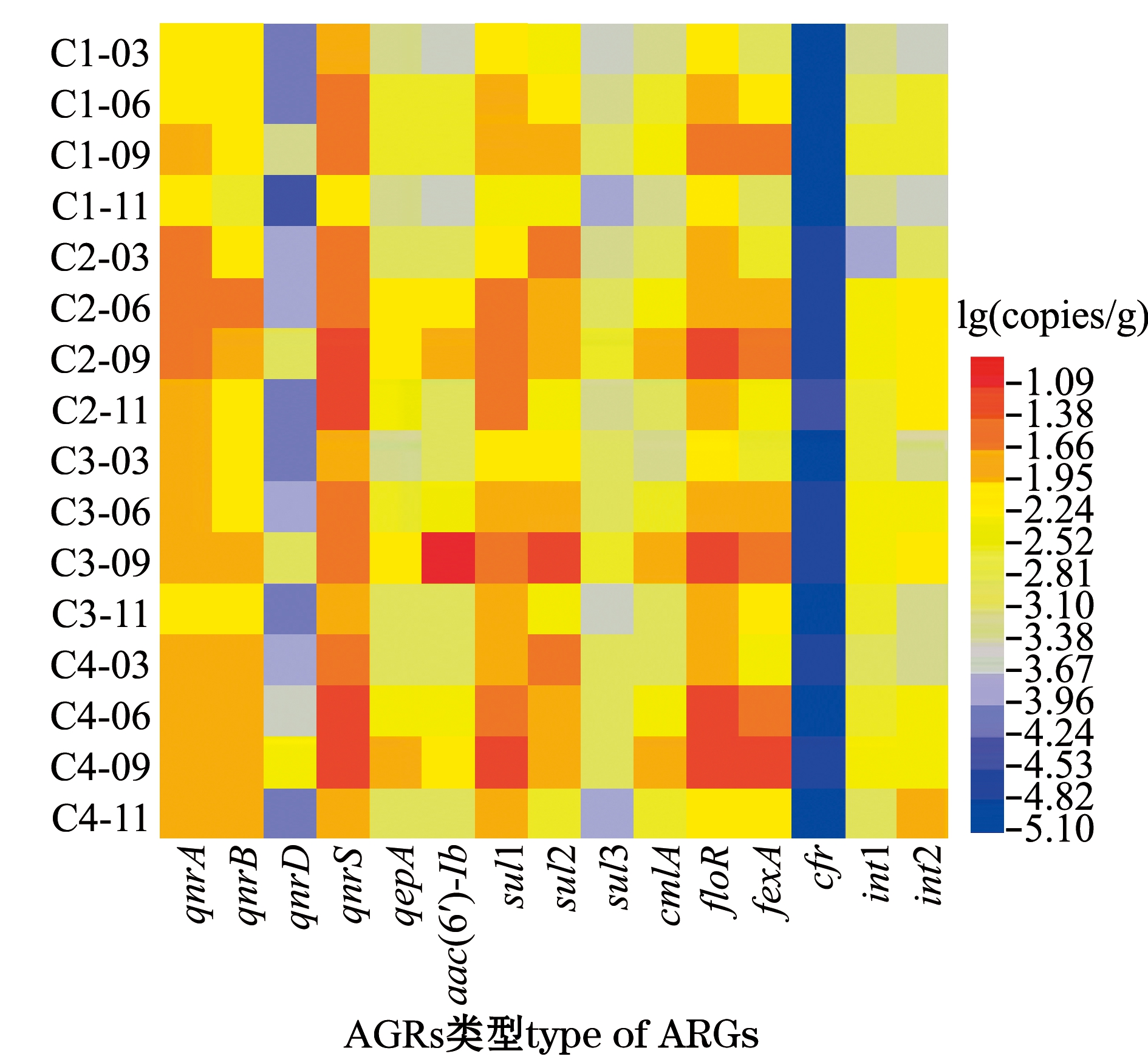
图3 典型滩涂养殖区沉积物中ARGs的年季分布热图
Fig.3 Annual distribution heatmap of ARGs in sediments of typical intertidal mudflat culture area
表2 典型滩涂养殖区沉积物的年季理化特征
Tab.2 Annual physicochemical characteristics in sediments of typical intertidal mudflat culture area
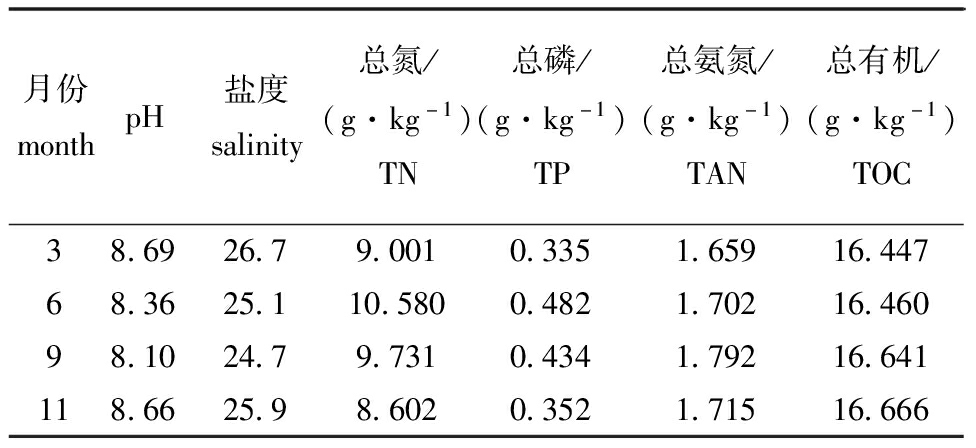
月份monthpH盐度salinity总氮/(g·kg-1)TN总磷/(g·kg-1)TP总氨氮/(g·kg-1)TAN总有机/(g·kg-1)TOC38.6926.79.0010.3351.65916.44768.3625.110.5800.4821.70216.46098.1024.79.7310.4341.79216.641118.6625.98.6020.3521.71516.666
从表3可见:2016年年季沉积物中Cu、Zn、Cr、Cd、Pb和Hg的浓度范围分别为16.456~23.509、60.141~93.478、1.140~1.740、0.120~0.143、23.274~27.075、0.019~0.037 mg/kg;夏季和秋季Cu和Zn浓度显著高于春季和冬季(P<0.05),其他金属浓度未见有统计学差异(P>0.05),表明季节性的人类养殖活动对沉积物中Cu和Zn的存在和分布影响较大,但对其他金属未表现出明显影响。
从表4和图4可见:沉积物中共检出15种抗生素,FQs是最优势的检出类型,其中6种特性的FQs全部检出,检出总浓度范围为4.682~78.368 ng/g,表明FQs可能是该滩涂养殖区主要施用的抗生素类型,NOR、LFC、OFC和SFC为优势检出的FQs类型,检出频率分别为100%、75%、75%、77%;SAs和CAPs的检出总浓度范围分别为4.312~26.463、0.953~1.436 ng/g,共有7种SAs被检出,其浓度范围为ND~7.066 ng/g,STZ、SDZ、SM和SAAM为SAs中优势的检出类型,检出频率大于50%,而2种CAPs的检出频率为100%,但其检出浓度范围仅为0.382~0.716 ng/g。由图4所示,夏季和秋季沉积物中抗生素的检出浓度显著高于春季和冬季(P<0.05),揭示了频繁的夏季和秋季养殖活动中,施用抗生素的频繁程度可能对沉积物中抗生素的累积具有一定影响[3,7]。
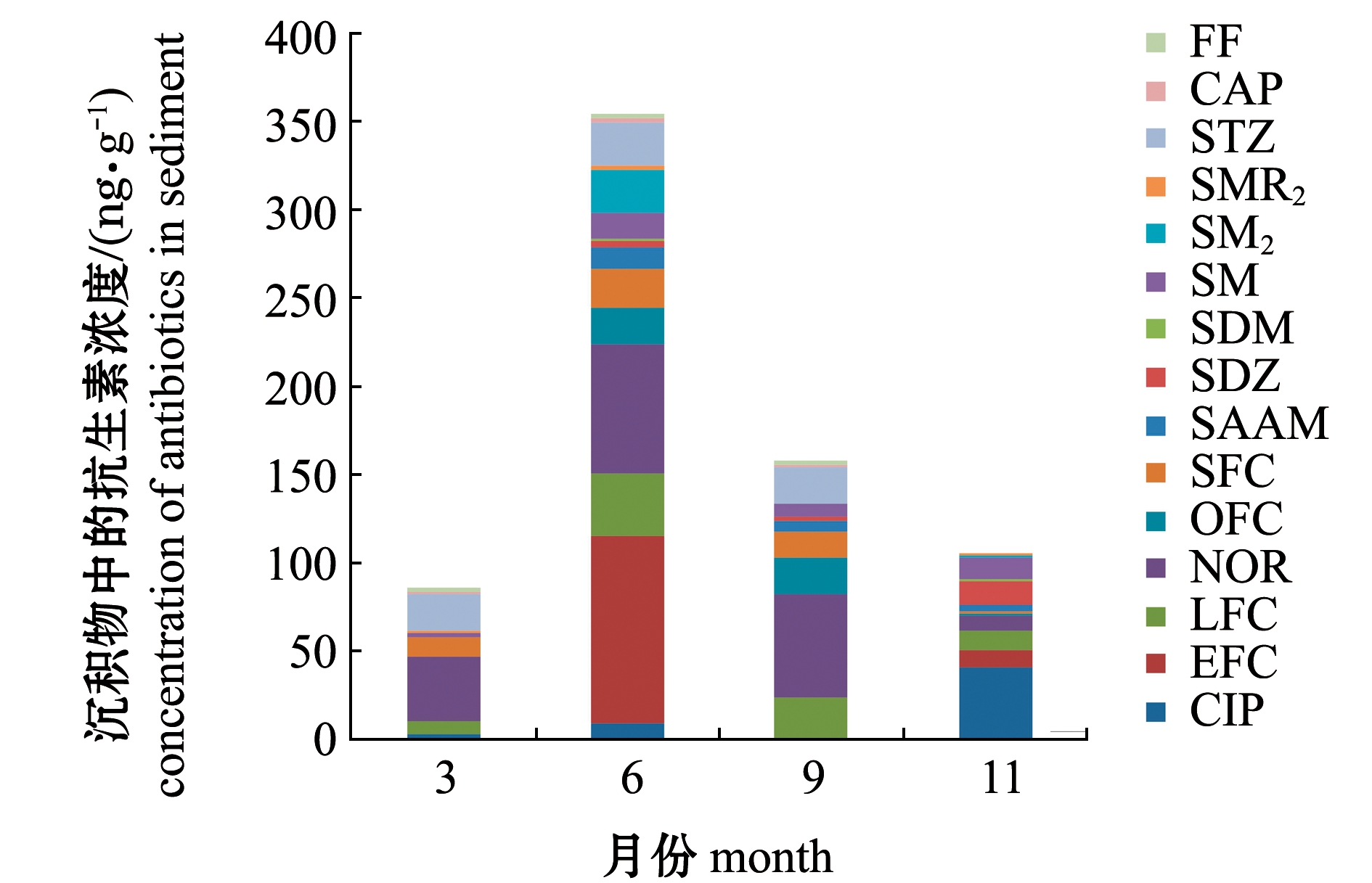
图4 典型滩涂养殖区沉积物中抗生素的年季组成
Fig.4 Annual composition of antibiotics in sediments of typical intertidal mudflat culture area
2.3 大连皮口典型滩涂养殖区沉积物中ARGs与理化特征、重金属、抗生素的相关性分析
基于皮尔森相关性的统计结果,本研究中分析了沉积物中理化指标、重金属和抗生素对ARGs的影响。首先,将所测定的沉积物中各种环境变量分为两个组别,分别为抗生素和其他环境因素,其他环境因素中包含沉积物的基础理化特征(TOC、TN、TP、TAN)和重金属因子(Cu、Zn、Cr、Cd、Hg和Pb)。其次,应用皮尔森相关性分析抗生素、环境因素与ARGs之间的相关性,结果如表5所示。其中,Cu和Zn与ARGs的丰度呈现极显著正相关(r=0.676~0.784, P<0.01),而pH、盐度、Cr和Pb则与ARGs呈现显著负相关(r=-0.897~-0.696, P<0.05或P<0.01)。5种抗生素NFC、SAAM、STZ、CAP和FF分别与其相应的ARGs类型呈显著正相关(r=0.590~0.853, P<0.05或P<0.01),表明抗生素对其相应的ARGs存在和分布具有直接筛选作用。值得注意的是,NFC、SAAM也分别对sul3(r=0.722,P<0.05)和aac(6′)-Ib(r=0.845, P<0.01)表现出相关性,揭示抗生素对其他类型的ARGs存在和分布也提供了间接的筛选作用。
表3 典型滩涂养殖区沉积物中重金属年季检出含量
Tab.3 Annual detected contents of heavy metals in sediments of typical intertidal mudflat culture area mg/kg

月份month铜Cu锌Zn铬Cr镉Cd铅Pb汞Hg范围range平均值mean范围range平均值mean范围range平均值mean范围range平均值mean范围range平均值mean范围range平均值mean316.635^18.26717.45161.530^65.88063.7051.425^1.5151.4700.121^0.1240.12323.984^27.07525.530.021^0.0270.024619.635^20.90720.21764.229^67.55965.9141.140^1.7401.4400.137^0.1430.14023.475^26.71525.0950.029^0.0370.033922.178^23.50922.84364.567^83.47874.0231.442^1.4711.4560.120^0.1390.13023.369^26.56124.9650.026^0.0370.0311116.456^21.92519.19160.141^63.31261.7271.403^1.4931.4480.120^0.1310.12523.274^24.54623.9100.019^0.0240.022年季annual16.456^23.50919.92660.141^93.47866.3421.140^1.7401.4530.120^0.1430.13023.274^27.07524.8750.019^0.0370.028
表4 滩涂养殖区沉积物中抗生素浓度范围和检出频率(n=16)
Tab.4 Concentration range and detected frequency of antibiotics in sediments of culture area(n=16)

检出类型detectedtype抗生素浓度/(ng·g-1)concentrationofantibiotics最大值max最小值min平均值mean检出频率/%frequency环丙沙星CIP2.330ND1.09054恩诺沙星EFC32.552ND14.31848洛美沙星LFC10.130ND6.61875诺氟沙星NOR22.3654.68215.978100氧氟沙星OFC5.437ND3.93775啥氟沙星SFC5.554ND4.20377醋酸酰胺SAAM4.006ND2.12754磺胺嘧啶SDZ0.949ND0.47575磺胺地索辛SDM1.236ND0.23821磺胺对甲氧嘧啶SM5.048ND2.79650磺胺二甲氧嘧啶SM27.066ND2.93446磺胺甲基嘧啶SMR21.092ND0.38840磺胺甲噁唑STZ7.0664.3125.717100氯霉素CAP0.6750.3820.462100氟苯尼考FF0.7610.5710.639100
注:ND(未检出)代表平均浓度低于检出限
Note:ND(not detected)represents that the average concentration is below the detection limit
另外,基于上述的皮尔森相关性分析结果,在滩涂养殖区沉积物中筛选出5种抗生素(NFC、SAAM、STZ、CAP和FF)和6种环境理化指标(pH、盐度、Cu、Zn、Cr和Pb)作为环境因素,进一步解析环境因素对ARGs的存在和丰度影响。首先,应用Canoco软件对ARGs组成与环境因素进行排序,结果显示排序的长度梯度大于4,适用于单峰模型的CCA分析。因此,选取CCA分析对物种组成与环境因素之间的关系进行限制性排序,结果如图5所示。其中,抗生素协同对ARGs组成和丰度的贡献率为51.2%。沿第一象限轴,SAAM、FF、Cu和Zn与ARGs呈显著的线性关联,其总贡献率为43.7%,说明这两种抗生素协同重金属Cu和Zn对微生物群落中ARGs的增殖和传播影响较大;而沿着第二象限轴,pH、盐度、Cr和Pb与大多数检出的ARGs呈显著的负相关,此结果与皮尔森相关性分析结果一致,但其对形成此ARGs分布的总贡献率仅为7.5%,表明这些因素对微生物群落中ARGs的影响较小。
表5 大连皮口典型滩涂养殖区沉积物中ARGs与抗生素、环境因素的皮尔森相关性分析(n=16)
Tab.5 Pearson correlation analysis among ARGs, antibiotics, and environmental factors in sediments of Pikou typical intertidal mudflat culture area in Dalian(n=16)
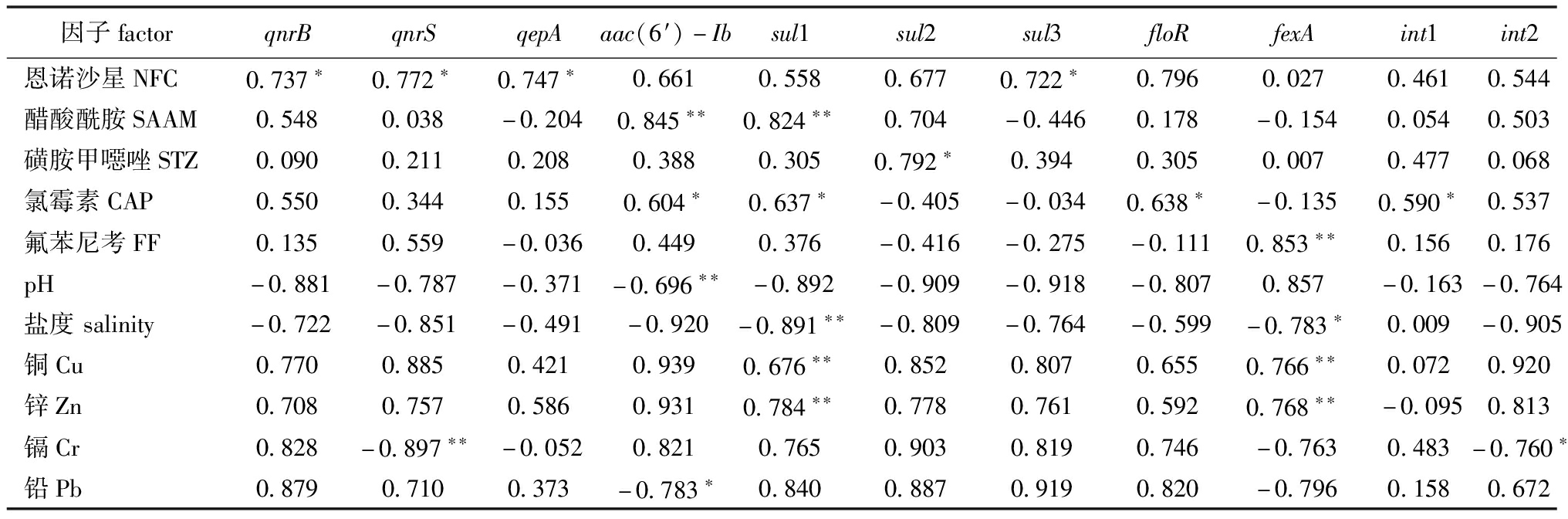
因子factorqnrBqnrSqepAaac(6′)-Ibsul1sul2sul3floRfexAint1int2恩诺沙星NFC0.737∗0.772∗0.747∗0.6610.5580.6770.722∗0.7960.0270.4610.544醋酸酰胺SAAM0.5480.038-0.2040.845∗∗0.824∗∗0.704-0.4460.178-0.1540.0540.503磺胺甲噁唑STZ0.0900.2110.2080.3880.3050.792∗0.3940.3050.0070.4770.068氯霉素CAP0.5500.3440.1550.604∗0.637∗-0.405-0.0340.638∗-0.1350.590∗0.537氟苯尼考FF0.1350.559-0.0360.4490.376-0.416-0.275-0.1110.853∗∗0.1560.176pH-0.881-0.787-0.371-0.696∗∗-0.892-0.909-0.918-0.8070.857-0.163-0.764盐度salinity-0.722-0.851-0.491-0.920-0.891∗∗-0.809-0.764-0.599-0.783∗0.009-0.905铜Cu0.7700.8850.4210.9390.676∗∗0.8520.8070.6550.766∗∗0.0720.920锌Zn0.7080.7570.5860.9310.784∗∗0.7780.7610.5920.768∗∗-0.0950.813镉Cr0.828-0.897∗∗-0.0520.8210.7650.9030.8190.746-0.7630.483-0.760∗铅Pb0.8790.7100.373-0.783∗0.8400.8870.9190.820-0.7960.1580.672
注: *表示显著相关(P<0.05), **表示极显著相关(P<0.01)
Note: * means significant correlation(P<0.05), **means very significant correlation(P<0.01)
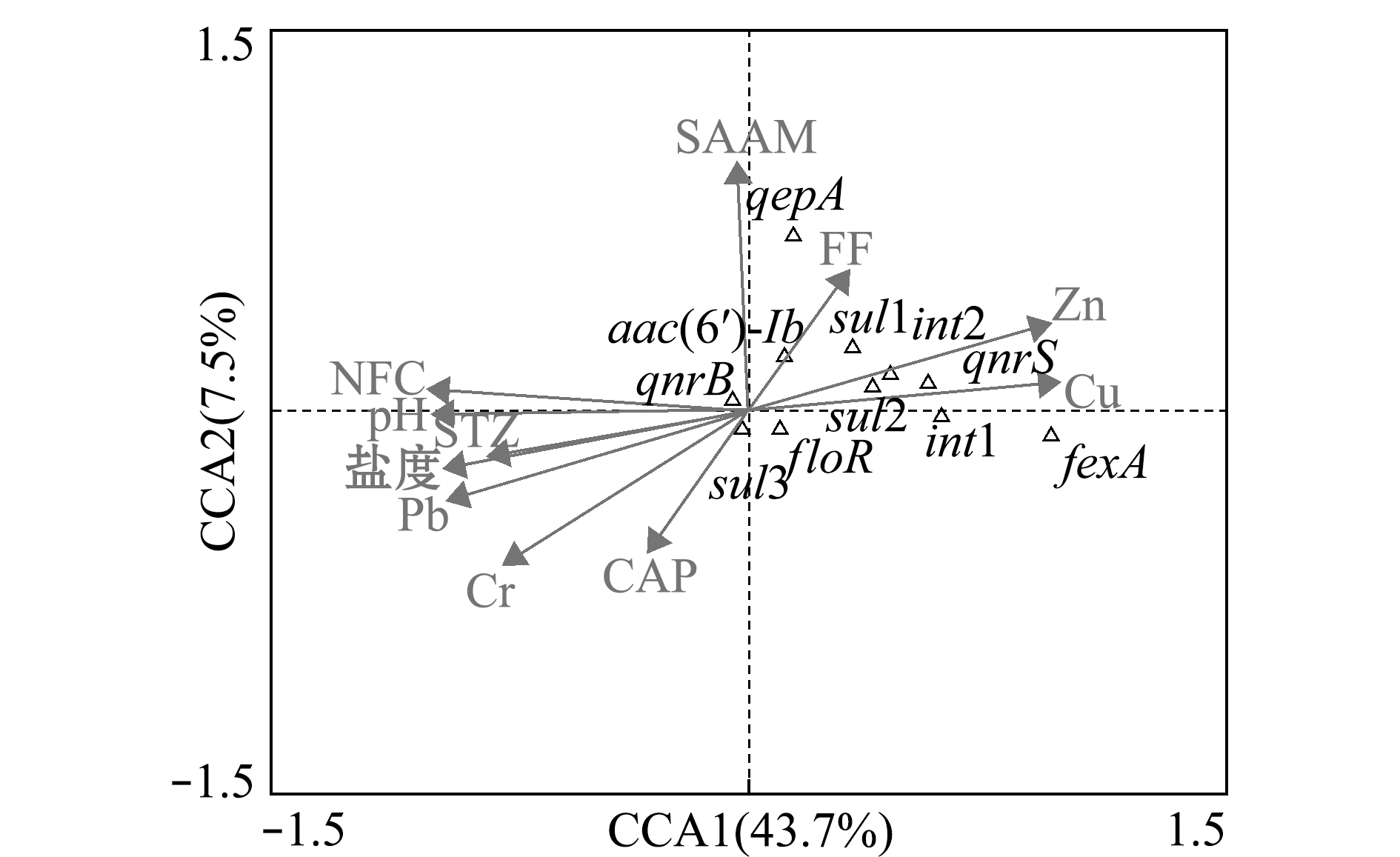
图5 滩涂养殖区沉积物中抗生素协同环境因素对ARGs的典范对应分析
Fig.5 Canonical correspondence analysis(CCA)of antibiotics coupled with environmental factors based on ARGs in sediments in mudflat culture area
3 讨论
3.1 滩涂养殖区沉积物中ARGs的多样性和丰度
本研究中分析了大连近岸典型滩涂养殖区沉积物中ARGs的存在种类和丰度水平,13种ARGs和2种整合子在沉积物中广泛存在。其中qnrA、qnrB、qnrS、sul1、sul2、floR和fexA的总丰度占所有检出ARGs的64.3%,是沉积物中优势的ARGs类型。在珠江附近的养虾池塘环境沉积物中也发现sul1、qnrD、floR和cmlA为检出的优势ARGs类型[15]。在中国南方水产养殖主产区沉积物中,四环素类、磺胺类ARGs被发现与赋予其抗性的抗生素浓度显著相关[8]。值得注意的是,本研究中的抗生素检测结果显示,磺胺类抗生素检出的种类和浓度都显著高于氯霉素类抗生素,且浓度变化呈现明显的季节特征。然而,本研究区域的沉积物中仅检出了4种氯霉素类ARGs(cmlA、floR、fexA和cfr),且其检出率和总丰度明显高于磺胺类ARGs。另外,统计分析显示,不同季节的沉积物中ARGs丰度未见显著性差异(P>0.05)。可见,滩涂养殖环境沉积物中抗生素残留对ARGs存在和分布仅具有一定影响,而其他的环境因素如营养盐和重金属也可能起到了协同筛选作用[10,16,29]。因此,在典型的滩涂养殖区沉积物中影响ARGs存在和分布的环境因素需进一步探究。
3.2 滩涂养殖区沉积物中环境因素、重金属协同抗生素对ARGs存在和分布的影响
抗生素对本土微生物产生的直接和间接的筛选作用是养殖环境中ARGs存在和分布的重要原因[8,21],然而越来越多的研究证实,环境因素和重金属对环境中ARGs的出现和传播具有共选择的机制[16,30-31]。本研究中通过皮尔森相关性分析发现,pH和盐度对ARGs在沉积物中的存在和丰度呈现显著的抑制作用。Bergeron等[30]也报道了沼泽水环境中浓度为6 mg/L的盐度最适合ARGs的存在和散布,而盐度水平高于或低于6 mg/L则对ARGs增殖呈现明显的抑制作用。Chen等[32]发现,环境中TOC可以与抗生素(如佛喹诺酮类和磺胺类抗生素)发生作用,形成稳定的络合物,这可能影响抗生素在环境细菌的生物有效性,进而可能降低对ARGs表达和增殖。在养猪场池塘和河口环境中,水质指标COD、TN、TAN和有效磷被证实与ARGs的存在和丰度显著相关,这间接揭示了其对ARGs的分布和传播起到协同筛选作用[25,31]。更值得注意的是,养殖过程中大量的饵料通常不能被养殖生物完全吸收或代谢,一部分直接进入海水和沉积物,使得其中氮磷的含量显著升高,因而养殖水体常呈现富营养化状态[33]。Zhao等[16]在山东东营水产养殖区周边的沉积物中发现,营养盐可联合细菌族群和重金属共同影响ARGs检出的轮廓。Han等[20]研究了鱼饲料添加对沉积物中ARGs的影响,揭示沉积物中营养盐的含量显著增加引发的微生物族群变化是ARGs增殖的根本原因。因此,滩涂养殖区沉积物中盐度、营养盐和TOC等环境因素对ARGs的存在和分布影响不容忽视。
先前的研究显示,在污水处理厂、养殖场的土壤和沉积物中重金属含量与ARGs丰度存在着极显著的相关性[16,34-35],这与本研究结果一致。Cu和Zn是畜牧和水产养殖动物生长所必需的微量元素,因而在畜牧和水产养殖的饲料中被普遍添加[20-21],这可能是本研究沉积物中Cu和Zn含量在养殖活动频繁的夏季和秋季显著增加的原因之一。在肉鸡养殖场环境中,He等[21]基于皮尔森相关性分析间接揭示了重金属对ARGs的存在和分布起到联合筛选作用。Zhao等[16]应用冗余分析直接证实了营养物和重金属的协同筛选对水产养殖环境中ARGs动力学变化起到重要作用。本研究中,皮尔森相关性分析和CCA结果显示,Cu和Zn协同5种抗生素(NFC、SAAM、STZ、CAP和FF)共同影响了ARGs的分布轮廓,证实了高浓度Cu和Zn能够联合养殖过程中残留的抗生素对本土微生物提供协同筛选压力,进而促进ARGs和相关移动基因元件的增殖和散布[10,21,34-35]。综上所述,环境因素协同抗生素的联合筛选是大连典型滩涂养殖区沉积物中ARGs存在和分布的重要因素。
3.3 大连典型滩涂养殖区ARGs潜在污染指示基因
有研究显示,环境中部分ARGs能作为污染指示基因,可以有效地反映该地区ARGs的污染水平。由图6可见,基于线性回归分析的统计结果,滩涂养殖区沉积物中频繁检出的qnrS、sul1与3种主要检出ARGs的总丰度显著相关(P<0.05)。Su等[15] 应用线性回归分析发现,检出丰度最高的sul1与主要检出四大类ARGs总丰度均显著相关,其可作为养殖虾池环境中ARGs的污染指示基因。Huang等[17]也阐明tetA对∑tet、∑ARGs和int1的丰度呈现出极其显著的相关性(P<0.01),这可作为判断tetA是该生态养殖池塘中四环素类ARGs污染指示基因的依据。另外,在代表性的养鸡环境中,检出频率高、丰度高的ARGs(如fexA、tetW和sul1)也作为示踪人为来源ARGs的污染指示基因被报道[21]。在本研究中,qnrS和sul1是检出最多、丰度最高的两种ARGs类型,且其与3类主要检出的ARGs总丰度(∑qnr、∑sul和∑cml)显著相关(P<0.05)。综上所述,本研究中认为,qnrS和sul1可作为示踪滩涂养殖沉积物中ARGs的潜在污染指示基因。

注:∑qnr为喹诺酮类ARGs总丰度;∑sul为磺胺类ARGs总丰度;∑cml为氯霉素类ARGs总丰度
Note:∑qnr,the total abundance of quinolones ARGs;∑sul,the total abundance of sulfonamides ARGs;∑cml,the total abundance of Chloramphenicols ARGs
图6 沉积物样品中qnrS/sul1丰度和3类主要检出ARGs总丰度的相关性(线性回归法拟合曲线)
Fig.6 Correlation between the abundance of qnrS/sul1 and the total abundance of three main ARGs’ classes in sediment samples(The fit curve is conducted by linear regression)
4 结论
(1)对大连皮口典型滩涂养殖区沉积物中的ARGs存在种类和丰度进行了年季监测,结果表明,养殖区沉积物中普遍存在13种ARGs和2种整合子,主要的检出类型为喹诺酮类、磺胺类和氯霉素类。其中qnrA、qnrB、qnrS、sul1、sul2、floR和fexA是优势的ARGs。不同养殖季节,沉积物中ARGs丰度的差异不显著(P>0.05)。
(2)典型滩涂养殖区沉积物中氟喹诺酮类抗生素是主要的抗生素污染类型。沉积物中TN和重金属Cu、Zn含量较高,呈现明显的季节变化(P<0.05)。抗生素、重金属、环境因素与ARGs的相关分析表明,在大连皮口典型滩涂养殖区沉积物中抗生素协同重金属和环境因素(NFC、FF、SAAM、STZ、CAP、Cu、Zn、pH、盐度、Cr和Pb)提供的协同筛选是诱导ARGs持久存在和传播的重要因素。
(3)qnrS和sul1是典型滩涂养殖区沉积物中优势的ARGs,其与主要检出的喹诺酮类、磺胺类和氯霉素类ARGs总丰度均呈显著相关,揭示qnrS和sul1可作为滩涂养殖区沉积物中ARGs的污染指示基因。
[1] Cabello F C,Godfrey H P,Buschmann A H,et al.Aquaculture as yet another environmental gateway to the development and globalisation of antimicrobial resistance[J].The Lancet Infectious Diseases,2016,16(7):e127-e133.
[2] Sarmah A K,Meyer M T,Boxall A B A.A global perspective on the use,sales,exposure pathways,occurrence,fate and effects of veterinary antibiotics(VAs)in the environment[J].Chemosphere,2006,65(5):725-759.
[3] Zhang Qianqian,Ying Guangguo,Pan Changgui,et al.Comprehensive evaluation of antibiotics emission and fate in the river basins of China:source analysis,multimedia modeling,and linkage to bacterial resistance[J].Environmental Science & Technology,2015,49(11):6772-6782.
[4] Liu Sisi,Zhao Hongxia,Lehmler H J,et al.Antibiotic pollution in marine food webs in Laizhou Bay,north China:trophodynamics and human exposure implication[J].Environmental Science & Technology,2017,51(4):2392-2400.
[5] Zhou Lijun,Ying Guangguo,Zhao Jianliang,et al.Trends in the occurrence of human and veterinary antibiotics in the sediments of the Yellow River,Hai River and Liao River in northern China[J].Environmental Pollution,2011,159(7):1877-1885.
[6] Zou Shichun,Xu Weihai,Zhang Ruijie,et al.Occurrence and distribution of antibiotics in coastal water of the Bohai Bay,China:impacts of river discharge and aquaculture activities[J].Environmental Pollution,2011,159(10):2913-2920.
[7] Na Guangshui,Fang Xiaodan,Cai Yaqi,et al.Occurrence,distribution,and bioaccumulation of antibiotics in coastal environment of Dalian,China[J].Marine Pollution Bulletin,2013,69(1-2):233-237.
[8] Chen C Q,Zheng L,Zhou J L,et al.Persistence and risk of antibiotic residues and antibiotic resistance genes in major mariculture sites in Southeast China[J].Science of the Total Environment,2017,580:1175-1184.
[9] Gao Panpan,Mao Daqing,Luo Yi,et al.Occurrence of sulfonamide and tetracycline-resistant bacteria and resistance genes in aquaculture environment[J].Water Research,2012,46(7):2355-2364.
[10] He Xiaolin,Xu Yanbin,Chen Jinliang,et al.Evolution of corresponding resistance genes in the water of fish tanks with multiple stresses of antibiotics and heavy metals[J].Water Research,2017,124:39-48.
[11] 罗义,周启星.抗生素抗性基因(ARGs)——一种新型环境污染物[J].环境科学学报,2008,28(8):1499-1505.
[12] 文汉卿,史俊,寻昊,等.抗生素抗性基因在水环境中的分布、传播扩散与去除研究进展[J].应用生态学报,2015,26(2):625-635.
[13] Yuan Julin,Ni Meng,Liu Mei,et al.Occurrence of antibiotics and antibiotic resistance genes in a typical estuary aquaculture region of Hangzhou Bay,China[J].Marine Pollution Bulletin,2019,138:376-384.
[14] Wang Jianhua,Lu Jian,Zhang Yuxuan,et al.Metagenomic analysis of antibiotic resistance genes in coastal industrial mariculture systems[J].Bioresource Technology,2018,253:235-243.
[15] Su Haochang,Liu Shan,Hu Xiaojuan,et al.Occurrence and temporal variation of antibiotic resistance genes(ARGs)in shrimp aquaculture:ARGs dissemination from farming source to reared organisms[J].Science of the Total Environment,2017,607-608:357-366.
[16] Zhao Zelong,Wang Jing,Han Ying,et al.Nutrients,heavy metals and microbial communities co-driven distribution of antibiotic resistance genes in adjacent environment of mariculture[J].Environmental Pollution,2017,220:909-918.
[17] Huang Lu,Xu Yanbin,Xu Jiaxin,et al.Antibiotic resistance genes(ARGs)in duck and fish production ponds with integrated or non-integrated mode[J].Chemosphere,2017,168:1107-1114.
[18] Tamminen M,Karkman A,Lõhmus A,et al.Tetracycline resistance genes persist at aquaculture farms in the absence of selection pressure[J].Environmental Science & Technology,2011,45(2):386-391.
[19] Shah S Q A,Colquhoun D J,Nikuli H L,et al.Prevalence of antibiotic resistance genes in the bacterial flora of integrated fish farming environments of Pakistan and Tanzania[J].Environmental Science & Technology,2012,46(16):8672-8679.
[20] Han Ying,Wang Jing,Zhao Zelong,et al.Fishmeal application induces antibiotic resistance gene propagation in mariculture sediment[J].Environmental Science & Technology,2017,51(18):10850-10860.
[21] He Liangying,Liu Yousheng,Su Haochang,et al.Dissemination of antibiotic resistance genes in representative broiler feedlots environments:identification of indicator ARGs and correlations with environmental variables[J].Environmental Science & Technology,2014,48(22):13120-13129.
[22] Halpern B S,Walbridge S,Selkoe K A,et al.A global map of human impact on marine ecosystems[J].Science,2008,319(5865):948-952.
[23] Zhu Yongguan,Zhao Yi,Li Bing,et al.Continental-scale pollution of estuaries with antibiotic resistance genes[J].Nature Microbiology,2017,2(4):16270.
[24] 王华,石振家,刘萱,等.大连典型滩涂养殖区菲律宾蛤仔体内Pb含量及溯源[J].海洋环境科学,2014,33(1):78-82.
[25] Lu Zihao,Na Guangshui,Gao Hui,et al.Fate of sulfonamide resistance genes in estuary environment and effect of anthropogenic activities[J].Science of the Total Environment,2015,527-528:429-438.
[26] 杜鹃,赵洪霞,陈景文.固相萃取-高效液相色谱-串联质谱法同时测定养殖海水中23种抗生素[J].色谱,2015,33(4):348-353.
[27] 叶赛,胡莹莹,张奎文,等.高效液相色谱-串联质谱测定海水中氯霉素残留量[J].分析试验室,2007,26(22):22-25.
[28] Ye Sai,Yao Ziwei,Na Guangshui,et al.Rapid simultaneous determination of 14 sulfonamides in wastewater by liquid chromatography tandem mass spectrometry[J].Journal of Separation Science,2007,30:2360-2369.
[29] Zhou Bingrui,Wang Chong,Zhao Qin,et al.Prevalence and dissemination of antibiotic resistance genes and coselection of heavy metals in Chinese dairy farms[J].Journal of Hazardous Materials,2016,320:10-17.
[30] Bergeron S,Brown R,Homer J,et al.Presence of antibiotic resistance genes in different salinity gradients of freshwater to saltwater marshes in southeast Louisiana,USA[J].International Biodeterioration & Biodegradation,2016,113:80-87.
[31] McKinney C W,Loftin K A,Meyer M T,et al.tet and sul antibiotic resistance genes in livestock lagoons of various operation type,configuration,and antibiotic occurrence[J].Environmental Science & Technology,2010,44(16):6102-6109.
[32] Chen Zeyou,Zhang Yingjie,Gao Yanzheng,et al.Influence of dissolved organic matter on tetracycline bioavailability to an antibiotic-resistant bacterium[J].Environmental Science & Technology,2015,49(18):10903-10910.
[33] Kawahara N,Shigematsu K,Miyadai T,et al.Comparison of bacterial communities in fish farm sediments along an organic enrichment gradient[J].Aquaculture,2009, 287(1-2):107-113.
[34] Di Cesare A,Eckert E M,D’Urso S,et al.Co-occurrence of integrase 1,antibiotic and heavy metal resistance genes in municipal wastewater treatment plants[J].Water Research,2016,94:208-214.
[35] Xu Yan,Xu Jian,Mao Daqing,et al.Effect of the selective pressure of sub-lethal level of heavy metals on the fate and distribution of ARGs in the catchment scale[J].Environmental Pollution,2017,220:900-908.