鱼粉和豆粕是动物饲料中常用的蛋白源,但因鱼粉资源短缺、价格偏高,用豆粕替代鱼粉已成为降低饲料成本的现实选择。然而动物尤其是幼龄动物摄食高水平添加的豆粕饲料常常导致过敏反应。主要原因在于豆粕含有多种抗原蛋白成分,如大豆球蛋白、大豆β-伴球蛋白等,其中,β-伴球蛋白(β-conglycinin)不仅含量多、热稳定性好,且抗原性强,是导致幼龄动物发生过敏反应最强的抗原蛋白[1]。当幼龄动物摄入大豆β-伴球蛋白后,其中的大部分被分解消化,仅有微量通过跨细胞和/或旁细胞途径进入循环系统,由抗原提呈细胞提呈给T细胞,进而刺激B细胞并产生特异性IgE抗体,使机体致敏;当大豆β-伴球蛋白再次与特异性IgE抗体结合,会引起过敏,导致机体免疫系统功能紊乱和诱发肠道及全身性病理变化,使生长受阻,造成严重的经济损失[2]。Wu等[3]证实,大豆β-伴球蛋白会导致断奶仔猪肠道过敏损伤及炎症相关细胞因子TNF-α、IL-1β、IL-8、IFN-γ等的表达增加;吴莉芳等[4]在不同食性鱼类饲料中添加60 mg/g大豆球蛋白和40 mg/g的大豆β-伴球蛋白,发现2种抗原蛋白均能引起免疫系统紊乱和肠道炎症反应,肠道炎症细胞因子TNF-α、IL-1β、IL-4和IFN-γ表达显著上调;Guo等[5]通过基因表达获得93%纯度的大豆β-伴球蛋白,灌服大鼠后发现发生了Ⅰ型超敏反应,导致大鼠肠肥大细胞数量增加,脱颗粒明显,血和脾脏中的IL-2、IL-4、IL-5含量增加;类似结果在犊牛试验中也观察到[6]。然而,大豆β-伴球蛋白是否引起动物头肾组织表达炎性细胞因子变化的研究报道不多,对于鱼类的研究更少。
头肾是硬骨鱼类的多功能器官,不仅参与鱼类排泄也参与免疫和造血功能,尤其在调节免疫细胞增殖分化和抗过敏免疫反应方面具有重要作用[7],因此,开展鱼类头肾免疫相关基因表达研究,不仅有助于深化其参与免疫调节的机理,还可针对养殖过程中的增强免疫调节及病害防控提供依据。黄河鲤Cyprinus carpio haematopterus是目前中国北方地区水产养殖的珍贵品种,例如河南省水产科学研究院培育的第8代品种(登记号:GS01-001-2004),随着养殖规模的不断扩大和豆粕的大量运用,由豆粕等含大豆抗原蛋白产品导致其免疫功能紊乱及过敏性炎症反应,甚至继发其他类型的疾病,给黄河鲤养殖产业造成严重的经济损失。为此,本研究中以黄河鲤为试验对象,通过饲料中添加不同水平的大豆β-伴球蛋白替代饲料中的鱼粉蛋白,探讨不同水平的大豆β-伴球蛋白对黄河鲤头肾中TLR2/NF-κB p65信号通路及下游关键炎性因子表达的变化,以期了解大豆β-伴球蛋白对黄河鲤头肾免疫功能造成的影响,为淡水鱼类饲料中合理添加豆粕提供数据参考。
1 材料与方法
1.1 材料
试验用黄河鲤购于河南省水产科学研究院种鱼繁殖场,并在河南工业大学生物工程学院鱼类营养实验室进行为期2周的驯化,驯化期间用鱼粉配制全价饲料进行饲喂。
1.2 方法
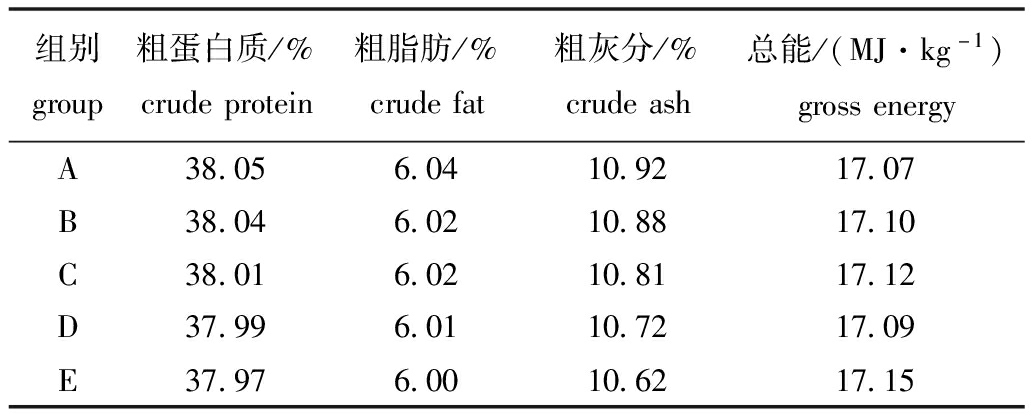
1.2.1 大豆β-伴球蛋白的分离纯化及试验饲料的制备 采用简化膜中间试验法[8]分离提取大豆β-伴球蛋白(纯度为89.3%),用于替代黄河鲤饲料中鱼粉蛋白。以鱼粉、玉米蛋白粉和大豆β-伴球蛋白为蛋白源,以面粉、糊精、鱼油、豆油等为能源,以麦麸、纤维素为辅料,配制含大豆β-伴球蛋白为0%(对照组)、1.0%、3.0%、5.0%和7.0%的5组等氮(粗蛋白质38.0%)、等能(17.0 MJ/kg)饲料,分别记为A、B、C、D、E组,其饲料组成及营养水平见表1、表2。除油脂外的其他各原料组分经粉碎过60目筛,按配方称重,逐级放大混合,加油、加水拌匀,用SLKL-120B型制粒机(曲阜市圣鲁机械厂)制成直径为 2.0 mm的颗粒饲料,于40 ℃下烘干6 h,4 ℃冰箱中保存备用。
表1 饲料组成(干物质)
Tab.1 Ingredient of diets(dry matter) w/%

组别group鱼粉fishmealβ-伴球蛋白β-conglycinin微晶纤维素microcrystallinecellulose豆油soybeanoil磷酸二氢钙Ca(H2PO4)2赖氨酸lysine蛋氨酸methionine其他成分othersA30.00.05.502.802.100.250.5558.8B27.91.05.873.322.220.30.5958.8C24.83.06.333.692.370.370.6458.8D21.75.06.784.132.470.430.6958.8E18.67.07.194.402.720.550.7458.8
注:其他成分包括玉米蛋白粉18.0%、糊精8.0%、面粉12.0%、麦麸16.0%、鱼油1.4%、氯化胆碱0.5%、预混剂2.9%;预混料为每千克日粮提供:维生素A 15 000 IU、维生素E 60 mg、维生素D3 3000 IU、维生素K3 5 mg、维生素B1 20 mg、维生素B2 30 mg、维生素B6 15 mg、维生素B12 0.5 mg、烟酸200 mg、叶酸5 mg、肌醇1000 mg、生物素3.0 mg、泛酸钙50 mg、铁 30 mg、铜 3 mg、锰 15 mg、碘 0.8 mg、镁 0.7 g
Note:In each diet, the followings are supplied: corn gluten 18.0%, dextrin 8.0%, wheat meal 12.0%, wheat bran 16.0%, fish oil 1.4%, choline chloride 0.5%, and premix 2.9%; The premix provides following per kg of diet: VA 15 000 IU, VE 60 mg, VD3 3000 IU, VK3 5 mg, VB1 20 mg, VB2 30 mg, VB6 15 mg, VB12 0.5 mg,niacin 200 mg, folic acid 5 mg, inositol 1000 mg, biotin 3.0 mg, calcium pantothenate 50 mg, Fe 30 mg, Cu 3 mg, Mn 15 mg, I 0.8 mg, and Mg 0.7 g
表2 饲料营养水平(干物质)
Tab.2 Nutrient levels of diets(dry matter)
组别group粗蛋白质/%crudeprotein粗脂肪/%crudefat粗灰分/%crudeash总能/(MJ·kg-1)grossenergyA38.056.0410.9217.07B38.046.0210.8817.10C38.016.0210.8117.12D37.996.0110.7217.09E37.976.0010.6217.15
注:营养水平为实测值
Note:Nutrient levels are determined in values
1.2.2 试验设计及养殖管理 驯化结束后,随机选择225尾体质量为(41.00 ± 0.12)g的黄河鲤分成5组,每组设3个重复,每个重复15尾鱼,分养于装自动循环微流水系统的15个水族箱中,养殖试验共进行21 d。试验期间,每天9:00和17:00投喂试验饲料,投喂量分别为体质量的1.4%和1.6%。整个试验期间,养殖用水为曝气的自来水,水温为25~27 ℃,溶氧大于6.0 mg/L,pH为6.8。
1.2.3 样品采集 分别在试验的第1、7、14、21 天从各重复组随机取幼鲤3尾,用MS-222(0.03%)麻醉后,立即于4 ℃条件下解剖取其头肾。用预冷的PBS(pH 7.2)清洗,液氮冷冻后于-80 ℃冰箱中保存。
1.2.4 头肾TLR2/NF-κB p65和炎性因子表达检测 采用Trizol Reagent Kit提取黄河鲤头肾总RNA,利用核酸内切酶Dnase水解头肾中的总RNA中的DNA,采用10 g/L琼脂糖凝胶电泳检测RNA的完整性,用扫描分光光度计(Beckman DU-800)测定吸光度,根据OD260 nm/OD280nm 值确定RNA质量。然后以mRNA为模板逆转录合成cDNA(大连宝生物工程有限公司,中国)。实时定量PCR按照课题组前期研究方法[9],以合成的cDNA为模板和β-action为内参基因检测黄河鲤头肾中TLR2、NF-κB p65、IL-1β、IL-6、TNF-α1、IFN-γ的表达量,利用2-ΔΔCt=2-Ct(目的基因)-Ct(管家基因)进行相对表达丰度分析。目的基因引物序列见表3。
表3 目的基因引物序列
Tab.3 Primer sequences of designated genes

目的基因targetgene引物序列primersequence(5′-3′)产物大小/bpproductlengthGenBankaccessionNo.IL-1βF:GCTGGAGCAATGCAATACAAAR:AGGTAGAGGTTGCTGTTGGAA69AJ245635IL-6F:TAGGTTAATGAGCAAGAGGAR:AGAGACTGTTGATACTGGAA115AY102633.1TNF-α1F:ACAACAATCAGGAAGGTGGAAR:TGGAAAGACACCTGGCTGTA106AJ311800IFN-γF:GTTTAGAGGGACAATTAACTGGACTAR:GAGGGTCCACTCTTTGAAAATG159KJ027520TLR2F:GAACCTTGTAGGAAACCCATR:CCCATCTAAGCCATTCTTGT145FJ858800.2NF-κBF:TATTCAGTGCGTGAAGAAGR:TATTAAAGGGGTTGTTCTGT77LN590704β-actinF:GCTATGTGGCTCTTGACTTCGR:CCGTCAGGCAGCTGATAGCT152M24113
1.3 数据处理
试验数据用平均值±标准差(mean ± S.D.)表示,采用SPSS 17.0软件对各时间点所取样品的检测数据进行单因素方差分析(One-way ANOVA),利用双因素方差分析(Two-way ANOVA)确定取样时间与添加剂量的交互作用,用Duncan法进行多重比较,显著性水平设为0.05。
2 结果与分析
2.1 大豆β-伴球蛋白添加组黄河鲤头肾TLR2/NF-κB p65 mRNA表达的变化
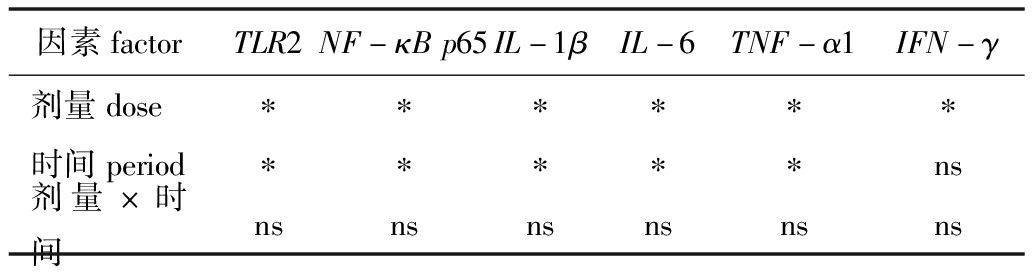
饲料中大豆β-伴球蛋白添加剂量和饲喂时间显著影响黄河鲤头肾的TLR2和NF-κB p65表达(P<0.05),但二者间无交互作用(P>0.05)(表4)。
表4 β-伴球蛋白剂量和时间对各基因表达的双因素方差分析
Tab.4 Two-way ANOVA of dietary β-conglycinin levels and time on expression of various genes
因素factorTLR2NF-κBp65IL-1βIL-6TNF-α1IFN-γ剂量dose∗∗∗∗∗∗时间period∗∗∗∗∗ns剂量×时间nsnsnsnsnsns
注:*表示有显著性影响(P<0.05);ns表示无显著性影响(P>0.05)
Note: *means significant effect(P<0.05);ns means no significant effect(P>0.05)
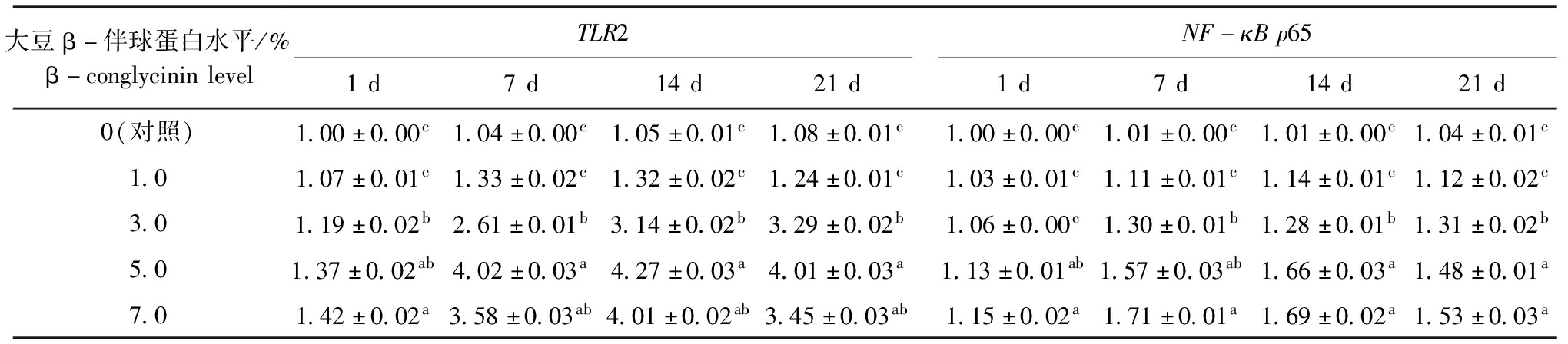
从表5可见:随时间的延长,饲料中大豆β-伴球蛋白各添加量组中黄河鲤头肾TLR2、NF-κB p65相对表达量总体呈先升高后降低的趋势,总体上在第14天时相对表达量最高;在第1天时,随着大豆β-伴球蛋白添加量的增加,各处理组中TLR2和NF-κB p65表达量上调,最高为7.0%添加组且显著高于对照组、1.0%和3.0%添加组(P<0.05);在第7、14、21天时,对照组的黄河鲤头肾TLR2和NF-κB p65表达量与1.0%添加组无显著性差异(P>0.05),但均显著低于其他添加组(P<0.05),各时间点下,TLR2 和NF-κB p65最高表达量分别出现在5.0%和7.0%添加组。
2.2 大豆β-伴球蛋白添加组黄河鲤头肾IL-1β、IL-6、TNF-α1和IFN-γ mRNA表达的变化
大豆β-伴球蛋白添加剂量和饲喂时间显著影响黄河鲤头肾的IL-1β、IL-6和TNF-α1表达(P<0.05),但二者间无交互作用(P>0.05);而IFN-γ表达仅受添加剂量的显著影响(P<0.05)(表4)。
从表6可见:随着时间的延长,饲料中大豆β-伴球蛋白各添加量组黄河鲤头肾中IL-1β、IL-6、TNF-α1和IFN-γ相对表达量总体呈先升高后降低的趋势,总体上在第14天时相对表达量最高;在第1天时,随着大豆β-伴球蛋白添加量的增加,各组黄河鲤头肾IL-1β、IL-6和TNF-α1表达上调,IFN-γ表达先增后降,其中,7.0%添加组的IL-1β和IL-6表达量最高且显著高于其他组(P<0.05),而7.0%添加组TNF-α1表达量和5.0%添加组IFN-γ表达量最高且显著高于对照组和1.0%组(P<0.05);第7天时,各组黄河鲤头肾中IL-1β、IL-6、TNF-α1和IFN-γ表达与第1天时相似,其中,5.0%和7.0%添加组的IL-1β、IL-6、TNF-α1表达量较高且显著高于对照组、1.0%添加组(P<0.05),3.0%添加组的IFN-γ表达量最高且显著高于其他组(P<0.05);第14、21天时,随着大豆β-伴球蛋白添加量的增加,各组黄河鲤头肾IL-6表达量上调,而IL-1β、TNF-α1和IFN-γ表达量先增后降;其中,7.0%添加组IL-6表达量最高且显著高于对照组、1.0%和3.0%组(P<0.05);5.0%组IL-1β和TNF-α1表达量最高且显著高于对照组、1.0%组(P<0.05);而IFN-γ表达最高值出现在3.0%组。
表5 饲料中不同水平的大豆β-伴球蛋白对黄河鲤头肾TLR2/NF-κB p65基因相对表达量的影响
Tab.5 Effects of dietary β-conglycinin levels on relative expression levels of TLR2/NF-κB p65 mRNA in head kidney of juvenile common carp Cyprinus carpio haematopterus
大豆β-伴球蛋白水平/%β-conglycininlevelTLR2NF-κBp651d7d14d21d1d7d14d21d0(对照)1.00±0.00c1.04±0.00c1.05±0.01c1.08±0.01c1.00±0.00c1.01±0.00c1.01±0.00c1.04±0.01c1.01.07±0.01c1.33±0.02c1.32±0.02c1.24±0.01c1.03±0.01c1.11±0.01c1.14±0.01c1.12±0.02c3.01.19±0.02b2.61±0.01b3.14±0.02b3.29±0.02b1.06±0.00c1.30±0.01b1.28±0.01b1.31±0.02b5.01.37±0.02ab4.02±0.03a4.27±0.03a4.01±0.03a1.13±0.01ab1.57±0.03ab1.66±0.03a1.48±0.01a7.01.42±0.02a3.58±0.03ab4.01±0.02ab3.45±0.03ab1.15±0.02a1.71±0.01a1.69±0.02a1.53±0.03a
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
表6 饲料中不同水平的大豆β-伴球蛋白对黄河鲤头肾IL-1β、IL-6、TNF-α1和IFN-γ基因相对表达量的影响
Tab.6 Effects of dietary β-conglycinin levels on relative expression levels of IL-1β, IL-6, TNF-α1 and IFN-γ mRNA in head kidney of juvenile common carp Cyprinus carpio haematopterus

大豆β-伴球蛋白水平/%β-conglycininlevelIL-1βIL-6TNF-α1IFN-γ1d7d14d21d1d7d14d21d1d7d14d21d1d7d14d21d0(对照)1.00±0.00c1.01±0.00c1.03±0.01c1.07±0.01c1.00±0.00c1.02±0.01c1.03±0.01c1.06±0.01c1.00±0.00c1.09±0.01c1.12±0.01c1.13±0.01c1.00±0.00c1.02±0.00c1.06±0.01c1.10±0.01c1.01.02±0.01c1.06±0.01c1.13±0.02c1.09±0.02c1.16±0.02c1.44±0.01b1.75±0.03b1.45±0.01b1.16±0.02bc1.19±0.01c1.31±0.02c1.25±0.01c1.22±0.01b1.85±0.01b1.98±0.02b1.88±0.03ab3.01.09±0.01b3.66±0.05b5.01±0.04a4.12±0.03a1.28±0.02bc1.83±0.02b2.99±0.01b2.41±0.02b1.35±0.02b2.82±0.01b3.74±0.04b2.37±0.02b1.43±0.03ab2.29±0.02a2.97±0.02a2.08±0.03a5.01.13±0.01b4.45±0.03ab5.51±0.03a3.23±0.02ab1.32±0.01b1.97±0.03a3.79±0.02ab2.63±0.02a1.79±0.03a3.81±0.03ab5.73±0.03a4.27±0.03a1.72±0.03a1.91±0.02b1.13±0.01bc1.54±0.01b7.01.74±0.03a5.06±0.03a4.30±0.02b2.75±0.03b1.48±0.02a2.14±0.03a4.28±0.03a2.94±0.03a1.82±0.03a4.14±0.04a5.35±0.03a4.03±0.02a1.14±0.01b0.95±0.00c0.81±0.01c1.12±0.02c
3 讨论
3.1 大豆β-伴球蛋白对TLR2/NF-κB p65 mRNA表达影响
TLR2是进化上相对保守的模式识别受体TLRs 家族成员之一,广泛表达于免疫细胞、上皮细胞等多种细胞的细胞膜上,通过识别病原体相关的分子模式(Pathogen-associated molecular patterns,PAMPs)与细胞内信号结构域及接头分子相互作用,激活NF-κB等信号通路,释放大量的TNF-α、IL-6、IL-1β等效应分子参与免疫功能的调节并诱导炎症反应[10]。Supajatura等[11]研究证实,过敏小鼠肥大细胞的TLR2 mRNA表达上调、NF-κB移位和过度激活,释放大量的炎性因子,说明TLR2可能对下游信号通路的异常调节而导致炎症反应的发生,推测肠上皮细胞接受大豆伴球蛋白刺激后,引起TLR2激活,产生炎症反应。头肾作为鱼类重要的免疫器官,是免疫细胞增殖分化的主要场所,对抗原应激极为敏感;过敏反应对头肾的影响主要表现在免疫细胞的增殖分化失衡和相关炎症细胞因子的差异表达等[7]。丁旭[12]研究发现,在聚肌胞苷酸(Poly I∶C)刺激斜带石斑鱼头肾白细胞1.5 h后,TLR2 mRNA表达量显著上调,3~6 h后表达量持续升高,并最终激活NF-κB,使其表达上调。本试验表明,TLR2/NF-κB p65表达在添加3.0%~7.0%的大豆β-伴球蛋白后,除第1天时NF-κB p65表达与对照组无显著性差异外,其他时间点TLR2/NF-κB p65表达均显著增加。TLR2/NF-κB表达增加可能与其过敏有关[13]。另外,本研究中发现,到第21天时,黄河鲤头肾TLR2/NF-κB表达较第14天时趋于下调,这可能是因为第21天后,黄河鲤的免疫系统逐渐恢复与重建,对大豆β-伴球蛋白产生免疫耐受。
3.2 大豆β-伴球蛋白对IL-1β、IL-6、TNF-α1和IFN-γ mRNA表达影响
被激活的机体免疫反应,免疫细胞和/或非免疫细胞都可合成和分泌抗炎或促炎细胞因子参与免疫等生理功能的调节。目前,关于抗原诱导的鱼类过敏反应研究表明,LPS诱导下的鲈[14]、鲤[15]头肾白细胞IL-1β表达显著升高;Zhang等[16]用含8%的大豆β-伴球蛋白饲料饲喂幼建鲤Cyprinus carpio var.jian,其肠上皮细胞IL-1β表达显著增加;本研究前期利用大豆β-伴球蛋白诱导黄河鲤的肠上皮细胞也发现IL-1β表达上调[9]。本试验中,在1~14 d时,IL-1β表达随大豆β-伴球蛋白替代鱼粉量的增加显著上调,同样结果也发生在IL-6和TNF-α1细胞因子。这可能由于过敏导致大量的炎症细胞浸润黄河鲤头肾组织,使促炎细胞因子分泌增加。而Urán等[17]认为,炎性细胞因子分泌增加主要与大豆抗原蛋白添加量、饲喂时间有关,表现在剂量-时间的依赖关系。IL-6是促炎细胞因子的代表,并通过正反馈调节,加速免疫细胞进一步增殖分化及B细胞分泌IgE抗体,从而促使过敏反应的快速发生[18]。本试验中,添加1.0%的大豆β-伴球蛋白组,第7天时IL-6表达量较对照组显著增加,而IL-1β和TNF-α1表达量与对照组无显著性差异,说明过敏反应中IL-6表达较快;随大豆β-伴球蛋白替代鱼粉量的增加,第7~14天时IL-1β、IL-6和TNF-α1表达量快速增加,表明大豆β-伴球蛋白引起的黄河鲤过敏呈现剂量-时间的依赖关系。但在第21天时,IL-1β、IL-6 和TNF-α1表达量有所降低,低于第14天时的表达,其主要原因可能是黄河鲤的免疫系统逐渐恢复与重建及TLR2/NF-κB mRNA表达下调引起。另外,在机体抗过敏的免疫应答中,IFN-γ同样发挥重要作用,不仅可激活T细胞以启动细胞免疫,还能够促进CD4+ T细胞向Th1细胞的分化,以抑制过敏反应引起的IL-1β和TNF-α1表达增加[19]。本试验中,1.0%和3.0%的大豆β-伴球蛋白替代鱼粉组,IFN-γ的表达量显著高于对照组,而7.0%的大豆β-伴球蛋白替代鱼粉组,IFN-γ的表达量在第7、14和21天时又与对照组无显著性差异,而IL-1β、IL-6 和TNF-α1表达则显著高于对照组,说明在炎性反应过程中,产生的IFN-γ不足以下调IL-1β和TNF-α1表达[18]。IFN-γ表达在第21天时与IL-1β、IL-6 和TNF-α1表达不同,不降反升,可能是因为黄河鲤免疫系统的恢复使IFN-γ的表达回升,但确切机制还需进一步研究。
综上所述,大豆β-伴球蛋白能促进黄河鲤头肾内TLR2/NF-κB p65信号通路及炎性因子的表达,表现为剂量-时间依赖关系,但无交互作用。
[1] Han Fenglu,Wang Xiaodan,Guo Jianlin,et al.Effects of glycinin and β-conglycinin on growth performance and intestinal health in juvenile Chinese mitten crabs(Eriocheir sinensis)[J].Fish & Shellfish Immunology,2019,84:269-279.
[2] Peng Chenglu,Cao Chengming,He Mengchu,et al.Soybean glycinin- and β-conglycinin-induced intestinal damage in piglets via the p38/JNK/NF-κB signaling pathway[J].Journal of Agricultural and Food Chemistry,2018,66(36):9534-9541.
[3] Wu Jinjie,Zhang Yu,Dong Jihong,et al.Allergens and intestinal damage induced by soybean antigen proteins in weaned piglets[J].Italian Journal of Animal Science,2016,15(3):437-445.
[4] 吴莉芳,孙泽威,秦贵信,等.Glycinin和β-Conglycinin对不同食性鱼类生长及肠道组织的影响[J].西北农林大学学报:自然科学版,2011,39(2):59-66,74.
[5] Guo Pengfei,Piao Xiangshu,Cao Yunhe,et al.Recombinant soybean protein β-conglycinin α′-subunit expression and induced hypersensitivity reaction in rats[J].International Archives of Allergy and Immunology,2008,145(2):102-110.
[6] 孙赵洋,赵元,袁志杰,等.大豆抗原蛋白β-conglycinin线性表位及其不同种属动物过敏血清结合能力比较[J].东北农业大学学报,2017,48(1):58-64.
[7] Holen E,Araujo P,Sissener N H,et al.A comparative study:difference in omega-6/omega-3 balance and saturated fat in diets for Atlantic salmon(Salmo salar)affect immune-,fat metabolism-,oxidative and apoptotic-gene expression,and eicosanoid secretion in head kidney leukocytes[J].Fish & Shellfish Immunology,2018,72:57-68.
[8] Wu Shaowen,Murphy P A,Johnson L A,et al.Simplified process for soybean glycinin and β-conglycinin fractionation[J].Journal of Agricultural and Food Chemistry,2000,48(7):2702-2708.
[9] 张甜甜,殷海成,黄巍.枯草芽孢杆菌肽聚糖对β-伴大豆球蛋白诱导的鲤幼鱼肠上皮细胞损伤的保护作用[J].水产学报,2018,42(4):495-502.
[10] Kong Delei,Wang Zanfeng,Tian Jie,et al.Glycyrrhizin inactivates toll-like receptor(TLR)signaling pathway to reduce lipopolysaccharide-induced acute lung injury by inhibiting TLR2[J].Journal of Cellular Physiology,2019,234(4):4597-4607.
[11] Supajatura V,Ushio H,Nakao A,et al.Differential responses of mast cell Toll-like receptors 2 and 4 in allergy and innate immunity[J].The Journal of Clinical Investigation,2002,109(10):1351-1359.
[12] 丁旭.斜带石斑鱼Toll样受体22基因的cDNA克隆、表达模式分析及其信号通路的初步探讨[D].海口:海南大学,2012.
[13] Lee W H,Wu H M,Lee C G,et al.Specific oligopeptides in fermented soybean extract inhibit NF-κB-dependent iNOS and cytokine induction by Toll-like receptor ligands[J].Journal of Medicinal Food,2014,17(11):1239-1246.
[14] Scapigliati G,Buonocore F,Bird S,et al.Phylogeny of cytokines:molecular cloning and expression analysis of sea bass Dicentrarchus labrax interleukin-1β[J].Fish & Shellfish Immunology,2001,11(8):711-726.
[15] Fujiki K,Shin D H,Nakao M,et al.Molecular cloning and expression analysis of carp(Cyprinus carpio)interleukin-1β,high affinity immunoglobulin E Fc receptor γ subunit and serum amyloid A[J].Fish & Shellfish Immunology,2000,10(3):229-242.
[16] Zhang Jinxiu,Guo Linying,Feng Lin,et al.Soybean β-conglycinin induces inflammation and oxidation and causes dysfunction of intestinal digestion and absorption in fish[J].PLoS One,2013,8(3):e58115.
[17] Urán P A,Gonçalves A A,Taverne-Thiele J J,et al.Soybean meal induces intestinal inflammation in common carp(Cyprinus carpio L.)[J].Fish & Shellfish Immunology,2008,25(6):751-760.
[18] Xu J,Zhou A,Wang Z,et al.Effects of glycinin and β-conglycinin on integrity and immune responses of mouse intestinal epithelial cells[J].The Journal of Animal and Plant Sciences,2010,20(3):170-174.
[19] Oh K,Seo M W,Kim Y W,et al.Osteopontin potentiates pulmonary inflammation and fibrosis by modulating IL-17/IFN-γ-secreting T-cell ratios in bleomycin-treated mice[J].Immune Network,2015,15(3):142-149.