水体结冰是鱼类越冬时常常面临的挑战,特别是在高寒地区的浅水区域,水体常会因为气温的急剧下降而“冻透”。水体完全结冰会引起鱼类体液结冰、特别是会阻碍气体交换,从而使鱼类处于完全缺氧的环境。关于鱼类适应结冰水体的报道多集中于一些海水鱼类,如南极鱼类利用抗冻蛋白与冰的水合作用阻止冰晶进入体内并抑制体内的冰晶生长[1],为鱼体提供1~2 ℃的热保护[2],因此,可以在低于冰点的海水环境(-1.91 ℃)中生存。关于淡水鱼类耐受零下低温的报道仅见于阿拉斯加黑鱼Dallia pectoralis,其可以在-20 ℃的温度下存活40 min,但是相关的耐受机制尚不清楚[3]。
葛氏鲈塘鳢Perccottus glenii主要分布于松花江流域,为了能够在高寒地区的浅水区顺利越冬,该鱼可以在完全结冰缺氧的环境下生存数天,甚至在间歇“冻透”的水体中存活几个月,因此,被当地渔民称为“还阳鱼”。但是目前关于葛氏鲈塘鳢对水体完全结冰缺氧的耐受能力,以及对这种极端环境的生理生化响应尚不清楚。为此,本研究中测定了葛氏鲈塘鳢在不同水体结冰温度下的存活率,水体结冰前、水体完全结冰、鱼体复苏各阶段的生理生化指标,旨在为揭示淡水鱼类对完全结冰缺氧环境的耐受机制提供科学依据。
1 材料与方法
1.1 材料
于2017年11月中旬(自然水温4 ℃左右)采用地笼在松花江湿地采集葛氏鲈塘鳢,选择体质量相近(全长12.5 cm±1.8 cm、体质量30.0 g± 2.7 g)的健康个体运至实验室,冰箱内(4 ℃)暂养7 d,期间不投饵,每天全量换水1次,暂养期间溶氧不低于6 mg/L。
1.2 方法
1.2.1 耐受试验 耐受的结冰温度分别设置为-2、-3、-4、-5 ℃,持续时间分别设为24、72 h。试验开始后,将暂养的鱼从4 ℃直接移入所设定温度的冰箱中。降温速率为1 ℃/h,至零度时水体存在一个结冰过程。由于设定温度不同,各组结冰的时间为24~48 h。试验容器为5 L的透明食品保鲜盒,水的体积为4 L,每个容器内放试验鱼10尾。每个处理设置3组平行。温度探头放置在容器中间,并在靠近鱼体的位置监测温度,在达到设定温度和持续时间后,手工机械破冰,迅速将鱼放入4 ℃水中,观察其存活情况。为防止试验鱼因低温表现麻木引起的误判,观察时间持续4 h,以碰触尾柄无反应、鳃盖无活动为标准判断死亡。
1.2.2 生理生化响应试验 根据耐受试验结果,选择存活率为100%的温度-2 ℃和持续时间24 h的试验组进行生理生化响应试验。水体从表层开始结冰至完全结冰的过程约为48 h。根据水体的冻融过程共设置5组,分别为水体结冰前(T1组,水温0 ℃,溶氧 6 mg/L)、水体完全结冰24 h(T2组,冰温度-2 ℃,溶氧约为0 mg/L)和鱼体复苏1 h(T3组)、24 h(T4组)和72 h(T5组)(机械破冰后鱼被直接移入4 ℃水中复苏,溶氧6 mg/L)。每个试验组设置3个平行,每个平行放5尾鱼,试验共75尾鱼。试验过程中监测温度和溶氧。
1.2.3 生化指标测定 将试验鱼置于冰盘上立即处死、解剖,分别取其肝脏、心脏、肌肉、鳃和脑组织,于-80 ℃保存待测。肝脏和肌肉的糖原含量,各组织中的葡萄糖、乳酸、总蛋白含量,乳酸脱氢酶(LDH)活性分别采用南京建成相应试剂盒测定。
1.3 数据分析
采用SPSS 17.0软件对试验各阶段不同组织中的生化指标进行单因素方差分析(ANOVA)和Duncan多重比较,显著性水平设为0.05。
2 结果与分析
2.1 葛氏鲈塘鳢耐受水体结冰缺氧环境的能力
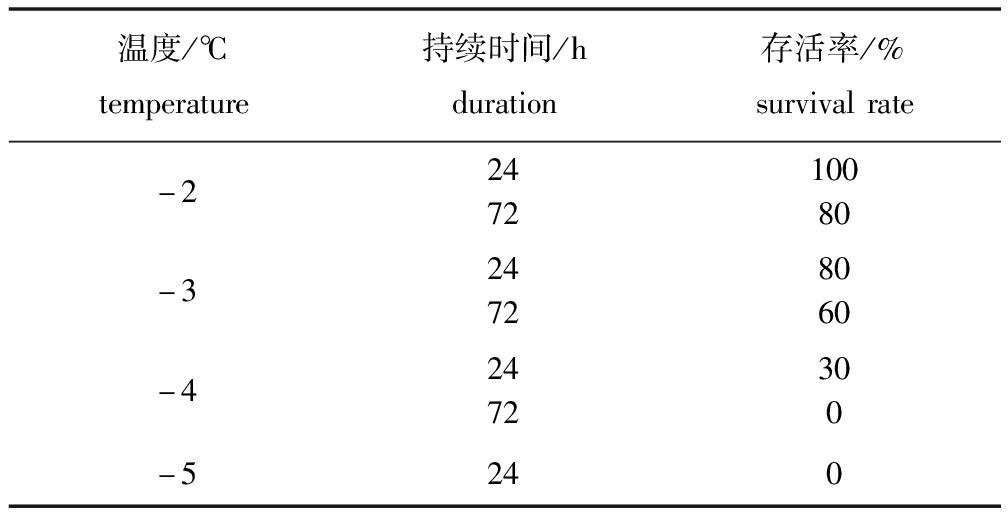
从表1可见:葛氏鲈塘鳢在-2 ℃持续24 h的存活率为100%,说明其可以短时间耐受较温和的完全结冰缺氧环境;随着温度降低和结冰时间的延长,其存活率明显下降,至-4 ℃时其24、72 h的存活率分别为30%和0,-5 ℃时其24 h的存活率为0。图1为葛氏鲈塘鳢分别在水体完全结冰(图1-A)、破冰(图1-B)和复苏阶段(图1-C)的状态,从图1-B可以看出,葛氏鲈塘鳢在冰中时的身体柔软,碰触尾柄有反应,并未出现冻僵现象。
表1 不同温度下葛氏鲈塘鳢的存活率(n=3)
Tab.1 Survival rates of Chinese sleeper Perccottus glenii at different temperatures(n=3)
温度/℃temperature持续时间/hduration存活率/%survivalrate-2247210080-324728060-42472300-5240

注:A为水体完全结冰时葛氏鲈塘鳢的状态;B为手工破冰时葛氏鲈塘鳢的状态;C为葛氏鲈塘鳢复苏时的状态
Note: A,the situation of fish in the iced up; B,the fish is sampled from broken ice by hand hammer; C, the situation of the recovery fish
图1 水体完全结冰、破冰和复苏阶段葛氏鲈塘鳢的状态
Fig.1 Situation of Chinese sleeper Perccottus glenii during the periods of iced up,meltedice and recovery
2.2 水体结冰前、完全结冰和鱼体复苏期葛氏鲈塘鳢的肝/肌糖原含量
从图2可见:水体结冰前(T1)葛氏鲈塘鳢的肝糖原水平为102.66 mg/g prot,在结冰期(T2)急剧降低至20.45 mg/g prot,随后在鱼体复苏1 h(T3)和24 h(T4)的肝糖原含量仍有小幅下降,直到复苏72 h(T5)时肝糖原含量出现上升趋势;葛氏鲈塘鳢在水体结冰期和复苏期的肝糖原含量显著低于水体结冰前的含量(P<0.05),肌糖原含量的变化趋势与肝糖原相似,但各组间无显著性差异(P>0.05)。
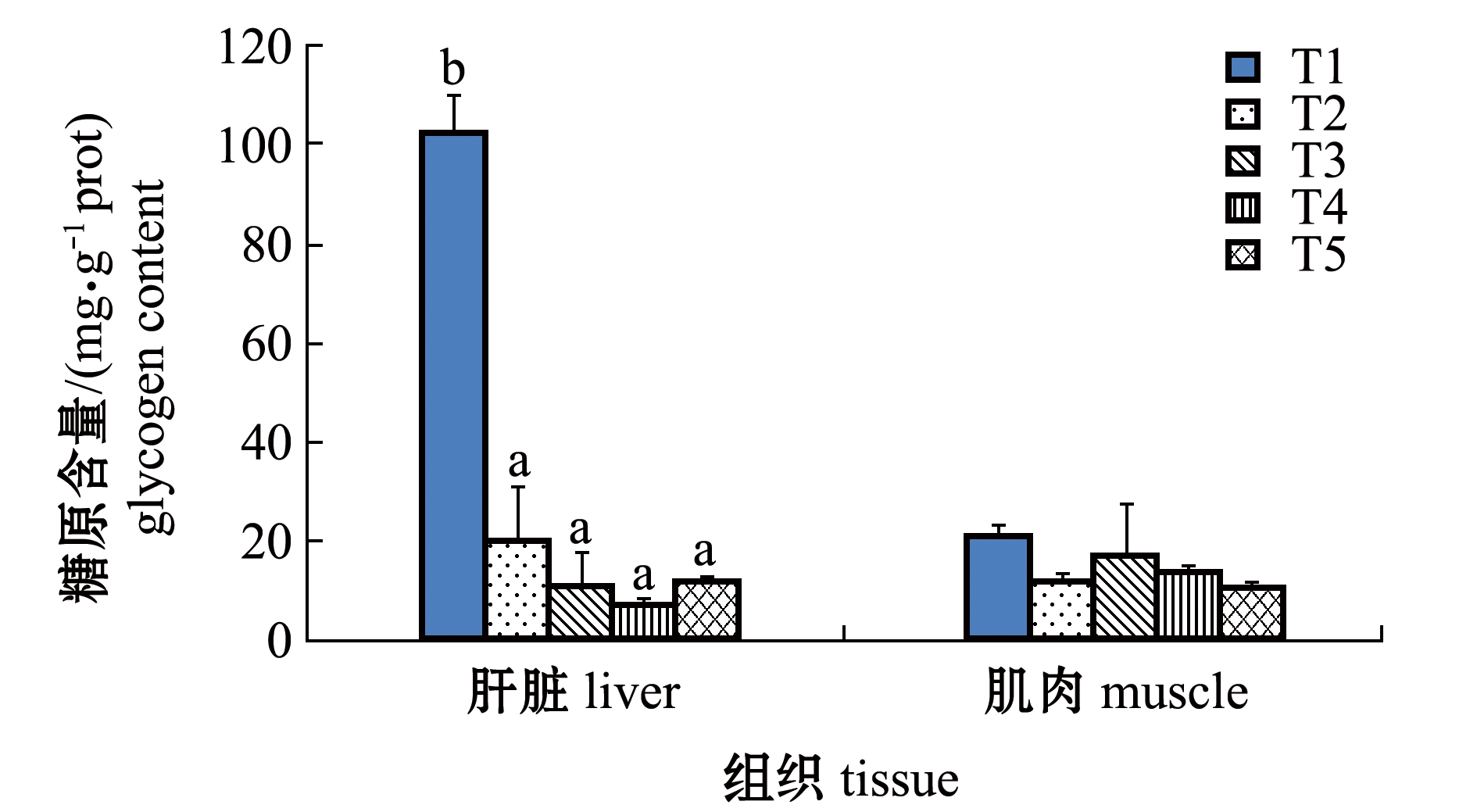
注:T1为水体结冰前(0 ℃);T2为水体完全结冰24 h(-2 ℃);T3为试验鱼复苏1 h(4 ℃);T4为试验鱼复苏24 h(4 ℃);T5为试验鱼复苏72 h(4 ℃)。标有不同字母者表示同一组织中不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note: T1,pre-iced up(0 ℃); T2,iced for 24 h(-2 ℃); T3,recovery of fish for 1 h(4 ℃); T4,recovery of fish for 24 h(4 ℃); T5,recovery of fish for 72 h(4 ℃).The means with different letters within the same tissue are significantly different in the different groups at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图2 水体结冰前、完全结冰和鱼体复苏期的肝/肌糖原含量
Fig.2 Glycogen levels in liver and muscle of fish during the periods of pre-iced, iced up and recovery
2.3 水体结冰前、完全结冰和鱼体复苏期各组织的葡萄糖含量
从图3可见:肌肉、鳃、脑和心脏中的葡萄糖含量水体结冰前(T1)均显著低于水体结冰期(T2)和鱼体复苏期(T3~T5)(P<0.05);肝脏中的葡萄糖含量表现出先升高后降低的趋势,峰值为4.75 mmol/g prot,出现在水体结冰期(T2),在鱼体复苏期逐渐降低,至鱼体复苏72 h(T5)时葡萄糖含量降至1.87 mmol/g prot,且各阶段葡萄糖含量的变化未达到显著性水平(P>0.05)。从图3还可以看出:鳃和脑组织中的葡萄糖含量在鱼体复苏1 h(T3)达到峰值后,随复苏时间的延长呈下降趋势;肌肉和心脏中的葡萄糖含量在鱼体复苏72 h(T5)时达到最大值,分别为2.31、1.41 mmoL/g prot。
2.4 水体结冰前、完全结冰和鱼体复苏期各组织的乳酸含量
从图4可见:在水体结冰期(T2)和鱼体复苏期(T3~T5),葛氏鲈塘鳢的脑和心脏组织中的乳酸含量显著高于水体结冰前(P<0.05),说明完全结冰缺氧环境下,组织中的无氧糖酵解加强,代谢终产物乳酸含量增加;各阶段的肌肉和肝脏中乳酸含量无显著性变化(P>0.05)。

图3 水体结冰前、完全结冰和鱼体复苏期的葡萄糖含量
Fig.3 Glucose contents in fish during the periods of pre-iced, iced up and recovery
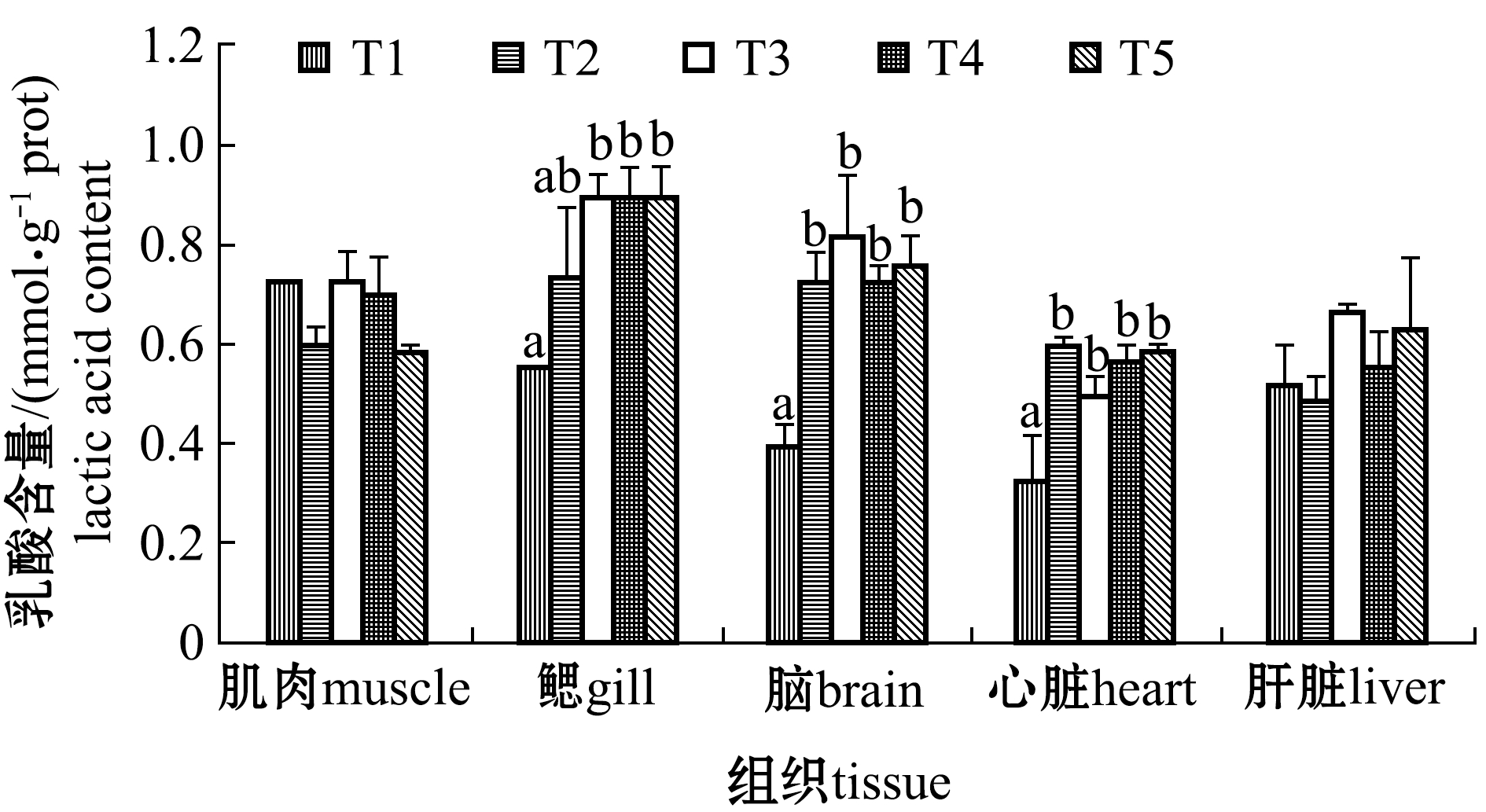
图4 水体结冰前、完全结冰和鱼体复苏期的乳酸含量
Fig.4 Lactic acid contents in fish during the periods of pre-iced, iced up and recovery
2.5 水体结冰前、完全结冰和鱼体复苏期各组织的LDH活性
从图5可见:试验各阶段的葛氏鲈塘鳢各组织的LDH活性均无显著性差异(P>0.05),但仍可以看出,水体结冰期(T2)的鳃、脑和肝脏组织中的LDH活性较水体结冰前有不同程度的升高;复苏期鳃、肌肉和心脏中的LDH活性最高值出现在鱼体复苏72 h(T5),脑中的LDH活性最大值出现在鱼体复苏1 h(T3),说明脑在复苏1 h的无氧糖酵解活动最高,而鳃、肌肉和心脏中的无氧糖酵解活动则在复苏72 h最活跃。
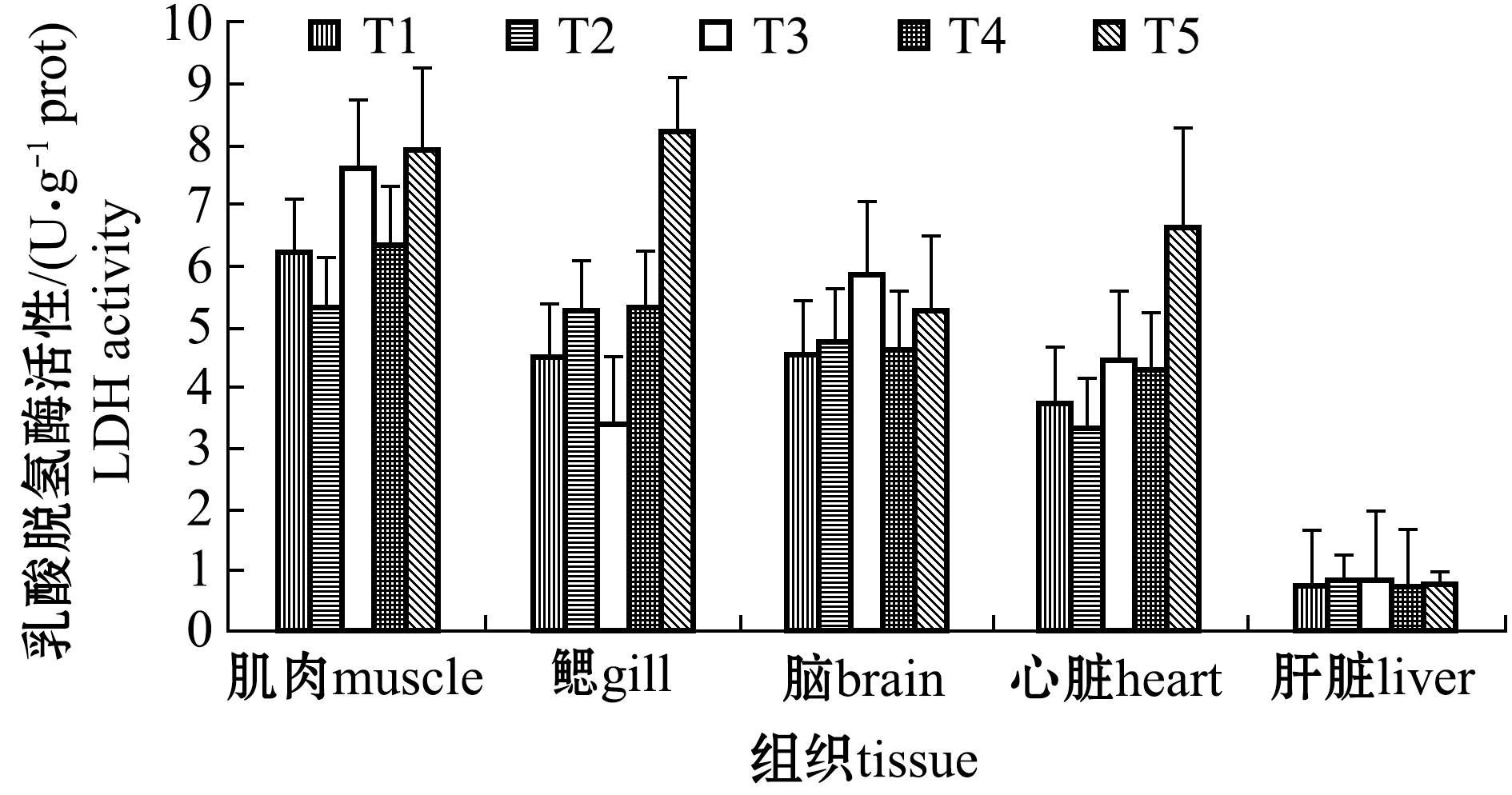
图5 水体结冰前、完全结冰和鱼体复苏期的LDH活性
Fig.5 LDH activities in fish during the periods of pre-iced, iced up and recovery
3 讨论
3.1 鱼类耐受环境结冰的能力
Evans等[2]研究发现,南极鱼类及一些生活在极地水域的海水鱼类可以在结冰的海水中生活,甚至可以在低于冰点的海水环境(-1.91 ℃)中生存。而关于淡水鱼类耐受环境结冰的报道相对较少。目前已知能够耐受水体完全结冰环境的淡水鱼类是阿拉斯加黑鱼Dallia pectoralis。阿拉斯加黑鱼分布于阿拉斯加和白令岛的淡水中,喜欢栖息在富含水生植物的湖泊、沼泽和池塘中,可以在完全结冰的环境下生存,甚至可以在-20 ℃存活40 min,但是60 min时会死亡[3]。本研究中葛氏鲈塘鳢在-2 ℃的冰中全部存活24 h,在-5 ℃的冰中24 h的存活率为0,破冰发现鱼体柔软并未出现僵硬的现象。这一结果说明葛氏鲈塘鳢具有与阿拉斯加黑鱼相似的耐受环境完全结冰的能力,但也无法耐受身体完全被冻僵。
需要强调的是,阿拉斯加黑鱼和葛氏鲈塘鳢都可以在环境完全结冰下生存一段时间,但是无法如某些两栖类(如树蛙Rana sylvatica)能够耐受超过60%的体液结冰[4]。也就是说,它们并非是耐冻种类。但是它们进化出的短期耐受环境完全结冰的能力,有助于其在极端天气下引起的水体暂时“冻透”时存活。而且从栖息环境来看,葛氏鲈塘鳢与阿拉斯加黑鱼有着共同的偏好,即喜欢栖息在富含水生植物的淡水浅水区。那么,这种水环境类型是否有助于淡水鱼类进化出耐受环境结冰的能力仍需要进一步研究。
3.2 鱼类的抗冻保护剂
在冰冻或零下的环境中,大部分动物会采取积累抗冻保护剂(cryoprotectants)的策略来降低冰点、提高体液渗透压,从而解决体内结冰、细胞内冰核再结晶等问题,常见的抗冻保护剂包括葡萄糖、蔗糖、甘油和抗冻(糖)蛋白等[5]。不同物种所选择的抗冻保护剂种类和数量均不相同。例如,同样生活在结冰溪流中的两种水生摇蚊幼虫Pseudodiamesa branickii和Diamesa cinerella分别采用葡萄糖和蔗糖作为抗冻保护剂[6]。胡瓜鱼Osmerus mordax则通过体内积累甘油来适应-1 ℃的低温环境[7]。南极鱼类则主要以抗冻(糖)蛋白作为抗冻物质[2]。两栖类和爬行类则多选择葡萄糖作为抗冻保护剂,如阿拉斯加越冬的树蛙R.sylvaticus[8]和欧洲普通蜥蜴Lacerta vivipara[9]都采用葡萄糖作为抗冻物质。
本研究结果显示,葛氏鲈塘鳢在水体结冰期和鱼体复苏期的肌肉、鳃、脑和心脏组织的葡萄糖含量均显著高于水体结冰前;而在结冰期肝糖原含量显著下降至结冰前的1/5左右,这说明葛氏鲈塘鳢很可能通过分解肝糖原在组织中积累葡萄糖作为细胞保护物,从而提高鱼体耐受水体结冰的能力。而在鱼体复苏期,肝脏、鳃和脑组织的葡萄糖含量均出现下降趋势,这可能是组织中的葡萄糖被重新转运至肝脏,以肝糖原的形式储存并为应对下一次水体结冰做准备。一些两栖耐冻种类也会采取类似的耐受策略来应对环境中的反复低温胁迫[4]。
3.3 鱼类对低温缺氧环境的响应
在完全结冰的水体中越冬需要适应的另一个环境胁迫是缺氧。因为水体完全结冰将鱼体与外界空气隔断形成了一个极度缺氧的环境。在完全结冰的环境中,阿拉斯加黑鱼的存活时间主要取决于其耐受缺氧的能力,其在水温1 ℃条件下的封闭环境中,因为缺氧而无法生存超过24 h[3]。通常缺氧情况下,细胞的葡萄糖代谢从依赖氧的三羧酸循环(TCA循环)转换为不依赖氧的糖酵解代谢。例如,麦瑞加拉鲮鱼Cirrhinus mrigala在缺氧72 h时糖酵解酶——己糖激酶、LDH和葡萄糖-6-磷酸酶的活性明显增加[10];印度鲇Clarias batrachus在缺氧72 h时心脏和肌肉组织中的LDH活性显著升高[11],这说明多数鱼类会通过提高糖酵解水平来适应缺氧环境。
无氧糖酵解从每个葡萄糖分子中释放2个ATP,而TCA循环能产生38个ATP,因此,缺氧细胞会通过增加葡萄糖的摄取来提升其生成ATP的能力。本研究中发现,水体结冰期葛氏鲈塘鳢在组织中大量积累葡萄糖也为无氧糖酵解提供了代谢底物。本试验过程中,葛氏鲈塘鳢所处的溶氧环境,从结冰前的6 mg/L逐渐下降至水体结冰24 h的0.22 mg/L,至完全结冰时溶氧接近0。在应对水体结冰引起的缺氧环境中,葛氏鲈塘鳢的鳃、脑和心脏组织的糖酵解最终产物——乳酸的含量在水体完全结冰24 h时显著升高,证实了其无氧糖酵解代谢增强。尽管葛氏鲈塘鳢各组织的LDH活性在结冰期和复苏期有所升高,但均未达到显著水平,这可能与其所处的温度较低有关,而且葛氏鲈塘鳢在冰块中停止一切运动(包括鳃盖运动)、所需能量降至最低水平,因此,LDH活性未出现显著升高。
[1] Czechura P,Tam R Y,Dimitrijevic E,et al.The importance of hydration for inhibiting ice recrystallization with C-linked antifreeze glycoproteins[J].Journal of the American Chemical Society,2008,130(10):2928-2929.
[2] Evans C W,Gubala V,Nooney R,et al.How do Antarctic notothenioid fishes cope with internal ice? A novel function for antifreeze glycoproteins[J].Antarctic Science,2011,23(1):57-64.
[3] Scholander P F,Flagg W,Hock R J,et al.Studies on the physiology of frozen plants and animals in the Arctic[J].Journal of Cellular Physiology,1953,42(S1):1-56.
[4] Rosendale A J,Lee R E Jr,Costanzo J P.Effect of physiological stress on expression of glucose transporter 2 in liver of the wood frog,Rana sylvatica[J].Journal of Experimental Zoology Part A:Ecological Genetics and Physiolog,2014,321(10):566-576.
[5] Gertrudes A,Craveiro R,Eltayari Z,et al.How do animals survive extreme temperature amplitudes?The role of natural deep eutectic solvents[J].ACS Sustainable Chemistry & Engineering,2017,5(11):9542-9553
[6] Lencioni V,Jousson O,Guella G,et al.Cold adaptive potential of chironomids overwintering in a glacial stream[J].Physiological Entomology,2015,40(1):43-53.
[7] Driedzic W R.Rainbow smelt:the unusual case of cryoprotection by sustained glycerol production in an aquatic animal[J].Journal of Comparative Physiology B,2015,185(5):487-499.
[8] Larson D J,Middle L,Vu H,et al.Wood frog adaptations to overwintering in Alaska:new limits to freezing tolerance[J].Journal of Experimental Biology,2014,217(12):2193-2200.
[9] Voituron Y,Storey J M,Grenot C,et al.Freezing survival,body ice content and blood composition of the freeze-tolerant European common lizard,Lacerta vivipara[J].Journal of Comparative Physiology B,2002,172(1):71-76.
[10] Varghese T,Pal A K,Mishal P,et al.Physiological and molecular responses of a bottom dwelling carp,Cirrhinus mrigala to short-term environmental hypoxia[J].Turkish Journal of Fisheries and Aquatic Sciences,2018,18:483-490.
[11] Kumar A,Gopesh A.Effect of hypoxia and energy conservation strategies in the air-breathing Indian catfish,Clarias batrachus[J].National Academy Science Letters,2015,38(2):135-137.