中间球海胆Strongylocentrotus intermedius又称虾夷马粪海胆,原产于日本北海道北部及俄罗斯远东部分沿海[1],其性腺色泽好、味道鲜美,深受消费者喜爱,是可食用海胆类中经济价值较高的种类之一。自1989年被引入中国后,逐渐成为中国主要的海胆养殖种类之一[2]。疾病是影响海胆养殖生产效率的主要因素,在养殖生产过程中,中间球海胆易患的疾病主要有黑嘴病、红斑病和病变综合征等[3]。近年来,无论是在海区养殖还是在室内养殖中,黑嘴病几乎发生于每年春夏交替时的低水温期,病变综合征和红斑病则几乎发生于每年的夏季高水温期,由这些疾病导致的大规模死亡现象也时有发生[4-7]。近两年,在夏季高水温期,还发现一种“掉棘病”,患病海胆外壳间步带区的棘刺全部脱落,并在出现症状后的2 d内死亡,由于未见报道,暂将此病命名为“掉棘病”。国内外学者研究一致认为,这些疾病的病原多是细菌,这些病原菌的激活、暴发和休眠与海水水温的变化直接相关[6-9]。在中国,中间球海胆的养殖方式主要为基于开放海域的筏式养殖,无法针对病原、水温等致病因子进行人为控制,因此,培育抗病能力强的海胆新品种将是抵御病原感染的最有效途径之一。
家系选育是近年来在水产动物中应用广泛的一种育种方法[10]。通过建立家系,对不同家系的生产性能进行比较,可选育出具有生长优势的家系用于继代选育。针对生长性状,研究人员已在多数水产动物中通过家系间比较开展了家系选择,如田永胜等[11]、张吕平等[12]、王俊杰等[13]分别通过家系比较,对牙鲆Paralichthys olivaceus、凡纳滨对虾Litopenaeus vannmei和虾夷扇贝Patinopecten yessoensis的生长性状进行了家系选择。针对抗病性状,研究人员已在一些水产动物如大菱鲆Scophthalmus maximus[14]、牙鲆[15-16]、凡纳滨对虾[17]中开展了家系间比较和家系选择。由于多数抗病性状遗传力较低,应用家系选择可能会获得更理想的选择反应。在中间球海胆中,针对生长性状和耐高温性状的家系选育研究已有较多报道[18-22],也有研究表明,中间球海胆的耐高温能力与生长速度间不具有显著的相关性[21]。然而,目前针对海胆抗病性状家系选育的研究尚未见报道,并且是否可同时对抗病和生长速度进行选择尚不明确。
本试验中对经7代选育的中间球海胆家系在自然感染病变综合征、掉棘病及黑嘴病下的存活率进行了比较,并对各家系在幼胆期和养成期的生长性状进行了比较,旨在为中间球海胆抗病速生家系的选择提供参考,为抗病海胆新品种选育奠定基础。
1 材料与方法
1.1 材料
试验所用中间球海胆家系为农业农村部北方海水增养殖重点实验室选育的第7代家系。
1.2 方法
1.2.1 家系建立 家系构建时间为2017年10月中旬,所用亲本选自第6代选育家系,其中,雄性亲本22个,雌性亲本34个。采用巢式不平衡设计和1∶1~1∶2的雄雌比例进行选配,选配过程中避免近交,共构建全同胞家系34个,其中成活32个。
1.2.2 幼体及稚胆培育 家系幼体的培育参照文献[20]中的方法进行。培育期间严格保持家系间培育条件一致。家系幼体经过20~22 d的浮游期后,匍匐于附着有底栖硅藻的波纹板上变态为稚海胆。在稚胆壳径小于3 mm期间,仅提供混合底栖硅藻为饵料,稚胆壳径达到3 mm后以孔石莼Ulva pertusa为饵料。稚胆培育期间,饵料足量供应,每隔2~4 d全量换水一次,各家系间保持培育条件一致。经过6个月的培育稚胆生长成为幼胆。
1.2.3 幼胆养殖 于2018年5月10日,对7月龄的幼胆开展家系标准化养殖,从每个家系中随机挑选220只幼胆移至1个养殖网箱(30 cm ×30 cm × 80 cm,共32个)中,并将所有家系的网箱置于同一常温循环水养殖池(以下称“常温池”)中养殖,养殖期间足量投喂海带Laminaria japonica、孔石莼或裙带菜Undaria pinnatifida,各家系投喂饵料种类保持完全一致,每隔3~7 d全量换水一次。夏季高温不仅显著影响海胆的生长,还是病变综合征的病因之一,因此,养殖至2018年8月1日,海胆年龄为10月龄时,从每个家系随机分出110只个体至另一低温循环水养殖池(以下称“低温池”)进行养殖,直至2018年12月1日,海胆为14月龄。
低温池养殖期间每日定时流水,流水量为总水体的1/2,足量投喂海带、孔石莼或裙带菜,各家系投喂饵料种类保持完全一致。在夏季高温期间,对低温池进行降温处理,具体为在8月1日到9月26日期间,水温保持在16.8~24.6 ℃,平均水温为20.6 ℃,同期常温循环池水温为17.7~25.6 ℃,平均水温为22.5 ℃。
1.2.4 养成 幼胆养殖结束后,海胆进入养成期,此期间春季水温上升时海胆易感染黑嘴病,因此,此阶段仍分为常温池和低温池养殖。2018年12月1日海胆14月龄时,将原常温池和低温池内34个家系中同一家系内存活下来的海胆进行合并,并随机挑出40只健康个体,平分至常温和低温池中继续培养至2019年4月28日,海胆为18月龄。养殖方法与幼胆养殖基本一致。养殖期间低温池水温保持在6.4~15.4 ℃,平均水温为10.0 ℃,常温循环池水温为6.6~16.5 ℃,平均水温为10.9 ℃。
1.2.5 存活率和综合抗病指数的计算 2018年8月7日至9月26日期间,常温池养殖的海胆家系自然感染病变综合征[8],此时水温为20.2~26.0 ℃,海胆为10~11月龄。感染前的养殖过程中,各家系内海胆不存在死亡或丢失现象,数量均为110只。感染期间,每日观察各家系染病情况,挑出死亡个体并进行记录,最终统计截止至9月26日。
2018年9月3日至9月26日期间,低温池养殖的海胆家系自然感染掉棘病,而常温池未出现该疾病。掉棘病出现时的水温为16.8~21.6 ℃,海胆年龄为11月龄。感染前的养殖过程中,各家系内海胆不存在死亡或丢失现象,数量均为110只。感染期间,每日观察各家系染病情况,挑出死亡个体并进行记录,最终统计截止至9月26日。
2019年3月1日至4月28日期间,常温池养殖的海胆家系自然感染黑嘴病,此时水温为7~11 ℃,海胆年龄为17~18月龄。感染前的养殖过程中,常温池家系存在个别非疾病死亡或由于网箱破损等原因导致的丢失现象,使各家系海胆数量介于15~20只。低温池未出现黑嘴病感染。此期间,每日观察各家系染病情况,挑出死亡个体并进行记录,最终统计截止至4月28日。
各疾病感染下,家系的存活率计算公式为
存活率=感染后存活个体数/感染前存活个体数×100%。
(1)
综合考虑中间球海胆养殖实践中3种疾病的发病频率和疾病影响程度,将病变综合征、掉棘病和黑嘴病分别赋予50%、15%和35%的权重,利用该权重和家系在各疾病感染下的存活率计算各家系的复合抗病指数(CDRI),即:
CDRI=50%×SR1+15%×SR2+35%×SR3。
(2)
其中:SR1为病变综合征感染后各家系的存活率(%);SR2为掉棘病感染后各家系的存活率(%);SR3为黑嘴病感染后各家系的存活率(%)。
1.2.6 家系体质量生长的测量与计算
(1)幼胆时期的体质量生长。7月龄家系标准化时,从各家系的220只幼胆中随机挑选110只个体,用电子天平测量每一个体的体质量,精确到0.01 g。在9月龄时,从每一家系中随机挑选50只个体进行体质量测量。
(2)养成期的体质量生长。在海胆年龄为14和17月龄时,分别测量常温和低温池中各家系中每一只海胆个体的体质量,精确到0.01 g。
幼胆和养成期各家系海胆体质量特定生长率(SGR,%/d)计算公式如下:
SGR=(lnW2-lnW1)/t×100%。
(3)
其中:W1和W2分别为t1和t2时各家系的体质量平均值(g)(幼胆期t1=210 d,t2=270 d;养成期t1=420 d,t2=510 d);t为t1至t2间的时间(d)。
1.3 数据处理
分别对病变综合征、掉棘病和黑嘴病自然感染下各家系的存活率进行卡方检验;筛选存活率或复合抗病指数最高的前5名家系和最低的后5名家系作为抗病家系和易感家系,以全部家系平均值做对照,分别以7月龄和14月龄各家系的体质量平均值作为协变量,以家系类型(抗病家系、易感家系和家系平均值)为固定效应,构建一般线性模型(GLM)分析家系类型对体质量平均值SGR的影响,获得剔除协变量效应后各家系类型体质量平均值SGR的估计值,采用LSD法对各类型家系的SGR估计值进行多重比较。所有分析均在SPSS 21.0软件上进行,显著性水平设为0.05。
2 结果与分析
2.1 中间球海胆抗病家系筛选
2.1.1 自然感染3种疾病对家系存活率的影响 分别对3种疾病感染下各家系的存活和死亡个数进行卡方检验,结果显示,3种疾病感染下,家系间海胆的存活率均有极显著性差异(P<0.01)(表1)。
表1 3种疾病自然感染下中间球海胆家系存活情况的卡方检验
Tab.1 Chi-square test of survival status of sea urchin Strongylocentrotus intermedius in different families naturally infected with three diseases
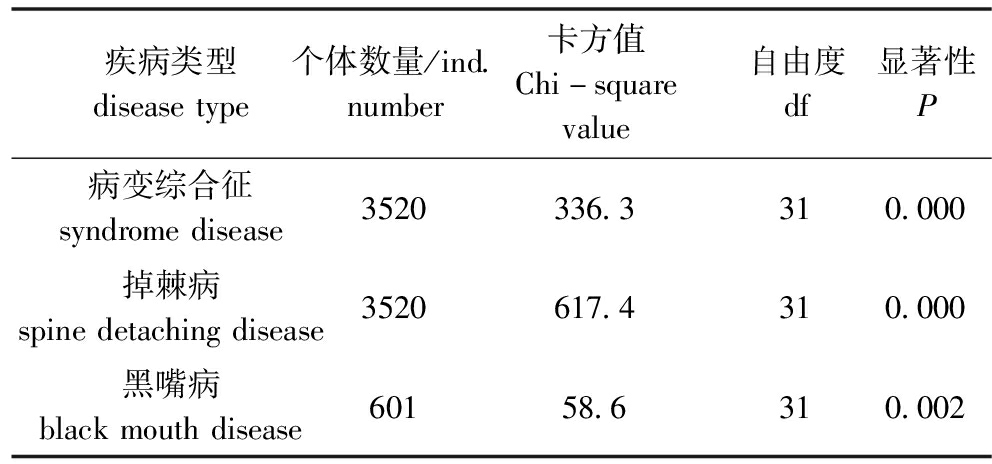
疾病类型diseasetype个体数量/ind.number卡方值Chi-squarevalue自由度df显著性P病变综合征syndromedisease3520336.3310.000掉棘病spinedetachingdisease3520617.4310.000黑嘴病blackmouthdisease60158.6310.002
2.1.2 3种疾病自然感染下家系存活率排名 从表2可见:在病变综合征自然感染下,各家系的存活率为30.9%~95.5%;家系F7211-1、F7209-1、F7208-1、F7103-2、F72C2等的存活率排名较高,具有较强的抗病变综合征能力;家系F7210-1、F7202-2、F72C1、F7213-1等的存活率排名较低,抗病变综合征能力较弱。
掉棘病自然感染下,各家系的存活率为10.0%~100.0%;家系F7214-1、F72C4、F7203-1、F7203-2、F7213-1等的存活率排名较高,具有较强的抗掉棘病能力;家系F7202-2、F7204-1、F7202-1等的存活率排名较低,抗掉棘病的能力较弱。
黑嘴病自然感染下,各家系的存活率为5.6%~84.2%;家系F7214-1、F7213-1、F7203-1、F7213-2、F72C6等的存活率排名较高,具有较强的抗黑嘴病能力;家系F7210-1、F72C2、F72C3等的存活率排名较低,抗黑嘴病能力较弱。
2.1.3 家系复合抗病指数排名 各家系的复合抗病指数排名见图1。从图1可见:各家系复合抗病指数为0.29~0.78,其中,F7209-1、F7211-1、F7214-1和F7203-2等家系的复合抗病指数排名较高,具有较高的综合抗病能力;F7210-1、F7202-2、F72C3等家系的复合抗病指数排名较低,具有较低的综合抗病能力。
2.1.4 抗病家系的筛选 在3种疾病分别自然感染下,存活率均超过70%的家系见表2,大部分家系仅在1~2种疾病感染下存活率超过70%。在2种以上疾病分别感染下存活率均超过70%的家系分布见图2,在这些家系中,仅有F7217-2家系在3种疾病分别感染下的存活率均超过70%。根据家系排名,进一步筛选出抗病家系5个,平均存活率为77.4%~90.0%,易感家系5个,平均存活率为27.8%~41.8%;并筛选出复合抗病家系5个,平均抗病指数为0.766±0.019,易感家系5个,平均抗病指数为0.447±0.101(表3)。
表2 3种疾病自然感染下各家系存活率排名
Tab.2 Order of survival rate of sea urchin in different families naturally infected with the three diseases

存活率排名survivalrateranking家系(存活率)family(survivalrate)/%病变综合征syndromedisease(10-11monthsoldnormaltemperaturetank)掉棘病spinedetachingdisease(11monthsoldlowtemperaturetank)黑嘴病blackmouthdisease(17-18monthsoldnormaltemperaturetank)1F7211-1(95.5)F7214-1(100.0)F7214-1(84.2)2F7209-1(90.9)F72C4(90.9)F7213-1(76.5)3F7208-1(82.7)F7203-1(88.2)F7203-1(76.2)4F7203-2(81.8)F7203-2(88.2)F7217-2(75.0)5F72C2(80.9)F7213-1(82.7)F72C6(75.0)6F7218-1(78.2)F7212-1(80.9)F7201-1(73.7)7F72C5(78.2)F7210-1(80.0)F7201-2(73.7)8F7201-1(77.3)F7218-2(79.1)F7205-1(70.0)9F7206-1(77.3)F72C1(78.2)F7209-2(70.0)10F7216-1(76.4)F7217-2(75.5)F7204-1(70.0)11F7218-2(76.4)F7218-1(70.9)F72C5(68.8)12F72C6(71.8)F7209-1(68.2)F7212-1(68.4)13F72C4(70.9)F7207-1(64.5)F7206-2(66.7)14F7217-2(70.0)F7216-1(63.6)F7202-2(66.7)15F7206-2(69.1)F7201-1(61.8)F7209-1(65.0)16F7212-1(67.3)F7206-1(61.8)F7211-1(65.0)17F7207-2(67.3)F7208-1(58.2)F7203-2(63.2)18F7214-1(64.5)F7205-1(57.3)F7218-1(63.2)19F7203-1(64.5)F7206-2(56.4)F7208-1(63.2)20F7208-2(64.5)F7208-2(56.4)F72C1(60.0)21F7201-2(63.6)F7207-2(51.8)F7206-1(60.0)22F7205-1(60.9)F72C2(51.8)F7216-1(57.9)23F7207-1(60.9)F72C5(50.9)F7210-2(57.9)24F7204-1(59.1)F7211-1(50.9)F7207-1(56.3)25F7202-1(56.4)F7210-2(50.9)F7218-2(55.6)26F7209-2(55.5)F72C3(50.9)F7207-2(55.6)27F7210-2(54.5)F7209-2(49.1)F7202-1(55.6)28F72C3(52.7)F7201-2(43.6)F7208-2(52.6)29F7213-1(46.4)F72C6(41.8)F72C4(47.4)30F72C1(46.4)F7202-1(28.2)F72C3(33.3)31F7202-2(32.7)F7204-1(15.5)F72C2(26.3)32F7210-1(30.9)F7202-2(10.0)F7210-1(5.6)
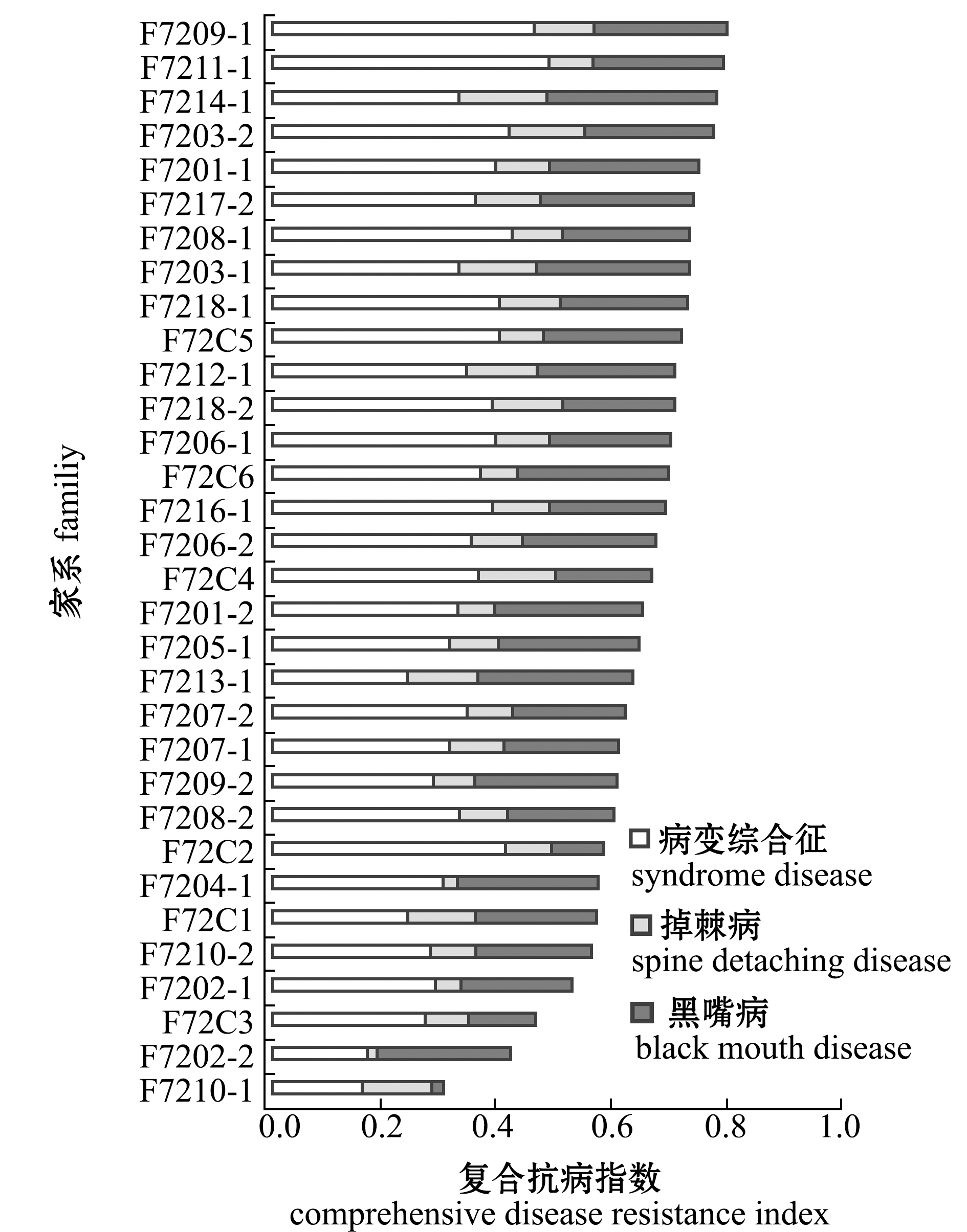
图1 各家系复合抗病指数排名
Fig.1 Order of comprehensive disease resistance index(CDRI)in different families

图2 存活率均超过70%的多抗病家系分布
Fig.2 Distribution of multi-disease-resistant families with survival rate over 70%
2.2 抗病家系生长性能分析
2.2.1 幼胆期的生长性能 构建一般线性模型,剔除协变量(7月龄体质量)的影响后,对抗病家系、易感家系和所有家系幼胆期体质量特定生长率的估计值进行比较。从图3可见:抗不同种类疾病的家系幼胆期体质量估计值与易感家系、所有家系平均值间均无显著性差异(P>0.05);选择抗病变综合征的家系及复合抗病的家系相对于所有家系特定生长率平均值会产生正向选择差。
表3 抗病和易感家系的筛选
Tab.3 Selection of disease-resistant families and susceptible families
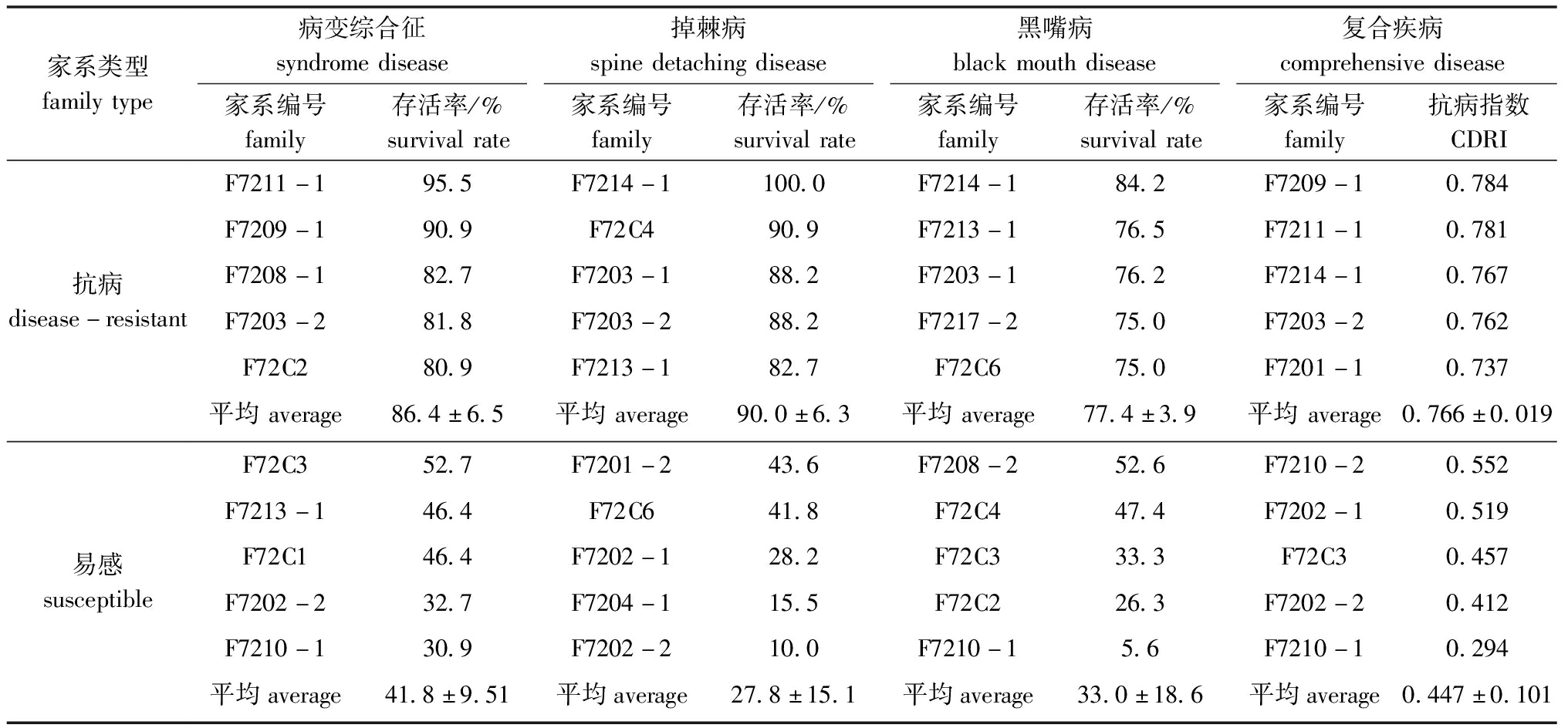
家系类型familytype病变综合征syndromedisease掉棘病spinedetachingdisease黑嘴病blackmouthdisease复合疾病comprehensivedisease家系编号family存活率/%survivalrate家系编号family存活率/%survivalrate家系编号family存活率/%survivalrate家系编号family抗病指数CDRI抗病disease-resistantF7211-195.5F7214-1100.0F7214-184.2F7209-10.784F7209-190.9F72C490.9F7213-176.5F7211-10.781F7208-182.7F7203-188.2F7203-176.2F7214-10.767F7203-281.8F7203-288.2F7217-275.0F7203-20.762F72C280.9F7213-182.7F72C675.0F7201-10.737平均average86.4±6.5平均average90.0±6.3平均average77.4±3.9平均average0.766±0.019易感susceptibleF72C352.7F7201-243.6F7208-252.6F7210-20.552F7213-146.4F72C641.8F72C447.4F7202-10.519F72C146.4F7202-128.2F72C333.3F72C30.457F7202-232.7F7204-115.5F72C226.3F7202-20.412F7210-130.9F7202-210.0F7210-15.6F7210-10.294平均average41.8±9.51平均average27.8±15.1平均average33.0±18.6平均average0.447±0.101

图3 不同抗病类型家系幼胆期(7月龄)的特定生长率
Fig.3 SGR for body weight of juvenile sea urchin(7 months old)in different families
2.2.2 养成期生长性能 构建一般线性模型,剔除协变量(14月龄体质量)的影响后,分别对常温池和低温池养殖的抗病家系、易感家系和所有家系养成期海胆体质量特定生长率的估计值进行比较。从图4可见:无论在常温下还是在低温下养殖,抗不同种类疾病的家系养成期体质量特定生长率估计值与易感家系、所有家系间均无显著性差异(P>0.05);在常温下,选择复合抗病的家系相对于所有家系特定生长率平均值会产生正向选择差;在低温下,所有类型的抗病家系相对于所有家系特定生长率平均值均会产生正向选择差。
2.2.3 抗病速生家系的筛选 复合抗病排名前5(表3)、幼胆期生长速度排名前10及低温池或常温池成胆期生长速度排名前10的家系的分布情况如图5所示。成胆期养殖于常温池情况下,家系F7211-1、F7203-2、F7209-1、F7214-1和F7201-1兼具抗病及幼胆期或成胆期速生的能力,其中F7211-1兼具抗病及幼胆和成胆期速生的能力;成胆期养殖于低温池情况下,家系F7214-1、F7211-1、F7203-2和F7209-1兼具抗病及幼胆期或成胆期速生的能力,其中F7214-1、F7211-1和F7203-2兼具抗3种疾病及幼胆和成胆期速生的能力。


图4 不同抗病类型家系养成期(14月龄)的体质量特定生长率
Fig.4 SGR for body weight of adult sea urchin(14 months old)in different families
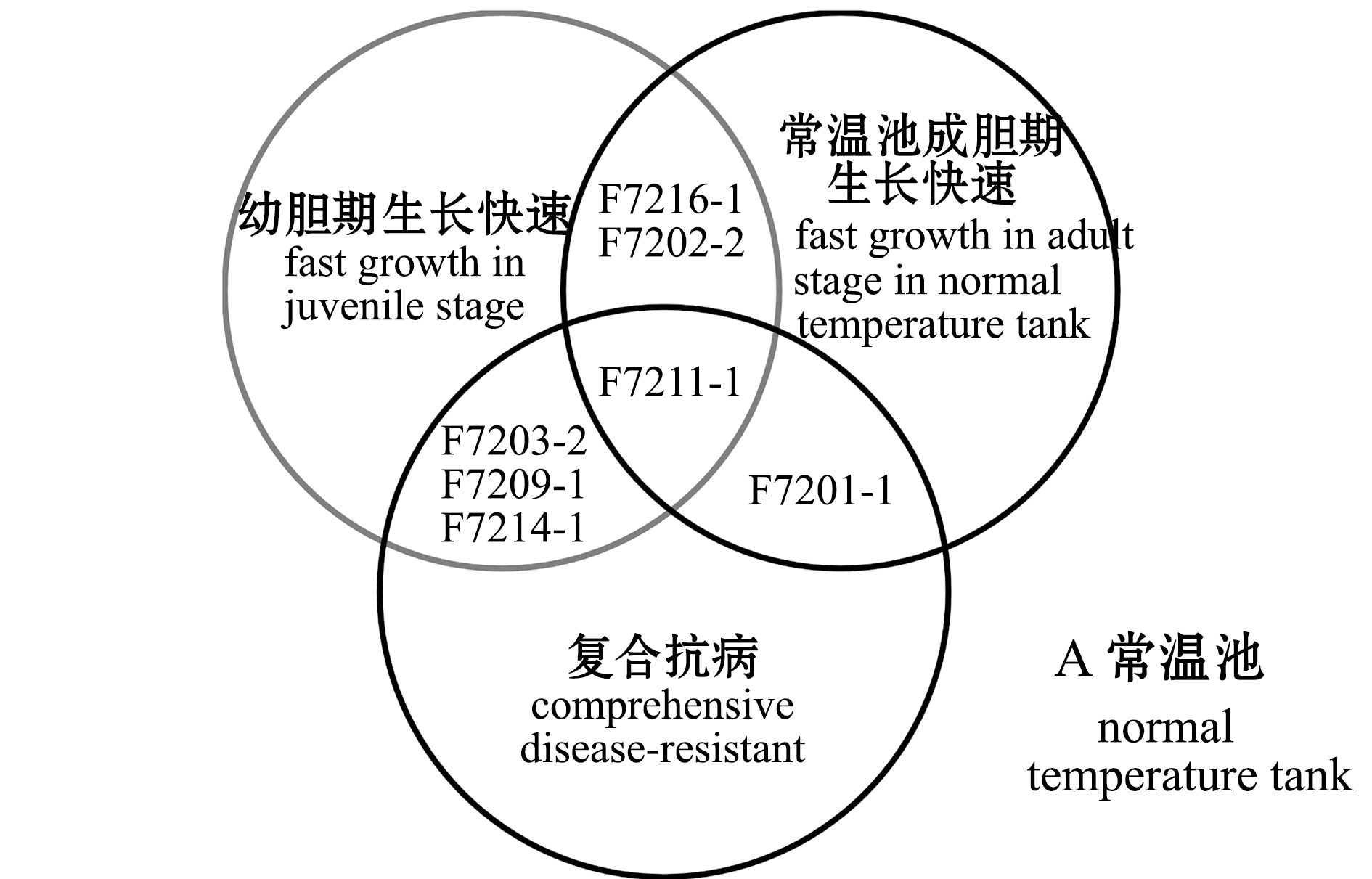
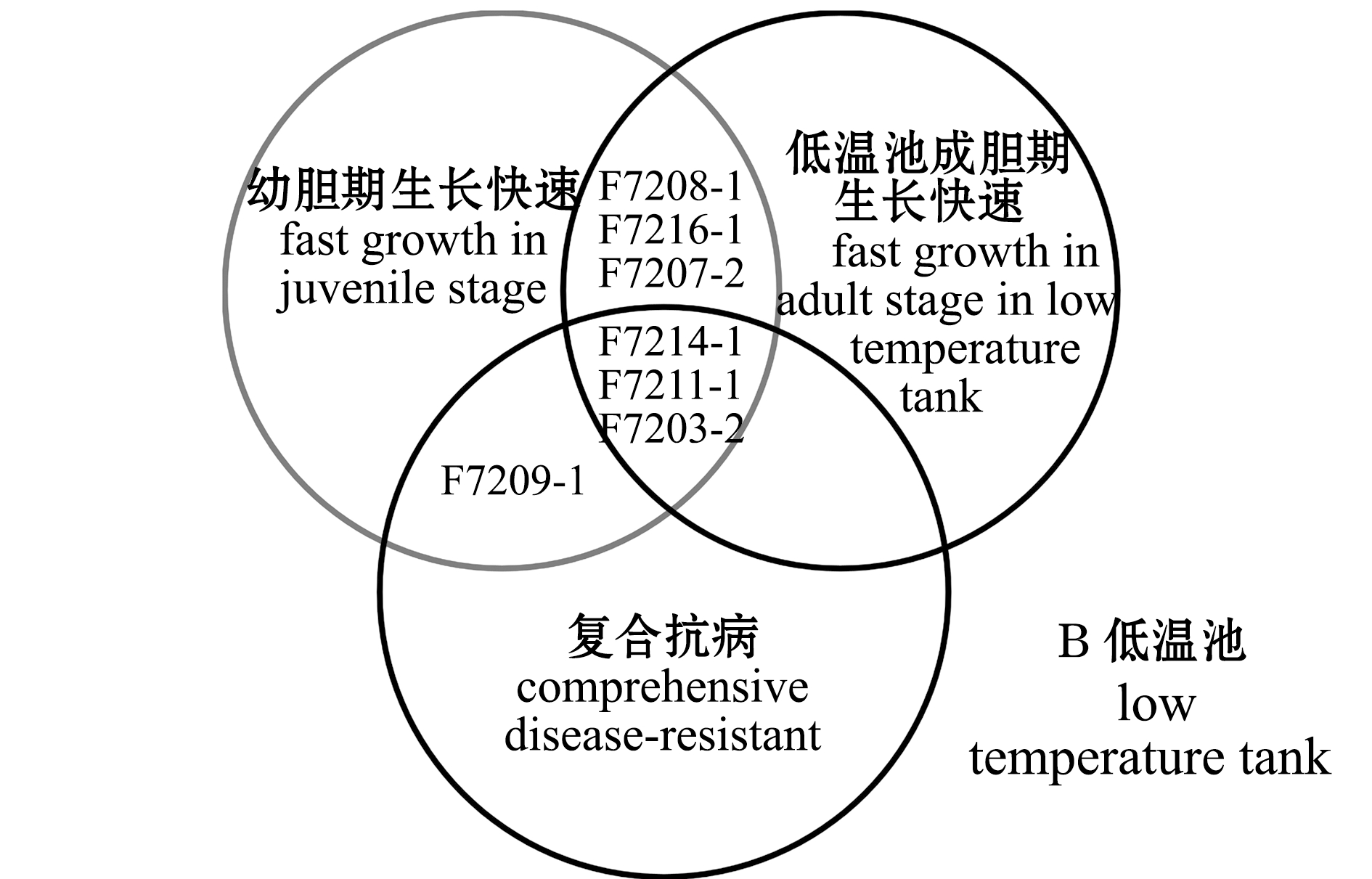
图5 抗病速生家系分布
Fig.5 Distribution of disease-resistant and fast-growing families
3 讨论
3.1 性状的表型及其选择依据
在3种疾病分别自然感染下,家系对海胆的成活率均具有极显著影响(表1),这说明中间球海胆家系间的抗病能力存在极显著性差异,相同的结论在大菱鲆[14]、牙鲆[15-16]、凡纳滨对虾[23]等水产动物中也有报道。由于家系间的差异在一定程度上代表了基因型的差异[24],因此可认为本研究中所选用的育种群体中存在抗病基因型,同时表明中间球海胆对此3种疾病的抗病性均具有一定的选育潜力。
从筛选出存活率较高的家系中可以看出(表2、图2),本研究中选用的家系群体中仅有1个家系F7217-2对3种疾病均具有较强的抗病力,其余家系大多仅对1~2种疾病具有抗病能力,这可能与3种疾病的致病原因不同有关,其中,病变综合征病因最为复杂,其病原菌可能有6种以上[8],并且发病季节为夏季,疾病的发生掺杂了高温因素;掉棘病是一种新发现的疾病,但病症明显,发病快且时间短,推测可能是由单一病原引起,该病也发生于夏季高水温期,疾病的发生同样掺杂了高温因素;黑嘴病病症明显,病原菌单一[4,7],其发病季节为春季,此时水温为中间球海胆的适宜温度,疾病的发生不掺杂高温因素。高温会使海胆的免疫水平大幅降低,在高温影响和病原感染下,抗病变综合征和抗掉棘病的家系应同时具有耐高温和抗细菌感染能力,而适温条件下抗黑嘴病的家系应具有更单纯的抗细菌感染能力。这一结果也表明,在对中间球海胆抗病家系进行选择时,若仅依据一种疾病感染下的存活率进行选择,仍可能会因感染其他疾病从而影响最终存活率,因此,抗病家系的选择应综合考虑家系对多种疾病的抵抗能力,至少要同时考虑对常见疾病如病变综合征和黑嘴病的抗病能力。需要指出的是,发生黑嘴病的家系群体是由经历了病变综合征或者掉棘病的存活个体组成,这些个体可能也对黑嘴病有较强的抵抗能力,在这种情况下,本研究中获得的抗黑嘴病的存活率可能会偏高,但家系间的排名应该不会受到大的影响。在实际养殖过程中,海胆确实要先在夏季经历病变综合征等疾病,后在春季经历黑嘴病,为更贴近真实的生产情况,选育符合生产实际需要的复合抗病品种,本研究中使用经历了病变综合征或者掉棘病的存活个体进行了黑嘴病感染试验。
在上述结果基础上,本研究中依据特定疾病的发病频率对各家系在该疾病感染下的存活率进行加权并求和构建了复合抗病指数。由于掉棘病为一种新发现的疾病,其发生可能具有相当大的偶然性,因此,其加权系数设定为0.15,由于病变综合征的发病频率略高于黑嘴病,将病变综合征的加权系数设定为0.5,黑嘴病的加权系数设定为0.35。通过复合抗病指数排名,筛选出的前5名复合抗病家系与依据特定疾病下存活率排名选择出的前5名家系不同(表3),但除F7201-1外,其余4个家系均来自依据特定疾病下存活率排名选择出的前5名家系,F7201-1入选是因为其同时具有抗病变综合征和黑嘴病(图2)。另外,同时抗3种疾病的家系F7217-2未入选,其复合抗病指数为0.726,位于第六名。综合以上结果,可认为复合抗病指数在抗病家系的选择中具有较高的参考价值。数量遗传学认为,选择反应为选择差和遗传力的乘积,因此,即使有足够的选择差,若抗病性状的遗传力为零也难以获得选择反应。水产动物的抗病性状遗传力往往为中低度遗传力[25-26],下一步将开展中间球海胆抗病性状的遗传力估计研究,结合本研究结果将会为中间球海胆的抗病育种提供重要参考。
3.2 抗病速生家系的筛选
对抗病家系的生长性能进行协方差分析均未获得具有显著差异的结果(图3、图4),然而以选育为目的,仍可以从选择差角度进行分析。利用特定疾病的存活率筛选抗病家系,其生长速度较群体平均值或高或低,且在不同环境下结果不同,而利用复合抗病指数筛选出的复合抗病家系,无论是在幼胆时期(图3)还是在不同环境下养殖的养成期(图4),均可相对于家系群体平均值获得正向的生长速度选择差,这表明利用复合抗病指数进行选择可实现对生长速度的间接选择,这进一步证明了复合抗病指数的优点。Chang等[21]研究表明,中间球海胆的耐高温能力与生长速度间不具有显著的相关性,而关于海胆抗病性状与生长速度的关系目前尚无报道。在其他水产动物中,抗病性状与生长速度几乎不相关、正相关或负相关[27-29]的结果均有报道。本研究中抗病家系具有较快的生长速度可能与这些家系免疫水平较高、能尽快消除病原,从而将更多能量用于生长有关,也可能是控制抗病性状与生长性状的基因间存在遗传连锁关系。
为实现对抗病和生长性状的复合选择,进一步选择出了抗病速生家系,5个复合抗病家系的生长速度全部或有4个排在幼胆期或成胆期前10名(图5),这表明选育中间球海胆抗病速生品系是可行的。中间球海胆的生长速度通常受到家系与环境交互作用的影响[18-19],但本研究中,养成期的水温环境对选择结果的影响较小,仅1个家系(F7201-1)在低温池未被选择,这说明对于利用复合抗病指数和特定生长率进行的复合选择来说,可不考虑环境与家系的交互作用,无论是在低温下还是常温下养成均可选择出抗病速生家系。
4 结论
本研究中对中间球海胆选育家系在自然感染病变综合征、掉棘病及黑嘴病下的存活率进行了比较,并通过对不同疾病下的存活率进行加权求和构建了复合抗病指数,根据存活率和抗病指数排名筛选出了抗病家系,认为相对于选择特定抗病家系,选择复合抗病家系会对幼胆期和不同水温养殖下的养成期的生长速度带来更稳定的正向选择差,家系F7211-1、F7203-2、F7209-1和F7214-1等家系均兼具抗病和速生的能力,可作为亲本用于下一代抗病速生家系的构建。
[1] 常亚青,丁君,宋坚,等.海参、海胆生物学研究与养殖[M].北京:海洋出版社,2004.
[2] 王子臣,常亚青.虾夷马粪海胆人工育苗的研究[J].中国水产科学,1997,4(1):60-67.
[3] Wang Yinan,Chang Yaqing,Lawrence J M.Disease in sea urchins[J].Developments in Aquaculture and Fisheries Science,2013,38:179-186.
[4] Tajima K,Takeuchi K,Iqbal M M,et al.Studies on a bacterial disease of sea urchin Strongylocentrotus intermedius occurring at low water temperatures[J].Fisheries Science,1998,64(6):918-920.
[5] Takeuchi K,Tajima K,Iqbal M M,et al.Taxonomical and serological studies on the causative bacteria of the disease of sea urchin Strongylocentrotus intermedius occurring at low water temperatures[J].Fisheries Science,1999,65(2):264-268.
[6] 王斌,李岩,李霞,等.中间球海胆“红斑病”病原弧菌致病机理的研究[J].大连水产学院学报,2005,20(1):11-15.
[7] 李太武,徐善良,王仁波,等.虾夷马粪海胆黑嘴病的初步研究[J].海洋科学,2000,24(3):41-43.
[8] Wang Yinan,Feng Nisha,Li Qiang,et al.Isolation and characterization of bacteria associated with a syndrome disease of sea urchin Strongylocentrotus intermedius in North China[J].Aquaculture Research,2013,44(5):691-700.
[9] Tajima K,Shimizu M,Miura K,et al.Seasonal fluctuations of Flexibacter sp.the causative bacterium of spotting disease of sea urchin Strongylocentrotus intermedius in the culturing facilities and coastal area[J].Fisheries Science,1998,64(1):6-9.
[10] Gjedrem T.Genetic improvement for the development of efficient global aquaculture:a personal opinion review[J].Aquaculture,2012,344-349:12-22.
[11] 田永胜,陈松林,徐田军,等.牙鲆不同家系生长性能比较及优良亲本选择[J].水产学报,2009,33(6):901-911.
[12] 张吕平,吴立峰,沈琪,等.凡纳滨对虾全同胞家系的建立及生长比较[J].水产学报,2009,33(6):932-939.
[13] 王俊杰,丁君,常亚青,等.虾夷扇贝家系早中期生长性状比较与遗传参数估计[J].水产学报,2014,38(9):1318-1325.
[14] 马爱军,郭建丽,王新安,等.大菱鲆选育家系抗鳗弧菌性能[J].中国水产科学,2014,21(3):484-493.
[15] 徐田军,陈松林,田永胜,等.牙鲆抗鳗弧菌病家系筛选及其分析[J].中国水产科学,2010,17(1):59-68.
[16] 陈松林,田永胜,徐田军,等.牙鲆抗病群体和家系的建立及其生长和抗病性能初步测定[J].水产学报,2008,32(5):665-673.
[17] 黄永春,艾华水,潘忠诚,等.凡纳滨对虾抗WSSV选育家系的建立及其抗病特性[J].水产学报,2013,37(3):359-366.
[18] 王海峰,赵帅,张伟杰,等.饵料、家系及二者交互作用对中间球海胆生长、摄食与变异的影响[J].中国水产科学,2015,22(6):1186-1194.
[19] Zhang Weijie,Zhao Chong,Chen Meng,et al.Family growth response to different laboratory culture environments shows genotype-environment interaction in the sea urchin Strongylocentrotus intermedius[J].Aquaculture Research,2013,44(11):1706-1714.
[20] Chang Yaqing,Zhang Weijie,Zhao Chong,et al.Estimates of heritabilities and genetic correlations for growth and gonad traits in the sea urchin Strongylocentrotus intermedius[J].Aquaculture Research,2012,43(2):271-280.
[21] Chang Yaqing,Tian Xiaofei,Zhang Weijie,et al.Family growth and survival response to two simulated water temperature environments in the sea urchin Strongylocentrotus intermedius[J].International Journal of Molecular Sciences,2016,17(9):1356.
[22] 韩奋杰,张伟杰,王中,等.中间球海胆与马粪海胆杂交后代幼胆期耐热性研究[J].大连海洋大学学报,2019,34(6):811-816.
[23] 黄永春,艾华水,殷志新,等.第四代凡纳滨对虾抗WSSV选育家系的抗病及免疫特性研究[J].水产学报,2010,34(10):1549-1558.
[24] Gjedrem T.Genetic improvement of cold-water fish species[J].Aquaculture Research,2000,31(1):25-33.
[25] 王炳谦,姜再胜,户国,等.虹鳟(Oncorhynchus mykiss)传染性造血器官坏死病(IHN)抗病力遗传参数估计及其抗病家系筛选[J].东北农业大学学报,2013,44(9):120-126.
[26] 郑卫卫,陈松林,李泽宇,等.牙鲆抗迟缓爱德华氏菌性状的遗传力和育种值分析[J].农业生物技术学报,2016,24(8):1181-1189.
[27] Yá ez J M,Bangera R,Lhorente J P,et al.Negative genetic correlation between resistance against Piscirickettsia salmonis and harvest weight in coho salmon(Oncorhynchus kisutch)[J].Aquaculture,2016,459:8-13.
ez J M,Bangera R,Lhorente J P,et al.Negative genetic correlation between resistance against Piscirickettsia salmonis and harvest weight in coho salmon(Oncorhynchus kisutch)[J].Aquaculture,2016,459:8-13.
[28] Xiong Xuemei,Chen Yulong,Liu Lifang,et al.Estimation of genetic parameters for resistance to Aeromonas hydrophila in blunt snout bream(Megalobrama amblycephala)[J].Aquaculture,2017,479:768-773.
[29] Liu Baosuo,Tan Caigang,Zhang Dongling,et al.Genetic parameters of growth and resistance to Polydora ciliata in the pearl oyster Pinctada fucata[J].Aquaculture Research,2017,48(5):2039-2046.