杂交育种作为传统育种方法可以显著提高后代经济性状。在杂交育种过程中,杂种优势的表现主要取决于杂交双亲,同种的不同群体, 基因频率差别越大, 遗传距离越远, 杂种优势就越大[1-2]。
杂交育种在长牡蛎Crassostrea gigas[3]、马氏珠母贝Pinctada martensii[4]、九孔鲍Haliotis diversicolor supertexta[5]、菲律宾蛤仔Ruditapes philippinarum[6]等海洋贝类中已有相关报道。Imai等[7]对长牡蛎育种研究表明,不同群体的牡蛎对不同环境的耐受力不同,杂交子代对环境的适应性优于双亲。王爱民等[8]对2个不同地理群体的马氏珠母贝间的双列杂交表明,杂种优势是杂合度和遗传多样性增加的直接原因。游伟伟等[9]对杂色鲍Haliotis diversicolor2个不同地理群体杂交研究表明,选择遗传基础不同的亲本进行杂交,可以使杂色鲍种质退化问题得以改善。高鑫等[6]、张跃环等[10]和Huo等[11]开展了菲律宾蛤仔(以下简称蛤仔)的2个壳色品系、壳型品系及家系间的双列杂交研究,指出蛤仔的杂种优势可能与杂交后代基因的显性、超显性和上位效应有关。
蛤仔中国莱州群体为壳宽型蛤仔,具有出肉率高、产卵量大的特点,而朝鲜新义州与丹东相邻可以认为是北方土著群体,开展两个不同地理群体蛤仔杂交,对培育具有优良性状、适合北方环境蛤仔优良品种具有重大意义。目前,关于蛤仔中国莱州群体与朝鲜新义州群体杂交育种尚无报道。本研究中开展了中国莱州和朝鲜新义州两个群体的双列杂交,旨在为菲律宾蛤仔的良种选育提供理论依据和基础材料。
1 材料与方法
1.1 材料
2018年6月分别从中国莱州、朝鲜新义州采集2龄野生蛤仔作为亲贝,暂养于辽宁丹东东港昱达水产有限公司的虾池中进行生态同步促熟。
1.2 方法
1.2.1 试验设计 2018年7月23日,将性腺成熟的亲贝移入室内,阴干后开始产卵排精。选取中国莱州群体(简称C)、朝鲜新义州群体(简称K)雌雄蛤仔按照表1的设计进行双列杂交,建立2个自繁群体C♀×C♂(简称CC)和K♀×K♂(简称KK)、1个正交群体C♀×K♂(简称CK)和1个反交群体K♀×C♂(简称KC),每组设置3个重复。将受精卵转入60 L大白桶内连续充气孵化,密度为5~6 ind./mL。
表1 2×2双列杂交试验设计
Tab.1 Design of 2×2 diallel cross in Manila clam

亲本parent中国莱州C♀朝鲜新义州K♀中国莱州C♂C♀×C♂K♀×C♂朝鲜新义州K♂C♀×K♂K♀×K♂
1.2.2 幼虫培育 幼虫期试验都在60 L的桶内进行,根据实际情况将幼虫密度设定为3~4 ind./mL,每个试验组设置3个重复。每隔一天进行全换水一次。每日根据幼虫摄食的实际情况进行投喂,试验前期投喂等鞭金藻,随着幼虫的生长逐渐改为角毛藻和小球藻等比例混合投喂。试验在全封闭的温室大棚中进行,试验过程中水温为24.8~36.4 ℃,试验期间恰逢辽宁省受到异常偏北的太平洋副热带高压影响,遭遇了罕见的高温天气,导致试验最高水温高于当地常规夏季水温, pH 为7.8~8.2,盐度为20~26。试验过程中要定期调整各试验组的密度。
1.2.3 稚贝培育 当稚贝30日龄时转入池塘进行中间育成,用80目网袋挂入池塘进行挂袋培养,水温为19.6~32.4 ℃,pH 为7.8~8.4,盐度为20~26。当稚贝70日龄时转入室内水泥池进行越冬。此时水温为30~8 ℃,盐度为28~30,pH为8.4~8.6。根据稚贝的大小定期更换网袋,并保持试验密度一致。
1.2.4 指标测定与计算
(1)受精率。单位体积内发生卵裂的受精卵数与卵子总数百分比。
(2)孵化率。单位体积内D形幼虫个数占受精卵总数的百分比。
(3)壳长、壳高。壳长、壳高小于3 mm时用显微镜目微尺进行测量,壳长、壳高大于3 mm时用游标卡尺进行测量,每次测量设3个重复,并对每个重复随机挑选30个存活的个体进行测量。
(4)存活率。测定3、15、30、45、70、90和120日龄时的存活率。3日龄和15日龄存活率为单位体积内不同日龄的幼虫密度与最初孵化D形幼虫密度的百分比。其他日龄稚贝存活率为存活稚贝数占各组合出现次生壳稚贝(包括死亡空壳)数的百分比。
(5)杂种优势。参考郑怀平等[12]和Cruz等[13]的方法,用下式计算杂种优势:
(1)
(2)
(3)
其中:CK、KC、CC、KK为各试验组的F1在同一日龄的表型值(生长、存活);H为双亲的杂种优势;HCK和HKC分别为正交组CK和反交组KC的单亲杂种优势。
(6)配合力。参照王卫军等[14]的方法,利用ASReml-R程序包, 使用限制性极大似然法和混合线性模型估算壳长、壳高的配合力, 混合线性模型选用亲本模型,模型如下:
yij = μ+Mi +Dj +MDij +eij。
(4)
其中:yij为第i 个父本与第j个母本杂交的壳长、壳高的观测值;μ为壳长、壳高的总平均值;Mi为母本效应;Dj为父本效应;MDij为杂交组合的效应;eij为随机误差效应。把μ设定为固定效应, 其他因子设定为随机效应,参考林元震等[15]编写的程序进行计算。
1.3 数据处理
利用SPSS 17.0软件对不同试验组间的数据进行单因素方差分析(One-way ANOVA),用Tukey进行多重比较,显著性水平设为0.05。
2 结果与分析
2.1 受精率、孵化率及D形幼虫
从表2可见:CK组受精率显著低于KK、CC、CK组(P<0.05),但KK、CC、CK之间无显著性差异(P>0.05);KC组孵化率显著低于其他3组(P<0.05),CC组孵化率显著高于其他3组(P<0.05)。
表2 各试验组受精率、孵化率及D形幼虫壳长
Tab.2 Fertilization rates, hatching rates and shell length of D larvae in the experimental groups
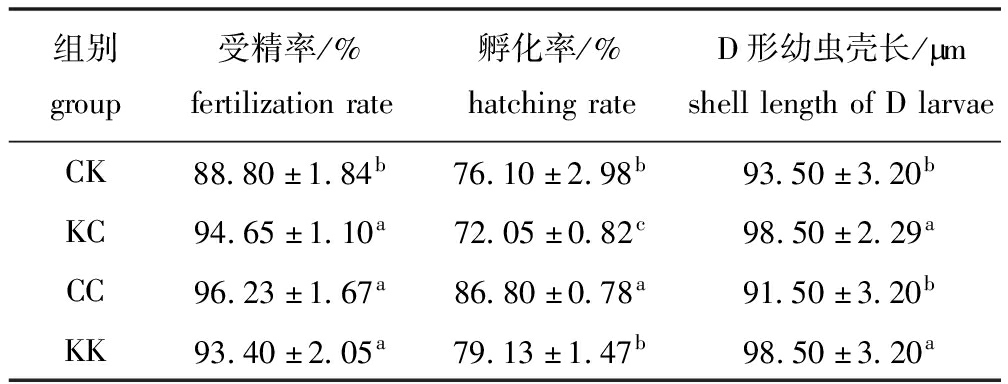
组别group受精率/%fertilizationrate孵化率/%hatchingrateD形幼虫壳长/BmshelllengthofDlarvaeCK88.80±1.84b76.10±2.98b93.50±3.20bKC94.65±1.10a72.05±0.82c98.50±2.29aCC96.23±1.67a86.80±0.78a91.50±3.20bKK93.40±2.05a79.13±1.47b98.50±3.20a
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
2.2 幼虫的存活及杂种优势
从表3可见:3日龄时,CC组幼虫存活率最高,为(97.30±2.07)%,KC组存活率最低,为(60.00±4.51)%,各组之间有显著性差异(P<0.05);15日龄时,CK组存活率最高,为(33.00±3.51)%,KC组存活率最低,为(13.40±4.45)%,CK与CC无显著性差异(P>0.05),二者均与KC和KK有显著性差异(P<0.05)。
表3 各试验组幼虫存活率及杂种优势
Tab.3 Survival rates and heterosis of larvae in the experimental groups

组别group不同日龄幼虫存活率/%survivalrateofvariousdaysoldlarvae3d15dCK90.00±1.35b33.00±3.51aKC60.00±4.51d13.40±4.45cCC97.30±2.07a30.40±3.91aKK85.40±2.45c23.20±2.33b组别group不同日龄幼虫存活杂种优势/%survivalheterosisofvariousdaysoldlarvae3d15dH-17.90-13.43HCK5.3942.24HKC-38.34-55.92
整个浮游期间,总体表现为杂种劣势,KC组均表现出负杂种优势,而CK在3日龄时表现出微弱的杂种优势(5.39),在15日龄时存活杂种优势(42.24)更加明显。
2.3 幼虫的生长及杂种优势
从表4可见:3日龄时,CK组幼虫壳长生长显著快于其余各组(P<0.05),其中,2个自交组间无显著性差异(P>0.05);6日龄时,CK组壳长显著快于其余组(P<0.05),其中,2个自交组之间也无显著性差异(P>0.05);9日龄时,CC、CK组壳长生长最快,而KC组壳长生长最慢且显著慢于其他3组(P<0.05);15日龄时,CC组壳长生长最快,壳长由大至小依次为CC>CK>KK>KC,各组之间有显著性差异(P<0.05)。
浮游幼虫期,壳长生长未表现出杂种优势。CK组仅在3日和6日龄时表现出微弱的杂种优势,而KC组在浮游幼虫期则一直为杂种劣势。
表4 各试验组幼虫壳长生长及杂种优势
Tab.4 Shell length and heterosis of larvae in the experimental groups

组别group不同日龄幼虫平均壳长/Bmaverageshelllengthofvariousdaysoldlarvae3d6d9d15dCK130.00±4.47a170.50±5.68a189.00±6.63a208.50±3.20bKC117.00±3.31c156.00±4.36c159.50±1.50c186.00±8.00dCC123.50±3.91b164.00±4.36b189.50±6.10a223.00±11.87aKK121.00±3.74b165.50±4.72b178.00±7.14b198.00±11.66c组别group不同日龄幼虫壳长杂种优势/%shelllengthofvariousdaysoldlarvae3d6d9d15dH1.02-0.91-5.17-6.29HCK5.263.96-0.26-6.50HKC-3.31-5.74-10.39-6.06
从表5可见:3日龄时,CK组壳高生长最快,KC组壳高生长最慢,2个自交组壳高介于中间且无显著性差异(P>0.05);6日龄时,CK组壳高生长最快,与KC组有显著性差异(P<0.05),但与2个自交组无显著性差异(P>0.05);9日龄时,CC组壳高生长最快,而KC组壳高生长最慢且显著慢于其他3组(P<0.05);15日龄时,CC组壳高生长最快,各组之间均有显著性差异(P<0.05)。
浮游幼虫期间,与壳长相同,壳高生长未表现出杂种优势。CK组仅在3日和6日龄表现了杂种优势,与壳长杂种优势情况相同,而KC组壳高的杂种优势也与壳长的趋势相同,在浮游期则一直表现为杂种劣势。
表5 各试验组幼虫壳高生长及杂种优势
Tab.5 Shell height and heterosis of larvae in the experimental groups

组别group不同日龄幼虫平均壳高/Bmaverageshellheightofvariousdaysoldlarvae3d6d9d15dCK119.00±3.00a147.00±6.00a167.00±6.40a197.50±4.03bKC92.50±3.35c138.50±3.20b145.50±1.51b168.00±7.48dCC104.00±4.90b144.00±8.00ab168.50±6.34a205.00±10.95aKK104.00±8.00b144.00±4.90ab162.50±6.42a181.50±14.15c组别group不同日龄幼虫壳高杂种优势/%shellheightofvariousdaysoldlarvae3d6d9d15dH1.68-0.87-5.59-5.43HCK14.422.08-0.89-3.66HKC-11.06-3.82-10.46-7.44
2.4 稚贝的存活及杂种优势
从表6可见:30日龄时,KC组的存活率最高,但与CK组、CC组无显著性差异(P>0.05),而KK组显著低于其余各组(P<0.05);45日龄时,KC组存活率最高且仅与KK组有显著性差异(P<0.05);70日龄时,KC组存活率最高,各组之间有显著性差异(P<0.05);90日龄时,KC组存活率最高,与其余组有显著性差异(P<0.05),KK组存活率最低,且与其余各组有显著性差异(P<0.05);120日龄时,KC组存活率最高且与其余各组有显著性差异(P<0.05),KK组存活率最低且与其余各组之间有显著性差异(P<0.05)。
表6 各试验组稚贝存活率及杂种优势
Tab.6 Survival rates and heterosis of juveniles in the experimental groups
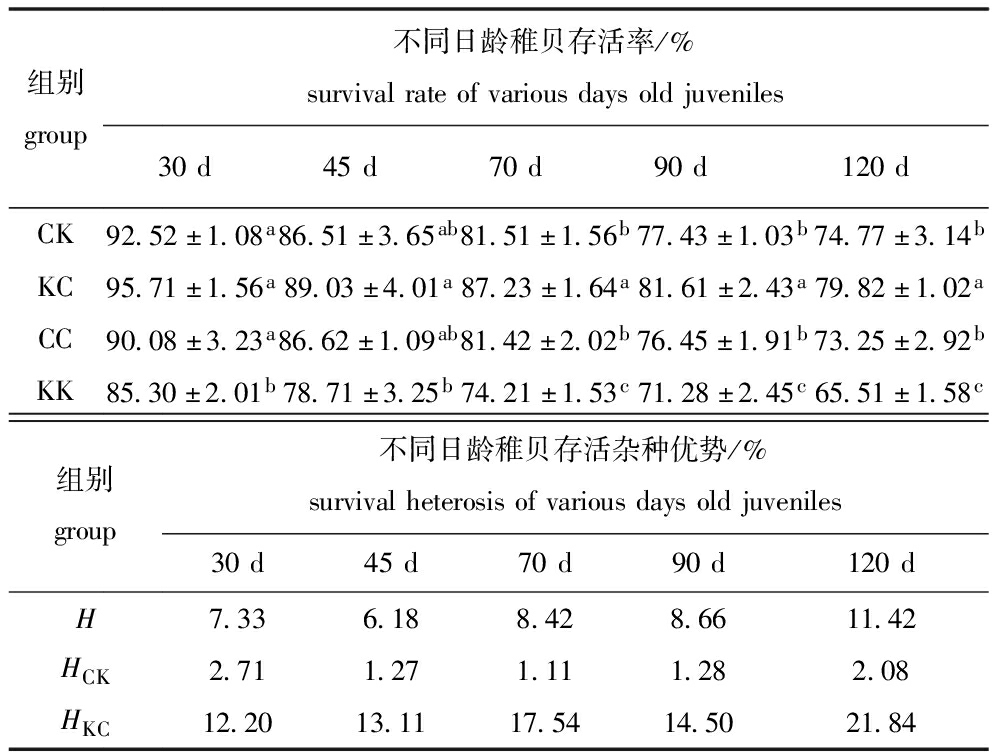
组别group不同日龄稚贝存活率/%survivalrateofvariousdaysoldjuveniles30d45d70d90d120dCK92.52±1.08a86.51±3.65ab81.51±1.56b77.43±1.03b74.77±3.14bKC95.71±1.56a89.03±4.01a87.23±1.64a81.61±2.43a79.82±1.02aCC90.08±3.23a86.62±1.09ab81.42±2.02b76.45±1.91b73.25±2.92bKK85.30±2.01b78.71±3.25b74.21±1.53c71.28±2.45c65.51±1.58c组别group不同日龄稚贝存活杂种优势/%survivalheterosisofvariousdaysoldjuveniles30d45d70d90d120dH7.336.188.428.6611.42HCK2.711.271.111.282.08HKC12.2013.1117.5414.5021.84
2.5 稚贝生长及杂种优势
从表7可见:30日龄时,CK组壳长生长最快且与其余组之间有显著性差异(P<0.05),KC组壳高生长最慢且与其余组有显著性差异(P<0.05);45日龄时,KC组壳长生长最快,但与CC组无显著性差异(P>0.05),KK组壳长生长最慢且显著慢于其他3组(P<0.05);90日龄时,CC组壳长生长最快(P<0.05),KK组生长最慢且显著慢于其余3组(P<0.05);120日龄时,CC组壳长生长最快,但与KC组、CK组无显著性差异(P>0.05),KK组壳长生长最慢且显著慢于其他3组(P<0.05)。
室内培育期间,KC组除30日龄外在壳长生长方面表现出了明显的杂种优势,而CK仅仅在30日龄时表现出杂种优势。这表明,杂交组在室内培育期间壳长生长表现出了杂种优势。
表7 各试验组稚贝壳长及杂种优势
Tab.7 Shell length and heterosis of juveniles in the experimental groups

组别group不同日龄稚贝平均壳长/mmaverageshelllengthofvariousdaysoldjuveniles30d45d90d120dCK0.83±0.13a1.44±0.72b5.39±1.83b5.45±1.55aKC0.50±0.08c1.83±0.65a5.31±2.22b5.87±2.04aCC0.70±0.19b1.82±0.51a5.89±1.63a6.34±1.08aKK0.66±0.07b1.14±0.76c3.26±1.06c3.82±1.42b组别group不同日龄稚贝壳长杂种优势/%heterosisinshelllengthofvariousdaysoldjuveniles30d45d90d120dH-1.8510.3816.9111.48HCK19.42-20.66-8.51-13.99HKC-24.2459.6762.7753.74
从表8可见:30日龄时,CK组壳高显著高于其他3组(P<0.05),KC组壳高生长最慢且显著慢于其余组(P<0.05);45、90、120日龄时,各组变化规律一致,CC组壳高生长均最快,但与KC、CK组无显著性差异(P>0.05),KK组生长显著低于其他3组(P<0.05)。
室内培育期间,KC组除30日龄外在壳长高生长方面表现出了明显的杂种优势,而CK组仅仅在30日龄时表现了杂种优势,其他日龄均为杂种劣势。这表明杂交组在室内培育期间总体上表现出了杂种优势。壳高杂种优势变化的趋势与壳长相一致。
表8 各试验组稚贝壳高及杂种优势
Tab.8 Shell height and heterosis of juveniles in the experimental groups

组别group不同日龄稚贝平均壳高/mmaverageshellheightofvariousdaysoldjuveniles30d45d90d120dCK0.71±0.02a1.26±0.61a3.84±1.30a4.09±1.27aKC0.42±0.06d1.46±0.49a3.87±1.50a4.29±1.59aCC0.60±0.17b1.55±0.41a4.31±1.08a4.65±0.71aKK0.52±0.09c1.02±0.62b2.91±1.06b2.80±0.94b组别group不同日龄稚贝壳高杂种优势/%heterosisinshellheightofvariousdaysoldjuveniles30d45d90d120dH0.456.146.6412.53HCK17.50-10.97-10.97-12.04HKC-19.4243.3832.7253.46
2.6 一般配合力(GCA)效应值和特殊配合力(SCA)效应值的比较
一般配合力主要由可遗传的加性效应基因影响,由于蛤仔早期阶段主要受到母本效应影响,因此,本研究中仅对45日龄、90日龄和120日龄壳长、壳高进行分析。从表9可见:蛤仔中国莱州群体无论父本和母本具有正向的一般配合力效应值, 而朝鲜新义州群体父本和母本均表现为负向的一般配合力效应值;所有的亲本一般配合力的绝对值均低于1。
表9 不同群体壳长、壳高的父母本一般配合力效应值
Tab.9 General combining ability effect values of parents with various shell length and shell height in different populations
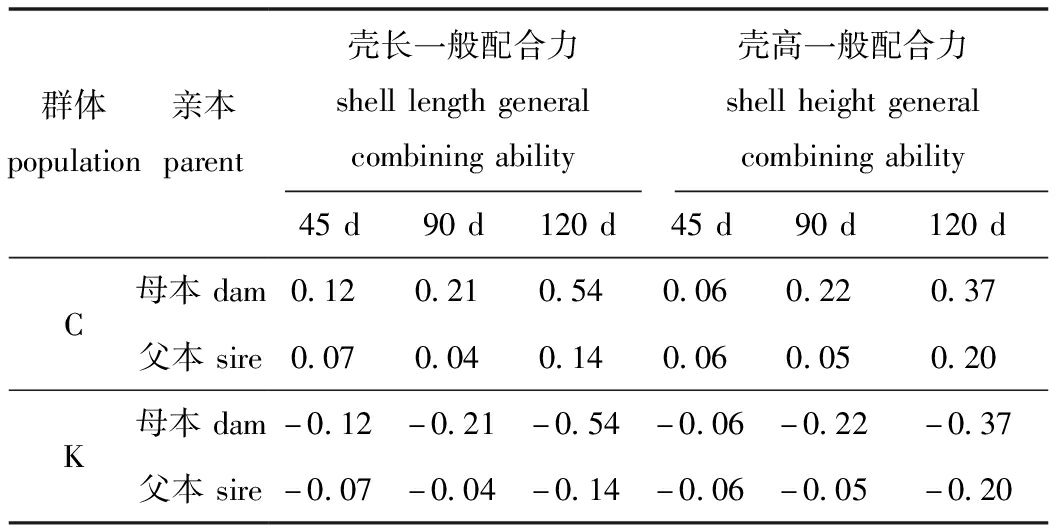
群体population亲本parent壳长一般配合力shelllengthgeneralcombiningability壳高一般配合力shellheightgeneralcombiningability45d90d120d45d90d120dC母本dam0.120.210.540.060.220.37父本sire0.070.040.140.060.050.20K母本dam-0.12-0.21-0.54-0.06-0.22-0.37父本sire-0.07-0.04-0.14-0.06-0.05-0.20
不同组合在不同日龄表现出不同的特殊配合力效应值(表10),45日龄时, 壳长、壳高的特殊配合力效应值均为CK>KC,此时C♀壳长、壳高的一般配合力比K♀大,效应值分别为0.12、0.06,而K♂一般配合力比C♂小,效应值分别为-0.07、-0.06。90日龄和120日龄时,壳长、壳高特殊配合力效应值均为KC>CK,此时K♀壳长、壳高一般配合力比C♀小,90日龄时壳长、壳高效应值分别为-0.21、-0.22,120日龄时壳长、壳高效应值分别为-0.54、-0.37;而C♂的一般配合力较K♂大,90日龄时壳长、壳高效应值分别为0.04、0.05,120日龄时壳长、壳高效应值分别为0.14、0.20。通过对比可见,一般配合力和特殊配合力在生长的不同阶段发挥着不同作用。
表10 不同交配组合壳长、壳高的特殊配合力效应值
Tab.10 Specific combining ability effect values of shell length and shell height in different mating combination

组别group壳长特殊配合力shelllengthspecialcombiningability壳高特殊配合力shellheightspecialcombiningability45d90d120d45d90d120dCK0.130.310.170.090.060.14KC0.110.320.330.080.110.20
3 讨论
3.1 生长发育比较
本试验中从孵化开始各组合便出现了一定的差异性,2个杂交组孵化率显著低于2个自交组。受精率和孵化率的高低不仅反映精卵的质量,还反映精卵之间的亲和度[10]。本试验用种贝在同一环境下促熟,但是受精率(除了KC的受精率)与孵化率均表现为劣势,说明这2个地理群体的蛤仔杂交可能存在配子间不亲和。D形幼虫以K为母本的组合大于以C为母本的组合。在显微镜下观察到,K♀的卵径约为70 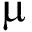 m,而C♀约为65
m,而C♀约为65 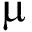 m,而具有相同母本的组合间的差异性不显著,说明1日龄D形幼虫的大小与其母本卵径大小有关。就生长而言,在幼虫期间以K为母本的组合长势缓慢尤其反交组KC,在稚贝期从45日龄开始壳长和壳高由大至小基本上为CC>KC>CK>KK。说明各组合在生态池中间育成期间在环境因素、基因显性能够稳定表达效应。就存活而言,幼虫期间以C为母本的组合存活率高于以K为母本的组合。而整个稚贝期,杂交组合在存活率大于自繁组,说明杂交提高了稚贝的存活率。
m,而具有相同母本的组合间的差异性不显著,说明1日龄D形幼虫的大小与其母本卵径大小有关。就生长而言,在幼虫期间以K为母本的组合长势缓慢尤其反交组KC,在稚贝期从45日龄开始壳长和壳高由大至小基本上为CC>KC>CK>KK。说明各组合在生态池中间育成期间在环境因素、基因显性能够稳定表达效应。就存活而言,幼虫期间以C为母本的组合存活率高于以K为母本的组合。而整个稚贝期,杂交组合在存活率大于自繁组,说明杂交提高了稚贝的存活率。
3.2 杂种优势分析
王亚馥等[16]、何文昭[17]认为,杂种优势是2个具有不同遗传背景的亲本杂交所得的F1代在生长、存活等方面可能出现均优于双亲或者双亲一方的现象。而本试验结果表明,反交组(KC)的子一代在稚贝期其生长速度优于 CK组、KK组,但是低于CC组。
试验中朝鲜群体蛤仔自繁组在稚贝期不同日龄时的存活率、生长优势均为最低,导致其结果的原因可能是在试验期间辽宁省持续高温天气,影响了朝鲜新义州群体和北方群体幼苗早期的生长发育,而以莱州群体为母本的组合却生长正常。说明莱州群体耐高温性状优于朝鲜新义州群体,这证明了中国莱州群体蛤仔与朝鲜新义州群体存在加性效应基因可以遗传给子代,且脱离母本效应后反交组杂种优势较大。张天时[18]认为,显性优良基因的互补作用增加了群体的杂合度,产生了杂种优势,从而抑制或者削弱了不利基因的作用,使得群体的显性效应和上位效应得以提高。本试验中,朝鲜新义州群体♀与中国莱州♂组合KC在幼虫期由于受到母本效应的影响导致生长缓慢,但是在45~120日龄期间KC组的存活率最高且最为稳定,其主要原因是在完成变态后母本效应消失,使得杂种优势开始得到稳定的表达,抑制了不良基因的作用,提高了群体的抗逆性。
3.3 配合力分析
可遗传的加性效应基因决定一般配合力,而不可遗传的显性效应基因和非等位基因的互作效应,决定着特殊配合力,一般配合力效应值代表亲本杂交后代平均表现的优劣,一般配合力效应值高的亲本才能产生性状优良的子代[19]。本研究中45~120日龄中国莱州群体的父母本壳长和壳高的一般配合力(GCA)效应值均为正值,而朝鲜新义州群体父母本的壳长和壳高一般配合力(GCA)均为负值,说明中国莱州群体作为亲本时更加容易将优良性状稳定遗传给子代。对一般配合力的研究可以选出具有优良性状子代的亲本,但是亲本的表型与杂交后代的表型并没有直接关系,往往会出现亲本表型很好但杂交子代表型不理想,表型不好的亲本反而会出现表型很好的杂交子代。在育种过程中,可以根据实际情况合理地将配合力作为一个标准对亲本进行评定[20-21]。一般配合力反映了亲本品种把性状传递给后代的能力,可以在品种之间进行比较,选择最佳亲本;特殊配合力反映了在特定交配策略下特定组合的杂种优势,据此可以选配最佳组合。本研究中随着母本效应影响的降低,90日龄后KC组合的K母本具有负向的壳长和壳高的一般配合力(GCA)效应值,C父本具有正向的壳长和壳高的一般配合力(GCA)效应值,此时壳长和壳高的特殊配合力(SCA)效应值为最高,说明以中国莱州群体为父本与朝鲜新义州群体为母本的交配策略最优。
4 结论
(1)中国莱州群体♀×朝鲜新义州♂在前30天表现出了较大的生长优势,而朝鲜新义州♀×中国莱州群体♂在45、90和120日龄时表现出较大的杂种优势,中国莱州群体自交组在除3、6、30日龄的都表现出了生长优势,可以在后续的试验中对其群体进行家系的建立使基因型纯化。朝鲜新义州群体自交组在15日龄后阶段均表现出生长、存活劣势,通过杂交可提高2个自交群体的存活率。
(2)中国莱州群体的一般配合力效应值高, 与其他北方群体进行杂交时可作为优良亲本进行群体组配。朝鲜新义州♀×中国莱州群体♂组合的特殊配合力效应值和生长、存活的杂种优势在45日龄后均较高,但是其在高温环境下幼虫期无论在生长、存活均表现出了劣势,可以在接下来的试验与浮游期表现良好的中国莱州群体自交组进行杂交改良。
[1] 刘小林,常亚青,相建海,等.栉孔扇贝不同种群杂交效果的研究:Ⅱ.中国种群和俄罗斯种群及其杂种F1中期生长发育[J].海洋学报,2005,27(2):135-140.
[2] 刘小林,常亚青,相建海,等.栉孔扇贝中国种群与日本种群杂交一代的中期生长发育[J].水产学报,2003,27(3):193-199.
[3] 王雪磊,李琪,孔令锋,等.壳金长牡蛎自交和杂交家系生长与存活比较[J].中国水产科学,2016,23(6):1358-1367.
[4] 方文珊.马氏珠母贝四种壳色遗传规律及壳色杂交家系生长特性研究[D].湛江:广东海洋大学,2013.
[5] 胡志国,刘建勇,包秀凤,等.九孔鲍双列杂交家系子代的杂种优势与配合力分析[J].南方水产科学,2014,10(1):43-49.
[6] 高鑫,闫喜武,张辉,等.蛤仔南北方养殖群体杂交子代早期生长发育的研究[J].大连海洋大学学报,2013,28(1):39-43.
[7] Imai T,Sakai S.Study of breeding of Japanese oyster,Crassostrea gigas[J].Tohoku Journal of Agricultural Research,1961,12(2):125-171.
[8] 王爱民,王嫣,顾志峰,等.马氏珠母贝(Pinctada martensii)2个地理群体杂交子代的杂种优势和遗传变异[J].海洋与湖沼,2010,40(1):140-147.
[9] 游伟伟,柯才焕,蔡明夷,等.杂色鲍日本群体与台湾群体杂交的初步研究[J].厦门大学学报:自然科学版,2005,44(5):701-705.
[10] 张跃环,闫喜武,姚托,等.菲律宾蛤仔2个壳色品系群体杂交的研究[J].南方水产,2008,4(3):27-32.
[11] Huo Zhongming,Yan Xiwu,Zhao Liqiang,et al.Larval and juvenile growth performance of Manila clam hybrids of two full-sib families[J].Journal of Ocean University of China,2015,14(3):564-568.
[12] 郑怀平,张国范,刘晓,等.海湾扇贝杂交家系与自交家系生长和存活的比较[J].水产学报,2004,28(3):267-272.
[13] Cruz P,Ibarra A M.Larval growth and survival of two catarina scallop(Argopecten circularis,Sowerby,1835)populations and their reciprocal crosses[J].Journal of Experimental Marine Biology and Ecology,1997,212(1):95-110.
[14] 王卫军,李琪,杨建敏,等.长牡蛎(Crassostrea gigas)三个选育群体完全双列杂交后代生长性状分析[J].海洋与湖沼,2015,46(3):628-635.
[15] 林元震,陈晓阳.R与ASReml-R统计分析教程[M].北京:中国林业出版社,2014.
[16] 王亚馥,戴灼华.遗传学[M].北京:高等教育出版社,1999.
[17] 何文昭.玉米产量和主要农艺性状杂种优势遗传分析[D].北京:中国农业科学院,2017.
[18] 张天时.中国对虾(Fenneropenaeus chinensis)育种的模型分析与遗传参数评估[D].青岛:中国海洋大学,2010:39-70.
[19] 邓岳文.皱纹盘鲍数量遗传与育种研究[D].青岛:中国科学院海洋研究所,2005.
[20] 刘来福,黄远樟.作物数量遗传学基础:四.配合力:完全双列杂交(上)[J].遗传,1979,1(6):45-47.
[21] 孙谦,段强,桑士田,等.菲律宾蛤仔选育家系间杂交的Kung育种值及配合力分析[J].大连海洋大学学报,2017,32(4):381-386.