刺参Apostichopus japonicus Selenka主要分布于35°N~44°N的西北太平洋沿岸[1-2]。刺参栖息于浅海,多在大型藻类着生岩礁附近爬行,以生物碎屑、微藻、各种细菌和原生动物等为食[3-4]。
刺参体色变化较大,背面一般为黄褐色或棕褐色,腹面为浅黄褐色,此外还有黄绿色、赤褐色和灰白色,而背腹体色均为白色的刺参被称为白刺参,背腹体色均为紫色的刺参被称为紫刺参,这两种刺参品系均为刺参的体色遗传变异,在自然条件下极为罕见。一般认为,刺参体色的深浅与生活环境有关,为了更好地保护自身,刺参的体色接近于周围的环境,这也是自然条件下白刺参、紫刺参稀少的原因。目前,白刺参已实现了规模化养殖,有学者已进行了初步研究。本研究团队收集的野生紫刺参亲本,并进行累代人工繁育,发现紫色这一体色特征可以稳定遗传。
光照是生物生长环境中不容忽视的生态因子,光照明显影响水生动物的趋光性、集群性和昼夜活动节律[5-6]。对于刺参而言,其生长存活的光照强度对其生长、行为有明显影响,且具有生长所需的最低和最适光照周期。自然条件下的刺参行为节律具明显光周期,光照较强时在阴影处栖息,弱光条件时爬行觅食[7],这是在长期进化过程中形成的对其生活环境的一种适应。目前,国内外学者对鱼类、甲壳类在光场中的反应已有较多研究[8-12],但有关光照对刺参特别是白刺参、紫刺参生长的影响报道较少。本试验在前期工作的基础上,研究了光照强度对白刺参、紫刺参及普通刺参幼参生长、消化酶活性、免疫酶活性的影响,以期对其健康养殖提供有益的数据资料。
1 材料与方法
1.1 材料
试验用刺参为山东东方海洋科技股份有限公司海参研究中心于2016年4月繁育的白刺参、青刺参和紫刺参,试验开始时各品系刺参初始体质量为白刺参(5.39±0.46)g、青刺参(5.36±0.51)g、紫刺参(5.29±0.37)g,各200头。试验阶段饲料为刺参配合饲料。
1.2 方法
1.2.1 试验设计 试验于2017年春季进行,周期为90 d,试验地点设在有暖气的钢结构玻璃阳光房内,刺参暂养在透明玻璃水缸中。试验设置4个光照强度组(5~10、25~50、1000、20 000 lx)和1个全黑对照组(0 lx),每组设4个平行,每个平行放10头白刺参、10头青刺参、10头紫刺参。其中,20 000 lx相当于养殖池塘(水深1.5 m)春季正午水底光照强度;1000 lx相当于围堰浅滩(水深3~5 m)春季正午水底光照强度;25~50 lx相当于春季正午养殖车间无附着基水体光照强度;5~10 lx相当于春季正午养殖车间附着基下水体光照强度;0 lx为全黑状态。光照强度通过调节养殖水槽与室内阳光距离及利用遮阳网来获得。白天光照周期为春季阳光周期,夜间无灯光照明,为自然状态。用水下照度计(美国LI-COR公司,型号LI-250A)测定光照强度。
1.2.2 试验管理 试验期间每天投饵一次,投饵量为刺参体质量的2%~3%,根据刺参的摄食情况适当调节投喂量。每天换水一次,日换水量为原水体的1/2,换水后投饵,每两天清理一次粪便及残饵。试验期间海水pH为7.8~8.1,养殖水温为14~16 ℃,盐度为28~30。
1.2.3 生长指标的测定与计算 刺参特定生长率(SGR,%/d)计算公式为
SGR=(ln W1-ln W2)/t×100%。
其中:W1为试验结束时刺参的体质量(每个平行刺参总质量)(g);W2为试验初始刺参的体质量(g);t为试验持续时间(d)。
1.2.4 免疫酶和消化酶活性的测定 在试验结束时,从每个平行取刺参1~2头,称取个体质量,用医用注射器抽取体腔液,在4 ℃下以3000 r/min冷冻离心15 min,取上清分装于1 mL的离心管中,-20 ℃下保存,用于测定免疫酶指标[13]。将抽取了体腔液的刺参置于冰盘上解剖并取出肠道,称重,转移至冻存管内并加入pH为 7.0的磷酸缓冲液(Na2HPO4-NaH2PO4),于-20 ℃下保存待测。
采用福林-酚试剂法和淀粉-碘显色法[14]测定刺参肠道内蛋白酶和淀粉酶活力。蛋白酶活力单位定义为:在pH 7.2和温度40 ℃条件下保温20 min,1 g刺参肠道1 min水解0.5%的酪蛋白产生1 g酪氨酸为1个蛋白酶活力单位。淀粉酶活力单位定义为:40 ℃条件下,30 min内100 mL酶液中的淀粉酶完全水解可溶性淀粉10 mg为1个淀粉酶活力单位。采用考马斯亮蓝G-250法测定样品的蛋白质浓度。使用南京建成生物技术公司相应试剂盒测定刺参肠道内碱性磷酸酶(AKP)、酸性磷酸酶(ACP)及体腔液中超氧化物歧化酶(SOD)活力。
1.3 数据处理
试验数值以平均值±标准差(mean±S.D.)表示,采用SPSS 19.0软件对试验结果进行单因素方差分析(ANOVA)和组间多重比较分析,显著性水平设为0.05。
2 结果与分析
2.1 不同光照强度下刺参生长指标的变化
从图1可见:光照强度显著影响刺参的特定生长率(P<0.05),随着光照强度由高至低变化,各品系刺参特定生长率呈现先升高后降低的趋势;强光(20 000 lx)不利于3个品系刺参的生长,尤其对白刺参影响更为明显(P<0.05);全黑状态亦不利于刺参生长,但对白刺参影响较小(P>0.05);青、紫品系刺参均在25~50 lx时表现出最大增长率,而白刺参特定生长率在5~10 lx时表现最大。
2.2 不同光照强度下刺参肠道消化酶活性的变化
从图2可见:光照强度对刺参肠道消化酶活性有显著性影响(P<0.05),随着光照强度从20 000 lx降至0,各品系刺参肠道蛋白酶和淀粉酶活性均呈先升高后降低的趋势;3个品系刺参均在25~50 lx光照强度时蛋白酶活性出现最大值,其中,青刺参蛋白酶活性最高;白、青刺参均在5~10 lx光照强度时淀粉酶活性出现最大值,紫刺参在25~50 lx光照强度时淀粉酶活性出现最大值;在所有光照强度试验组中,白刺参体内淀粉酶活力均较高,在5~10 lx即白刺参特定生长率最为明显的光照强度条件下,其淀粉酶活性显著高于青、紫刺参(P<0.05),而在每个光照强度条件下,白刺参肠道蛋白酶均低于同光照强度条件下青、紫刺参,这表明白刺参对蛋白质的需求不如青、紫刺参高,能够较多地利用淀粉类物质。

注:标有不同字母者表示同一光照强度下不同品系间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note: The means with different letters in same light intensity are significant differences in different group at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图1 不同光照强度对3个品系刺参特定生长率的影响
Fig.1 Effects of different light intensities on specific growth rates(SGR)of three strains of sea cucumber

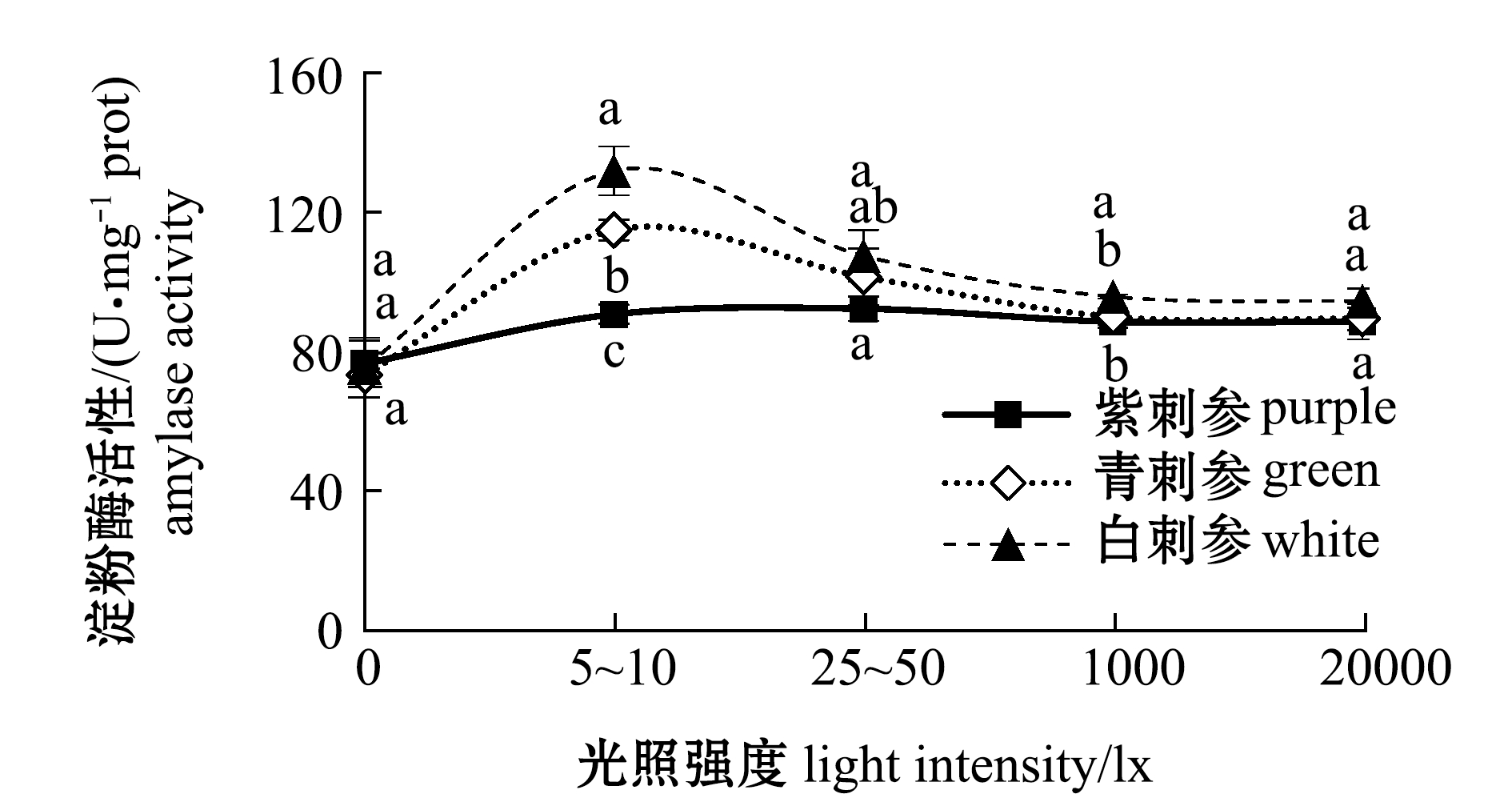
图2 不同光照强度对3个品系刺参肠道内蛋白酶和淀粉酶活性的影响
Fig.2 Effects of different light intensities on activities of protease in three strains of and amylase sea cucumber
2.3 不同光照强度下刺参肠道和体腔液中免疫酶活性的变化
从图3可见:随着光照强度由高至低变化,在青、紫刺参肠道中AKP和ACP活性呈先升高后降低的趋势;光照强度对不同品系刺参肠道内AKP和ACP的影响与对特定生长率的影响规律类似,青、紫刺参酶活力在25~50 lx光照强度下最大,白刺参在5~10 lx条件下酶活力最大;在不同光照强度下,3个品系刺参体腔液中SOD活性有所差异,在0 lx光照强度下,白刺参SOD活性显著高于青刺参(P<0.05),其他光照强度下3个品系刺参酶活力无显著性差异(P>0.05)。

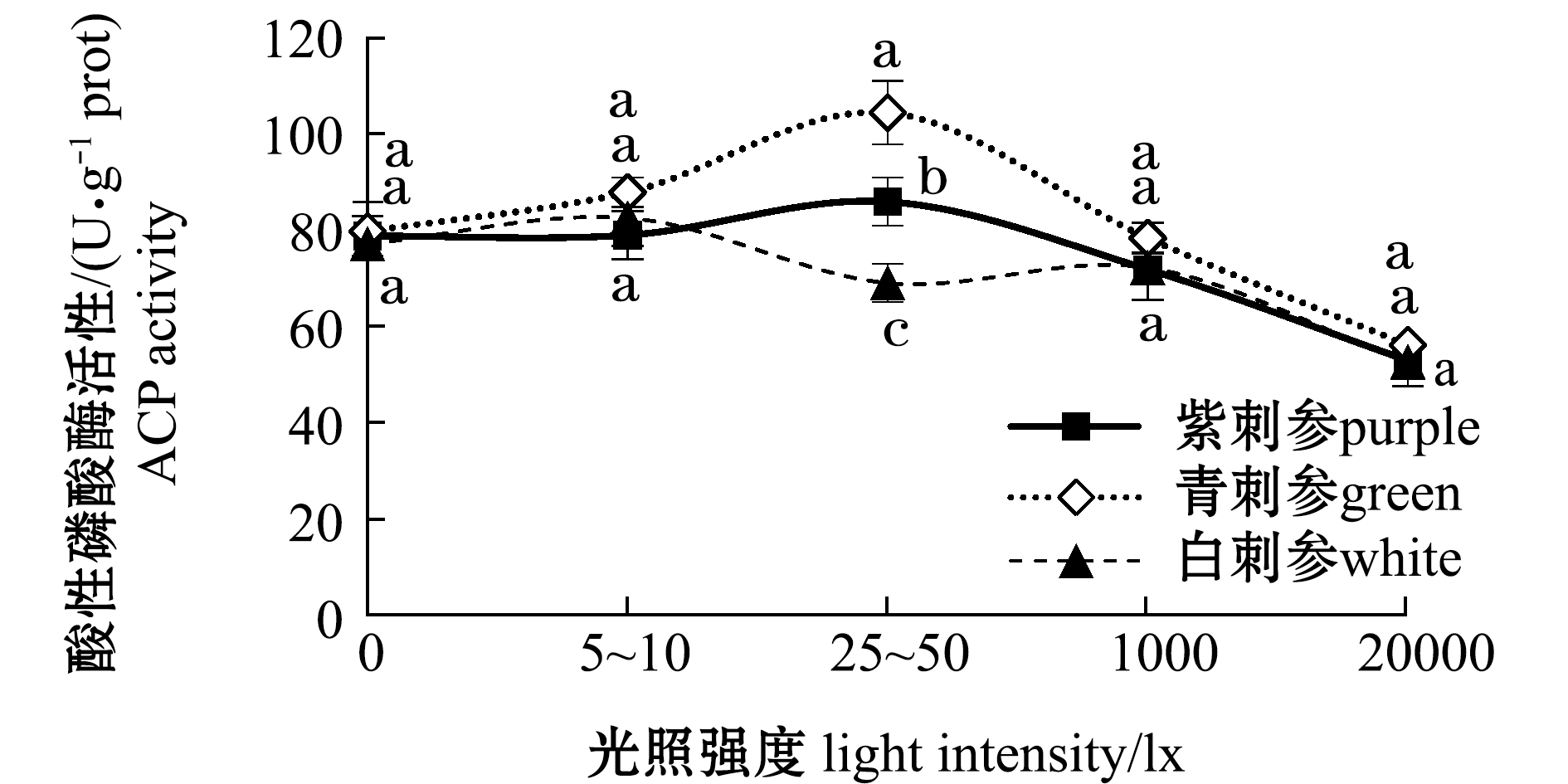
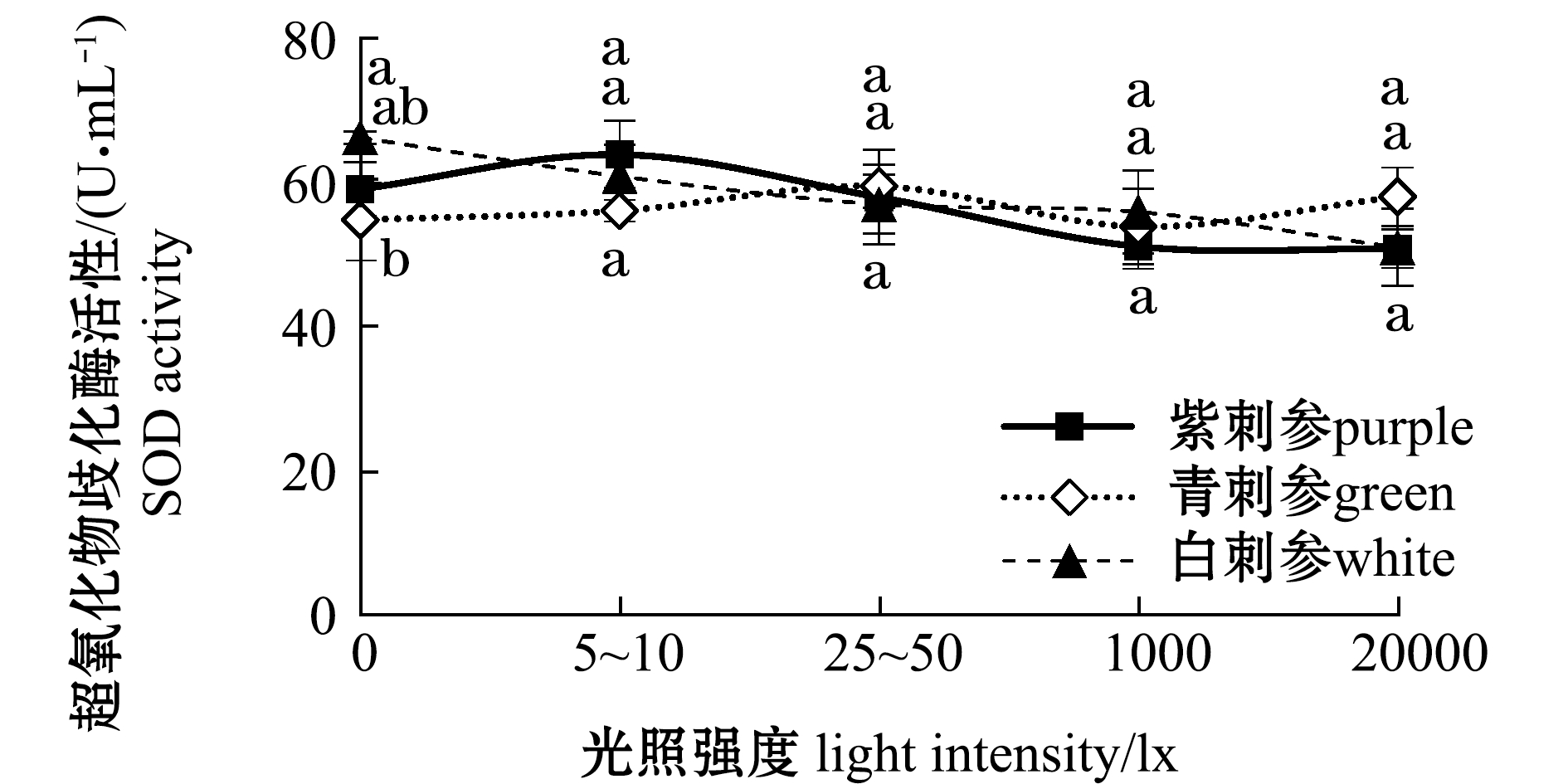
图3 不同光照强度对3个品系刺参肠道内AKP、ACP和体腔液中SOD活性的影响
Fig.3 Effects of different light intensities on activities of AKP and ACP in intestine and SOD in coelomic fluid of three strains of sea cucumber
3 讨论
3.1 光照强度对刺参行为特征的影响
在自然条件下,光照随季节及昼夜变化而变化。刺参在长期的进化过程中,对光照变化形成了一系列适应性特征。在车间、池塘和海区养殖条件下,研究光照对刺参生长和摄食的影响,找出适合其生长发育的光照条件,及时提供必要遮光掩体,对于加速刺参生长具有十分重要的意义。
光照能直接或间接影响水生生物的摄食、发育、生长和生存等[15-16]。目前,国外对刺参的研究主要包括幼参的种群结构、生长、发育、死亡等[17-19],国内则主要研究了刺参苗种培育、增殖技术及环境影响因子温度、盐度等[20-21]。其中,Olmsted[22]研究发现, 刺参通过其存在于肉刺和触手基部的感光点感知光照并做出反应。Millot[23]发现, 刺参利用散布于真皮上的感光点来感知光照。Mercier等[24]发现,糙海参Holothuria scabra Jaeger 在发育至五触手幼体阶段出现避光性, 在较强光照强度下喜欢栖息在底层附着物的阴影下。一些学者也研究了光照强度及光照周期对刺参的影响,发现两者都能直接影响刺参的生长和行为[25]。光也能够对水生动物的昼夜活动节律、迁移和集群行为产生影响。在长期的进化过程中, 海参受敌害攻击时能吐脏逃逸,或在白天躲避于狭小的缝隙内, 调整其昼夜节律以避开捕食者, 用以实现躲避敌害的目的[26]。张硕等[27]在研究光照强度对刺参的行为影响时发现,刺参在黑暗或者光照强度低的条件下频繁活动,基本不在人工礁模型上聚集;而在光照强度较高时,刺参会躲藏在人工礁模型阴影处栖息或附着在礁上。工厂化养殖的刺参无论在车间或者池塘,也出现同样的行为节律, 在黑暗或光照强度较低的条件下活动;而在强光下,刺参选择在附着基下栖息或在附着基内觅食。
3.2 光照强度对3个品系刺参生长的影响
研究表明,光照明显影响刺参的生长。Ramofafia等[28]研究指出,由于光照强度的减弱而引起微藻种类及数量减少时,会限制刺参的生长;薛素燕等[29]研究表明,强光照(2700~110 00 lx)下刺参生长较快;张鹏等[30]认为,光照强度可显著影响刺参的摄食、消化吸收食物效率,试验利用的不同光源和光照周期差异会影响附着在试验水槽壁的微藻的优势藻种类、生物量及其比例, 从而影响刺参的生长;陈勇等[31]认为,在全光照、全黑暗和自然光照条件下,相对于半光照半黑暗组,刺参的活动不频繁,差异也不大。本试验结果表明, 3个品系刺参在5~50 lx 下生长速度较快, 强光(200 00 lx)或全黑(0 lx)条件下生长速度显著减慢(图1), 在弱光照条件下,刺参活动频繁,摄食较强光或全黑旺盛。车间养殖刺参定期投喂,不存在光照引起藻类生长变化进而影响刺参生长的情况,但在池塘、围堰及海区底播增殖刺参,光照对刺参的生长应有明显影响,其不仅影响底栖硅藻的生长,在光照较强的春夏两季,也会引起大型有害藻类的生长,大型藻类死亡后,藻体腐烂变质、水体溶氧减少进而威胁刺参生长甚至生存。
3.3 光照强度对3个品系刺参消化酶活性的影响
消化酶是生物体内各种生化反应的催化剂,主要作用是消化和分解生物体从外界所摄取的食物,为其提供生长、发育、繁殖等所需的各种营养物质。虽然光照并不是影响刺参肠道消化酶活性的第一因素,但其可通过影响刺参摄食进而显著影响消化酶活力。魏子仲等[32]研究了光照强度对不同养殖方式下幼参生长和消化酶的影响,认为光照对刺参幼参的消化酶活性影响显著。本试验表明,蛋白酶活性基本上反映了青、紫刺参特定生长率大小的变化,在25~50 lx光照强度时,这两个品系刺参蛋白酶活力最高,与这两种刺参特定生长率最高一致,淀粉酶活性与特定生长率表现不一致,在5~10 lx时酶活力最高,原因可能是饵料中淀粉含量较低,并不是影响青、紫刺参生长的主要因素。而白刺参在5~10 lx时明显表现出淀粉酶活性较高,与其特定生长率最高表现一致,说明其饵料中淀粉需求较高,这也为工厂化养殖白刺参的饵料配方提供了新的思路。
3.4 光照强度对3个品系刺参免疫酶活性的影响
刺参属于无脊椎动物,它的免疫系统是非特异性的。巨噬细胞代表性的水解酶ACP,也是溶酶体的标志性酶,其诱导阿米巴细胞吞噬外来物质,形成包囊,在刺参免疫系统中起着调理素的作用[33]。前期工作中已经检测到了ACP活性[34-35]可作为机体免疫机能的重要指标。AKP在细胞膜上较为活跃,在体能细胞代谢过程中发挥着重要作用[8]。由于刺参在水中吸水,离水后吐水,对体腔液指标反复测定发现,刺参体内含水量对体腔液内各种免疫酶活性指标影响较大,而肠道内酶活性稳定,并且在刺参肠道中ACP、AKP活性较高,所以本试验中选择测定肠道免疫酶活性。本研究表明,光照对不同品系刺参肠道内ACP、AKP的影响与对特定生长率影响结果类似,青、紫刺参在25~50 lx光照强度时ACP、AKP酶活力最大,白刺参则在5~10 lx时酶活力最大,与3种刺参的特定生长率表现一致。SOD可清除生物体内的自由基、活性氧,可使细胞免受氧化伤害,同时也可预防机体衰老和生物分子损伤,有着极为重要的抗氧化作用。当生物体受到逆境胁迫时,肌体细胞会产生很多活性氧,如![]() 等,此时SOD活性升高,产生抗应激反应,从而提高机体的抗病力[36];而当受到重度逆境胁迫时,SOD活性通常降低,使机体积累过量的活性氧,导致生物体受伤害[37]。本试验中,在不同光照强度下,3个品系刺参体腔液SOD活性有所差异,在0 lx光照强度下,白刺参SOD活性显著高于青刺参和紫刺参。
等,此时SOD活性升高,产生抗应激反应,从而提高机体的抗病力[36];而当受到重度逆境胁迫时,SOD活性通常降低,使机体积累过量的活性氧,导致生物体受伤害[37]。本试验中,在不同光照强度下,3个品系刺参体腔液SOD活性有所差异,在0 lx光照强度下,白刺参SOD活性显著高于青刺参和紫刺参。
3.5 刺参体色变化的探讨
薛素燕等[29]研究认为,在弱光照条件下,刺参在试验结束后体色加深,其他光照组刺参体色变浅,并认为刺参体色的深浅与生活环境相关,体色深的刺参生活在光照强度较低的深水区,对较强的光照强度敏感,而体色浅的刺参生活在光照强度较高的浅水区,可耐受较强的光照强度;张硕等[27]研究认为,体色浅的刺参可以耐受较强的光照强度,而体色深的刺参遇到强光的照射会迅速避开。本试验中利用色度计比色发现,在较低光强下,试验组刺参体色在试验前后基本保持不变,在强光照条件下,紫刺参体色变淡(体色向普通刺参靠近),白刺参体色变深(略显淡黄、淡绿色)。通过对刺参体色变化跟踪测定表明,本试验条件下,白刺参、紫刺参在光照强度高的试验组中体色变化大于光照强度低的试验组。在自然海域及池塘养殖环境下,由于一年四季有强烈的光照,观察到随着时间及刺参年龄推移,部分紫刺参、白刺参体色向青刺参靠近,这也是自然环境中白刺参、紫刺参稀少的一个原因。在工厂化养殖系统中,车间养殖在光照强度方面控制较好,青刺参、紫刺参体色变化不大,白刺参体色对光照更为敏感。
4 结论
本研究团队已经初步建立了白刺参、青刺参及紫刺参种质资源库,并探索出了一套稳健的3个品系刺参种参培育和苗种繁育技术方法,并在此基础上,进行了模拟海区、池塘和车间条件下光照对3个品系刺参生长影响试验,结果显示,光照强度能够显著影响刺参生长,强光或全黑暗均不利于刺参生长,青刺参及紫刺参最适宜光照强度为25~50 lx,白刺参最适宜光照强度为5~10 lx。下一阶段的工作中将积极进行3个品系刺参基础生物学及其体成分的研究,为刺参良种培育提供参考数据。
[1] 廖玉麟.中国动物志:棘皮动物门 海参纲[M].北京:科学出版社,1997.
[2] Sloan N A.Echinoderm fisheries of the world:a review[C]//Proceedings of the 5th International Echinoderm Conference.Rotterdam,Netherlands:Balkema Publishers,1984:109-124.
[3] Choe S.Study of Sea Cucumber:Morphology,Ecology and Propagation of Sea Cucumber[M].Tokyo:Kaibundo,1963.
[4] Yingst J Y.The utilization of organic matter in shallow marine sediments by an epibenthic deposit-feeding holothurian[J].Journal of Experimental Marine Biology and Ecology,1976,23(1):55-69.
[5] 赵文.养殖水域生态学[M].北京:中国农业出版社,2011.
[6] 赵文.刺参池塘养殖生态学及健康养殖理论[M].北京:科学出版社,2009.
[7] 周显青,牛翠娟,李庆芬.光照对水生动物行为的影响[J].动物学杂志,1999,34(2):45-48.
[8] 郭柏福,袁涛,石小涛,等.中华鲟子二代仔鱼对光照强度的趋性行为[J].中国水产科学,2013,20(6):1204-1211.
[9] Wurts W A,Stickney R R.An hypothesis on the light requirements for spawning penaeid shrimp,with emphasis on Penaeus setiferus[J].Aquaculture,1984,41(2):93-98.
[10] Primavera J H,Caballero R M V.Light color and ovarian maturation in unablated and ablated giant tiger prawn Penaeus monodon(Fabricius)[J].Aquaculture,1992,108(3-4):247-256.
[11] Moller T H,Naylor E.Environmental influence on locomotor activity in Nephrops norvegicus(Crustacea:Decapoda)[J].Journal of the Marine Biological Association of the United Kingdom,1980,60(1):103-113.
[12] Wang Fang,Dong Shunaglin,Huang Guoqiang,et al.The effect of light color on the growth of Chinese shrimp Fenneropenaeus chinensis[J].Aquaculture,2003,228(1-4):351-360.
[13] 刘佳亮,王琳超,曹学彬,等.饲料中添加盐酸甜菜碱对刺参幼参生长、消化酶活力和免疫力的影响[J].大连海洋大学学报,2018,33(5):570-575.
[14] 郝佳,吴英茜,刘晗奇,等.几种微生态制剂对刺参幼参生长、存活和消化酶活性的影响[J].大连海洋大学学报,2015,30(3):248-252.
[15] Dong Guancang,Dong Shuanglin,Tian Xiangli,et al.Effects of photoperiod on daily activity rhythm of juvenile sea cucumber,Apostichopus japonicus(Selenka)[J].Chinese Journal of Oceanology and Limnology,2011,29(5):1015-1022.
[16] Wang Fang,Dong Shuanglin,Huang Guoqiang,et al.The effect of light intensity on the growth of Chinese shrimp Fenneropenaeus chinensis[J].Aquaculture,2004,234(1-4):475-483.
[17] Hamel J F,Mercier A.Early development,settlement,growth,and spatial distribution of the sea cucumber Cucumaria frondosa(Echinodermata:Holothuroidea)[J].Canadian Journal of Fisheries and Aquatic Sciences,1996,53(2):253-271.
[18] Battaglene S C,Seymour J E,Ramofafia C.Survival and growth of cultured juvenile sea cucumbers,Holothuria scabra[J].Aquaculture,1999,178(3-4):293-322.
[19] Wiedemeyer W L.Biology of small juveniles of the tropical holothurian Actinopyga echinites:growth,mortality,and habitat preferences[J].Marine Biology,1994,120(1):81-93.
[20] 李宝泉,杨红生,张涛,等.温度和体重对刺参呼吸和排泄的影响[J].海洋与湖沼,2002,33(2):182-187.
[21] 袁秀堂,杨红生,周毅,等.盐度对刺参(Apostichopus japonicus)呼吸和排泄的影响[J].海洋与湖沼,2006,37(4):348-354.
[22] Olmsted J M D.The comparative physiology of Synaptula hydriformis(Lesueur)[J].Journal of Experimental Zoology,2005,24(2):333-379.
[23] Millot N.La Photosensibilité des animaux dépourvus d’yeux[J].Endeavour,1957,16:19-28.
[24] Mercier A,Battaglene S C,Hamel J S.Settlement preferences and early migration of the tropical sea cucumber Holothuria scabra[J].Journal of Experimental Marine Biology and Ecology,2000,249(1):89-110.
[25] 隋佳佳,董双林,田相利,等.光谱和体重对刺参耗氧率和排氨率的影响[J].中国海洋大学学报,2010,40(3):61-64.
[26] 薛素燕.养殖刺参(Apostichopus japonicus)的生态习性及代谢生理的初步研究[D].青岛:中国海洋大学,2007.
[27] 张硕,陈勇,孙满昌.光强对刺参行为特性和人工礁模型集参效果的影响[J].中国水产科学,2006,13(1):20-27.
[28] Ramofafia C,Foyle T P,Bell J D.Growth of juvenile Actinopyga mauritiana(Holothuroidea)in captivity[J].Aquaculture,1997,152(1-2):119-128.
[29] 薛素燕,方建光,毛玉泽,等.不同光照强度对刺参幼参生长的影响[J].海洋水产研究,2007,28(6):13-18.
[30] 张鹏,董双林.光照强度对青色系与红色系仿刺参生长与能量分配的影响[J].中国水产科学,2013,20(4):778-784.
[31] 陈勇,高峰,刘国山,等.温度、盐度和光照周期对刺参生长及行为的影响[J].水产学报,2007,31(5):687-691.
[32] 魏子仲,赵文.光照强度对不同养殖方式下刺参幼参生长和消化酶活性的影响[J].应用生态学报,2014,25(1):237-242.
[33] Bertheussen K.Receptors for complement on echinoid phagocytes.Ⅱ.Purified human complement mediates echinoid phagocytosis[J].Developmental and Comparative Immunology,1982,6(4):635-642.
[34] Dybas L,Fankboner P V.Holothurian survival strategies:mechanisms for the maintenance of a bacteriostatic environment in the coelomic cavity of the sea cucumber,Parastichopus californicus[J].Developmental & Comparative Immunology,1986,10(3):311-330.
[35] Canicatti C.Lysosomal enzyme pattern in Holothuria polii coelomocytes[J].Journal of Invertebrate Pathology,1990,56(1):70-74.
[36] Coteur G,Warnau M,Jangoux M,et al.Reactive oxygen species(ROS)production by amoebocytes of Asterias rubens(Echinodermata)[J].Fish & Shellfish Immunology,2002,12(3):187-200.
[37] Fang Yunzhong,Yang Sheng,Wu Guoyao.Free radicals,antioxidants,and nutrition[J].Nutrition,2002,18(10):872-879.