红鳍东方鲀Takifugu rubripes隶属于鲀形目Telraodontiformes鲀科Teraodontoidae东方鲀属Takifugu[1],是目前水产养殖的主要品种之一。在红鳍东方鲀养殖类生产过程中,寄生虫、细菌、病毒会对其造成危害[2]。之前主要通过化学药物和抗生素来对抗鱼类疾病,但是过多地使用化学药品会出现鱼体耐药性、污染环境等问题[3]。因此,在养殖中通过向饲料中添加新型免疫添加剂来预防鱼类疾病的方法已成为人们研究的热点。
壳聚糖(Chitosan, CS),是几丁质脱乙酰基后得到的产物,存在于虾、蟹、昆虫等的外壳及真菌细胞壁中[4],其代谢产物无毒、可生物降解,具有抗微生物等活性[5]。近年来研究表明,壳聚糖作为饲料添加剂能有效提高水产动物免疫力[6-8]。但壳聚糖分子量大,不易吸收。壳寡糖(Chitosan oligosaccharide,COS)在水产中的研究报道效果好[9],但成本高。纳米化的饲料或饲料添加剂,由于粒径小,有利于在消化道滞留,延长肠壁接触时间易于被吸收,能大大提高饲料的生物利用率[10-11],且成本低。本项目组引入纳米技术制备纳米级壳聚糖用于水产养殖动物饲料添加剂,对于水产养殖业是一项技术性及概念性的革新之举,意义重大。本研究中,以红鳍东方鲀幼鱼为研究对象,考察了壳聚糖纳米颗粒对鲀幼鱼生长及免疫指标的影响,旨在为壳聚糖纳米颗粒作为水产饲料添加剂提供参考。
1 材料与方法
1.1 材料
试验用红鳍东方鲀幼鱼购自大连天正实业有限公司,初始体质量为(9.910±0.306)g,体长为(6.577±0.437)cm。
1.2 方法
1.2.1 试验饲料的配制 试验用基础饲料为颗粒饲料,购自大连天正实业有限公司,其营养成分见表1。壳聚糖购于阿拉丁公司,脱乙酰度>95%,黏度为100~200 mPa·s。壳寡糖由中科院大连化学物理研究所天然产物及糖工程研究组提供,聚合度为2~10,脱乙酰度>95%,平均相对分子质量<1500。壳聚糖纳米颗粒:溶液A为壳聚糖与1%醋酸的混合液,溶液B为三聚磷酸钠溶液,将溶液A与B逐滴混匀,以3000 r/min离心,去除沉淀保留上清液[12]。壳聚糖纳米颗粒平均粒径为460 nm,平均浓度为0.19%。将0.2%的壳寡糖、0.2%的壳聚糖,以及0.2%、0.1%、0.02%的壳聚糖纳米颗粒添加到基础饲料中,另设一组不添加任何免疫添加剂的基础饲料为对照,配制成6种红鳍东方鲀试验饲料,饲料现用现配。
表1 基础饲料营养成分
Tab.1 Nutritional content of basic diet
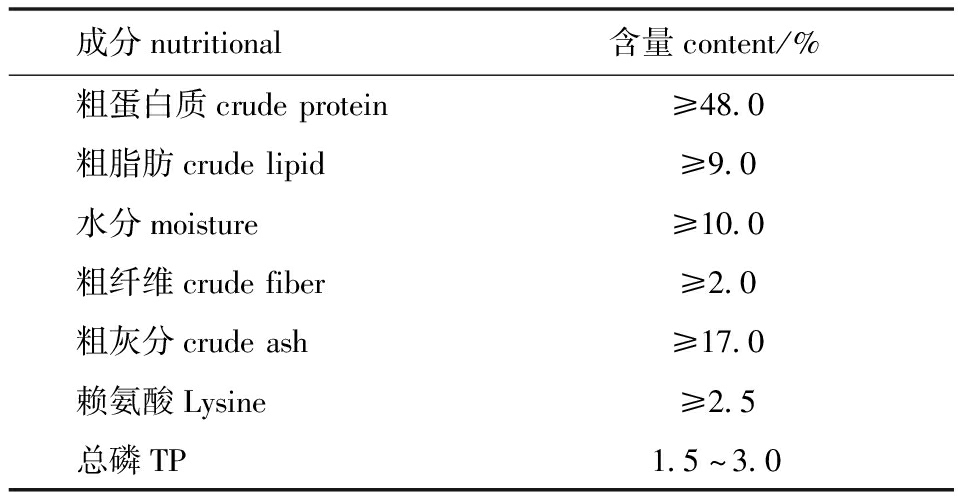
成分nutritional含量content/%粗蛋白质crudeprotein粗脂肪crudelipid水分moisture粗纤维crudefiber粗灰分crudeash赖氨酸Lysine总磷TP≥48.0≥9.0≥10.0≥2.0≥17.0≥2.51.5^3.0
1.2.2 试验设计及饲养管理 将540尾红鳍东方鲀随机分成6组,每组设3个平行,每个平行放30尾鱼,于大连天正实业有限公司大黑石养殖场中暂养1周后开始正式试验。用6种试验饲料投喂试验鱼,分别记为空白对照组、0.2%壳寡糖组(0.2%COS组)、0.2%壳聚糖组(0.2%CS组)、0.2%壳聚糖纳米颗粒组(0.2%CN组)、0.1%壳聚糖纳米颗粒组(0.1%CN组)和0.02%壳聚糖纳米颗粒组(0.02%CN组),每日投喂5次,饱食投喂,早晚各清底1次,水温控制在17~23 ℃,pH为7.5~8.0,24 h连续充氧,试验周期为50 d。
1.2.3 样品采集 试验结束后,称量各组中全部红鳍东方鲀的体质量并记录,计算其特定生长率(SGR,%/d):
SGR=100%×(ln 终末体质量-ln初始体质量)/试验时间。
从每组随机选取6尾红鳍东方鲀幼鱼作为测定混合样本,分别取鱼体的肝脏、肾脏和脾脏组织于液氮中速冻后存放于-80 ℃冰箱中保存备用。一部分用于检测不同组织中的酶活性,另一部用于RNA的提取。
1.2.4 酶活性测定 在检测酶活性之前,分别取出0.5 mg肝脏、肾脏、脾脏组织,加入4.5 mL的生理盐水,研磨,4 ℃下以3000 r/min离心15 min。取上清分别测定超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、溶菌酶(LZM)的活性,试验步骤严格按照南京建成生物工程研究所的试剂盒说明书进行。每个样品分3个平行进行测定。
1.2.5 总 RNA的提取及反转录 试验步骤严格按照莫纳生物科技有限公司的RNA提取试剂说明书进行。提取红鳍东方鲀不同组织中的总RNA,并取3 μL使用10 g/L琼脂糖凝胶电泳检测RNA的完整性,取1 μL用于RNA纯度和浓度的检测。OD260 nm/OD280 nm 值在 1.9~2.1 之间的 RNA 可继续按照莫纳生物科技有限公司的MonScriptTM RTIII aII-in-one Mix(with dsDNase)说明书进行反转录合成cDNA,扩增产物使用 10 g/L琼脂糖凝胶电泳检测结果,并于-20 ℃下保存。
1.2.6 实时荧光定量PCR 选取β-actin作为内参基因,以hsp70、ifr2、tlr3、c3作为目的基因,引物由生工生物工程(上海)股份有限公司合成(表2)。试验步骤根据莫纳生物科技有限公司的实时荧光定量PCR说明书进行,最后用2-△△CT法来计算4个基因的相对表达量[13]。每个样品分3个平行进行测定。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示,使用SPSS 24.0软件进行单因素方差分析,用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果
2.1 不同添加剂组红鳍东方鲀的生长性能
从表3可见:壳寡糖和壳聚糖纳米颗粒对红鳍东方鲀幼鱼生长有显著性影响(P<0.05);饲料中添加0.2%壳寡糖、0.2%壳聚糖纳米颗粒、0.02%壳聚糖纳米颗粒的试验组幼鱼终末体质量和特定生长率与对照组相比均有显著升高(P<0.05);各添加剂组中,0.2%壳聚糖纳米颗粒组的促生长效果最好,显著好于壳聚糖组和壳寡糖组(P<0.05)。
表2 实时荧光定量PCR引物
Tab.2 Sequences of primers for real-time PCR
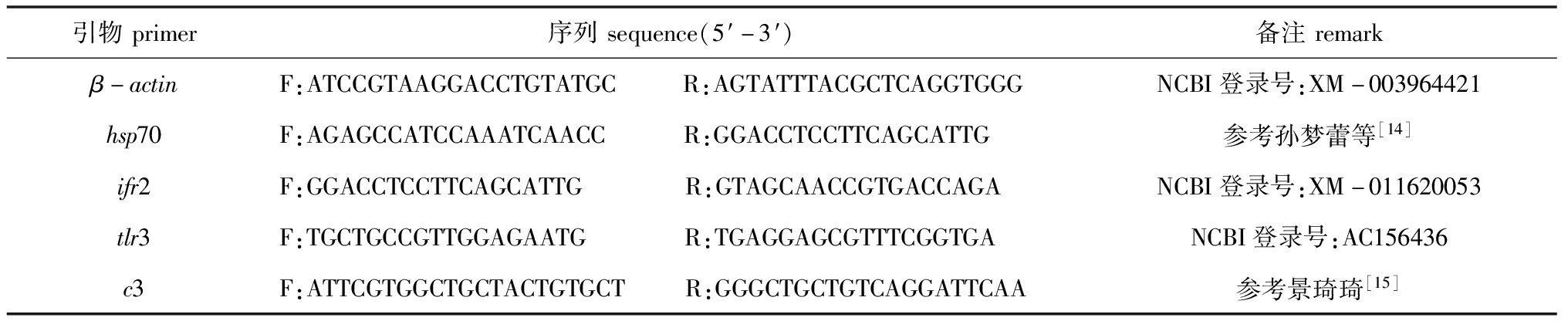
引物primer序列sequence(5′-3′)备注remarkβ-actinF:ATCCGTAAGGACCTGTATGC R:AGTATTTACGCTCAGGTGGGNCBI登录号:XM-003964421hsp70F:AGAGCCATCCAAATCAACC R:GGACCTCCTTCAGCATTG参考孙梦蕾等[14]ifr2F:GGACCTCCTTCAGCATTG R:GTAGCAACCGTGACCAGANCBI登录号:XM-011620053tlr3F:TGCTGCCGTTGGAGAATG R:TGAGGAGCGTTTCGGTGANCBI登录号:AC156436c3F:ATTCGTGGCTGCTACTGTGCT R:GGGCTGCTGTCAGGATTCAA参考景琦琦[15]
表3 饲料中不同免疫添加剂对红鳍东方鲀生长性能的影响
Tab.3 Effects of dietary immune additives on the growth of tiger puffer Takifugu rubripes
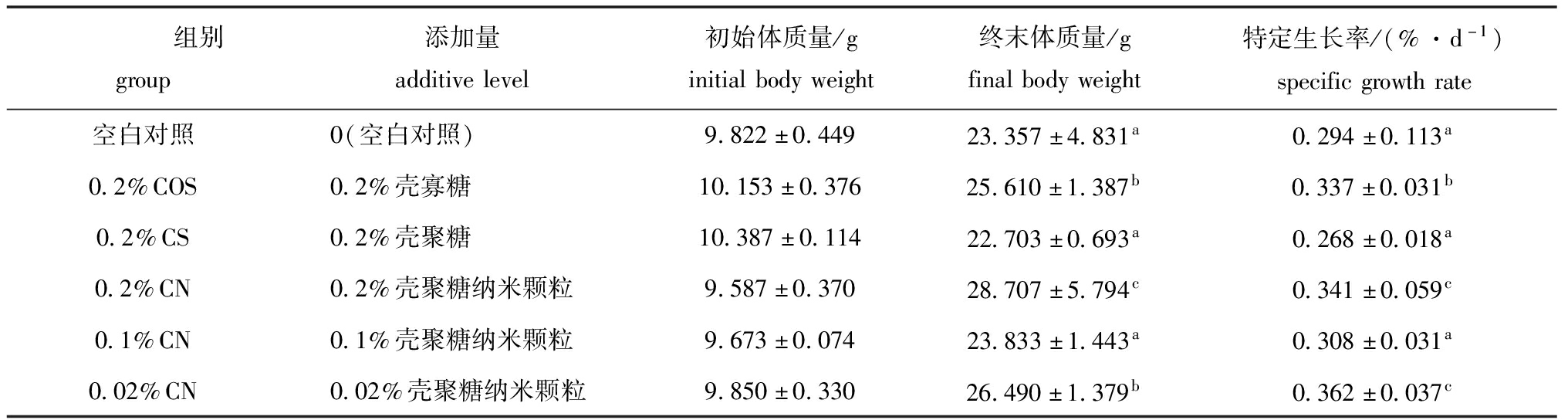
组别group添加量additivelevel初始体质量/ginitialbodyweight终末体质量/gfinalbodyweight特定生长率/(%·d-1)specificgrowthrate空白对照0(空白对照)9.822±0.44923.357±4.831a0.294±0.113a0.2%COS0.2%壳寡糖10.153±0.37625.610±1.387b0.337±0.031b0.2%CS0.2%壳聚糖10.387±0.11422.703±0.693a0.268±0.018a0.2%CN0.2%壳聚糖纳米颗粒9.587±0.37028.707±5.794c0.341±0.059c0.1%CN0.1%壳聚糖纳米颗粒9.673±0.07423.833±1.443a0.308±0.031a0.02%CN0.02%壳聚糖纳米颗粒9.850±0.33026.490±1.379b0.362±0.037c
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
2.2 不同添加剂组红鳍东方鲀几种非特异性免疫酶活性的变化
从表4可见:红鳍东方鲀肝脏中,0.2%壳寡糖组、0.2%壳聚糖组、0.2%壳聚糖纳米颗粒组和0.1%壳聚糖纳米颗粒组AKP酶活性与对照组相比均显著升高(P<0.05),壳聚糖纳米颗粒组与壳寡糖、壳聚糖组AKP酶活性有显著性差异(P<0.05);肾脏中,0.2%壳寡糖组和0.2%壳聚糖纳米颗粒组AKP酶活性与对照组无显著性差异(P>0.05),而添加0.2%壳聚糖组、0.1%壳聚糖纳米颗粒组和0.02%壳聚糖纳米颗粒组AKP酶活性较对照组显著降低(P<0.05);脾脏中,所有试验组AKP酶活性与对照组均无显著性差异(P>0.05)。
从表4可见:肝脏中,不同的添加剂组CAT酶活性均较对照组显著升高(P<0.05),0.2%壳聚糖纳米颗粒组较对照组CAT酶活性提高了6.3倍,且0.2%壳聚糖纳米颗粒组CAT酶活性较壳寡糖组和壳聚糖组有显著性升高(P<0.05);肾脏中,0.1%和0.02%壳聚糖纳米颗粒组的CAT酶活性显著高于对照组(P<0.05),且3个壳聚糖纳米颗粒组CAT酶活性均显著高于壳寡糖和壳聚糖组(P<0.05);脾脏中,不同的添加剂组CAT酶活性均显著低于对照组(P<0.05)。
从表4可见:肝脏中,0.2%壳寡糖组、0.2%壳聚糖纳米颗粒组的SOD酶活性显著高于对照组(P<0.05),且0.2%壳聚糖纳米颗粒组显著高于0.2%壳寡糖组(P<0.05);肾脏中,所有海洋多糖添加剂试验组与对照组相比,SOD酶活性均显著升高(P<0.05),但所有壳聚糖纳米颗粒组与壳寡糖组均未表现出显著性差异(P>0.05),与壳聚糖组表现出显著性差异(P<0.05);脾脏中,0.2%壳寡糖组和0.1%壳聚糖纳米颗粒组SOD酶活性与对照组相比略有升高(P>0.05)。
从表4可见:肝脏中,0.2%壳寡糖组、0.2%壳聚糖组的ACP酶活性与对照组相比均显著升高(P>0.05);肾脏中,所有海洋多糖添加剂试验组ACP酶活性与对照组相比均降低;脾脏中,所有海洋多糖添加剂试验组ACP酶活性与对照组相比均有显著升高(P<0.05)。
从表4可见:肝脏中,除0.02%壳聚糖纳米颗粒组外其他海洋多糖添加剂组的LZM酶活性均显著低于对照组(P<0.05);肾脏中,所有海洋多糖添加剂试验组LZM酶活性与对照组相比均升高,除0.2%壳寡糖组无显著性差异外其他组均表现出显著性差异(P<0.05);脾脏中,所有海洋多糖添加剂试验组LZM酶活性与对照组相比均显著升高(P<0.05),且0.1%和0.02%壳聚糖纳米颗粒组LZM酶活性均显著高于壳寡糖组(P<0.05)。
表4 饲料中不同添加剂对红鳍东方鲀相关免疫酶活性的影响
Tab.4 Effects of dietary additives on the activities of related immune enzymes in tiger puffer Takifugu rubripes U/100 mL
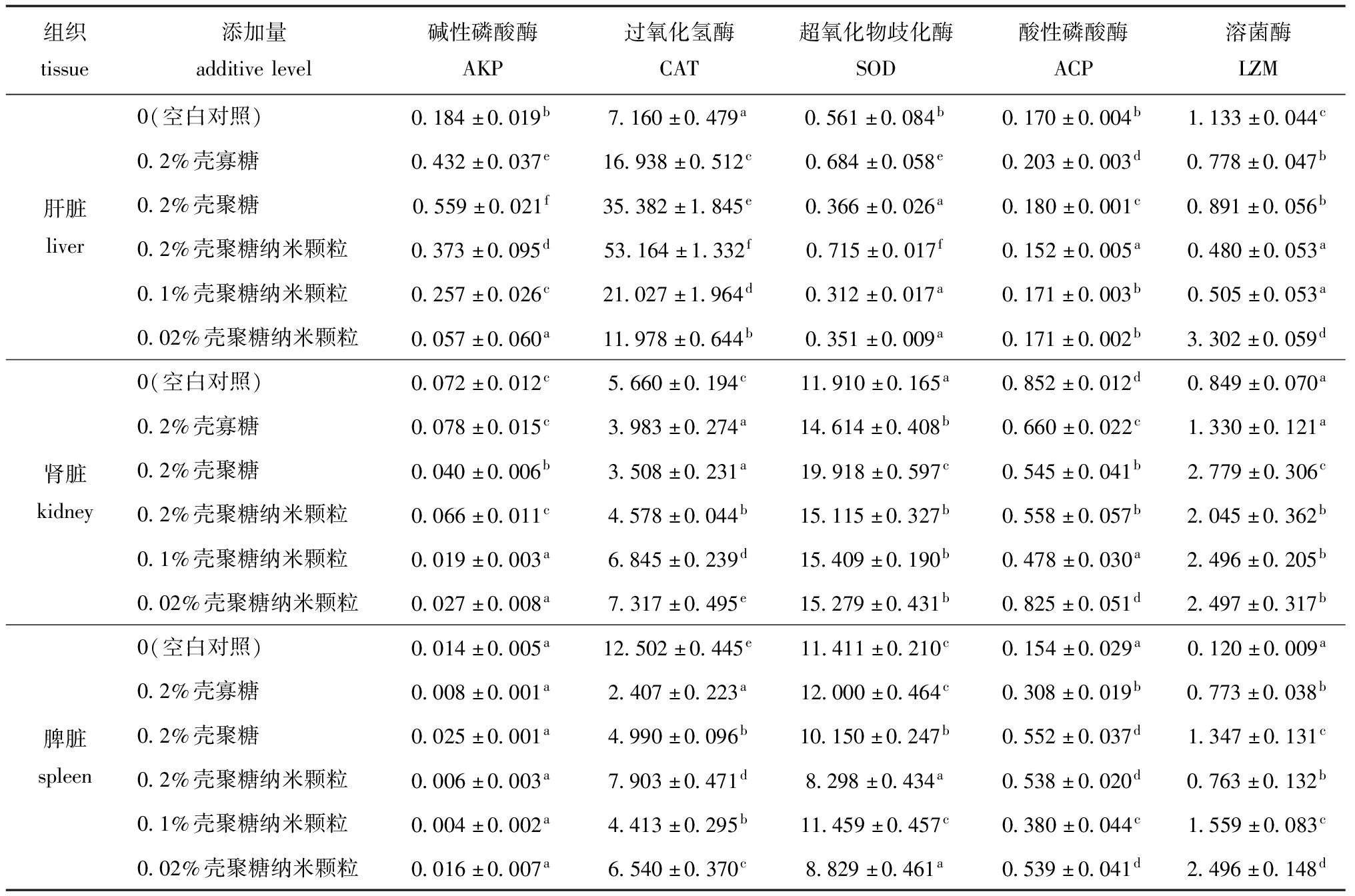
组织tissue添加量additivelevel碱性磷酸酶AKP过氧化氢酶CAT超氧化物歧化酶SOD酸性磷酸酶ACP溶菌酶LZM肝脏liver0(空白对照)0.184±0.019b7.160±0.479a0.561±0.084b0.170±0.004b1.133±0.044c0.2%壳寡糖0.432±0.037e16.938±0.512c0.684±0.058e0.203±0.003d0.778±0.047b0.2%壳聚糖0.559±0.021f35.382±1.845e0.366±0.026a0.180±0.001c0.891±0.056b0.2%壳聚糖纳米颗粒0.373±0.095d53.164±1.332f0.715±0.017f0.152±0.005a0.480±0.053a0.1%壳聚糖纳米颗粒0.257±0.026c21.027±1.964d0.312±0.017a0.171±0.003b0.505±0.053a0.02%壳聚糖纳米颗粒0.057±0.060a11.978±0.644b0.351±0.009a0.171±0.002b3.302±0.059d肾脏kidney0(空白对照)0.072±0.012c5.660±0.194c11.910±0.165a0.852±0.012d0.849±0.070a0.2%壳寡糖0.078±0.015c3.983±0.274a14.614±0.408b0.660±0.022c1.330±0.121a0.2%壳聚糖0.040±0.006b3.508±0.231a19.918±0.597c0.545±0.041b2.779±0.306c0.2%壳聚糖纳米颗粒0.066±0.011c4.578±0.044b15.115±0.327b0.558±0.057b2.045±0.362b0.1%壳聚糖纳米颗粒0.019±0.003a6.845±0.239d15.409±0.190b0.478±0.030a2.496±0.205b0.02%壳聚糖纳米颗粒0.027±0.008a7.317±0.495e15.279±0.431b0.825±0.051d2.497±0.317b脾脏spleen0(空白对照)0.014±0.005a12.502±0.445e11.411±0.210c0.154±0.029a0.120±0.009a0.2%壳寡糖0.008±0.001a2.407±0.223a12.000±0.464c0.308±0.019b0.773±0.038b0.2%壳聚糖0.025±0.001a4.990±0.096b10.150±0.247b0.552±0.037d1.347±0.131c0.2%壳聚糖纳米颗粒0.006±0.003a7.903±0.471d8.298±0.434a0.538±0.020d0.763±0.132b0.1%壳聚糖纳米颗粒0.004±0.002a4.413±0.295b11.459±0.457c0.380±0.044c1.559±0.083c0.02%壳聚糖纳米颗粒0.016±0.007a6.540±0.370c8.829±0.461a0.539±0.041d2.496±0.148d
2.3 不同添加剂组红鳍东方鲀几种免疫相关基因表达的变化
从图1可见:肾脏中,0.2%壳寡糖组、0.2%壳聚糖组的c3基因表达量与对照组相比均显著增高(P<0.05),添加不同浓度的壳聚糖纳米颗粒组与对照组均无显著性差异(P>0.05);肝脏中,所有海洋多糖添加剂试验组c3基因的相对表达量与对照组相比均降低;脾脏中,所有海洋多糖添加剂试验组c3基因的相对表达量均高于对照组,除0.1%壳聚糖纳米颗粒组外其他组均显著升高(P<0.05)。
从图2可见:肾脏中,所有海洋多糖添加剂试验组hsp70基因相对表达量与对照组相比均显著降低(P<0.05);肝脏中,除了0.2%壳聚糖纳米颗粒组hsp70基因相对表达量显著高于对照组外(P<0.05),其他海洋多糖添加剂试验组hsp70基因相对表达量均低于对照组;脾脏中,所有海洋多糖添加剂试验组hsp70基因相对表达量与对照组相比均有增加。

注:标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note: The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图1 不同免疫添加剂对红鳍东方鲀c3基因的影响
Fig.1 Effects of different immune additives on c3 immune genes in tiger puffer Takifugu rubripes
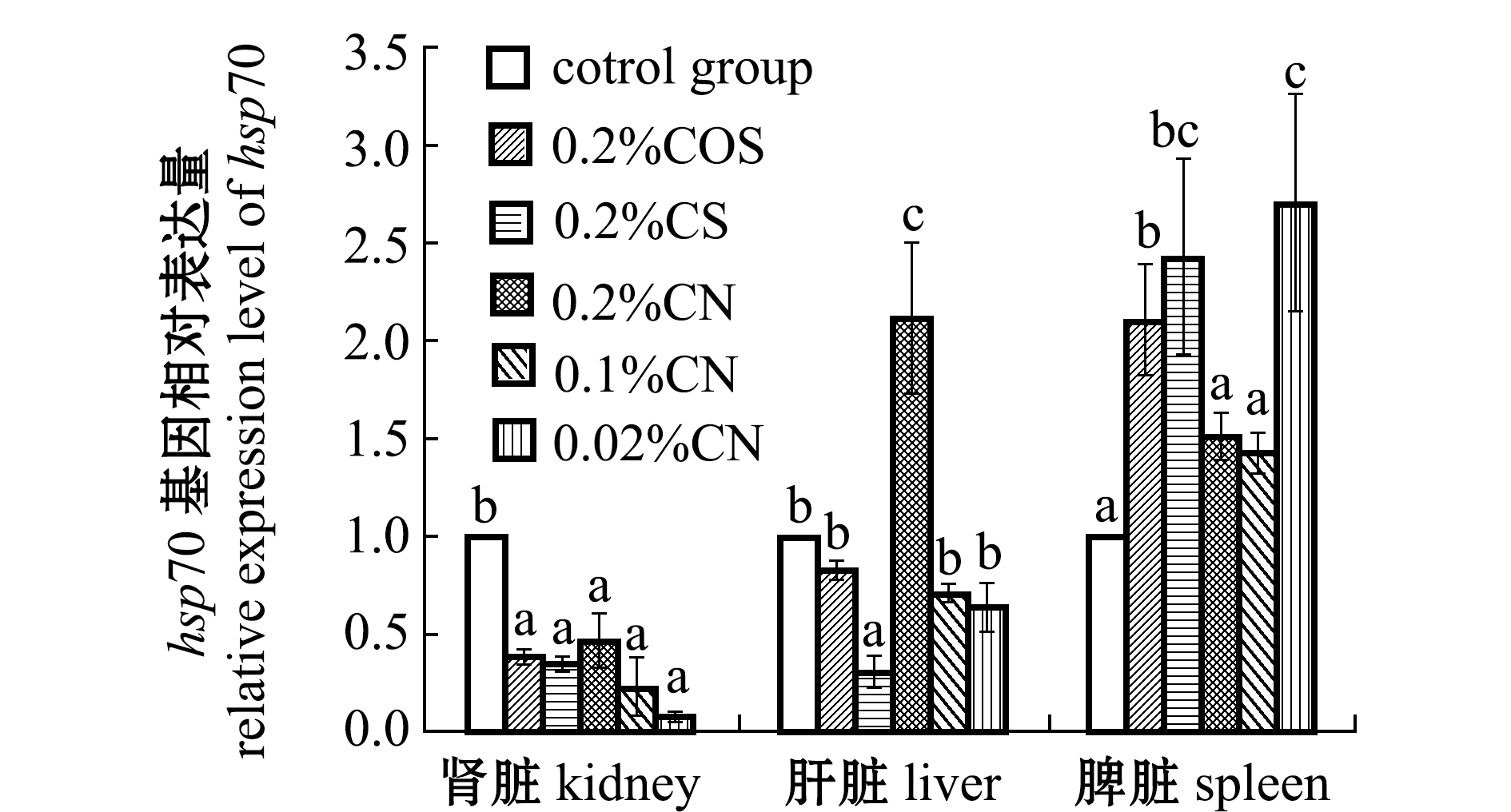
图2 不同免疫添加剂对红鳍东方鲀hsp70基因的影响
Fig.2 Effects of different immune additives on hsp70 immune genes in tiger puffer Takifugu rubripes
从图3可见:肾脏中,0.2%壳寡糖组、0.2%壳聚糖组、0.1%壳聚糖纳米颗粒组ifr2基因相对表达量均显著高于对照组(P<0.05);肝脏中,除了0.02%壳聚糖纳米颗粒组ifr2基因相对表达量略高于对照组外,其他海洋多糖添加剂试验组ifr2基因表达量均显著低于对照组(P<0.05);脾脏中,所有海洋多糖添加剂试验组ifr2基因相对表达量均显著低于对照组(P<0.05)。

图3 不同免疫添加剂对红鳍东方鲀ifr2基因的影响
Fig.3 Effects of different immune additives on ifr2 immune genes in tiger puffer Takifugu rubripes
从图4可见:肾脏中,0.2%壳寡糖组、0.2%壳聚糖组的tlr3基因相对表达量略高于对照组(P>0.05),所有壳聚糖纳米颗粒试验组tlr3基因相对表达量均显著低于对照组(P<0.05);肝脏中,0.1%壳聚糖纳米颗粒组、0.02%壳聚糖纳米颗粒组的tlr3基因相对表达量均高于对照组,分别提高0.1倍、0.7倍,其他海洋多糖添加剂组的tlr3基因相对表达量均显著低于对照组(P<0.05);脾脏中,0.2%壳寡糖组、0.2%壳聚糖纳米颗粒组和0.1%壳聚糖纳米颗粒组tlr3基因相对表达量与对照组相比均显著升高(P<0.05)。
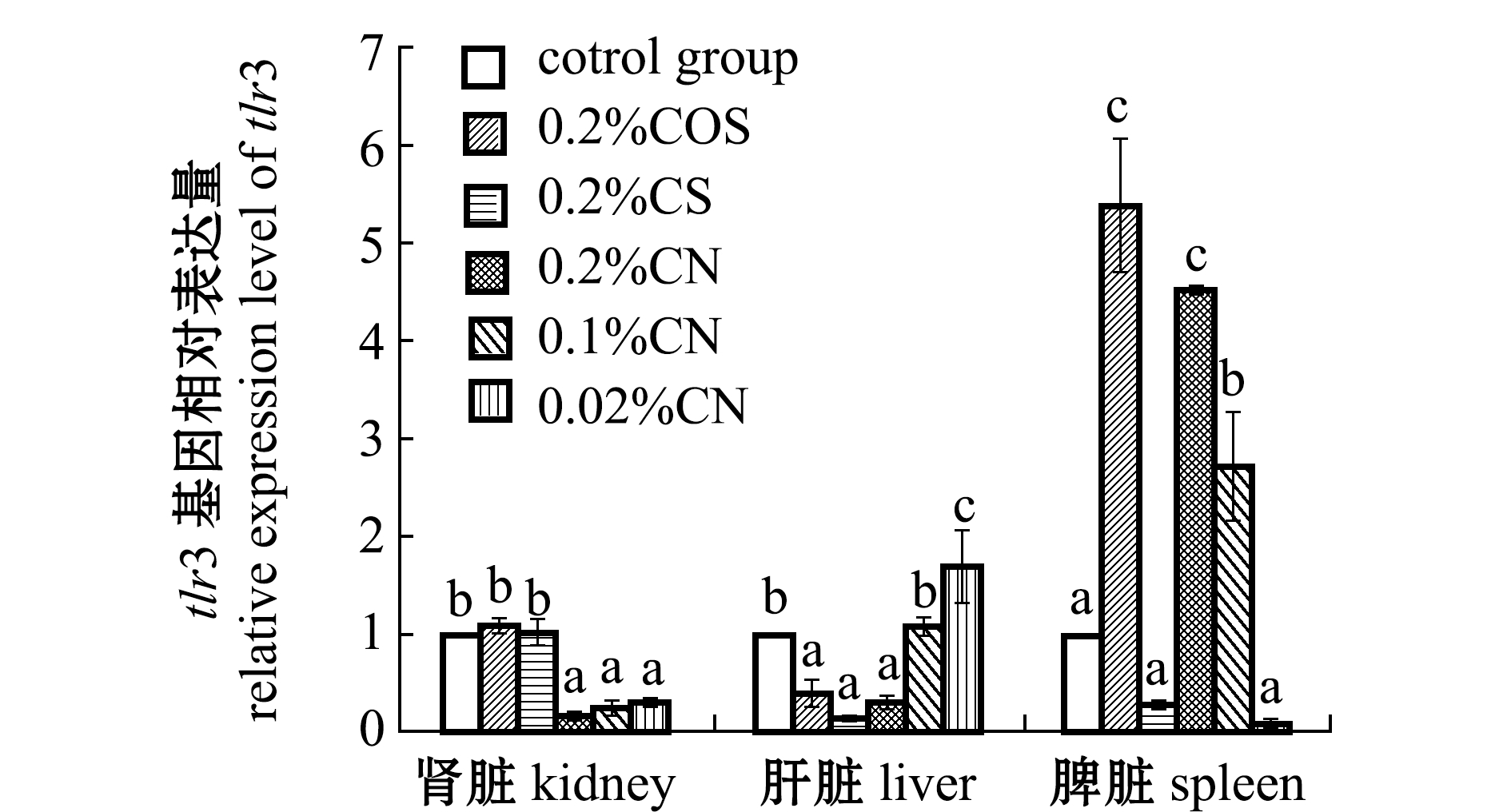
图4 不同免疫添加剂对红鳍东方鲀tlr3基因的影响
Fig.4 Effects of different immune additives of tlr3 immune genes in tiger puffer Takifugu rubripes
3 讨论
3.1 不同添加剂对红鳍东方鲀生长性能的影响
本试验中,添加壳聚糖纳米颗粒对红鳍东方鲀的生长有明显的促进作用,且饲料中添加0.2%相同浓度的壳聚糖纳米颗粒比壳寡糖的促进效果更好,分析原因可能是壳聚糖纳米颗粒易通过内吞方式进入细胞[16]。壳聚糖纳米颗粒尺寸小,其负载小分子物质的能力较强,水溶性较好、稳定性强,能促进细胞的吞噬作用[17],更容易被红鳍东方鲀利用。
3.2 不同添加剂对红鳍东方鲀免疫酶活性的影响
AKP是一种磷酸单酯酶, 可直接参与鱼类机体磷的代谢, 在DNA、RNA、脂质、蛋白质等营养物质代谢中有极其重要的生理功能[18],也是鱼类体内巨噬细胞溶酶体的标志性酶, 在鱼类机体内磷酸基团的代谢中发挥重要作用,其活性的高低反映了溶酶体酶防御和消化功能的强弱[19]。本试验中,饲料中添加壳聚糖纳米颗粒和壳寡糖组一样,能使肝脏中AKP活性显著提高,这说明,其在肝脏中发挥了重要的解毒作用,有助于鱼体对营养物质的吸收和自身的生长,可促进机体的代谢。
动物机体内的有害超氧阴离子自由基会通过各种应激反应和细胞活动而产生,自身及其衍生出的活性产物,都具有毒性作用,可引起细胞和组织的氧化损伤[20]。SOD 和 CAT 酶可分别清除机体内超氧阴离子自由基和自由基被分解过后的氧化氢产物,其活性的高低可反映动物机体在胁迫环境下的免疫力[21]。本试验中,饲料中添加壳聚糖纳米颗粒组CAT酶在鱼体肝脏中活性升高,分析原因可能是试验过程中由于小瓜虫病的暴发,向养殖水体中投入了不同程度的双氧水来杀灭小瓜虫,导致其活性在红鳍东方鲀体内积累,进而损伤细胞,从而激活了肝脏CAT酶分解过量的过氧化氢,以及激活肾脏中SOD酶分解大量活性氧自由基。
溶菌酶为一种碱性蛋白酶, 在鱼类的皮肤黏液、吞噬细胞、血清及组织器官中均有分布,在鱼体的非特异性免疫系统中占有重要地位[22]。本试验中,所有海洋多糖添加剂试验组溶菌酶活性在肾脏、脾脏中都显著增加,说明添加多糖类物质可提高鱼体溶菌酶活性,增加吞噬细胞活性,抵御异物入侵,且肾脏中壳聚糖纳米颗粒组均显著高于寡糖组和对照组,说明壳聚糖纳米颗粒具有一定的抗菌作用,这与之前的研究结果一致[23]。
3.3 不同添加剂对红鳍东方鲀免疫基因的影响
补体是抗体与吞噬细胞间连接的中介, 能在非特异性免疫系统中发挥重要的作用, c3在补体系统中占关键性地位,被激活后的补体c3有溶菌、杀菌、杀病毒的作用, 也能灭活细菌胞外的毒素[24]。本试验中,壳聚糖纳米颗粒添加剂能有效促进脾脏中补体c3的表达量,而脾脏和肾脏是红鳍东方鲀的主要免疫器官,说明添加壳聚糖纳米颗粒可增加脾脏免疫器官对病原菌的抗性。
热休克蛋白70(hsp70)是一类重要的非特异性细胞保护蛋白,具有抗氧化、分子伴侣、抗原递呈和免疫等作用。hsp70能调节机体非特异性的免疫应答过程,即当免疫细胞产生免疫应答时,免疫细胞如淋巴细胞等分泌的一些细胞因子可诱导生成hsp70,hsp70协同免疫细胞完成一系列应答过程[25]。本试验中,壳聚糖纳米颗粒添加组hsp70基因在脾脏中表达显著增加。推测壳聚糖纳米颗粒的刺激作用能有效地激发脾脏hsp70协助抗原提呈细胞将抗原提呈给淋巴细胞,促进淋巴细胞分泌溶菌酶,从而提高红鳍东方鲀抗逆性。这与溶菌酶活性测定结果一致。
干扰素调节因子ifr2是一种转录因子,主要调节Ⅰ型干扰素、干扰素刺激基因的表达[26],在机体免疫反应中有重要作用,如抗菌、细胞因子信号转导、病原体应答和细胞生长调节等反应过程。本试验中,干扰素调节因子ifr2在各个组织中表达量未有显著变化,表明以上海洋多糖添加剂对红鳍东方鲀ifr2基因的表达没有明显促进作用。
tlr3是Toll样受体之一,是一种跨膜受体,位于细胞表面,主要作用于信号传导,在识别病原、激活先天免疫和诱导适应性免疫方面具有重要作用[27]。本试验中,添加壳聚糖纳米颗粒的试验组脾脏中Toll样受体tlr3基因表达量显著高于对照组,推测添加多糖后可增强跨膜受体对病原菌的识别,刺激下游免疫反应的发生,进而提高鱼体免疫力。
4 结论
在本试验条件下,壳聚糖米颗粒可有效促进红鳍东方鲀的生长,能显著增加肝脏的AKP、CAT酶活性,脾脏的ACP、LZM活性,以及肾脏的SOD、LZM酶活性,提高脾脏中c3、tlr3、hsp70基因的相对表达量,对鱼体免疫力的提高有一定的促进作用。
同时,添加壳聚糖纳米颗粒与壳寡糖组效果相当,总体看,可为下一步红鳍东方鲀免疫增强剂的添加提供新的选择。
[1] 王奎旗,陈梅,高天翔.东方鲀属鱼类的分类与区系分布研究[J].青岛海洋大学学报,2001,31(6):855-860.
[2] 张涛,徐思祺,宋颖.红鳍东方鲀的病害防治简述[J].科学养鱼,2017(6):65-67.
[3] 刘晓晖.洞庭湖流域水环境中典型抗生素污染特征、来源及风险评估[D].济南:山东师范大学,2017.
[4] 王小红,马建标,何炳林.甲壳素、壳聚糖及其衍生物的应用[J].功能高分子学报,1999,2(2):197-202.
[5] Liu Nan,Chen Xiguang,Park H J,et al.Effect of MW and concentration of chitosan on antibacterial activity of Escherichia coli[J].Carbohydrate Polymers,2006,64(1):60-65.
[6] 常青,梁萌青,王家林,等.壳聚糖对花鲈生长和非特异性免疫力的影响[J].海洋水产研究,2006,27(5):17-22.
[7] 金思,龚一富,章丽,等.壳聚糖对香鱼溶菌酶活性和hsp70基因表达的影响[J].生物学杂志,2012,29(5):10-14.
[8] 任秀芳,周鑫,赵朝阳,等.投饲频率和饵料种类对中华绒螯蟹幼蟹生长及能量收支的影响[J].大连海洋大学学报,2013,28(5):468-474.
[9] 陈海燕,张彬,何勇松.壳寡糖的研究进展和应用前景[J].广东畜牧兽医科技,2007,32(2):17-20,29.
[10] 丁永良.纳米材料与水产养殖[J].中国渔业经济,2003(2):43-44.
[11] 邓岳松,夏枚生,胡彩虹,等.纳米技术在水产养殖中的应用[J].中国饲料,2003(20):22-23.
[12] Wu Tiantian,Wu Chunhua,Fu Shalu,et al.Integration of lysozyme into chitosan nanoparticles for improving antibacterial activity[J].Carbohydrate Polymers,2017,155:192-200.
[13] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CT Method[J].Methods,2001,25(4):402-408.
[14] 孙梦蕾,吕绘倩,暴宁,等.急性低盐胁迫下红鳍东方纯幼鱼IgM、NKCC1和HSP70基因的表达[J].中国水产科学,2017,24(1):65-72.
[15] 景琦琦.不同养殖模式下红鳍东方鲀生长、血液生理及抗逆能力研究[D].泰安:山东农业大学,2018.
[16] 韩璐,杜立波,贾宏瑛,等.新型Trolox-壳聚糖纳米颗粒的制备及抗氧化效应[J].高等学校化学学报,2011,32(5):1013-1015.
[17] Sorokina O,Goryanin I.Preface[J].European Journal of Pharmaceutical Sciences,2012,46(4):189.
[18] 王兰,王茜,吉晋芳,等.低分子量壳聚糖对长江华溪蟹免疫功能的影响[J].山西大学学报:自然科学版,2009,32(4):627-633.
[19] 周进,宋晓玲,黄倢,等.A3α肽聚糖对牙鲆不同组织中超氧化物歧化酶及磷酸酶活性的影响[J].中国水产科学,2004,11(4):296-301.
[20] 肖艳翼,夏永涛,刘腾飞,等.壳聚糖对俄罗斯鲟幼鱼生长性能及免疫功能的影响[J].水生生物学报,2017,41(1):114-120.
[21] 周婧,王旭,刘霞,等.饲料中牛磺酸水平对红鳍东方鲀免疫及消化酶的影响[J].大连海洋大学学报,2019,34(1):101-108.
[22] Brattgjerd S,Evensen Ø.A sequential light microscopic and ultrastructural study on the uptake and handling of Vibrio salmonicida in phagocytes of the head kidney in experimentally infected Atlantic salmon(Salmo salar L.)[J].Veterinary Pathology,1996,33(1):55-65.
[23] 颜焕新,潘一峰,赵劲风,等.壳聚糖纳米粒的制备及体外抗幽门螺杆菌效果评价[J].中国组织工程研究与临床康复,2009,13(29):5695-5698.
[24] 王志平,张士璀,王光锋.鱼类补体系统成分及补体特异性和功能的研究进展[J].水生生物学报,2008,32(5):760-769.
[25] 许丹宁,田允波,黄运茂,等.HSP70/HSP27对免疫细胞保护作用的研究进展[J].仲恺农业工程学院学报,2011,24(1):56-60.
[26] Taniguchi T,Ogasawara K,Takaoka A,et al.IRF family of transcription factors as regulators of host defense[J].Annual Review of Immunology,2001,19:623-655.
[27] 范泽军,邹鹏飞,姚翠鸾.鱼类Toll样受体及其信号传导的研究进展[J].水生生物学报,2015,39(1):173-184.