刺参Apostichopus japonicus Selenka分布于西北太平洋沿岸国家,包括俄罗斯、日本和韩国等国家均有分布。在中国,刺参主要产于黄渤海沿岸的潮间带区域,是北方沿海地区主要养殖经济种类之一[1],其具有独特的风味及较高的医疗保健功效[2-3],自古就被誉为“海产八珍”、“海中人参”,是名贵的海珍品[4]。
体壁是刺参主要食用和药用的部位,具有较高的营养价值[5]。干品刺参体壁营养成分主要包括蛋白质、脂质、多肽、多糖及糖苷等,蛋白质含量在34%~60%之间,其中人体必需氨基酸含量可占到30%~40%[5-7]。刺参脂质的主要成分是磷脂,约占总脂质的九成,胆固醇含量则较低,仅占1%[8]。其体壁中C20∶5n3(EPA)、C22∶6n3(DHA)等人体必需脂肪酸含量丰富[8],不饱和脂肪酸在脂质中的含量多于饱和脂肪酸,其多不饱和脂肪酸含量超过三分之一[5,7]。多糖也刺参的一种重要的药效成分,约占体壁干质量的6%[9],对抗病毒、抗癌、抑菌消炎、促进代谢机能及提高机体免疫力均有较为显著的效果[2-3,10]。
近年来,随着刺参养殖规模的逐渐扩大及集约化高密度养殖模式的不断发展,一些饲料问题也逐渐暴露出来,其中之一就是鼠尾藻、马尾藻等传统饲料原料的短缺[11]。这两种藻类主要由于其营养结构适宜、藻胶含量较低、不易污染水质,一直被认为是刺参养殖最佳的天然藻类饲料来源,但由于养殖业对其资源的大量需求,加之在开采过程中没有施以得当的保护措施,导致其自然资源急剧下降,已远远不能满足市场需求,其价格也随之上涨,严重影响刺参养殖业的发展[12-13]。为此,一些学者开始尝试人工培育鼠尾藻,虽然获得了一定的突破,但由于人力物力等多方面因素的影响,还不足以形成规模化的生产模式,难以满足养殖业的实际需求[14-15]。大部分研究集中在传统饲料的替代物上。到目前为止,还没有对相关饲料的原料及营养配比达成一个统一的标准[16]。因此,寻求储备丰富、价格相对低廉的新型藻类饲料,对推动刺参养殖业持续发展有着非常积极的作用。越南大叶菜、印尼大叶菜、菲律宾大叶菜3种大型藻类原料来源于热带及亚热带海域,资源丰富、价格低廉,是潜在的刺参饲料原料替代品。已有研究表明,通过对室内养殖刺参幼体进行食源分析,得出以大叶菜贡献率最高[17]。浒苔及石莼早已被应用到食品及饲料加工当中,其产量大、来源广、储备资源丰富,是很容易获得的饲料资源,在刺参饲料方面也有应用[13,18]。郭娜[14]比较了几种大型藻对刺参的培育效果后认为,投喂鼠尾藻、浒苔对刺参的生长性能有更明显的促进作用,培育效果优于海带粉组。朱建新等[19]使用石莼替代鼠尾藻干粉培育刺参获得了更好的效果。廖梅杰等[20]研究表明,浒苔与海泥按3∶7的比例混合制成的饲料可替代传统藻类饲料鼠尾藻。
为此,本试验中将马尾藻、石莼、浒苔及3种产自热带及亚热带海域的大叶菜分别与配合饲料按比例混合制成6种幼参配合饲料,并通过研究各藻类饲料的投喂对幼参生长、存活、消化生理、免疫性能及营养组成的影响,评价这些藻类饲料对幼参阶段刺参的培育效果及可行性,为刺参幼参的培育和饲料开发提供基础资料。
1 材料与方法
1.1 材料
试验用幼参购自大连鑫玉龙海洋生物种业科技股份有限公司(大连市普兰店区)。产脘假丝酵母购自郑州百益宝生物有限公司。
1.2 方法
1.2.1 试验饲料的制备 试验以马尾藻、石莼、浒苔、越南大叶菜、菲律宾大叶菜、印尼大叶菜为藻类原料(营养成分见表1和表2),将上述藻粉分别加入一定比例的产脘假丝酵母、配合饲料和海泥,采用逐级混合法配制成试验用幼参饲料,分别记为M、S、H、YC、FC和NC(表3),制备好的饲料装入自封袋中并保存于-20 ℃冰箱中待用。试验饲料在投喂前经发酵处理,将适量饲料与灭菌纯净水(质量比1∶2)在100 mL塑料烧杯中混合,用自封袋密封后置于37 ℃恒温培养箱发酵3 d。配合饲料的原料配比为:鱼粉40%、虾粉20%、豆粕30%、牡蛎壳粉8%、复合维生素2%。
表1 藻粉饲料的营养成分
Tab.1 Nutritional composition of the experimental diets containing algal powder w/%

组别group粗蛋白质crudeprotein粗脂肪crudelipid粗灰分crudeash磷P钙CaM8.713.9555.470.09961.417S22.5012.6078.950.14860.534H23.809.2175.810.23650.744YC6.615.0954.390.071911.780FC6.994.4267.730.08692.340NC6.518.6162.060.07945.365
表2 藻粉饲料的氨基酸组成
Tab.2 Amino composition of the experimental algal powder g/kg
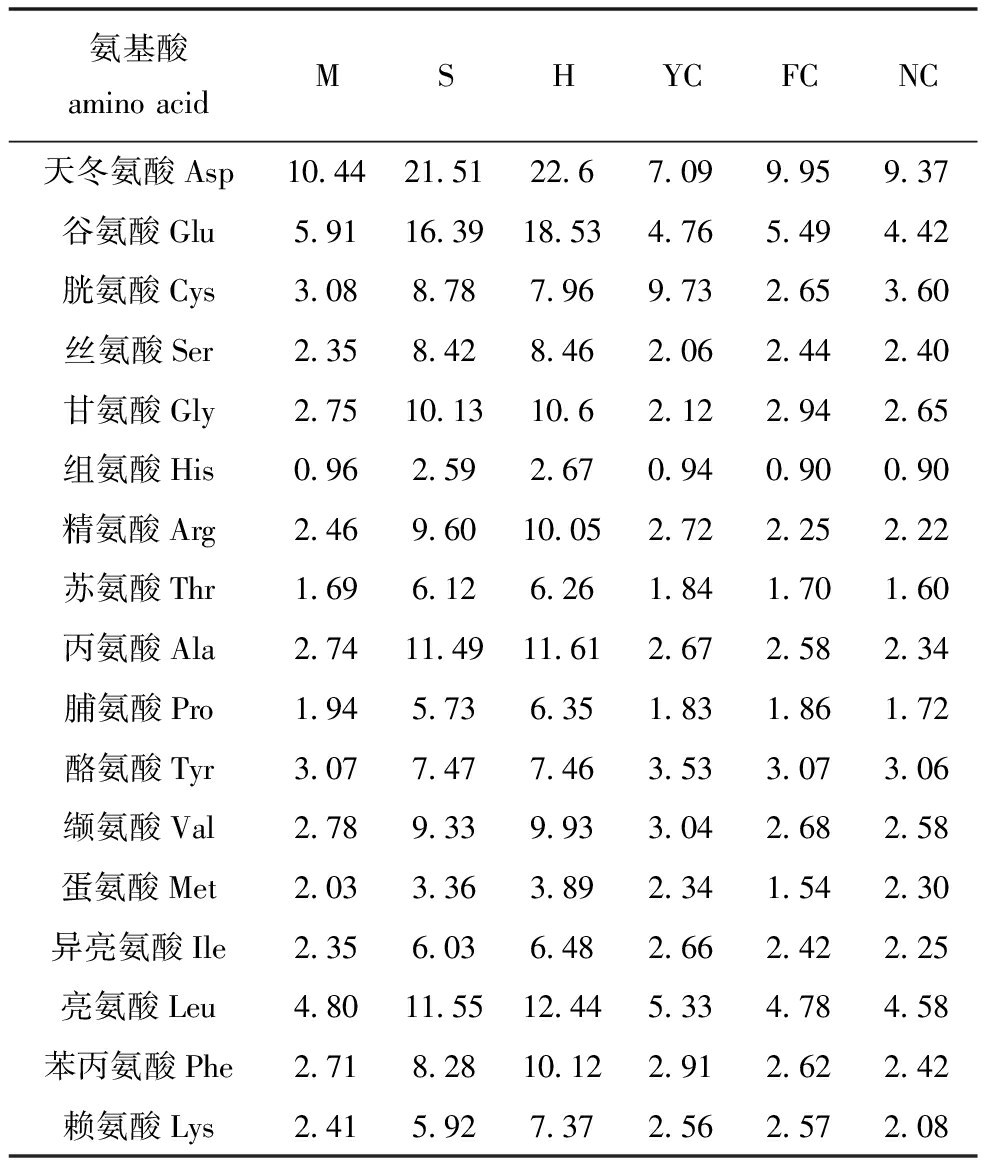
氨基酸aminoacidMSHYCFCNC天冬氨酸Asp10.4421.5122.67.099.959.37谷氨酸Glu5.9116.3918.534.765.494.42胱氨酸Cys3.088.787.969.732.653.60丝氨酸Ser2.358.428.462.062.442.40甘氨酸Gly2.7510.1310.62.122.942.65组氨酸His0.962.592.670.940.900.90精氨酸Arg2.469.6010.052.722.252.22苏氨酸Thr1.696.126.261.841.701.60丙氨酸Ala2.7411.4911.612.672.582.34脯氨酸Pro1.945.736.351.831.861.72酪氨酸Tyr3.077.477.463.533.073.06缬氨酸Val2.789.339.933.042.682.58蛋氨酸Met2.033.363.892.341.542.30异亮氨酸Ile2.356.036.482.662.422.25亮氨酸Leu4.8011.5512.445.334.784.58苯丙氨酸Phe2.718.2810.122.912.622.42赖氨酸Lys2.415.927.372.562.572.08
1.2.2 试验设计及饲养管理 选取体长为(3.0±0.5)cm、体质量为(1.0±0.2)g的幼参暂养于500 L水槽中,在水温(22±1)℃、盐度33±1、pH 7.9~8.1、溶氧9.5~10.0 mg/L且用1 μm过滤的自然海水中驯化一周。期间正常充气,隔日换水1/2,每日投喂一次,并根据其摄食情况适当调整投喂量。正式试验开始前,挑选发育良好、体型匀称、健康无病的幼参个体270头,随机分配至18个70 L的方形塑料试验水槽中,每个水槽放入15头幼参。每种饲料随机投喂3组海参,每天两次(8:00和18:00)进行表观饱食投喂,并于投喂24 h后吸底1次,每3 d全量换水1次。试验期间,温度为13~21 ℃,盐度为33±1,pH为8.0±0.1,溶氧为9.95~10.05 mg/L,氨氮和亚硝酸盐含量均低于0.1 mg/L。养殖试验周期为60 d。
表3 试验饲料配比及营养成分(干质量)
Tab.3 Ingredient and approximate nutritional comosition of the experimental diets(dry matter) w/%

组别group马尾藻Sargassum石莼Ulva浒苔Enteromorph越南大叶菜VietnamS.fusiforme菲律宾大叶菜PhilippinesS.fusiforme印尼大叶菜IndonesianS.fusiforme产朊假丝酵母yeast配合饲料formulateddiet海泥seamud粗蛋白质crudeprotein粗脂肪crudelipidM30110596.631.49S301105910.754.08H301105911.143.06YC30110595.991.83FC30110596.101.63NC30110595.952.88
1.2.3 样品的制备 试验前将幼参置于干净毛巾上静置30 s,待其体腔内的水尽量排空后用精确度为0.01 g的电子秤进行称重[6,21]。试验结束后将幼参停食饥饿36 h,以排空其肠道内的粪便。将刺参置于干净毛巾上静置30 s,待其体腔内的水尽量排空后用精确度0.01 g的电子秤进行称重。在冰盘上解剖幼参,将体腔液收集至1.5 mL离心管并置于液氮中保存。用精确度为0.01 g的电子秤称量体壁质量,然后装入自封袋放入冰盒中。在冰盘上将肠道和呼吸树分离,将肠道拉伸测量肠长,用电子秤称量肠质量,然后将肠道样品收集至1.5 mL离心管置于液氮中保存[14]。取样结束后,将幼参体壁、体腔液及肠的样品置于-80 ℃下保存,用于相关指标的测定。
1.2.4 生长指标的测定与计算 幼参生长指标的计算公式为
增重率WGR=(Wt-W0)/W0×100%,
脏壁比R=WI/WB×100%,
比肠重RGM=WI/Wt×100%,
比肠长RGL=LI/L×100%,
特定生长率SGR=(lnWt-lnW0)/t。
其中:Wt、W0分别为试验幼参的终末体质量和初始体质量(g);t为试验时间(d);WI为肠质量(g);WB为体壁质量(g);LI为肠长(cm);L为体长(cm)。
1.2.5 免疫性能及消化酶活性的测定 幼参体腔液中4种免疫性能指标包括超氧化歧化酶(SOD)、丙二醛(MDA)、过氧化氢酶(CAT)和总抗氧化能力(T-AOC),肠道4种消化生理指标包括脂肪酶(LPS)、胃蛋白酶(PP)、淀粉酶(AMS)和纤维素酶(CL),均采用南京建成生物工程研究所生产的试剂盒测定。
1.2.6 常规营养成分的测定 采用ISO—5983 118(2005)、GB/T 14772—2008、GB/T 6438—2007、GB/5009.3—2010中的方法测定幼参体壁和饲料样品的粗蛋白质、粗脂肪、灰分和水分含量。试验用各大型藻类饲料的钙、磷含量送至青岛科创质量检测有限公司进行检测。
1.2.7 氨基酸组成分析 将幼参体壁和饲料样品用MillRock-BT48型冷冻干燥机冻干处理至恒重,再用研磨棒将样品磨至粉状。称取35~40 mg样品至20 mL安瓿瓶,记录样品质量。加入10 mL 6 mol/L盐酸混匀置于4 ℃冰箱,5 min后取出放到SE812型吹氮仪上吹氮15 min。吹氮完毕后立即用酒精喷灯封口,然后移入110 ℃烘箱消解22 h。取0.2 μm滤膜过滤消解液0.2 mL,经60 ℃氮气吹干,用0.02 mol/L盐酸定容至1 mL,移入L-8900型氨基酸自动分析仪进行分析。
样品氨基酸含量(mg/g)=[各种氨基酸含量(nmol)×氨基酸分子量(g/mol))×进样样品体积1 mL×消解液体积10 mL]/[进样体积20 μL×消解后干燥用氨基酸体积0.2 mL×物质质量(mg)]。
2 结果与分析
2.1 不同饲料组幼参生长指标的变化
从表4可见:各饲料组幼参的初始体质量无显著性差异(P>0.05);M组幼参终末体质量与增重率最高且显著高于S和H组(P<0.05),但与YC、FC和NC组无显著性差异(P>0.05);各试验组幼参的体壁质量均无显著性差异(P>0.05)。
2.2 不同饲料组幼参消化道性状指数的变化
从表5可见:各饲料组幼参的肠长和比肠长均无显著性差异(P>0.05);YC组的肠质量、比肠重和脏壁比均最高,且显著高于H组的肠质量(P<0.05)和NC组的比肠重(P<0.05),其余各组均无显著性差异(P>0.05);FC组与YC组的脏壁比相近(P>0.05),但均显著高于其他组(P<0.05)。
表4 不同藻类饲料对幼参生长指标的影响
Tab.4 Growth related indices of juvenile sea cucumber Apostichopus japonicus fed diets containing different algae

组别group初始体质量/ginitialbodyweight终末体质量/gfinalbodyweight体壁质量/gbodywall增重率/%WGRM0.97±0.223.01±0.42a1.59±0.44218.22±50.00aS1.01±0.302.12±0.34bc1.42±0.64120.49±65.59abH0.90±0.041.93±0.48c1.40±0.31112.47±50.40bYC1.13±0.252.92±0.65ab1.51±0.10165.31±74.45abFC0.94±0.132.58±0.51abc1.48±0.27172.73±27.72abNC0.94±0.102.76±0.23abc1.51±0.08195.16±7.34ab
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
表5 不同藻类饲料对幼参消化道性状指数的影响
Tab.5 Digestive tract characteristic indices of juvenile sea cucumber Apostichopus japonicus fed diets containing different algae
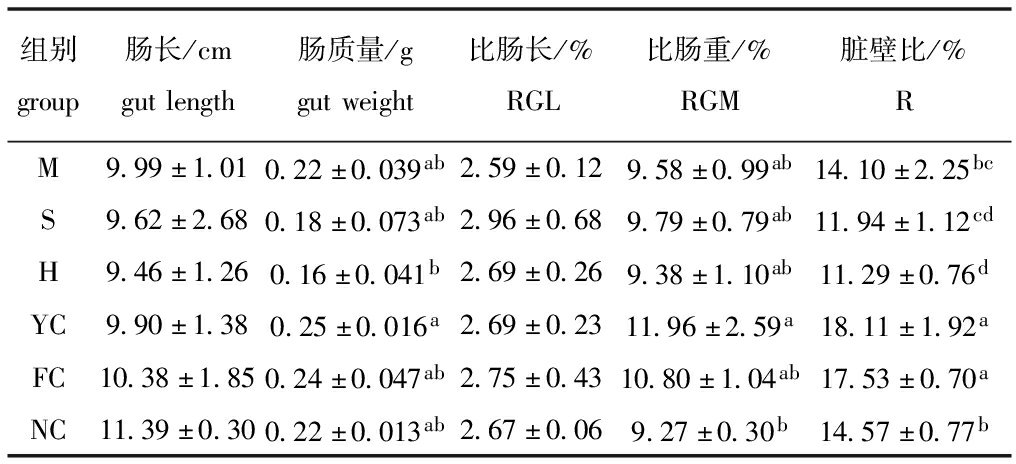
组别group肠长/cmgutlength肠质量/ggutweight比肠长/%RGL比肠重/%RGM脏壁比/%RM9.99±1.010.22±0.039ab2.59±0.129.58±0.99ab14.10±2.25bcS9.62±2.680.18±0.073ab2.96±0.689.79±0.79ab11.94±1.12cdH9.46±1.260.16±0.041b2.69±0.269.38±1.10ab11.29±0.76dYC9.90±1.380.25±0.016a2.69±0.2311.96±2.59a18.11±1.92aFC10.38±1.850.24±0.047ab2.75±0.4310.80±1.04ab17.53±0.70aNC11.39±0.300.22±0.013ab2.67±0.069.27±0.30b14.57±0.77b
2.3 不同饲料组幼参免疫及消化生理指标的变化
从表6可见:H组幼参肠道胃蛋白酶活性最高,其次是S组,两组之间无显著性差异(P>0.05),但均显著高于M、YC、NC组(P<0.05);M组与NC组幼参脂肪酶活性相近(P>0.05),均显著高于其他各组(P<0.05);H组幼参淀粉酶活性最高且显著高于其余各组(P<0.05);FC组幼参纤维素酶活性最高且显著高于YC组和H组(P<0.05)。
从表7可见:M组幼参体腔液超氧化物歧化酶活性最高,其次是S组,两组均显著高于其余各组(P<0.05);NC组幼参丙二醛含量最高且显著高于YC组和FC组(P<0.05);FC组幼参过氧化氢酶活性最高且显著高于其余各组(P<0.05),其次为YC、H和S组,均明显高于NC组和M组(P<0.05);S组幼参体腔液总抗氧化能力与M组相近,均显著高于H、FC、NC 组(P<0.05)。
表6 不同藻类饲料对幼参肠道4种消化酶活性的影响
Tab.6 Activities of 4 kinds of digestive enzymes in juvenile sea cucumber Apostichopus japonicus fed diets containing different algae

组别group胃蛋白酶/(U·mg-1prot)PP脂肪酶/(U·g-1prot)LPS淀粉酶/(U·mg-1prot)AMS纤维素酶/(U·mg-1prot)CLM2.24±0.21d18.50±0.68a0.95±0.00d7.09±0.78abS3.22±0.13ab16.96±0.70b0.93±0.02d7.18±0.38abH3.47±0.17a12.41±0.59e1.21±0.02a4.75±0.83cYC2.71±0.12c13.58±0.65d1.03±0.01b6.11±0.86bFC3.11±0.20b15.67±0.67c0.79±0.03e7.37±0.34aNC2.04±0.18d18.13±0.30a1.00±0.01c6.17±0.37ab
表7 不同藻类饲料对幼参体腔液4种免疫酶活性的影响
Tab.7 Activities of 4 kinds of immune enzymes in coelomic fluid of juvenile sea cucumber Apostichopus japonicus fed diets containing different algae

组别group超氧化物歧化酶/(U·mL-1)SOD丙二醛/(nmol·mL-1)MDA过氧化氢酶/(U·mL-1)CAT总抗氧化能力/(nmol·mL-1)T-AOCM65.79±2.57a2.15±0.27ab0.63±0.045c0.069±0.006aS61.83±0.69b2.33±0.15ab0.77±0.045b0.070±0.005aH59.00±0.27c2.02±0.25ab0.83±0.052b0.052±0.005bcYC58.79±0.92c1.91±0.18b0.84±0.026b0.063±0.006abFC56.83±0.62c1.94±0.27b0.96±0.069a0.053±0.011bcNC51.75±0.36d2.51±0.39a0.66±0.069c0.046±0.004c
2.4 不同饲料组幼参体壁营养成分的变化
从表8可见:各饲料组幼参体壁粗蛋白质和水分含量均无显著性差异(P>0.05),其中,NC组幼参体壁粗蛋白质含量最高,FC组最低;H组幼参体壁水分含量最高,YC组最低;YC组幼参体壁粗脂肪含量最高且显著高于其余各组(P<0.05),其次为M组和S组,H组粗脂肪含量最低。
从表9可见:各饲料组幼参体壁中的总必需氨基酸含量无明显变化(P>0.05);YC组幼参体壁中总氨基酸含量最高且显著高于FC组(P<0.05),其中,YC组缬氨酸和异亮氨酸含量显著高于M组(P<0.05),苏氨酸含量显著高于FC组(P<0.05);各组的药效氨基酸含量无显著性差异(P>0.05);在各组的呈味氨基酸中,YC 组的甘氨酸和丙氨酸含量均显著高于H组(P<0.05),其余各组氨基酸含量均无明显变化(P>0.05)。
表8 不同藻类饲料对幼参体壁体成分的影响
Tab.8 Proximate composition in body wall of juvenile sea cucumber Apostichopus japonicus fed diets containing different algae w/%
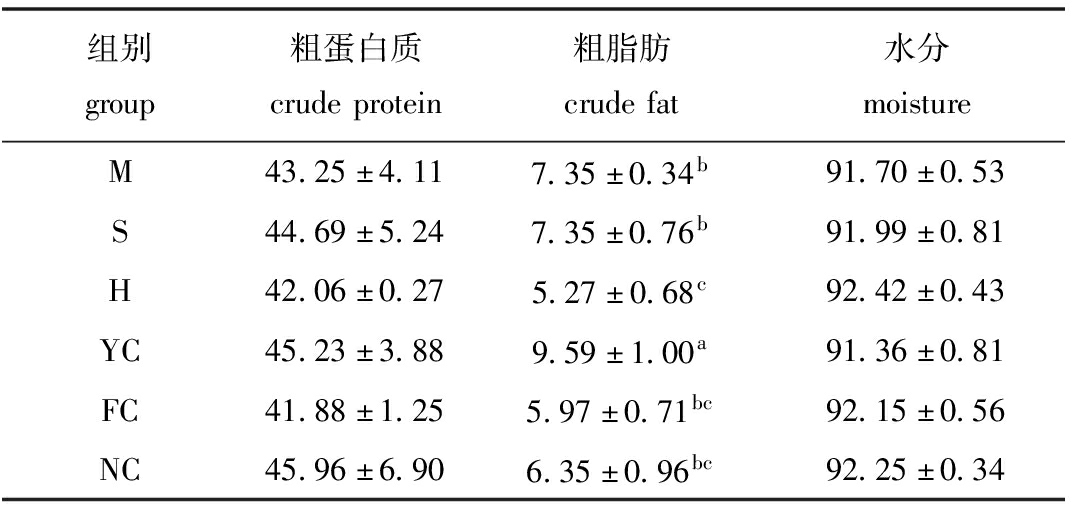
组别group粗蛋白质crudeprotein粗脂肪crudefat水分moistureM43.25±4.117.35±0.34b91.70±0.53S44.69±5.247.35±0.76b91.99±0.81H42.06±0.275.27±0.68c92.42±0.43YC45.23±3.889.59±1.00a91.36±0.81FC41.88±1.255.97±0.71bc92.15±0.56NC45.96±6.906.35±0.96bc92.25±0.34
3 讨论
3.1 不同藻类饲料对幼参生长的影响
本试验中,从各藻类饲料组幼参生长指标可以看出,马尾藻为传统的藻类饲料有其优势,投喂马尾藻的幼参终末体质量、体壁质量及增重率均为各组最高,对于幼参生长及增重效果优于其他藻类饲料,这与吴国均等[21]的结论相似。本试验中,3种大叶菜在幼参生长和增重方面的培育效果不尽相同,与传统饲料马尾藻相比存在较小的差距,可以一定程度的代替马尾藻。石莼和浒苔虽较早地被使用到水产饲料当中,并在刺参饲料研究中有所应用,但本试验结果显示,石莼和浒苔单独投喂刺参幼参的增重效果不及3种大叶菜及马尾藻且差距较为明显,其原因可能是石莼和浒苔中钙含量较低,幼参难以从饲料中获取足够的钙以满足其生理需求[19]。
表9 各试验组幼参体壁的氨基酸组成
Tab.9 Amino acid composition in body wall of juvenile sea cucumber Apostichopus japonicus in each experimental group mg/g

氨基酸aminoacidMSHYCFCNC牛磺酸Tau0.38±0.11ab0.25±0.08b0.27±0.055b0.43±0.08a0.32±0.068ab0.38±0.042ab天冬氨酸Asp△#38.75±2.3639.57±0.5338.63±0.4240.48±1.0738.27±0.8138.85±1.31苏氨酸Thr∗19.92±1.23ab20.65±0.42ab19.97±0.26ab21.00±0.33a19.70±0.27b20.03±0.48ab丝氨酸Ser17.72±1.0217.72±0.5517.32±0.3118.23±0.1717.35±0.1317.69±0.43谷氨酸Glu△#54.69±3.3555.36±0.7654.24±0.4556.79±1.2754.25±0.8955.36±1.85甘氨酸Gly#40.37±2.54ab39.36±0.78bc37.85±0.50c42.41±0.90a38.55±0.48bc38.98±1.21bc丙氨酸Ala#21.00±1.42ab21.05±0.43ab20.63±0.11b22.09±0.35a20.76±0.13b21.10±0.56ab半胱氨酸Cys2.59±0.282.92±0.122.88±0.042.94±0.112.86±0.152.75±0.39缬氨酸Val∗△17.15±1.03b18.02±0.18ab17.67±0.25ab18.39±0.68a17.50±0.27ab17.60±0.68ab甲硫氨酸Met∗6.44±0.577.03±0.046.56±0.087.19±0.276.76±0.346.36±0.89异亮氨酸Ile∗△15.73±1.09b16.54±0.32ab16.11±0.04ab16.87±0.36a16.06±0.05ab16.18±0.48ab亮氨酸Leu∗△21.89±1.3922.77±0.4222.29±0.0523.05±0.4122.28±0.1222.54±0.63酪氨酸Tyr#12.35±1.2012.94±0.5712.73±0.3513.17±0.3812.78±0.2213.01±0.30苯丙氨酸Phe∗#13.83±1.1814.89±0.3614.88±0.2615.28±0.3614.02±0.7114.34±1.13赖氨酸Lys∗△18.46±1.7018.50±1.6418.33±1.4818.44±0.8117.62±1.1718.93±1.23组氨酸His6.44±0.336.56±0.196.50±0.276.77±0.186.20±0.346.52±0.49精氨酸Arg△26.07±1.6526.29±0.4025.70±0.2127.27±0.5225.73±0.1625.97±0.85总氨基酸TAA364.59±22.87ab371.41±7.97ab362.75±2.09ab383.08±5.88a361.22±1.06b368.78±9.38ab总必需氨基酸TEAA113.42±7.38118.40±3.21115.80±1.32120.22±0.70113.93±0.84115.98±4.40呈味氨基酸FAA181.00±11.52ab183.17±3.35ab178.95±1.06b190.22±3.16a178.64±1.54b181.64±6.08ab药效氨基酸DEAA192.74±11.67197.05±4.11192.97±1.19201.30±3.48191.70±1.05195.44±5.68
注:*为必需氨基酸;△为药效氨基酸;#为呈味氨基酸。同行中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note: *,the essential amino acid; △,the effective amino acid;#,flavor amino acid.The means with different letters within the same line are significantly different in the groups at the 0.05 probability level, and the means with the same letters within the same line are not significant differences
3.2 不同藻类饲料对幼参消化道性状指数的影响
刺参消化系统分化水平较低,主要包括口、咽、胃囊、肠道及泄殖腔五个部分[22]。其中,食管和胃囊较短,黏膜层主要由假复柱状上皮构成,肌肉较为发达,其功能包括运输及机械处理食物,食管几乎不参与消化酶的分泌[22]。肠道是刺参进行食物消化及消化酶分泌的主要场所,其表面黏膜层向内凹陷形成褶皱可有效增大与食物接触面积,胃肠黏膜上皮的单细胞腺体可分泌消化酶,帮助食物消化[22-23]。肠道皮下覆盖着丰富的血窦,可有效地运输和吸收营养物质。消化道性状指数也是评价饲料培育效果的有效指标,在刺参营养与饲料研究中也有所应用[24]。本试验结果显示,各饲料组幼参的肠长和比肠长均未表现出显著差异,但在肠质量、比肠重及脏壁比上呈现一定差异,说明不同藻类饲料的投喂对刺参幼参消化道性状指数存在一定影响。本试验中,用越南大叶菜培育的幼参比肠重最高,优于传统饲料马尾藻及其他试验饲料,表明可以在幼参饲料中加入适量的越南大叶菜。但饲喂石莼和浒苔的幼参脏壁比均较低,且各饲料组幼参的脏壁比与各试验藻类的蛋白质含量成反比,因此,推测幼参的脏壁比主要受饲料蛋白质含量影响,已有研究表明,饲料中较高的蛋白质含量可有效降低刺参的脏壁比[24]。
3.3 不同藻类饲料对幼参免疫机制及消化生理的影响
刺参属于棘皮动物,与其他无脊椎动物一样,缺乏特异性免疫系统,其免疫应答主要通过体腔细胞的吞噬作用及免疫因子的分泌实现的,其主要作用是识别、清除异物及修复伤口[25]。影响刺参免疫的因素有很多,主要包括养殖温度、盐度、溶氧、饲料营养结构等[26]。刺参各组织中体腔液的免疫酶活性最高,对刺参的免疫功能起着非常重要的作用,因此,本试验中选取体腔液用于评价各饲料组刺参的免疫性能。本试验结果显示,浒苔的超氧化物歧化酶和总抗氧化能力均低于马尾藻,说明马尾藻促进刺参非特异性免疫的能力优于浒苔,这与杨星愿等[27]的研究结果一致;李旭等[28]研究表明,石莼有利于刺参体内蛋白质合成代谢,而其他饲料则能维持刺参较好的免疫能力,在本试验结果中石莼的总抗氧化能力最高,可能是因为石莼会产生较高的丙二醛,从而影响幼参本身的抗氧化能力;投喂越南大叶菜的幼参丙二醛含量最低,超氧化物歧化酶和过氧化氢酶也相对低于马尾藻组,且总抗氧化能力仅次于马尾藻和石莼组,这表明,投喂越南大叶菜对刺参的免疫能力的提高有较强的作用,菲律宾大叶菜总抗氧化能力仅次越南大叶菜,而印尼大叶菜的总抗氧化能力最低,说明不同地区的大叶菜对提高幼参的免疫能力不同,菲律宾和越南大叶菜优于印尼大叶菜。
刺参的消化系统分化较低,缺少特定的消化腺体,肠道可以分泌消化液起到消化腺的作用,因此,其肠道消化酶的活性可以侧面反映刺参对营养物质的消化吸收能力[4,16]。本试验中选取肠道胃蛋白酶、脂肪酶、淀粉酶及纤维素酶4种消化酶作为评价各组藻类饲料对幼参消化生理的影响。试验藻类饲料中浒苔和石莼的蛋白质含量最高,均达到其他4种饲料的3倍左右,饲喂浒苔和石莼的幼参胃蛋白酶活力也相对较高,可能是受饲料蛋白质含量的影响。饲料中添加菲律宾大叶菜投喂的幼参蛋白酶活性仅次于浒苔和石莼,说明菲律宾大叶菜也可增加幼参胃蛋白酶的活性,促进幼参对蛋白质的消化。与蛋白酶一样,脂肪酶也是内源性消化酶,但刺参食性可能以植物性食物为主[29],因此,对糖类有较强的消化能力,而对脂肪的消化能力则较弱,且在其他海参科动物的研究中也发现脂肪酶主要在海参的后肠部分才发挥作用[30]。普遍认为,由于刺参肠道pH与脂肪酶的最适pH存在差异,影响了脂肪酶的活性[31],但本研究中投喂印尼大叶菜的幼参脂肪酶活性仅次于投喂马尾藻的幼参且明显高于投喂其他饲料,说明饲料中添加适量印尼大叶菜可使幼参肠道内的脂肪酶活性增强,提高对饲料中脂肪的消化能力。淀粉酶也是刺参肠道中一种重要的消化酶,根据分解特性主要分为α-淀粉酶和β-淀粉酶两种,分别表现为耐热不耐酸和耐酸不耐热的特性[32],其活力较蛋白酶弱[31]。已有研究表明,淀粉酶活性会影响刺参生长。本试验结果表明,幼参饲料中适当添加浒苔对幼参肠道内淀粉酶的活性有较好的提高作用,这与杨宁等[33]的结论一致。纤维素酶是由多种可催化分解纤维素的水解酶所组成的一个复杂酶系,在中性或中性偏酸性条件下活性较好且受季节变化影响很小[31]。本试验中投喂浒苔的幼参肠道纤维素酶活性最低,这一结果与杨星愿等[27]的研究结果存在差异,原因可能与饲料来源有关,不同品种、采集时间和生长地点及投喂前对浒苔的处理情况的差异均会影响刺参对其的利用,从而影响肠道中的纤维素酶的活力。
3.4 不同藻类饲料对幼参体壁营养成分的影响
刺参体壁具有较高的食用和药用价值,其蛋白质含量丰富,脂肪和胆固醇含量较低,具有增强免疫力、延缓衰老等多种健体功效,其所特有的海参多糖、海参皂苷、海参多肽等生物活性物质在抗炎、抗癌及疾病预防等多个方面也都有较好的效果[10]。本试验结果显示,幼参阶段,各饲料组刺参体壁蛋白质含量无显著性差异,这与王长云等[34]和李丹彤等[5]的结果相似,说明6种不同海藻饲料对刺参发育过程中体壁蛋白质含量影响不明显。各饲料组在幼参体壁脂肪含量有明显的差异,但总体较其他研究者的结果偏高[2-3,5],这可能是因为试验中刺参的生长阶段不同,随着其生长发育体壁脂肪含量会有一个逐渐下降的过程。
刺参蛋白质的营养价值本质是氨基酸的构成及比例,研究表明,刺参体壁蛋白质中的氨基酸种类丰富,可与鸡蛋蛋白媲美[3,5]。幼参体壁中含量较高的氨基酸包括谷氨酸、甘氨酸和天冬氨酸,与李丹彤等[5]、李春燕等[3]及王长云等[34]的研究结果相一致。各饲料组幼参体壁的总氨基酸含量有明显差异,其中越南大叶菜组显著高于菲律宾大叶菜组,说明在幼参饲料中适当添加越南大叶菜可提高幼参体壁中氨基酸的含量,但各饲料组幼参体壁的总必需氨基酸含量无显著性变化。越南大叶菜组幼参体壁呈味氨基酸含量最高,与菲律宾大叶菜组及浒苔组有显著性差异,说明幼参阶段,投喂越南大叶菜对提高刺参的口感有所帮助。与必需氨基酸含量类似,各饲料组幼参体壁药效氨基酸含量无显著性差异,说明从氨基酸组成的角度看,这6种藻类饲料对刺参幼参体壁药用价值无明显的影响。
4 结论
越南大叶菜对幼参的生长与传统饲料马尾藻无明显差异,但比肠重、脏壁比、胃蛋白酶及淀粉酶活性等方面均优于马尾藻,越南大叶菜对幼参总抗氧化能力也较强,对幼参的免疫也有提高作用,且幼参体壁中粗脂肪含量、必需氨基酸及呈味氨基酸含量明显优于其他饲料,但在胃蛋白酶和纤维素酶活性等方面不如石莼。因此,越南大叶菜可代替部分马尾藻作为幼参配合饲料的主成分,能更好地满足幼参的生长营养需求,石莼可作为辅助性成分原料,有助于增加幼参饲料中蛋白质含量,提高幼参肠道中胃蛋白酶和纤维素酶活力,同时也为幼参的饲料配制提供更加广泛的原料资源。
[1] Dong Guancang,Dong Shuanglin,Tian Xiangli,et al.Effects of photoperiod on daily activity rhythm of juvenile sea cucumber,Apostichopus japonicus(Selenka)[J].Chinese Journal of Oceanology and Limnology,2011,29(5):1015-1022.
[2] 苏秀榕,娄永江,常亚青,等.海参的营养成分及海参多糖的抗肿瘤活性的研究[J].营养学报,2003,25(2):181-182.
[3] 李春艳,常亚青.海参的营养成分介绍[J].科学养鱼,2006(2):71-72.
[4] 李旭.刺参幼参饲料原料选择与蛋白质营养需求的研究[D].扬州:扬州大学,2013.
[5] 李丹彤,常亚青,陈炜,等.獐子岛野生刺参体壁营养成分的分析[J].大连水产学院学报,2006,21(3):278-282.
[6] 高岳.不同产地刺参多糖的分离纯化及其组分含量的研究[D].大连:大连海洋大学,2015.
[7] 向怡卉,苏秀榕,董明敏.海参体壁及消化道的氨基酸和脂肪酸分析[J].水产科学,2006,25(6):280-282.
[8] Svetashev V I,Levin V S,Lam C N,et al.Lipid and fatty acid composition of holothurians from tropical and temperate waters[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1991,98(4):489-494.
[9] Katzman R L,Jeanloz R W.The carbohydrate chemistry of invertebrate connective tissue[M]//Balazs E A.Chemistry and Molecular Biology of the Intercellular Matrix.London:Academic Press,1970,1:217-227.
[10] 樊绘曾.海参:海中人参-关于海参及其成分保健医疗功能的研究与开发[J].中国海洋药物,2001,20(4):37-44.
[11] 邹吉新,李源强,刘雨新,等.鼠尾藻的生物学特性及筏式养殖技术研究[J].齐鲁渔业,2005,22(3):25-28.
[12] 史策.鲜活菱形筒柱藻(硅藻)对刺参饵料效果的研究[D].青岛:中国海洋大学,2014.
[13] Sun Huiling,Liang Mengqing,Yan Jingping,et al.Nutrient requirements and growth of the sea cucumber,Apostichopus japonicus[R].Qingdao:Yellow Sea Fisheries Research Institute,2004.
[14] 郭娜.不同饲料对刺参(Apostichopus japonicus)生长、消化生理和能量收支的影响[D].青岛:中国海洋大学,2011:1-75.
[15] Zhao Ziguo,Zhao Fengjuan,Yao Jianting,et al.Early development of germlings of Sargassum thunbergii(Fucales,Phaeophyta)under laboratory conditions[J].Journal of Applied Phycology,2008,20(5):925-931.
[16] 刘营.不同饲料对刺参(Apostichopus japonicus)生长及能量收支的影响及机制[D].青岛:中国海洋大学,2010.
[17] 周永亮.刺参的稳定同位素组成及其环境因子研究[D].大连:大连海事大学,2016.
[18] 刘朝阳,孙晓庆.石莼的综合开发与利用前景[J].饲料广角,2006(17):35-37.
[19] 朱建新,刘慧,冷凯良,等.几种常用饵料对稚幼参生长影响的初步研究[J].海洋水产研究,2007,28(5):48-53.
[20] 廖梅杰,郝志凯,尚德荣,等.浒苔营养成分分析与投喂刺参试验[J].渔业现代化,2011,38(4):32-36.
[21] 吴国均,姚国兴,张曹进,等.4种不同饵料对刺参生长影响试验[J].水产养殖,2013,34(4):1-3.
[22] 崔龙波,董志宁,陆瑶华.仿刺参消化系统的组织学和组织化学研究[J].动物学杂志,2000,35(6):2-4.
[23] 王霞.刺参消化道与呼吸树再生和夏眠的组织学研究[D].大连:大连水产学院,2004.
[24] 朱伟,麦康森,张白刚,等.刺参稚参对蛋白质和脂肪需求量的初步研究[J].海洋科学,2005,29(3):54-58.
[25] Coffaro K A,Hinegardner R T.Immune response in the sea urchin Lytechinus pictus[J].Science,1977,197(4311):1389-1390.
[26] 王吉桥,张筱墀,姜玉声,等.盐度骤降对幼仿刺参生长、免疫指标及呼吸树组织结构的影响[J].大连水产学院学报,2009,24(5):387-392.
[27] 杨心愿,林承刚,宋肖跃,等.不同产地浒苔对幼刺参生长、消化和非特异性免疫的影响[J].海洋与湖沼,2018,49(5):1103-1108.
[28] 李旭,章世元,陈四清,等.四种饲料原料对刺参蛋白质代谢及免疫功能的影响[J].广东饲料,2014,23(10):29-32.
[29] 任庆印,潘鲁青.刺参消化酶性质与活性分布的研究[J].海洋湖沼通报,2013(2):51-56.
[30] Féral J P.Activity of the principal digestive enzymes in the detritivorous apodous holothuroid Leptosynapta galliennei and two other shallow-water holothuroids[J].Marine Biology,1989,101(3):367-379.
[31] 姜令绪,杨宁,李建,等.温度和pH对刺参(Apostichopus japonicus)消化酶活力的影响[J].海洋与湖沼,2007,38(5):476-480.
[32] 孙永欣.黄芪多糖促进刺参免疫力和生长性能的研究[D].大连:大连理工大学,2008.
[33] 杨宁,郭中帅,王正丽.饲料中添加浒苔对仿刺参幼参生长、消化酶活性和免疫力的影响[J].水产科学,2016,35(5):498-503.
[34] 王长云,李八方.三种海珍品蛋白质营养价值的评价[J].中国海洋药物,1993(2):24-29.