红鳍东方鲀Takifugu rubripes俗称河豚,为近海底层肉食性鱼类,主要分布于北太平洋西部的日本、朝鲜半岛和中国沿海,因其肉质鲜美、价值 较高,广受消费者的喜爱,是具有重要经济价值的鱼种之一[1-2]。在硬骨鱼类生长、发育、繁殖过程中,诸多环境因子对其内在的生理、生化和行为产生影响,如温度、食物、光周期等[3-4]。在这些环境因子中,光周期被认为是首要的授时因子,光周期为激素的合成和释放(即褪黑素)提供内部同步信号,进而影响鱼类的生理节律性及相关的生理功能[5]。稳定的节律是保证海水鱼类正常生长发育的必要条件。在非哺乳类脊椎动物中,光信号通过神经通路传递到松果体,这些信号控制着多种激素的分泌,如生长激素、褪黑素、生殖激素等[6-7],而激素的分泌与其相应的基因表达密切相关,故许多研究从基因层面探究环境因子对动物的影响。
光环境因子在水生生物生长发育过程中起着重要作用,其直接或间接作用于内分泌系统,从而对生长发育产生影响[8-11]。生长激素(Growth hormone,GH)和生长抑制激素(Somatostatin,SS)是调节生物体生长的重要内在因子,激素的分泌又受其相应基因表达的控制。有研究表明,红鳍东方鲀在红光条件下SS基因的表达水平高于绿光组,而GH基因在蓝、绿、红光下的表达水平无显著性差异[2],这表明光色对红鳍东方鲀SS和GH基因的表达具有调控作用,而光周期对红鳍东方鲀SS和GH基因的影响鲜有报道。光环境因子不仅可以影响生长相关基因的表达量,还对这些基因的昼夜表达模式产生影响。有研究表明,点蓝子鱼Siganus guttatus的GH基因表达在正常光照条件下(12L∶12D),遵循黑暗阶段表达量高、光照阶段表达量低的昼夜变化模式;在全天光照组(24L∶0D),GH基因表达的昼夜模式消失,其表达水平在全天表现均较稳定;在全天黑暗组(0L∶24D),GH基因的表达变得不规则,时高时低,未呈现出昼夜模式[3]。
目前,国内外对于红鳍东方鲀生长相关基因的表达量及昼夜表达模式研究较少,而有关光周期对这些基因的影响也未见文献报道。因此,本研究中研究了红鳍东方鲀幼鱼时期脑组织中GH和SS基因在不同光周期下的表达水平及昼夜变化情况,旨在探究光周期对其表达量和表达模式的影响规律与机制,丰富红鳍东方鲀的生态学理论,为其健康养殖提供理论依据。
1 材料与方法
1.1 材料
试验用红鳍东方鲀幼鱼(3月龄左右)购于大连天正实业有限公司,暂养于大连海洋大学水产设施养殖与装备技术研究中心,待其适应环境正常摄食后,选取健康、规格一致的幼鱼(体质量为7.89 g±0.42 g,体长为7.12 cm±0.53 cm)用于试验。
试验用RNA提取试剂盒RNAfast200由飞捷生物公司提供,RNA反转录试剂盒TransScript© One-Step gDNA Removal and cDNA SuperMix由全式金公司提供,荧光定量PCR试剂盒FastStart Essential DNA Green Master 购于Roche公司。
1.2 方法
1.2.1 试验设计 试验在两间密闭遮光的养殖池内进行,遮光材料选用深灰色遮光布,每个养殖池内设置4个试验隔间,每个试验隔间放置3个试验桶(直径80 cm、深50 cm)。试验在其中5个独立的试验隔间内进行。光源采用LED新型光源(CK 54,深圳市超频三科技股份有限公司),光色为白色(λ400~780 nm),选取5种光周期,分别为8L∶16D(光照时间 8:00—16:00)、12L∶12D(光照时间8:00—20:00)、16L∶8D(光照时间 8:00—24:00)、20L∶4D(光照时间 8:00—次日4:00)和24L∶0D(光照时间 8:00—次日8:00),水面的光辐照度设定为200 mW/m2。
试验开始时,每个光周期处理组内设置3个平行组,共15个试验桶,清洗消毒后的每个试验桶内养殖60尾红鳍东方鲀幼鱼。试验期间,海水温度控制在19~23 ℃,盐度为31~32, pH为7.5~7.8,溶氧>6 mg/L,每天8:30投喂一次,按体质量的2.2%进行投喂,每天换水一次,每周测定水质参数一次,试验周期共30 d。试验结束后,进行24 h全天取样,从8:00开始每隔4 h取一次样品,从每个桶中随机选取3尾鱼取其脑组织用于测定。整个取样过程均在碎冰上进行,脑组织取出后用液氮冷冻后于冰箱(-80 ℃)中保存备用。
1.2.2 总RNA的提取和基因表达量的测定 将冻存的样品取出后,按照总RNA提取试剂盒(RNAfast200)说明书,对脑组织样品进行总RNA提取,利用微量分光光度计(SMA4000,merinton)所测定的RNA样品OD260 nm/OD280 nm值确定其浓度,根据 OD260 nm/OD280 nm 的比值判断总 RNA 纯度,经10 g/L琼脂糖凝胶电泳检测RNA 质量。
按照TransScript© One-Step gDNA Removal and cDNA SuperMix说明书步骤将RNA反转成cDNA,以cDNA为模板使用LightCycle96 (Roche罗氏)仪器和 SG Fast qPCR Master Mix(2X) (BBI,Roche罗氏)试剂盒进行荧光定量PCR试验。采用Primer 5软件并根据GenBank中的cDNA全序列设计特异性引物GH、SS,引物序列见表1。PCR反应条件为:95 ℃下预变性3 min;95 ℃下变性10 s,60 ℃下退火10 s,72 ℃下延伸30 s,共进行45个循环,反应体系为20 μL。试验结束后对溶解曲线进行分析。所有的PCR过程中,每个RNA样品均设3个重复。以β-actin作为内参基因计算其2-ΔΔCt值。
表1 实时荧光定量PCR引物
Tab.1 Primers for RT-qPCR
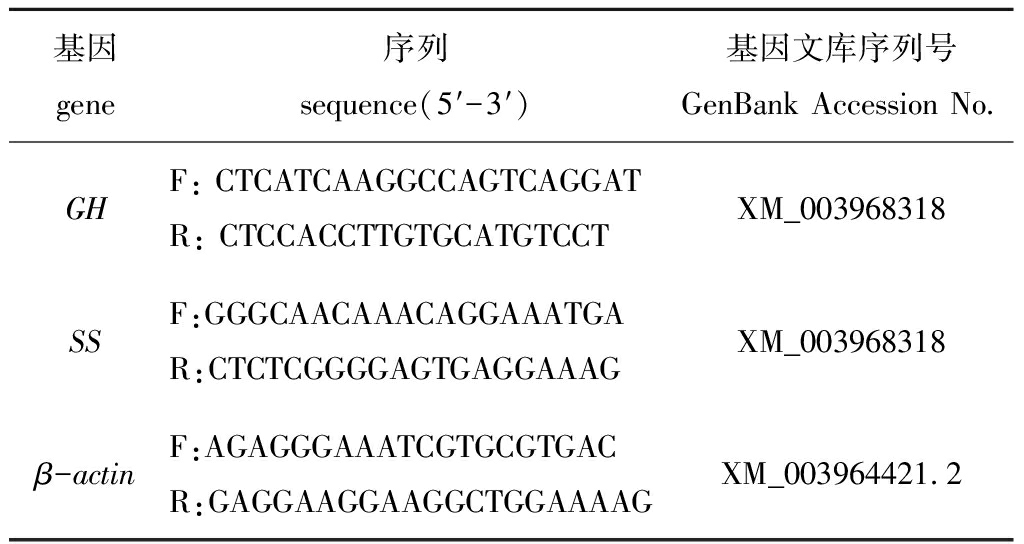
基因gene序列 sequence(5′-3′)基因文库序列号GenBank Accession No.GHF: CTCATCAAGGCCAGTCAGGATR: CTCCACCTTGTGCATGTCCTXM_003968318SSF:GGGCAACAAACAGGAAATGAR:CTCTCGGGGAGTGAGGAAAGXM_003968318β-actinF:AGAGGGAAATCGTGCGTGACR:GAGGAAGGAAGGCTGGAAAAGXM_003964421.2
1.3 数据处理
试验数据均以平均值±标准差 (mean±S.D.)表示,运用SPSS 17.0软件进行单因素方差分析(One-way ANOVE),采用LSR法进行多重比较,检验显著性水平为0.05。
2 结果与分析
2.1 红鳍东方鲀幼鱼脑组织中GH和SS基因表达量的变化
从图1可见:GH基因的相对表达量在8L∶16D光照条件下最高且显著高于其他光周期处理组(P<0.05),GH基因在其他处理组的相对表达量依此为12L∶12D>16L∶8D>20L∶4D>24L∶0D;SS基因的相对表达量在8L∶16D光照条件下最高且显著高于24L∶0D处理组(P<0.05),其他处理组间SS基因相对表达量均无显著性差异(P>0.05)。
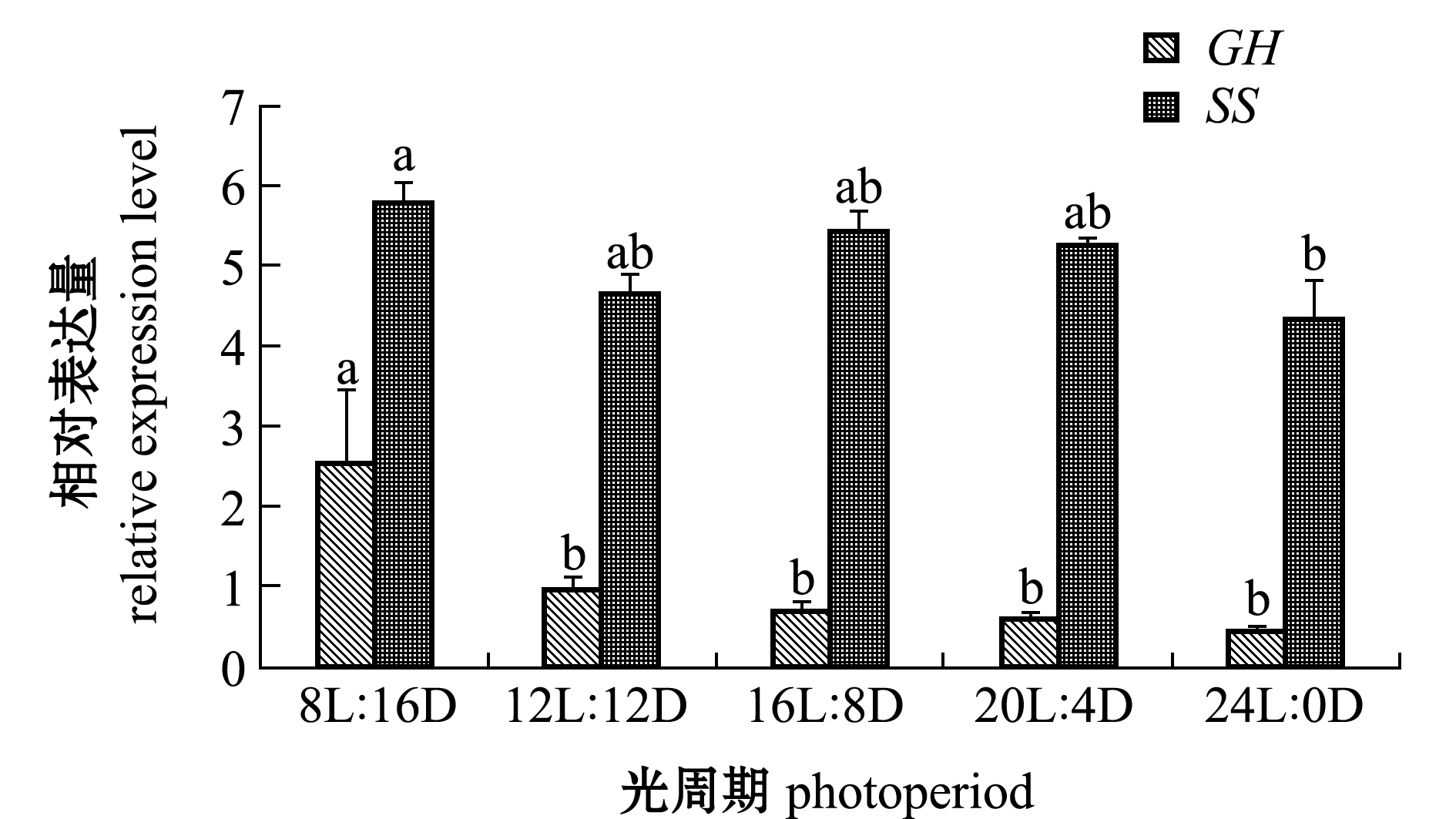
注:标有不同字母者表示同一基因在不同光周期下的相对表达量有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note: The means with different letters indicate significant differences in different photoperiods in same gene (P<0.05),and the means with same letters are not significant differences (P>0.05)
图1 不同光周期下GH和SS基因的相对表达量
Fig.1 Relative expression levels of GH and SS genes under different photoperiods
2.2 GH基因的昼夜表达模式
从图2可见:不同光周期下,GH基因的昼夜表达量表现出不同模式;在8L∶16D光照条件下,GH基因表达量整体呈下降趋势,其中,高峰值出现在凌晨4:00,此时其相对表达量均显著高于其他时间点的表达量(P<0.05);在12L∶12D光照条件下,GH基因的相对表达量整体上呈现先下降后上升的趋势,在光照阶段12:00 时 GH基因表达量最低,而在黑暗阶段20:00 时出现一次高峰值;在16L∶8D和20L∶4D 光照条件下,GH基因在4:00 时相对表达量最高均显著高于其他时间点(P<0.05),光照阶段的GH基因表达量总体低于黑暗阶段的表达量,出现昼低夜高表达模式;在24L∶0D光照条件下,GH基因表达呈脉动式,在4:00 h和16:00 h分别出现一次峰值。
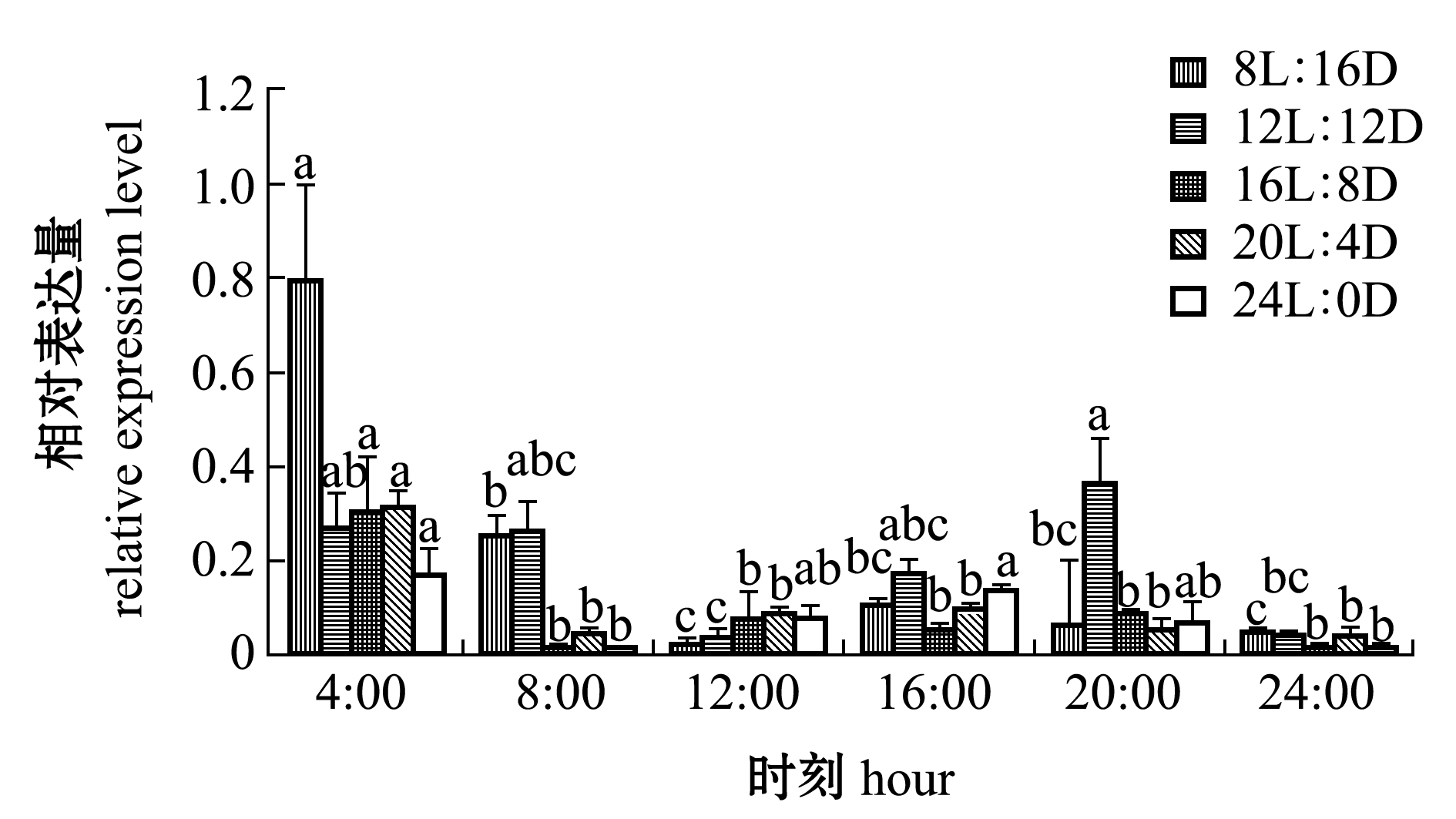
注:标有不同字母者表示同一光周期下不同时刻间基因表达量存在显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters indicate significant differences in different hous in same photoperiod (P<0.05),and the means with same letters are not significant differences (P>0.05),et sequentia
图2 GH基因表达量随时间的变化
Fig.2 Changes in expression levels of GH gene with time
2.3 SS基因的昼夜表达模式
从图3可见:不同光周期下,SS基因的昼夜表达量也表现出不同模式;在8L∶16D光照条件下,SS基因在8:00—16:00时表达量呈下降趋势,在16:00 时表达量至最低且显著低于4:00(P<0.05),在20:00—24:00时表达量有上升的趋势,SS基因的表达遵循昼低夜高模式;在12L∶12D光照条件下,SS基因的相对表达量在光照阶段呈下降趋势;在16L∶8D光照条件下,SS基因的表达量在黑暗和光照阶段时高时低,呈无规则状态,均在16:00 时出现一次峰值;在20L∶ 4D光照条件下,SS基因在16:00时出现一次高峰值且表达量显著高于其他时间点(P<0.05);在24L∶0D条件下,SS基因的相对表达量在各组间无明显变化。
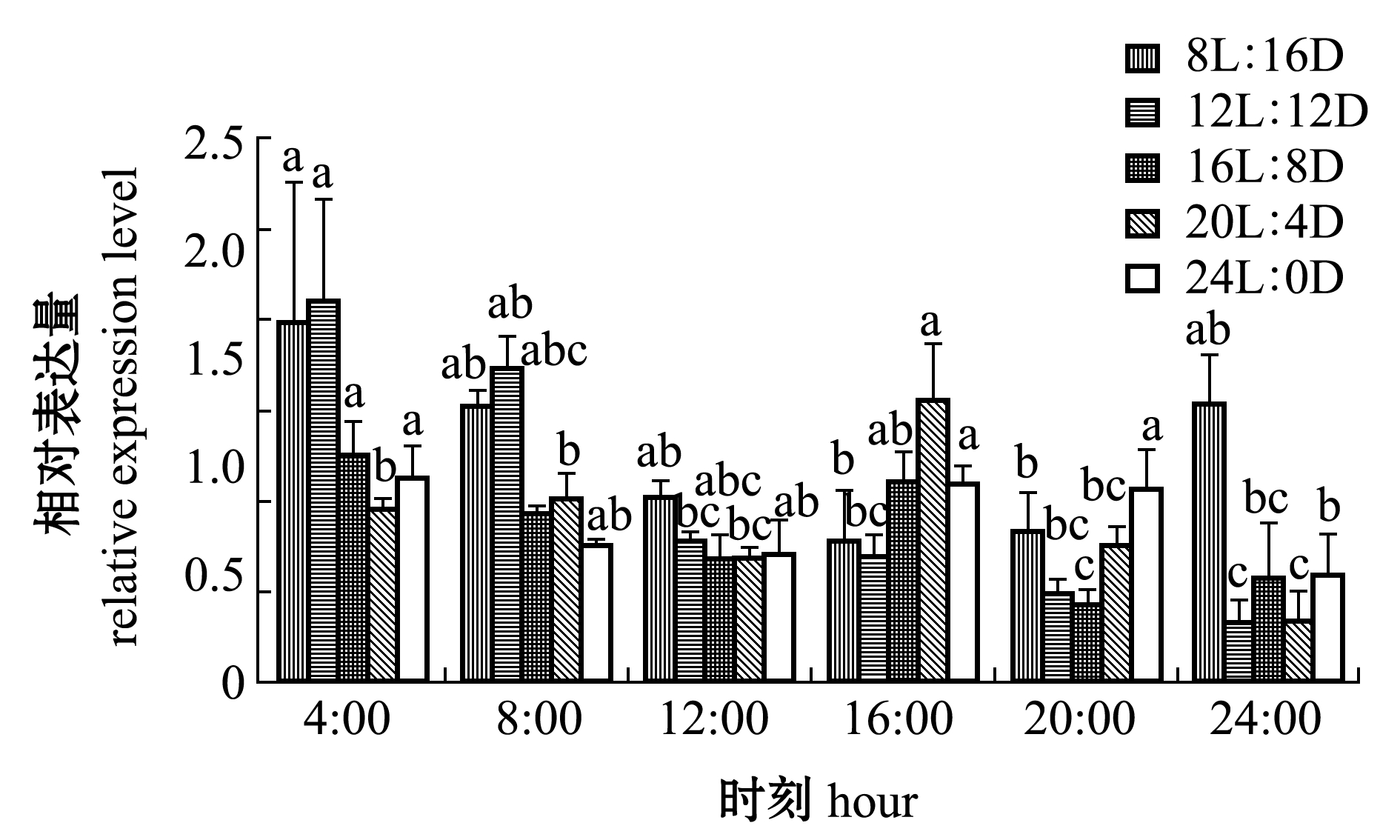
图3 SS基因表达量随时间的变化
Fig.3 Changes in expression levels of SS gene with time
3 讨论
3.1 光周期对GH和SS基因相对表达水平的影响
光周期是影响鱼类生长发育、性成熟、繁殖、迁移等的重要环境因子[12-13],其可以通过影响生长相关激素的水平调控鱼类生长[14]。由脊椎动物垂体释放的生长激素(GH)具有促进生长的作用,而GH分泌受到生长激素抑制素(SS)的控制,共同影响脊椎动物的生长发育。本试验中,研究了5种光周期(8L∶16D、12L∶12D、16L∶8D、20L∶4D、24L∶0D)对GH和SS基因的表达情况。结果表明,随着光照时间的延长,GH基因的表达量逐渐减少,在8L∶16D光周期处理下的GH基因表达量最高且显著高于其他处理组。除此之外,在8L∶16D光周期处理下SS基因的相对表达量最高但仅显著高于24L∶0D处理组。对大西洋鲑Salmon salar幼鱼的研究表明,延长光照时间可以显著提高GH的分泌水平[15-16]。但李大鹏[17]对史氏鲟Acipenser schrenckii的研究表明,不同光周期(24L∶0D、0L∶24D、自然光)条件下GH的分泌水平无显著性差异。目前,相关研究领域尚未见到光周期对生长抑制素的报道,而对其他光照因子方面的研究表明,红鳍东方鲀幼鱼的SS基因在红光条件下的表达量显著高于绿光组,而GH基因在蓝、红、绿光条件下无显著性差异[2]。光信号可通过神经通路从视网膜传递到松果体,进而控制着各种激素的分泌[3,7,18],其中包括与生长相关的激素(GH、SS),光周期作为光照三因子之一在激素调控方面也发挥着重要作用,由于不同鱼类栖息环境有所不同,它们对外界环境变化的适应能力也不同,因此,光周期对不同鱼类激素分泌的影响具有一定的种属特异性[19]。
3.2 光周期对GH和SS基因昼夜表达模式的影响
在许多脊椎动物中,血浆和脑组织中GH的分泌不是连续的,而是脉动的,通常遵循昼夜表达模式[3]。但也有研究表明,鲑鱼Oncorhynchus tshawytscha血浆中GH分泌呈现脉动式,而虹鳟Oncorhynchus mykiss血浆中GH分泌则是不规则的,一天中会出现一个或几个峰值[20-22]。还有研究发现,虹鳟血浆GH水平的日变化存在昼低夜高模式[23-24]。本试验结果显示,在8L∶16D条件下,红鳍东方鲀幼鱼GH基因的表达总体呈现降低趋势,未发现明显的昼夜模式。在12L∶12D条件下,GH基因的表达遵循光照阶段低、黑暗阶段高的模式,这与对点蓝子鱼的研究结果相似[3]。在24L∶0D条件下,GH基因的表达呈脉动式,在16:00 时出现一次峰值,这与对点蓝子鱼脑组织中GH基因在长期光照中的表达模式不同[3]。有研究表明,光周期对不同鱼类的影响不同,在对虹鳟的研究中发现,血浆中GH基因表达的峰值频率和时间也与光周期不同步[20]。探究光周期影响GH基因表达的内部原因试验显示,在12L∶12D光周期条件下点蓝子鱼GH基因的表达模式与褪黑素的表达模式相似,呈现出昼低夜高的模式[25],根据鱼类中已有研究分析表明,褪黑素通过直接作用于垂体细胞来调节GH的分泌[26]。
SS是调节脊椎动物脑组织GH合成和分泌的重要激素之一[27-28]。目前,在鱼类研究中对SS基因昼夜表达模式的研究涉及的较少[29]。有报道显示,在12L∶12D光周期条件下,红鳍东方鲀脑组织中SS基因的表达量遵循黑暗阶段高、光照阶段低的模式;而在24L∶0D光照条件下,SS基因未出现昼低夜高表达模式[30]。本试验中,在24L∶0D光照条件下,SS基因表达量无显著昼夜变化,这与之前的研究结果类似;在12L∶12D光照条件下,未出现昼低夜高的表达模式,这可能与鱼的规格有关,先前的研究采用的试验对象规格为128.4 g[30],而本试验采用的规格为7.89 g;在8L∶16D光照条件下,遵循昼夜模式,SS基因有光阶段的表达水平低于黑暗阶段。但在16L∶8D和20L∶4D光照条件下,SS基因的表达时高时低,呈现无规则状态,未呈现出昼低夜高的表达模式。有研究表明,在光周期为24L∶0D和12L∶12D条件下,SS基因昼夜表达模式与褪黑素的昼夜分泌模式相似,均呈现出昼低夜高的模式[30]。分析认为,褪黑素是由松果体分泌的一类吲哚衍生的激素,作为光周期信号调节昼夜节律,其主要的分泌特征为白天分泌少夜晚分泌多[30-31],而褪黑素的分泌会影响鱼类生理活动,包括生长[32-33]。由此可以推测,红鳍东方鲀幼鱼GH和SS基因的昼夜表达模式可能与其褪黑素相关,在对莫桑比克罗非鱼的研究中也发现,血浆褪黑素水平在夜间增加,在白天减少[34]。今后将有待进一步验证GH和SS基因的昼夜模式与褪黑素昼夜分泌节律之间的相关性。
4 结论
本研究中通过监测不同光周期下红鳍东方鲀脑组织中GH和SS基因的表达量规律,探究鱼类对光环境的生理反应,得出如下结论:在8L∶16D光周期下GH基因表达量更高,且显著高于其他处理组(P<0.05),而8L∶16D组SS基因的相对表达量显著高于24L∶0D组(P<0.05),这说明SS基因与GH 基因间存在相互平衡作用;GH基因在12L∶12D条件下的表达水平呈现昼低夜高的特点,而SS基因在8L∶16D条件下的表达水平呈现昼低夜高的表达特点,因此,在红鳍东方鲀幼鱼养殖过程中可以考虑用短时间光照(8-12h/d)。本研究结果可为红鳍东方鲀幼鱼的养殖提供参考依据。
[1] 魏平平,李鑫,费凡,等.光谱对红鳍东方鲀仔稚鱼生长及相关基因表达量的影响[J].大连海洋大学学报,2019,34(5):668-673.
[2] Kim B H,Hur S P,Hur S W,et al.Relevance of light spectra to growth of the rearing tiger puffer Takifugu rubripes[J].Development & Reproduction,2016,20(1):23-29.
[3] Ayson F G,Takemura A.Daily expression patterns for mRNAs of GH,PRL,SL,IGF-I and IGF-II in juvenile rabbitfish,Siganus guttatus,during 24-h light and dark cycles[J].General and Comparative Endocrinology,2006,149(3):261-268.
[4] Villamizar N,Blanco-Vives B,Migaud H,et al.Effects of light during early larval development of some aquacultured teleosts:a review[J].Aquaculture,2011,315(1-2):86-94.
[5] Bromage N,Porter M,Randall C.The environmental regulation of maturation in farmed finfish with special reference to the role of photoperiod and melatonin[J].Aquaculture,2001,197(1-2):63-98.
[6] Moore A F,Menaker M.The effect of light on melatonin secretion in the cultured pineal glands of Anolis lizards[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2011,160(2):301-308.
[7] Hur S P,Takeuchi Y,Esaka Y,et al.Diurnal expression patterns of neurohypophysial hormone genes in the brain of the threespot wrasse Halichoeres trimaculatus[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2011,158(4):490-497.
[8] 郭玲玲,赵文,杨为东,等.光照对马来沙水母幼体生长的影响[J].大连海洋大学学报,2012,27(1):18-21.
[9] 周显青,牛翠娟,李庆芬.光照对水生动物摄食、生长和存活的影响[J].水生生物学报,2000,24(2):178-181.
[10] 冯广朋,庄平,章龙珍,等.温度对中华鲟幼鱼代谢酶和抗氧化酶活性的影响[J].水生生物学报,2012,36(1):137-142.
[11] 刘涵,姜玉声,栾攀,等.不同颜色光照对日本蟳摄食与生长的影响[J].大连海洋大学学报,2012,27(6):528-533.
[12] Imsland A K,Folkvord A,Stefansson S O.Growth,oxygen consumption and activity of juvenile turbot (Scophthalmus maximus L.) reared under different temperatures and photoperiods[J].Netherlands Journal of Sea Research,1995,34(1-3):149-159.
[13] Porter M J R,Randall C F,Bromage N R,et al.The role of melatonin and the pineal gland on development and smoltification of Atlantic salmon (Salmo salar) parr[J].Aquaculture,1998,168(1-4):139-155.
[14] Björnsson B T.The biology of salmon growth hormone:from daylight to dominance[J].Fish Physiology and Biochemistry,1997,17(1-6):9-24.
[15] 仇登高,徐世宏,刘鹰,等.光环境因子对循环水养殖系统中大西洋鲑生长和摄食的影响[J].中国水产科学,2015,22(1):68-78.
[16] Björnsson B T,Hemre G I,Bjørnevik M,et al.Photoperiod regulation of plasma growth hormone levels during induced smoltification of underyearling Atlantic salmon[J].General and Comparative Endocrinology,2000,119(1):17-25.
[17] 李大鹏.环境因子对史氏鲟生长的影响及其调控机制的研究[D].武汉:华中农业大学,2003.
[18] Revel F G,Saboureau M,Masson-Pévet M,et al.Kisspeptin mediates the photoperiodic control of reproduction in hamsters[J].Current Biology,2006,16(17):1730-1735.
[19] Boeuf G,Le Bail P Y.Does light have an influence on fish growth?[J].Aquaculture,1999,177(1-4):129-152.
[20] Le Bail P Y,Sumpter J P,Carragher J F,et al.Development and validation of a highly sensitive radioimmunoassay for chinook salmon (Oncorhynchus tshawytscha) growth hormone[J].General and Comparative Endocrinology,1991,83(1):75-85.
[21] Niu P D,Perez-Sanchez J,Le Bail P Y.Development of a protein binding assay for teleost insulin-like growth factor (IGF)-like:relationships between growth hormone (GH) and IGF-like in the blood of rainbow trout (Oncorhynchus mykiss)[J].Fish Physiology and Biochemistry,1993,11(1-6):381-391.
[22] Gomez J M,Boujard T,Fostier A,et al.Characterization of growth hormone nycthemeral plasma profiles in catheterized rainbow trout (Oncorhynchus mykiss)[J].Journal of Experimental Zoology,1996,274(3):171-180.
[23] Holloway A C,Reddy P K,Sheridan M A,et al.Diurnal rhythms of plasma growth hormone,somatostatin,thyroid hormones,cortisol and glucose concentrations in rainbow trout,Oncorhynchus mykiss,during progressive food deprivation[J].Biological Rhythm Research,1994,25(4):415-432.
[24] Reddy P K,Leatherland J F.Does the time of feeding affect the diurnal rhythms of plasma hormone and glucose concentration and hepatic glycogen content of rainbow trout?[J].Fish Physiology and Biochemistry,1994,13(2):133-140.
[25] Takemura A,Susilo E S,Rahman S,et al.Perception and possible utilization of moonlight intensity for reproductive activities in a lunar-synchronized spawner,the golden rabbitfish[J].Journal of Experimental Zoology Part A:Comparative Experimental Biology,2004,301A(10):844-851.
[26] Falcón J,Besseau L,Fazzari D,et al.Melatonin modulates secretion of growth hormone and prolactin by trout pituitary glands and cells in culture[J].Endocrinology,2003,144(10):4648-4658.
[27] Bertherat J,Bluet-Pajot M T,Epelbaum J.Neuroendocrine regulation of growth hormone[J].European Journal of Endocrinology,1995,132(1):12-24.
[28] Sheridan M A,Hagemeister A L.Somatostatin and somatostatin receptors in fish growth[J].General and Comparative Endocrinology,2010,167(3):360-365.
[29] 杨靖,井上慎一.大鼠交叉上核中SS和VIPmRNA昼夜节律的研究[J].动物学报,1995,41(3):322-326.
[30] Kim B H,Hur S P,Hur S W,et al.Circadian rhythm of melatonin secretion and growth-related gene expression in the tiger puffer Takifugu rubripes[J].Fisheries and Aquatic Sciences,2017,20:17.
[31] 汪晓飞,刘志民,彭树勋.褪黑素:一个多功能的光周期信号[J].生理科学进展,1998,29(3):281-287.
[32] Taylor J F,Migaud H,Porter M J R,et al.Photoperiod influences growth rate and plasma insulin-like growth factor-I levels in juvenile rainbow trout,Oncorhynchus mykiss[J].General and Comparative Endocrinology,2005,142(1-2):169-185.
[33] Herrero M J,Martínez F J,Míguez J M,et al.Response of plasma and gastrointestinal melatonin,plasma cortisol and activity rhythms of European sea bass (Dicentrarchus labrax) to dietary supplementation with tryptophan and melatonin[J].Journal of Comparative Physiology B-Biochemical,Systemic,and Environmental Physiology,2007,177(3):319-326.
[34] Nikaido Y,Ueda S,Takemura A.Photic and circadian regulation of melatonin production in the Mozambique tilapia Oreochromis mossambicus[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2009,152(1):77-82.