Hepcidin是一种主要由肝脏产生的分泌肽激素,是铁摄入和全身铁稳态的主要调节因子,属于富含半胱氨酸且具有二硫键结构的抗菌肽超家族[1-2]。它首先在人体血液和尿液中被鉴定为先天性免疫抗菌肽,后来发现其主要由肝脏分泌,又称之为肝脏表达的抗菌多肽[1,3]。Hepcidin在体内或体外具有抑制细菌、真菌、原生动物生长和抑制肿瘤的作用[4],可作为机体抵御病原入侵的第一道防线。目前,对鱼类抗菌肽的研究较广泛,主要涉及免疫、抗菌、抗病毒、抗肿瘤等[5]。已从大西洋鳕Gadus morhua、大菱鲆Scophthalmus maximus、虹鳟Oncorhynchus mykiss等鱼中克隆到抗菌肽[6]。根据功能和来源,抗菌肽又可分为Hepcidin、Cathelicidins、Chrysophsins、LEAP-2、Pleurocidin等几种类型。研究发现,重组表达的斑点叉尾鮰 Ietalurus punetaus Hepcidin蛋白对大肠杆菌 E.coli、铜绿假单胞菌P.aeruginosa的生长有抑制作用[7]。重组表达的鲤 Cyprinus carpio Hepcidin蛋白对大肠杆菌E.coli有抑制作用,而对金黄色葡萄球菌 S. aureus未表现出抑制作用[8]。人工合成的海水青鳉Oryzias melastigmus抗菌肽OmHep1和pro-OmHep1可抑制红螯螯虾 Cherax quadricarinatus体内白斑综合征病毒(WSSV)的复制[9]。莫桑比克罗非鱼Oreochromis mossambicus抗菌肽TH2-3的成熟肽能明显抑制人纤维肉瘤细胞的增殖和转移[10]。由此可见,抗菌肽不仅对细菌类病原有抑制作用,而且在抗病毒和抗肿瘤中也发挥着重要作用。
太平洋鳕 Gadus macrocephalus 又称大头鳕,是鳕科重要的海洋经济种类,该鱼在中国黄渤海的资源日益减少,而人工繁育又面临神经坏死病毒的困扰[11-13],为此,本研究中拟在前期转录组基础上克隆太平洋鳕抗菌肽Hepcidin(GmHep)的基因序列,并揭示其在太平洋鳕不同组织和发育早期的表达模式,利用基因工程手段构建GmHep的原核表达载体,优化表达条件,获得表达产物,旨在为开发太平洋鳕抗菌肽奠定基础,为解决太平洋鳕人工繁育提供新的思路。
1 材料与方法
1.1 材料
试验用太平洋鳕成鱼采自大连市旅顺口区附近海域,平均体质量为2.438 kg,均已性成熟,取发育较好的成鱼进行人工授精,受精卵孵化后第5、10、30、37、40 d时分别取5尾仔鱼;另取3尾成鱼的肝、肾、脾、脑、肠、鳃、肌肉组织用于组织差异表达分析。各样品用液氮速冻后转移至-80 ℃超低温冰箱中保存备用。
1.2 方法
1.2.1 总RNA提取及cDNA合成 总RNA提取方法参照Tripure Reagent(罗氏)说明书进行,采用NV 3000 微量分光光度计检测RNA浓度,用15 g/L琼脂糖凝胶电泳检测总RNA的质量和完整性。经DNaseⅠ处理500 ng总RNA去除基因组DNA后,按照反转录试剂盒(TaKaRa)说明书进行反转录合成cDNA,置于-20 ℃下保存。
1.2.2 GmHep基因克隆及测序 根据本实验室前期转录组数据获得的太平洋鳕GmHep基因序列,利用Primer Premier 5.0设计合成引物(GmHep-F1:5′ATGAAGGCATTCAGCATTGCAGTTG 3′; GmHep-R1:5′AACGTGAGGGACTAGAATTTGC 3′),由生工生物工程(上海)股份有限公司合成。以太平洋鳕肝脏cDNA为模板进行PCR,扩增获得GmHep基因片段序列。回收PCR产物与pMD18-T载体(TaKaRa)连接,并转化至感受态细胞DH5α中,挑取阳性克隆送至生工生物工程(上海)股份有限公司进行测序。
1.2.3 基因序列生物信息学分析 利用软件DNAMan对基因序列和氨基酸序列进行预测分析;利用软件BioEdit和MEGA 5.0对Hepcidin氨基酸序列进行同源比对并构建系统进化树。同源序列由BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)数据库检索获得。利用SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)对GmHep氨基酸序列进行信号肽结构预测;用ExPASy(https://www.expasy.org/)在线分析工具进行蛋白分子量和等电点的分析预测。
1.2.4 GmHep组织分布及发育早期表达模式 根据太平洋鳕GmHep和内参基因β-actin序列,利用软件Primer Premier 5.0设计荧光定量引物(GmHep-qF: 5′ TGGCAGGATACTGGATGA 3′,GmHep-qR: 5′AAATGCCACAGCCCTTCT 3′;β-actqF: 5′ATCCGTAAGACCTGTATGC 3′,β-actqR: 5′AGTATTTACGCTCAGGTGGG 3′),分别以各个组织cDNA和不同日龄幼鱼cDNA为模板,进行Real-time PCR(qPCR)反应。组织差异表达以鳃组织作为对照组进行相对定量分析,不同发育时期的样品以5日龄样品为对照组进行相对定量分析,数据经SPSS 13.0软件分析,以0.05为显著性水平。
1.2.5 GmHep原核载体构建及表达条件优化 设计含有EcoRI和XhoI酶切位点的引物(GmHep-exp-F1: 5′ CGGAATTCATGGCCACCGTCCGCTGGG- CGGGCAG 3′;GmHep-exp-R1: 5′CCGCTCGAGCTAGAATTTGCAGCAAATG 3′,下划线为酶切位点序列),以GmHep基因为模板进行PCR,PCR产物经切胶回收后,利用EcoRI和XhoI酶对PCR产物进行双酶切,同时也对原核表达载体pET-32a进行双酶切,使用T4 DNA连接酶对两个酶切产物进行连接,连接产物转化至感受态细胞E.coli BL21 (DE3)中。原核表达载体的诱导表达及条件优化参照文献[14-15]。
1.2.6 GmHep亚细胞定位 根据GmHep的开放阅读框(ORF)序列和pEGFP-N1表达载体酶切位点序列设计特异引物(GmHep-exp-F2:5′ ATCAAGCTTATGGCCACCGTGCCGCTGGGC 3′;GmHep-exp-R2:5′ACCGTCGACTGGAATTTGCAGCAAATGCCACA 3′),将质粒pEGFP-N1和含有GmHep基因的pMD18-T质粒分别用Hind Ⅲ与Sal I双酶切(下划线为酶切位点序列),回收线性化pEGFP-N1质粒和GmHep基因,连接转化至DH5α感受态细胞中,筛选阳性克隆并测序,命名为pEGFP-GmHep。根据FuGENE© 6 Transfection Reagent(Promega)试剂说明,将鲤上皮瘤细胞(EPC)平铺于6孔板,20 h后将0.5 ng pEGFP-GmHep转染EPC,转染48 h后开始染色。用Hoechst标记细胞核,在荧光显微镜下观察增强型绿色荧光蛋白(EGFP)的表达并拍照[16]。
2 结果
2.1 GmHep基因序列分析
GmHep基因长度为1045 bp,ORF长度为297 bp,C-端非编码区有两个“AATAA”终止信号序列,编码98个氨基酸(图1)。信号肽切割位点位于第22和23个氨基酸之间,GmHep成熟肽由76个氨基酸组成,C-端具有典型的8个半胱氨酸残基特征,预测成熟肽分子量为8555,理论pI 6.91。

注:方框为终止信号序列;阴影部分为推导的氨基酸序列;下划线为信号肽序列
Note: Square box stands for the termination signal sequence; The deduced amino acid sequence is shadowed;Signal peptide is underlined
图1 GmHep基因cDNA序列及推导的氨基酸序列
Fig.1 cDNA sequence and the deduced amino acid sequence of GmHep gene
利用DNAstar软件分析发现,GmHep氨基酸序列N-端信号肽和C-端半胱氨酸活性区域较为保守,其他区域保守性较差。GmHep与大西洋鳕Hepcidin的一致性可达93%,与其他多数鱼类的一致性为50%~60%,由此可见,鳕的抗菌肽具有特殊性。系统进化树结果显示,鳕属鱼类抗菌肽单独成支,其他大部分鱼类聚为一大支(半滑舌鳎除外),两栖类和哺乳类分别聚为一支(图2),这表明GmHep与其他物种存在明显差异。
2.2 GmHep mRNA的组织分布
利用qPCR技术检测GmHep mRNA在太平洋鳕各组织中的分布[13],结果显示,在肝、头肾、脾、脑、肠、鳃、肌肉中均检测到GmHep表达,其中在肝脏中的相对表达量显著高于其他组织(P<0.05),其次是脾和肠,GmHep在肝脏中的表达量约为脾的1.59倍,肠的5.79倍(图3-A)。太平洋鳕发育早期GmHep的相对表达量处于较低水平,但在10日龄时GmHep的转录水平显著高于其他日龄(P<0.05)(图3-B),原因可能是在该时期受到外界环境刺激引起的。
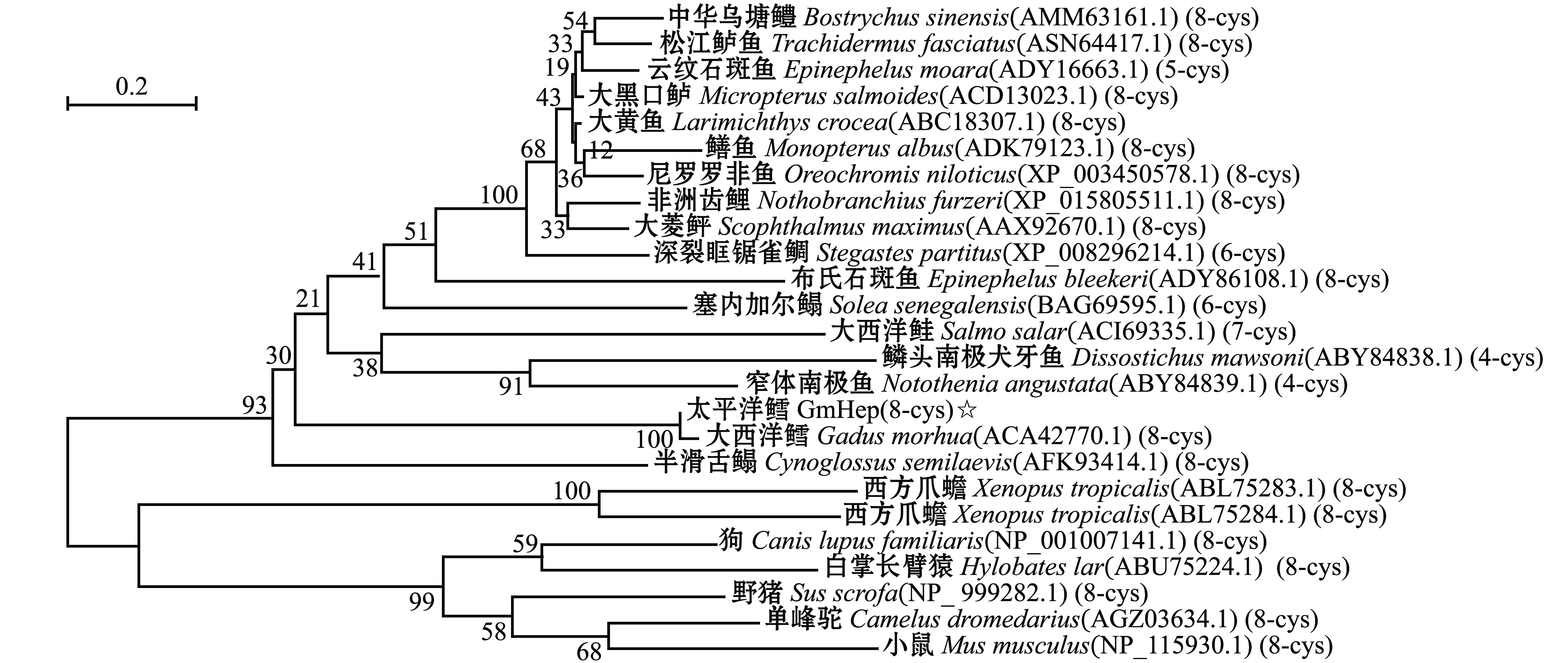
图2 基于Hepcidin氨基酸序列构建的系统进化树
Fig.2 Phylogenetic trees constructed based on the amino acid sequence alignment of Hepcidin
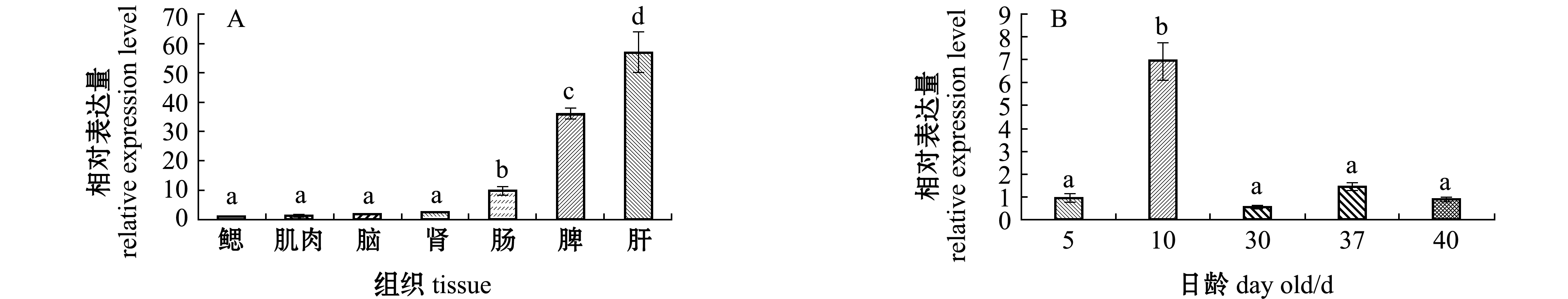
注:标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters are significantly different among the groups at the 0.05 probability level, and the means with the same letters are not significant differences
图3 太平洋鳕不同组织(A)及发育早期(B)Hepcidin的转录水平
Fig.3 Hepcidin transcript levels in various tissues (A) and early development stages (B) of Pacific cod
2.3 重组蛋白诱导表达及条件优化
如图4-A所示,除了对照组,各IPTG浓度下目的蛋白均大量表达,由于IPTG具有一定毒性,宜选择最低诱导浓度,因此,诱导剂IPTG的最佳添加浓度为 0.01 mmol/L。如图4-B 所示,在22~30 ℃时,目的蛋白的表达量随温度的升高而增多,表达量最高值出现在30 ℃,37 ℃时表达量降低,因此,最适诱导温度为 30 ℃。如图4-C所示,目的蛋白在诱导 2 h 后开始表达,且在 2~4 h 时表达量随诱导时间的延长而增多,4 h 后表达量趋于稳定,因此,最佳诱导时间为4 h。
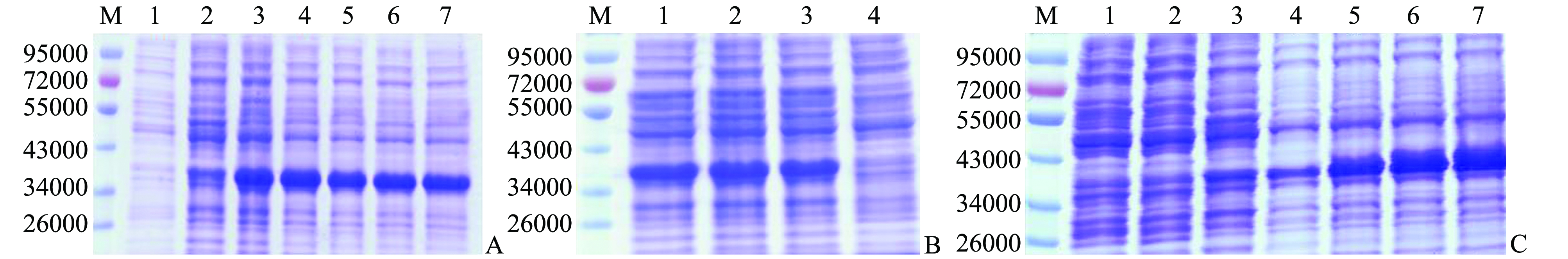
注:M为蛋白Ladder;A中,1为空白对照,2~7分别为IPTG诱导浓度0、0.01、0.05、0.10、0.50、1.00 mmol/L;B中,1~4分别为诱导温度22、25、30、37 ℃;C中,1 为未诱导, 2~7分别为诱导时长1、2、3、4、5、6 h
Note:M,the protein ladder;A, 1, the blank control group,from 2 to 7, 0, 0.01, 0.05, 0.10, 0.50 and 1.00 mmol/L of IPTG, respectively;B,from 1 to 4, 22, 25, 30 and 37 ℃, respectively;C,1,the blank control group,from 2 to 7,1, 2, 3, 4, 5, and 6 h, respectively.
图4 IPTG浓度(A)、诱导温度(B)和诱导时长(C)对GmHep蛋白表达的影响
Fig.4 Expression of GmHep induced by different IPTG concentrations(A), temperature (B) and period (C)
2.4 GmHep的亚细胞定位
转染细胞经Hoechst染色后,在倒置荧光显微镜下可观察到蓝色细胞核,目的蛋白与绿色荧光蛋白共表达于细胞质中(图5),表明GmHep蛋白主要定位细胞质中。
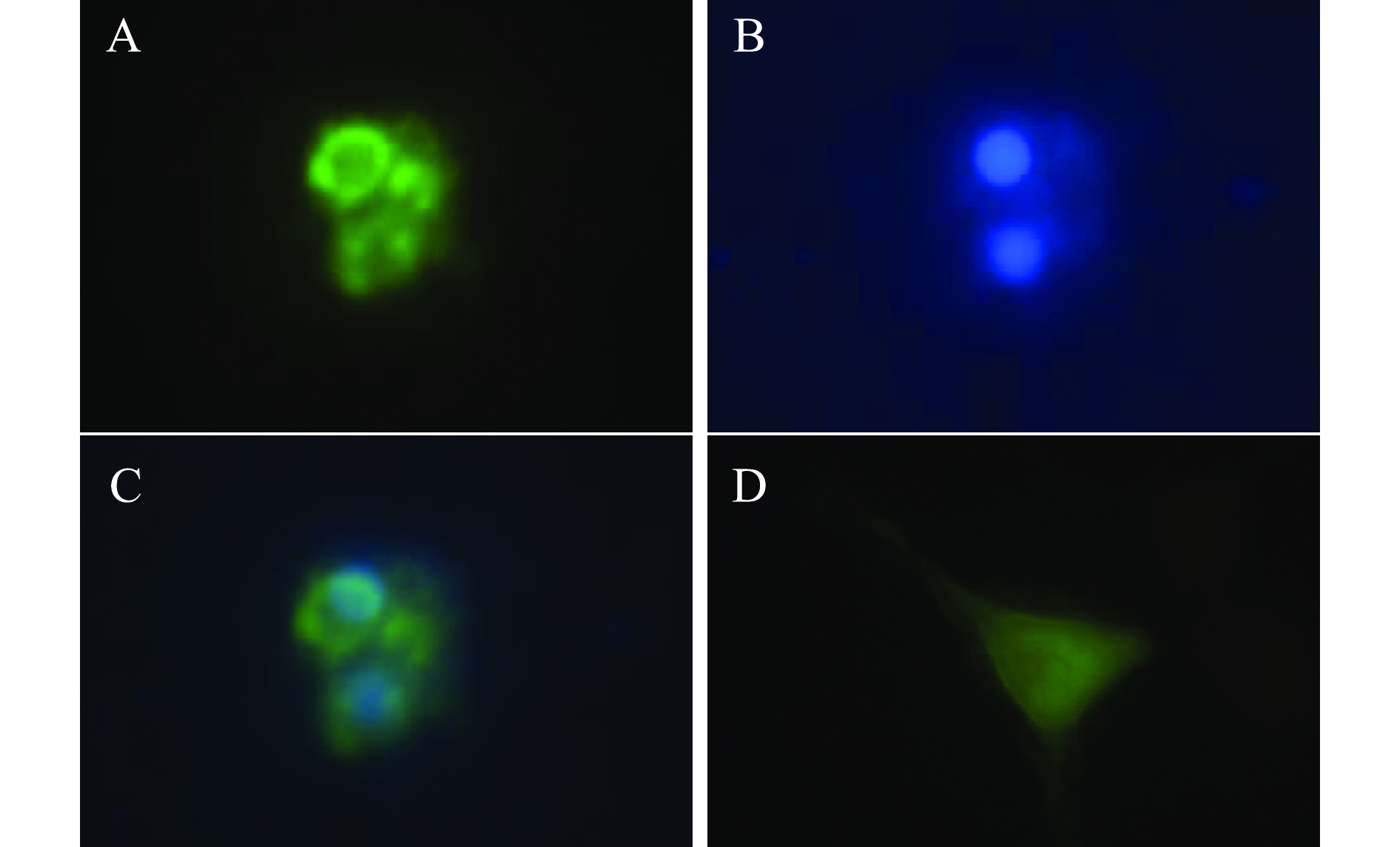
注:A,绿色荧光为GmHep蛋白表达信号;B,蓝色荧光为细胞核区域;C,A和B图的叠加;D,空载体pEGFP-N1的表达信号
Note:A, the GmHep protein signal is expressed in green; B, blue staining indicates the nucleus region; C, merge of both Fig.A and Fig.B; D, empty vector of pEGFP-N1 as control
图5 GmHep的亚细胞定位
Fig.5 Subcellular localization of GmHep
3 讨论
3.1 GmHep结构的保守性与特异性
本研究中推导的GmHep氨基酸序列由98个氨基酸组成,Hepcidin N端信号肽序列和C端半胱氨酸区域相对保守,C端具有8个半胱氨酸,可形成4个二硫键结构,这与文献报道的Hepcidin典型结构特点[17]是一致的。然而,除了N端和C端区域,其他区域同源性并不高。太平洋鳕Hepcidin与大西洋鳕Hepcidin一致性可达93%,但与其他鱼类一致性却达不到60%,说明鳕Hepcidin具有自身独特的结构特点。目前,在太平洋鳕和大西洋鳕中仅发现了一种Hepcidin,在其他鱼类中发现了多种类型,如Huang等[18]从尼罗罗非鱼肝脏中分离出了3种Hepcidin,分别为TH1-5、TH2-2和TH2-3;Yang等[19]在黑鲷中发现了7个Hepcidin突变体,其中AS-hep2在肝脏中特异高表达,而AS-hep6在头肾中特异高表达,这与之前所有Hepcidin均在肝脏中高表达的情况不同。
3.2 GmHep在太平洋鳕中的表达模式与功能探讨
在小鼠和人类中,Hepcidin主要由肝脏表达,但肝外表达也被证实,尽管数量较少[20]。对犬Hepcidin的研究发现,Hepcidin在肝脏中特异表达,在肾脏、肺和骨髓中mRNA含量很少,其他组织几乎检测不到[21]。哺乳动物Hepcidin是机体铁稳态的调控因子,Nicolas等[22]对使用Upstream Stimulatory Factor(USF)上游刺激因子敲除的小鼠研究发现,这种小鼠肝脏存在严重的铁沉积,原因是敲除USF以后下游的Hepcidin基因也不能表达,导致Hepcidin缺乏的组织铁积聚,而Hepcidin基因高表达的转基因鼠出现严重的铁缺乏和严重的细胞性贫血且生存时间大大缩短。
Hepcidin的结构在鱼类和哺乳类之间存在高度保守性。Lauth等[23]使用核磁共振方法获得了白鲈Hepcidin的蛋白结构,表明白鲈Hepcidin蛋白与人类Hepcidin蛋白具有非常相似的结构,但二者的表达模式却有显著的不同。2008年,对大西洋鳕的研究发现,Hepcidin主要由肝脏表达,在肾脏和脾脏中也有较高表达,但在其他组织中表达量较低[24]。本研究结果显示,GmHep主要在肝脏中表达,这与对大西洋鳕研究结果基本一致。大西洋鳕在鳗利斯顿氏菌Listonella anguillarum的感染下,各组织中的Hepcidin均出现显著升高,说明鳕的Hepcidin对细菌感染有着较明显的活性。然而,本研究中对太平洋鳕发育早期的检测发现,在不同时期均检测到了GmHep的表达,虽然表达水平较低,但在孵化后第10天时其表达量显著上升,这可能是受到外界刺激或者细菌感染所致,说明GmHep在发育早期也可以出现较高水平的表达,以发挥非特异免疫防御的功能。
3.3 GmHep的体外表达研究与展望
从进化树和序列比对发现,GmHep既有较高的结构保守性,又有序列特异性,可推测其功能与其他鱼类存在差异。为此本研究中根据已知序列设计特异引物,构建了GmHep成熟肽的原核表达载体,并优化表达条件,成熟肽分子量约为8555,表达载体含有标签序列6×His、Trx等,载体与目的基因共表达的产物分子量约为35 000左右,这与SDS-PAGE结果基本一致。原核表达具有表达效率高的优点,但原核表达的蛋白在空间结构上会出现错误折叠,进而影响其功能,后期可通过变性再复性的手段提高其活性。另外,有研究显示,原核表达菌也是一种细菌,Hepcidin可以抑制表达菌的扩增,进而影响表达效果。Peng等[25]从水生动物中克隆获得了多种抗菌肽,并利用酵母表达技术进行体外表达,避免了原核表达的缺点,并获得了较好的产品。本研究中未发现重组蛋白对表达菌有抑制的作用,这可能是原核表达的GmHep在空间结构上存在不确定性,仍需构建真核表达载体进一步深入探讨。
近几年,由于抗生素的不当使用,造成了耐药菌株的出现,甚至出现了超级细菌,危害极大。而抗菌肽来源于动物自身,新型抗菌肽的研发与应用越来越被业界重视,本研究中利用原核表达技术探讨了太平洋鳕Hepcidin体外表达的特点,为将来开展酵母表达和开发应用提供了依据。
[1] Park C H,Valore E V,Waring A J,et al.Hepcidin,a urinary antimicrobial peptide synthesized in the liver[J].Journal of Biological Chemistry,2001,276(11):7806-7810.
[2] Fung E,Nemeth E.Manipulation of the hepcidin pathway for therapeutic purposes[J].Haematologica,2013,98(11):1667-1676.
[3] Krause A,Neitz S,Mägert H J,et al.LEAP-1,a novel highly disulfide-bonded human peptide,exhibits antimicrobial activity[J].FEBS Letters,2000,480(2-3):147-150.
[4] Leite J,Silva L P,Rodrigues M,et al.Phylloseptins:a novel class of anti-bacterial and anti-protozoan peptides from the Phyllomedusa genus[J].Peptides,2005,26(4):565-573.
[5] Qu H D,Chen B,Peng H,et al.Molecular cloning,recombinant expression,and antimicrobial activity of EC-hepcidin3,a new four-cysteine hepcidin isoform from Epinephelus coioides[J].Bioscience,Biotechnology,and Biochemistry,2013,77(1):103-110.
[6] Hilton K B,Lambert L A.Molecular evolution and characterization of hepcidin gene products in vertebrates[J].Gene,2008,415(1-2):40-48.
[7] 赵冬梅.斑点叉尾鮰(Ictalurus punctatus)hepcidin抗菌肽的基因工程制备[D].上海:上海海洋大学,2013.
[8] 李华.鲤鱼抗菌肽Hepcidin的基因克隆、表达及其功能的研究[D].济南:山东师范大学,2010.
[9] Cai L,Cai J J,Liu H P,et al.Recombinant medaka (Oryzias melastigmus) pro-hepcidin:multifunctional characterization[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2012,161(2):140-147.
[10] Chen J Y,Lin W J,Lin T L.A fish antimicrobial peptide,tilapia hepcidin TH2-3,shows potent antitumor activity against human fibrosarcoma cells[J].Peptides,2009,30(9):1636-1642.
[11] Mao M G,Jiang J L,Jiang Z Q,et al.Molecular characterization of caspase members and expression response to nervous necrosis virus outbreak in Pacific cod[J].Fish & Shellfish Immunology,2018,74(1):559-566.
[12] Mao M G,Wen S H,Perálvarez-Marín,et al.Evidence for and characterization of nervous necrosis virus infection in Pacific cod (Gadus macrocephalus)[J].Archives of Virology,2015,160(9):2237-2248.
[13] Mao M G,Li X,Alejandro,Perálvarez-Marín,et al.Transcriptomic analysis and biomarkers (Rag1 and Igμ) for probing the immune system development in Pacific cod,Gadus macrocephalus[J].Fish & Shellfish Immunology,2015,44(2):622-632.
[14] 毛明光,温施慧,姜志强,等.太平洋鳕神经坏死病毒衣壳蛋白(CP)的原核表达及条件优化[J].大连海洋大学学报,2016,31(2):117-123.
[15] 吕绘倩,蒋洁兰,姜志强,等.太平洋鳕抗冻基因AFP4的原核表达及多克隆抗体的制备[J].大连海洋大学学报,2017,32(2):127-133.
[16] Shi Y,Zhang Y B,Zhao Z,et al.Molecular characterization and subcellular localization of Carassius auratus interferon regulatory factor-1[J].Developmental and Comparative Immunology,2008,32(2):134-146.
[17] Ganz T.Hepcidin,a key regulator of iron metabolism and mediator of anemia of inflammation[J].Blood,2003,102(3):783-788.
[18] Huang P H,Chen J Y,Kuo C M.Three different hepcidins from tilapia,Oreochromis mossambicus: analysis of their expressions and biological functions[J].Molecular Immunology,2007,44(8):1922-1934.
[19] Yang M,Wang K J,Chen J H,et al.Genomic organization and tissue-specific expression analysis of hepcidin-like genes from black porgy (Acanthopagrus schlegelii B)[J].Fish & Shellfish Immunology,2007,23(5):1060-1071.
[20] Pigeon C,Ilyin G,Courselaud B,et al.A new mouse liver-specific gene,encoding a protein homologous to human antimicrobial peptide hepcidin,is overexpressed during iron overload[J].Journal of Biological Chemistry,2001,276(11):7811-7819.
[21] Kulaksiz H,Theilig F,Bachmann S,et al.The iron-regulatory peptide hormone hepcidin: expression and cellular localization in the mammalian kidney[J].Journal of Endocrinology,2005,184(2):361-370.
[22] Nicolas G,Viatte L,Bennoun M,et al.Hepcidin,a new iron regulatory peptide[J].Blood Cells,Molecules,and Diseases,2002,29(3):327-335.
[23] Lauth X,Babon J J,Stannard J A,et al.Bass hepcidin synthesis,solution structure,antimicrobial activities and synergism,and in vivo hepatic response to bacterial infections[J].Journal of Biological Chemistry,2005,280(10):9272-9282.
[24] Solstad T,Larsen A N,Seppola M,et al.Identification,cloning and expression analysis of a hepcidin cDNA of the Atlantic cod (Gadus morhua L.)[J].Fish & Shellfish Immunology,2008,25(3):298-310.
[25] Peng H,Yang M,Huang W S,et al.Soluble expression and purification of a crab antimicrobial peptide scygonadin in different expression plasmids and analysis of its antimicrobial activity[J].Protein Expression & Purification,2010,70(1):109-115.