厚壳贻贝Mytilus coruscus隶属于软体动物门Mollusca瓣鳃纲Lamellibranchia贻贝目Mytilodia贻贝科Mytilidae,其具有较强的环境适应能力和繁殖能力,是中国东海重要的海产经济贝类和大型海洋污损生物[1-2]。厚壳贻贝生活史与大多数的海洋无脊椎动物相同,在生长发育过程中均有两种不同的生活阶段——浮游生活阶段和附着生活阶段,一般在变态发育之前靠浮游生活方式生存,后期通过附着于基质表面进入底栖附着期,之后经历变态发育成长为稚贝。幼虫的附着变态对于贝类等无脊椎动物的生存和繁殖至关重要,研究其附着机理对于调控其附着过程具有重要的意义。
大多数海洋无脊椎动物可以识别环境信号来调节自身的附着变态过程。研究证明,海洋细菌可通过形成生物被膜,参与调控大多数海洋无脊椎动物幼虫的附着变态[3]。例如,Pseudoalteromonas是变形菌门的一类革兰氏阴性海洋细菌属,可分泌多种具有生物学活性的胞外产物[4-5],其生物被膜能促进华美盘管虫Hydroides elegans[6]和厚壳贻贝[7]等幼虫的附着变态。而Shewanella是变形菌门γ-变形菌纲的兼性厌氧革兰氏阴性细菌,具有较强的成膜能力和多产的胞外产物,对厚壳贻贝幼虫的附着变态具有高诱导活性[7]。
纤维素在自然界中分布广泛,多种细菌可以产生纤维素,且大多数细菌生物被膜胞外产物中包含纤维素,纤维素可参与生物被膜的形成,具有重要的生物学功能[8-9]。研究发现,纤维素的过量产生能有效提高假交替单胞菌属细菌生物被膜的抗污损性能,抑制厚壳贻贝幼虫的附着变态[10],但纤维素对细菌生物被膜的形成产生何种影响及对厚壳贻贝幼虫附着变态的调控机制尚不清楚。本研究中,选取了对厚壳贻贝附着具有诱导活性的假交替单胞菌属和希瓦氏细菌属[7,11]为研究对象,探讨了纤维素与海洋细菌形成生物被膜过程前后对生物被膜的细菌密度与分布、膜厚和胞外产物等生物学特性的影响,以及这些变化对厚壳贻贝幼虫附着变态的影响,旨在为贝类与海洋细菌互作关系及贝类附着分子机制的研究提供理论依据。
1 材料与方法
1.1 材料
试验所用的眼点期厚壳贻贝幼虫,均于2017年5月取自浙江省舟山市嵊泗县(30°69′N、122°46′E),在盐度为30的自然海水中于18 ℃黑暗条件下充气培养,密度为104cells/L,每隔2 d换水一次,每日一次投喂湛江等鞭金藻饵料(1×104cells/mL)。所有幼虫均适应一周后进行试验。取纤维素[默克生命科学(上海)有限公司]1 g溶于500 mL 灭菌过滤海水(Autoclaved filtered seawater,AFSW)中制成母液,调pH为7.6。试验用海洋细菌Pseudoalteromonas atlantica、Shewanella loihica均分离于自然生物被膜,于-80 ℃下保存。
1.2 方法
1.2.1 生物被膜制备 参照杨金龙等[12]的方法,取-80 ℃下保存的P.atlantica、S.loihica菌划线于ZoBell 2216E平板上,于25 ℃下培养12 h,挑取单菌落接种到80 mL液体培养基,黑暗条件下25 ℃、200 r/min摇床中培养24 h,以3500 r/min离心15 min,去培养液,用AFSW清洗3次,最后加入AFSW定容至50 mL,均匀混合至细菌悬浮液,取10 μL稀释100倍后,取1 mL菌液用0.22 μm滤膜(Whatman)过滤,用0.1%吖啶橙染色5 min,在荧光显微镜(Olympus BX51)×1000放大倍率下选择10个随机视野计数,计算细菌总密度。
1.2.2 P.atlantica、S.loihica与纤维素共同形成生物被膜 取无菌载玻片放入高温灭菌培养皿(直径为64 mm × 19 mm)中,加入适量细菌悬浮液和纤维素,随后加入适量AFSW定容至20 mL,细菌终浓度为1.0×108 cells/mL,纤维素终浓度为0(对照)、0.02、0.2、2、20、200 mg/L,每个浓度设置9个平行,18 ℃下避光培养48 h形成生物被膜。
1.2.3 纤维素处理 当P.atlantica、S.loihica单一生物被膜形成后,取出载玻片,用AFSW清洗后放入无菌培养皿中,加入纤维素,随后加入适量AFSW定容至20 mL,使纤维素终浓度为0(对照)、0.02、0.2、2、20、200 mg/L,每个浓度设置9个平行,18 ℃下避光培养。
1.2.4 幼虫附着试验 将附有生物被膜的载玻片清洗,缓慢放入到20 mL AFSW的无菌培养皿中,随后各加入20只眼点幼虫,18 ℃下避光培养。记录12、24、48、96 h时幼虫附着变态个体数,计算幼虫附着变态率。
1.2.5 生物被膜细菌密度计数 参照杨金龙等[12]方法,生物被膜用5%福尔马林溶液固定24 h,用0.1%吖啶橙染色5 min,在荧光显微镜(Olympus BX51)×1000放大倍率下随机选取10个视野计数,每组3个平行,计算生物被膜细菌的密度。
1.2.6 生物被膜扫描电镜试验 将单一细菌生物被膜及2 mg/L纤维素处理的生物被膜浸泡于5%甲醛溶液中固定24 h,用1×PBS溶液清洗以去除残余甲醛溶液,在浓度为25%、50%、75%、100%的乙醇溶液中梯度脱水,每次10 min,室温晾干,使用Hitachi S-3400N II 型扫描电子显微镜(Scanning electron microscopy,SEM),5 kV加速电压,在×6500放大倍率下观察,每组3个重复,每个重复随机选取10个视野,并拍摄记录。
1.2.7 生物被膜激光共聚焦试验 将单一细菌生物被膜及2 mg/L纤维素处理的生物被膜浸泡于5%的甲醛溶液中固定24 h,再用5 μg/mL的碘化丙啶(PI)溶液浸染15 min,使用激光共聚焦扫描显微镜(Confocal laser scanning microscopy,CLSM)×630放大倍率下观察,每组3个重复,每个重复随机选取10个视野,并拍摄记录。
1.2.8 生物被膜胞外多糖染色试验 将单一细菌生物被膜及2 mg/L纤维素处理的生物被膜浸泡于10%甲醛溶液中固定24 h,用1×PBS清洗,使用200 μL浓度为100 μg/mL 的Fitc-conA[默克生命科学(上海)有限公司]染色液浸染20 min,随后使用1×PBS溶液和Tris溶液清洗以去除残留的Fitc-conA染色液;再用200 μL浓度为10 μmol/L的STYO64染色液避光侵染2 min,用1×PBS溶液和Tris溶液清洗3次以去除残留的STYO64染色液,室温下避光晾干。每组3个重复,每个重复随机选取10个视野,并拍摄记录。
1.2.9 生物被膜胞外脂类染色试验 将单一细菌生物被膜及2 mg/L纤维素处理的生物被膜浸泡于10%甲醛溶液中固定24 h,用1×PBS清洗,使用苏丹红染色液避光染色20 min,随后将生物被膜轻放入1×PBS溶液中,避光浸洗5 min,室温晾干。每组3个重复,每个重复随机选取10个视野,并拍摄记录。
1.2.10 生物被膜胞外蛋白染色试验 将单一细菌生物被膜及2 mg/L纤维素处理的生物被膜浸泡于10%甲醛溶液中固定24 h,用1×PBS清洗,使用考马斯亮蓝染色液避光染色1 h,在脱色液中避光脱色10 min,随后将生物被膜轻放入1×PBS中,避光浸洗10 min,室温晾干。每组3个重复,每个重复随机选取10个视野,并拍摄记录。
1.3 数据处理
采用JMP 10.0.0软件进行统计分析及相关性检验。将原始数据进行反正弦转化及正态性检验,若满足正态分布且方差相同,则使用单因素方差分析,若不满足正态性分布,则使用Tukey-Kramer法进行显著性检验。之后使用Steel-Dwass和Wicoxon法进行评估检验。使用IBM SPSS Statistics 20软件偏相关分析方法,对影响生物被膜诱导活性的纤维素浓度和细菌密度进行相关性检验,显著性水平设为0.05。
2 结果与分析
2.1 纤维素对厚壳贻贝幼虫附着变态的影响
从图1可见:在无细菌形成生物被膜情况下,5个浓度组的纤维素悬浮液对幼虫的附着变态与空白对照组并无显著性影响(P>0.05)。
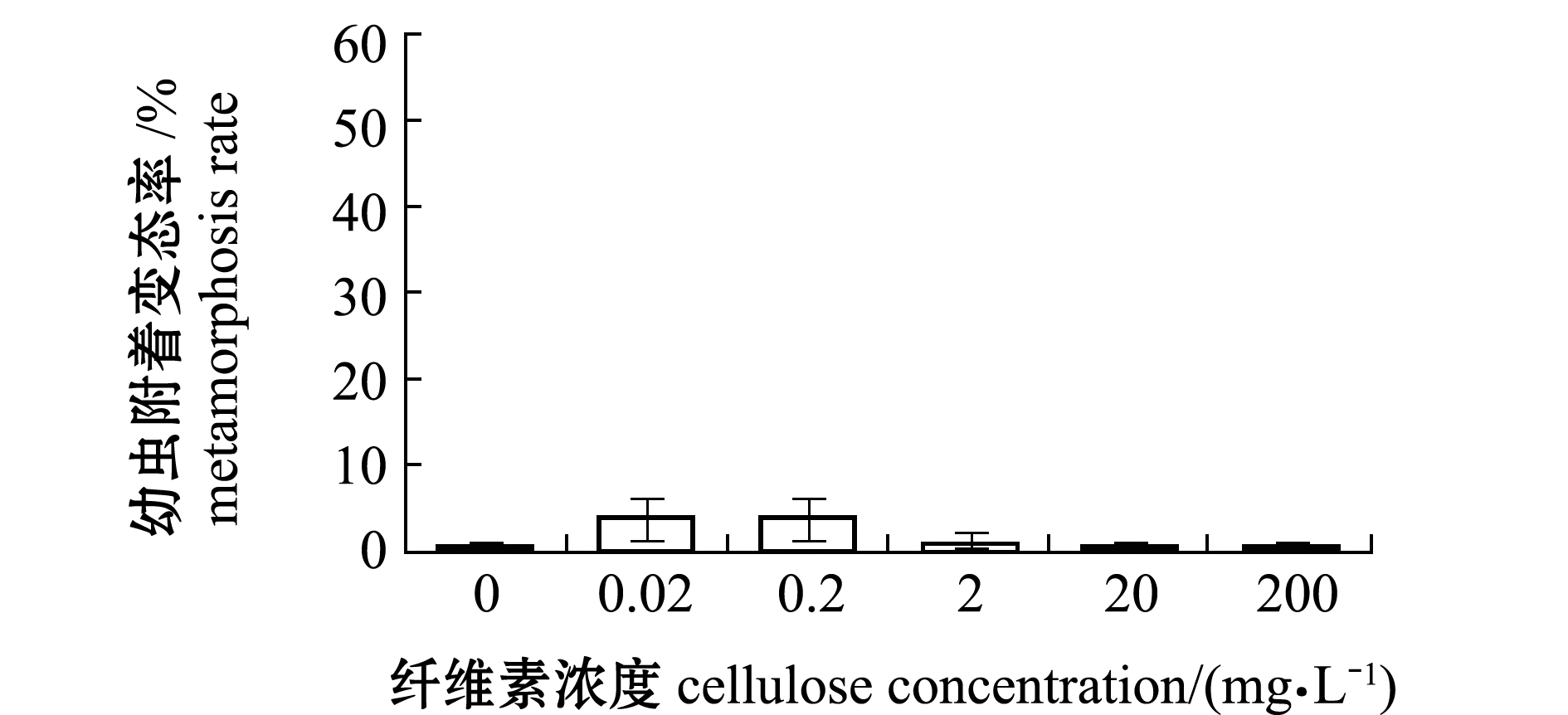
图1 不同浓度纤维素对厚壳贻贝幼虫附着变态的影响
Fig.1 Effects of different concentrations of cellulose on larval settlement and metamorphosis of mussel Mytilus coruscus
2.2 纤维素与P.atlantica和S.loihica共同形成的生物被膜对厚壳贻贝幼虫附着变态的影响
从图2可见:纤维素与P.atlantica和S.loihica共同形成的生物被膜诱导的幼虫附着变态率与单一细菌生物被膜相比显著降低(P<0.05);两株细菌在初始细菌浓度为1×108 cells/mL,纤维素浓度为2、20、200 mg/L时与2种细菌形成的生物被膜,对幼虫附着变态的抑制最为显著(P<0.05);纤维素浓度为2 mg/L与P.atlantica共同形成生物被膜诱导的幼虫附着变态率最低,为(25.0±1.4)%,显著低于P.atlantica单一生物被膜诱导的幼虫附着变态率(38.8±3.09)%(P<0.05);纤维素浓度为2 mg/L与S.loihica共同形成生物被膜诱导的幼虫附着变态率也最低,为(26.7±1.7)%,同样显著低于S.loihica单一生物被膜诱导的幼虫附着变态率(52.8±2.9)%(P<0.05)。
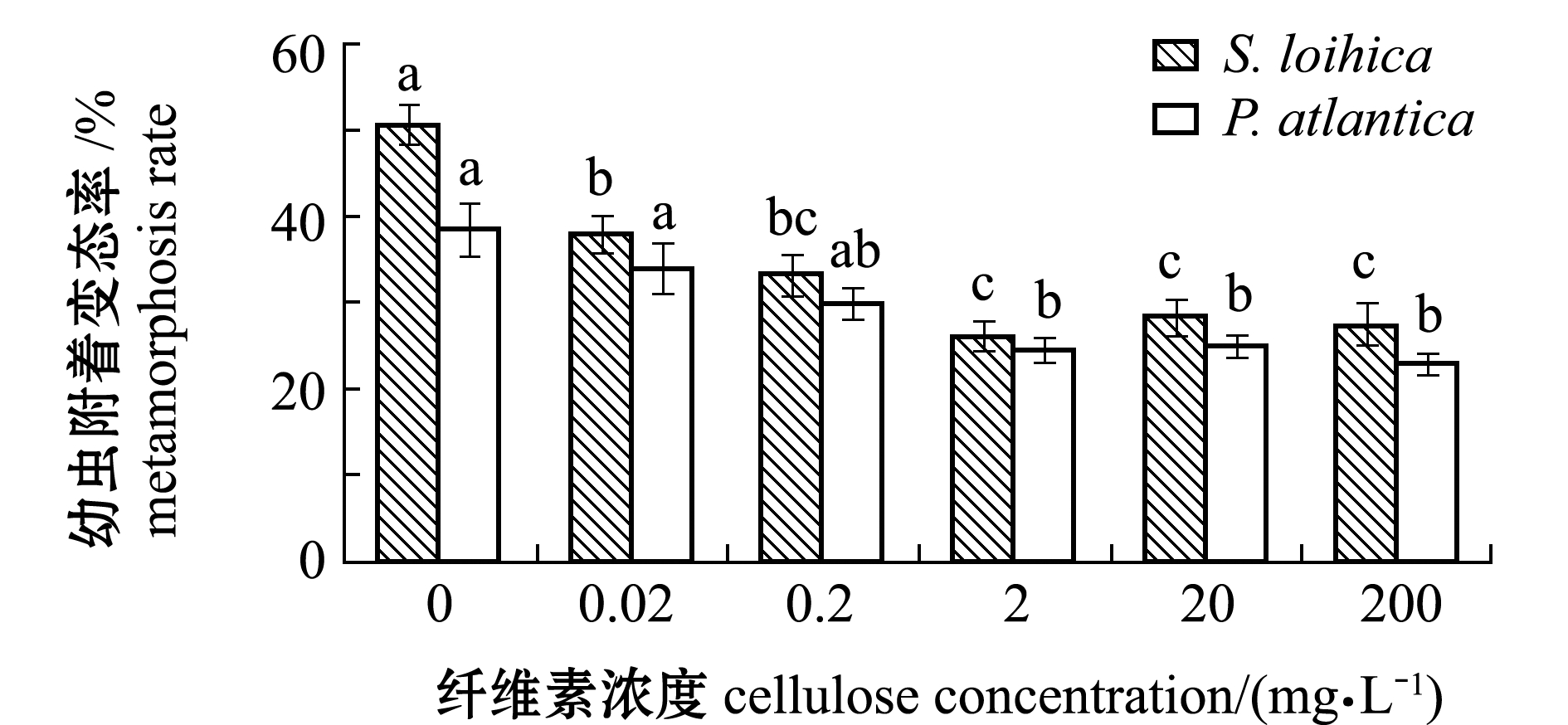
注:标有不同字母者表示同一种细菌下不同纤维素浓度间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters in same bacteria are significant differences in different cellulose concentrations at the 0.05 probability level,and the means with the same letters are not significant differences,et sequentia
图2 纤维素与Pseudoalteromonas atlantica和Shewanella loihica共同形成的生物被膜对厚壳贻贝幼虫附着变态的影响
Fig.2 Effects of Pseudoalteromonas atlantica and Shewanella loihica biofilms formed with cellulose on larval settlement and metamorphosis of mussel Mytilus coruscus
从图3可见:P.atlantica和S.loihica在初始细菌浓度为1×108 cells/mL时,与纤维素共同形成的生物被膜细菌密度与单一细菌生物被膜密度相比也显著降低(P<0.05);P.atlantica在纤维素浓度为2 mg/L时表现出显著性差异(P<0.05),在20、200 mg/L时,生物被膜细菌密度达到最低;S.loihica在纤维素浓度为0.02 mg/L时表现出显著性差异(P<0.05),并在2、20、200 mg/L时,生物被膜细菌密度达到最低。
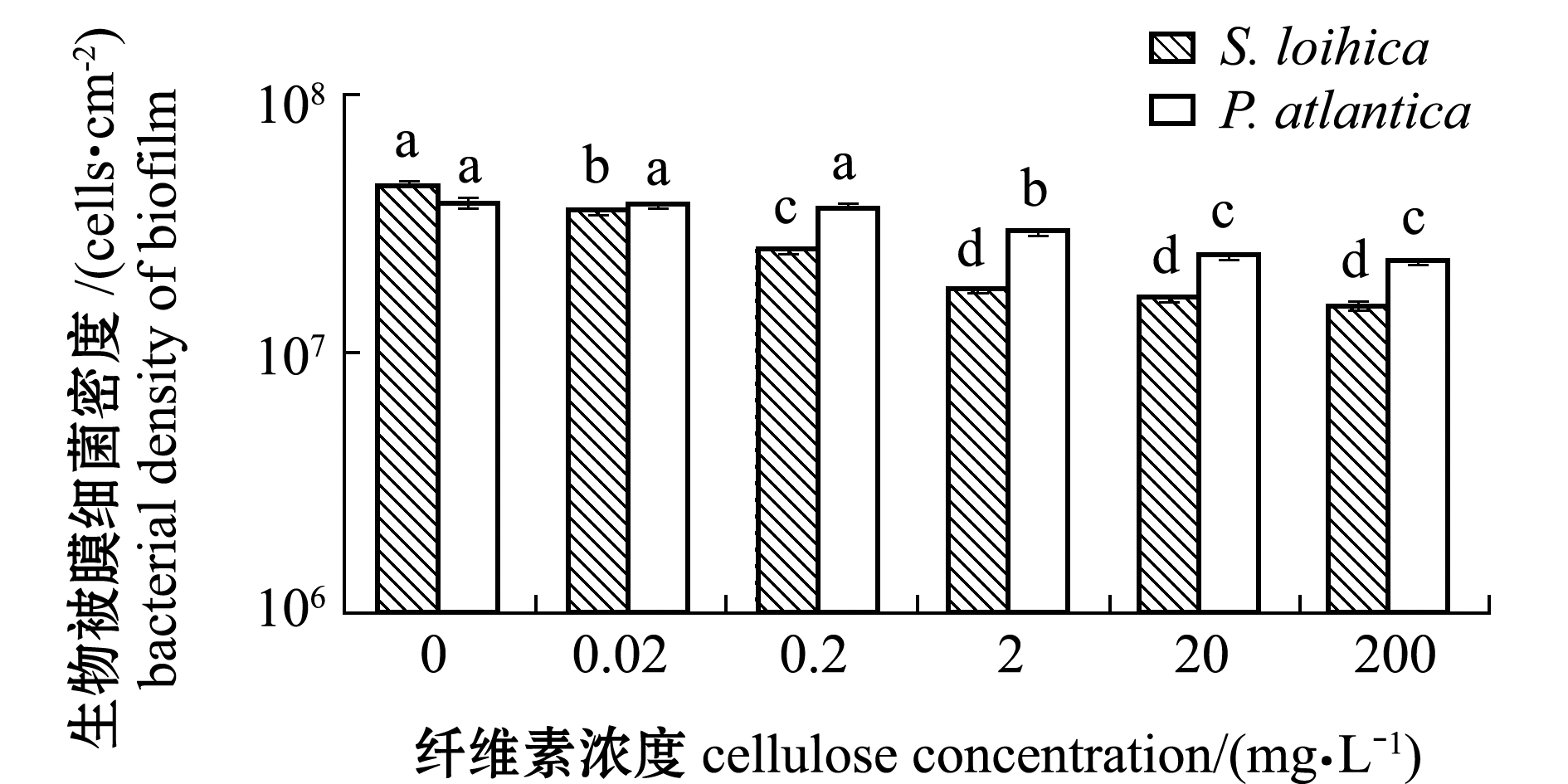
图3 纤维素与Pseudoalteromonas atlantica和Shewanella loihica共同形成的生物被膜的细菌密度
Fig.3 Density of Pseudoalteromonas atlantica and Shewanella loihica biofilms formed with cellulose
从表1可见,P.atlantica和S.loihica生物被膜的诱导活性与细菌密度呈极显著相关(P<0.01),而与纤维素浓度无显著相关性(P>0.05)。
表1 纤维素浓度和生物被膜细菌密度与幼虫变态率的偏相关性分析
Tab.1 Partial correlations analyses among the cellulose concentration,bacterial density of biofilms and metamorphosis of larvae
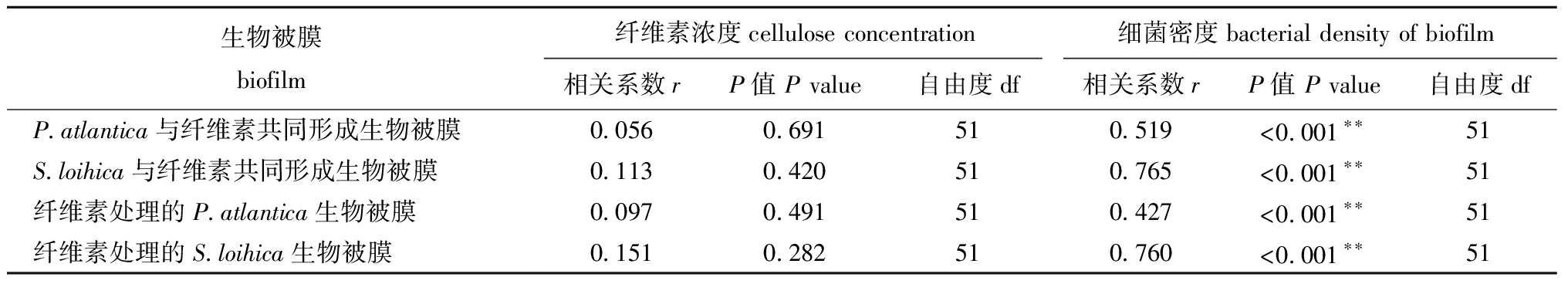
生物被膜biofilm纤维素浓度cellulose concentration细菌密度bacterial density of biofilm相关系数rP值 P value自由度df相关系数rP值 P value自由度dfP.atlantica与纤维素共同形成生物被膜0.0560.691510.519<0.001∗∗51S.loihica与纤维素共同形成生物被膜0.1130.420510.765<0.001∗∗51纤维素处理的P.atlantica生物被膜0.0970.491510.427<0.001∗∗51纤维素处理的S.loihica生物被膜0.1510.282510.760<0.001∗∗51
注: *为显著相关(P<0.05);**为极显著相关(P<0.01),下同
Note:* means significant effect (P<0.05);** means very significant effect(P<0.01),et sequentia
2.3 纤维素对P.atlantica和S.loihica生物被膜诱导厚壳贻贝幼虫附着变态的影响
从图4可见:P.atlantica、S.loihica生物被膜形成后再加入不同浓度纤维素,对厚壳贻贝幼虫的附着变态率与单一细菌生物被膜相比显著下降(P<0.05);P.atlantica生物被膜处理结果显示,添加2 mg/L纤维素时,P.atlantica生物被膜诱导的幼虫变态率最低,为(17.2±1.7)%,显著低于未添加纤维素的P.atlantica生物被膜(38.8±3.09)%(P<0.05);S.loihica生物被膜处理结果显示,添加浓度为2、20、200 mg/L的纤维素,对幼虫附着变态的抑制最为显著(P<0.05),添加2 mg/L纤维素时,S.loihica生物被膜诱导的幼虫变态率降至(21.1±2.5)%。
通过生物被膜细菌密度计算与分析,发现初始细菌浓度为1×108 cells/mL时形成的生物被膜,加入纤维素后,P.atlantica和S.loihica生物被膜中的细菌密度均有下降趋势(图5)。
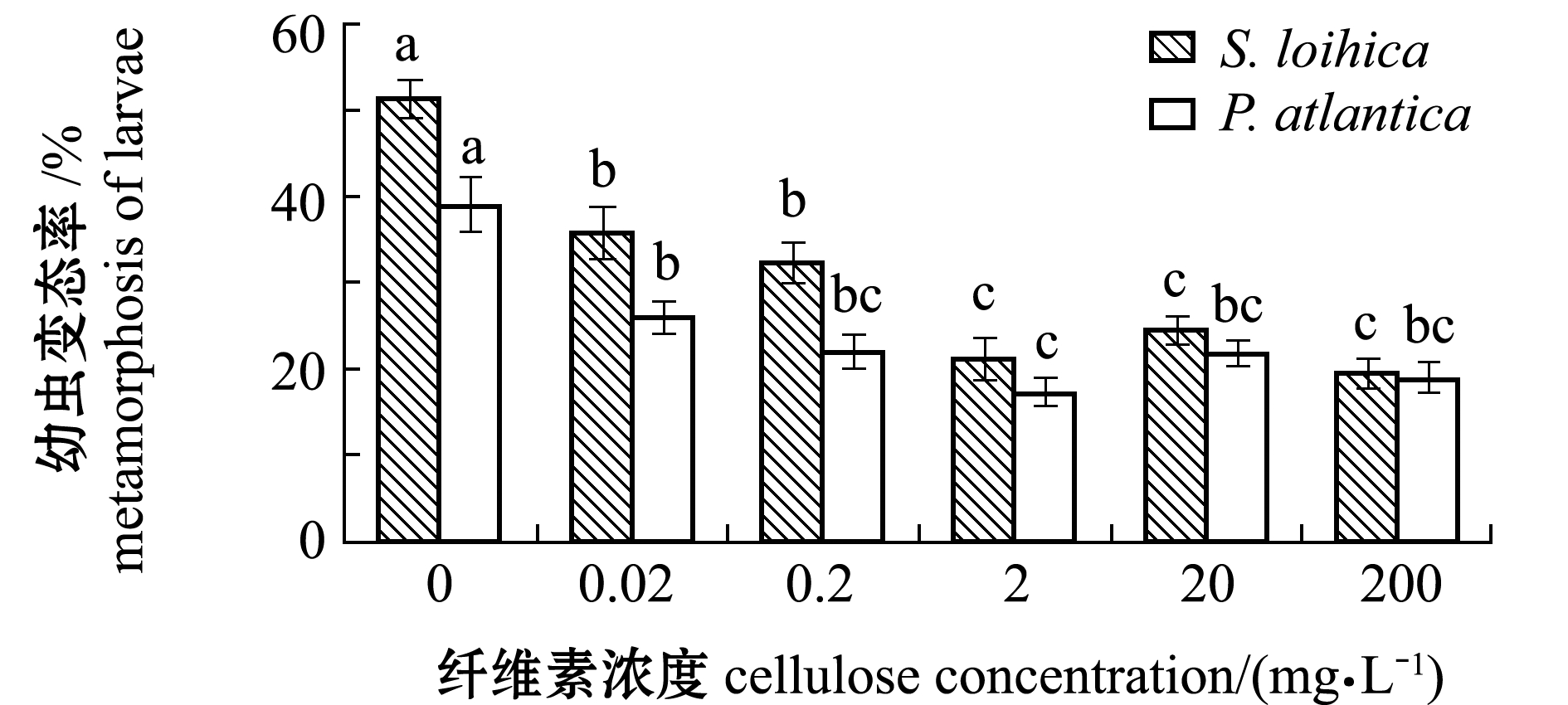
图4 纤维素对Pseudoalteromonas atlantica和Shewanella loihica生物被膜诱导厚壳贻贝幼虫附着变态的影响
Fig.4 Effects of cellulose on the larval settlement and metamorphosis of mussle Mytilus coruscus induced by Pseudoalteromonas atlantica and Shewanella loihica biofilms
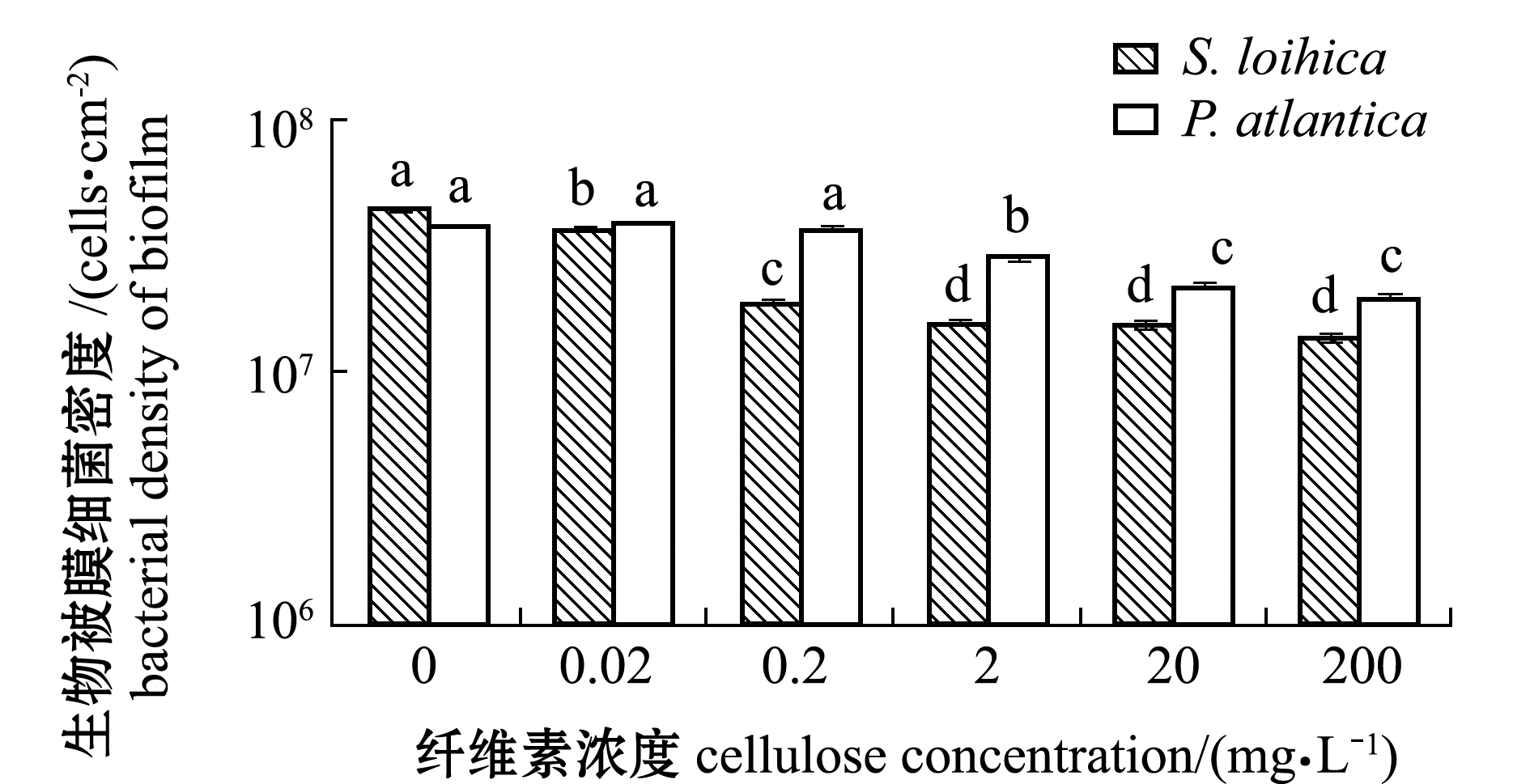
图5 Pseudoalteromonas atlantica、Shewanella loihica生物被膜形成后纤维素对生物被膜细菌密度的影响
Fig.5 Effects of cellulose on the density of Pseudoalteromonas atlantica and Shewanella loihica biofilms
2.4 纤维素对P.atlantica和S.loihica生物被膜细菌形态的影响
纤维素与P.atlantica和S.loihica不同方式形成或处理的生物被膜,在扫描电镜下观察结果如图6所示,其中,P.atlantica的细菌形状呈椭圆形,细菌周围分泌有白色胞外产物,与单一生物被膜相比,纤维素处理的两种生物被膜胞外产物含量明显降低,细菌量减少;而S.loihica的细菌形状呈杆状,细菌周围分泌有大量白色囊状胞外产物,与单一生物被膜相比,纤维素处理的两种生物被膜胞外产物含量同样明显降低,细菌聚集程度相对分散。
2.5 纤维素对P.atlantica和S.loihica生物被膜细菌分布和膜厚的影响
纤维素与P.atlantica和S.loihica以不同方式形成或处理的生物被膜细菌聚集状态和分布如图7所示,其中P.atlantica和S.loihica单一生物被膜细菌密度与聚集程度相对较高,出现大面积块状聚集的细菌,而P.atlantica和S.loihica与纤维素共同形成的生物被膜,以及生物被膜形成后添加纤维素处理的生物被膜,细菌密度相对减少,分布较为分散。

图6 扫描电子显微镜下纤维素处理的Pseudoalteromonas atlantica和Shewanella loihica生物被膜
Fig.6 Scanning electronic microscopy of Pseudoalteromonas atlantica and Shewanella loihica biofilms treated by cellulose

图7 激光共聚焦扫描显微镜下纤维素处理的Pseudoalteromonas atlantica和Shewanella loihica生物被膜
Fig.7 CLSM scanning electronic microscopy of biofilm images of Pseudoalteromonas atlantica and Shewanella loihica
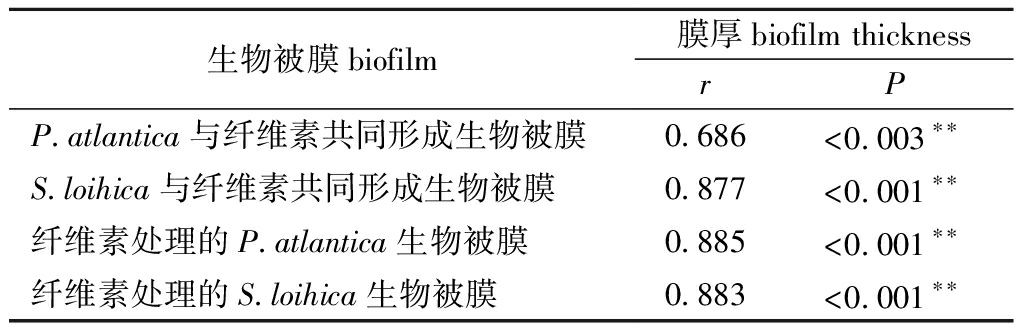
从图8可见:相比P.atlantica单一生物被膜膜厚,纤维素两种方式处理的P.atlantica生物被膜膜厚减少29%和30%,表现出显著性差异(P<0.05);相比S.loihica单一生物被膜膜厚,纤维素两种方式处理的S.loihica生物被膜膜厚减少39%和40%(P<0.05);两种纤维素处理方式处理的P.atlantica或S.loihica生物被膜间细菌聚集状态、分布及膜厚并无显著性差异(P>0.05)。通过分析生物被膜诱导活性与膜厚同样呈现极显著性相关(P<0.01,表2)。
2.6 纤维素对P.atlantica和S.loihica生物被膜胞外多糖的影响
P.atlantica和S.loihica单一生物被膜与纤维素两种方式处理的生物被膜胞外多糖染色结果如图9所示。从图9可见:P.atlantica单一生物被膜细菌呈现聚集状态,胞外多糖分布较为均匀,且有大量胞外多糖呈块状分布,而纤维素两种方式处理的生物被膜胞外多糖含量明显减少,多呈颗粒状分布,两个纤维素处理组胞外多糖的含量与分布并无明显变化;S.loihica单一生物被膜胞外多糖分布广泛,多呈块状分布,含量明显高于纤维素两种方式处理的两种生物被膜,纤维素与S.loihica共同形成的生物被膜和纤维素处理的S.loihica生物被膜,胞外多糖含量与分布并无明显差异。
表2 生物被膜膜厚与幼虫变态率相关性分析
Tab.2 Correlation analyses between biofilm thickness and metamorphosis of larvae
生物被膜biofilm膜厚biofilm thicknessrPP.atlantica与纤维素共同形成生物被膜0.686<0.003∗∗S.loihica与纤维素共同形成生物被膜0.877<0.001∗∗纤维素处理的P.atlantica生物被膜0.885<0.001∗∗纤维素处理的S.loihica生物被膜0.883<0.001∗∗
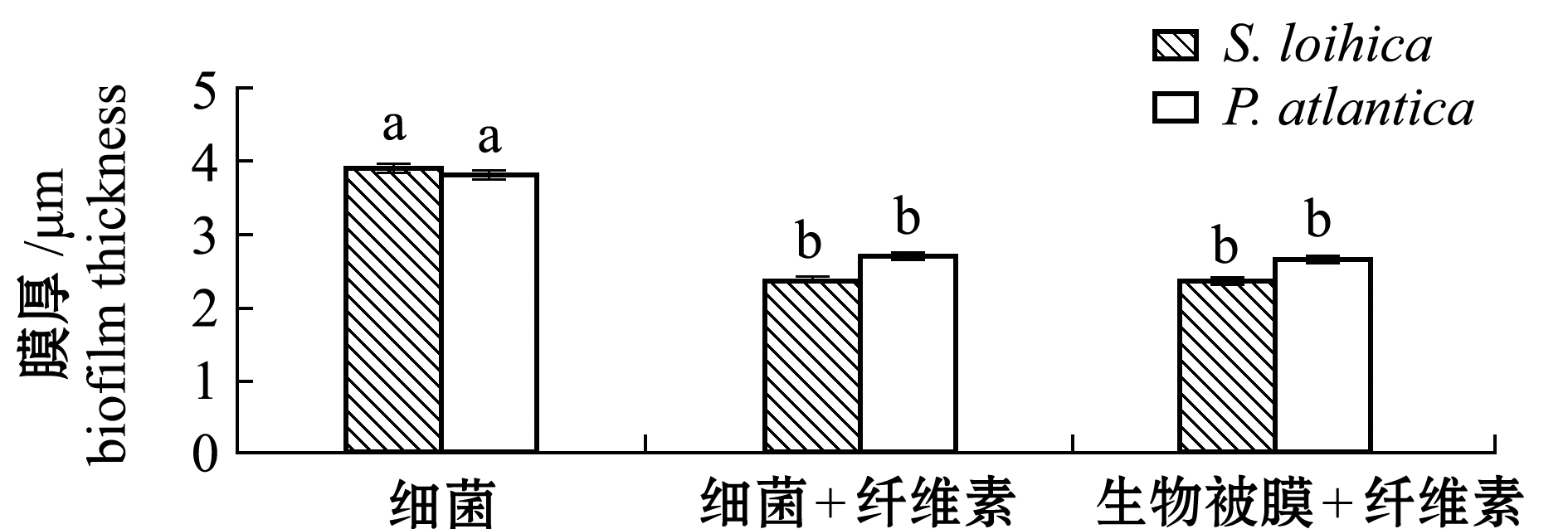
图8 纤维素处理的Pseudoalteromonas atlantica和Shewanella loihica生物被膜膜厚
Fig.8 Biofilm thickness of cellulose-treated Pseudoalteromonas atlantica and Shewanella loihica

图9 激光共聚焦显微镜下纤维素处理的Pseudoalteromonas atlantica和Shewanella loihica生物被膜胞外多糖分布
Fig.9 CLSM scanning electronic microscopy of extracellular polysaccharides in Pseudoalteromonas atlantica and Shewanella loihica biofilms treated by cellulose
2.7 纤维素对P.atlantica和S.loihica生物被膜胞外脂类的影响
P.atlantica和S.loihica单一生物被膜与纤维素两种方式处理的生物被膜胞外脂类染色结果如图10所示。从图10可见:P.atlantica单一生物被膜胞外脂类分布较为均匀,大量胞外脂类呈块状分布,而纤维素两种方式处理的生物被膜胞外脂类含量明显减少,多呈颗粒状分布,两个纤维素处理组间胞外脂类含量与分布并无明显变化;S.loihica单一生物被膜胞外脂类分布广泛,多呈块状分布,含量明显高于纤维素处理的两种生物被膜,纤维素与S.loihica共同形成的生物被膜和纤维素处理的S.loihica生物被膜,胞外脂类含量与分布也无明显差异。
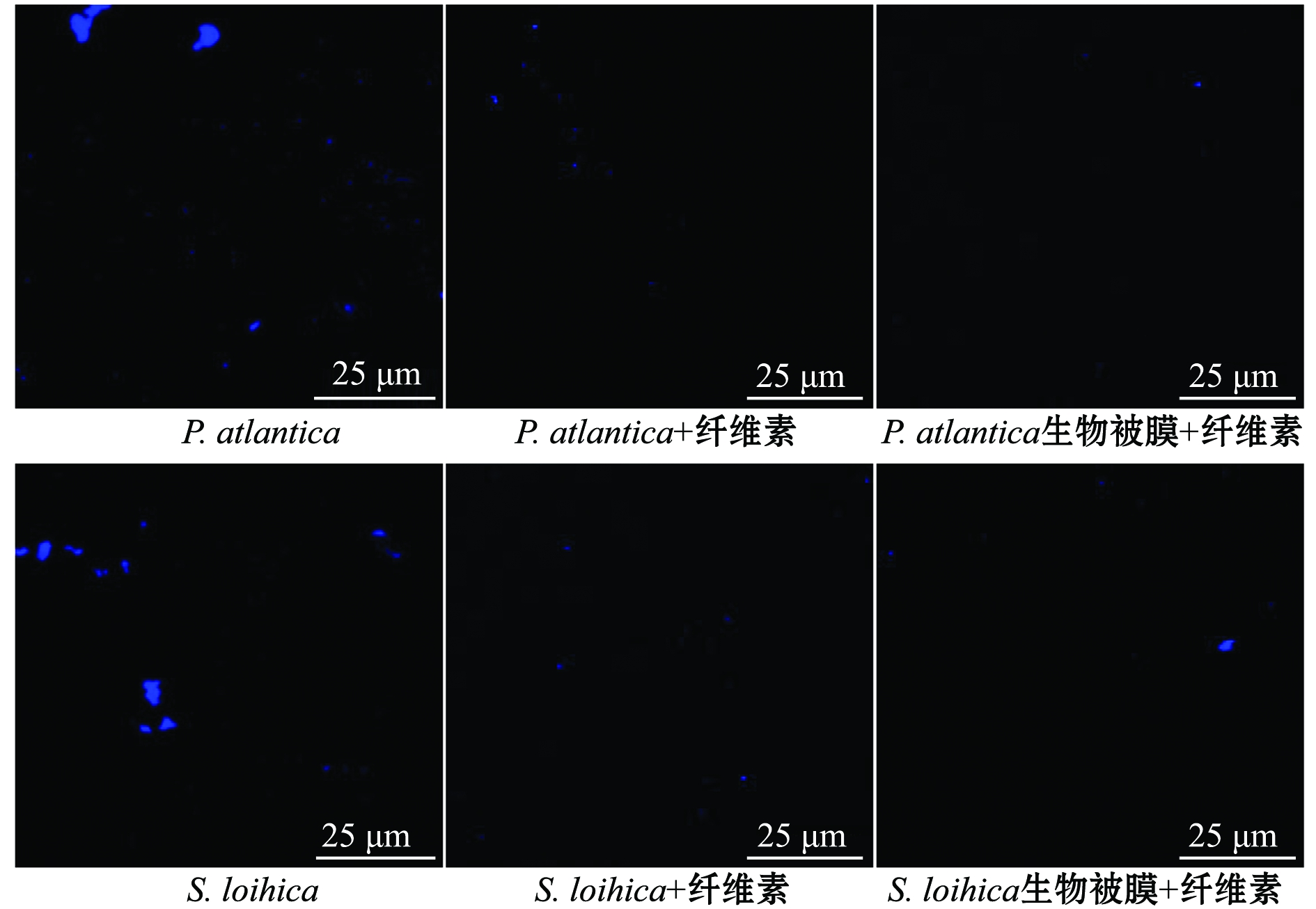
图10 激光共聚焦显微镜下纤维素处理的Pseudoalteromonas atlantica和Shewanella loihica生物被膜胞外脂类分布
Fig.10 CLSM electronic microscopy of lipids in Pseudoalteromonas atlantica and Shewanella loihica biofilms by cellulose treatment
2.8 纤维素对P.atlantica和S.loihica生物被膜胞外蛋白的影响
P.atlantica和S.loihica单一生物被膜与纤维素两种方式处理的生物被膜胞外蛋白染色结果如图11所示。从图11可见:纤维素两种方式处理的P.atlantica生物被膜与P.atlantica单一生物被膜相比,胞外蛋白分布和含量并无明显变化;纤维素两种方式处理的S.loihica生物被膜与S.loihica单一生物被膜相比,胞外蛋白的分布及含量也无明显差异。
3 讨论
对海洋无脊椎动物附着影响研究发现,影响海洋无脊椎动物幼虫附着变态的自然诱导物相对较少[13],本研究中也发现,纤维素对厚壳贻贝幼虫的附着变态无影响。生物被膜是诱导厚壳贻贝附着的重要影响因素[1,7,14],且在大多数海洋无脊椎动物幼体附着变态的发育过程中都发挥着极其重要的作用[3,15]。然而,细菌胞外产物对生物被膜的形成及对海洋无脊椎动物幼体附着变态的影响研究相对较少。本研究中首次探讨了纤维素对海洋细菌P.atlantica和S.loihica生物被膜形成前后的生物量和胞外产物的影响,以及对厚壳贻贝幼虫附着变态的调控作用。

图11 激光共聚焦显微镜下纤维素处理的Pseudoalteromonas atlantica和Shewanella loihica生物被膜胞外蛋白分布
Fig.11 CLSM electronic microscopy of proteins in Pseudoalteromonas atlantica and Shewanella loihica biofilms by cellulose treatment
3.1 生物被膜的生物量与幼虫附着的相互关系
细菌密度是影响海洋无脊椎动物幼虫附着的重要因素之一。厚壳贻贝与生物被膜的相关研究证实了生物被膜细菌密度与厚壳贻贝的附着具有显著相关性。例如,对自然微生物被膜的研究证明了厚壳贻贝幼虫和稚贝的附着同样受生物被膜细菌密度的影响[1,14,16-17];对单一细菌生物被膜的研究发现,一些海洋菌株形成的被膜密度与厚壳贻贝的附着间具有明显关联性[7,12,18-19]。同样,生物被膜细菌密度对华美盘管虫的附着变态呈显著相关[20]。但对鹿角杯形珊瑚Pocillopora damicornis的研究发现,试验中仅有一株细菌的密度与幼虫的附着变态呈现显著相关,其他菌株细菌密度与其附着并无相关性[21]。本研究中发现,与P.atlantica和S.loihica单一生物被膜相比,纤维素对P.atlantica和S.loihica生物被膜形成前后的细菌密度、膜厚均有影响,且随着纤维素浓度的增加,细菌密度与膜厚呈现显著下降趋势,同时厚壳贻贝幼虫的附着变态率显著降低。通过偏相关分析发现,纤维素浓度的增加并不会影响生物被膜对厚壳贻贝幼虫附着变态的诱导,而生物被膜细菌密度和膜厚的变化与生物被膜的诱导活性呈极显著相关。由此推测,细菌密度和膜厚的降低是影响厚壳贻贝幼虫附着变态的因素之一。
3.2 细菌胞外产物与幼虫附着的相互关系
细菌分泌的胞外产物是生物被膜的重要组成部分,大量研究证明,生物被膜中胞外产物(主要包含糖、脂、蛋白)是影响海洋无脊椎动物附着的重要影响因素[15,22]。研究表明,自然生物被膜的群落结构和胞外产物对合浦珠母贝幼虫的附着具有重要的诱导作用[23]。海洋细菌属Pseudomonas sp.Strain S9分泌的胞外多糖对海鞘类Ciona intestinalis幼虫的附着具有促进作用[24];铜绿假单胞菌Pseudomonas aeruginosa产生的脂类抑制了鞭毛驱动的运动性,从而促进了生物被膜的形成[25];蛋白质复合物(SIPC)对藤壶类Balanus amphitrite幼虫附着具有诱导作用[26]。本研究中发现,纤维素处理的P.atlantica和S.loihica生物被膜诱导的厚壳贻贝附着变态活性降低,生物被膜中胞外多糖和胞外脂质明显减少,表明胞外多糖和胞外脂质可能参与调控厚壳贻贝幼虫附着变态过程。
以往研究证实了Pseudoalteromonas lipolytica生物被膜中纤维素的含量与其生物被膜的抗污损能力呈正相关[10]。本研究中利用P.lipolytica同属细菌P.atlantica和不同属细菌S.loihica,分析了其纤维素在生物被膜形成过程中及形成后对生物被膜生物学特性及对厚壳贻贝幼虫附着变态的影响。研究发现,纤维素两种处理方式处理的P.atlantica、S.loihica生物被膜对厚壳贻贝幼虫附着变态诱导活性明显降低。通过生物被膜激光共聚焦试验进一步分析,P.atlantica、S.loihica单一生物被膜胞外多糖和胞外脂含量明显高于纤维素处理的生物被膜,而蛋白含量无明显差异,因此,推测生物被膜中的胞外多糖或胞外脂含量的减少也是导致厚壳贻贝幼虫附着变态率降低的主要因素。
综上所述,纤维素对海洋细菌P.atlantica和S.loihica生物被膜的细菌密度、膜厚及胞外多糖、胞外脂质等有影响,并通过影响生物被膜抑制厚壳贻贝幼虫的附着变态。本研究结果对进一步开展厚壳贻贝幼虫附着分子机制及贝类与细菌互作关系研究提供了有益参考。
[1] Wang Chong,Bao Weiyang,Gu Zhongqi,et al.Larval settlement and metamorphosis of the mussel Mytilus coruscus in response to natural biofilms[J].Biofouling,2012,28(3):249-256.
[2] 徐嘉康,彭莉华,高伟,等.光照、水温和密度对厚壳贻贝稚贝群聚性的影响[J].大连海洋大学学报,2017,32(3):275-279.
[3] 杨金龙,王冲,顾忠旗,等.微生物膜对海洋无脊椎动物幼体附着变态的影响研究[J].海洋科学,2012,36(8):116-121.
[4] Holmström C,Kjelleberg S.Marine Pseudoalteromonas species are associated with higher organisms and produce biologically active extracellular agents[J].FEMS Microbiology Ecology,1999,30(4):285-293.
[5] Uhlinger D J,White D C.Relationship between physiological status and formation of extracellular polysaccharide glycocalyx in Pseudomonas atlantica[J].Applied and Environmental Microbiology,1983,45(1):64-70.
[6] Shikuma N J,Pilhofer M,Weiss G L,et al.Marine tube worm metamorphosis induced by arrays of bacterial phage tail-like structures[J].Science,2014,343(6170):529-533.
[7] Yang Jinlong,Shen Peijing,Liang Xiao,et al.Larval settlement and metamorphosis of the mussel Mytilus coruscus in response to monospecific bacterial biofilms[J].Biofouling,2013,29(3):247-259.
[8] Römling U,Galperin M Y.Bacterial cellulose biosynthesis:diversity of operons,subunits,products,and functions[J].Trends in Microbiology,2015,23(9):545-557.
[9] Thongsomboon W,Serra D O,Possling A,et al.Phosphoethanolamine cellulose:a naturally produced chemically modified cellulose[J].Science,2018,359(6373):334-338.
[10] Zeng Zhenshun,Guo Xing Pan,Li Baiyuan,et al.Characterization of self-generated variants in Pseudoalteromonas lipolytica biofilm with increased antifouling activities[J].Applied Microbiology and Biotechnology,2015,99(23):10127-10139.
[11] Wang Jinsong,Peng Lihua,Guo Xingpan,et al.Complete genome of Pseudoalteromonas atlantica ECSMB14104,a gammaproteobacterium inducing mussel settlement[J].Marine Genomics,2019,46:54-57.
[12] 杨金龙,郭行磐,陈芋如,等.中湿度表面的海洋细菌对厚壳贻贝稚贝附着的影响[J].水产学报,2015,39(3):421-428.
[13] Pawlik J R.Natural and artificial induction of metamorphosis ofPhragmatopoma lapidosa Californica (Polychaeta:Sabellariidae),with a critical look at the effects of bioactive compounds on marine invertebrate larvae[J].Bulletin of Marine Science,1990,46(2):512-536.
[14] 杨金龙,慎佩晶,王冲,等.微生物膜对厚壳贻贝稚贝附着的影响[J].水产学报,2013,37(6):904-909.
[15] Hadfield M G.Biofilms and marine invertebrate larvae:what bacteria produce that larvae use to choose settlement sites[J].Annual Review of Marine Science,2011,3:453-470.
[16] 杨金龙,李响,王冲,等.低盐度形成的微生物膜对厚壳贻贝稚贝附着的影响[J].海洋科学,2013,37(8):107-113.
[17] Yang Jinlong,Li Xiang,Liang Xiao,et al.Effects of natural biofilms on settlement of plantigrades of the mussel Mytilus coruscus[J].Aquaculture,2014,424-425:228-233.
[18] Li Yifeng,Guo Xingpan,Yang Jinlong,et al.Effects of bacterial biofilms on settlement of plantigrades of the mussel Mytilus coruscus[J].Aquaculture,2014,433:434-441.
[19] 周轩,郭行磐,陈芋如,等.低湿度表面的海洋附着细菌对厚壳贻贝附着的影响[J].大连海洋大学学报,2015,30(1):30-35.
[20] Huang Shuyi,Hadfield M G.Composition and density of bacterial biofilms determine larval settlement of the polychaete Hydroides elegans[J].Marine Ecology Progress Series,2003,260:161-172.
[21] Tran C,Hadfield M G.Larvae of Pocillopora damicornis(Anthozoa)settle and metamorphose in response to surface - biofilm bacteria[J].Marine Ecology Progress Series,2011,433:85-96.
[22] Kirchman D,Graham S,Reish D,et al.Bacteria induce settlement and metamorphosis of Janua (Dexiospira)brasiliensis Grube (Polychaeta:Spirprbidae)[J].Journal of Experimental Marine Biology and Ecology,1981,56(2-3):153-163.
[23] Yu Xiujuan,He Weihong,Li Hengxiang,et al.Larval settlement and metamorphosis of the pearl oyster Pinctada fucata in response to biofilms[J].Aquaculture,2010,306(1-4):334-337.
[24] Szewzyk U,Holmström C,Wrangstadh M,et al.Relevance of the exopolysaccharide of marine Pseudomonas sp.strain S9 for the attachment of Ciona intestinalis larvae[J].Marine Ecology Progress Series,1991,75(2):259-265.
[25] Martínez E,Campos-Gómez J.Oxylipins produced by Pseudomonas aeruginosa promote biofilm formation and virulence[J].Nature Communications,2016,7:13823.
[26] Dreanno C,Matsumura K,Dohmae N,et al.An α2-macroglobulin-like protein is the cue to gregarious settlement of the barnacle Balanus amphitrite[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(39):14396-14401.