蛋白质是饲料中最昂贵的成分,直接影响饲料成本,制约着水产养殖业的发展,为此寻求一个既节约成本又能保证鱼类快速生长的营养方案对优化鱼类养殖业至关重要[1]。鱼类生长主要是体内蛋白质沉积,而鱼体规格和蛋白质的种类均会影响其需求量。大量研究证实,饲料蛋白质水平为40%~56%时,可促进石斑鱼健康快速生长[2-4]。早期研究发现,以体质量特定增长率为评价指标,经线性模型得出珍珠龙胆石斑鱼幼鱼(初始体质量为6.50 g±0.00 g)最适蛋白质需求量为51.57%[5]。适宜的蛋白质水平不仅可以增强动物自身免疫力、改善机体肠道组织形态[6-7],还可优化肠道微生态环境[8-9],从而提高鱼体增重率。
高蛋白质日粮投喂断奶仔猪会抑制肠绒毛生长,从而提高仔猪腹泻率,而适当降低日粮蛋白质水平并补充主要氨基酸则有利于改善肠道健康,从而促进机体生长[10],饲料蛋白质水平能够调节水貂空肠各项形态指标[11]。此外,作为宿主的一个组成部分的肠道微生物群落也受到饲料蛋白质水平影响。珍珠龙胆石斑鱼Epinephelus lanceolatu♂×Epinephelus fuscoguttatus♀是由鞍带石斑鱼E.lanceolatu♂和棕点石斑鱼E.fuscoguttatus♀杂交而来,具有肉质鲜美、生长速度快、适应能力强、经济效益高和发展潜力大等特点[12]。目前的研究表明,石斑鱼肠道菌群组成受水体环境[13]、摄食类型[14]、不同生长阶段[15]、禁食和摄食[16]等因素的影响,但关于饲料蛋白质水平对珍珠龙胆石斑鱼肠道形态和肠道菌群的影响尚未见报道。本研究中,通过评估珍珠龙胆石斑鱼摄入不同水平蛋白质饲料后的肠道形态及其肠道菌群结构,以期了解饲料蛋白质水平对石斑鱼肠道微生态群落的影响,为龙胆石斑鱼饲料的开发及其增养殖提供参考依据。
1 材料与方法
1.1 材料
试验用鱼珍珠龙胆石斑鱼幼鱼购自广东省雷州市石斑鱼苗场。试验用水为经过沉淀、沙滤的天然海水。维生素预混料和矿物质预混料由青岛玛斯特生物技术有限公司提供。
1.2 方法
1.2.1 试验饲料配制 以红鱼粉和酪蛋白为蛋白源,鱼油和豆油为脂肪源,高筋面粉和玉米淀粉为碳水化合物源,配制6组蛋白质水平分别为35%、40%、45%、50%、55%、60%的等脂等能饲料(记为P35、P40、P45、P50、P55和P60组),所有原料经粉碎后过60目筛,按饲料配方(表1)准确称取后搅拌均匀,微量组分采取逐级扩大法混合均匀,再通过V型立式混合机(浙江正泰电器股份有限公司,JS-14S型)充分混匀,加入预先称取并混合好的鱼油和豆油,边搅拌边添加适量的水,用双螺杆挤条机(华南理工大学,F-75型)制成粒径为2.5 mm的颗粒饲料。自然风干至水分含量为10%左右时,用封口袋分装后置于冰箱(-20 ℃)中保存备用。
表1 试验饲料配方和营养水平(风干基础)
Tab.1 Ingredients and nutrient levels of the test diets (air-dry basis)
w/%
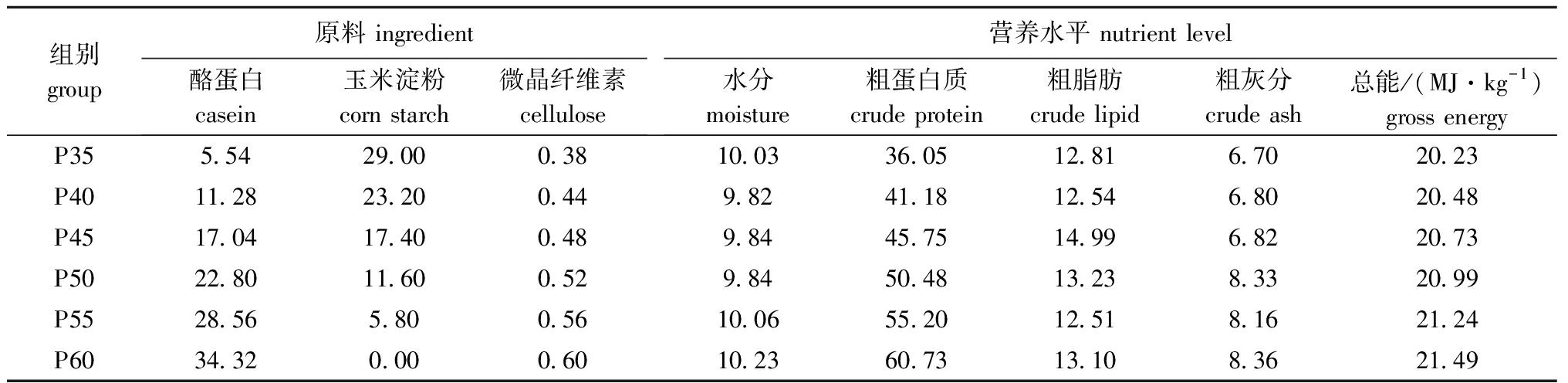
组别group原料 ingredient 酪蛋白casein玉米淀粉corn starch微晶纤维素cellulose营养水平 nutrient level水分moisture粗蛋白质crude protein粗脂肪crude lipid粗灰分crude ash总能/(MJ·kg-1)gross energyP355.5429.000.3810.0336.0512.816.7020.23P4011.2823.200.449.8241.1812.546.8020.48P4517.0417.400.489.8445.7514.996.8220.73P5022.8011.600.529.8450.4813.238.3320.99P5528.565.800.5610.0655.2012.518.1621.24P6034.320.000.6010.2360.7313.108.3621.49
注:原料中还包括红鱼粉 38.00%,高筋面粉 16.00%,鱼油 4.30%,豆油 4.30%,氯化胆碱 0.30%,磷酸二氢钙 Ca(H2PO4)2 1.00%,维生素预混料 0.30%,矿物质预混料 0.70%,维生素C 0.05%,乙氧基喹啉 0.03%,诱食剂 0.10%
Note: The other ingredients include brown fish meal of 38.00%,bread flour 16.00%,fish oil 4.30%,soybean oil 4.30%,choline chloride 0.30%,Ca(H2PO4)2 1.00%,vitamin premix 0.30%,mineral premix 0.70%,vitamin C 0.05%,ethoxyquin 0.03%,and attractant 0.10%
1.2.2 试验设计及饲养管理 将珍珠龙胆石斑鱼幼鱼在室内玻璃钢桶(1 m3)中驯化10 d,期间投喂石斑鱼商业配合饲料(广东上上生物科技有限公司,粗蛋白质≥49%,粗脂肪≥8%)。待石斑鱼稳定并适应养殖环境后,挑选健康、规格一致的试验鱼(体质量为6.50 g±0.00 g)随机分配到18个养殖桶中,养殖8周。试验共设6个处理组,每个处理设3个重复,每个重复30尾鱼,分别投喂6种不同蛋白质含量的试验饲料。每天饱食投喂两次(8:00和16:00)。养殖试验在国家(863)项目海水养殖种子工程南方基地进行。
养殖期间,水温为28~30 ℃,海水盐度为27~29,不间断充氧气,溶解氧≥5 mg/L,氨氮含量≤0.03 mg/L。定期清洗玻璃钢桶,并定时观察石斑鱼摄食情况,根据摄食情况及时调整,记录投喂量和鱼体死亡情况。
1.2.3 样品采集与处理 养殖试验结束后,禁饲24 h后取样。将石斑鱼用丁香酚(1∶10 000)麻醉后,从每个重复取2尾鱼解剖,取其肠道并分为前肠、中肠和后肠分别置于10%甲醛溶液中,用于制作肠道切片;再从每个重复中随机取3尾鱼,用75%酒精擦拭体表,用无菌解剖剪剪开腹部,取出肠道,用0.9%的无菌生理盐水冲洗肠道外壁,置于-80 ℃下保存用于菌落分析。
1.2.4 DNA提取及PCR扩增 根据E.Z.N.A.® soil试剂盒(Omega Bio-tek, Norcross, GA, U.S.)说明书进行总DNA抽提,DNA浓度和纯度利用NanoDrop2000进行检测,用10 g/L琼脂糖凝胶电泳检测DNA提取质量;用338-F(5′ACTCCTACGGGAGGCAGCAG 3′)和806-R(5′GGACTACHVGGGTWTCTAAT 3′)引物对V3~V4可变区进行PCR扩增。扩增程序为:95 ℃下预变性3 min;95 ℃下变性30 s,55 ℃下退火30 s,72 ℃下延伸30 s,共进行27个循环;最后在72 ℃下再延伸10 min(PCR仪,ABI GeneAmp© 9700型)。PCR扩增体系(共20 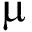 L)包含:4
L)包含:4 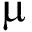 L 5×FastPfu 缓冲液,2
L 5×FastPfu 缓冲液,2 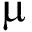 L 2.5 mmol/L dNTPs,0.8
L 2.5 mmol/L dNTPs,0.8 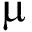 L引物(5
L引物(5 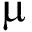 mol/L),0.4
mol/L),0.4 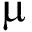 L FastPfu 聚合酶,10 ng DNA模板。
L FastPfu 聚合酶,10 ng DNA模板。
1.2.5 MiSeq测序及指标计算 使用20 g/L琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences, Union City, CA, USA) 进行纯化,用Tris-HCl洗脱,洗脱后用连接“Y”接头,使用磁珠筛选去除接头自连片段,利用PCR扩增进行文库模板的富集并以0.1 mol/L氢氧化钠变性,产生单链DNA片段,构建测序文库后,在Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。
数据分析流程:原始数据→连接质控→优化数据→OUT聚类→数据分析与信息挖掘。
使用UPARSE软件(Version 7.1,http://drive5.com/uparse/),根据97%的相似度对序列进行OTU聚类,利用RDP classifier (http://rdp.cme. msu.edu/)对每条序列进行物种分类注释,比对Silva数据库(SSU123),设置比对阈值为70%。 利用香农指数(Shannon)、辛普森指数(Simpson)、Ace和Chao指数评估各组细菌多样性和丰富度。
1.2.6 H.E染色、切片 取用10%甲醛固定好的珍珠龙胆石斑鱼前肠、中肠和后肠样本,分别常规石蜡包埋,切片厚度为6 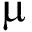 m,用苏木精-伊红(H.E)染色,在4倍全自动生物显微镜(DM600)下观察和拍照,每张切片分别用体视显微镜(SZX7)测定10个点的皱襞高度(PH)、皱襞宽度(PW)、隐窝深度(CD)和肌层厚度(MT)数据。
m,用苏木精-伊红(H.E)染色,在4倍全自动生物显微镜(DM600)下观察和拍照,每张切片分别用体视显微镜(SZX7)测定10个点的皱襞高度(PH)、皱襞宽度(PW)、隐窝深度(CD)和肌层厚度(MT)数据。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示,试验数据用SPSS 20.0软件进行单因素方差分析(One-way ANOVA),用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 珍珠龙胆石斑鱼肠道组织形态的变化
从图1可见:前肠中,饲料蛋白质水平超过45%时,肌层厚度明显变大,P50组皱襞比其他组更加浓密;中肠中,P50组皱襞发育明显比其他组好,皱襞高且规则,而P40、P55和P60组与其他组相比,皱襞相对较短,形状不规则;后肠中,P35和P40组皱襞出现脱落、变形,随着蛋白质水平升高其现象略有改善,在P50组获得良好效果,而随后皱襞又开始变得稀疏、变形且开始有损伤。

图1 饲料蛋白质水平对珍珠龙胆石斑鱼前肠、中肠和后肠组织形态的影响
Fig.1 Effects of dietary protein levels on histomorphology of the foregut, midgut and hindgut of juvenile pearl gentian grouper
从表2可见:前肠中,P50和P55组皱襞高度显著高于其他组(P<0.05),P50组皱襞宽度显著低于除P60组外的其他组(P<0.05),隐窝深度各组间并无显著性差异(P>0.05),皱襞高度与隐窝深度的比值中,P55组显著高于P35和P40组(P<0.05),P50、P55和P60组肌层厚度显著高于P35、P40和P45组(P<0.05);中肠中,各组皱襞高度并未见显著性差异(P>0.05),P50组的皱襞宽度显著低于P35和P40组(P<0.05),P50组隐窝深度显著低于P45组(P<0.05),P45组皱襞高度与隐窝深度的比值显著低于其他组(P<0.05),P50组肌层厚度显著高于除P40组外的其他组(P<0.05);后肠中,P50和P55组皱襞高度显著高于P40、P45和P60组(P<0.05),P50组皱襞宽度和隐窝深度显著低于P35组(P<0.05),P50组皱襞高度与隐窝深度的比值显著高于除P55组外的其他组(P<0.05),P50和P55组肌层厚度显著高于P45组(P<0.05)。
表2 珍珠龙胆石斑鱼肠道显微指标
Tab.2 Histomorphological microstructure of intestine in juvenile pearl gentian fed diets containing various levels of proteinμm

肠道 intestine 组别 group 皱襞高度(PH)villus height皱襞宽度(PW)villus width隐窝深度(CD)crypt depth皱襞高度/隐窝深度PH/CD肌层厚度(MT)muscle thickness前肠foregut P35344.67±28.32a29.90±3.30b38.00±4.599.50±0.38a71.86±6.68aP40369.69±1.34a30.31±0.40b38.78±5.548.79±2.52a74.69±0.46aP45350.21±6.67a29.99±0.12b35.52±3.429.97±1.19ab70.24±4.45aP50433.33±8.81b25.87±0.52a36.53±3.0412.11±1.16ab125.96±10.21bP55432.06±8.85b29.54±0.05b35.52±2.0313.00±0.20b121.27±2.24bP60366.91±34.07a29.26±1.02ab37.75±0.599.71±0.75ab109.34±12.24b中肠midgutP35256.34±41.2434.85±1.23bc32.23±2.08ab7.10±0.00bc58.97±0.77bP40274.69±8.7338.38±1.49c34.76±2.04ab7.53±0.36c62.10±3.77bcP45256.94±13.6032.48±2.89ab35.26±2.96b6.36±0.15a57.68±3.08bP50261.49±29.1227.75±2.56a30.54±1.02a7.26±0.07bc66.54±2.87cP55253.80±27.3229.92±2.04ab32.91±1.63ab6.93±022b54.65±5.11abP60238.37±10.7729.84±4.85ab30.83±2.97ab7.56±0.19c48.56±3.67a后肠hindgutP35423.33±3.27cd40.52±3.21bc39.99±1.49b10.77±0.56bc119.02±1.16abP40410.19±10.77c43.85±2.53c39.30±0.96ab10.07±1.84ab126.23±13.19abP45249.22±6.99a36.21±2.19ab34.51±4.64ab9.59±0.04ab100.88±25.86aP50434.97±4.10d33.87±2.45a33.19±0.70a12.83±0.18d141.49±18.85bP55433.32±14.69d37.37±1.85ab36.83±2.77ab11.49±0.08cd142.18±3.24bP60357.57±3.34b36.74±3.49ab38.22±2.94ab9.18±0.79a113.12±14.80ab
注:同列中标有不同字母表示同一组织不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significant differences in different groups in same tissue (P<0.05), and the means with the same letters within the same column are not significant differences(P>0.05), et sequentia
2.2 珍珠龙胆石斑鱼肠道微生物多样性的变化
2.2.1 Alpha多样性分析 从表3可见:各试验组间基于Ace指数的Alpha多样性无显著性差异(P>0.05);P55和P60组Chao指数显著高于P40、P45和P50组(P<0.05);各组间Shannon和Simpson的多样性指数分别为4.02~4.95、0.03~0.04,不同蛋白质水平对石斑鱼幼鱼肠道细菌多样性无显著性影响(P>0.05);各组Coverage指数均在0.99以上,说明未被检测细菌可能性较少。
表3 珍珠龙胆石斑鱼肠道Alpha多样性(n=3)
Tab.3 Alpha diversity in the intestinal tract of juvenile pearl gentian fed diets containing various levels of protein(n=3)
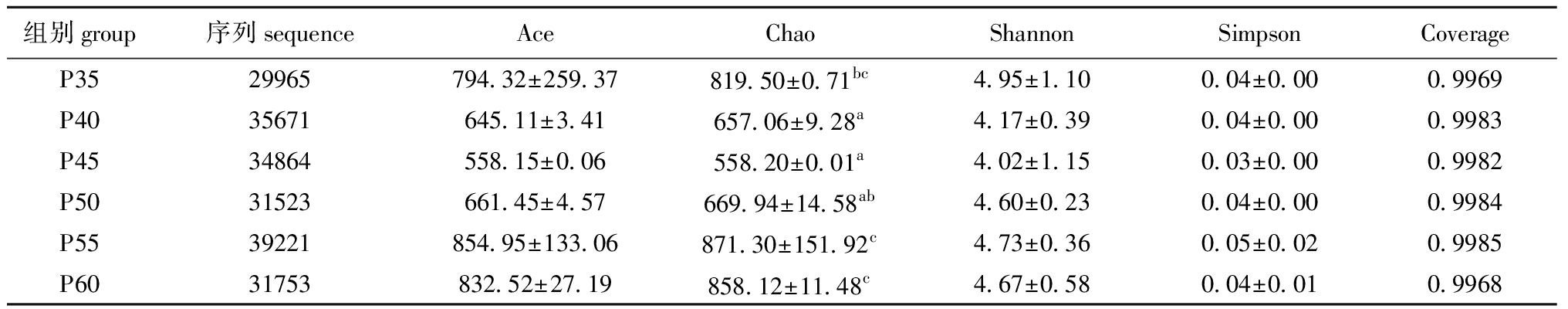
组别group序列sequenceAceChaoShannonSimpsonCoverageP3529965794.32±259.37819.50±0.71bc4.95±1.100.04±0.000.9969P4035671645.11±3.41657.06±9.28a4.17±0.390.04±0.000.9983P4534864558.15±0.06558.20±0.01a4.02±1.150.03±0.000.9982P5031523661.45±4.57669.94±14.58ab4.60±0.230.04±0.000.9984P5539221 854.95±133.06871.30±151.92c4.73±0.360.05±0.020.9985P6031753832.52±27.19858.12±11.48c4.67±0.580.04±0.010.9968
2.2.2 肠道菌落结构组成 门水平上定义相对丰度≥10%为占主导地位的细菌群。石斑鱼肠道菌群优势门依次为变形菌门Proteobacteria、放线菌门Actinobacteria、厚壁菌门Firmicutes和拟杆菌门Bacteroidetes,且总含量均高于85%。变形菌门在P50组含量最低,在其他组均较高;放线菌门在P45组含量最高,在其他组均有所下降且蛋白质水平超过50%时逐渐降到稳定水平;蛋白质含量超过45%时,厚壁菌门和拟杆菌门含量均有所升高,其中P50组含量较高(表4)。
在属水平上,红球菌属Rhodococcus、罗尔斯通菌属Ralstonia和不动杆菌属Acinetobacter是肠道细菌群落中最具优势的3个属。从表5可见:红球菌属含量在各组中均为最高,P40和P45组分别高达31.77%和41.51%,而其他组只占14%~24%;各组罗尔斯通菌属数值上差异不大;蛋白质含量超过45%时,不动杆菌属含量均有所下降,其中 P50组含量最低;假单胞菌属在P40组含量最高,在P60组含量最低,而在其他组差异不大;乳酸杆菌属则在P50组中含量最高,在其他组含量均有所下降;P45和P50组未检测到互营杆菌属细菌。
以样品的OUT数为依据构建Venn图,比较分析P35、P50和P60组间细菌多样性。从图2可见:3个处理组克隆样品OUT数分别为310、294和409,总数为1013,其中有153个共同OUT,占总数15.10%;P35、P50和P60组单独具有的OUT数分别为59、54和119,分别占总数的5.82%、5.33%和11.74%;P35与P50、P35与P60、P50与P60组共有OUT数分别为177、277和216,分别占其中两组总数的29.30%、38.53%和30.73%。这显示了以不同蛋白质水平的饲料喂养珍珠龙胆石斑鱼,对其肠道结构影响具有一定的相似性,尽管相似性高,但各组在多样性中均有一定的差异性。
表4 珍珠龙胆石斑鱼肠道中门水平细菌种群及含量
Tab.4 Communities and relative abundance of bacteria in the intestine of juvenile pearl gentian grouper at the level of phylum %
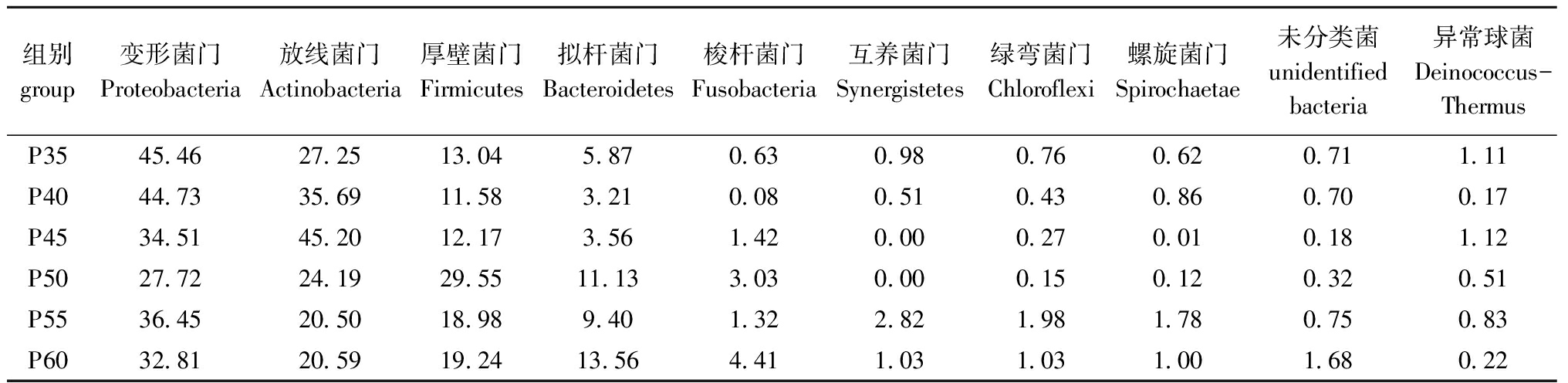
组别group变形菌门Proteobacteria放线菌门Actinobacteria厚壁菌门Firmicutes拟杆菌门Bacteroidetes梭杆菌门Fusobacteria互养菌门Synergistetes绿弯菌门Chloroflexi螺旋菌门Spirochaetae未分类菌unidentified bacteria异常球菌Deinococcus-ThermusP3545.4627.2513.045.870.630.980.760.620.711.11P4044.7335.6911.583.210.080.510.430.860.700.17P4534.5145.2012.173.561.420.000.270.010.181.12P5027.7224.1929.5511.133.030.000.150.120.320.51P5536.4520.5018.989.401.322.821.981.780.750.83P6032.8120.5919.2413.564.411.031.031.001.680.22
表5 珍珠龙胆石斑鱼肠道中属水平细菌种群及含量
Tab.5 Communities and relative abundance of bacteria in the intestine of juvenile pearl gentian grouper at the level of genus%
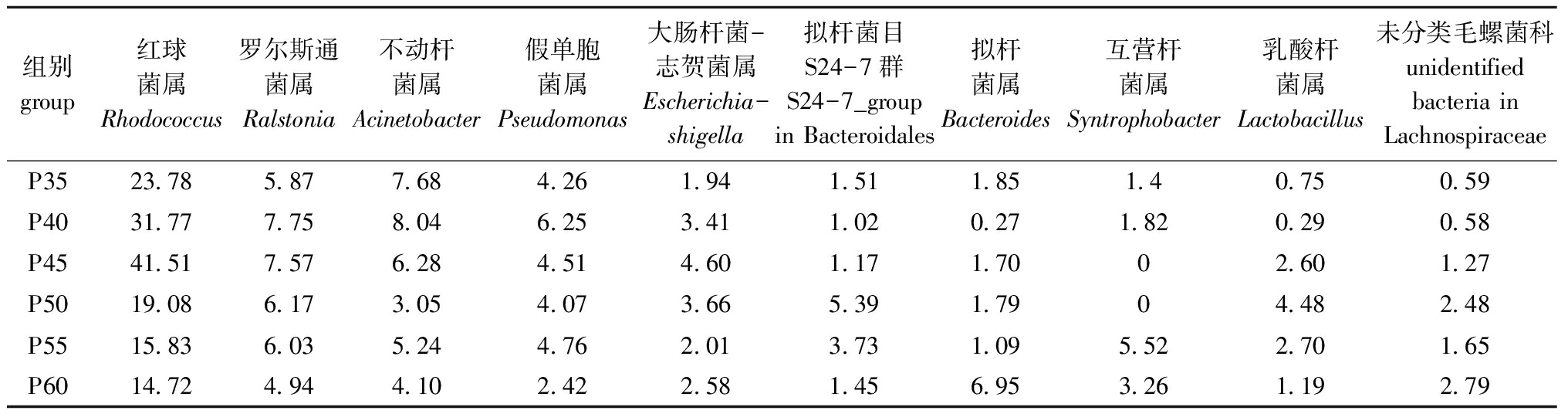
组别group红球菌属Rhodococcus罗尔斯通菌属Ralstonia不动杆菌属Acinetobacter假单胞菌属Pseudomonas大肠杆菌-志贺菌属Escherichia-shigella拟杆菌目S24-7群S24-7_groupin Bacteroidales拟杆菌属Bacteroides互营杆菌属Syntrophobacter乳酸杆菌属Lactobacillus未分类毛螺菌科unidentified bacteria inLachnospiraceaeP3523.785.877.684.261.941.511.851.40.750.59P4031.777.758.046.253.411.020.271.820.290.58P4541.517.576.284.514.601.171.7002.601.27P5019.086.173.054.073.665.391.7904.482.48P5515.836.035.244.762.013.731.095.522.701.65P6014.724.944.102.422.581.456.953.261.192.79
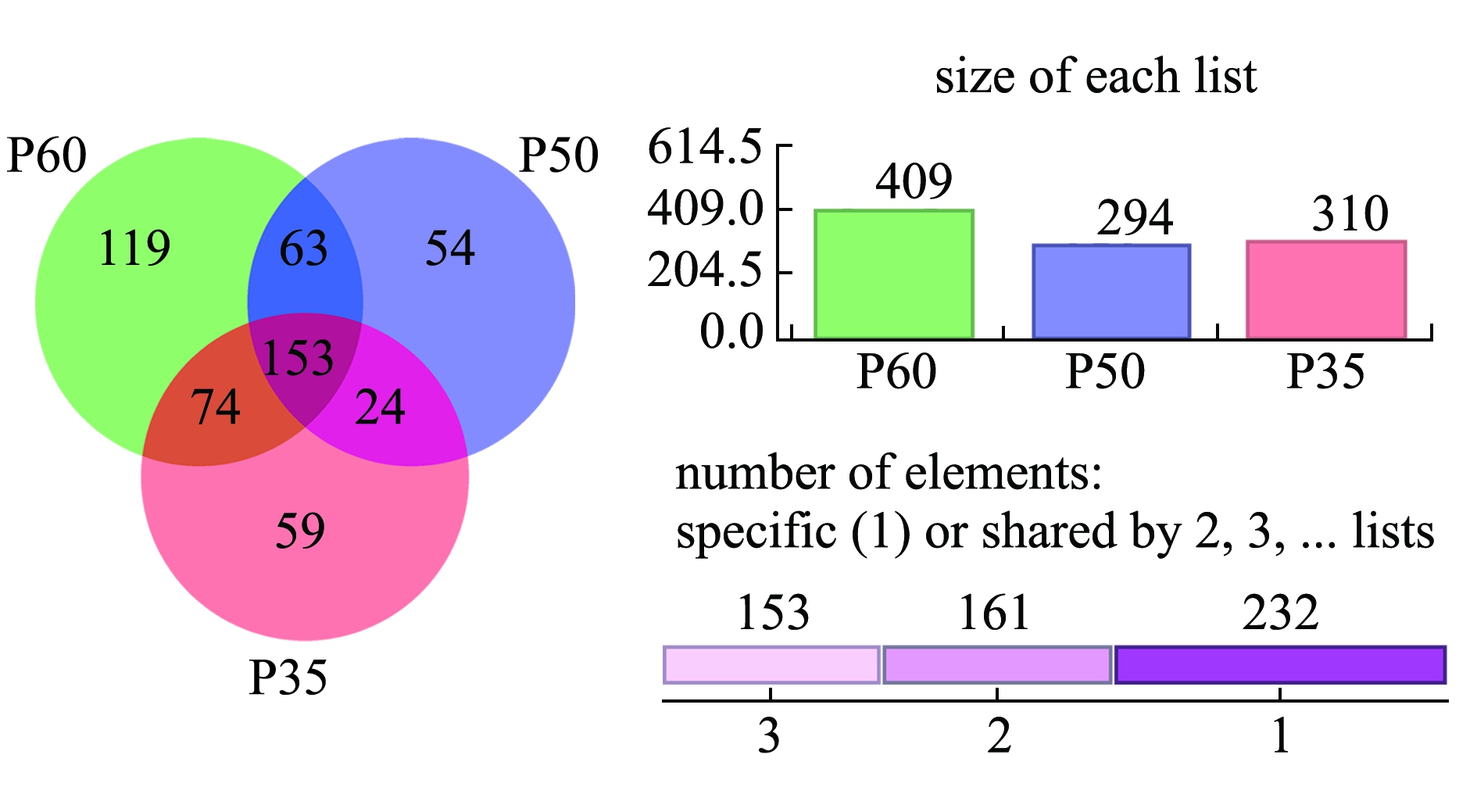
图2 P35、P50和P60组的OUT分析
Fig.2 Common OTU analysis of groups P35, P50, and P60
3 讨论
3.1 饲料蛋白质水平对珍珠龙胆石斑鱼肠道组织形态的影响
肠道隐窝深度、肌层厚度,以及皱襞的高度、宽度和疏密程度等是衡量动物消化吸收能力的重要指标。肠道隐窝是肠壁凹陷的结构,隐窝深度影响动物对营养物质吸收的能力;皱襞越高越宽越浓密,表明肠道吸收表面积越大,越有利于提高营养物质的吸收效率;肌层厚度则表示肠壁肌肉收缩能力,收缩能力强则有利于物质的吸收和运输[17-18]。适宜的饲料蛋白质水平有利于优化畜禽肠道结构,改善肠道对营养物质的吸收消化能力,从而促进机体生长[19]。然而,饲料蛋白质水平对海水鱼类肠道组织形态学的影响研究报道较少,本试验中,50%饲料蛋白质水平组鱼体肠道皱襞高度、密度均优于其余各组,该水平下石斑鱼增重率最高[5]。类似结果在建鲤[20]和团头鲂[21]中也被发现,表现为饲料蛋白质水平显著影响鱼类肠道皱褶的发育,且皱褶高度和肠道绒毛密度与其生长表现出一致的变化趋势,提示饲料蛋白质水平对鱼类肠道发育的影响可能与其生长直接相关。另外,本试验表明,适宜的蛋白质水平还能增大肠道皱襞高度与隐窝深度的比值和肌层厚度值。皱襞高度与隐窝深度的比值与肠道功能密不可分,是体现肠道黏膜分化程度的标志,其数值越大表示消化吸收能力越强。在本试验中,饲料蛋白质水平改善皱襞高度与隐窝深度的比值主要表现在前肠和后肠的P50和P55组。蛋白质水平超过45%时,前肠肌层厚度值显著升高,在P50组达到最大值,此后随蛋白质水平升高,肌层厚度值略有下降;P50组中肠肌层厚度值虽与P40组相比无显著性差异,但却显著高于其他组;P50和P55组后肠肌层厚度值显著高于P45组。综上所述,P50组肠道形态发育较之其他组好,皱襞高度与隐窝深度的比值和肌层厚度值均保持在高水平下。因此,鱼体摄入的蛋白质水平适宜时,可以较好地改善肠道形态发育,促进消化吸收机能,更好地满足生长。
3.2 饲料蛋白质水平对珍珠龙胆石斑鱼肠道菌群组成的影响
肠道有益菌属可通过改善宿主免疫调节功能、营养吸收能力和内环境调节能力来促进宿主生长[22],而有害菌属则会增加肠道黏膜层的通透性,从而导致细菌和其他大分子穿过黏膜屏障[23]。因此,建立良好的肠道微生态系统对于鱼类健康生长至关重要。
从门水平上看,本试验各组并未出现新的优势菌种,饲料蛋白质水平虽然不同,但各组优势菌群种类相同,只是其数量有所改变。有研究指出,脊椎动物尤其是哺乳动物的优势菌门为变形菌门、厚壁菌门和拟杆菌门[24],本研究结果显示,珍珠龙胆石斑幼鱼肠道优势菌门为变形菌门、放线菌门、厚壁菌门和拟杆菌门,与饲料蛋白质水平对卵形鲳鲹[8]肠道优势菌群的研究结果相似。变形菌门是细菌中最大的一门,普遍存在于海洋生物肠道之中,是罗非鱼腐败过程中的优势菌门[25],其含量过高会破坏肠道微生态环境,增加机体患病可能性[26]。放线菌门属于条件致病菌,其中某些营腐生生活菌可分泌许多胞外酶和次生代谢产物等物质参与自然界氮素循环,而某些放线菌却为致病菌,可在机体免疫能力低的时候侵染机体,产生慢性或亚急性疾病[27]。厚壁菌门在宿主肠道中被认为是促进纤维素分解[28]和帮助多糖发酵[29]的重要菌群。拟杆菌门则与DNA、蛋白质和脂质等有机物的转换密切相关,并参与糖类、胆汁酸和类固醇代谢[30]。本试验结果显示,P50组变形菌门和放线菌门含量有所降低,厚壁菌门和拟杆菌门含量有所升高,这有利于促进机体肠道对营养物质的转换和吸收。有研究指出,厚壁菌门与拟杆菌门的比值与动物肥胖相关,但究竟是正相关还是负相关至今仍存在争议[31-32],这可能是由于物种差异或机体的自身健康状况所致。本试验中厚壁菌门与拟杆菌门的比值随饲料蛋白质水平的升高呈先升后降趋势,在P40组达到最大值,P60组达到最小值,其趋势与全鱼粗脂肪含量随蛋白质水平变化的趋势一致[7],这也验证了厚壁菌门与拟杆菌门的比值影响脂代谢,由此猜想鱼体增重率提高的原因可能是脂肪对蛋白质起了节约作用。另外,蛋白质含量过低(P35组)或过高(P60组),有益菌含量减少而变形菌门含量增多(相对P50组),这可能是由于变形菌门适应性较强,在低蛋白质环境下仍能争夺大量营养用于自身繁殖,并竞争大量的肠道黏附位点,从而导致有益菌含量减少。另一方面,机体分解肠道中高蛋白质饲料会加剧消化器的负担,长久的积累可能会造成系统缺陷,最终导致致病菌侵入肠道并大量繁殖。
从属水平来说,各组肠道红球菌属、罗尔斯通氏菌属和不动杆菌属为优势菌群。红球菌属可参与工业合成和转化、生物去污,产生许多生物表面活性剂及生物絮凝剂等,具有较好的生态价值,然而,在生物学上却常为许多动物的致病菌,如马红球菌能够通过破坏动物呼吸系统,从而引起机体产生病变[33]。罗尔斯通氏菌属和不动杆菌属是致病菌,可分别导致人体产生菌血症、败血症和各种炎症[34],并使鳟和印度鲤等水产动物产生溃疡等病症[35]。假单胞菌属为条件致病菌,在环境良好的作用下,能产生多种抗生素和活性小分子物质,具有抗菌溶菌作用,而在不良环境下会使鱼体体表溃烂,体内肿胀充血等[36]。乳酸菌属是水生动物的有益菌,主要是通过分泌乳酸等有机酸降低pH来抑制革兰氏致病菌扩散,对增强肠道免疫力、改善肠道结构、提高抗病力等具有重要意义[37]。Liu等[20]研究显示,饲料蛋白质水平影响建鲤幼鱼肠道乳酸菌的含量,低蛋白质组乳酸菌含量显著低于其他各组,而嗜水气单胞菌含量显著高于其他各组。本试验中,低蛋白质组乳酸菌含量同样有所下降,与此同时,P50组乳酸菌属含量有所提高,而红球菌属和不动杆菌属含量均有所下降,这反映了该蛋白质水平有利于肠道良好微生态的构建。另外,在对畜禽的研究发现,低蛋白质日粮可有效减少仔猪肠道致病菌的繁殖,并增加乳酸杆菌等益生菌在肠道定植,从而缓解仔猪肠道功能紊乱等问题[38]。而在本试验中,低蛋白质组致病菌尚无明显减少,这可能是由于物种差异所致,石斑鱼更倾向于利用蛋白质提供能量,对碳水化合物利用能力较弱,而仔猪则能够更好地利用碳水化合物供能。此外,肠道微生物的组成与众多因素有关,其中包括养殖环境、养殖种类、饲料成分和养殖对象的不同生长阶段等[39],因此,多角度评估肠道微生物对宿主生长产生的影响显得尤为重要。
[1] 陈蓝荪,陈乃松,黄旭雄.中国水产饲料工业与世界鱼粉市场[J].水产科技情报,2014,41(4):209-215.
[2] Wang Jiteng,Jiang Yudong,Li Xinyu,et al.Dietary protein requirement of juvenile red spotted grouper (Epinephelus akaara)[J].Aquaculture,2016,450:289-294.
[3] Shapawi R,Ebi I,Yong A S K,et al.Optimizing the growth performance of brown-marbled grouper,Epinephelus fuscoguttatus(Forskal),by varying the proportion of dietary protein and lipid levels[J].Animal Feed Science & Technology,2014,191(5):98-105.
[4] 杨俊江.三个生长阶段斜带石斑鱼蛋白质、脂肪和碳水化合物需要量研究[D].湛江:广东海洋大学,2013.
[5] 郭鑫伟,谭北平,迟淑艳,等.摄食不同蛋白质水平饲料的珍珠龙胆石斑鱼幼鱼生长与血清激素和消化酶活性的相关性分析[J].水产学报,2019,43(8):1808-1820.
[6] Kaushik S J,Seiliez I.Protein and amino acid nutrition and metabolism in fish:current knowledge and future needs[J].Aquaculture Research,2010,41(3):322-332.
[7] 孙金辉,范泽,张美静,等.饲料蛋白水平对鲤幼鱼肝功能和抗氧化能力的影响[J].南方水产科学,2017,13(3):113-119.
[8] 唐媛媛.饲料蛋白质水平对卵形鲳鲹消化酶、非特异性免疫和肠道内容物细菌的影响[D].厦门:厦门大学,2014.
[9] Lynch M B,Sweeney T,Callan B F J J,et al.The effect of high and low dietary crude protein and inulin supplementation on nutrient digestibility,nitrogen excretion,intestinal microflora and manure ammonia emissions from finisher pigs[J].Animal,2007,1(8):1112-1121.
[10] 郝瑞荣,岳文斌,范志勇,等.日粮蛋白质水平对断奶仔猪肠道发育的影响[J].激光生物学报,2009,18(3):383-388.
[11] 张铁涛,崔虎,岳志刚,等.饲粮蛋白质水平对冬毛期水貂胃肠道消化酶活性以及空肠形态结构的影响[J].动物营养学报,2012,24(2):376-382.
[12] Li Songlin,Li Ziqiang,Sang Chunyan,et al.Glucose transporters in pearl gentian grouper (Epinephelus fuscoguttatus♀×E. lanceolatus♂):molecular cloning,characterization,tissue distribution and their expressions in response to dietary carbohydrate level[J].Aquaculture Research,2018,49(1):253-264.
[13] 孙敏秋,林克冰,葛辉,等.基于宏基因组比较分析石斑鱼育苗两种模式水体中的菌群多样性和分布特点[J].渔业研究,2016,38(3):181-191.
[14] 丛林梅.商品饲料和冰鲜杂鱼对珍珠龙胆石斑鱼生长、抗氧化、脂质代谢、肠道菌群和品质的影响[D].长春:吉林农业大学,2016.
[15] 孙云章,凌泽春,杨红玲,等.斜带石斑鱼稚鱼和早期幼鱼消化道可培养菌群研究[J].华南农业大学学报,2010,31(3):65-70.
[16] Mekuchi M,Asakura T,Sakata K,et al.Intestinal microbiota composition is altered according to nutritional biorhythms in the leopard coral grouper (Plectropomus leopardus)[J].PLoS One,2018,13(6):e0197256.
[17] 李美君,方成堃,张凯,等.饲粮中添加乳铁蛋白对早期断奶仔猪生长性能、肠道菌群及肠黏膜形态的影响[J].动物营养学报,2012,24(1):111-116.
[18] 翟少伟,史庆超,陈学豪.饲料中添加抗菌肽Surfactin对吉富罗非鱼肠道健康的影响[J].水生生物学报,2016,40(4):823-829.
[19] Wu Yunpeng,Jiang Zongyong,Zheng Chuntian,et al.Effects of protein sources and levels in antibiotic-free diets on diarrhea,intestinal morphology,and expression of tight junctions in weaned piglets[J].Animal Nutrition,2015,1(3):170-176.
[20] Liu Yong,Feng Lin,Jiang Jun,et al.Effects of dietary protein levels on the growth performance,digestive capacity and amino acid metabolism of juvenile Jian carp (Cyprinus carpio var. Jian)[J].Aquaculture Research,2009,40(9):1073-1082.
[21] 姚林杰.团头鲂(Megalobrama amblycephala)三个生长阶段适宜蛋白/脂肪(蛋白/能量)比和脂肪需要量的研究[D].苏州:苏州大学,2013.
[22] Cahenzli J,Köller Y,Wyss M,et al.Intestinal microbial diversity during early-life colonization shapes long-term IgE levels[J].Cell Host & Microbe,2013,14(5):559-570.
[23] Lee D J,Drongowski R A,Coran A G,et al.Evaluation of probiotic treatment in a neonatal animal model[J].Pediatric Surgery International,2000,16(4):237-342.
[24] Qin Junjie,Li Ruiqiang,Raes J,et al.A human gut microbial gene catalogue established by metagenomic sequencing[J].Nature,2010,464(7285):59-65.
[25] 韩少锋.罗非鱼腐败过程菌群结构分析及腐败菌的分离、鉴定与调控[D].北京:中国农业科学院,2010.
[26] Shin N R,Whon T W,Bae J W.Proteobacteria:microbial signature of dysbiosis in gut microbiota[J].Trends in Biotechnology,2015,33(9):496-503.
[27] 李秀丽,李祥翠,廖万清.放线菌病的研究进展[J].中国真菌学杂志,2008,3(3):189-192.
[28] Brulc J M,Antonopoulos D A,Berg Miller M E,et al.Gene-centric metagenomics of the fiber-adherent bovine rumen microbiome reveals forage specific glycoside hydrolases[J].Proceedings of the National Academy of Sciences of the United States of America,2009,106(6):1948-1953.
[29] 王琨,孙云章,李富东,等.饲料中添加两种寡糖和一种芽孢杆菌对牙鲆肠道菌群的影响[J].大连海洋大学学报,2011,26(4):299-305.
[30] Michaud L,Lo Giudice A,Troussellier M,et al.Phylogenetic characterization of the heterotrophic bacterial communities inhabiting a marine recirculating aquaculture system[J].Journal of Applied Microbiology,2009,107(6):1935-1946.
[31] Venema K.Role of gut microbiota in the control of energy and carbohydrate metabolism[J].Current Opinion in Clinical Nutrition and Metabolic Care,2010,13(4):432-438.
[32] Ley R E,Turnbaugh P J,Klein S,et al.Microbial ecology:human gut microbes associated with obesity[J].Nature,2006,444(7122):1022-1023.
[33] Cisek A A,Rzewuska M,Witkowski L,et al.Antimicrobial resistance in Rhodococcus equi[J].Acta Biochimica Polonica,2014,61(4):633-638.
[34] 李金钟,李中华,刘利平.罗尔斯顿菌属和亲铜菌属的研究进展[J].国际检验医学杂志,2008,29(5):437-439.
[35] Behera B K,Paria P,Das A,et al.Molecular characterization and pathogenicity of a virulent Acinetobacter baumannii associated with mortality of farmed Indian major carp Labeo rohita (Hamilton 1822)[J].Aquaculture,2017,471:157-162.
[36] 杨海君,谭周进,肖启明,等.假单胞菌的生物防治作用研究[J].中国生态农业学报,2004,12(3):158-161.
[37] 章文明,汪海峰,刘建新.乳酸杆菌益生作用机制的研究进展[J].动物营养学报,2012,24(3):389-396.
[38] Rist V T S,Weiss E,Eklund M,et al.Impact of dietary protein on microbiota composition and activity in the gastrointestinal tract of piglets in relation to gut health:a review[J].Animal,2013,7(7):1067-1078.
[39] 蔡雪峰,罗琳,战文斌,等.壳寡糖对虹鳟幼鱼肠道菌群影响的研究[J].中国海洋大学学报,2006,36(4):606-610.