饲料中脂肪作为鱼类的主要能量来源会影响其生长及发育,鱼类的大部分生命活动需要依靠脂肪来维持[1]。Takeuchi 等[2]研究发现,提高鱼类饲料脂肪含量会使蛋白质更多地被用于生长发育,适当增加脂肪含量可以增加饲料中蛋白质的利用率。饲料中脂肪水平偏低时,鱼类就会利用体内的蛋白质作为能量来源,从而对鱼类的生长产生影响[3-5]。饲料中脂肪含量过高,也会对鱼类造成一定的影响,脂肪摄入过量时,鱼类的腹腔、肠壁及肝脏等部位会大量囤积脂肪,造成鱼体代谢紊乱[6]。
饲料中的脂肪水平也会影响脂溶性色素的利用效果。薛继鹏[7]着重探究了脂类对鱼类着色及类胡萝卜素吸收累积的影响。叶黄素是类胡萝卜素的一种,与β胡萝卜素相似,也是维生素A的前体,作为一种脂溶性色素,可以借助食物中摄取的脂肪为载体更好地被鱼体吸收利用,从而达到增色效果[8-9]。由于鱼类体内无法自身合成叶黄素,但可以消化吸收叶黄素并积累在鱼体内,故为了让鱼类色泽鲜艳并富含叶黄素可以在饲料中添加适量叶黄素[10]。
淡黑镊丽鱼Labidochromis caeruleus隶属于鲈形目慈鲷科镊丽鱼属,属于马拉维湖慈鲷岩栖类,是一种极具观赏价值的鱼类。成年个体呈橙黄色,可适应人工饲料[11]。目前,国内外对淡黑镊丽鱼的研究主要集中在形态学等基础研究方面。本试验中,探讨了饲料中脂肪水平对淡黑镊丽鱼生长状况、体态及色素积累的影响,旨在完善淡黑镊丽鱼营养生理学基础数据。也为淡黑镊丽鱼配合饲料的开发提供理论参考。
1 材料与方法
1.1 材料
试验用淡黑镊丽幼鱼自行繁育于当地养殖场,体长为(4.7±0.1)cm,体质量为(1.70±0.09)g。
1.2 方法
1.2.1 试验饲料的制备 由大连龙源海洋生物有限公司提供饲料原料,原料通过研磨、过筛后利用搅拌器充分混匀,用小型颗粒饲料制粒机压制而成。经过60 ℃烘箱烘干,使饲料含水量稳定于18%,避光、真空密封存放于冰箱(-20 ℃)中。其中脂肪源由大豆油(益海嘉里食品营销有限公司,上海)提供,混合矿物质和混合维生素预混料配方参照文献[12]。试验饲料的基本营养成分及比例引用作者之前同系列试验配方[13],配制成5组等氮饲料(表1)。
表1 试验饲料营养成分含量
Tab.1 Nutrient levels of the trial diets %
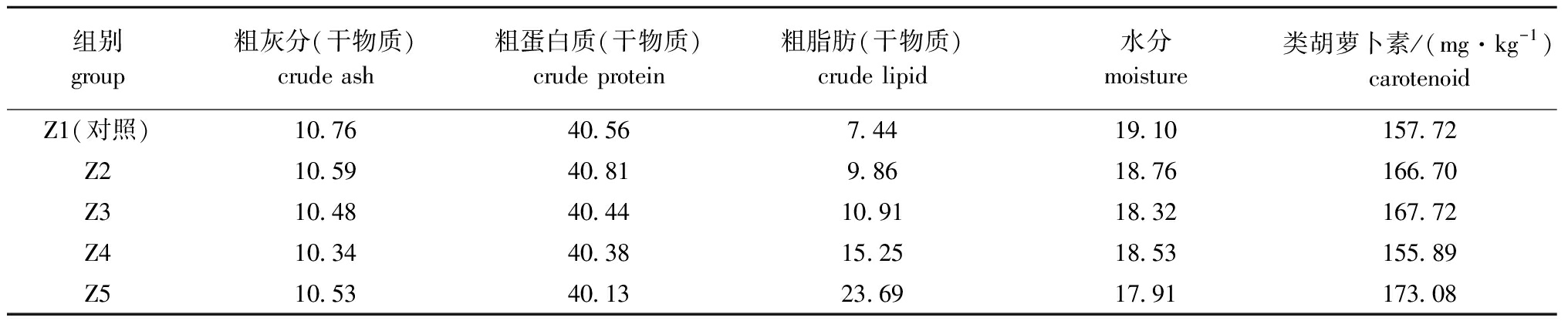
组别group粗灰分(干物质)crude ash粗蛋白质(干物质)crude protein粗脂肪(干物质)crude lipid水分moisture类胡萝卜素/(mg·kg-1)carotenoidZ1(对照)10.7640.567.4419.10157.72Z210.5940.819.8618.76166.70Z310.4840.4410.9118.32167.72Z410.3440.3815.2518.53155.89Z510.5340.1323.6917.91173.08
1.2.2 试验设计及饲养管理 将试验鱼暂养一周后,取120尾状态良好的淡黑镊丽鱼随机分成5个试验组,即Z1(对照)、Z2、Z3、Z4、Z5组,分别投喂饲料脂肪水平为7.44%、9.86%、10.91%、15.25%和23.69%的5组试验饲料,各试验组设3个平行,每个平行组饲养8尾试验鱼。整个试验过程中,将所有组均随机置于控温循环水系统(大连汇新钛有限责任公司)中,共用15个水槽,水温为25.0 ℃,循环水流量为3 L/min,养殖水体体积为30 L,每日8:00和16:00表观饱食投喂2次。投喂1 h后吸底,养殖过程中用吸管虹吸循环水系统中的粪便,每日18:00换水20%,以保证水质稳定良好,每日光照12 h。用气泵持续充气,确保氧气充足(溶解氧≥7.0 mg/L)。养殖试验共进行68 d。
1.2.3 样品的采集 试验开始时测定试验鱼初始体长、体质量和体色,试验过程中对每组鱼进行观察并记录死亡状况。每20 d使用色差仪(Konica Minolta Spectrophotometer CM-2600d)测量鱼体体色。试验结束后停食24 h,从每个平行组随机取6尾鱼,精确测量其体长、体质量后,解剖称量其内脏团、肠道和肝脏质量,取其肌肉、皮肤(带鳞片)、眼、肝脏、背鳍、尾鳍、胸鳍、腹鳍、臀鳍分别做混样测定总类胡萝卜素含量。取每组试验鱼肝脏混合样,使用南京建成试剂盒测定转氨酶活性。
1.2.4 指标的测定及计算
(1)鱼体生长指标。对淡黑镊丽鱼的饲料系数、特定生长率、脏体比、肝体比、增重率、存活率和肥满度进行测定与计算,即
增重率(BWG)=(Wt-W0)/W0×100%,
特定生长率 (SGR)=(lnWt-lnW0)/t×100%,
饲料系数 (FCR)=C/(Wt-W0),
肥满度 (CF)=Wt/L3×100%,
肝体比(HSI)=WH/Wt×100%,
脏体比(VSI)=WV/Wt×100%,
存活率(SR)=Nt/N0×100%。
其中:Wt、W0分别为终末和初始试验鱼体质量(g);Nt、N0分别为终末和初始试验鱼数量(ind.);L为鱼体长度(cm);C为摄饵量(干质量,g);t为试验时间(d);WH为鱼体肝脏质量(g);WV为鱼体内脏团质量(g)。
采用Foss Kjeltec 8400系列凯氏定氮仪测定淡黑镊丽鱼样品的粗蛋白质含量,分别采用国标GB/T 6433—1994、GB/T 6438—1992、GB/T 6435—1986测定粗脂肪、粗灰分和水分含量。
(2)鱼体色度。参照Robinson[14]的方法,以L*(亮度)、a*(+a*代表偏红,-a*代表偏绿)、b*值(+b*代表偏黄,-b*代表偏蓝)来代表颜色的状态对体色进行检测。本试验中采用色差仪(Konica Minolta Spectrophotometer CM—2600d)进行检测,随机抽取每个平行组中的4尾鱼于胸鳍后侧线处测得L*、a*、b*值并进行统计分析。
(3)总类胡萝卜素含量。参考崔培等[15]的方法略做修改,取适量样品记录样品质量后,对淡黑镊丽鱼的眼、肝脏、肌肉、皮肤(带鳞片)、鳍各组织及饲料进行总类胡萝卜素含量(mg/kg)的测定,即
总类胡萝卜素含量=A×K×V/(E×G)。
其中:A为吸光度值;K为系数(104 mg/L);V为提取液体积(mL);E为摩尔消光系数(2500);G为样品质量(g)。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,采用SPSS 20.0软件对试验数据进行单因素方差分析,并用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 淡黑镊丽鱼的生长性能
从表2可见:淡黑镊丽鱼的终末体质量和特定生长率随着摄入脂肪量的增加呈先增后降趋势,并于Z3组出现最高值,且显著高于Z1组(P<0.05);Z3组的增重率最高且显著高于Z1和Z2组(P<0.05);Z3、Z4组存活率最高,Z5组存活率最低且显著低于其他各组(P<0.05);饲料系数随饲料脂肪水平的增加呈先降后增的趋势,并在Z3组出现最低值,Z1组出现最高值且显著高于其他组(P<0.05)。
饲料脂肪水平与淡黑镊丽鱼体质量特定生长率之间的关系如图1所示,通过折线模型回归方程得出饲料脂肪水平在10.76%时淡黑镊丽鱼的体质量特定生长率最大,为1.46%/d。
表2 饲料脂肪水平对淡黑镊丽鱼生长性能的影响
Tab.2 Effect of dietary lipid levels on growth performance of cichlid Labidochromis caeruleus
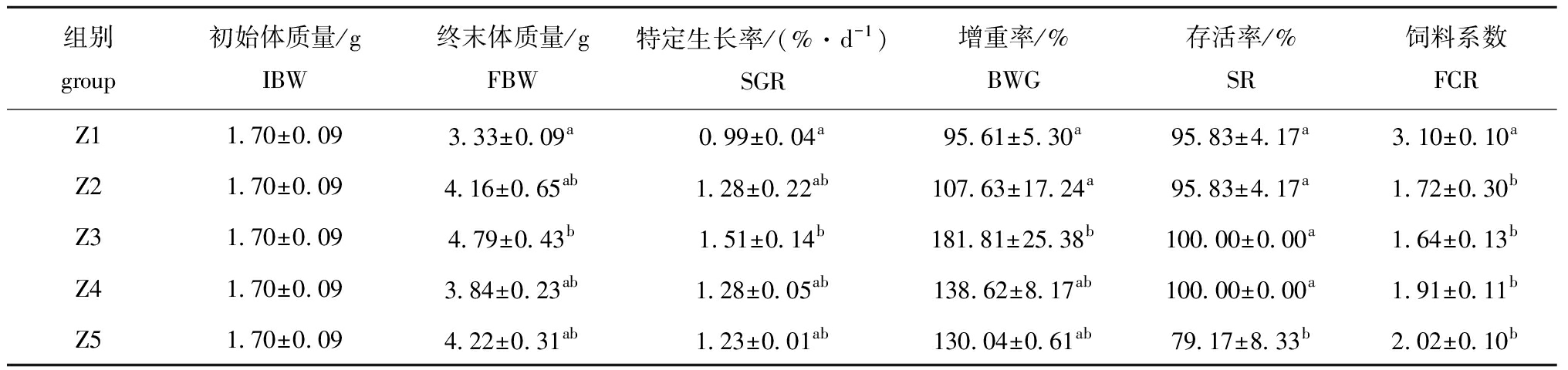
组别group初始体质量/gIBW终末体质量/gFBW特定生长率/(%·d-1)SGR增重率/%BWG存活率/%SR饲料系数FCRZ11.70±0.093.33±0.09a0.99±0.04a95.61±5.30a95.83±4.17a3.10±0.10aZ21.70±0.094.16±0.65ab1.28±0.22ab107.63±17.24a95.83±4.17a1.72±0.30bZ31.70±0.094.79±0.43b1.51±0.14b181.81±25.38b100.00±0.00a1.64±0.13bZ41.70±0.093.84±0.23ab1.28±0.05ab138.62±8.17ab100.00±0.00a1.91±0.11bZ51.70±0.094.22±0.31ab1.23±0.01ab130.04±0.61ab79.17±8.33b2.02±0.10b
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significantly different among the groups at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
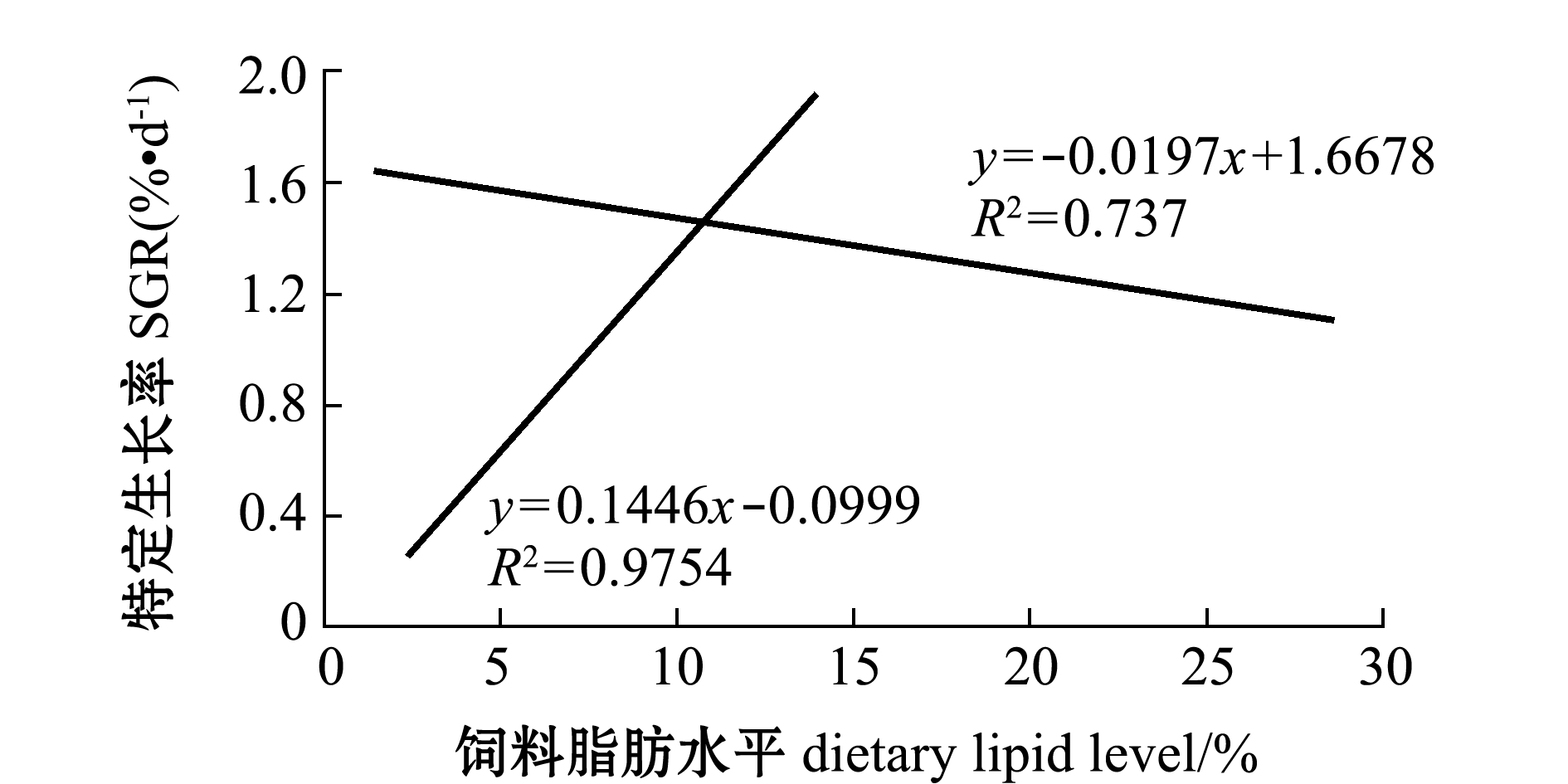
图1 饲料脂肪水平与体质量特定生长率的回归分析
Fig.1 Regression analysis between dietary lipid levels and SGR
2.2 淡黑镊丽鱼肝体比、脏体比和肥满度的变化
从表3可见:饲料中脂肪水平的变化对淡黑镊丽鱼脏体比无显著性影响(P>0.05);Z3和Z4组淡黑镊丽鱼肝体比较低且显著低于其他组(P<0.05);肥满度随摄入脂肪量的增加呈现先增后降的趋势,Z3组出现最大值且显著高于其他组(P<0.05)。
2.3 鱼体各部分总类胡萝卜素含量的变化
从表4可见:肌肉和皮肤(含鳞片)中总类胡萝卜素含量随着摄入脂肪量的增加整体上呈升高趋势,但各组间无显著性差异(P>0.05);摄入脂肪量的增加主要对肝脏、背鳍、尾鳍、胸鳍、腹鳍中总类胡萝卜素含量产生显著影响,并于Z5组出现最高值(P<0.05);臀鳍中总类胡萝卜素含量于Z4组出现最高值,且Z4、Z5组显著高于其他组(P<0.05)。淡黑镊丽鱼身体各部分的总类胡萝卜素的含量比较显示,鳍和皮肤(含鳞片)中的含量比肌肉、肝脏和眼中要高,肌肉中的含量最低,背鳍中的含量最高。
表3 饲料脂肪水平对淡黑镊丽鱼形体指数的影响
Tab.3 Effect of dietary lipid levels on body indices of cichlid Labidochromis caeruleus
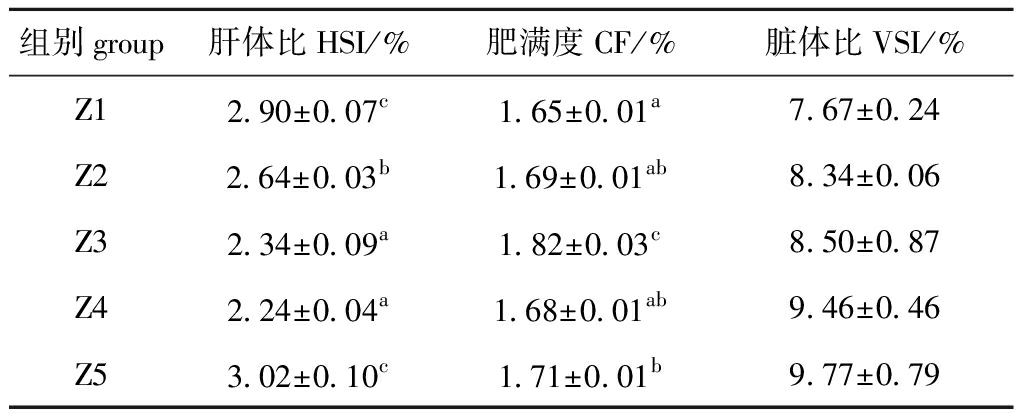
组别group肝体比HSI/%肥满度CF/%脏体比VSI/%Z12.90±0.07c1.65±0.01a7.67±0.24Z22.64±0.03b1.69±0.01ab8.34±0.06Z32.34±0.09a1.82±0.03c8.50±0.87Z42.24±0.04a1.68±0.01ab9.46±0.46Z53.02±0.10c1.71±0.01b9.77±0.79
表4 饲料脂肪水平对淡黑镊丽鱼各组织总类胡萝卜素含量的影响
Tab.4 Effect of dietary lipid levels on total carotenoid contents in different organs of cichlid Labidochromis caeruleus
mg/kg
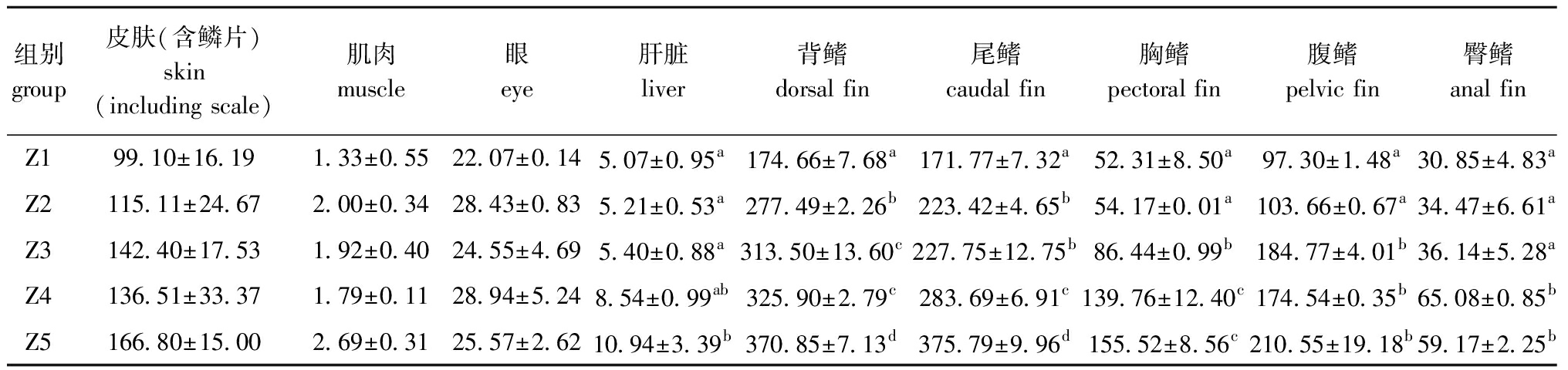
组别group皮肤(含鳞片)skin(including scale)肌肉muscle眼eye肝脏liver背鳍dorsal fin尾鳍caudal fin胸鳍pectoral fin腹鳍pelvic fin臀鳍anal finZ199.10±16.191.33±0.5522.07±0.145.07±0.95a174.66±7.68a171.77±7.32a52.31±8.50a97.30±1.48a30.85±4.83aZ2115.11±24.672.00±0.3428.43±0.835.21±0.53a277.49±2.26b223.42±4.65b54.17±0.01a103.66±0.67a34.47±6.61aZ3142.40±17.531.92±0.4024.55±4.695.40±0.88a313.50±13.60c227.75±12.75b86.44±0.99b184.77±4.01b36.14±5.28aZ4136.51±33.371.79±0.1128.94±5.248.54±0.99ab325.90±2.79c283.69±6.91c139.76±12.40c174.54±0.35b65.08±0.85bZ5166.80±15.002.69±0.3125.57±2.6210.94±3.39b370.85±7.13d375.79±9.96d155.52±8.56c210.55±19.18b59.17±2.25b
2.4 淡黑镊丽鱼体表色度的变化
从图2可见:随着饲料脂肪水平的增加,各组间亮度无显著性差异(P>0.05),红度呈升高趋势,黄度呈先升后降趋势且在Z3组开始平缓下降;红度和黄度在试验进行到40 d后各处理组间有显著性差异(P<0.05);试验结束时(68 d),Z4、Z5组红度显著高于Z1和Z3组(P<0.05),Z1组黄度显著低于其余各组(P<0.05);随养殖时间的延长,Z4和Z5组鱼红度有显著升高的趋势(P<0.05),Z3、Z4、Z5组鱼黄度有显著升高的趋势(P<0.05)。
2.5 淡黑镊丽鱼转氨酶活力的变化
从表5可见:淡黑镊丽鱼肝脏谷草转氨酶活力随饲料脂肪水平的增加有升高趋势,但各组间均无显著性差异(P>0.05);饲料中过高的脂肪含量(Z5)和过低的脂肪含量(Z1)对谷丙转氨酶的活力有显著性影响(P<0.05)。
表5 饲料脂肪水平对淡黑镊丽鱼肝脏转氨酶活力的影响
Tab.5 Effect of dietary lipid levels on transaminase activities of cichlid Labidochromis caeruleus
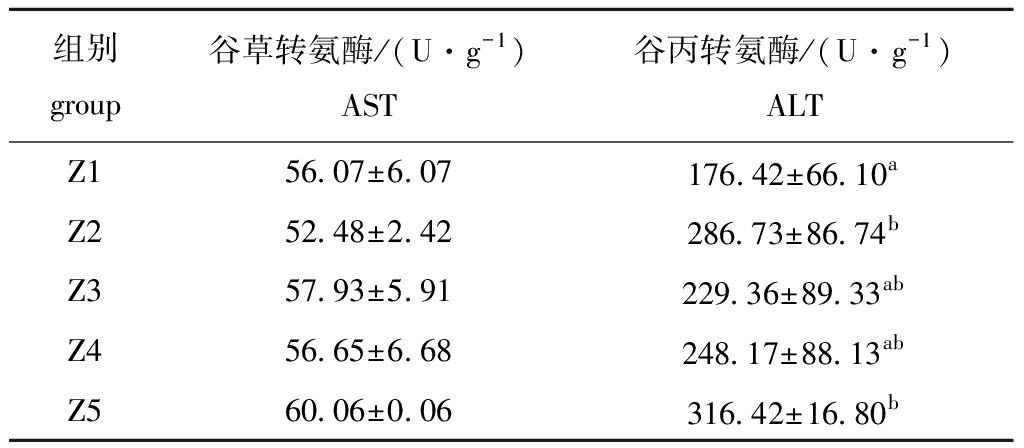
组别group谷草转氨酶/(U·g-1)AST谷丙转氨酶/(U·g-1)ALTZ156.07±6.07176.42±66.10aZ252.48±2.42286.73±86.74bZ357.93±5.91229.36±89.33abZ456.65±6.68248.17±88.13abZ560.06±0.06316.42±16.80b
3 讨论
3.1 饲料脂肪水平对淡黑镊丽鱼生长状况的影响
饲料中的脂肪是动物脂肪酸的来源及维持机体正常生长和发育的重要能量物质。由于鱼类对碳水化合物利用率低,主要的能量来源由蛋白质和脂肪提供。本试验中淡黑镊丽鱼的特定生长率和体增重率随饲料脂肪水平的增加呈先增高后降低的趋势,并在10.91%饲料脂肪组(Z3)出现峰值,而饲料系数则呈现相反的变化趋势。造成此现象,一方面可能是因为饲料中脂肪含量不足时,就会迫使蛋白质作为供能物质,而使蛋白质无法更好地用于鱼体的生长发育,故在饲料中适当提高脂肪含量,能够减少蛋白质作为供能物质的消耗[16],从而促进鱼生长;另一方面,适量的脂肪还可以促进脂溶性的维生素更好地被吸收利用[17]。但若是饲料脂肪水平高于所需水平,饲料中的能蛋比平衡被打破,脂肪的消化利用率会降低,从而抑制肌肉中脂肪酸的合成,对有些种类的鱼还会产生高血糖效应,同时还对葡萄糖-6-磷酸酶(G6Pase)活性及基因的表达产生诱导作用,对碳水化合物的利用效率产生影响,导致鱼体生长发育速度下降[18-19]。饲料脂肪较高还会影响其他营养物质的消化吸收[20],故脂肪添加量过高或过低均不利于鱼的生长发育。本研究中,通过饲料脂肪水平与体质量特定生长率的折线模型分析得出最适的脂肪添加量为10.76%,其体质量特定生长率为1.46%/d。本试验中23.69%高脂肪饲料组存活率显著低于其他脂肪组,在试验取样解剖中发现,15.25%和23.69%饲料脂肪组试验鱼的体腔、肠道及肝脏都覆盖有大量的脂肪,并且饲料脂肪水平为23.69%时肝脏体积极大,肝脏颜色发生变化,可能为肝脏损伤的一种表现。Otwell等[21]在试验中也发现相似现象,其解释为饲料中的脂肪含量过高会使鱼体摄入多余的脂肪大量累积于腹腔、肌肉、脏器等部位,严重时会诱发脂肪肝,最终导致死亡。
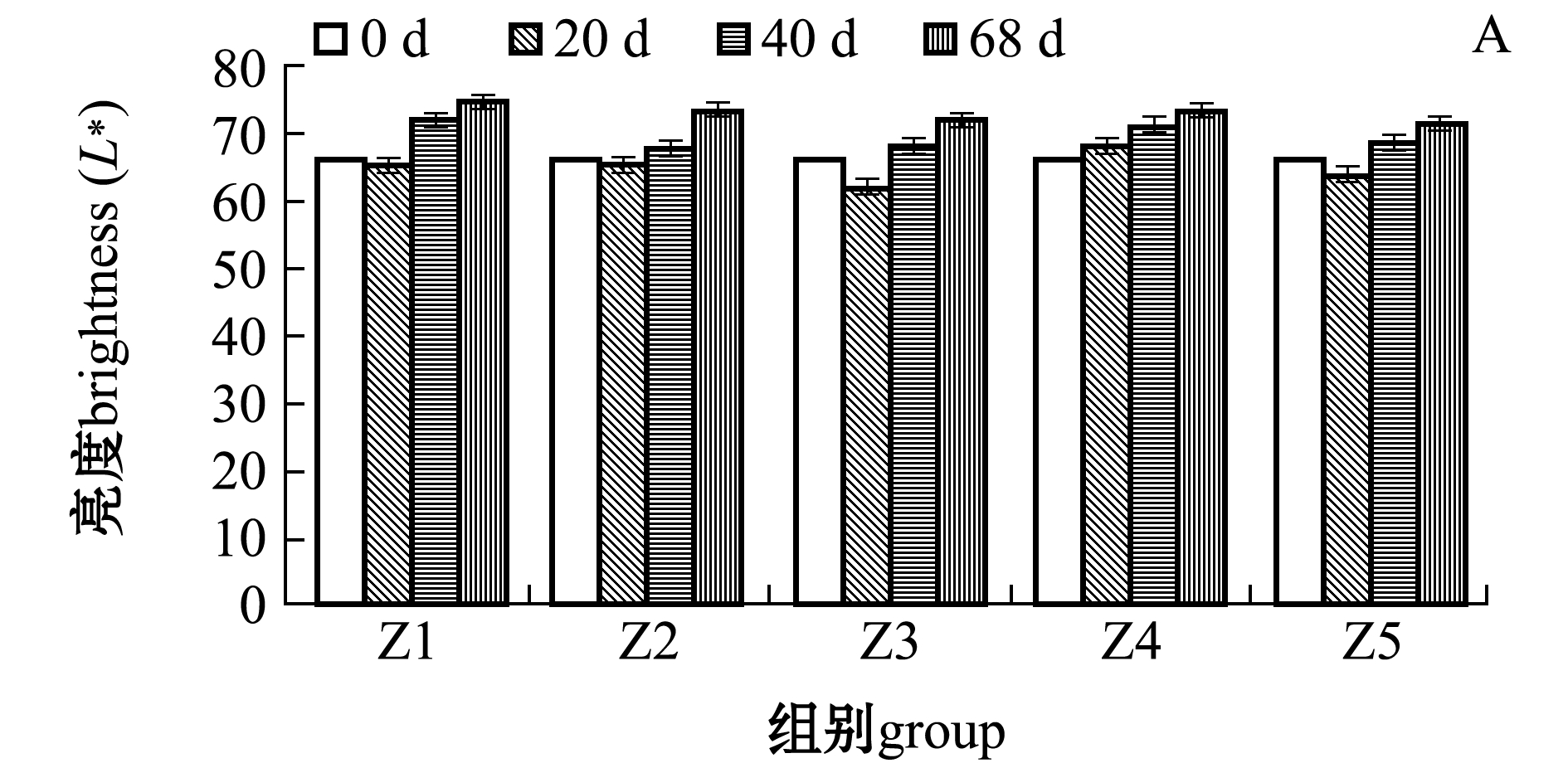
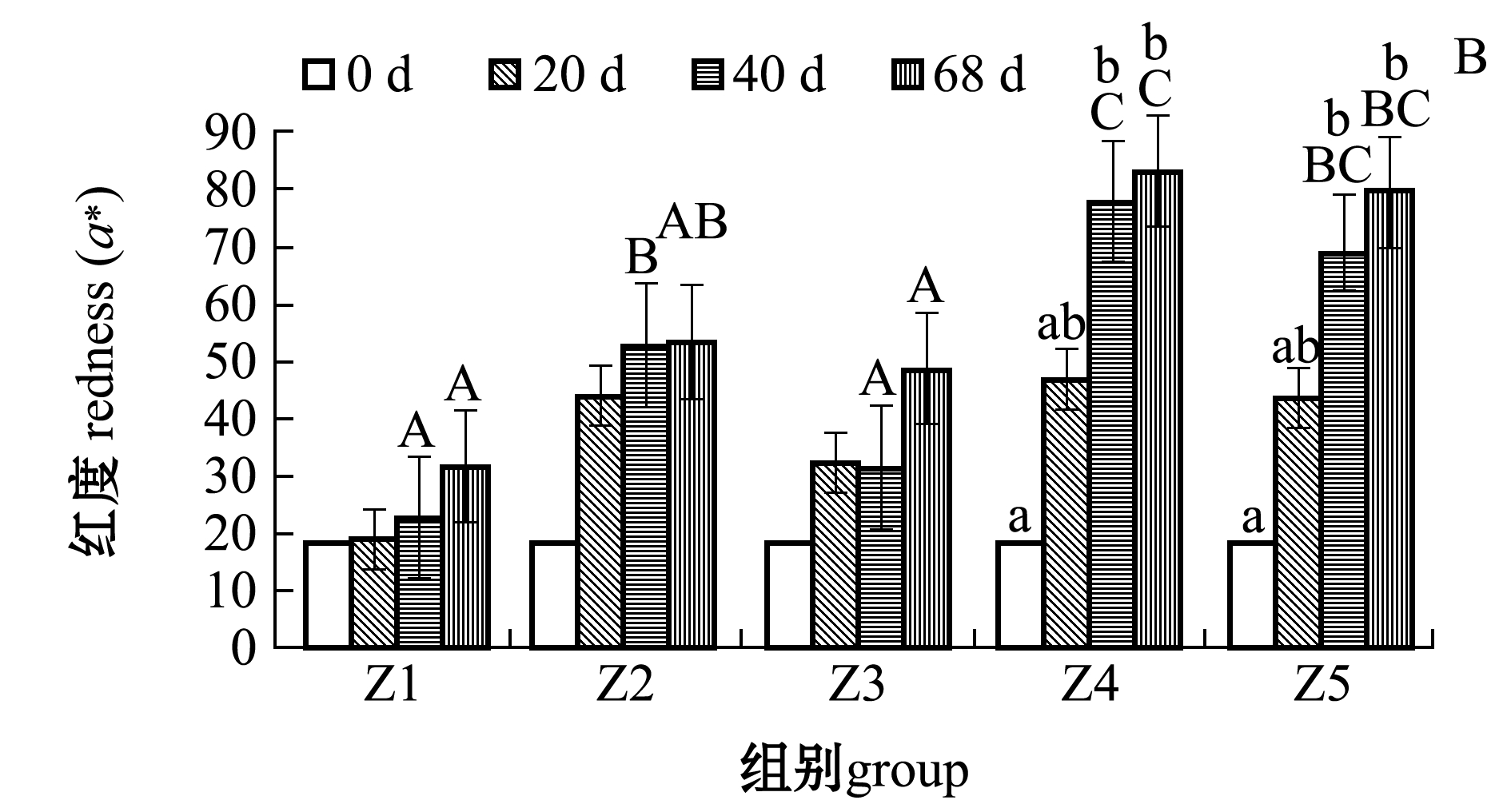
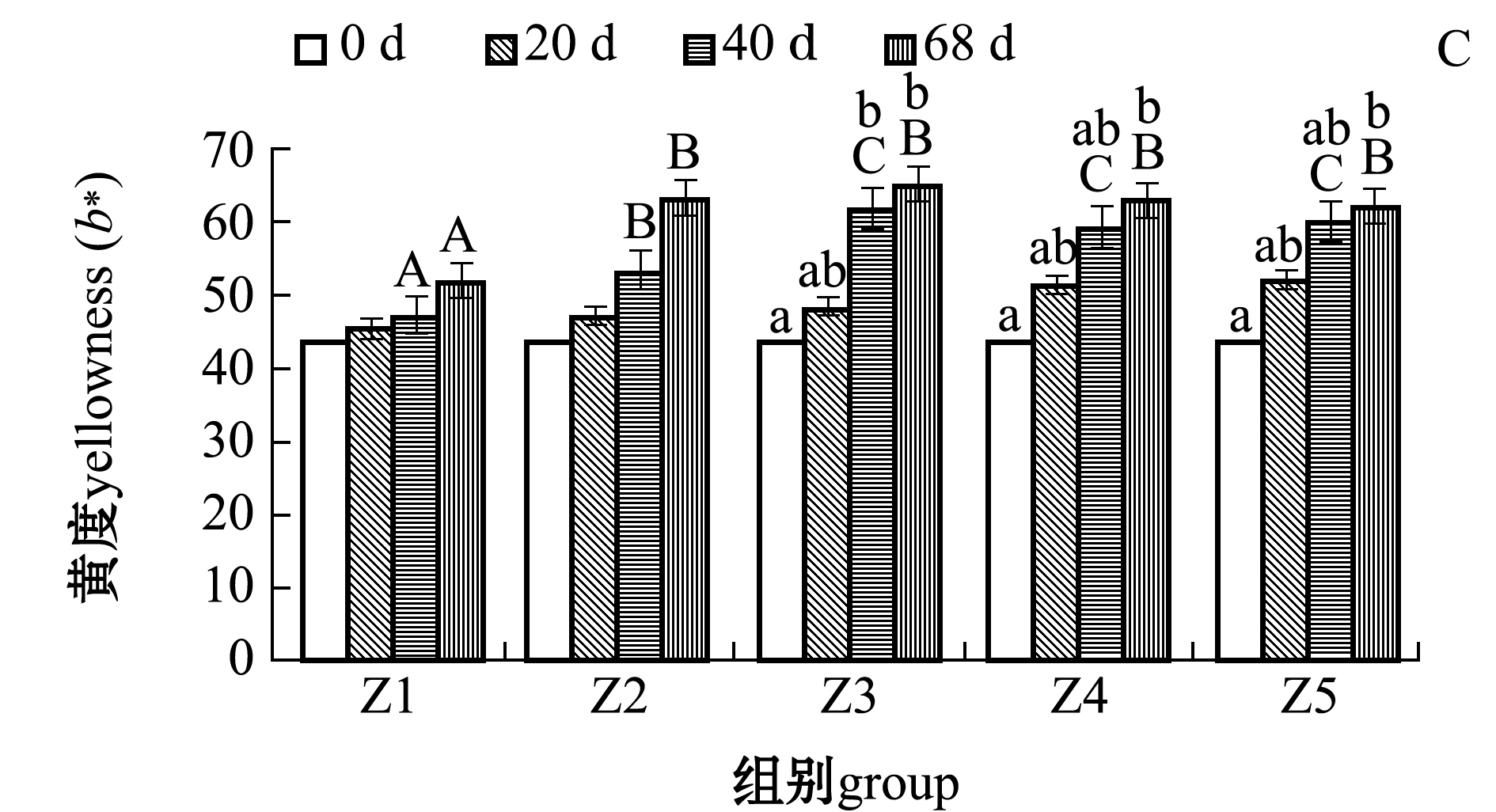
注:标有不同小写字母者表示同一组内不同时间下有显著性差异(P<0.05),标有不同大写字母者表示相同时间下不同组间有显著差异(P<0.05),标有相同字母者表示组间无显著性差异 (P>0.05)
Note: The means with different letters within the different time in the same group are significantly different(P<0.05); The means with different capital letters within the different groups in the same time are significantly different(P<0.05); The means with same letters within the different groups are not significantly different(P>0.05)
图2 饲料脂肪水平对淡黑镊丽鱼不同时期亮度、红度和黄度的影响
Fig.2 Effect of dietary lipid levels on brightness(L*), redness (a*) and yellowness(b*) in different periods of cichlid Labidochromis caeruleus
3.2 饲料脂肪水平对淡黑镊丽鱼肝体比、脏体比和肥满度的影响
脏体比反映鱼体内脂肪积累量的多少,本试验中脏体比随饲料脂肪水平的增加而升高,这也反映了鱼体内脂肪累积情况。本试验中除23.69%高脂肪饲料组以外,其他4组的肝体比随饲料脂肪水平(7.44%~12.25%)的增加呈较平缓下降趋势,23.69%饲料脂肪组升高说明脂肪摄入已超过了正常范围,鱼体会将摄入的脂肪转化为体脂储存在肌肉、肝脏及体腔之内[22]。而肝脏作为脂肪主要的代谢器官,鱼体摄入脂肪增多会增加肝脏的代谢负担,进而引起肝脏增大[23]。结合存活率可以看出,过高的饲料脂肪水平能够对试验鱼产生健康隐患。从体质量特定生长率和体增重率较低分析得出,低脂肪饲料被鱼体的肠道消化吸收较困难,从而引起肝内、外胆汁淤积,造成胆汁淤积性肝肿大,只有适量的脂肪摄入水平才能保证鱼体的健康[24]。
3.3 饲料脂肪水平对淡黑镊丽鱼各组织器官总类胡萝卜素含量的影响
Torrissen等[25]提出通过提高饲料中脂肪水平来影响鱼类对虾青素的消化吸收,这与本试验中随着饲料脂肪水平的升高,淡黑镊丽鱼鱼体表、肝脏及身体各个部分的总类胡萝卜素含量呈升高的结果相符合。Lee等[26]对虹鳟的究结果也显示,随饲料脂肪水平的升高鱼体内虾青素的累积量会增加,进一步证明试验饲料脂肪水平的适当升高有助于鱼体积累类胡萝卜素的假设。本试验中,鱼体类胡萝卜素累积量顺序是鳍最多,其次是皮肤(含鳞片),然后是眼和肝脏,最后是肌肉。同时,鳍和皮肤对类胡萝卜素的积累量明显高于眼、肝脏和肌肉,这与张晓红等[27]在对血鹦鹉Amphilophus citrinellus× Cichlasoma synspilum体色的研究结果相似。
3.4 饲料脂肪水平对淡黑镊丽鱼体表色度的影响
本试验中,随着饲料脂肪水平的增加,淡黑镊丽鱼的亮度无显著性变化,表明饲料脂肪水平对亮度的影响不显著;鱼体红度、黄度均在试验第40天时各组间开始出现显著性差异,鱼体黄度在10.91%饲料脂肪时出现峰值,之后趋于平缓,而15.25%和23.69%饲料脂肪组的红度显著高于其他脂肪组,说明饲料中适当的脂肪水平对鱼体色度有一定提高效果。这与崔培等[28]对红白锦鲤Cyprinus carpio的研究结果一致。本试验中,随着时间的积累,亮度、红度和黄度呈升高趋势,且高脂肪组不同时间测得数据具有显著性差异,而低脂肪组无显著性差异,推测随时间的延长体色的变化受饲料脂肪水平的影响,饲料中适当的提高脂肪水平有助于鱼体颜色鲜艳。本试验中还发现,当黄度在10.91%饲料脂肪组趋于平缓时,红度在10.91%饲料脂肪组之后开始升高明显,推断脂肪水平提高到一定程度后促使体表的黄色会开始呈现红色。Simpson[29]和Yuangsoi等[30]分别对金鱼Carassius auratus和锦鲤Cyprinus carpio的研究中发现,饲料中添加叶黄素,此两种鱼红度会升高,证明一些鱼类会将多余的叶黄素转化为红色素,与本试验现象相似,且本试验中鱼皮肤(含鳞片)的总类胡萝卜素含量虽然升高,但是黄度在饲料脂肪为10.91%之后呈平缓下降趋势,此结果可能与鱼类对黄色类胡萝卜素与红色类胡萝卜素之间的转化有关,或与鱼类体表色素细胞的种类和生长相关[29-30]。
3.5 饲料脂肪水平对淡黑镊丽鱼转氨酶活力的影响
谷草转氨酶和谷丙转氨酶主要参与体内转氨反应,体内的多种器官均存在此两种酶,主要由肝脏器官产生,当肝脏发生病变、坏死,肝功能受到损伤时,此两种酶的活性就会发生变化,故常用此两种酶来判断肝功能指标是否正常[31]。本试验中谷丙转氨酶随摄入脂肪量的增加,其活性呈现波动上升,并在饲料脂肪含量为23.69%时显著升高,且此时的存活率显著低于其他脂肪组,说明随着脂肪摄入的增加,鱼体肝脏承受的负荷也在增加,直至造成严重损伤,进而导致死亡。谷草转氨酶各组间虽无明显差异,但也与谷丙转氨酶的趋势相近,与叶坤等[32]对黄姑鱼Albiflora croaker的研究结果相同。
4 结论
淡黑镊丽鱼的饲料中脂肪水平低于10.91%时,随饲料脂肪水平的升高,淡黑镊丽鱼的生长性能、饲料利用率随之升高。饲料中脂肪水平超过10.91%时,会对淡黑镊丽鱼的生长产生影响,且谷丙转氨酶和谷草转氨酶活力升高,对鱼类健康状况产生负面影响,过高饲料脂肪含量会引起淡黑镊丽鱼存活率显著下降。鱼体各部分总类胡萝卜素含量随饲料脂肪水平的升高而持续升高,但黄度在饲料脂肪水平达到10.91%后趋于平缓。折线模型回归方程拟后得到,饲料中最适脂肪添加量为10.76%,体质量特定生长率达1.46%/d。
[1] Chou B S,Shiau S Y.Optimal dietary lipid level for growth of juvenile hybrid tilapia,Oreochromis niloticus×Oreochromis aureus[J].Aquaculture,1996,143(2):185-195.
[2] Takeuchi T,Shiina Y,Watanabe T.Suitable protein and lipid levels in diet for fingerling of red seabream Pagrus major[J].Nippon Suisan Gakkaishi,1991,57(2):293-299.
[3] Hanley F.Effects of feeding supplementary diets containing varying levels of lipid on growth,food conversion,and body composition of Nile tilapia,Oreochromis niloticus (L.)[J〗.Aquaculture,1991,93(4):323-334.
[4] Cowey C B,Cooke D J,Matty A J,et al.Effects of quantity and quality of dietary protein on certain enzyme activities in rainbow trout[J].The Journal of Nutrition,1981,111(2):336-345.
[5] Huang C H,Lin W Y,Chu J H.Dietary lipid level influences fatty acid profiles,tissue composition,and lipid peroxidation of soft-shelled turtle,Pelodiscus sinensis[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2005,142(3):383-388.
[6] 麦康森.水产动物营养与饲料学[M].北京:中国农业出版社,2011:41-53.
[7] 薛继鹏.三聚氰胺、氧化鱼油和脂肪对瓦氏黄颡鱼生长和体色的影响[D].青岛:中国海洋大学,2011.
[8] 幸宏伟.抗氧化剂—叶黄素[J].重庆工商大学学报:自然科学版,2006,23(5):477-480.
[9] 刘宏程.万寿菊中叶黄素的化学性质、定量分析及其制品安全性研究[D].杭州:浙江大学,2012.
[10] 王莉苹,姜志强,孙梦蕾,等.饲料中亮氨酸和异亮氨酸交互作用对牙鲆消化酶及免疫相关酶活力的影响[J].大连海洋大学学报,2017,32(3):287-293.
[11] Ergün S,Güroy D,Teke
![]() H,et al.Optimum dietary protein level for blue streak hap,Labidochromis caeruleus[J].Turkish Journal of Fisheries and Aquatic Sciences,2010,10:27-31.
H,et al.Optimum dietary protein level for blue streak hap,Labidochromis caeruleus[J].Turkish Journal of Fisheries and Aquatic Sciences,2010,10:27-31.
[12] 赵雪芹,赵丹,吕宁,等.叶黄素的功能及在饲料中的应用[J].广东饲料,2016,25(4):35-37.
[13] 付旭,崔前进,陈冰,等.饲料脂肪水平对淡黑镊丽鱼消化酶、免疫酶以及抗氧化酶的影响[J].河北渔业,2017(12):9-13.
[14] Agatsuma Y.Aquaculture of the sea urchin (Strongylocentrotus nudus) transplanted from coralline flats in Hokkaido,Japan[J].Journal of Shellfish Research,1998,17(5):1541-1547.
[15] 崔培,姜志强,王雪,等.不同蛋白水平的虾青素饲料对锦鲤体色、生长及免疫的影响[J].上海海洋大学学报,2012,21(3):382-388.
[16] 陈水春.饲料脂肪及不同脂肪源对鱼类的影响[J].现代渔业信息,2008,23(10):7-11.
[17] 付世建,谢小军,张文兵,等.南方鲇的营养学研究:Ⅲ.饲料脂肪对蛋白质的节约效应[J].水生生物学报,2001,25(1):61-69.
[18] Watanabe T.Lipid nutrition in fish[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1982,73(1):3-15.
[19] 刘波,唐永凯,俞菊华,等.饲料脂肪对翘嘴红鲌生长、葡萄糖激酶和葡萄糖-6-磷酸酶活性与基因表达的影响[J].中国水产科学,2008,15(6):1024-1033.
[20] 尾崎久雄.鱼类消化生理[M].吴尚忠,译.上海:上海科学技术出版社,1983:252-258.
[21] Otwell W S,Rickards W L.Cultured and wild American eels,Anguilla rostrata:fat content and fatty acid composition[J].Aquaculture,1981,26(1-2):67-76.
[22] 胡静,叶乐,赵旺,等.饲料脂肪水平对眼斑双锯鱼幼鱼生长性能和体成分的影响[J].中国饲料,2016(6):25-28.
[23] 宋理平,冒树泉,马国红,等.饲料脂肪水平对许氏平鲉脂肪沉积、血液生化指标及脂肪代谢酶活性的影响[J].水产学报,2014,38(11):1879-1888.
[24] 李瑞,陈佑江,文明波.胆汁淤积性肝炎[J].器官移植内科学杂志,2008,3(3):155-160.
[25] Torrissen O J,Hardy R W,Shearer K D,et al.Effects of dietary canthaxanthin level and lipid level on apparent digestibility coefficients for canthaxanthin in rainbow trout (Oncorhynchus mykiss)[J].Aquaculture,1990,88(3-4):351-362.
[26] Lee S M,Jeon I G,Lee J Y.Effects of digestible protein and lipid levels in practical diets on growth,protein utilization and body composition of juvenile rockfish (Sebastes schlegeli)[J].Aquaculture,2002,211(1-4):227-239.
[27] 张晓红,吴锐全,王海英,等.虾青素与螺旋藻对血鹦鹉体色的影响[J].大连水产学院学报,2009,24(1):79-82.
[28] 崔培,姜志强,韩雨哲,等.饲料脂肪水平对红白锦鲤体色、生长及部分生理生化指标的影响[J].天津农学院学报,2011,18(2):23-31.
[29] Simpson K L.Carotenoids in fish feeds[M]//Bauemfeind J C.Carotenoids as Colorants and Vitamin A Precursors.New York:Academic Press,1981:463-537.
[30] Yuangsoi B,Jintasataporn O,Tabthipwon P,et al.Utilization of carotenoids in fancy carp (Cyprinus carpio):astaxanthin,lutein and β-carotene[J].World Applied Sciences Journal,2010,11(5):590-598.
[31] 康格菲.临床生物化学[M].北京:人民卫生出版,1989:73-96.
[32] 叶坤,王秋荣,谢仰杰,等.饲料脂肪水平对黄姑鱼幼鱼生长性能、肌肉组成和血浆生化指标的影响[J].动物营养学报,2017,29(4):1418-1426.