眼斑拟石首鱼Sciaenops ocellatus,又名美国红鱼、红鼓鱼、黑斑红鲈、斑点尾鲈等,属鲈形目Perciformes石首鱼科Sciaenidae拟石首鱼属Sciaenops,原主要分布于美国东南海岸和墨西哥沿岸,为广温广盐性鱼类。经人工驯养,可以完全适应淡水[1]。自1991年中国首次引进,至1995年成功培育出第一代仔鱼,眼斑拟石首鱼已成为中国重要的养殖鱼类之一[2]。眼斑拟石首鱼为肉食性鱼类,人工养殖条件下可摄食配合饲料。关于眼斑拟石首鱼对蛋白质和脂肪的需求国内外已有相关研究,但对于脂肪需求量,不同研究者存在较大差异:Brinkmeyer等[3]以鲱鱼油为脂肪源进行投喂试验,结果发现,脂肪含量为18%的饲料能使眼斑拟石首鱼幼鱼达到最佳生长速度;Webb等[4]研究表明,饲料中10%的脂肪就能满足眼斑拟石首鱼的生长需要;李雪菲等[5]报道了以同比例豆油和鱼油混合为脂肪源时,眼斑拟石首鱼的需求量为7.19%~9.17%。
闻海波等[6]研究表明,眼斑拟石首鱼具有作为中国引进用于培育紫黑珍珠的新品种——紫黑翼蚌替代寄主鱼的潜力,但在寄生和淡水低渗双重胁迫下,眼斑拟石首鱼在寄生后出现极高的死亡率。另一方面,基于自主创建新型体外培养技术,添加眼斑拟石首鱼血浆可实现紫黑翼蚌钩介幼虫的变态发育,但变态率较低,比较分析结果表明,血浆中多不饱和脂肪酸二十二碳六烯酸(docosahexaenoic acid,DHA)和二十二碳五烯酸(docosapentaenoic acid,DPA)的含量可能是影响幼虫变态率的关键营养限制因子[7]。因此,拟通过提高眼斑拟石首鱼血液中多不饱和脂肪酸含量从而提高幼虫的变态率。由于大部分海水鱼缺乏脂肪酸去饱和酶和(或)延长酶,无法合成HUFAs或合成的HUFAs量有限,只能通过饲料摄入HUFAs[8-9]。 魏广莲等[10]研究表明,通过添加高含量的不饱和脂肪酸,可以显著增加刀鲚Coilia nasus Temminck et schlegel鱼体和血液中不饱和脂肪酸的含量。
为确认鱼油添加量对眼斑拟石首鱼脂肪代谢和血浆营养指标的影响,本研究中设计了3种鱼油添加量对眼斑拟石首鱼的营养强化试验,比较了不同组的鱼体生长指标和血浆营养指标的差异,尤其是血浆中多不饱和脂肪酸的含量差异,系统地测定了胃、消化盲囊、肠道及肝脏的脂肪酶活性及脂质过氧化物含量,探讨不同鱼油添加量对鱼体脂肪代谢的影响。本研究旨在确定眼斑拟石首鱼的适宜鱼油添加量,以提高鱼体血浆DHA和DPA含量,提高影响紫黑翼蚌钩介幼虫变态所需的关键营养因子,为眼斑拟石首鱼寄生前强化培育提供科学依据,从而提高紫黑翼蚌钩介幼虫体外培养和寄生的变态率及紫黑翼蚌产量,促进中国紫黑珍珠养殖产业化发展。
1 材料与方法
1.1 材料
试验用眼斑拟石首鱼购自福建漳州,体质量为34~56 g,养殖试验在江阴市申港三鲜养殖有限公司进行,投喂试验前暂养于水泥池中,养殖水体盐度为4,用普通海水鱼类配合饲料(常熟泉兴营养添加剂有限公司)进行投喂驯化。精制鱼油购自安徽省新洲海洋生物制品有限公司,EPA相对含量为36%,DHA为24%。
1.2 方法
1.2.1 试验饲料的制备 3组试验饲料中包括鱼油(4%、7%、9%),淀粉(10%、7%、5%),鱼粉45%,豆粕15%,菜粕10%,磷脂粉2%,维生素添加剂1%,磷酸二氢钙2%,分别设计等氮等能的3种饲料,试验饲料营养水平如表1所示。用饲料1(鱼油添加量为4%)、饲料2(鱼油添加量为7%)、饲料3(鱼油添加量为9%)投喂眼斑拟石首鱼,8周后采样分析。其中,3种饲料的水分、粗蛋白质和粗灰分均无显著性差异(P>0.05),但粗脂肪含量有显著性差异(P<0.05)。
表1 试验饲料营养水平
Tab1 Nutrient levels of experimental diets w/%
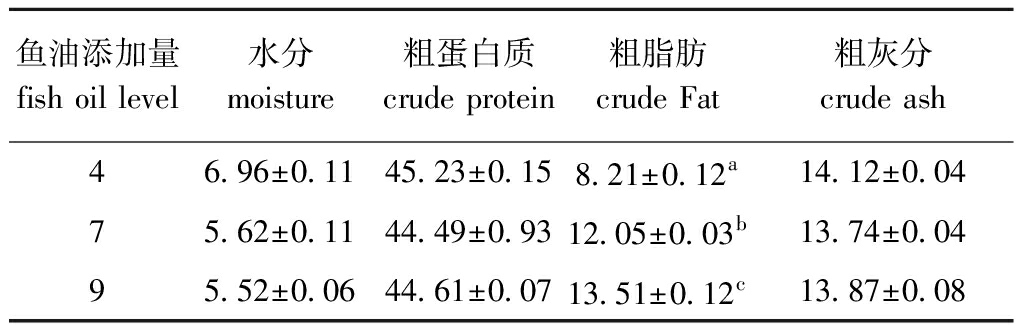
鱼油添加量fish oil level水分moisture粗蛋白质crude protein粗脂肪crude Fat粗灰分crude ash46.96±0.1145.23±0.158.21±0.12a14.12±0.0475.62±0.1144.49±0.9312.05±0.03b13.74±0.0495.52±0.0644.61±0.0713.51±0.12c13.87±0.08
注: 同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note: Means followed by different letters in the same column are significant differences at the 0.05 probability,and the means followed by the same letters in the same column are not insignificant differences at the 0.05 probability,et sequentia
1.2.2 试验设计及养殖管理 驯养1周后,选取健康无伤的个体270尾,体质量为(43.40±6.40)g,体长为(13.69±0.83)cm。在室内同一水泥池中设置9只网箱(1 m×1 m×1 m)。试验共分3组,分别投喂饲料1、饲料2和饲料3,每个网箱放养30尾,每组3个重复。养殖试验共进行8周。采用定量投喂方式,于8:00和16:00各投喂一次,初始投喂量为体质量的3.5%,之后根据实际情况进行调整;定期进行水质测量和换水,保证水体氨氮小于0.2 mg/L,亚硝酸盐小于0.01 mg/L,24 h气泡式增氧。
1.2.3 饲料一般营养成分测定 采用105 ℃烘干法(GB5009.3—2003)测定饲料水分含量;采用马福炉 560 ℃ 灼烧法(GB 5009.4—2003)测定粗灰分含量;采用微量凯氏定氮法(GB 5009.5—2003)测定粗蛋白质含量;采用全脂肪法(GB 5009.6—2003)测定粗脂肪含量。
1.2.4 生长指标测定与计算 饲养8周后,禁食24 h开始采样。先测量所有鱼的体质量和体长,然后从每个重复随机捞取4尾,测量体长、体质量。在低温下进行解剖,取肌肉、内脏、肝脏等,用滤纸吸干后分别称量内脏、肝脏质量,用于计算增重率(WGR)、肝体指数(HSI) 、脏体指数(VSI) 和肥满度(CF)。称重后于-20 ℃冰箱中保存备用。计算公式如下:
HSI=Wh/Wb×100%,
VSI=Wv/Wb×100%,
CF=Wb/L3×100%。
其中:Wb为试验末鱼体质量(g) ;Wh为试验末鱼体肝脏质量(g); Wv为试验末鱼体内脏质量(g);L为试验末鱼体长(cm)。
1.2.5 脂肪代谢相关酶活性及脂质过氧化物含量测定 从每个网箱随机取4尾鱼,每个处理共12尾。冰上解剖,分离肝脏。同一处理中将每3尾鱼的肝脏分别剪碎等量均匀混合,保存于-20 ℃冰箱中,用于脂肪代谢相关酶活性及脂质过氧化物(LPO)含量测定。将组织样品与PBS按1∶9(mg∶mL)比例加入玻璃匀浆器中,冰上充分研磨后将匀浆液以5000 g离心5~10 min,取上清检测。样品处理和测定方法参照魏广莲等[10]的方法。测定指标包括脂肪酶(LPS)、总酯酶(TLP)、肉碱软脂酰基转移酶-Ⅰ(CPT-Ⅰ)、肉碱软脂酰基转移酶-Ⅱ(CPT-Ⅱ)、乙酰CoA羧化酶(ACC)活性及脂质过氧化物(LPO)含量。测定试剂盒购自南京建成生物工程研究所。
1.2.6 肝脏组织切片观察 从每组随机取2尾鱼,解剖分离其肝脏,样品处理和测定参照魏广莲等[11]的方法,用Bouin’s液固定、清洗及脱水,用二甲苯透明浸蜡及石蜡包埋,再用LeicaRM2235切片机连续切片,切片厚度6 μm,H.E染色,中性树胶封片,在光学显微镜下观察并拍照。
1.2.7 血浆生化指标测定 从每个网箱随机取4尾鱼,用湿毛巾完全覆盖鱼体,从尾静脉采血。将采集的血液以3000 r/min离心5 min,吸取上清液,于-80 ℃冰箱中保存待测。生化指标采用日立 7600-110 型全自动生化分析仪测定,主要测定血浆总蛋白(TP)、白蛋白(ALB)、甘油三酯(TG)、胆固醇(TCH)、血糖(GLU)、低密度脂蛋白 (LDL)、高密度脂蛋白 (HDL)、 谷草转氨酶(AST) 和谷丙转氨酶(ALT)。
1.2.8 血浆脂肪酸组成测定 选取4%和7%鱼油组眼斑拟石首鱼,从尾静脉采血,以3000 r/min离心5 min,吸取上清液,将同组每5尾鱼血浆等量混合作为1个试样,每个试样取5 mL用于血浆脂肪酸组成测定,每组3个重复。先将血浆样品冷冻干燥后,加入十一碳酸(C11:0)标准品作为内标,振荡、提取3次,过滤后挥干,采用GC/FID方法在日本岛津(Shimadzu)GC-2010气相色谱仪上进行定量分析。
1.3 数据处理
试验结果以平均值±标准误(mean ± S.E.)表示。采用 SPSS 20.0软件对组间数据进行单因子方差分析(One-way ANOVA),采用Duncan法进行组间多重比较,显著性水平设为 0.05。
2 结果与分析
2.1 眼斑拟石首鱼生长指标的变化
从表2可见:各处理组眼斑拟石首鱼成活率均在70%以上,最高为7%鱼油添加组;4%和7%鱼油添加组存活率、体长、末体质量、增重率均显著高于9%鱼油添加组(P<0.05);4%鱼油添加组肝体指数、脏体指数显著低于9%鱼油添加组(P<0.05);3组肥满度无显著性差异(P>0.05)。
表2 鱼油添加量对眼斑拟石首鱼生长指标的影响
Tab.2 Effect of dietary fish oil levels on the growth performance of red drum
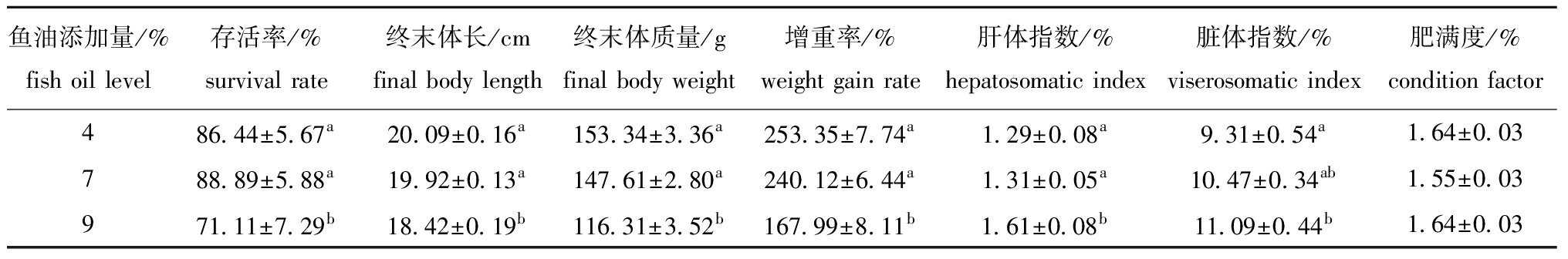
鱼油添加量/%fish oil level存活率/%survival rate终末体长/cmfinal body length终末体质量/gfinal body weight增重率/%weight gain rate肝体指数/%hepatosomatic index脏体指数/%viserosomatic index肥满度/%condition factor486.44±5.67a20.09±0.16a153.34±3.36a253.35±7.74a1.29±0.08a9.31±0.54a1.64±0.03788.89±5.88a19.92±0.13a147.61±2.80a240.12±6.44a1.31±0.05a10.47±0.34ab1.55±0.03971.11±7.29b18.42±0.19b116.31±3.52b167.99±8.11b1.61±0.08b11.09±0.44b1.64±0.03
2.2 眼斑拟石首鱼脂肪代谢的变化
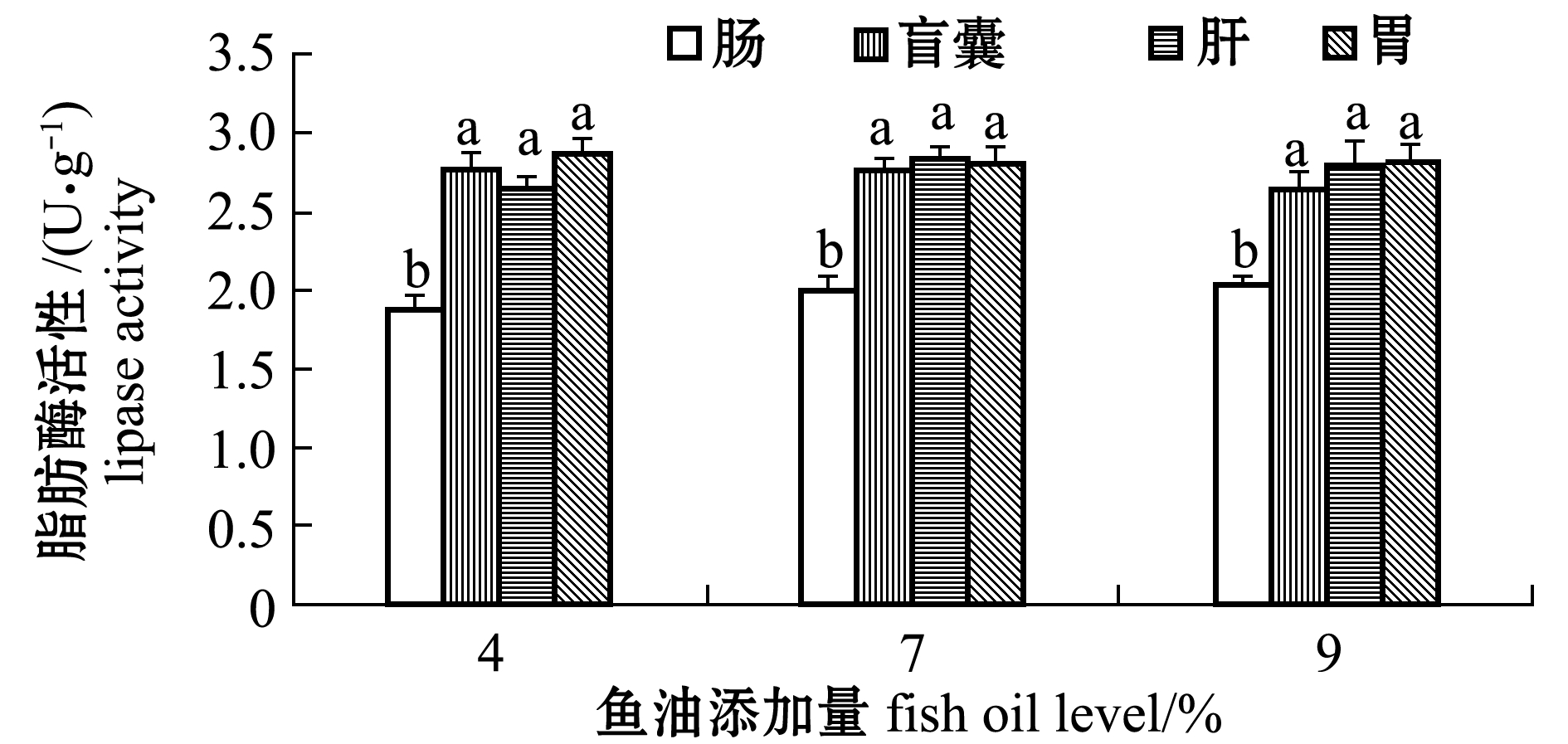
从图1可见:不同鱼油处理组间每种组织的脂肪酶活性无显著性差异(P>0.05);组织间差异上,3个鱼油处理组肠脂肪酶活性均显著低于盲囊、肝、胃(P<0.05)。
从图2可见:不同鱼油处理组间每种组织的总脂酶活性无显著性差异(P>0.05);组织间差异上,4%鱼油添加组肠总脂酶活性显著低于肝、胃、盲囊(P<0.05)且盲囊总脂酶活性显著低于胃(P<0.05),7%和9%鱼油添加组肠和盲囊总脂酶活性均显著低于肝、胃(P<0.05)。
从图3可见:4%、7%鱼油添加组肠脂质过氧化物含量显著低于9%组(P<0.05);组织间差异上,4%、7%、9%鱼油添加组肠脂质过氧化物含量均显著低于盲囊、肝、胃(P<0.05)。
注:标有不同大写字母者表示同一组织不同鱼油添加量组间有显著性差异(P<0.05),标有不同小写字母者表示同一鱼油添加量下不同组织间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different capital letters in same tissue are significantly different in different dietary fish oil levels at the 0.05 probability level, the means with different letters in same dietary fish oil level being significantly different in different tissues at the 0.05 probability level, and the means with the same letter are not significant differences, et sequentia
图1 鱼油添加量对眼斑拟石首鱼脂肪酶活性的影响
Fig.1 Effect of dietary fish oil level on the lipase activity of the red drum
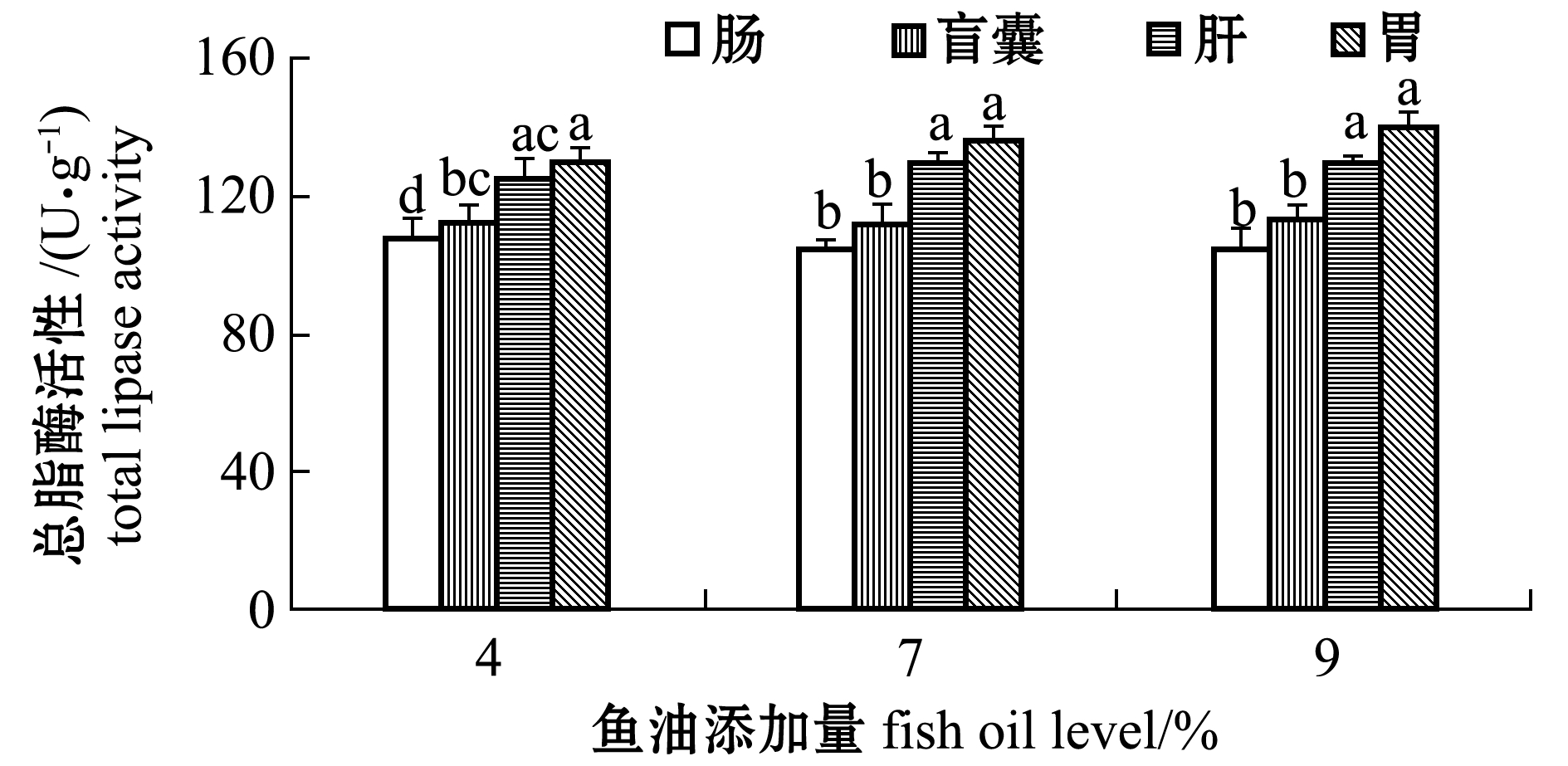
图2 鱼油添加量对眼斑拟石首鱼总脂酶活性的影响
Fig.2 Effect of dietary fish oil level on the total lipase activity of the red drum
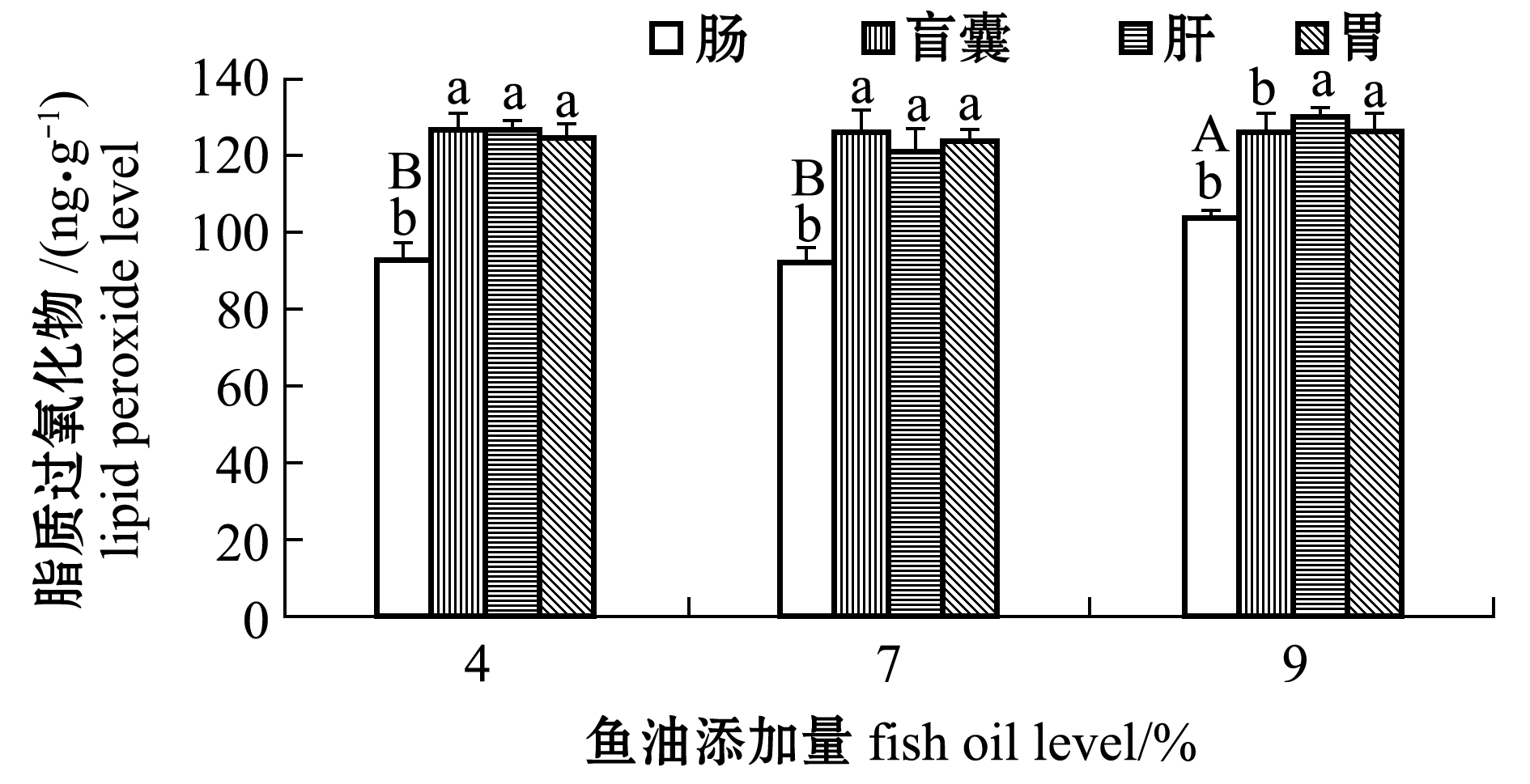
图3 鱼油添加量对眼斑拟石首鱼脂质过氧化物的影响
Fig.3 Effect of dietary fish oil level on the lipid peroxide levels of the red drum
从图4可见:不同鱼油处理组间每种组织的CPT-Ⅰ活性无显著性差异(P>0.05);组织间差异上,4%鱼油添加组肠、盲囊CPT-Ⅰ活性显著高于肝、胃(P<0.05),7%鱼油添加组肠CPT-Ⅰ活性显著高于肝、胃(P<0.05)且盲囊CPT-Ⅰ活性显著高于胃(P<0.05),9%鱼油添加组肠CPT-Ⅰ活性显著高于盲囊、肝、胃(P<0.05)且盲囊CPT-Ⅰ活性显著高于肝、胃(P<0.05)。
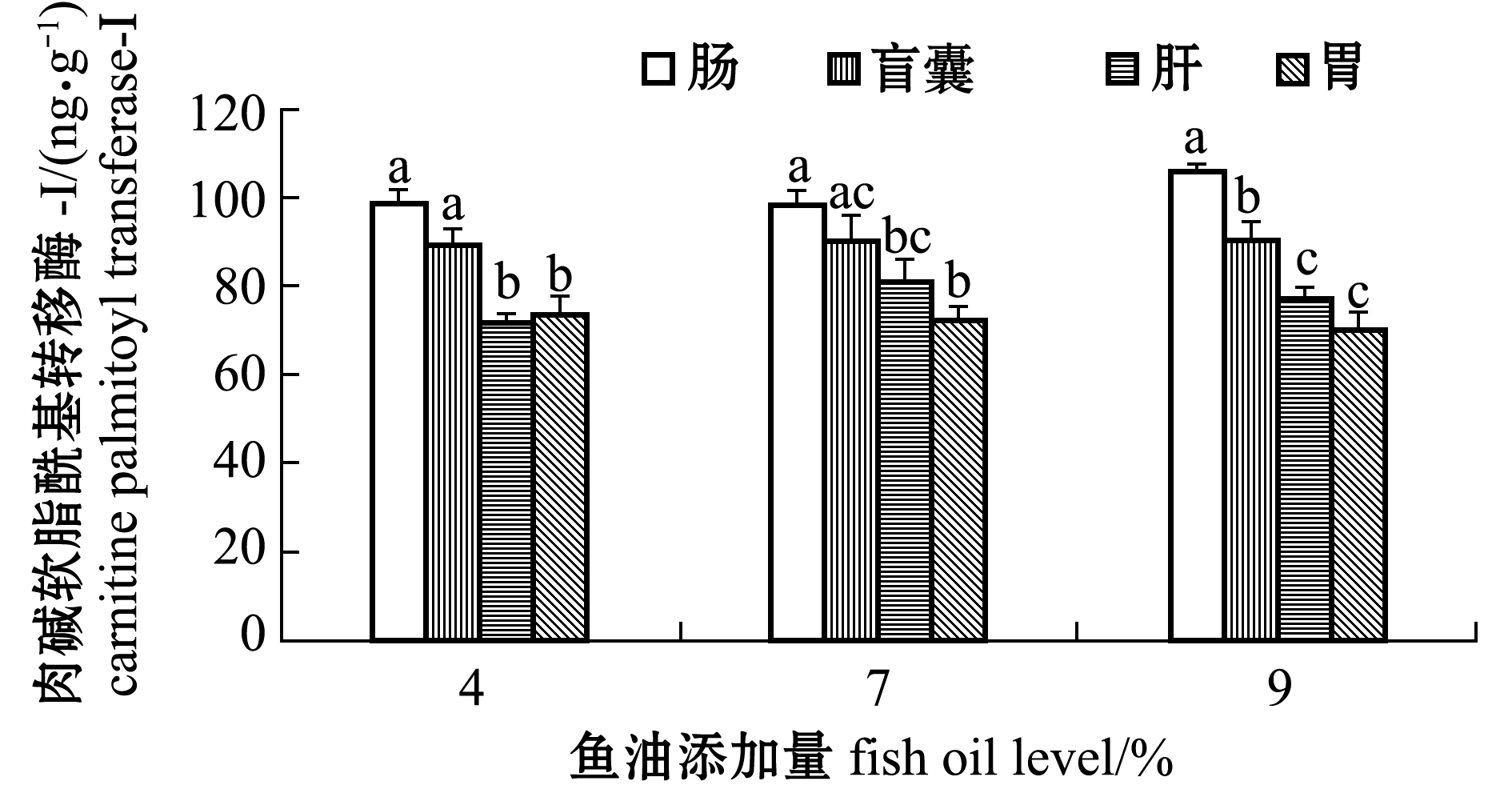
图4 鱼油添加量对眼斑拟石首鱼肉碱软脂酰基转移酶-Ⅰ活性的影响
Fig.4 Effect of dietary fish oil levels on the carnitine palmitoyl transferase-Ⅰactivity of the red drum
从图5可见:不同鱼油处理组间每种组织的CPT-Ⅱ活性无显著性差异(P>0.05);组织间差异上,4%、7%、9%鱼油添加组的肠CPT-Ⅱ活性显著高于盲囊、肝、胃(P<0.05)且盲囊、肝CPT-Ⅱ活性显著高于胃(P<0.05)。
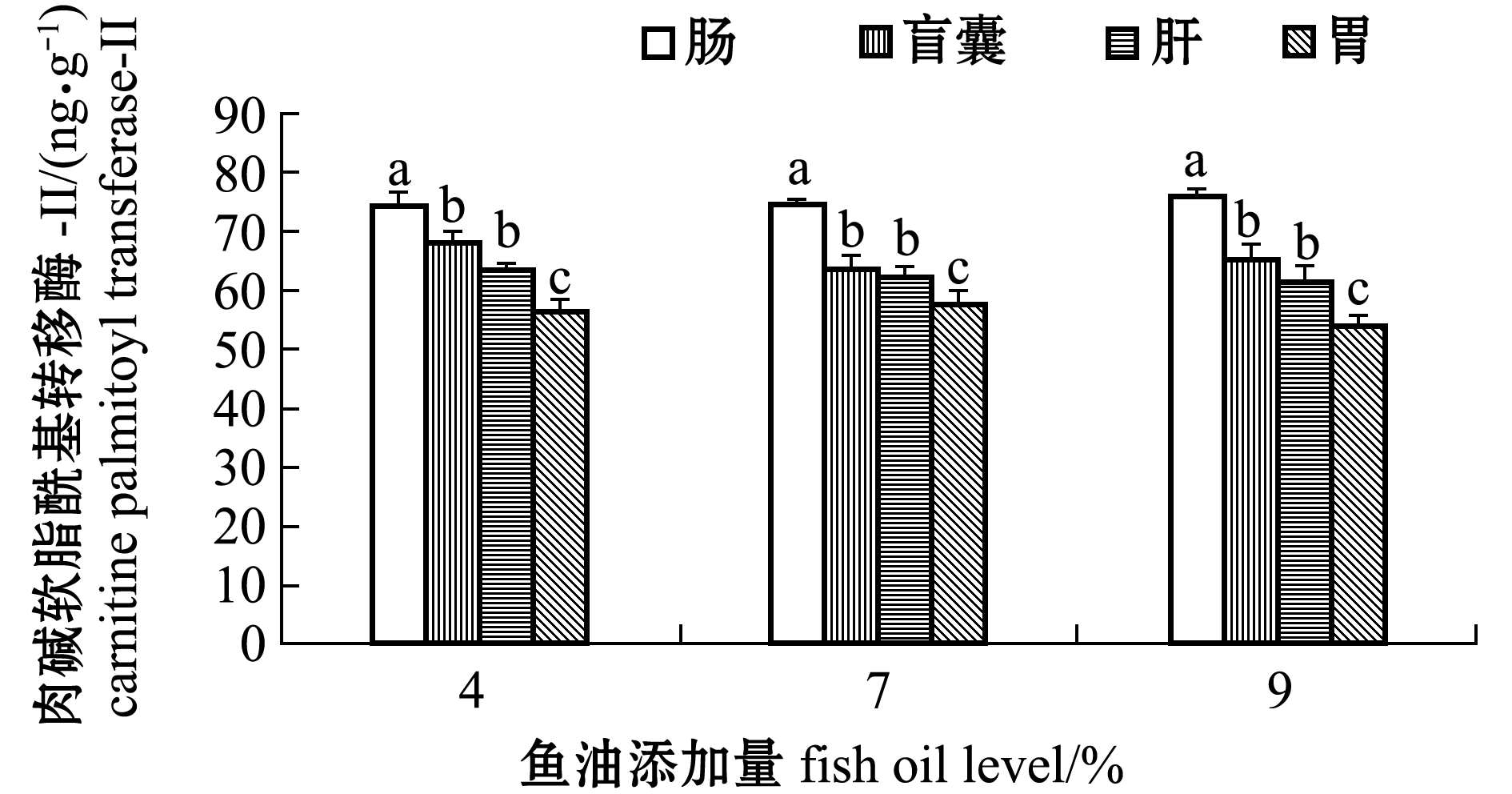
图5 鱼油添加量对眼斑拟石首鱼肉碱软脂酰基转移酶-Ⅱ活性的影响
Fig.5 Effect of dietary fish oil levels on the carnitine palmitoyl transferase-Ⅱ activity of the red drum
从图6可见:4%、9%鱼油添加组肝乙酰CoA羧化酶活性显著低于7%鱼油添加组(P<0.05);组织差异上,4%和7%鱼油添加组肠乙酰CoA羧化酶活性显著低于肝、胃(P<0.05),9%鱼油添加组肠、盲囊、肝显著低于胃(P<0.05)。
2.3 眼斑拟石首鱼肝脏组织的变化
鱼油添加对各处理组鱼肝脏组织脂肪和肝变产生显著影响(表3)。从图7可见:4%鱼油添加组鱼体肝细胞大小基本相似,呈多边形、边界清楚,细胞核位于细胞的中央,呈圆形,胞间脂滴30%~40%,肝脏比较正常(图-A、B);7%鱼油添加组肝细胞大部分呈多边形,细胞核位于细胞中央,部分出现偏移,胞间脂滴60%~70%,肝脏结构发生变化(图-C、D);9%鱼油添加组肝细胞透明,空泡化严重,排列不整齐,细胞大部分空间被脂滴占据,细胞核浓缩,出现细胞核偏移,肝窦狭窄,胞间脂滴大小不一,数量为70%以上,肝脏结构发生明显变化(图-E)。
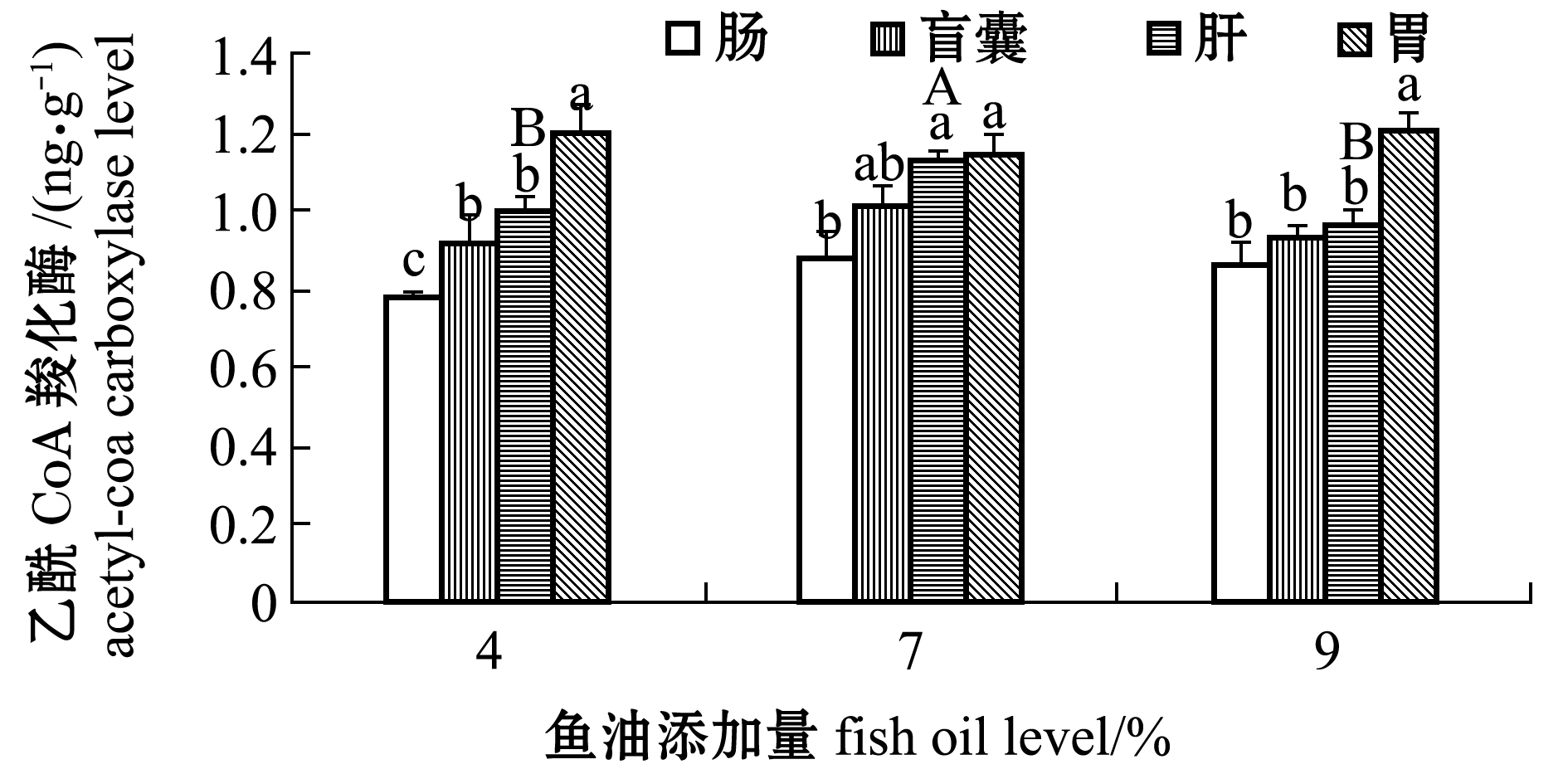
图6 鱼油添加量对眼斑拟石首鱼乙酰CoA羧化酶活性的影响
Fig.6 Effect of dietary fish oil levels on theacetyl-coa carboxylase avtivity in the red drum
表3 鱼油添加量对眼斑拟石首鱼肝脏组织的影响
Tab.3 Effect of dietary fish oil levels on the liver structure in the red drum

鱼油添加量/% fish oil level脂滴数量/% amount of lipid肝变程度degree of liver change430~40+760~70++9>70+++
注:+表示肝脏脂肪聚集程度一般;++表示肝脏脂肪聚集程度较高;+++表示肝脏脂肪聚集程度高
Note:+ indicates the general accumulation of liver fat; + + indicates the higher aggregation degree of liver fat; +++ indicates the highest aggregation degree of liver fat
2.4 眼斑拟石首鱼血液生化指标的变化
从表4可见:4%和7%鱼油添加组血糖含量显著高于9%鱼油添加组(P<0.05);4%鱼油添加组谷丙转氨酶活性和高密度脂蛋白含量显著低于9%鱼油添加组(P<0.05);4%鱼油添加组甘油三酯含量显著高于9%鱼油添加组(P<0.05);4%鱼油添加组谷草转氨酶活性显著低于9%鱼油添加组(P<0.05);3组总蛋白、总胆固醇和低密度脂蛋白含量均无显著性差异(P>0.05)。

注:A、B为4%鱼油添加组;C、D为7%鱼油添加组;E为9%鱼油添加组;L,脂滴;H,肝细胞;ID,小叶间导管;IA,小叶间动脉;S,肝血窦;K,肝巨噬细胞
Note:A,B,addition of 4% fish oil;C,D,addition of 7% fish oil;E,addition of 9% fish oil;L,lipid;H,hepatocyte;ID,interlobular duct;IA,interlobular artery;S,hepatic sinusoid;K,kupffer cell
图7 不同鱼油添加量组眼斑拟石首鱼肝脏组织切片
Fig.7 Histological observation of the red drum fed the diets containing various levels of fish oil
2.5 眼斑拟石首鱼血浆脂肪酸组成的变化
由表5可知,4%和7%鱼油添加组血浆脂肪酸组成无显著性差异(P>0.05)。
表4 鱼油添加量对眼斑拟石首鱼血浆生理生化指标的影响
Tab.4 Effect of dietary fish oil levels on blood plasma physiological and biochemical indices of red drum
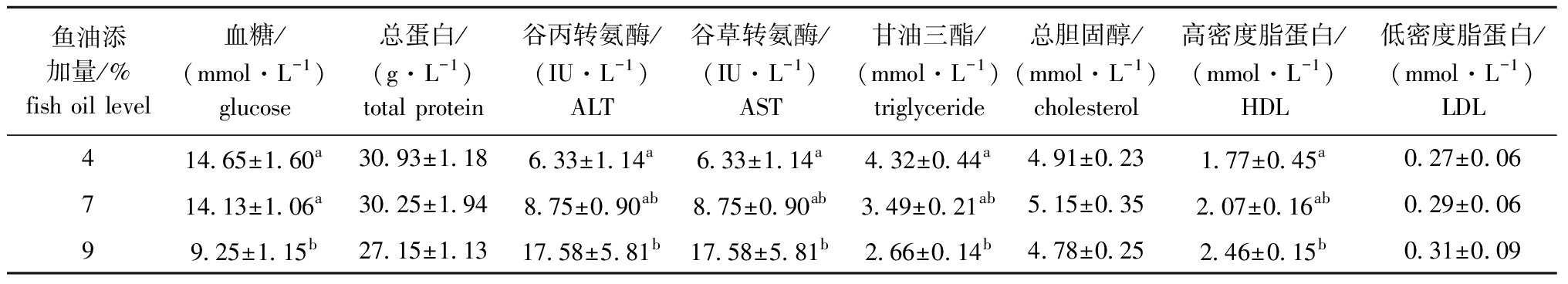
鱼油添加量/%fish oil level血糖/(mmol·L-1)glucose总蛋白/(g·L-1)total protein谷丙转氨酶/(IU·L-1)ALT谷草转氨酶/(IU·L-1)AST甘油三酯/(mmol·L-1)triglyceride总胆固醇/(mmol·L-1)cholesterol高密度脂蛋白/(mmol·L-1)HDL低密度脂蛋白/(mmol·L-1)LDL414.65±1.60a30.93±1.186.33±1.14a6.33±1.14a4.32±0.44a4.91±0.231.77±0.45a0.27±0.06714.13±1.06a30.25±1.948.75±0.90ab8.75±0.90ab3.49±0.21ab5.15±0.352.07±0.16ab0.29±0.0699.25±1.15b27.15±1.1317.58±5.81b17.58±5.81b2.66±0.14b4.78±0.252.46±0.15b0.31±0.09
表5 鱼油添加量对眼斑拟石首鱼血浆脂肪酸组成的影响
Tab.5 Effect of dietary fish oil levels on blood plasma fatty acid composition in the red drum
mg/L

脂肪酸fatty acid鱼油添加量fish oil level/%47C14∶069.31±7.8863.42±5.50C15∶017.53±1.9217.48±1.46C16∶01369.85±151.981309.89±106.41C16∶1151.64±17.78135.85±12.91C17∶027.30±2.4026.84±1.69C18∶0345.53±38.04330.07±22.87C18∶1790.99±92.01744.22±70.88C18∶2463.89±55.24400.78±36.26C18∶3n69.63±1.0610.67±0.99C18∶3n359.57±7.1952.49±4.81C18∶426.55±3.4025.61±2.36C20∶014.33±1.5915.76±1.14C20∶172.33±8.6571.61±6.44C20∶212.84±1.5011.83±0.93C20∶311.79±2.0711.46±1.62C20∶4211.74±25.91217.16±19.12C20∶51127.06±141.911160.90±106.22C22∶07.84±1.447.54±0.39C22∶181.70±12.4280.81±7.62C22∶334.28±3.2730.21±7.24C22∶457.50±7.2963.39±5.68C22∶5(DPA)226.72±27.74219.82±18.70C22∶6(DHA)2470.31±293.512672.78±227.45∑n3PUFA3905.07±473.214128.12±35.78∑n6PUFA675.63±81.15617.94±55.38∑PUFA4580.70±554.354746.06±415.16∑UFA5808.53±698.905909.61±529.06
3 讨论
3.1 饲料鱼油添加量对眼斑拟石首鱼生长的影响
脂肪是鱼类重要的营养源,对于如眼斑拟石首鱼这样的温水性鱼类来说,脂肪一般以氧化供能的形式发挥作用[12]。假如饲料的蛋白质过高,即可降低对脂肪的依赖。饲料中适宜的脂肪量是鱼类健康生长的保证。鱼类长期摄食高脂肪饲料时,极易引起代谢紊乱,肝脏脂肪聚集过度,从而影响蛋白质的吸收,降低免疫力,引发疾病,严重时甚至导致死亡。本试验中,4%和7%鱼油添加组的终末体长、体质量及增重率均显著高于9%鱼油添加组。这表明,9%鱼油添加组饲料脂肪过量,使得眼斑拟石首鱼的生长可能受到抑制。脂肪过量抑制生长也出现在对大菱鲆Scophthalmus maximus、军曹鱼Rachycentron canadum、欧鳎Solea senegalensis和红鳍东方鲀Fugu obscurus的研究上[13-16]。然而也有不受饲料脂肪水平影响及饲料脂肪水平增加能促进生长的报道[17-19]。目前,关于眼斑拟石首鱼脂肪的需求量已有报道。Tucker等[12]试验证明,眼斑拟石首鱼幼鱼能有效利用12.7%的鲱鱼油和5%豆油的饲料。冯健等[20]报道了以不同比例玉米油和鱼油混合为脂肪源,脂肪量分别为7.98%和11.92%的两组眼斑拟石首鱼在第5周时死亡率快速上升。本试验中鱼油添加量为4%和7%的两组生长良好,但仍出现一定的死亡率,9%鱼油组眼斑拟石首鱼在第50天时死亡率明显上升。本试验结果与Tucker等[12]、冯健等[20]的试验结果有所差异,其原因可能是本试验中养殖密度过大,眼斑拟石首鱼在拥挤胁迫下免疫能力出现一定程度的降低。鱼油添加过量,高脂肪饲料长期摄食会使眼斑拟石首鱼幼鱼产生脂肪肝,影响其生长率。
3.2 饲料中鱼油添加量对眼斑拟石首鱼肝脏脂肪代谢的影响
脂肪酶广泛存在于动植物中,动物体内脂肪酶大都存在于胰脏和脂肪组织中。总脂酶包括蛋白质酶和肝酯酶,作用主要为催化甘油三酯水解[21]。UFA易氧化分解,产生的脂质过氧化物对细胞有毒性,脂质过氧化物可作为脂质过氧化损伤程度的指标之一[22]。肉碱转运系统是脂肪分解的重要一环,肉碱软脂酰基转移酶-Ⅰ和肉碱软脂酰基转移酶-Ⅱ是其重要组成酶,也是脂肪分解的限速酶[10]。本研究中表明,眼斑拟石首鱼在肠道的脂肪分解速度低于盲囊、肝、胃。乙酰CoA羧化酶可以催化乙酰辅酶A,生成丙二酸单酰辅酶A,参加脂肪酸合成中二碳单位的供体提供过程并具有酯解作用,制约着脂肪酸合成第一阶段的速度。乙酰CoA羧化酶的活性受到饲料组成的影响,Rollin等[23]报道了高脂饲料显著抑制虹鳟Oncorhynchus mykiss肝脏乙酰CoA羧化酶的活性。这与本试验中对肝脏乙酰CoA羧化酶的研究结果一致。
鱼体消化吸收的脂类主要以甘油三酯的形式存储于肝脏、肠道、腹腔和肌肉等组织中,也分布于头盖腔、皮下及腹侧等其他器官中。肝脏是鱼类脂肪代谢的重要器官,肝脏中沉积大量脂肪会改变肝细胞正常的组织形态,影响其生物学功能。大部分肉食性鱼类肝脏与脂肪代谢有着不可分割的关系,体内肝脏脂肪的储存量对鱼类越冬和性腺发育具有十分重要的作用[24]。在对大西洋鳕Gadus morhua、真鲷Pagrosomus major、眼斑拟石首鱼的研究中,饲料脂肪含量的增加会导致肝脏脂肪的增加,细胞核的偏移程度也一定程度上代表肝脏损伤程度[5,25-26]。谷丙转氨酶和谷草转氨酶的升高往往伴随着肝脏细胞的受损程度加大[18-21],这在本试验中也得到了验证。结合本研究中脂肪酶的显著性差异认为,4%鱼油组肝脏比较健康,其余两组肝脏均出现一定程度地损伤。
3.3 饲料中鱼油添加量对眼斑拟石首鱼血浆脂肪酸组成的影响
本试验中采用高含量不饱和脂肪酸鱼油作为脂肪源,与其他动植物油相比,∑n-3PUFA的含量比较丰富。有关血浆脂肪酸的研究大多集中在哺乳动物和人类,研究表明,饲料中添加鱼油可以导致大鼠Rattus norvegicus、母猪York shire血浆中∑n3PUFA增加[27-28]。对水产动物脂肪酸的研究中,一般选取肝脏和肌肉,对于血浆脂肪酸的报道大多与寄生虫有关。闻海波[7]文献中所报道的眼斑拟石首鱼血浆DPA和DHA含量分别为(104.60±3.58)、(1272.10±51.22)mg/L,而本试验中眼斑拟石首鱼血浆DHA和DPA含量显著提高,且均达到其2倍水平。
4 结语
本研究中眼斑拟石首鱼营养强化所需脂肪在8%~12%,其中最佳鱼油添加量为4%。在饲料总脂肪8.21%条件下,即添加4%鱼油(DHA含量24%)有利于眼斑拟石首鱼的生长及血浆营养、DHA与DPA含量增加,为进一步提高紫黑翼蚌体外培养和寄生繁育效率奠定了基础。而饲料13.51%总脂肪(添加9%鱼油)会造成眼斑拟石首鱼肝脏损伤,不利于生长,降低了脂肪代谢水平。
[1] 王俊生,谢育宏,林延川,等.美国红鱼淡化驯养试验[J].科学养鱼,2001(5):34-35.
[2] 邓锦锋,王安利.美国红鱼营养研究进展[J].水利渔业,2006,26(2):75-78.
[3] Brinkmeyer R L,Holt G J.Highly unsaturated fatty acids in diets for red drum (Sciaenops ocellatus) larvae[J].Aquaculture,1998,161(1-4):253-268.
[4] Webb Jr K A, Gatlin III D M.Effects of dietary protein level and form on production characteristics and ammonia excretion of red drum Sciaenops ocellatus[J].Aquaculture,2003,225(1-4):17-26.
[5] 李雪菲,田丽霞,牛津,等.饲料脂肪水平对美国红鱼生长性能、体组成和肝脏组织结构的影响[J].动物营养学报,2015,27(11):3448-3456.
[6] 闻海波,马学艳,徐跑,等.紫黑翼蚌钩介幼虫寄主鱼的人工筛选及寄生包囊形成观察[J].水生生物学报,2018,42(2):356-363.
[7] 闻海波.紫黑翼蚌养殖基础生物学特性与钩介幼虫变态发育研究[D].南京:南京农业大学,2016.
[8] Sargent J R,Tocher D R,Bell J G.The lipids[M]//Halver J E,Hardy R W.Fish Nutrition.San Diego:Academic Press,2003:181-257.
[9] Seiliez I,Panserat S,Corraze G,et al.Cloning and nutritional regulation of a Δ6-desaturase-like enzyme in the marine teleost gilthead seabream (Sparus aurata)[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2003,135(3):449-460.
[10] 魏广莲,徐钢春,顾若波,等.饲料中添加不饱和脂肪酸对刀鲚幼鱼脂肪代谢酶活性和肌肉成分的影响[J].动物营养学报,2014,26(1):270-278.
[11] 魏广莲,徐钢春,顾若波,等.两种配合饲料对刀鲚幼鱼消化系统显微结构和功能的影响[J].大连海洋大学学报,2014,29(1):35-39.
[12] Tucker Jr J W,Lellis W A,Vermeer G K,et al.The effects of experimental starter diets with different levels of soybean or menhaden oil on red drum (Sciaenops ocellatus)[J].Aquaculture,1997,149(3-4):323-339.
[13] Regost C,Arzel J,Cardinal M,et al.Dietary lipid level,hepatic lipogenesis and flesh quality in turbot (Psetta maxima)[J].Aquaculture,2001,193(3-4):291-309.
[14] Wang Jiteng,Liu Yongjian,Tian Lixia,et al.Effect of dietary lipid level on growth performance,lipid deposition,hepatic lipogenesis in juvenile cobia (Rachycentron canadum)[J].Aquaculture,2005,249(1-4):439-447.
[15] Borges P,Oliveira B,Casal S,et al.Dietary lipid level affects growth performance and nutrient utilisation of Senegalese sole (Solea senegalensis) juveniles[J].British Journal of Nutrition,2009,102(7):1007-1014.
[16] Kikuchi K,Furuta T,Iwata N,et al.Effect of dietary lipid levels on the growth,feed utilization,body composition and blood characteristics of tiger puffer Takifugu rubripes[J].Aquaculture,2009,298(1-2):111-117.
[17] Wang Xinxia,Li Yongjin,Hou Chonglin,et al.Physiological and molecular changes in large yellow croaker (Pseudosciaena crocea R.) with high-fat diet-induced fatty liver disease[J].Aquaculture Research,2015,46(2):272-282.
[18] Boujard T,Gélineau A,Covès D,et al.Regulation of feed intake,growth,nutrient and energy utilisation in European sea bass (Dicentrarchus labrax) fed high fat diets[J].Aquaculture,2004,231(1-4):529-545.
[19] López-Soldado I,Avella M,Botham K M.Differential influence of different dietary fatty acids on very low-density lipoprotein secretion when delivered to hepatocytes in chylomicron remnants[J].Metabolism,2009,58(2):186-195.
[20] 冯健,贾刚.饵料中不同脂肪水平诱导红姑鱼脂肪肝病的研究[J].水生生物学报,2005,29(1):61-64.
[21] 石桂城,董晓慧,陈刚,等.饲料脂肪水平对吉富罗非鱼生长性能及其在低温应激下血清生化指标和肝脏脂肪酸组成的影响[J].动物营养学报,2012,24(11):2154-2164.
[22] 任泽林,霍启光,曾虹,等.氧化鱼油对鲤鱼生产性能和肌肉组织结构的影响[J].动物营养学报,2001,13(1):59-64.
[23] Rollin X,Médale F,Gutieres S,et al.Short- and long-term nutritional modulation of acetyl-CoA carboxylase activity in selected tissues of rainbow trout (Oncorhynchus mykiss)[J].British Journal of Nutrition,2003,89(6):803-810.
[24] 胡玲玲,李加儿,区又君,等.养殖条石鲷消化道形态构造及组织学观察[J].南方水产科学,2010,6(6):65-69.
[25] Shahidi F,Dunajski E.Lipid fatty acids,growth and compositional characteristics of farmed cod (Gadus morhua)[J].Journal of Food Lipids,1994,1(4):265-271.
[26] Umino T,Nakagawa H,Arai K.Development of adipose tissue in the juvenile red sea bream[J].Fisheries Science,1996,62(4):520-523.
[27] 孙书红,孟宏涛,惠增骞,等.n-3PUFA对高脂SHR大鼠血压及血浆游离脂肪酸谱的影响[J].现代生物医学进展,2016,16(2):225-229.
[28] 母猪日粮中脂肪酸组成对猪乳和血液以及仔猪血液中脂肪酸的组成的影响[J].王成,译.饲料广角,2012(20):30-33.