中国水域面积辽阔,鱼类资源丰富,其加工过程中产生了大量副产物,引起了研究者的关注。目前已出现从鱼鳞、鱼皮、鱼骨和内脏等鱼副产物中提取胶原蛋白并应用的研究报道[1-3],但鱼鳞存在腥味且含有较多钙杂质[4],鱼皮带有颜色且热变性温度较低,在一定程度上限制了其应用,鱼鳔则成为另一种富含胶原蛋白的重要替代原料。鱼鳔是鱼的平衡和比重调节器官,用于感压、发声和辅助呼吸,又名鱼胶、鱼泡、鱼白、鱼肚、压胞,是可用于烹饪的名贵佳肴,能养血补血、滋阴补肾、消疲御疾等,具有极高的食用和药用价值[5]。
除了部分鱼鳔被食用或医用,大量鱼鳔都以废弃物形式丢弃,既浪费了资源,也污染了环境。因此,如何实现鱼鳔高效利用具有重要意义。鱼鳔的重要组分为高级胶原蛋白,如新鲜鲫鳔组织中胶原蛋白含量为115.05 mg/g,蛋白质含量高达84.2%,脂肪含量仅为0.2%[6-7]。鱼鳔胶原蛋白具有卓越的生物相容性、低免疫原性、可降解性和高细胞直接黏附能力等,在提高免疫力、活化组织细胞、抑制癌细胞、抗氧化、止血等方面具有明显功效[8]。目前,关于鱼鳔的研究多数集中在生物活性肽的分离和评价方面[9-15],而在高分子胶原蛋白提取并应用于生物医学领域方面尚关注不足,为此,本研究中系统地综述了鱼鳔胶原蛋白的研究现状并探讨了其应用发展。
1 鱼鳔胶原蛋白的制备方法
鱼鳔胶原蛋白的制备是其应用的前提,主要包括预处理、提取和分离纯化。如无特殊要求,制备过程一般在4 ℃左右进行。
1.1 鱼鳔胶原蛋白的预处理
对鱼鳔材料的预处理直接影响着最后获得胶原蛋白的质量。通常采用酸、碱、有机溶剂等进行前期处理,以去除鱼鳔中的灰分、杂蛋白、脂质、色素等成分,并使胶质膨胀,组织疏松,利于下一操作步骤。其中,色素和杂蛋白一般可用氢氧化钠(NaOH)除去,而脱脂处理则多使用异丙醇或丁醇[16]。此外,借助超声波、微波等方法能实现更好的除杂效果。不同来源鱼鳔胶原蛋白制备的除杂处理如表1所示。
1.2 鱼鳔胶原蛋白的提取
提取是鱼鳔胶原蛋白制备过程中的核心步骤,旨在保证获得鱼鳔胶原蛋白生理活性的同时获得最大提取率。常见的提取工艺有酸法、酶法、热水法、盐法、碱法和发酵法。为提高产率、降低成本,也可将多种方法结合使用,如利用酸-酶结合法能明显提高黄鳍金枪鱼鱼鳔胶原蛋白得率[18];用10%的NaOH和10%的Na2SO4对鲟和白鱼鱼鳔进行4 h的碱盐处理,可导致糖胺聚糖等胶结物质受到破坏,纤维结构松弛、脱落,经检测,胶原蛋白多肽键的酰胺A、酰胺Ⅰ、酰胺Ⅱ、酰胺Ⅲ带完好,保留了天然结构[28]。利用酸-水提取法提取原鹤鳗鱼鱼鳔胶原蛋白,最佳提取条件为0.1 mol/L乙酸下分别酸浸1 h和水解1 h,产率为63.35%[23]。利用乙酸、6 mol/L NaOH、盐酸、NaCl等提取太湖白鱼鱼鳔,可获得较高提取率的胶原蛋白[4]。
表1 不同鱼类鱼鳔胶原蛋白制备的除杂处理
Tab.1 Deimpurity treatment of swim bladder from different fish species
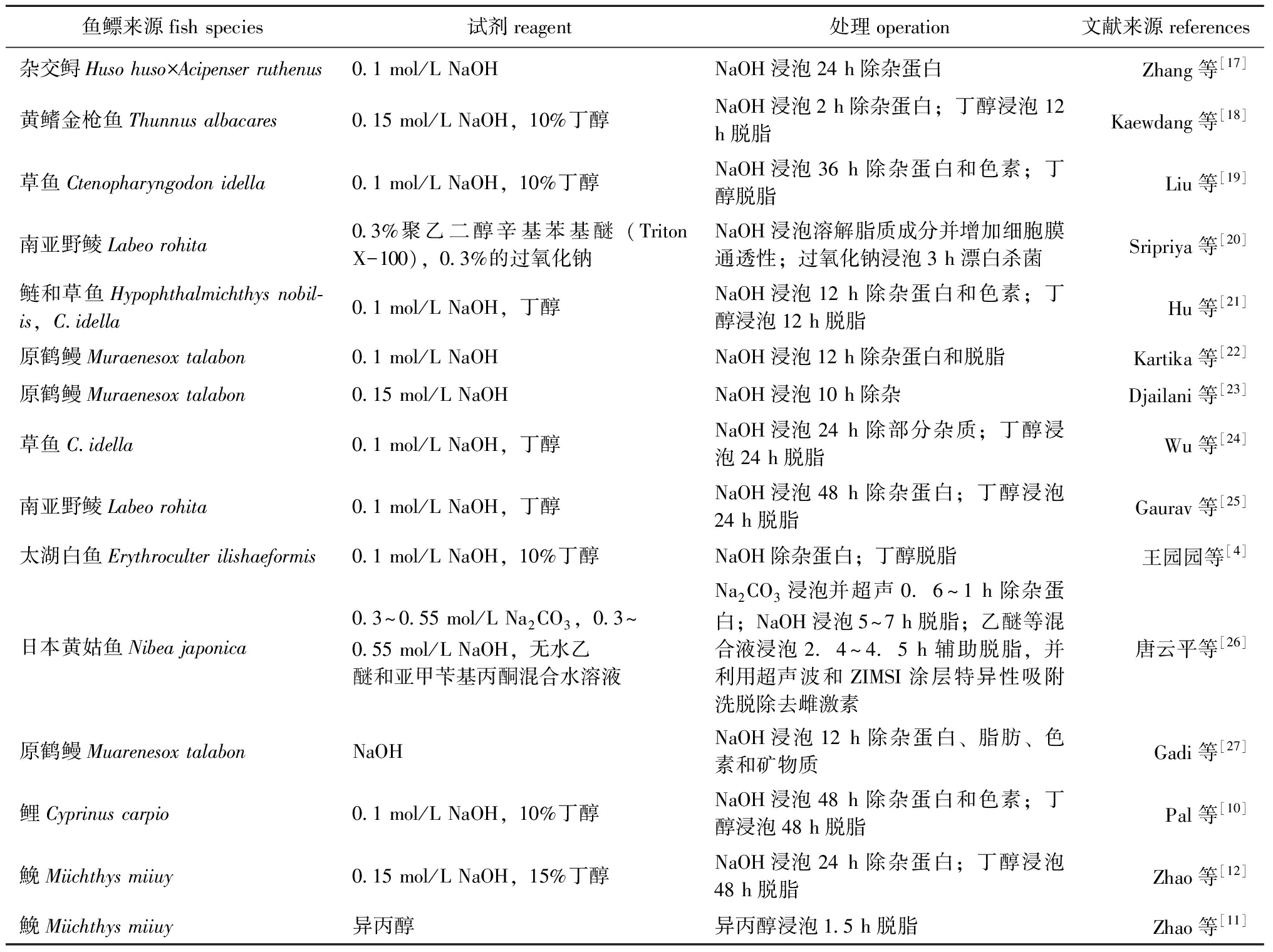
鱼鳔来源fish species试剂reagent处理operation文献来源references杂交鲟Huso huso×Acipenser ruthenus0.1 mol/L NaOHNaOH浸泡24 h除杂蛋白Zhang等[17]黄鳍金枪鱼Thunnus albacares0.15 mol/L NaOH,10%丁醇NaOH浸泡2 h除杂蛋白;丁醇浸泡12 h脱脂Kaewdang等[18]草鱼Ctenopharyngodon idella0.1 mol/L NaOH,10%丁醇NaOH浸泡36 h除杂蛋白和色素;丁醇脱脂Liu等[19]南亚野鲮Labeo rohita0.3%聚乙二醇辛基苯基醚(Triton X-100),0.3%的过氧化钠NaOH浸泡溶解脂质成分并增加细胞膜通透性;过氧化钠浸泡3 h漂白杀菌Sripriya等[20]鲢和草鱼Hypophthalmichthys nobil-is,C.idella0.1 mol/L NaOH,丁醇NaOH浸泡12 h除杂蛋白和色素;丁醇浸泡12 h脱脂Hu等[21]原鹤鳗Muraenesox talabon0.1 mol/L NaOHNaOH浸泡12 h除杂蛋白和脱脂Kartika等[22]原鹤鳗Muraenesox talabon0.15 mol/L NaOHNaOH浸泡10 h除杂Djailani等[23]草鱼C.idella0.1 mol/L NaOH,丁醇NaOH浸泡24 h除部分杂质;丁醇浸泡24 h脱脂Wu等[24]南亚野鲮Labeo rohita0.1 mol/L NaOH,丁醇NaOH浸泡48 h除杂蛋白;丁醇浸泡24 h脱脂Gaurav等[25]太湖白鱼Erythroculter ilishaeformis0.1 mol/L NaOH,10%丁醇NaOH除杂蛋白;丁醇脱脂王园园等[4]日本黄姑鱼Nibea japonica0.3~0.55 mol/L Na2CO3,0.3~0.55 mol/L NaOH,无水乙醚和亚甲苄基丙酮混合水溶液Na2CO3浸泡并超声0.6~1 h除杂蛋白;NaOH浸泡5~7 h脱脂;乙醚等混合液浸泡2.4~4.5 h辅助脱脂,并利用超声波和ZIMSI涂层特异性吸附洗脱除去雌激素唐云平等[26]原鹤鳗Muarenesox talabonNaOHNaOH浸泡12 h除杂蛋白、脂肪、色素和矿物质Gadi等[27]鲤Cyprinus carpio0.1 mol/L NaOH,10%丁醇NaOH浸泡48 h除杂蛋白和色素;丁醇浸泡48 h脱脂Pal等[10]鮸Miichthys miiuy0.15 mol/L NaOH,15%丁醇NaOH浸泡24 h除杂蛋白;丁醇浸泡48 h脱脂Zhao等[12]鮸Miichthys miiuy异丙醇异丙醇浸泡1.5 h脱脂Zhao等[11]
1.2.1 酸法提取 酸法提取是指在较低浓度酸溶液条件下,由于介质离子渗入,破坏鱼鳔分子间的盐键、希夫(Schiff)键和醛胺键等,引起膨胀、纤溶,胶原蛋白发生游离而溶出的方法,常用乙酸、盐酸、柠檬酸等[29]。此法提取时间短,通过电泳图谱分析发现,提取得到的胶原蛋白的酰胺条带清晰且一般无杂带,因此,酸法能在最大程度上保持鱼鳔胶原蛋白的三股螺旋结构,保持天然活性,尤其适用于生物医用材料的制备。但胶原蛋白末端存在醛基相互作用和分子共价交联作用,酸溶出的胶原蛋白量较少,另外可能出现溶剂残留、设备受腐蚀和环境污染等问题。酸法较常用于鱼鳔胶原蛋白的提取,不同来源鱼鳔胶原蛋白的酸法提取过程如表2所示。
表2 不同来源鱼鳔胶原蛋白的酸法提取
Tab.2 Acid extraction of swim bladder collagen from different fish species
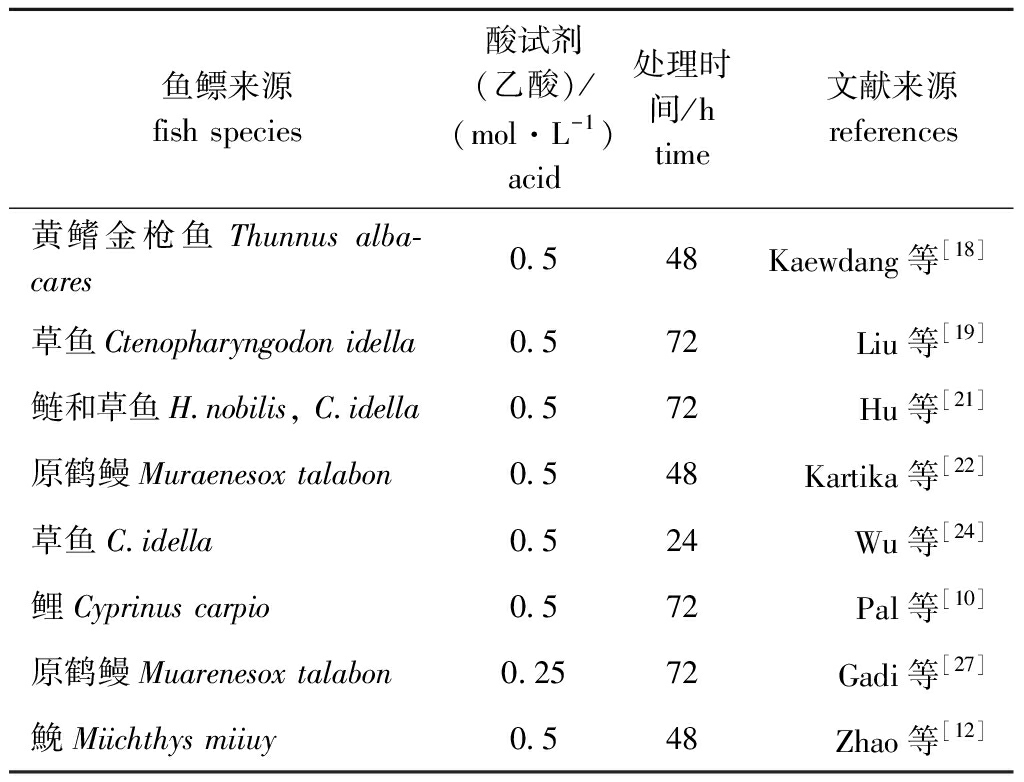
鱼鳔来源fish species酸试剂(乙酸)/(mol·L-1)acid处理时间/htime文献来源 references 黄鳍金枪鱼Thunnus alba-cares0.548 Kaewdang等[18]草鱼Ctenopharyngodon idella0.572 Liu等[19]鲢和草鱼H.nobilis, C.idella0.572 Hu等[21]原鹤鳗Muraenesox talabon0.548 Kartika等[22]草鱼C.idella0.5 24 Wu等[24]鲤Cyprinus carpio0.572 Pal等[10]原鹤鳗Muarenesox talabon0.2572 Gadi等[27]鮸Miichthys miiuy0.548 Zhao等[12]
1.2.2 酶法提取 通过酶的作用选择性切除胶原蛋白分子的末端肽使其溶于酶液中。常用工艺包括直接酶提法、混合酶分步提取法和酸碱初步水解后酶提法。常用的酶包括胃蛋白酶、胰蛋白酶、复合蛋白酶、木瓜蛋白酶等。影响提取效率的因素包括酶的种类、酶浓度、酶解温度、提取时间及pH值等。酶法提取率明显高于酸法,因其能进一步切割端肽,有利于胶原蛋白分子溶出,如利用酶法提取得到的草鱼鱼鳔胶原蛋白产率为114 g/kg,远高于酸法提取的51 g/kg[24]。相比较,用酸法提取可能由于鱼鳔胶原蛋白交联组分的存在而在电泳图谱中出现高分子量的条带,而酶法提取则可能出现低分子量小肽片段条带[19]。另外,使用酶法可有效缩短胶原蛋白的提取时间,以及保证胶原蛋白中与活性相关的结构的完整性,作用条件温和,材料无毒无污染,是目前较常使用的一种工艺[16],但成本较高。酶法也是鱼鳔胶原蛋白提取的常用方法,不同来源鱼鳔胶原蛋白的酶法提取过程如表3所示。
表3 不同来源鱼鳔胶原蛋白的酶法提取
Tab.3 Enzyme extraction of swim bladder collagen from different fish species
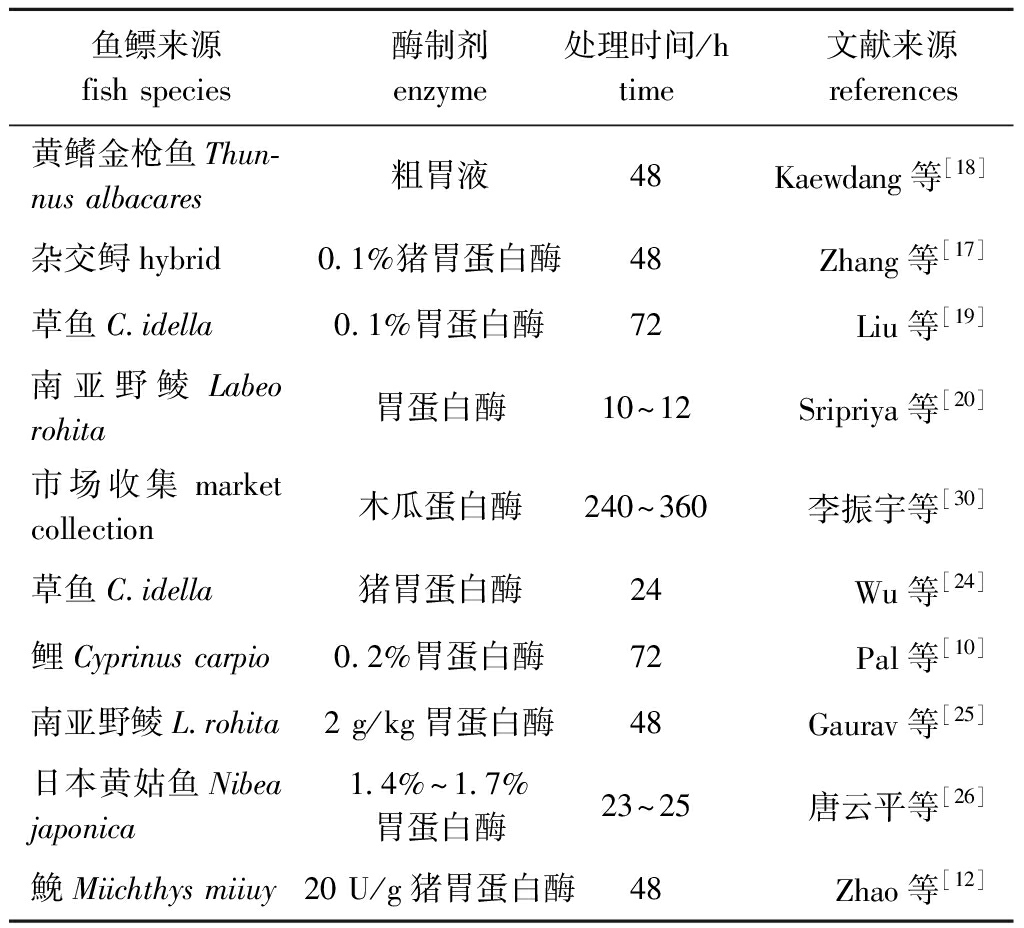
鱼鳔来源fish species酶制剂enzyme处理时间/htime文献来源 references 黄鳍金枪鱼Thun-nus albacares粗胃液48 Kaewdang等[18]杂交鲟hybrid0.1%猪胃蛋白酶48Zhang等[17]草鱼C.idella0.1%胃蛋白酶72Liu等[19]南亚野鲮Labeo rohita胃蛋白酶10~12Sripriya等[20]市场收集market collection木瓜蛋白酶240~360李振宇等[30]草鱼C.idella猪胃蛋白酶24Wu等[24]鲤Cyprinus carpio0.2%胃蛋白酶72Pal等[10]南亚野鲮L.rohita2 g/kg胃蛋白酶48 Gaurav等[25]日本黄姑鱼Nibea japonica1.4%~1.7%胃蛋白酶23~25唐云平等[26]鮸Miichthys miiuy20 U/g猪胃蛋白酶48Zhao等[12]
1.2.3 热水法提取 热水提取法一般是指将预处理后的鱼鳔用约65 ℃的水直接浸提和回流,使氢键等断开而得到鱼鳔胶原蛋白的方法。热水提取法相对于前两种方法使用略少,与酸法提取相比,该法可获得具有更高亚氨酸含量的胶原蛋白[22]。此法操作简单、成本低廉、安全环保,且获得的鱼鳔胶原蛋白纯度较高,水溶性好。诸永志等[31]发明了一种工艺,可使用热水将腌制后的鲫鱼鳔利用梯度加热的方式充分溶出胶原蛋白,并经降温获得胶原蛋白。以1∶1的原鹤鳗鱼鳔和热液质量体积比在40 ℃下反应2 h,过滤,冻干,得到胶原蛋白[22]。用50~60 ℃的去离子水对经碳酸钠浸泡处理后的鲇鱼鳔进行2~3 h的搅拌提取,冷却离心后在-30~-20 ℃下真空干燥20~24 h,得到鱼鳔胶原蛋白[32]。以1∶5的黄唇鱼鱼鳔与饮用水料液比在80 ℃下反应2 h,提取鱼鳔胶原蛋白[33],但此法存在温度过高而导致胶原蛋白共价键断裂改性的不足,常与其他方法结合使用。如涂宗财等[34]用3倍体积的0.15% NaOH浸提草鱼鱼鳔,水洗并用硫酸处理后,再用80 ℃热水浸泡2 h获得鱼鳔胶原蛋白。
1.2.4 盐法提取 一定浓度的中性盐溶液如NaCl、三羟甲基氨基甲烷盐酸盐(Tris-HCl)、柠檬酸盐等可使鱼鳔胶原蛋白溶解。在提取鲫鱼鳔胶原蛋白的过程中使用一定浓度的NaCl可使胶原蛋白表面电荷增加,从而与水分子间的作用力增强,加速胶原的溶出,但盐浓度不宜过高,否则导致盐析反应而降低得率[31]。此法能保证胶原分子的完整性和稳定性,但可能引入杂质离子。
1.2.5 碱法提取 碱法是指利用碱性物质使材料中的肽键水解得到胶原蛋白,常用的碱有NaOH、Ca(OH)2等。用0.1 mol/L的NaOH溶液浸泡大黄鱼鱼鳔4 h,并经水洗、乙酸中和、沉淀等步骤可获得胶原蛋白[7]。此法操作简单、提取速度快,但产物相对分子质量较低,胶原在碱性条件下不稳定,易过度水解使胶原的三螺旋结构受到破坏,此外残留的碱提取剂有毒性作用,因此,实际应用相对较少。
1.2.6 发酵法提取 此法是通过发酵过程中微生物所产生的蛋白酶对鱼鳔进行水解提取,可通过调控发酵时间获得活性最佳的胶原蛋白;发酵法提取效率高、成本低,适用于大规模生产,已成为现今最常用的提取方法[35]。
1.3 鱼鳔胶原蛋白的分离纯化
分离纯化是获得鱼鳔胶原蛋白关键性的一步,指根据胶原蛋白的分子量大小、溶解度、亲和性和带电性等,利用透析、盐析、层析、离心、色谱、电泳、冷冻干燥等方法除去相关杂质,如提取过程中产生的裂解肽、残留溶剂及胶原聚合物中的杂质部分,获得纯胶原蛋白。鱼鳔胶原蛋白的分离纯化报道见表4。在实际应用过程中常常多种方法结合使用,以达到更好的纯化效果,如超滤膜分离技术与色谱技术结合达到逐级分离纯化的效果[36]。
表4 不同来源鱼鳔胶原蛋白的分离纯化
Tab.4 Isolation and purification of swim bladder collagen from different fish species

鱼鳔来源fish species主要方法method文献来源 references 黄鳍金枪鱼Thun-nus albacares0.1 mol/L乙酸透析12 h,蒸馏水透析Kaewdang等[18]杂交鲟hybrid蒸馏水透析24 hZhang等[17]草鱼Ctenopharyn-godon idella离心20 min,NaCl透析12 h,7 000透析袋透析Liu等[19]南亚野鲮Labeo rohita2.5 mol/L NaCl差速盐析,离心Sripriya等[20]鲢和草鱼H.nob- ilis,C.idella2.0 mol/L NaCl盐析12 h,离心20 min,0.1 mol/L乙酸透析Hu等[21]草鱼C.idella0.1 mol/L乙酸透析48 hWu等[24]南亚野鲮L.rohitaNaCl盐析,离心,0.1 mol/L乙酸透析48 hGaurav等[25]太湖白鱼Erythro-culter ilishaeformis超纯水透析12 h王园园等[4]日本黄姑鱼Nibea japonica0.57~0.68 mol/L NaCl浸泡后离心,0.08~0.12 mol/L乙酸和蒸馏水透析1.5~2.3 h唐云平等[26]原鹤鳗M.talabon0.1 mol/L乙酸透析24 hGadi等[27]鮸Miichthys miiuy离心30 min,0.1 mol/L乙酸透析12 h,蒸馏水透析48 hZhao等[12]
2 鱼鳔胶原蛋白的特征
鱼鳔胶原蛋白呈白色,不透明状态,不溶于水。这与动物体内分布最广、含量最高的胶原蛋白类型[29]一致,鱼鳔所含为Ⅰ型胶原蛋白,由两条α1、一条α2和三条左旋多肽链组成右手三重螺旋结构,并含二聚体β链和三聚体γ链,相对分子质量较稳定,约300 000[10,12,19-20]。红外光谱分析在230 nm处可见羟脯氨酸特征吸收峰;其中,甘氨酸是含量最高的氨基酸,约占总量的1/3,脯氨酸含量较高,酪氨酸和组氨酸含量较低,几乎不含胱氨酸和色氨酸[37],因此,在280 nm处无明显吸收峰,可用于与一般胶原蛋白相区别。红外光谱分析显示,在1078 cm-1处出现显著吸收峰,这是鱼鳔胶原蛋白与陆生哺乳动物胶原蛋白相区别的特征峰[38]。与哺乳动物相比,鱼鳔胶原蛋白的丝氨酸、亮氨酸、异亮氨酸、蛋氨酸含量较高,羟脯氨酸较低[38]。不同鱼类来源鱼鳔胶原蛋白的甘氨酸、脯氨酸、谷氨酸和天冬氨酸含量存在一定差异,其他氨基酸种类和含量相近[8]。鱼鳔胶原蛋白通过甘氨酸三联体的氢键等共价交联作用形成高拉伸强度,维持其结构稳定性,同时脯氨酸的亚稳定状态提供结构灵活性,赋予胶原蛋白一定的柔韧性[39]。
鱼鳔中胶原蛋白含量与鱼的种类和年龄等有关。通常,鱼鳔胶原蛋白含量与鱼皮相当,明显高于鱼骨、鱼鳞、鱼鳍、鱼肉及内脏[3-4,6,16-17,40]。小牛皮和鲟鱼皮等胶原原纤维形成速度慢且稳定性不佳[41],而鱼鳔胶原蛋白由于黏度适合,具有极快速的原纤维形成能力[10],从而明显提高变性温度[17]。因此,鱼鳔胶原蛋白较适合作为哺乳动物胶原蛋白替代来源。
鱼类属于变温动物,鱼鳔胶原蛋白的热变性温度一般略低于陆生哺乳动物胶原,这与亚氨酸(脯氨酸和羟脯氨酸)的含量呈正相关[12],因亚氨酸中吡咯环能形成稳定三螺旋结构的化学键。但也存在更高的情况,如温带罗湖鱼鱼鳔胶原蛋白变性温度为42.16 ℃[25],高于牛皮、猪皮、鼠尾等常见陆生动物源胶原蛋白[41],且受季节影响不大,变化幅度0.5 ℃[21]。鱼鳔胶原蛋白亚氨酸含量一般高于鱼皮、鱼鳞及其他内部器官[6,16,20,24],相应的热变性温度也高[4,19,40],这是其作为水产胶原蛋白的一大优势。另外,温水或浅表层胶原蛋白的亚氨酸含量较冷水或深海层胶原蛋白多,同时热变性温度也较高[20,42],如分布于温水中上层的太湖白鱼鱼鳔胶原蛋白的脯氨酸、羟脯氨酸、亚氨酸分别占11.4%、8.5%、19.9%,热变性温度为36.4 ℃[4],而温水底栖类鲟鱼鳔3种氨基酸含量分别为10.2%、8.8%、19.0%,热变性温度为32.9 ℃[17]。
3 鱼鳔胶原蛋白的医学应用
鱼鳔胶原蛋白具有组织相容性、低抗原性、凝胶乳化性、可降解性,以及促进细胞定向黏附并生长增殖、促进止血等良好的理化性质,且来源广、生物安全性高,可被加工成各种形式的生物医用材料(如制作心脏瓣膜、作为创伤烧伤修复材料、人造皮肤、止血剂等[36])、高分子复合材料和细胞组织工程支架。
3.1 应用于骨科
人体内骨骼的软支撑组织一旦受伤,难以在体内自发修复再生。胶原蛋白是软组织的主要成分,可将其制成人工软骨组织凝胶用于骨组织缺损修复,刺激细胞生长并对新生细胞起定向支架作用,随骨组织修复逐渐被降解,从而改善损伤愈合。
鱼鳔胶原蛋白可制成复合制剂治疗关节损伤。杨子中等[43]利用浓度为1.5%~2.5%的羧甲基几丁质与10%~20%的大黄鱼鱼鳔胶原蛋白溶液制备出一种复合交联医用几丁糖制剂,在关节软骨修复或退行性骨关节炎治疗方面展现出了良好的应用前景;几丁糖水溶性好,能抑制纤维细胞生长;鱼鳔胶原蛋白生物相容性良好,可为软骨细胞的生长提供立体支架及基质环境,将二者形成的复合制剂进行关节腔内注射能有效促进损伤修复。
鱼鳔胶原蛋白可作为人工软骨材料。Mredha等[41]基于双网络概念,从鲟鱼鳔中提取胶原蛋白溶于酸性溶液中,注入大量的缓冲盐溶液,由于酸性胶原蛋白具有快速纤维生成能力,制备出柱状物理水凝胶作为一网,并采用化学交联聚合物N,N-二甲基丙烯酰胺作为二网,紫外365 nm波长照射引发两种网络单体聚合成双网络水凝胶,表面以羟基磷灰石作为涂层,成功研制出一种应用于骨组织的修复材料——胶原基硬质双网络水凝胶;其中,一网具备刚性、脆性及良好的生物相容性,可与二网带来的柔软性和灵活性相结合;将此胶原基硬质双网络水凝胶植入兔膝关节软骨缺损模型中,其具有的高黏结强度表现出了较强的骨形成能力,经推出试验等力学性能测试,发现在植入四周后胶原水凝胶并未降解,仍保持高强度,有望代替脆性较大的传统材料羟基磷灰石等,作为人工骨移植材料制作人工软骨。
鱼鳔胶原蛋白可用于制作骨修复的支架。李璐等[32]以50~60 ℃去离子水处理鲇鱼鳔获取鱼鳔胶原蛋白,以乙二胺四乙酸提取珍珠蛋白,以4%的NaOH、20%过氧化氢、1%磷酸钠缓冲液处理牛骨块制得双相磷酸钙粉;将三者混匀、制模、固化可得纳米骨修复材料,其中双相磷酸钙为基本骨架,其骨诱导性、生物活性、降解性均高,鱼鳔胶原蛋白和珍珠蛋白作为填充材料,能够改善材料的力学性能;整个纳米材料作为三维支架,能诱导成骨细胞生长分化,促进骨吸收,其降解速率与骨组织生长速率相协调,可有效应用于骨修复过程。
3.2 应用于组织细胞的培养
鱼鳔胶原蛋白的组织相容性和促进细胞定向黏附并生长增殖的特性显示出了组织细胞培养的潜能。在25 ℃下对鲟鱼鳔胶原蛋白进行扩散诱导凝胶试验,鉴于制成的水凝胶的快速凝胶生成率、高溶解度、均质性、低黏度、凝胶扩散诱导可控、高凝胶强度、变性温度高于机体生理温度等优点,进一步证实了其适用于细胞的培养和用作人工生物材料[44]。若直接制成支架其机械性能和热稳定性相对不足,亟待进一步的优化;Zhang等[17]在一定的试验条件下得到的鲟鱼鳔胶原蛋白具有高热稳定性和高纤维形成能力,可促进胶原纤维梭形结构的形成,提高机械强度。
3.3 应用于止血和伤口修复
鱼鳔胶原蛋白可通过凝聚血小板、调节凝血因子并激活外源性凝血途径促进止血过程,有望做成体外贴敷料或植入体内加速止血过程,并辅助皮肤和黏膜的损伤修复。
鱼鳔胶原蛋白可制成胶原膜治疗创伤。将南亚野鲮鱼鳔胶原蛋白制成胶原膜,经紫外照射交联促进胶原中芳香氨基酸中的残基自由基间成键作用,提高拉伸强度至(120.02±1.0) kg/cm2;将小鼠胚胎成纤维细胞和成肌细胞(L6)株接种在鱼鳔胶原蛋白基质中,发现细胞增殖率高,生长形态良好[20],有望作为生物医学植入物、涂层材料等应用于伤口愈合和重建外科中。从鲟和白鱼鱼鳔中提取胶原蛋白制成的胶原薄膜具有减少创口面积、缩短肉芽组织形成时间和伤口愈合时间等疗效[28],加之胶原薄膜具有无定形的特点,可用于预防和治疗皮肤和黏膜炎症并治疗创伤。
鱼鳔胶原蛋白制成的医用材料可较少发生炎症反应,而能促进伤口修复。以0.5%脱氧胆酸钠处理罗湖鱼鱼鳔,制得富含胶原的脱细胞鱼鳔基质,用1%的1,4-丁二醇二缩水甘油醚对基质进行交联处理,并制成双层支架贴附于家兔背部全层皮肤创面,每周观察一次,连续3周,发现在创面愈合过程中无动物感染死亡,肉眼不见化脓性炎症,支架内层与伤口整合良好,有利于细胞贴附生长,后期蛋白酶降解支架,新生表皮覆盖创面,有新血管生成,经检测和对照,总IgG免疫应答反应降低,交联剂处理能有效降低支架的抗原性[45]。可见,交联后的富含胶原的脱细胞鱼鳔基质具有免疫惰性、抗菌活性,能刺激血管生成,可作为皮肤临时支架促进皮肤伤口的修复。
3.4 应用于制药及保健食品
(1)制药催化剂。鱼鳔胶原蛋白复合物可作为制药过程中重要的催化剂。将鱼鳔细粉与靛红衍生物、苊醌、亚甲基腈、1,3-二羰基等混合,经一系列操作得到一种纯的生物催化剂IG[46],它主要由胶原蛋白组成,可在水中催化合成螺环吲哚和螺环萘,这是许多药物重要的核心结构,兼之具有双功能有机催化、生物相容性好、安全无毒等优点,在医药制剂行业展现出了巨大的应用前景。
(2)营养保健食品。鱼鳔胶原蛋白可被人体吸收利用,用于补充和合成蛋白质;此外,还具有增强消化功能、提高思维能力、维持腺体分泌的作用,也可滋润皮肤、增强肌肉弹性、延缓衰老等功效。鱼鳔胶原蛋白具有滋补养生、抗疲劳和免疫调节的功效,可制备成营养口服液;也可将其制成鱼鳔胶珠,可补真气,调气血[37]。
(3)炮制中药品。鱼鳔胶可入药。往鱼鳔胶中加入蛤粉和滑石粉等辅料,炮制成各种质量稳定的鱼鳔胶饮片,具有散瘀消肿,滋养筋脉的功效[47]。利用鱼鳔胶蛋白与枸杞、菊花、熟地黄等中药配伍制得杞菊地黄膏,具有滋补肝肾、育阴潜阳的功效,适用于健忘失眠,肝肾阴虚导致听力下降者[48]。此外,鱼鳔经炸酥、压碎等处理后可用于辅助治疗食道癌和胃癌[5]。
(4)胶原口腔喷雾。鱼鳔胶原蛋白可制成口腔喷雾制剂用于治疗多种口腔疾病。将石首鱼、鲟、鳕、鲤等的鱼鳔胶原蛋白溶于乙酸或柠檬酸中,以一定的比例和工艺按顺序加入绿茶粉、复合水果汁、透明质酸、精油、蜂蜜、中草药混合均匀,经超声处理后即得一种新型口气清新喷雾药剂,具有杀菌消炎的作用[49]。
3.5 其他应用
(1)鱼鳔胶原蛋白可用于制作纳米发电机,在生物电的开发应用中展现出了巨大潜力。Ghosh等[50]开发了一种基于鱼鳔胶原蛋白的纳米发电机——生物压电纳米发电机(BPNG),经测量,BPNG的压电能量转换效率为0.3%,输出功率密度为4.15 μW/cm2,鱼鳔胶原纤维高度有序,其固有的化学键和结晶度使其保持稳定结构,胶原纤维具有良好的生物相容性,因此,BPNG在生物医学领域有较好的应用前景,如将其植入活体内可从心跳、呼吸、血液循环等信号中获取生物能量。
(2)鱼鳔胶原蛋白具有护肤功效。用成分为5%~10%的鱼鳔胶原蛋白提取液、3%~5%的蘑菇提取液、3%~5%的落地生根提取液、2%~5%的海藻提取液、2%~5%的石斛提取液、0.3%~0.5%的吐温60、0.1%~0.3%的柠檬酸液、8%~12%的甘油、防腐剂、纯水,以及少量香精等制作一种护肤精华液,该精华液具有滋润皮肤,保持弹性,除皱抗衰老等功效[51]。相比哺乳动物,海洋鱼类的胶原蛋白由于凝固点较低、抗冻活性好[52],适用于生产高寒地区护肤品。
(3)鱼鳔胶原蛋白具有抗疲劳功效。将小鼠设置成高、中、低剂量黄唇鱼鱼鳔胶原蛋白组和等体积纯净水替代的空白对照组,灌胃40 d后,利用金属铅块对小鼠进行负重自由游泳测试,发现3组鱼鳔胶原蛋白组平均游泳时间均较空白对照组长,速率也较快,且剂量越高表现出的运动耐力越强;将小鼠处死后,测其部分生化指标发现,与空白对照组比,鱼鳔胶原蛋白组血乳酸含量较低,乳酸脱氢酶活性较高,肝糖原与肌糖原储备量较高,尿素氮含量较少,整体呈现出机体运动能力更强、有效抗疲劳的特性,且高剂量更有利于抗疲劳[33]。
4 存在问题与展望
整体来说,鱼鳔胶原蛋白比陆生动物源胶原蛋白安全,比鱼的其他部位胶原蛋白产量高且热稳定性更好,对其开发是基于生物医药上原材料来源的迫切需要,也是更好地实现副产物经济价值的重要途径。然而,鱼鳔胶原蛋白的发展仍存在不足,今后需要从以下6个方面开展更深入的研究与应用。
(1)安全性。现阶段的研究大多集中于表层鱼类的鱼鳔,而对于深海中种类繁多的鱼类鱼鳔胶原蛋白的开发利用欠缺,从深海鱼鱼鳔中分离出的胶原蛋白可能含有更少的寄生虫,在医学领域的应用中具有更高的安全性。
(2)热稳定性。从不同种类的鱼鳔中得到的胶原蛋白热稳定性存在差异,可能需要更全面地研究分析,使其作为生物医用材料在制作支架的过程中能落实对温度参数的调控,从而满足生物体各部位对生物材料的温度需求。
(3)机械性能。鱼鳔胶原蛋白的力学性能不足,使得其在生物体支撑组织方面的应用程度不高,一般只作为辅助材料使用。可考虑通过对温度、pH、反应速率、离子强度、胶原与试剂的配比等的调控,以及胶原组装过程中排列方式的监控等,提高胶原支架的强度。
(4)异型杂化。目前鱼鳔胶原蛋白常以单一胶原形式应用,然而许多生物体组织中的胶原以杂化形式存在,如真皮组织由Ⅰ/Ⅲ型胶原蛋白构成,可考虑将鱼鳔胶原蛋白与其他类型胶原蛋白通过温箱培育、磁场辅助等方法进行体外异型组装后使用,使得胶原支架更易于发挥组织的正常功能。
(5)制备新技术。鱼鳔胶原蛋白最终应走向产业化生产,实现更大的社会经济价值。鱼鳔胶原蛋白要实现产业化生产,优化制备工艺是首要任务。在提取方面,目前已产生了集超声系统、循环系统和冷却装置于一体的工业超声波胶原蛋白提取系统,有效提高提取率并降低总经济成本[53]。然而,后续的胶原蛋白纯化程度仍不理想,可考虑借助超滤技术,高效地实现胶原蛋白的纯化,除去小分子肽段,避免在医疗应用过程中引起免疫排斥等反应。
(6)配套工艺环保化。目前常用的鱼鳔胶原蛋白的制备方法中使用了酸碱和有机溶剂等易造成环境污染,故相关的互补配套设施或环保工艺的研发有着重大意义,如设计出与胶原蛋白的提取相结合,用于同步处理酸、碱、有机溶剂等的设备,从而实现回收利用、减少污染。
[1] Wang J K,Yeo K P,Chun Y Y,et al.Fish scale-derived collagen patch promotes growth of blood and lymphatic vessels in vivo[J].Acta Biomaterialia,2017,63:246-260.
[2] Li Jie,Wang Mingchao,Qiao Yingyun,et al.Extraction and characterization of type I collagen from skin of tilapia (Oreochromis niloticus) and its potential application in biomedical scaffold material for tissue engineering[J].Process Biochemistry,2018,74:156-163.
[3] Yu Di,Chi Changfeng,Wang Bin,et al.Characterization of acid-and pepsin-soluble collagens from spines and skulls of skipjack tuna (Katsuwonus pelamis)[J].Chinese Journal of Natural Medicines,2014,12(9):712-720.
[4] 王园园,张靓,周鹏.太湖白鱼中胶原蛋白的提取及其理化性质分析[J].食品工业科技,2017,38(18):45-49.
[5] 段振华,殷安齐,贾巧利,等.海鱼鱼鳔资源利用研究[J].食品研究与开发,2006,27(1):136-137,154.
[6] 贡雯玉,卞欢,吴海虹,等.高效液相色谱法检测鲫鱼不同组织中的胶原蛋白含量[J].食品科学,2015,36(14):65-69.
[7] 曾丽,李丽,王加斌,等.茶味鱼鳔胶原蛋白果冻的研制[J].浙江海洋学院学报:自然科学版,2013,32(4):334-339.
[8] 章丽莉,谢润筹,陈永东,等.食用鱼胶的制备和功效研究[J].海洋与渔业,2017(6):76-77.
[9] 孙燕丽,王琼生,潘志斌,等.草鱼鱼鳔酶解液的抗氧化活性及理化性质研究[J].福建师大福清分校学报,2017(2):30-36.
[10] Pal G K,Suresh P V.Physico-chemical characteristics and fibril-forming capacity of carp swim bladder collagens and exploration of their potential bioactive peptides by in silico approaches[J].International Journal of Biological Macromolecules,2017,101:304-313.
[11] Zhao Wenhao,Luo Qianbin,Pan Xin,et al.Preparation,identification,and activity evaluation of ten antioxidant peptides from protein hydrolysate of swim bladders of miiuy croaker (Miichthys miiuy)[J].Journal of Functional Foods,2018,47:503-511.
[12] Zhao Wenhao,Chi Changfeng,Zhao Yuqin,et al.Preparation,physicochemical and antioxidant properties of acid- and pepsin-soluble collagens from the swim bladders of miiuy croaker (Miichthys miiuy)[J].Marine Drugs,2018,16(5):161.
[13] Zhao Yuqin,Zeng Li,Yang Zuisu,et al.Anti-fatigue effect by peptide fraction from protein hydrolysate of croceine croaker (Pseudosciaena crocea) swim bladder through inhibiting the oxidative reactions including DNA damage[J].Marine Drugs,2016,14(12):221.
[14] 郑婷婷,涂宗财,唐平平,等.鱼鳔胶原肽抗氧化稳定性研究[J].食品与机械,2017,33(9):9-14.
[15] 雷春生,宋豪.一种鱼鳔胶原蛋白小肽螯合钙的制备方法:中国,CN106343579A[P].2017-01-25.
[16] 胡杨,朱士臣,熊善柏,等.鱼类加工副产物中胶原提取技术与性质分析[J].渔业现代化,2016,43(4):44-50.
[17] Zhang Xi,Ookawa M,Tan Yongkai,et al.Biochemical characterisation and assessment of fibril-forming ability of collagens extracted from Bester sturgeon Huso huso × Acipenser ruthenus[J].Food Chemistry,2014,160:305-312.
[18] Kaewdang O,Benjakul S,Kaewmanee T,et al.Characteristics of collagens from the swim bladders of yellowfin tuna (Thunnus albacares)[J].Food Chemistry,2014,155:264-270.
[19] Liu Dasong,Zhang Xuan,Li Tiancheng,et al.Extraction and characterization of acid- and pepsin-soluble collagens from the scales,skins and swim-bladders of grass carp (Ctenopharyngodon idella)[J].Food Bioscience,2015,9:68-74.
[20] Sripriya R,Kumar R.A novel enzymatic method for preparation and characterization of collagen film from swim bladder of fish rohu (Labeo rohita)[J].Food and Nutrition Sciences,2015,6(15):1468-1478.
[21] Hu Jinhua,Li Tiancheng,Liu Xiaoyong,et al.Seasonal variation of acid-soluble collagens extracted from the swim bladders and skins of bighead carp (Hypophthalmichthys nobilis) and grass carp (Ctenopharyngodon idella)[J].Food Bioscience,2016,15:27-33.
[22] Kartika I W D,Trilaksani W,Adnyane I K M.Karakterisasi kolagen dari limbah gelembung renang ikan cunang hasil ekstraksi asam dan hidrotermal[J].Jurnal Pengolahan Hasil Perikanan Indonesia,2016,19(3):222-232.
[23] Djailani F,Trilaksani W,Nurhayati T.Optimasi ektraksi dan karakterisasi kolagen dari gelembung renang ikan cunang dengan metode asam-hidro-ekstraksi[J].Jurnal Pengolahan Hasil Perikanan Indonesia,2016,19(2):156-167.
[24] Wu Xiaosa,Cai Luyun,Cao Ailing,et al.Comparative study on acid-soluble and pepsin-soluble collagens from skin and swim bladder of grass carp (Ctenopharyngodon idella)[J].Journal of the Science of Food and Agriculture,2016,96(3):815-821.
[25] Gaurav Kumar P,Nidheesh T,Govindaraju K,et al.Enzymatic extraction and characterisation of a thermostable collagen from swim bladder of rohu (Labeo rohita)[J].Journal of the Science of Food and Agriculture,2017,97(5):1451-1458.
[26] 唐云平,丁国芳,杨最素,等.一种日本黄姑鱼鱼鳔胶原蛋白的提取方法及应用:中国,CN107586331A[P].2018-01-16.
[27] Gadi D S,Trilaksani W,Nurhayati D T.Histologi,ekstraksi dan karakterisasi kolagen gelembung renang ikan cunang Muarenesox talabon[J].Jurnal Ilmu dan Teknologi Kelautan Tropis,2017,9(2):665-683.
[28] Иванова С Ф,Петрова Н Н.Исследование коллагена из плавательного пузыря осетровых (Acipenseridae) и сиговых (Corogenidae) пород рыб[J].Веctник СВФУ,2015,5(49):51-59.
[29] 文卓琼,黄爱妮.鱼类胶原蛋白的研究进展[J].黑龙江科技信息,2016(14):95-96.
[30] 李振宇,薛红娟,宋国.一种高粘度鱼鳔胶的制备方法:中国,CN105112011A[P].2015-12-02.
[31] 诸永志,王道营,吴海虹,等.一种从鱼肉、鱼皮、鱼鳔中溶出胶原蛋白的工艺:中国,CN104970180A[P].2015-10-14.
[32] 李璐,王文新,史玉玲.一种纳米骨修复材料及其制备方法:中国,CN108066817A[P].2018-05-25.
[33] 周沫希,来梦婕,薛凡,等.墨西哥黄唇鱼鱼鳔胶抗疲劳作用的动物试验研究[J].中国海洋药物,2018,37(4):31-38.
[34] 涂宗财,唐平平,郑婷婷,等.响应面优化鱼鳔胶原肽制备工艺及其抗氧化活性研究[J].食品与发酵工业,2017,43(5):160-166.
[35] 刘梅花,郑芷青,王小琴,等.鱼鳔加工技术研究进展[J].安徽农学通报,2018,24(8):115-116.
[36] 孙燕丽,程伟青,胡巧云,等.鱼鳔胶原蛋白活性肽的研究进展[J].生物技术与计算机科学研究,2016(8):431,433.
[37] 周斯仪,屈义,钟赛意,等.鱼鳔的功效因子及其开发利用研究进展[J].食品与机械,2017,33(11):208-211.
[38] 杨璐,王丽琴,黄建华,等.文物胶料鱼鳔胶的红外光谱、拉曼光谱及氨基酸分析[J].西北大学学报:自然科学版,2011,41(1):63-66.
[39] Liu Xinhua,Zheng Chi,Luo Xiaomin,et al.Recent advances of collagen-based biomaterials:multi-hierarchical structure,modification and biomedical applications[J].Materials Science and Engineering:C,2019,99:1509-1522.
[40] Liu Dadong,Liang Li,Regenstein J M,et al.Extraction and characterisation of pepsin-solubilised collagen from fins,scales,skins,bones and swim bladders of bighead carp (Hypophthalmichthys nobilis)[J].Food Chemistry,2012,133(4):1441-1448.
[41] Mredha M T I,Kitamura N,Nonoyama T,et al.Anisotropic tough double network hydrogel from fish collagen and its spontaneous in vivo bonding to bone[J].Biomaterials,2017,132:85-95.
[42] Regenstein J M,Zhou P.Collagen and gelatin from marine by-products[M]//Shahidi F.Maximising the Value of Marine By-Products.Cambridge,England:Woodhead Publishing,2007:279-303.
[43] 杨子中,何浩明,高坚杰,等.一种复合交联医用几丁糖制剂及其制备方法:中国,CN104491846A[P].2015-04-08.
[44] Mredha M T I,Zhang Xi,Nonoyama T,et al.Swim bladder collagen forms hydrogel with macroscopic superstructure by diffusion induced fast gelation[J].Journal of Materials Chemistry B,2015,3(39):7658-7666.
[45] Kumar V,Kumar N,Gangwar A K,et al.Comparative histologic and immunologic evaluation of 1,4-butanediol diglycidyl ether crosslinked versus noncrosslinked acellular swim bladder matrix for healing of full-thickness skin wounds in rabbits[J].Journal of Surgical Research,2015,197(2):436-446.
[46] Javanshir S,Saghiran Pourshiri N,Dolatkhah Z,et al.Caspian Isinglass,a versatile and sustainable biocatalyst for domino synthesis of spirooxindoles and spiroacenaphthylenes in water[J].Monatshefte für Chemie-Chemical Monthly,2017,148(4):703-710.
[47] 赵斌,刘敬,王琼,等.鱼鳔胶古今炮制规范初探[J].亚太传统医药,2016,12(14):72-74.
[48] 胡献国.耳鸣耳聋蜜膏疗方[J].蜜蜂杂志,2017,37(12):30.
[49] 谢海青,谢君毅.一种口气清新喷雾药剂的制备方法:中国,CN108310348A[P].2018-07-24.
[50] Ghosh S K,Mandal D.Efficient natural piezoelectric nanogenerator:electricity generation from fish swim bladder[J].Nano Energy,2016,28:356-365.
[51] 吴春元,李桂珠.一种护肤精华液:中国,CN108653143A[P].2018-10-16.
[52] 连喜军,鲁晓翔,刘勤生.鱼类胶原蛋白研究进展[J].肉类研究,2007(1):46-49.
[53] Song K M,Jung S K,Kim Y H,et al.Development of industrial ultrasound system for mass production of collagen and biochemical characteristics of extracted collagen[J].Food and Bioproducts Processing,2018,110:96-103.