新中国成立70年来,中国农业实施“藏粮于地、藏粮于技”战略,在粮食安全方面取得了举世瞩目的成就。2018年,中国居民人均优质蛋白质的占有量猪牛羊肉46.8 kg、水产品46.4 kg和牛奶为22.1 kg,比1996年分别增加16.6、19.5、17.0 kg[1],其中,水产品在改善人民生活质量、提升小康水平中发挥了不可替代的作用。
坚持绿色发展、保障粮食安全是中国的基本国策。中国是世界水产养殖第一大国,2018年水产品总产量为6457.7万t,其中养殖产量为4991.0万t[2]。水产养殖是中国海洋经济的重要组成部分,在促进渔业产业兴旺和渔民生活富裕、建设和谐社会、保障中国食物安全、提升国际市场竞争力等方面做出了突出贡献。近年来,由于全球气候变化和人类活动双重影响的加剧,近岸海洋和河口生态系统的结构和功能已经发生了历史性变化。中国海水养殖业养殖品种繁多,模式多样,随着养殖规模的不断扩大,长期危害养殖产业的病害问题日益突出。2018年,中国水产养殖因病害造成的经济损失约450亿元[2]。因此,开展病害防控研究,加快推进水产养殖业绿色发展,对于落实国家新发展理念、保护水域生态环境、保障国家粮食安全和建设美丽中国是十分紧迫和至关重要的。
预警预报是农业病害防控研究的热点及主流方向,近年来,国内外研究人员在农业灾害风险预警研究方面取得了重要进展,并将该技术广泛应用于农作物病害防控领域,有效增强了农业病害防控的预见性和计划性[3-7]。与农作物病害预警预报研究相比,中国水产动物病害预警预报体系的研究刚刚起步,主要工作集中在封闭或半封闭养殖系统,依据养殖水质的预测结果,对养殖动物病害发生情况进行测报[8-10]。水产动物的病害发生是病原、宿主与环境相互作用的结果[11-12],因此,系统研究水产动物免疫防御机制,解析病原、宿主、环境间的耦合关系,是建立和发展疫病防控策略的核心。借鉴农作物病害防控的理论与技术,建立水产动物健康评价体系,加强水产动物养殖生态环境的监测及病害发生的预警预报已成为保障中国水产养殖业健康可持续发展、确保粮食和生态安全的迫切需求。本研究中,对国内外水产养殖动物病害预警预报领域的研究进展进行了综述,并结合团队在扇贝病害预警方面的相关工作,重点阐述了海水养殖贝类病害预警模型构建的思路、原理和初步应用,以期为发展和完善中国海水养殖业病害防控体系、保障海水养殖业绿色健康发展提供理论参考和技术支撑。
1 水产动物病害预警的技术原理及国内外研究进展
水产动物生活在水中,环境因素复杂,病害发生难以预见,且通过水质调节或药物投放控制病害流行的可操作性较低[13-14]。“预防为主,防重于治”是目前水产动物病害防控的基本理念,而水产动物病害预警预报体系的构建将有效预防水产动物疫病的发生、流行与传播,推动中国水产养殖产业的绿色健康发展。
1.1 水产动物病害预警预报体系的技术原理
预警源于预测,又是更高层次的预测[3],其侧重于对警情发生的演化动态、方向及由此产生的后果等进行分析和预测[15]。广义而言,预警包含发现警情、分析预警、寻找警源、判断警度及排除警情等过程[15]。水产养殖动物病害预警预报是指在总结以往监测数据的基础上,系统分析各生物、非生物因素与水产动物病害发生及死亡的相关性,通过构建预警模型对病害的发生时间、范围、危害程度等进行预测并发布警示,指导生产活动,规避养殖风险。
借鉴农作物病害预警相关研究进展和成果,水产动物病害预警可分为明确警义、监测警兆、追溯警源、预报及排除警情等一系列相互衔接的阶段和过程[3,16](图1)。① 明确警义,即明确预警的研究对象,这是开展病害预警的前提。② 监测警兆,指对环境、病原及水产动物生理、免疫指标等与疾病发生和死亡密切相关因素的长期监测,这是构建预警预报体系的基础。③ 追溯警源,即分析警情产生的根源,发病原因越明晰,预警的准确度越高。④ 预报及排除警情,即利用分析模型预测结果,借助现代信息技术发布病害发生风险警示信息及可能的应对处置方案,最终排除警情。
1.2 水产动物病害预警预报体系的国内外研究进展
在长期进化过程中,水产动物为了适应复杂多变的水环境,形成了独特复杂的免疫防御机制。水产动物病害的发生是病原、宿主与环境相互作用的结果[11-12,17-22],故预警预报体系的建立必须同时考虑这三方面的耦合关系和协同作用,厘清三者间的相互关系,选择关键因素作为预警系统的重要指标以大幅提高水产动物病害预警的可靠性。
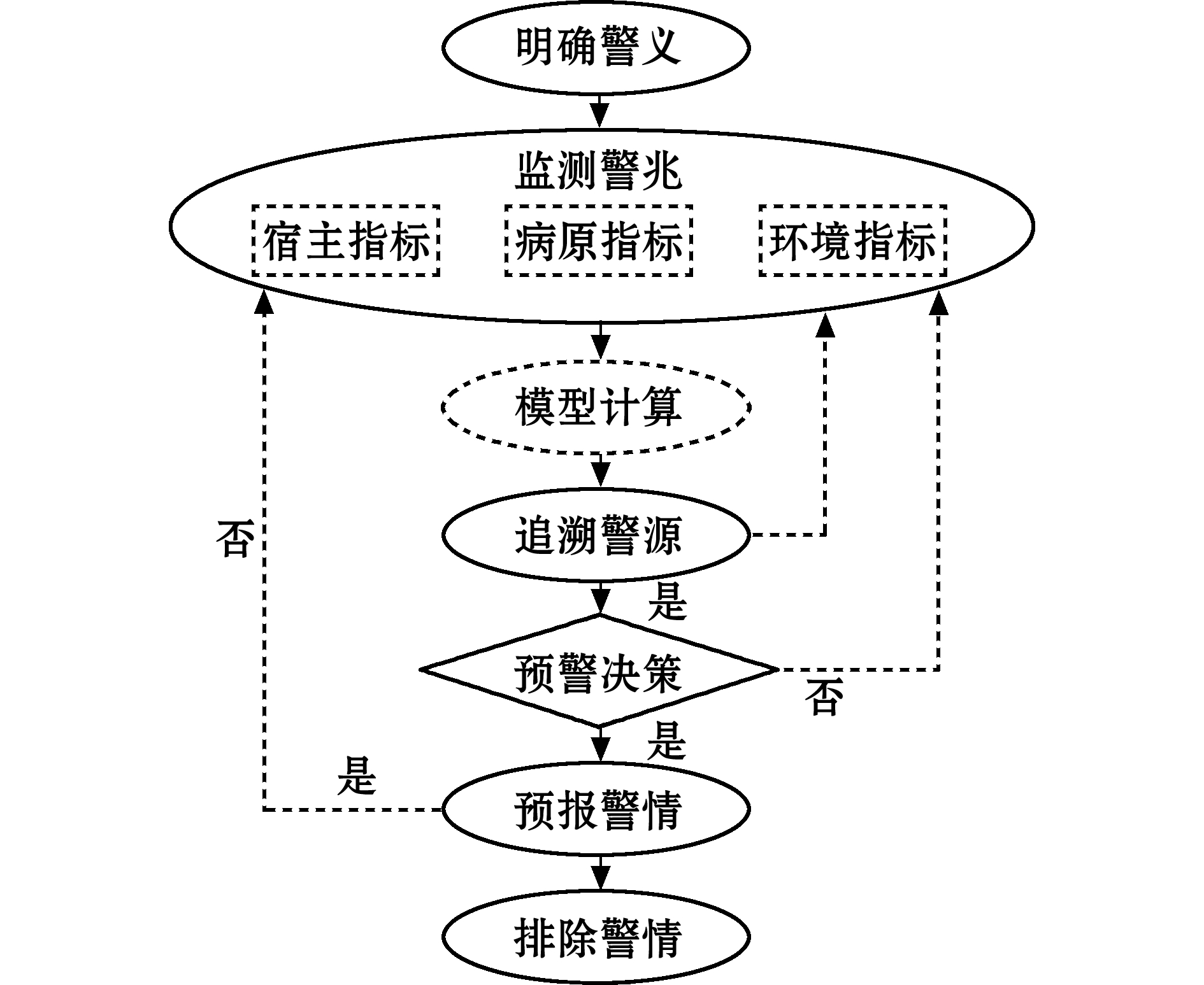
图1 养殖贝类病害预警逻辑过程
Fig.1 Rational process on an early warning system for disease occurrence in mollusc aquaculture
1.2.1 病原 病原是引发水产动物疫病发生的最主要因素,也是病害预警研究的关键内容。研发病原的快速高通量检测技术,完善疫病诊断的标准体系,创新病害预警的综合分析技术,促进水产动物病害防控技术的转型升级,不仅是发展绿色养殖产业的迫切需要,也是保障水产动物食品安全的必然要求。
目前,国内外报道的水产动物病害预警模型主要是通过分析环境因子后对病害发生做出预测。由于水环境尤其是开放海域生态环境极其复杂,仅依靠环境因子进行病害预测可能会产生一定程度的偏差,故将病原的相关指标纳入预警系统,将会提高预测结果的准确性。水产养殖动物的病原主要包括细菌、病毒和寄生虫等,国内外已有关于病原相关指标应用于病害预警方面的研究报道。Powell等[23]构建了长牡蛎、寄生虫和环境相互作用的数学模型,并利用该模型准确模拟了两个海湾中养殖的长牡蛎群体感染寄生虫的时间和感染程度,为牡蛎寄生虫病的预警防控提供了技术保障。中国科研人员通过对大黄鱼养殖海域环境因子的分析发现,温度、溶解氧和化学需氧量是影响网箱养殖大黄鱼发病率的主要环境因子,并在此基础上分别针对刺激隐核虫和细菌病构建了网箱养殖大黄鱼的疾病预报模型,有效预测了疾病发生的等级[24-25]。中国水产养殖动物种类多,病原多样性丰富,病情复杂。其中,2018年监测到发病养殖种类66种,主要的养殖鱼类和虾类均有疾病发生。监测到的疾病主要包括鲤春病毒血症、草鱼出血病、传染性脾肾坏死病、锦鲤疱疹病毒病、传染性造血器官坏死病、病毒性神经坏死病、鲤浮肿病、鲫造血器官坏死病等鱼类疾病,以及白斑综合征、传染性皮下和造血器官坏死病、虹彩病毒病和肝肠胞虫病等虾类疾病[2]。开展养殖动物疫病监测与诊断、病原致病机制、病原鉴定和快速检测技术研究,筛选病原警兆指标,构建全面可靠的水产动物病害预警系统,是水产养殖动物疫病防控的重要方向。
1.2.2 宿主 水产动物进化形成较为完善的免疫系统来抵御病原的侵染,其生理状态和抗病力是决定病害发生的关键因素。免疫识别是机体识别和阻止病原感染的第一道防线。水产动物主要通过被称为模式识别受体(Pattern recognition receptors,PRRs)的免疫识别分子识别入侵的病原[26]。目前,已在水产动物中鉴定出十几类PRRs,主要包括肽聚糖识别蛋白(Peptidoglycan recognition proteins,PGRPs)、C-型凝集素(C-type lectins,CTLs)、纤维蛋白原相关蛋白(Fibrinogen-elated proteins,FREPs)、含C1q 结构域蛋白(C1q domain containing proteins,C1qDCs)、清道夫受体(Scavenger receptors,SRs)、含免疫球蛋白结构域的细胞黏附分子和Toll样受体(Toll-like receptors,TLRs)等[27-28]。免疫识别过程是激活机体免疫应答反应的首要步骤,免疫识别信号能诱导机体的细胞免疫和体液免疫以抵抗或清除病原。细胞免疫主要包括吞噬作用(phagocytosis)、包囊作用(encapsulation)、结节形成(nodule formation)和凝集反应(aggregation)或凝结反应(coagulation)等过程。病原侵染也能激活水产动物体液免疫,主要包括激活Toll、Janus激酶/信号转导与转录激活子(Janus kinase signal transducers and activators of transcription,JAK-STAT)、丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)、补体(Complement system)和肿瘤坏死因子(Tumor necrosis factor,TNF)等免疫信号通路,进而促进多种免疫效应分子如细胞因子和抗菌肽等的合成,并通过与细胞免疫协同作用共同清除病原,维持自身稳态[26,28-29]。
目前,一些重要的免疫、生理生化和代谢指标可用于指示水产动物健康状态及环境胁迫强度,也因此被筛选为指示水产养殖动物病害发生的候选警兆指标。例如,鲈细胞因子(TNF-1,Interleukin (IL)-1β,IL-8)的转录水平和抗氧化酶活性在受到高温和低氧诱导后显著升高[30-31]。草鱼呼肠孤病毒能诱导草鱼体内活性氧(Reactive oxygen species,ROS)合成和杀伤细胞中自噬小体的形成[32]。斑马鱼的凝集素和胸腺肽在受到脂多糖(Lipopolysaccharide,LPS)、脂磷壁酸(Lipoteichoic acid,LTA)或嗜水气单胞菌刺激后呈现升高的趋势[33-34]。在亚硝酸胁迫下,对虾肠道中ROS、过氧化脂质和丙二醛(Malondialdehyde,MDA)含量,以及超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化物酶(Catalase,CAT)和谷胱甘肽过氧化物酶(Glutathione peroxidas,GPx)活性显著升高[35];受到硫化物刺激后,对虾肝胰腺的糖原、血清葡萄糖、乳酸含量及乳酸脱氢酶活性显著降低[36];暴露于Cu条件下,对虾血淋巴细胞的凋亡水平和SOD活性显著升高[37];受到病原菌刺激后,对虾血淋巴细胞中的多种PRRs(如CTL和Toll)、激酶(MAPK)、关键转录因子(Dorsal和Stat)和抗菌肽显著升高,血淋巴细胞的吞噬能力显著升高[38-41]。中华绒螯蟹血淋巴细胞中的半胱氨酸天冬氨酸酶Caspase-3/7-1转录水平在嗜水气单胞菌、LPS和过氧化氢(H2O2)处理后显著升高[42],LPS能诱导中华绒螯蟹血淋巴细胞发生凋亡[43]。使用亚致死温度短期处理牡蛎,可激活机体热休克蛋白(Heat shock proteins,HSPs)大量表达[44],从而有效降低病原感染造成的死亡。贝类酚氧化酶的活性水平受环境中有机/无机污染物的显著影响[45]。水产动物的这些免疫、生理生化和代谢指标对水体环境的变化较为敏感,可作为监测水产动物疾病和水体环境的潜在标志物,应用于水产动物病害的预警预报。
1.2.3 环境 在病原、宿主与环境三者相互作用过程中,环境因子不仅影响病原微生物的群落组成和致病能力,还能诱发改变宿主的生理和免疫状态,因此,在水产动物病害的预警预报中占据重要地位。
水产动物种类繁多,生活习性迥异,不同种类的生物学特性差异显著,各种环境因子对水产动物病害发生所发挥的作用也各不相同。水产养殖系统中的环境因子主要包括温度、盐度、光照、水流、溶解氧、pH、氨氮![]() 硝氮
硝氮![]() 亚硝氮
亚硝氮![]() 无机磷、叶绿素、生化需氧量(BOD)和化学需氧量(COD)等。国内外学者围绕环境因子与水产动物病害发生的关系及预警预报开展了大量研究,并在开放养殖系统的水质预警方面积累了良好的经验。利用人工神经网络研究了环境因子与北极鳕产量间的关系,并对其产量和存活率进行了预测[46]。Silva等[47]在连续监测葡萄牙沿海藻华的基础上,构建了有害藻华预警系统,通过对潮汐、水温及盐度等环境因子的分析预测了有害藻华爆发及持续的时间,有效指导了当地渔民对扇贝的捕捞。中国学者在封闭水体养殖环境的研究方面也取得了可喜进展,构建了多项水质预警系统。例如,针对凡纳滨对虾集约化养殖中病害频发的问题,建立了水质预警模型;构建了中华绒螯蟹养殖过程中溶解氧的实时预警系统,并及时发布预报信息[48]。通过实时监测水质数据,对养殖鱼类疾病发生风险进行预测,构建了池塘养殖鱼类病害预警模型[49]。对环境因子进行监测并对水质进行调控是水产养殖的关键,然而目前对开放式养殖系统的水质进行实时监测和预警预报还处于起步阶段。加快对开放水体环境风险的预警研究是实现陆海统筹、构建新型渔业生产体系、确保近海生态安全的迫切需要。
无机磷、叶绿素、生化需氧量(BOD)和化学需氧量(COD)等。国内外学者围绕环境因子与水产动物病害发生的关系及预警预报开展了大量研究,并在开放养殖系统的水质预警方面积累了良好的经验。利用人工神经网络研究了环境因子与北极鳕产量间的关系,并对其产量和存活率进行了预测[46]。Silva等[47]在连续监测葡萄牙沿海藻华的基础上,构建了有害藻华预警系统,通过对潮汐、水温及盐度等环境因子的分析预测了有害藻华爆发及持续的时间,有效指导了当地渔民对扇贝的捕捞。中国学者在封闭水体养殖环境的研究方面也取得了可喜进展,构建了多项水质预警系统。例如,针对凡纳滨对虾集约化养殖中病害频发的问题,建立了水质预警模型;构建了中华绒螯蟹养殖过程中溶解氧的实时预警系统,并及时发布预报信息[48]。通过实时监测水质数据,对养殖鱼类疾病发生风险进行预测,构建了池塘养殖鱼类病害预警模型[49]。对环境因子进行监测并对水质进行调控是水产养殖的关键,然而目前对开放式养殖系统的水质进行实时监测和预警预报还处于起步阶段。加快对开放水体环境风险的预警研究是实现陆海统筹、构建新型渔业生产体系、确保近海生态安全的迫切需要。
2 北黄海和渤海养殖贝类病害预警预报模型构建及应用
水产养殖业已成为北黄海和渤海地区海洋产业的重要组成部分,其中,牡蛎、扇贝、鲍、蛤等贝类是北黄海和渤海海域的主导养殖品种。近年来,养殖贝类的病害时有发生,且难以发现、诊断和治疗,已成为制约北黄海和渤海贝类养殖产业稳定发展的瓶颈。构建养殖贝类的病害预警体系能够有效地指导实际生产,规避或减少因病害发生导致的经济损失,确保贝类养殖产业的健康发展。目前,国内关于海水养殖贝类病害预警预报体系的研究和报道较少,国家贝类产业技术体系病害控制功能实验室组织相关科研力量,开展了海水贝类病害预警体系的研发工作,针对北黄海和渤海贝类养殖海区的生态系统特征及贝类养殖现状,解析了环境、病原及宿主健康状态与病害发生的关系,筛选了病害预警的警兆指标,构建了病害预警模型,初步实现了贝类病害预警体系的推广应用。
2.1 贝类病原相关的警兆指标
近年来爆发的贝类疫病主要包括弧菌病、细菌性溃疡病、脓包病、气单胞菌病、才女虫病等,主要由细菌、病毒、寄生虫和真菌等病原引发[2,22,50-53]。贝类通常养殖于浅海、滩涂等开放海域,难以通过投放药物或改善水质等措施控制和消灭病原微生物。因此,检测开放养殖水体的微生物群落结构,监测病原微生物丰度的变化,构建病原相关的预警测报系统,是贝类病害预警预报,实现有效防控的重要内容。
中国养殖贝类病原的研究主要集中在重要病原数据库构建、病原致病机制探索和快速高通量检测技术研发。研究者建立了鳗弧菌Vibrio anguillarum、溶藻弧菌V.alginolyticus、迟缓爱德华氏菌Edwardsiella tarda、灿烂弧菌V.splendidus、副溶血弧菌V.parahaemolyticus、荧光假单胞菌Pseudomonas fluorescens和恶臭假单胞菌Pseudomonas putida等贝类常见病原菌的快速特异检测方法,制定了贝类派琴虫病、鲍疱疹病毒病、牡蛎包纳米虫病、单孢子虫病、马尔太虫病等的诊断规程。牡蛎疱疹病毒(Ostreid herpesvirus 1,OsHV-1)是导致全球贝类大量死亡的重要病原之一。对OsHV-1的流行病学研究表明,OsHV-1及其变异株急性病毒性坏死病毒(Acute viral necrosis virus,AVNV)能够感染扇贝、牡蛎、魁蚶等多种贝类[54-58]。目前学者已完成了OsHV-1基因组序列的测序[59-61],揭示了其与宿主相互作用的机制[62-63],并且研发了多种OsHV-1的快速检测方法[64-66]。已有研究表明,灿烂弧菌[50,67]、发光杆菌Photorhabdus和弗朗西斯氏菌Francisella tularensis[68]是北黄海养殖虾夷扇贝脓包病的主要病原菌。研究人员揭示了灿烂弧菌JZ6的低温适应和低温致病分子机制,研究了温度对灿烂弧菌溶血活性的影响[69-70],并根据灿烂弧菌主要毒力因子金属蛋白酶Vsm基因建立了灿烂弧菌快速检测方法[71]。本研究团队自2012年起,跟踪监测了北黄海和渤海养殖区病原的种类和数量变化情况,通过监测不同季节贝类养殖水体中灿烂弧菌数量和弗朗西斯氏菌丰度的变化,发现在每年6月,即虾夷扇贝病害爆发前夕,养殖环境中的灿烂弧菌和弗朗西斯氏菌数量或丰度大幅增加。因此,选取了弧菌和弗朗西斯氏菌丰度等作为贝类病害预警模型的警兆指标进行长期跟踪监测,为预警预报模型的构建提供了重要的数据支撑。
2.2 贝类的健康状态指标
贝类缺乏基于淋巴细胞和抗体的获得性免疫机制,主要依赖固有免疫系统清除病原。目前的研究已初步明确了贝类免疫系统的基本分子组成,克隆获得500余个贝类免疫相关功能基因。确定了贝类免疫识别受体(FREP、SR、CTL、C1qDC、Toll、Leucine-rich repeats、DM9CP、Caspase等)、补体相关分子、肿瘤坏死因子、白介素、神经递质代谢酶及其受体、能量代谢关键激酶等基因在贝类免疫防御过程中发挥的重要作用[26,72-74]。病原侵染能引发一系列的细胞防御反应,包括细胞吞噬、凋亡、包囊化和结节形成等。研究者确认了鳃丝基部为长牡蛎潜在的造血位点,鉴定了颗粒细胞是长牡蛎发挥吞噬作用的主要细胞类群[75-76]。长牡蛎血淋巴细胞的吞噬作用能够启动氧化还原反应、溶酶体蛋白水解等抗细菌免疫反应[72,77]。
评价和确定养殖贝类的健康状态是病害预警预报体系的基础。近年来,本研究团队结合免疫学、生理学、分子生物学、生物化学等多学科理论与技术,探索建立了贝类健康状态的评价技术。发现病原侵染和环境胁迫可以诱导免疫识别、信号转导、免疫效应分子等的表达[78]。通过研究重金属、高温、氨氮、微生物刺激等多种胁迫对贝类免疫稳态的影响,发现环境胁迫和细菌感染双重压力可加速低能耗条件下的氧化损伤,从而造成贝类的大量死亡[79-81]。在急性高温胁迫条件下,长牡蛎肝胰腺的总能量储备和细胞能量分配(Cellular energy allocation,CEA)显著下降,高温胁迫干扰了长牡蛎免疫应答和能量代谢相关基因的正常表达,打破了代谢平衡,导致长牡蛎在夏季的免疫能力下降,易出现大规模死亡[79]。细胞凋亡是贝类在逆境下实现自我保护的重要机制之一[82]。长牡蛎在干露状态下可通过多种方式维持胞内稳态,其中,泛素化修饰、DNA损伤修复及MAPK通路在胁迫应答中可能扮演着重要角色[83]。通过分析这些生理及免疫相关指标与养殖贝类健康状态的关联性,筛选出部分免疫因子、抗氧化分子、不同血淋巴细胞类群比例、儿茶酚胺、CEA、能量代谢底物、总抗氧能力(Total antioxidant oxyradical capacity,T-AOC)等作为养殖贝类健康状态评价的候选指标。根据长期连续跟踪监测数据分析及预警预报模型的拟合与优化,进一步筛选了SOD活性、MDA含量及闭壳肌糖原含量等作为贝类健康的警兆指标。
2.3 环境因子与贝类病害发生的关系
环境风险预警是水产动物病害预警的重要方面,是突破水域环境控制、实现生态优先养殖的关键环节。北黄海和渤海的贝类养殖主要以近海浮筏吊养为主[84]。北黄海和渤海养殖海区的环境因子具有较明显的季节性变化特征,且与全球气候及人类活动息息相关[85]。根据北黄海和渤海贝类养殖海区的生态系统特征及贝类养殖现状,本研究团队对海区水文、无机盐、藻相、微生物群落等生态环境指标进行连续跟踪监测,通过分析养殖海域主要环境因子的年际及季节性变化规律后发现,温度、溶解氧、硝酸盐和硅酸盐是影响浮筏养殖虾夷扇贝生长的主要环境因子(图2);水温、叶绿素和溶解氧显著影响细菌的群落结构,通过分析贝类养殖海区浮游藻类群落的季节性演化规律后发现,在虾夷扇贝病害高发季节,海水中叶绿素含量和硅藻丰度较低,而甲藻等有害藻类丰度较高[86]。最后研究筛选了水温、叶绿素、溶解氧、硝酸盐和硅酸盐浓度、浮游藻类丰度等作为贝类病害预警模型的警兆指标进行长期监测。
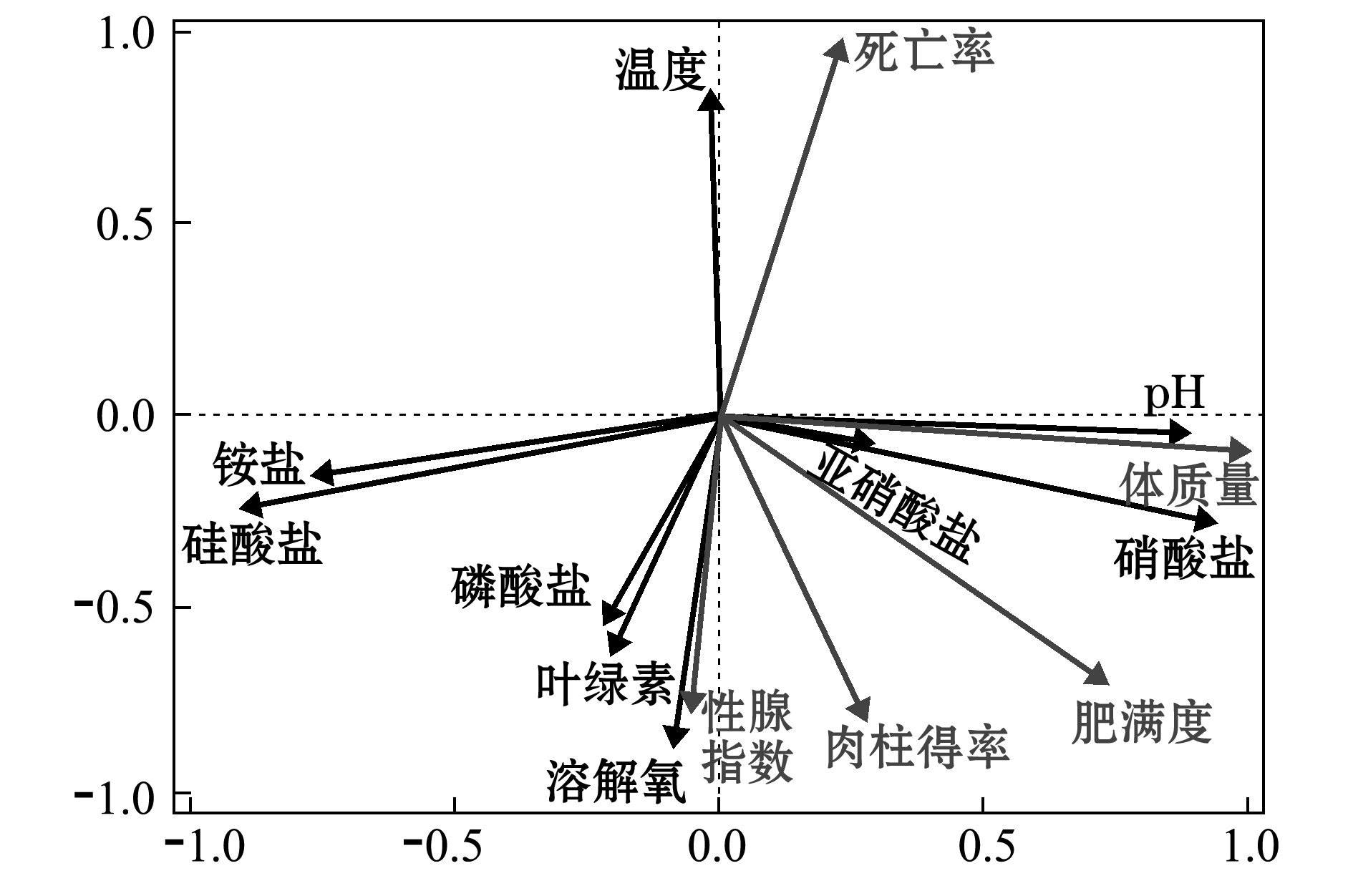
图2 虾夷扇贝生长性状与环境因素的相关性分析
Fig.2 Correlation analysis of the growth trait of yesso scallop Patinopecten yessoensis and the environmental factors
2.4 海水养殖贝类病害预警数学模型构建与优化
自2009年开始,本研究团队对北黄海和渤海虾夷扇贝及海湾扇贝养殖区开展了连续监测工作,通过分析病原、宿主与环境之间的耦合关系,构建了病害预警模型。同时对一大批候选警兆指标进行筛选,最后选择海水温度、叶绿素含量、弧菌丰度,以及养殖动物总抗氧化能力、闭壳肌糖原含量等指标作为输入样本(即警兆)。基于MATLAB的BP神经网络进行数据建模,以死亡率指标作为预测样本(即警情),根据输入样本和预测样本分别建立输入数据矩阵和目标数据矩阵,并利用原始数据矩阵对输入网络进行初始化,初步构建了虾夷扇贝病害预警预报体系。通过对输出矩阵中的预测死亡率和实际死亡率进行绘图比较,发现两组数值曲线几乎重合,与预期结果相一致(未发表数据)。拟合的源代码能有效利用已知环境、病原及养殖贝类指标数据,可用于目标警情(死亡率)的预测。
2.5 海水养殖贝类病害预警系统的初步应用
虾夷扇贝为冷水性贝类,20世纪80年代初由日本引进到中国后迅速发展成为北黄海的主导养殖对象。近年来,虾夷扇贝大规模死亡问题引起了广泛关注。目前认为病害是导致筏养虾夷扇贝大规模死亡的主要原因之一,水温是重要的诱导因素。针对北黄海虾夷扇贝产业存在的问题,本研究团队连续多年对浮筏养殖的虾夷扇贝及海区进行了跟踪调查,筛选了海水温度、溶解氧、弧菌数量及丰度、硅藻丰度,以及扇贝闭壳肌糖原、MDA含量、SOD活性等作为警兆指标,构建了虾夷扇贝的病害预警预报系统,并对以上警兆指标实行长年跟踪监测。2019年7—8月,在示范站点监测到海水温度、溶解氧、弧菌数量与丰度、糖原含量、MDA含量等指标出现警情。在此基础上,联合大连市气象局,综合分析了未来10天该地区的气候变化趋势,利用大连市气象局微信公众号,连续3次发布了浮筏养殖虾夷扇贝风险提醒,有效规避了扇贝大规模死亡的发生。
抑食金球藻Aureococcus anophagefferens是海金藻纲的一种微微型浮游植物,具有抑制贝类摄食的能力,是连续20余年在美国东海岸引发褐潮的主要原因藻种。2009年始中国渤海海域频繁爆发以抑食金球藻为主的褐潮,对海水贝类养殖造成巨大危害。本研究团队针对抑食金球藻研发了Taqman探针快速定量检测方法,开展了全国贝类养殖海区抑食金球藻普查工作,有效跟踪监测了贝类养殖海区抑食金球藻的变化情况。针对秦皇岛海域由抑食金球藻引发的褐潮爆发事件,本研究团队自2010年开始连续关注秦皇岛海域水色异常、扇贝滞长问题,以海水温度、抑食金球藻浓度及扇贝闭壳肌糖原含量等作为警兆指标,构建了预警系统,并根据连续监测情况,多次发布《关于秦皇岛海域出现抑食金球藻的情况通报》、《关于秦皇岛海域海湾扇贝滞长及死亡的预警通报》、《关于秦皇岛海域抑食金球藻藻华爆发的情况通报》等褐潮预警预报信息,提醒有关单位密切关注藻华动态,积极采取规避措施,避免对养殖业造成重大经济损失。
3 展望
近年来,中国在海水养殖贝类病害预警预报体系研究方面取得了重要进展,部分研究成果已经进入国际前沿水平,但在整体上同国际农业病害预警水平相比仍有一定差距。围绕2019年国家10部委印发的《关于加快推进水产养殖业绿色发展的若干意见》中提出的新理念,水产动物防疫工作面临新的形势和新的要求。
(1)在理论研究方面,海水养殖贝类病害预警预报体系未来将借鉴人类医学及动植物疫病防控理论,有效综合免疫学、水产养殖学、微生物学、生态学、海洋学等学科领域的最新研究成果,深入解析病原致病机理、贝类的免疫防御体系,以及海域生境变化与贝类病害发生的关系,进一步完善水产动物病害预警的理论体系。
(2)在技术研发方面,海水养殖贝类病害预警预报体系要充分利用现代生态学、生物学及信息学等技术平台,研发警兆指标的快速高通量检测及实时在线监测技术,提升预警预报技术的准确性、灵敏性和时效性。
(3)在管理体制方面,相关部门应紧紧围绕水产养殖绿色发展这一主线,健全水产动物病害防控法律法规体系,完善水产动物疫病防控行政管理机构、水产动物卫生监督机构、水产技术推广机构及技术支撑机构建设,依法推进综合防治技术措施的落实与实施,为水产养殖业绿色可持续发展保驾护航。
(4)在队伍建设方面,积极发挥水产养殖病害防治专家委员会的决策咨询和引领作用,加强水产动物医学高等教育体系建设,扩大渔业执业兽医和渔业乡村兽医等队伍,提升专业队伍的理论和技术水平。
加快推进产学研等跨部门、跨学科、跨领域的协作运行,构建一个“上下贯通、横向协调、运转高效、保障有力”的水产动物疫病防控体系,将为全面指导中国海水养殖业绿色可持续发展提供理论支撑和技术储备。
[1] 中华人民共和国国务院新闻办公室.中国的粮食安全[M].北京:人民出版社,2019.
[2] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2019中国水生动物卫生状况报告[M].北京:中国农业出版社有限公司,2019.
[3] 李明,赵春江,杨信廷,等.温室蔬菜病害预警体系初探——以黄瓜霜霉病为例[J].中国农学通报,2010,26(6):324-331.
[4] Apan A,Datt B,Kelly R.Detection of pests and diseases in vegetable crops using hyperspectral sensing:a comparison of reflectance data for different sets of symptoms[C]//Proceedings of 2005 Spatial Intelligence,Innovation and Praxis:The national biennial Conference of the Spatial Sciences Institute.Melbourne:Spatial Sciences Institute,2005:10-18.
[5] 李念祥,白鸿岩,郭瑞,等.松材线虫病远程监测预警系统[J].现代化农业,2017(10):10-11.
[6] Moh A A,Massart S,Jijakli M H,et al.Models to predict the combined effects of temperature and relative humidity on Pectobacterium atrosepticum and Pectobacterium carotovorum subsp.carotovorum population density and soft rot disease development at the surface of wounded potato tubers[J].Journal of Plant Pathology,2012,94(1):181-191.
[7] Rumpf T,Mahlein A K,Steiner U,et al.Early detection and classification of plant diseases with support vector machines based on hyperspectral reflectance[J].Computers and Electronics in Agriculture,2010,74(1):91-99.
[8] 马真.凡纳滨对虾集约化养殖水质预警模型的研究[D].青岛:中国海洋大学,2010.
[9] 刘文生,林齐鹏,孙亮亮,等.一种黄颡鱼养殖水体富营养化预警方法及其应用:中国,CN105454144A[P].2016-04-06.
[10] 徐云娟.基于BP神经网络和遗传算法的养殖水域预警模型[J].计算机科学,2017,44(6A):126-128.
[11] 冯继兴,许修明,吴雪,等.贝类筏式养殖产业发展的主要问题及对策[J].水产养殖,2016,37(3):30-32.
[12] 董波,相建海,杨鸣,等.海水养殖生物病害发生和抗病力的基础研究[J].中国基础科学,2003(6):19-24.
[13] 周晓苏,王印庚.我国海水养殖疾病防控策略[J].海洋与渔业,2008(5):17-18.
[14] 吴淑勤,王亚军.我国水产养殖病害控制技术现状与发展趋势[J].中国水产,2010(8):9-10.
[15] 李京梅,郭斌.我国海水养殖的生态预警评价指标体系与方法[J].海洋环境科学,2012,31(3):448-452.
[16] Xing Bin,Li Daoliang,Wang Jianqin,et al.An early warning system for flounder disease[C]//Proceedings of the 2nd International Conference on Computer and Computing Technologies in Agriculture.Beijing:Springer,2009:1011-1018.
[17] Trabal Fernández N,Mazón-Suástegui J M,Vázquez-Juárez R,et al.Changes in the composition and diversity of the bacterial microbiota associated with oysters (Crassostrea corteziensis,Crassostrea gigas and Crassostrea sikamea) during commercial production[J].FEMS Microbiology Ecology,2014,88(1):69-83.
[18] Beaz-Hidalgo R,Balboa S,Romalde J L,et al.Diversity and pathogenecity of Vibrio species in cultured bivalve molluscs[J].Environmental Microbiology Reports,2010,2(1):34-43.
[19] Paillard C,Le Roux F,Borrego J J.Bacterial disease in marine bivalves,a review of recent studies:trends and evolution[J].Aquatic Living Resources,2004,17(4):477-498.
[20] Soletchnik P,Le Moine O,Faury N,et al.Summer mortality of the oyster in the Bay Marennes-Oléron:spatial variability of environment and biology using a geographical information system (GIS)[J].Aquatic Living Resources,1999,12(2):131-143.
[21] Watermann B T,Herlyn M,Daehne B,et al.Pathology and mass mortality of Pacific oysters,Crassostrea gigas (Thunberg),in 2005 at the East Frisian coast,Germany[J].Journal of Fish Diseases,2008,31(8):621-630.
[22] 于佐安,李文姬,张明,等.虾夷扇贝大规模死亡的流行病学研究及可能致病因子的探讨[J].中国海洋大学学报,2013,43(6):52-57.
[23] Powell E N,Klinck J M,Hofmann E E.Modeling diseased oyster populations.II.Triggering mechanisms for Perkinsus marinus epizootics[J].Journal of Shellfish Research,1996,15(1):141-165.
[24] 蔡晓鹏.大黄鱼疾病诊断与预警系统初步构建[D].厦门:厦门大学,2013.
[25] 周瑞娟.网箱养殖大黄鱼主要疾病的预报模型研究[D].宁波:宁波大学,2011.
[26] Wang Lingling,Song Xiaorui,Song Linsheng.The oyster immunity[J].Developmental & Comparative Immunology,2018,80:99-118.
[27] Wang Weilin,Song Xiaorui,Wang Lingling,et al.Pathogen-derived carbohydrate recognition in molluscs immune defense[J].International Journal of Molecular Sciences,2018,19(3):721.
[28] Su Jianguo,Yu Xiaoqiang.Editorial:ligands,adaptors and pathways of TLRs in non-mammals[J].Frontiers in Immunology,2019,10:2439.
[29] Söderhäll K.Invertebrate Immunity[M].Boston,MA:Springer,2010.
[30] Wang Yunfeng,Li Caijuan,Pan Chenglong,et al.Alterations to transcriptomic profile,histopathology,and oxidative stress in liver of pikeperch (Sander lucioperca) under heat stress[J].Fish & Shellfish Immunology,2019,95:659-669.
[31] Sun Junlong,Zhao Liulan,Liao Lei,et al.Interactive effect of thermal and hypoxia on largemouth bass (Micropterus salmoides) gill and liver:aggravation of oxidative stress,inhibition of immunity and promotion of cell apoptosis[J].Fish & Shellfish Immunology,2019,doi:10.1016/j.fsi.2019.11.056.
[32] Rao Youliang,Wan Quanyuan,Su Hang,et al.ROS-induced HSP70 promotes cytoplasmic translocation of high-mobility group box 1b and stimulates antiviral autophagy in grass carp kidney cells[J].Journal of Biological Chemistry,2018,293(45):17387-17401.
[33] Zou Songsong,Wang Jing,Li Baoxia,et al.Thymosin participates in antimicrobial immunity in zebrafish[J].Fish & Shellfish Immunology,2019,87:371-378.
[34] Yang Qingyun,Wang Peng,Yang Shuaiqi,et al.A novel hepatic lectin of zebrafish Danio rerio is involved in innate immune defense[J].Fish & Shellfish Immunology,2019,doi:10.1016/j.fsi.2019.10.068.
[35] Duan Yafei,Zhang Jiasong,Wang Yun,et al.Nitrite stress disrupts the structural integrity and induces oxidative stress response in the intestines of Pacific white shrimp Litopenaeus vannamei[J].Journal of Experimental Zoology.Part A,Ecological and Integrative Physiology,2018,329(1):43-50.
[36] Li Tongyu,Li Erchao,Suo Yantong,et al.Energy metabolism and metabolomics response of Pacific white shrimp Litopenaeus vannamei to sulfide toxicity[J].Aquatic Toxicology,2017,183:28-37.
[37] Guo Hui,Li Kexu,Wang Wei,et al.Effects of copper on hemocyte apoptosis,ROS production,and gene expression in white shrimp Litopenaeus vannamei[J].Biological Trace Element Research,2017,179(2):318-326.
[38] Sun Jiejie,Lan Jiangfeng,Zhao Xiaofan,et al.Binding of a C-type lectin’s coiled-coil domain to the Domeless receptor directly activates the JAK/STAT pathway in the shrimp immune response to bacterial infection[J].PLoS Pathogens,2017,13(9):e1006626.
[39] Sun Jiejie,Xu Sen,He Zhonghua,et al.Activation of toll pathway is different between kuruma shrimp and Drosophila[J].Frontiers in Immunology,2017,8:1151.
[40] Sun Jiejie,Lan Jiangfeng,Shi Xiuzhen,et al.A fibrinogen-related protein (FREP) is involved in the antibacterial immunity of Marsupenaeus japonicus[J].Fish & Shellfish Immunology,2014,39(2):296-304.
[41] Liu Ning,Lan Jiangfeng,Sun Jiejie,et al.A novel crustin from Marsupenaeus japonicus promotes hemocyte phagocytosis[J].Developmental & Comparative Immunology,2015,49(2):313-322.
[42] Qu Chen,Yang Wen,Xu Qingsong,et al.A novel effector caspase (Caspase-3/7-1) involved in the regulation of immune homeostasis in Chinese mitten crab Eriocheir sinensis[J].Fish & Shellfish Immunology,2018,83:76-83.
[43] Xu Haisheng,Lyu Sunjian,Xu Jiehao,et al.Effect of lipopolysaccharide on the hemocyte apoptosis of Eriocheir sinensis[J].Journal of Zhejiang University-SCIENCE B,2015,16(12):971-979.
[44] Aleng N A,Sung Y Y,MacRae T H,et al.Non-lethal heat shock of the Asian green mussel,Perna viridis,promotes Hsp70 synthesis,induces thermotolerance and protects against vibrio infection[J].PLoS One,2015,10(8):e0135603.
[45] Luna-Acosta A,Breitwieser M,Renault T,et al.Recent findings on phenoloxidases in bivalves[J].Marine Pollution Bulletin,2017,122(1-2):5-16.
[46] Huse G,Ottersen G.Forecasting recruitment and stock biomass of northeast Arctic cod using neural networks[J].Scientia Marina,2003,67(S1):325-335.
[47] Silva A,Pinto L,Rodrigues S M,et al.A HAB warning system for shellfish harvesting in Portugal[J].Harmful Algae,2016,53:33-39.
[48] 周慧.河蟹养殖环境监测及预警模型研究[D].长沙:湖南农业大学,2014.
[49] Li Nan,Wang Ruimei,Zhang Jian,et al.Developing a knowledge-based early warning system for fish disease/health via water quality management[J].Expert Systems with Applications,2009,36(3):6500-6511.
[50] Liu Rui,Qiu Limei,Yu Zuoan,et al.Identification and characterisation of pathogenic Vibrio splendidus from Yesso scallop (Patinopecten yessoensis) cultured in a low temperature environment[J].Journal of Invertebrate Pathology,2013,114(2):144-150.
[51] Itoh N,Meyer G R,Tabata A,et al.Rediscovery of the Yesso scallop pathogen Perkinsus qugwadi in Canada,and development of PCR tests[J].Diseases of Aquatic Organisms,2013,104(1):83-91.
[52] Meyer G R,Lowe G J,Gilmore S R,et al.Disease and mortality among Yesso scallops Patinopecten yessoensis putatively caused by infection with Francisella halioticida[J].Diseases of Aquatic Organisms,2017,125(1):79-84.
[53] Bower S M,Blackbourn J,Meyer G R.Distribution,prevalence,and pathogenicity of the protozoan Perkinsus qugwadi in Japanese scallops,Patinopecten yessoensis,cultured in British Columbia,Canada[J].Canadian Journal of Zoology,1998,76(5):954-959.
[54] Bai Changming,Gao Wenhui,Wang Chongming,et al.Identification and characterization of Ostreid herpesvirus 1 associated with massive mortalities of Scapharca broughtonii broodstocks in China[J].Diseases of Aquatic Organisms,2016,118(1):65-75.
[55] Friedman C S,Estes R M,Stokes N A,et al.Herpes virus in juvenile Pacific oysters Crassostrea gigas from Tomales Bay,California,coincides with summer mortality episodes[J].Diseases of Aquatic Organisms,2005,63(1):33-41.
[56] EFSA Panel on Animal Health and Welfare.Scientific opinion on the increased mortality events in Pacific oysters,Crassostrea gigas[J].EFSA Journal,2010,8(11):1894.
[57] Gittenberger A,Voorbergen-Laarman M A,Engelsma M Y.Ostreid herpesvirus OsHV-1 μVar in Pacific oysters Crassostrea gigas (Thunberg 1793) of the Wadden Sea,a UNESCO world heritage site[J].Journal of Fish Diseases,2016,39(1):105-109.
[58] Ren Weicheng,Chen Haixia,Renault T,et al.Complete genome sequence of acute viral necrosis virus associated with massive mortality outbreaks in the Chinese scallop,Chlamys farreri[J].Virology Journal,2013,10:110.
[59] Bai Changming,Morga B,Rosani U,et al.Long-range PCR and high-throughput sequencing of Ostreid herpesvirus 1 indicate high genetic diversity and complex evolution process[J].Virology,2019,526:81-90.
[60] Burioli E A V,Prearo M,Houssin M.Complete genome sequence of Ostreid herpesvirus type 1 μVar isolated during mortality events in the Pacific oyster Crassostrea gigas in France and Ireland[J].Virology,2017,509:239-251.
[61] Xia Junyang,Bai Changming,Wang Chongming,et al.Complete genome sequence of Ostreid herpesvirus-1 associated with mortalities of Scapharca broughtonii broodstocks[J].Virology Journal,2015,12:110.
[62] Bai Changming,Rosani U,Xin Lusheng,et al.Dual transcriptomic analysis of Ostreid herpesvirus 1 infected Scapharca broughtonii with an emphasis on viral anti-apoptosis activities and host oxidative bursts[J].Fish & Shellfish Immunology,2018,82:554-564.
[63] Rosani U,Young T,Bai Changming,et al.Dual analysis of virus-host interactions:the case of Ostreid herpesvirus 1 and the cupped oyster Crassostrea gigas[J].Evolutionary Bioinformatics,2019,doi:10.1177/1176934319831305.
[64] 赵小金,张盛静,白昌明,等.牡蛎疱疹病毒魁蚶株交叉引物等温扩增检测方法的建立及初步应用[J].水产学报,2015,39(4):580-588.
[65] 高文辉,白昌明,蔡生力,等.基于牡蛎疱疹病毒DNA聚合酶基因的巢式PCR检测方法的建立及应用[J].水产学报,2016,40(3):326-333.
[66] 李亚楠,白昌明,刘金兰,等.牡蛎疱疹病毒(OsHV-1)间接原位杂交PCR检测方法的建立与初步应用[J].水产学报,2019,43(3):679-687.
[67] 滕炜鸣,李文姬,张明,等.虾夷扇贝脓胞病病原的分离、鉴定与致病性[J].水产学报,2012,36(6):937-943.
[68] Yu Zichao,Liu Chao,Fu Qiang,et al.The differences of bacterial communities in the tissues between healthy and diseased Yesso scallop (Patinopecten yessoensis)[J].AMB Express,2019,9(1):148.
[69] Binesse J,Delsert C,Saulnier D,et al.Metalloprotease vsm is the major determinant of toxicity for extracellular products of Vibrio splendidus[J].Applied and Environmental Microbiology,2008,74(23):7108-7117.
[70] Le Roux F,Binesse J,Saulnier D,et al.Construction of a Vibrio splendidus mutant lacking the metalloprotease gene vsm by use of a novel counter selectable suicide vector[J].Applied and Environmental Microbiology,2007,73(3):777-784.
[71] Liu Rui,Qiu Limei,Zhao Xin,et al.Variation analysis of pathogenic Vibrio spp. and Pseudomonas spp. in Changhai mollusc farming waters using real-time PCR assay during 2011-2014[J].Marine Biology Research,2016,12(2):146-157.
[72] Song Linsheng,Wang Lingling,Qiu Limei,et al.Bivalve immunity[M]//Söderhäll K.Invertebrate Immunity.Boston,MA:Springer,2010:44-65.
[73] Song Linsheng,Wang Lingling,Zhang Huan,et al.The immune system and its modulation mechanism in scallop[J].Fish & Shellfish Immunology,2015,46(1):65-78.
[74] Liu Zhaoqun,Li Meijia,Yi Qilin,et al.The neuroendocrine-immune regulation in response to environmental stress in marine bivalves[J].Frontiers in Physiology,2018,9:1456.
[75] Jiang Shuai,Jia Zhihao,Zhang Tao,et al.Functional characterisation of phagocytes in the Pacific oyster Crassostrea gigas[J].Peer J,2016,4:e2590.
[76] Wang Weilin,Li Meijia,Wang Lingling,et al.The granulocytes are the main immunocompetent hemocytes in Crassostrea gigas[J].Developmental & Comparative Immunology,2017,67:221-228.
[77] Jiang Shuai,Qiu Limei,Wang Lingling,et al.Transcriptomic and quantitative proteomic analyses provide insights into the phagocytic killing of hemocytes in the oyster Crassostrea gigas[J].Frontiers in Immunology,2018,9:1280.
[78] Wang Xiudan,Wang Mengqiang,Xu Jiachao,et al.Soluble adenylyl cyclase mediates mitochondrial pathway of apoptosis and ATP metabolism in oyster Crassostrea gigas exposed to elevated CO2[J].Fish & Shellfish Immunology,2017,66:140-147.
[79] Zhang Huan,Wang Hao,Chen Hao,et al.The transcriptional response of the Pacific oyster Crassostrea gigas under simultaneous bacterial and heat stresses[J].Developmental & Comparative Immunology,2019,94:1-10.
[80] Wang Xingqiang,Wang Lingling,Zhang Huan,et al.Immune response and energy metabolism of Chlamys farreri under Vibrio anguillarum challenge and high temperature exposure[J].Fish & Shellfish Immunology,2012,33(4):1016-1026.
[81] Wang Xingqiang,Wang Lingling,Yao Chen,et al.Alternation of immune parameters and cellular energy allocation of Chlamys farreri under ammonia-N exposure and Vibrio anguillarum challenge[J].Fish & Shellfish Immunology,2012,32(5):741-749.
[82] Lv Zhao,Song Xiaorui,Xu Jiachao,et al.The modulation of Smac/DIABLO on mitochondrial apoptosis induced by LPS in Crassostrea gigas[J].Fish & Shellfish Immunology,2019,84:587-598.
[83] Xin Lusheng,Zhang Huan,Du Xinyu,et al.The systematic regulation of oyster CgIL17-1 and CgIL17-5 in response to air exposure[J].Developmental & Comparative Immunology,2016,63:144-155.
[84] 于佐安,李文姬,王笑月,等.长海县筏养虾夷扇贝大规模死亡原因探讨[J].水产科学,2019,38(3):420-427.
[85] Xu Lingling,Wu Dexing,Lin Xiaopei,et al.The study of the yellow sea warm current and its seasonal variability[J].Journal of Hydrodynamics,Ser.B,2009,21(2):159-165.
[86] Yu Zichao,Liu Chao,Wang Feifei,et al.Diversity and annual variation of phytoplankton community in Yesso scallop (Patinopecten yessoensis) farming waters of North Yellow Sea of China[J].Aquaculture,2019,511:734266.