转化生长因子-β(Transforming growth factor β,TGF-β)是一类具有生物活性的多功能细胞因子,可以控制细胞增殖(Cell proliferation)、细胞分化(Cell differentiation)和细胞凋亡(Cell apoptosis)等多种细胞反应,在胞外基质合成(Extracellular matrix synthesis)、胚胎发育(Embryonic development)、器官形成(Organofaction)、骨骼再生(Bone regeneration)及机体免疫应答等生理生化过程中发挥重要作用[1-2]。自1983年首次发现TGF存在不同亚型以来[3],TGF-β超家族(表1)的40多个成员被陆续发现,根据其结构、功能及受体的不同,将这些成员进一步分为4个亚家族: (1)转化生长因子-β亚家族(TGF-β); (2)DVR(Decapentaplegic/vg-1-related)亚家族,包括骨形态发生蛋白(Bone morphogenetic protein,BMP)和生长分化因子(Growth differentiation factor,GDF); (3)激活素/抑制素(Activin/Inhibin)亚家族; (4)其他,包括胚胎形态发生素(Nodal)、抗米勒管激素(Anti-Mullerian hormone,AMH)和穆勒氏抑制物(Mullerian inhibitory substance,MIS)等[4]。
结构生物学研究显示,已知生物TGF-β超家族成员在其C末端的成熟区(Mature domain)均具有一个高度保守的半胱氨酸残基结构域(7或9个保守的半胱氨酸残基),其中的6或8个半胱氨酸通过3或4个单体内二硫键形成典型的半胱氨酸节(Cysteine knot)结构[5]。TGF-β超家族成员通过配体-受体-胞内信号转导途径发挥作用,即配体先与细胞膜表面的Ⅱ型受体结合,Ⅱ型受体随之发生自动磷酸化,形成一个磷酸化的四聚体;随后,磷酸化的Ⅱ型受体与Ⅰ型受体结合,Ⅰ型受体被磷酸化,形成一个磷酸化的异源六聚体;活化的Ⅰ型受体继续磷酸化细胞内的下游信号转导分子,进而启动细胞内的信号转导途径[6]。一般认为,TGF-β超家族成员胞内的信号传导途径主要分为Smads(Drosophila mothers against deca-pentaplegic,Smad)蛋白依赖型和非Smads蛋白依赖型。Smads蛋白依赖型是TGF-β信号传导的主要方式,Smads蛋白为TGF-β的细胞质内信号转导分子,可以将信号直接转导至细胞核内,调控靶基因的表达[7-8]。非Smads蛋白依赖型是指在缺乏Smads蛋白的情况下,依赖丝裂原活化蛋白激酶(Mitogen activation protein kinase,MAPK)、RAS蛋白(Rat sarcoma,Ras)、磷脂酰肌醇3-激酶(Phosphoinositide 3-kinase,PI3Ks)等信号转导通路进行信号转导[9]。
表1 TGF-β超家族成员及其受体
Tab.1 Members and receptors in TGF-β superfamily
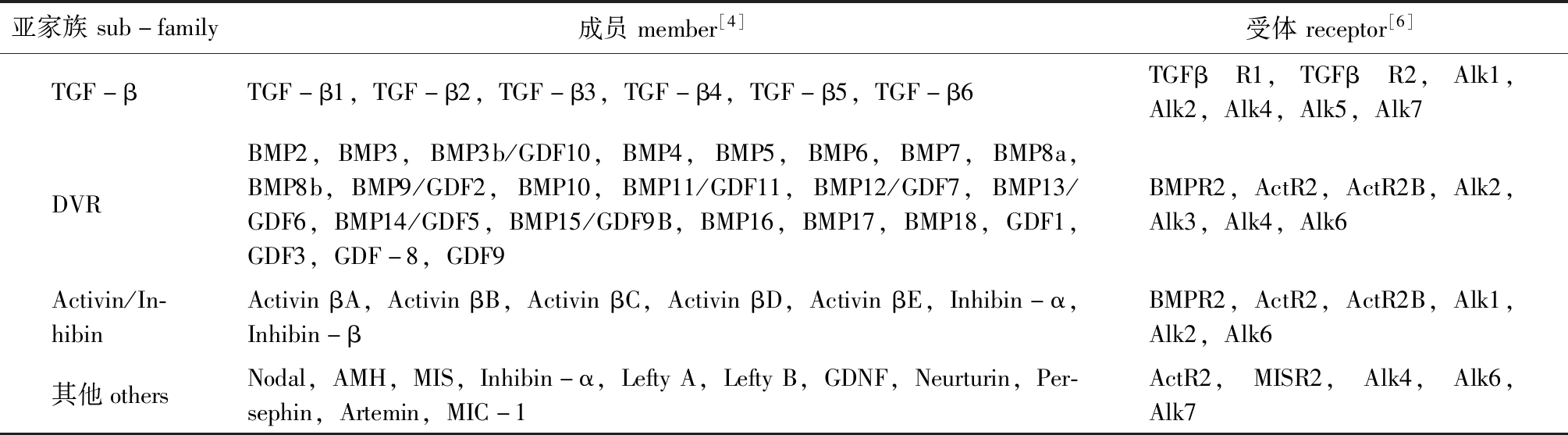
亚家族sub-family成员member[4]受体receptor[6]TGF-βTGF-β1,TGF-β2,TGF-β3,TGF-β4,TGF-β5,TGF-β6TGFβR1,TGFβR2,Alk1,Alk2,Alk4,Alk5,Alk7DVRBMP2,BMP3,BMP3b/GDF10,BMP4,BMP5,BMP6,BMP7,BMP8a,BMP8b,BMP9/GDF2,BMP10,BMP11/GDF11,BMP12/GDF7,BMP13/GDF6,BMP14/GDF5,BMP15/GDF9B,BMP16,BMP17,BMP18,GDF1,GDF3,GDF-8,GDF9BMPR2,ActR2,ActR2B,Alk2,Alk3,Alk4,Alk6Activin/In-hibinActivinβA,ActivinβB,ActivinβC,ActivinβD,ActivinβE,Inhibin-α,Inhibin-βBMPR2,ActR2,ActR2B,Alk1,Alk2,Alk6其他othersNodal,AMH,MIS,Inhibin-α,LeftyA,LeftyB,GDNF,Neurturin,Per-sephin,Artemin,MIC-1ActR2,MISR2,Alk4,Alk6,Alk7
注:GDNF为神经胶质源神经营养因子;MIC-1为巨噬细胞抑制因子-1;Alk为活化素受体样激酶
Note: GDNF, neurotrophic factor derived from glia; MIC-1, macrophage inhibitory cytokine-1;Alk,activin receptor-like kinase
水产动物TGF-β超家族的研究最早可以追溯到20世纪90年代,截至2018年12月,在美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI,https://www.ncbi.nlm. nih.gov/)数据库中登录的TGF-β超家族基因序列信息多达7911条,包括哺乳动物3318条、硬骨鱼1681条、贝类68条、棘皮动物26条、其他物种2818条。相较于哺乳动物,水产动物TGF-β超家族基因的研究仍相对落后。本研究中,就水产动物TGF-β超家族基因的系统进化及生物学功能研究进展进行综述,旨在丰富水产动物TGF-β超家族基因的研究数据,为深入了解水产动物TGF-β超家族成员的生物学功能提供参考。
1 水产动物TGF-β亚家族
1.1 主要种类及系统进化分析
目前,在水产动物中发现的TGF-β亚家族成员有TGF-β1、TGF-β2、TGF-β3和TGF-β6四种亚型,主要集中在鱼类、半索动物、棘皮动物、软体动物、腔肠动物和多孔动物中(表2)。通过对各物种的不同TGF-β亚型氨基酸序列进行系统进化分析(图1)发现:哺乳类和鱼类的TGF-β各亚型自然地分别聚为一个大支,提示鱼类的TGF-β与哺乳动物的亲缘关系比较密切,各物种的TGF-β1亚型单独聚为一个小支,而TGF-β2和TGF-β3聚为一个小支,提示脊索动物的TGF-β2和TGF-β3的遗传距离较近,而TGF-β2和TGF-β3与TGF-β1的遗传距离较远;较特殊的金鲷Sparus aurata TGF-β6,与哺乳类和鱼类的TGF-β2和TGF-β3亚型聚为最近的一支,而与TGF-β1则呈现出较大进化距离,提示鱼类中的TGF-β6亚型可能由TGF-β2或TGF-β3亚型进一步进化而来;非脊索动物各TGF-β亚型单独聚为一支,与脊索动物的TGF-β1、TGF-β2和TGF-β3遗传距离较远,提示非脊索动物和脊索动物的TGF-β同源序列的形成在系统进化过程中存在较大分离。本研究中用于构建TGF-β超家族系统进化树的氨基酸序列信息见表3。
表2 NCBI数据库中常见水产动物TGF-β超家族成员氨基酸序列统计(截至2018年12月)
Tab.2 Statistics on the amino acid sequence of TGF-β superfamily members of common aquatic animals in NCBI database (by December 2018)
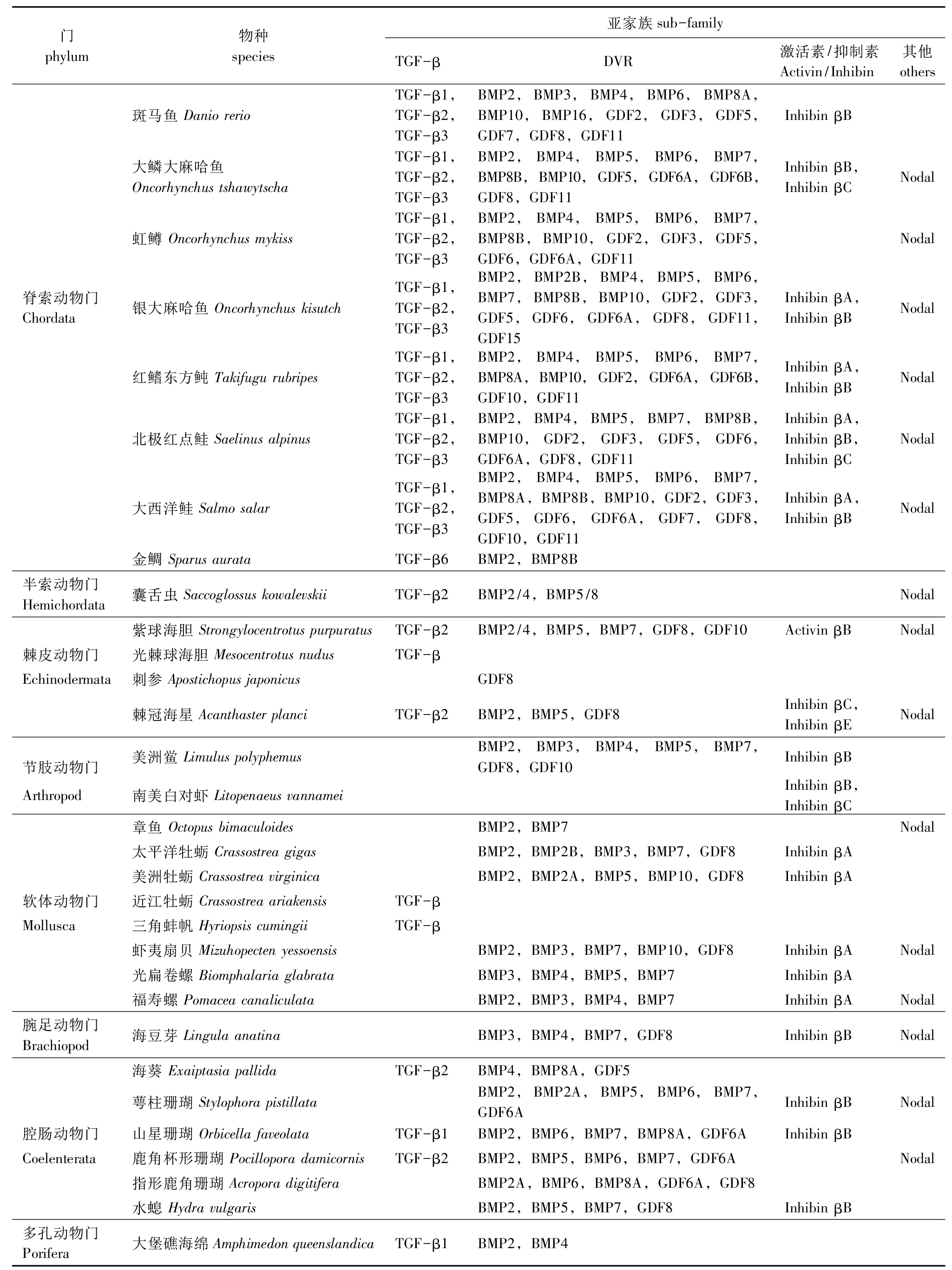
门phylum物种species亚家族sub-familyTGF-βDVR激活素/抑制素Activin/Inhibin其他others斑马鱼DaniorerioTGF-β1,TGF-β2,TGF-β3BMP2,BMP3,BMP4,BMP6,BMP8A,BMP10,BMP16,GDF2,GDF3,GDF5,GDF7,GDF8,GDF11InhibinβB大鳞大麻哈鱼OncorhynchustshawytschaTGF-β1,TGF-β2,TGF-β3BMP2,BMP4,BMP5,BMP6,BMP7,BMP8B,BMP10,GDF5,GDF6A,GDF6B,GDF8,GDF11InhibinβB,InhibinβCNodal虹鳟OncorhynchusmykissTGF-β1,TGF-β2,TGF-β3BMP2,BMP4,BMP5,BMP6,BMP7,BMP8B,BMP10,GDF2,GDF3,GDF5,GDF6,GDF6A,GDF11Nodal脊索动物门Chordata银大麻哈鱼OncorhynchuskisutchTGF-β1,TGF-β2,TGF-β3BMP2,BMP2B,BMP4,BMP5,BMP6,BMP7,BMP8B,BMP10,GDF2,GDF3,GDF5,GDF6,GDF6A,GDF8,GDF11,GDF15InhibinβA,InhibinβBNodal红鳍东方鲀TakifugurubripesTGF-β1,TGF-β2,TGF-β3BMP2,BMP4,BMP5,BMP6,BMP7,BMP8A,BMP10,GDF2,GDF6A,GDF6B,GDF10,GDF11InhibinβA,InhibinβBNodal北极红点鲑SaelinusalpinusTGF-β1,TGF-β2,TGF-β3BMP2,BMP4,BMP5,BMP7,BMP8B,BMP10,GDF2,GDF3,GDF5,GDF6,GDF6A,GDF8,GDF11InhibinβA,InhibinβB,InhibinβCNodal大西洋鲑SalmosalarTGF-β1,TGF-β2,TGF-β3BMP2,BMP4,BMP5,BMP6,BMP7,BMP8A,BMP8B,BMP10,GDF2,GDF3,GDF5,GDF6,GDF6A,GDF7,GDF8,GDF10,GDF11InhibinβA,InhibinβBNodal金鲷SparusaurataTGF-β6BMP2,BMP8B半索动物门Hemichordata囊舌虫SaccoglossuskowalevskiiTGF-β2BMP2/4,BMP5/8Nodal紫球海胆StrongylocentrotuspurpuratusTGF-β2BMP2/4,BMP5,BMP7,GDF8,GDF10ActivinβBNodal棘皮动物门光棘球海胆MesocentrotusnudusTGF-βEchinodermata刺参ApostichopusjaponicusGDF8棘冠海星AcanthasterplanciTGF-β2BMP2,BMP5,GDF8InhibinβC,InhibinβENodal节肢动物门美洲鲎LimuluspolyphemusBMP2,BMP3,BMP4,BMP5,BMP7,GDF8,GDF10InhibinβBArthropod南美白对虾LitopenaeusvannameiInhibinβB,InhibinβC章鱼OctopusbimaculoidesBMP2,BMP7Nodal太平洋牡蛎CrassostreagigasBMP2,BMP2B,BMP3,BMP7,GDF8InhibinβA美洲牡蛎CrassostreavirginicaBMP2,BMP2A,BMP5,BMP10,GDF8InhibinβA软体动物门近江牡蛎CrassostreaariakensisTGF-βMollusca三角蚌帆HyriopsiscumingiiTGF-β虾夷扇贝MizuhopectenyessoensisBMP2,BMP3,BMP7,BMP10,GDF8InhibinβANodal光扁卷螺BiomphalariaglabrataBMP3,BMP4,BMP5,BMP7InhibinβA福寿螺PomaceacanaliculataBMP2,BMP3,BMP4,BMP7InhibinβANodal腕足动物门Brachiopod海豆芽LingulaanatinaBMP3,BMP4,BMP7,GDF8InhibinβBNodal海葵ExaiptasiapallidaTGF-β2BMP4,BMP8A,GDF5萼柱珊瑚StylophorapistillataBMP2,BMP2A,BMP5,BMP6,BMP7,GDF6AInhibinβBNodal腔肠动物门山星珊瑚OrbicellafaveolataTGF-β1BMP2,BMP6,BMP7,BMP8A,GDF6AInhibinβBCoelenterata鹿角杯形珊瑚PocilloporadamicornisTGF-β2BMP2,BMP5,BMP6,BMP7,GDF6ANodal指形鹿角珊瑚AcroporadigitiferaBMP2A,BMP6,BMP8A,GDF6A,GDF8水螅HydravulgarisBMP2,BMP5,BMP7,GDF8InhibinβB多孔动物门Porifera大堡礁海绵AmphimedonqueenslandicaTGF-β1BMP2,BMP4
表3 用于构建系统进化树的氨基酸序列信息
Tab.3 Amino acid sequence information for constructing phylogenetic tree
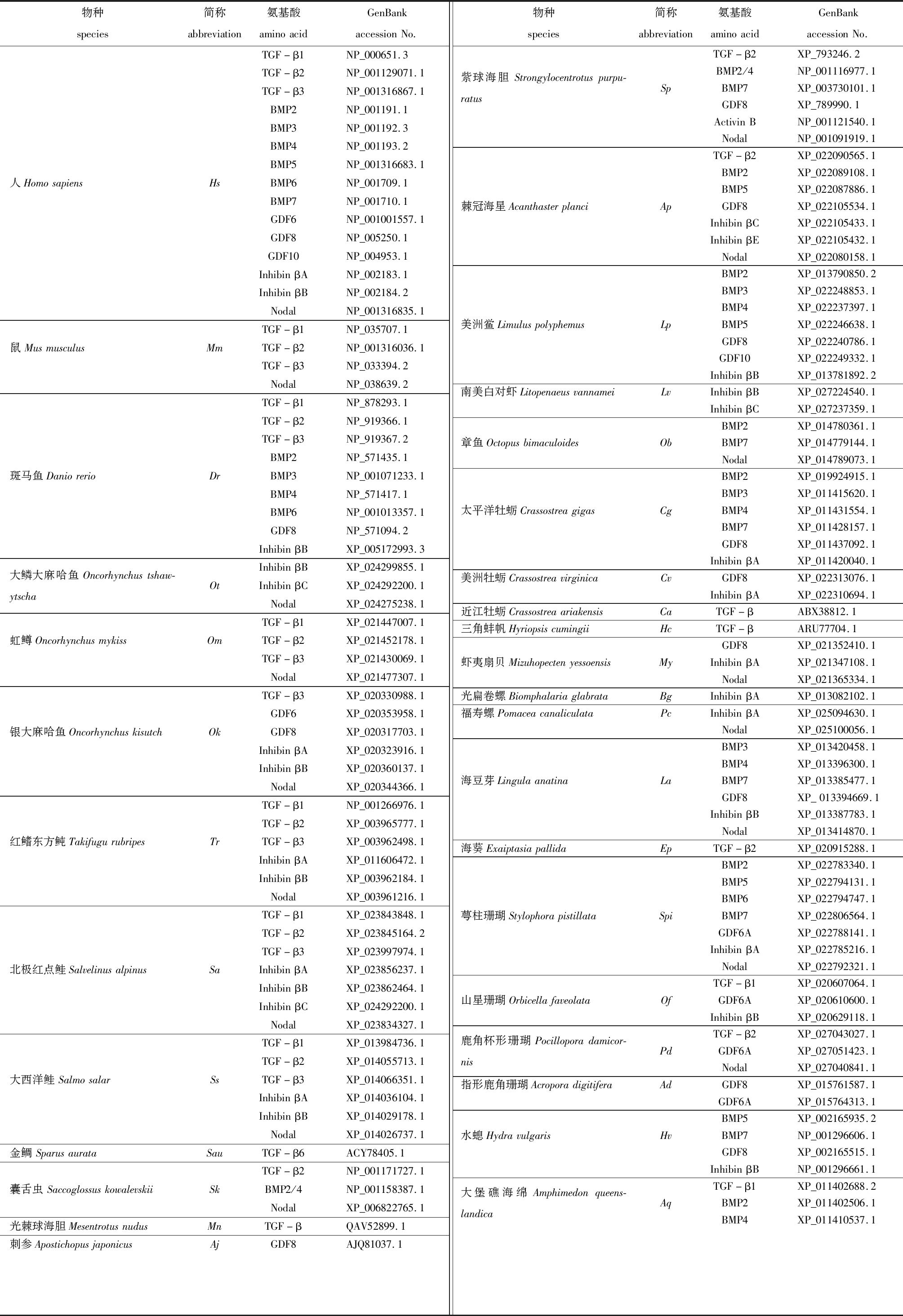
物种species简称abbreviation氨基酸aminoacidGenBankaccessionNo.TGF-β1NP_000651.3TGF-β2NP_001129071.1TGF-β3NP_001316867.1BMP2NP_001191.1BMP3NP_001192.3BMP4NP_001193.2BMP5NP_001316683.1人HomosapiensHsBMP6NP_001709.1BMP7NP_001710.1GDF6NP_001001557.1GDF8NP_005250.1GDF10NP_004953.1InhibinβANP_002183.1InhibinβBNP_002184.2NodalNP_001316835.1TGF-β1NP_035707.1鼠MusmusculusMmTGF-β2NP_001316036.1TGF-β3NP_033394.2NodalNP_038639.2TGF-β1NP_878293.1TGF-β2NP_919366.1TGF-β3NP_919367.2BMP2NP_571435.1斑马鱼DaniorerioDrBMP3NP_001071233.1BMP4NP_571417.1BMP6NP_001013357.1GDF8NP_571094.2InhibinβBXP_005172993.3InhibinβBXP_024299855.1大鳞大麻哈鱼Oncorhynchustshaw-ytschaOtInhibinβCXP_024292200.1NodalXP_024275238.1TGF-β1XP_021447007.1虹鳟OncorhynchusmykissOmTGF-β2XP_021452178.1TGF-β3XP_021430069.1NodalXP_021477307.1TGF-β3XP_020330988.1GDF6XP_020353958.1银大麻哈鱼OncorhynchuskisutchOkGDF8XP_020317703.1InhibinβAXP_020323916.1InhibinβBXP_020360137.1NodalXP_020344366.1TGF-β1NP_001266976.1TGF-β2XP_003965777.1红鳍东方鲀TakifugurubripesTrTGF-β3XP_003962498.1InhibinβAXP_011606472.1InhibinβBXP_003962184.1NodalXP_003961216.1TGF-β1XP_023843848.1TGF-β2XP_023845164.2TGF-β3XP_023997974.1北极红点鲑SalvelinusalpinusSaInhibinβAXP_023856237.1InhibinβBXP_023862464.1InhibinβCXP_024292200.1NodalXP_023834327.1TGF-β1XP_013984736.1TGF-β2XP_014055713.1大西洋鲑SalmosalarSsTGF-β3XP_014066351.1InhibinβAXP_014036104.1InhibinβBXP_014029178.1NodalXP_014026737.1金鲷SparusaurataSauTGF-β6ACY78405.1TGF-β2NP_001171727.1囊舌虫SaccoglossuskowalevskiiSkBMP2/4NP_001158387.1NodalXP_006822765.1光棘球海胆MesentrotusnudusMnTGF-βQAV52899.1刺参ApostichopusjaponicusAjGDF8AJQ81037.1物种species简称abbreviation氨基酸aminoacidGenBankaccessionNo.TGF-β2XP_793246.2BMP2/4NP_001116977.1紫球海胆Strongylocentrotuspurpu-ratusSpBMP7XP_003730101.1GDF8XP_789990.1ActivinBNP_001121540.1NodalNP_001091919.1TGF-β2XP_022090565.1BMP2XP_022089108.1BMP5XP_022087886.1棘冠海星AcanthasterplanciApGDF8XP_022105534.1InhibinβCXP_022105433.1InhibinβEXP_022105432.1NodalXP_022080158.1BMP2XP_013790850.2BMP3XP_022248853.1BMP4XP_022237397.1美洲鲎LimuluspolyphemusLpBMP5XP_022246638.1GDF8XP_022240786.1GDF10XP_022249332.1InhibinβBXP_013781892.2南美白对虾LitopenaeusvannameiLvInhibinβBXP_027224540.1InhibinβCXP_027237359.1BMP2XP_014780361.1章鱼OctopusbimaculoidesObBMP7XP_014779144.1NodalXP_014789073.1BMP2XP_019924915.1BMP3XP_011415620.1太平洋牡蛎CrassostreagigasCgBMP4XP_011431554.1BMP7XP_011428157.1GDF8XP_011437092.1InhibinβAXP_011420040.1美洲牡蛎CrassostreavirginicaCvGDF8XP_022313076.1InhibinβAXP_022310694.1近江牡蛎CrassostreaariakensisCaTGF-βABX38812.1三角蚌帆HyriopsiscumingiiHcTGF-βARU77704.1GDF8XP_021352410.1虾夷扇贝MizuhopectenyessoensisMyInhibinβAXP_021347108.1NodalXP_021365334.1光扁卷螺BiomphalariaglabrataBgInhibinβAXP_013082102.1福寿螺PomaceacanaliculataPcInhibinβAXP_025094630.1NodalXP_025100056.1BMP3XP_013420458.1BMP4XP_013396300.1海豆芽LingulaanatinaLaBMP7XP_013385477.1GDF8XP_013394669.1InhibinβBXP_013387783.1NodalXP_013414870.1海葵ExaiptasiapallidaEpTGF-β2XP_020915288.1BMP2XP_022783340.1BMP5XP_022794131.1BMP6XP_022794747.1萼柱珊瑚StylophorapistillataSpiBMP7XP_022806564.1GDF6AXP_022788141.1InhibinβAXP_022785216.1NodalXP_022792321.1TGF-β1XP_020607064.1山星珊瑚OrbicellafaveolataOfGDF6AXP_020610600.1InhibinβBXP_020629118.1TGF-β2XP_027043027.1鹿角杯形珊瑚Pocilloporadamicor-nisPdGDF6AXP_027051423.1NodalXP_027040841.1指形鹿角珊瑚AcroporadigitiferaAdGDF8XP_015761587.1GDF6AXP_015764313.1BMP5XP_002165935.2水螅HydravulgarisHvBMP7NP_001296606.1GDF8XP_002165515.1InhibinβBNP_001296661.1TGF-β1XP_011402688.2大堡礁海绵Amphimedonqueens-landicaAqBMP2XP_011402506.1BMP4XP_011410537.1
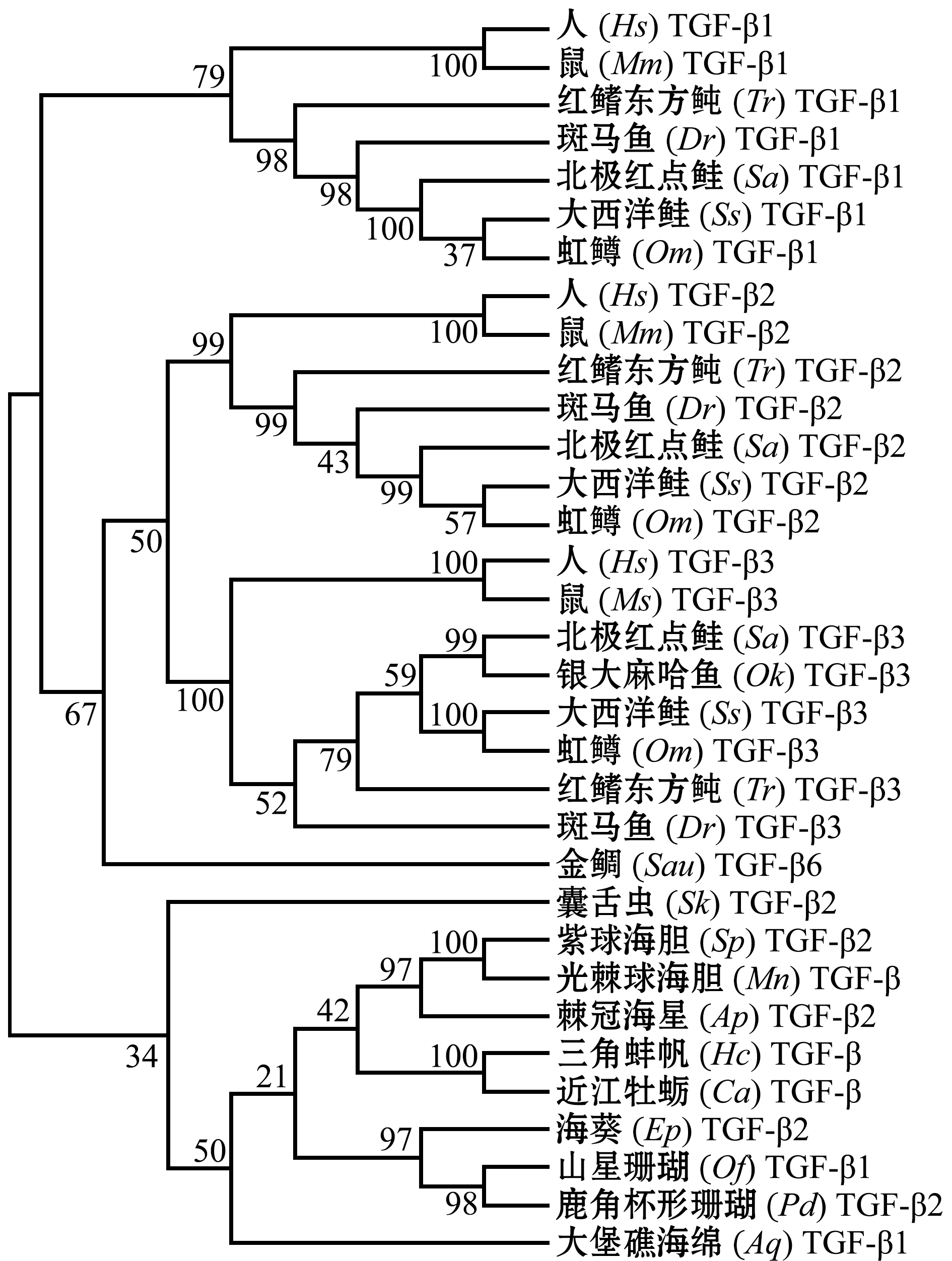
注:利用MEGA 7.0构建系统进化树,树节点上的数字表示1000次重复之后的百分比;括号内的字母为物种拉丁名简称;物种拉丁名全称及氨基酸序列登录号等详细信息见表3;下同
Note:The numbers at the tree nodes indicate the percentage of bootstrapping after 1000 replicates; the letters in brackets are abbreviation of Latin name for species; Details of the Latin name for species and the GenBank accession number of each amino acid sequence are found in the Tab.3, et sequentia
图1 哺乳动物和17种水产动物TGF-β亚家族成员的系统进化分析
Fig.1 NJ phylogenetic analysis of TGF-β sub-family members in mammals and seventeen species of aquatic animals based on the amino acid sequences
1.2 生物学功能
在哺乳动物中,TGF-β是多种组织纤维化过程中最主要的细胞因子[10-13],其可通过p38α/β、Smad、蛋白激酶C(Protein kinase C,PKC)和丝裂原活化蛋白激酶 MAPK等多种信号通路引起组织器官的纤维化,从而影响机体的正常功能[14-15]。
相较于哺乳动物,关于水产动物TGF-β亚型生物学功能的研究较少,多集中于对TGF-β1亚型的初步研究。现已证实,TGF-β1在调控水产动物生殖生理、生长发育和免疫防御等方面发挥重要作用。关于TGF-β1调控水产动物生殖发育的研究多集中在鱼类。TGF-β1可显著抑制斑马鱼Danio rerio卵母细胞的成熟,且TGF-β1相对表达量显著降低可使斑马鱼胚胎发育滞后[16-17]。在调控水产动物免疫防御方面,大量研究显示,当鱼类[18-19]、贝类[20]、棘皮类[21-22]和海鞘类[23]等受到病毒、致病菌或免疫刺激剂攻击或是环境胁迫时,其体内的TGF-β1的表达水平均呈现显著上升趋势,提示水产动物的TGF-β1可能作为细胞因子参与水产动物的免疫防御过程。有趣的是,在体外培养草鱼Ctenopharyngodon idellus外周血白细胞和头肾白细胞的培养基中分别加入草鱼TGF-β1重组蛋白,结果显示,草鱼外周血白细胞的活力和促炎症因子(TNF-α和IFN-γ)与T、B细胞标签[Cd4-like(Cd4l)、Cd8α、Cd8β和Igμ]的产生会随TGF-β1重组蛋白注入时间的增加而增加,而草鱼头肾白细胞的活力及促炎症因子和T、B细胞标签的表达水平则呈现出相反的趋势,这一结果提示,在硬骨鱼的免疫调节中TGF-β1的功能具有组织特异性[24]。
目前,关于水产动物TGF-β2、TGF-β3和TGF-β6这3种亚型的生物学功能研究较少,其中,TGF-β2和TGF-β3两种亚型可调节虹鳟Oncorhynchus mykiss的肌肉生长和细胞分化过程[25];TGF-β2还被证实为草鱼中的一种抗炎症细胞因子[26];鱼类中特有的TGF-β6亚型可通过营养水平调节金鲷骨骼肌的生长[27]。值得注意的是,关于脊索动物中存在TGF-β6的研究目前尚未见报道,提示TGF-β6可能是进化过程中在水产动物类群中形成的特异性TGF-β直系同源序列。
2 水产动物DVR亚家族
2.1 主要种类及系统进化分析
DVR(Decapentaplegic/vg-1-related)亚家族是TGF-β超家族中最大的蛋白家族,主要包括骨形态发生蛋白(除BMP1外)和生长分化因子(Growth differentiation factor,GDF)两种蛋白[28]。水产动物DVR蛋白多达20种亚型,广泛分布在鱼类、半索动物、棘皮动物、节肢动物、软体动物、腕足动物、腔肠动物和多孔动物中,其中存在较为普遍的亚型有BMP2、BMP3、BMP4、BMP5、BMP7、GDF6、GDF8和GDF10(表2)。对哺乳动物和11种水产动物的BMP亚型进行系统进化分析(图2)发现:所有动物(除大堡礁海绵Amphimedon queenslandica外)的BMP2和BMP4亚型聚为一支,表明BMP2和BMP4亚型的蛋白序列较相近,且具有相似的生物学功能;所有动物的BMP3亚型聚为一支,提示脊索动物和无脊索动物的BMP3亚型的蛋白序列相似性较高,在进化过程中相对保守。

图2 哺乳动物和11种水产动物BMP亚型的系统进化分析
Fig.2 NJ phylogenetic analysis of BMP subtypes in the mammals and eleven species of aquatic animals based on the amino acid sequences
对哺乳动物和15种水产动物的GDF亚型进行系统进化分析(图3)发现:人Homo sapiens和银大麻哈鱼Oncorhynchus kisutch的GDF6亚型与腔肠动物的GDF6A亚型聚为一支,提示哺乳类和鱼类的GDF6亚型可能是由腔肠动物的GDF6A亚型进一步进化而来;所有动物的GDF8亚型聚为最近的一支,提示GDF8亚型在进化中相对保守;此外,人和与美洲鲎Limulus polyphemus的GDF10亚型亲缘关系较近,提示哺乳动物的GDF10可能是由节肢动物进化而来。
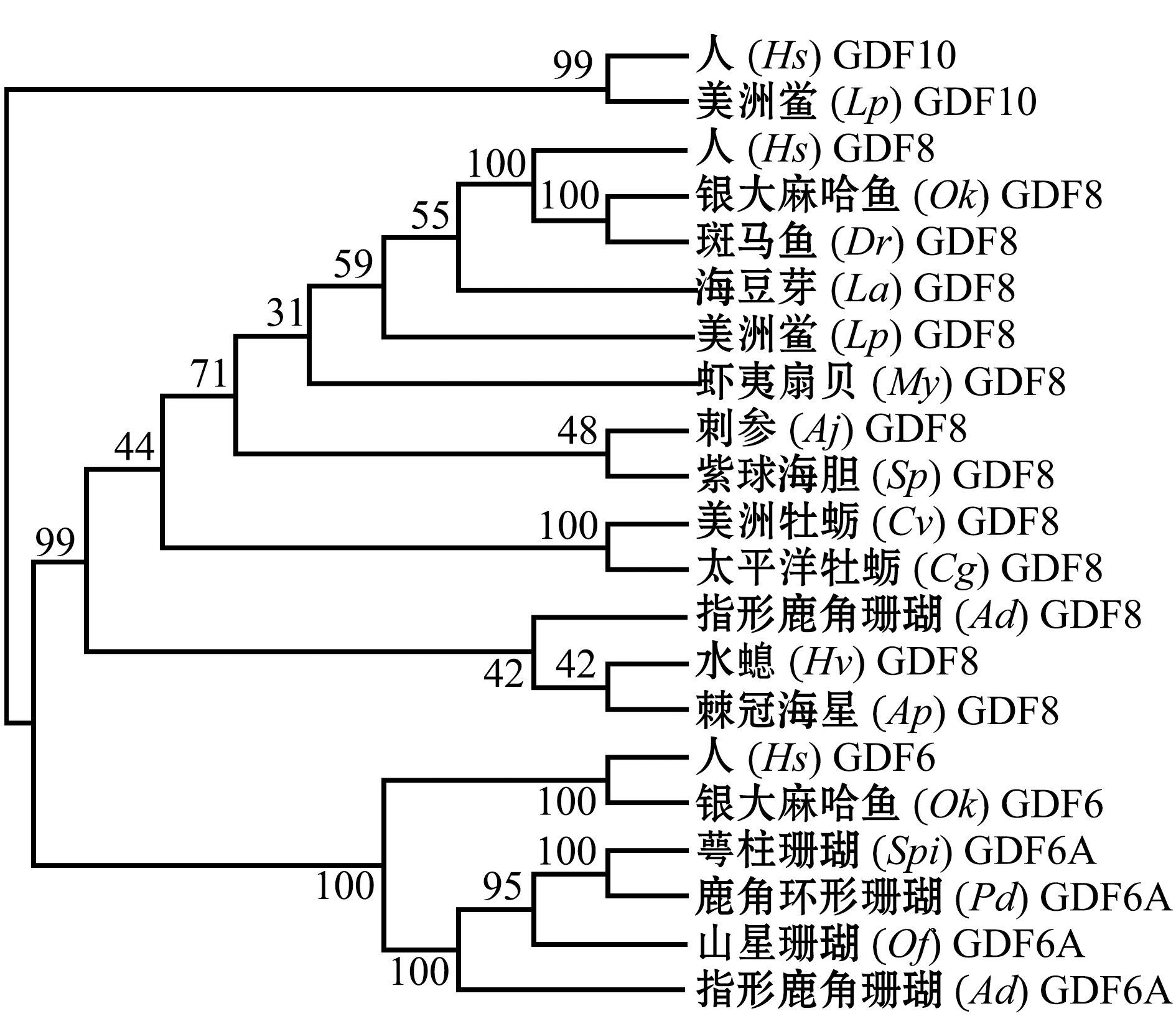
图3 哺乳动物和15种水产动物GDF亚型的系统进化分析
Fig.3 NJ phylogenetic analysis of GDF subtypes in the mammals and fifteen species of aquatic animals based on the amino acid sequences
2.2 生物学功能
DVR亚家族中的BMP在哺乳动物骨形成发育过程中具有广泛的作用[29-30]。在骨细胞分化和骨形成的过程中,BMP信号通路与MAPK、Wnt(Wingless/Integrated)、Hedgehog、Notch和成纤维细胞生长因子(Fibroblast growth factor,FGF)等多种信号传导通路存在交叉互作,通过不同的模式对骨形成过程进行调节[31-32]。
在水产动物方面,大多DVR亚家族成员已被证实具有诱导骨组织形成的活性,其在生物钙化(Biocalcification)、组织修复(Tissue reconstruction)与再生(Regeneration)和生殖调控(Procreation regulation)等方面也发挥重要作用。在骨骼形成和生物钙化方面,鱼类中的BMP2和BMP4在脊索和鱼鳍等生物矿化较为活跃的组织中呈现相对高表达状态[33-34]。BMP2、BMP3、BMP7、BMP7b和BMP10在贝类贝壳的钙化生长、形成及损伤修复等方面均发挥重要的作用[35-38]。在调控生殖发育方面,BMP7、BMP15和GDF9可能参与调控鱼类[39-40]和甲壳类[41]的卵巢发育。最近的研究结果表明,虹鳟中BMP4的相对表达量在其卵黄发育前期达到高峰,并随着卵巢的成熟而呈逐渐下降趋势,推测BMP4编码产物参与了虹鳟的卵黄发生过程[42],但其具体机制尚不明确。GDF8在棘皮类动物刺参Apostichopus japonicus的早期发育过程中发挥重要的作用,并可能作为刺参分子辅助育种的候选基因[43]。此外,棘皮类动物的组织再生机制一直是水产生物学基础研究的热点领域。BMP的同源基因Afuni不仅在海蛇尾Amphiura filiformis再生腕中的相对表达量显著高于正常腕,还在其神经索和体腔上皮部位大量表达[44],这一结果提示,骨形态发生蛋白基因的同源基因Afuni可能参与调节海蛇尾的腕再生过程,但就其具体的调控机制仍需进一步研究。另外,BMP可与miRNA相互作用以此促进斑马鱼的心脏发育[45]。
3 水产动物激活素/抑制素亚家族
3.1 主要种类及系统进化分析
激活素和抑制素均为两种亚基组成的异二聚体糖蛋白,由于激活素和抑制素的蛋白二聚体具有相同的β亚基,因此,将激活素和抑制素划分为同一亚家族。目前,水产动物中存在的激活素亚型主要有Activin βB,抑制素亚型主要有Inhibin βA、Inhibin βB、Inhibin βC和Inhibin βE 4种亚型,主要存在于鱼类、棘皮动物、节肢动物、软体动物、腕足动物和腔肠动物中(表2)。通过对人和19种水产动物的激活素和抑制素的氨基酸序列进行系统进化分析(图4)发现:人与鱼类的Inhibin βA和Inhibin βB各聚为一支,且Inhibin βA和Inhibin βB亚型聚为一个大支,提示鱼类的Inhibin βA和Inhibin βB亚型可能是由同一祖先基因复制进化而来;大鳞大麻哈鱼Oncorhynchus tshawytscha、北极红点鲑Salvelinus alpinus和南美白对虾Litopenaeus vannamei的Inhibin βC亚型聚为最近的一支,且与软体动物的Inhibin βA亚型聚为最近的一类,这一结果提示,鱼类和节肢动物中的Inhibin βC亚型可能是由软体动物的Inhibin βA亚型进化而来。
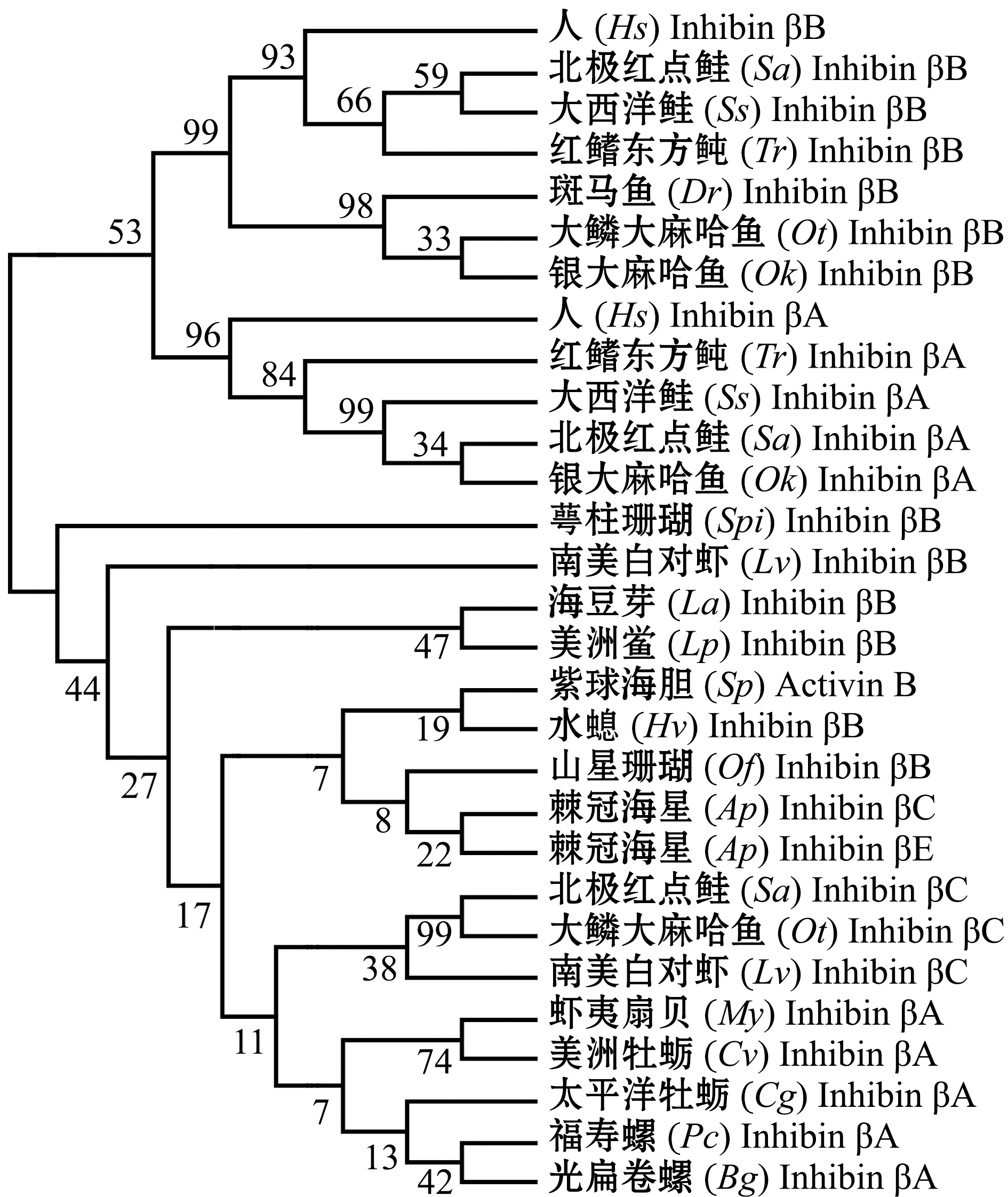
图4 哺乳动物和19种水产动物激活素/抑制素亚家族成员的系统进化分析
Fig.4 NJ phylogenetic analysis of Activin/Inhibin sub-family members in the mammals and ninteen species of aquatic animals based on the amino acid sequences
3.2 生物学功能
激活素和抑制素是一种重要的多功能生长分化因子。在哺乳动物中,激活素和抑制素是性腺糖蛋白激素,具有调节性腺发育功能。但最近的研究结果显示,激活素/抑制素也可在脑区和中枢神经中表达,提示两者可能在多个系统中发挥细胞间和细胞内功能,且激活素具有抑制多发性骨髓瘤细胞生长的作用,但其机制尚不明确[46-47]。
在水产动物方面,激活素和抑制素广泛存在于多种鱼类中,通过多种途径调控鱼类卵巢发育过程。激活素可以促进生发泡破裂(Germinal vesicle break down,GVBD),从而加快底舩Fundulus heteroclitus卵母细胞的发育;而抑制素则抑制卵母细胞成熟,与激活素具有相反的作用[48]。此外,激活素还可以通过调节垂体分泌促性腺激素(Gonadotropins,Gn)及mPRα、mPRβ两种膜黄体酮受体(Membrane progestin receptors,mPR)蛋白的表达,进而调控鱼类卵巢发育成熟[49-50]。
4 水产动物TGF-β其他亚家族成员
4.1 主要种类及系统进化分析
TGF-β的其他亚家族成员包括Nodal、AMH和MIS等。其中,关于水产动物的Nodal的研究比较广泛,在鱼类、半索动物、棘皮动物、软体动物、腕足动物和腔肠动物中均发现存在Nodal基因(表2)。对哺乳动物和15种水产动物的Nodal氨基酸序列进行系统进化分析(图5)发现:人、鼠Mus musculus和鱼类的Nodal聚为一支,提示哺乳类的Nodal是由鱼类进化而来的;哺乳类和鱼类的Nodal与紫球海胆Strongylocentrotus purpuratus和棘冠海星Acanthaster planci的Nodal聚为一个大类,这一结果提示,棘皮动物的Nodal与鱼类的亲缘关系更为密切;而属于半索动物的囊舌虫Saccoglossus kowalevskii与软体动物、腕足动物和腔肠动物的Nodal聚为一支,而没有与更高等的无脊索动物—棘皮动物聚为一支,此结果提示,Nodal的进化过程并非完全遵守从简单到复杂、从低级到高级的进化过程。
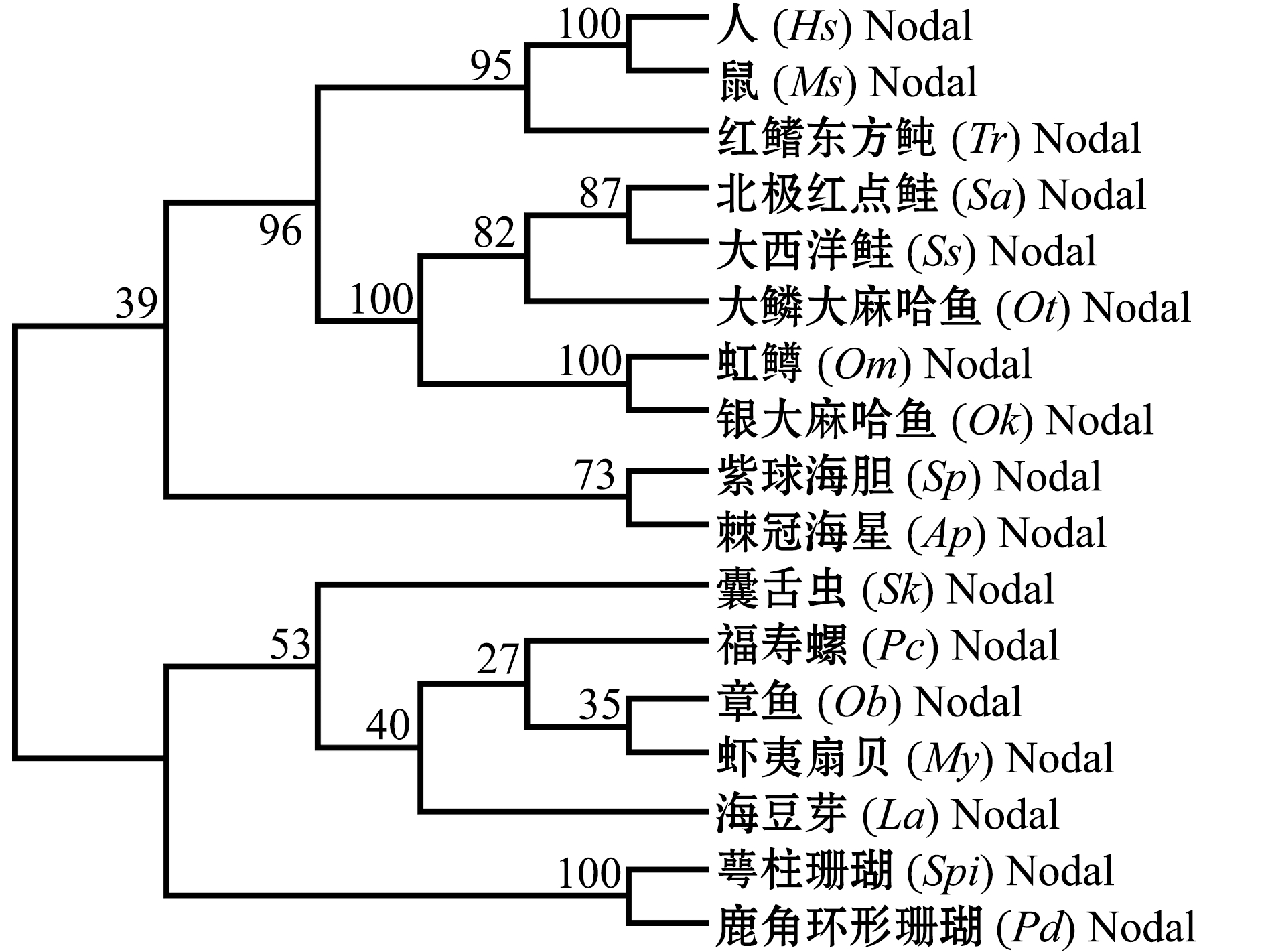
图5 哺乳动物和15种水产动物Nodal氨基酸序列的系统进化分析
Fig.5 NJ phylogenetic analysis of Nodal protein in the mammals and fifteen species of aquatic animals based on the amino acid sequences
4.2 生物学功能
Nodal是哺乳动物胚胎发育过程中一个重要的调节因子,其作为诱导早期胚胎信号的关键成分,参与中胚层和内胚层之间的形成、前后体轴位置的确定和左右体轴不对称发育等一系列关键性事件,对哺乳动物的早期发育有重要作用[51]。随着研究的不断深入,人们进一步发现Nodal蛋白可通过促进新生肿瘤血管生成或上皮细胞的恶性转化等过程参与人类恶性肿瘤的形成[52-53]。
在水产动物方面,研究证实Nodal主要参与鱼类与棘皮类动物的胚胎发育及体轴形成过程。在斑马鱼的胚胎中发现的3个胚胎形态发生素的同源基因Cyclops(cyc)、Squint(sqt)和Southpaw均参与斑马鱼的胚胎发育过程[54]。另外,Nodal对棘皮和腔肠动物体制的形成也具有重要意义,可参与海胆的轴形成[55],也可在水螅Hydra magnipapillata[56]建立轴向不对称和侧向分支过程中发挥重要作用。
5 存在问题及展望
TGF-β家族是重要的调控型基因超家族,全面系统地了解和掌握该家族成员在水产动物繁殖、发育、生理生化及病理响应等过程中的作用,以及其对环境因素变化的响应[57],不仅可以丰富和加深人们对调控型基因家族生物学功能的理解和认识,亦可为筛选水产动物分子辅助育种相关分子提供线索和参考资料。然而,目前关于水产动物体内的TGF-β家族成员的研究仍比较匮乏,大量的工作有待进一步开展和深入。因此,今后的工作可以主要围绕以下3个方面展开:
(1)利用高通量测序和生物信息分析技术,从基因组层面大规模挖掘水产动物体内的TGF-β家族成员的序列信息,目前仅见有学者利用高通量测序和基因组数据挖掘技术分别在斑马鱼和鲤Cyprinus carpio中鉴定出了22个BMP同源基因和44个BMP同源基因[58],其他大多数水产动物有待挖掘。
(2)在基因表达水平,进一步探究水产动物TGF-β超家族成员在水产动物不同发育阶段的表达规律及病理生理条件下的响应规律,同时,探明TGF-β家族成员之间在水产动物机体发育或病理生理响应中是否存在交互作用(Cross-talking)。
(3)在转录及转录后层面,进一步筛选和鉴定与水产动物TGF-β家族成员存在靶向调控关系的非编码RNA(Non-coding RNA,NcRNA),解析两者之间的调控关系和作用机制,为进一步了解和掌握水产动物TGF-β超家族成员的生物调控功能及机制奠定基础。
[1] Ravelich S R,Shelling A N,Wells D N,et al.Expression of TGF-β1,TGF-β2,TGF-β3 and the receptors TGF-βRI and TGF-βRII in placentomes of artificially inseminated and nuclear transfer derived bovine pregnancies[J].Placenta,2006,27(2-3):307-316.
[2] 周玉娟.合浦珠母贝TGFβ信号通路相关基因的克隆及功能研究[D].北京:清华大学,2010.
[3] Anzano M A,Roberts A B,Smith J M,et al.Sarcoma growth factor from conditioned medium of virally transformed cells is composed of both type alpha and type beta transforming growth factors[J].Proceedings of the National Academy of Sciences of the United States of America,1983,80(20):6264-6268.
[4] Bondestam J.Ligands & signaling components of the transforming growth factor β family:local regulators of inhibin production in ovarian granulosa cells[D].Helsinki:University Helsinki University,2002.
[5] 郭慧慧.栉孔扇贝TGF-β/Smad信号通路基因的克隆、表达分析及生长性状相关SNP位点筛查[D].青岛:中国海洋大学,2012.
[6] de Caestecker M.The transforming growth factor-β superfamily of receptors[J].Cytokine & Growth Factor Reviews,2004,15(1):1-11.
[7] 周敏,冯强,黄丽波,等.转化生长因子β1/Smads信号传导通路在哺乳动物卵巢发育中的调控作用及其作用机制[J].动物营养学报,2017,29(7):2283-2288.
[8] 柳林,张宝警,李莹莹,等.中间球海胆smad2/3基因克隆、组织表达及其脂多糖刺激响应[J].大连海洋大学学报,2019,34(3):345-354.
[9] Li M O,Wan Y Y,Sanjabi S,et al.Transforming growth factor-β regulation of immune responses[J].Annual Review of Immunology,2006,24:99-146.
[10] Dong Zhaoxing,Zhao Xinxiang,Tai Wenlin,et al.IL-27 attenuates the TGF-β1-induced proliferation,differentiation and collagen synthesis in lung fibroblasts[J].Life Sciences,2016,146:24-33.
[11] Humphreys B D,Xu Fengfeng,Sabbisetti V,et al.Chronic epithelial kidney injury molecule-1 expression causes murine kidney fibrosis[J].Journal of Clinical Investigation,2013,123(9):4023-4035.
[12] Lam S,Wiercinska E,Teunisse A F A S,et al.Wild-type p53 inhibits pro-invasive properties of TGF-β3 in breast cancer,in part through regulation of EPHB2,a new TGF-β target gene[J].Breast Cancer Research and Treatment,2014,148(1):7-18.
[13] Lan H Y,Chung A C K.TGF-β/Smad signaling in kidney disease[J].Seminars in Nephrology,2012,32(3):236-243.
[14] Bragado P,Estrada Y,Parikh F,et al.TGF-β2 dictates disseminated tumour cell fate in target organs through TGF-β-RIII and p38α/β signalling[J].Nature Cell Biology,2013,15(11):1351-1361.
[15] Hong F,Wu N,Ge Y,et al.Nanosized titanium dioxide resulted in the activation of TGF-β/Smads/p38MAPK pathway in renal inflammation and fibration of mice[J].Journal of Biomedical Materials Research Part A,2016,104(6):1452-1461.
[16] Kohli G,Hu Siqin,Clelland E,et al.Cloning of transforming growth factor-β1 (TGF-β1) and its type II receptor from zebrafish ovary and role of TGF-β1 in oocyte maturation[J].Endocrinology,2003,144(5):1931-1941.
[17] 侯少丰,李艳丽,徐功玉,等.斑马鱼胚胎发育过程中TGF-β1基因的表达特征分析[J].水生生物学报,2014,38(6):1054-1061.
[18] Holopainen R,Tapiovaara H,Honkanen J.Expression analysis of immune response genes in fish epithelial cells following ranavirus infection[J].Fish & Shellfish Immunology,2012,32(6):1095-1105.
[19] Orieux N,Douet D G,Le Hénaff M,et al.Prevalence of Flavobacterium psychrophilum bacterial cells in farmed rainbow trout:characterization of metallothionein A and interleukin1-β genes as markers overexpressed in spleen and kidney of diseased fish[J].Veterinary Microbiology,2013,162(1):127-135.
[20] Lelong C,Badariotti F,Le Quéré H,et al.Cg-TGF-β,a TGF-β/activin homologue in the Pacific oyster Crassostrea gigas,is involved in immunity against Gram-negative microbial infection[J].Developmental & Comparative Immunology,2007,31(1):30-38.
[21] 胡婉彬.马粪海胆(Hemicentrotus pulcherrimus)浮游幼体对海水酸化响应的转录组学研究[D].大连:大连海洋大学,2017.
[22] 李莹莹,崔东遥,常亚青,等.光棘球海胆(Mesocentrotus nudus)TGF-β基因克隆及其对海水酸化的响应[J].生物技术通报,2019,35(2):116-128.
[23] Vizzini A,Di Falco F,Parrinello D,et al.Transforming growth factor β (CiTGF-β) gene expression is induced in the inflammatory reaction of Ciona intestinalis[J].Developmental & Comparative Immunology,2016,55:102-110.
[24] Yang Mu,Wang Xinyan,Chen Danyan,et al.TGF-β1 exerts opposing effects on grass carp leukocytes:implication in teleost immunity,receptor signaling and potential self-regulatory mechanisms[J].PLoS One,2012,7(4):e35011.
[25] de Mello F,Streit D P Jr,Sabin N,et al.Dynamic expression of tgf-β2,tgf-β3 and inhibin βA during muscle growth resumption and satellite cell differentiation in rainbow trout (Oncorhynchus mykiss)[J].General and Comparative Endocrinology,2015,210:23-29.
[26] Dong Yuwen,Jiang Weidan,Liu Yang,et al.Threonine deficiency decreased intestinal immunity and aggravated inflammation associated with NF-κB and target of rapamycin signalling pathways in juvenile grass carp (Ctenopharyngodon idella) after infection with Aeromonas hydrophila[J].British Journal of Nutrition,2017,118(2):92-108.
[27] Funkenstein B,Olekh E,Jakowlew S B.Identification of a novel transforming growth factor-β (TGF-β6) gene in fish:regulation in skeletal muscle by nutritional state[J].BMC Molecular Biology,2010,11:37.
[28] Bragdon B,Moseychuk O,Saldanha S,et al.Bone morphogenetic proteins:a critical review[J].Cellular Signalling,2011,23(4):609-620.
[29] Salazar V S,Gamer L W,Rosen V.BMP signalling in skeletal development,disease and repair[J].Nature Reviews Endocrinology,2016,12(4):203-221.
[30] Rahman M S,Akhtar N,Jamil H M,et al.TGF-β/BMP signaling and other molecular events:regulation of osteoblastogenesis and bone formation[J].Bone Research,2015,3:15005.
[31] Chen Guiqian,Deng Chuxia,Li Yiping.TGF-β and BMP signaling in osteoblast differentiation and bone formation[J].International Journal of Biological Sciences,2012,8(2):272-288.
[32] Wu Mengrui,Chen Guiqian,Li Yiping.TGF-β and BMP signaling in osteoblast,skeletal development,and bone formation,homeostasis and disease[J].Bone Research,2016,4:16009.
[33] 徐启玉.文昌鱼尾部再生过程中BMPR-Ⅰ,BMPR-Ⅱ,Smad1,Smad4,Smad7基因的表达模式研究和BMP2/4,BMPR-Ⅰ,BMPR-Ⅱ的原核表达、多抗制备和免疫定位[D].青岛:中国海洋大学,2015.
[34] 马骞,冯文荣,柳淑芳,等.半滑舌鳎骨形态发生蛋白4基因的克隆和表达分析[J].中国水产科学,2016,23(3):500-512.
[35] 封利颖,郭慧慧,李雪,等.栉孔扇贝骨形态发生蛋白2基因的克隆及表达分析[J].中国海洋大学学报,2013,43(12):48-55.
[36] 林静云.三角帆蚌珍珠形成相关基因的克隆与表达分析[D].上海:上海海洋大学,2014.
[37] 周代志,黄桂菊,刘宝锁,等.合浦珠母贝骨形态发生蛋白10(BMP10)基因的克隆与表达分析[J].南方水产科学,2016,12(6):83-90.
[38] 范嗣刚,周代志,刘宝锁,等.合浦珠母贝BMP7b基因的克隆与表达分析[J].南方水产科学,2018,14(1):121-126.
[39] García-López A,Sánchez-Amaya M I,Halm S,et al.Bone morphogenetic protein 15 and growth differentiation factor 9 expression in the ovary of European sea bass (Dicentrarchus labrax):cellular localization,developmental profiles,and response to unilateral ovariectomy[J].General and Comparative Endocrinology,2011,174(3):326-334.
[40] 王瑶,陈阿琴,杨志刚,等.日本白鲫BMP15和GDF9基因片段的克隆及组织表达分析[J].上海海洋大学学报,2012,21(5):693-700.
[41] Shu Ling,Yang Yanan,Huang Huiyang,et al.A bone morphogenetic protein ligand and receptors in mud crab:a potential role in the ovarian development[J].Molecular and Cellular Endocrinology,2016,434:99-107.
[42] Lankford S E,Weber G M.Temporal mRNA expression of transforming growth factor-beta superfamily members and inhibitors in the developing rainbow trout ovary[J].General and Comparative Endocrinology,2010,166(2):250-258.
[43] Li Shilei,Zhou Zunchun,Dong Ying,et al.Molecular characterization,expression analysis of the myostatin gene and its association with growth traits in sea cucumber (Apostichopus japonicus)[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2016,201:12-20.
[44] Bannister R,McGonnell I M,Graham A,et al.Afuni,a novel transforming growth factor-β gene is involved in arm regeneration by the brittle star Amphiura filiformis[J].Development Genes and Evolution,2005,215(8):393-401.
[45] 刘云,王丛丛,郭亚南,等.海七鳃鳗pma-miR-200c-3p对斑马鱼心脏发育的作用研究[J].大连海洋大学学报,2016,31(5):510-515.
[46] Roberts V J,Barth S L,Meunier H,et al.Hybridization histochemical and immunohistochemical localization of inhibin/activin subunits and messenger ribonucleic acids in the rat brain[J].Journal of Comparative Neurology,1996,364(3):473-493.
[47] Olsen O E,Sankar M,Elsaadi S,et al.BMPR2 inhibits activin and BMP signaling via wild-type ALK2[J].Journal of Cell Science,2018,131(11):jcs213512.
[48] Petrino T R,Toussaint G,Lin Y W P.Role of inhibin and activin in the modulation of gonadotropin- and steroid-induced oocyte maturation in the teleost Fundulus heteroclitus[J].Reproductive Biology and Endocrinology,2007,5:21.
[49] Wu Tingting,Patel H,Mukai S,et al.Activin,inhibin,and follistatin in zebrafish ovary:expression and role in oocyte maturation[J].Biology of Reproduction,2000,62(6):1585-1592.
[50] Tan Q,Zagrodny A,Bernaudo S,et al.Regulation of membrane progestin receptors in the zebrafish ovary by gonadotropin,activin,TGF-β and BMP-15[J].Molecular and Cellular Endocrinology,2009,312(1-2):72-79.
[51] Schier A F.Nodal morphogens[J].Cold Spring Harbor Perspectives in Biology,2009,1(5):a003459.
[52] Lawrence M G,Margaryan N V,Loessner D,et al.Reactivation of embryonic Nodal signaling is associated with tumor progression and promotes the growth of prostate cancer cells[J].The Prostate,2011,71(11):1198-1209.
[53] 李又空,周家杰,张先觉,等.Nodal蛋白在肾细胞癌组织中的表达及意义[J].贵州医药,2014,38(4):295-299.
[54] 孙智慧.斑马鱼胚胎早期发育过程中TGFβ信号的转导与功能[D].北京:清华大学,2006.
[55] Duboc V,Lapraz F,Saudemont A,et al.Nodal and BMP2/4 pattern the mesoderm and endoderm during development of the sea urchin embryo[J].Development,2010,137(2):223-235.
[56] Watanabe H,Schmidt H A,Kuhn A,et al.Nodal signalling determines biradial asymmetry in Hydra[J].Nature,2014,515(7525):112-115.
[57] 闫浩,梁利群,常玉梅,等.遗传和温度因素对鱼类性别分化相关基因表达及性别比例的影响[J].大连海洋大学学报,2017,32(1):111-118.
[58] 陈琳.鲤头型性状的全基因组遗传解析及生长性状的SNP挖掘[D].新乡:河南师范大学,2018.