核酸有诸多生理及保健功能,近年来,作为营养补充剂,摄入核酸的生物利用越来越受到关注。正常人的肝脏可合成足够多的核酸以满足机体需要,但随着年龄的增长,这种合成能力逐渐减弱,致使体内核酸不足并因此患上各种疾病。试验证明,长期缺乏核苷酸摄入会导致免疫系统功能衰退、骨髓造血功能降低等[1]。补充核酸最简便的方式是饮食,但一般食品中核酸含量较少,如1000 g的猪肉或鸡肉仅含核酸0.9~1.5 g[2-3]。家畜的内脏中核酸含量较高,但胆固醇含量也比较高,不利于中老年人健康。WHO推荐的核酸日摄入量不少于1.5 g/d,因此,摄食富含核酸的食品有一定必要。
水产品被公认为富含核酸且核酸功能突出。据王海明等[4]报道,鱼精蛋白中的DNA有延缓衰老、辅助治疗男性不育等作用;鱿鱼精提取物有抗疲劳、抗氧化和免疫调节作用[5]。目前对核酸的营养,特别是消化代谢方面的理论尚有欠缺。传统的观点局限在核酸消化始于小肠,但张艳芳[6]、Liu 等[7]研究发现,提取的DNA和RNA能够被胃蛋白酶降解(30 nt的裸核酸在体外模拟胃液中5 h内约消化20%,其中约15%由胃蛋白酶消化),由此揭示了胃中的消化是核酸生物利用的重要环节。而水产品核酸在胃中的消化研究目前仍为空白,学界需在该新发现的基础上研究水产核酸的消化情况,以阐明其营养作用和消化机制。
水产品成分复杂,特别是含有一些独特的成分如壳聚糖等。近期研究发现,胃蛋白酶也可以消化瓜尔半乳甘露聚糖和壳聚糖等[8],表明核酸在胃中的消化可能受到糖类成分的影响。糖是水产品中的特征基质成分,若解析水产核酸生物利用和营养功效,需从实际摄食角度,结合糖与核酸的实际含量进行研究。因此,本研究中选取了水产品中特征多糖——壳聚糖,研究了不同浓度的壳聚糖及其组成的寡糖、单糖对胃蛋白酶消化的影响,旨在进一步了解蛋白酶消化DNA的机制。
1 材料与方法
1.1 材料
试验试剂:NaCl、NaH2PO4、HCl、NaOH、硼酸、乙二胺四乙酸二钠和Tris碱均为国产分析纯;λDNA、鲑鱼精DNA和ddH2O均购自Thermo Scientific公司;琼脂糖购自天根生化科技公司;壳聚糖(相对分子质量为70 000,脱乙酰度为90.25%)和壳寡糖(相对分子质量<3000)购自源叶生物有限公司;盐酸氨基葡萄糖、N-乙酰葡糖胺(HPLC≥98%,相对分子质量为221.21)和壳聚糖酶购自北京索莱宝科技有限公司。
试验仪器:DYY-6C型电泳仪(北京六一仪器厂);PCR仪(杭州博日科技有限公司);纯水系统(德国Sartorius公司);高压蒸汽灭菌锅(美国ZEALWAY公司);磁力搅拌器(金坛市科析仪器有限公司);酶标仪(Thermo Scientific)。
1.2 方法
1.2.1 储备液的配制
10 mg/mL猪胃蛋白酶液:称取10 mg的猪胃蛋白酶粉末于2 mL EP管中,加入1 mL的ddH2O轻微震荡溶解,于-20 ℃下保存待用。
300 ng/μL鲑鱼精DNA:称取3 mg的鲑鱼精DNA溶于10 mL的ddH2O中,于-20 ℃下保存待用。
4× Buffer:用超纯水溶解NaCl和NaH2PO4至浓度分别为0.75 mol/L和0.1 mol/L,然后用1 mol/L HCl调节pH为3.5,121 ℃下灭菌20 min,分装于2 mL EP管中,于-20 ℃下保存待用。
10×TBE电泳缓冲液:将890 mmol/L Tris碱、20 mmol/L EDTA、890 mmol/L硼酸盐,定容至1 L。
壳寡糖、氨基葡萄糖、N-乙酰葡糖胺溶液:分别取一定质量的糖加入相应体积的超纯水,配成不同浓度的糖溶液。
10 mg/mL的壳聚糖溶液:将1 g的壳聚糖溶于10 mL水中,溶胀8 min后,加入50 mL 1%乙酸,搅拌至无不溶物,最后用水定容至100 mL。
1.2.2 体外模拟胃液 人胃液的pH值一般为1.8,但考虑到进食后胃液的pH会有所升高,故将胃蛋白酶降解DNA的pH设为3.8;食物在胃中停留时间为2~5 h,之后的反应时间为2 h;中国药典中胃蛋白酶浓度设为1 mg/mL,美国药典中胃蛋白酶浓度设为3.2 mg/mL,本试验体系中胃蛋白酶浓度设为1 mg/mL。反应温度为37 ℃。
1.2.3 DNA的消化 在20 μL缓冲液(pH 3.8,包括1 mg/mL胃蛋白酶、25 mmol/L NaH2PO4和200 mmol/L NaCl)中消化2 μL的DNA(300 ng/μL),37 ℃下反应2 h。
1.2.4 荧光光谱的测定 样品混匀后,室温放置30 min。用酶标仪于荧光激发波长为280 nm、发射波长为345 nm及激发与发射狭缝为12 nm的条件下测定。
2 结果与分析
2.1 壳聚糖对胃蛋白酶消化DNA的影响
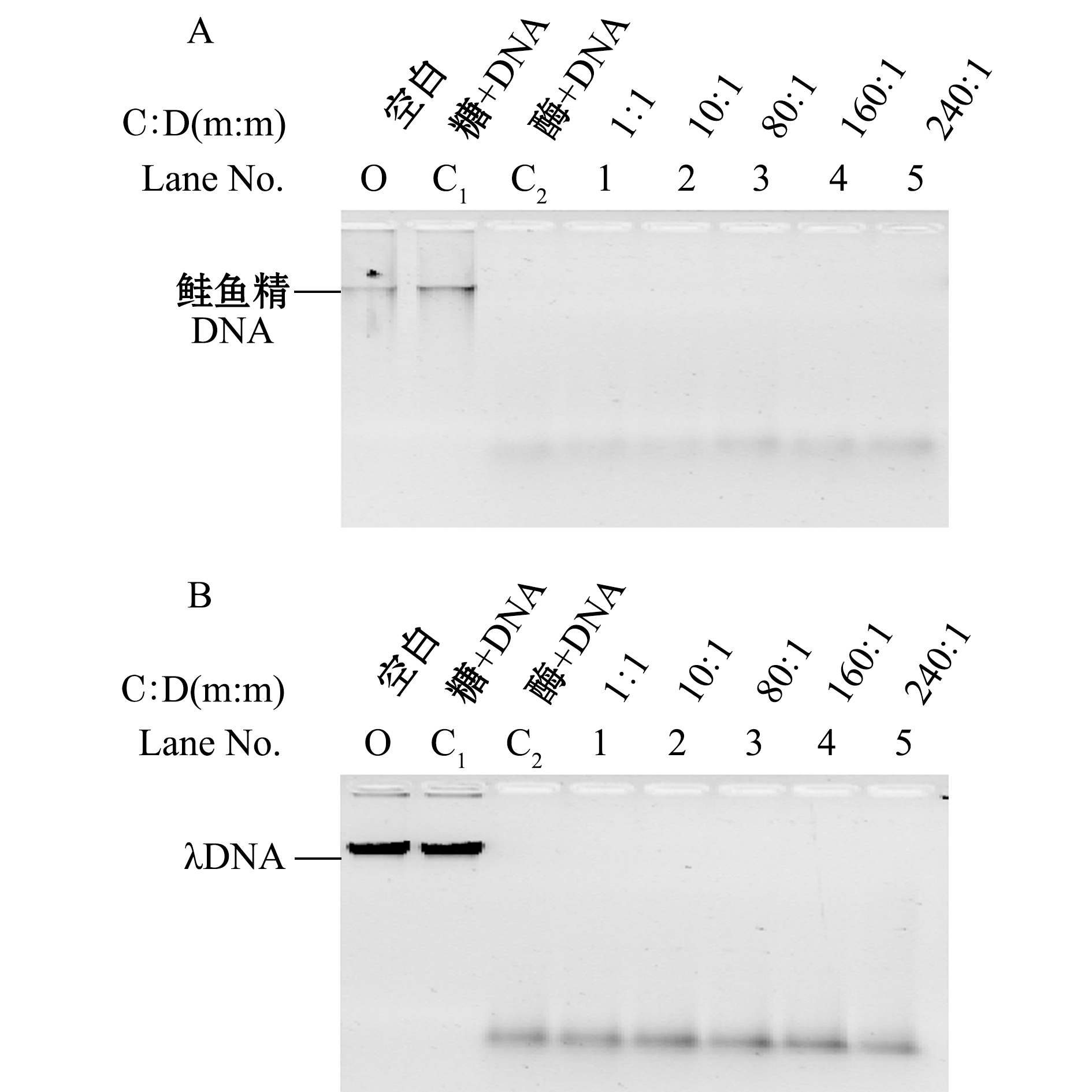
采用鲑鱼精DNA和分子量为70 000的壳聚糖,将壳聚糖与鲑鱼精DNA以质量比为0.1∶1、0.5∶1、1∶1、5∶1的比例混合,以1 mg/mL的胃蛋白酶,37 ℃下反应2 h,研究壳聚糖对胃蛋白酶消化DNA的影响,结果见图1。
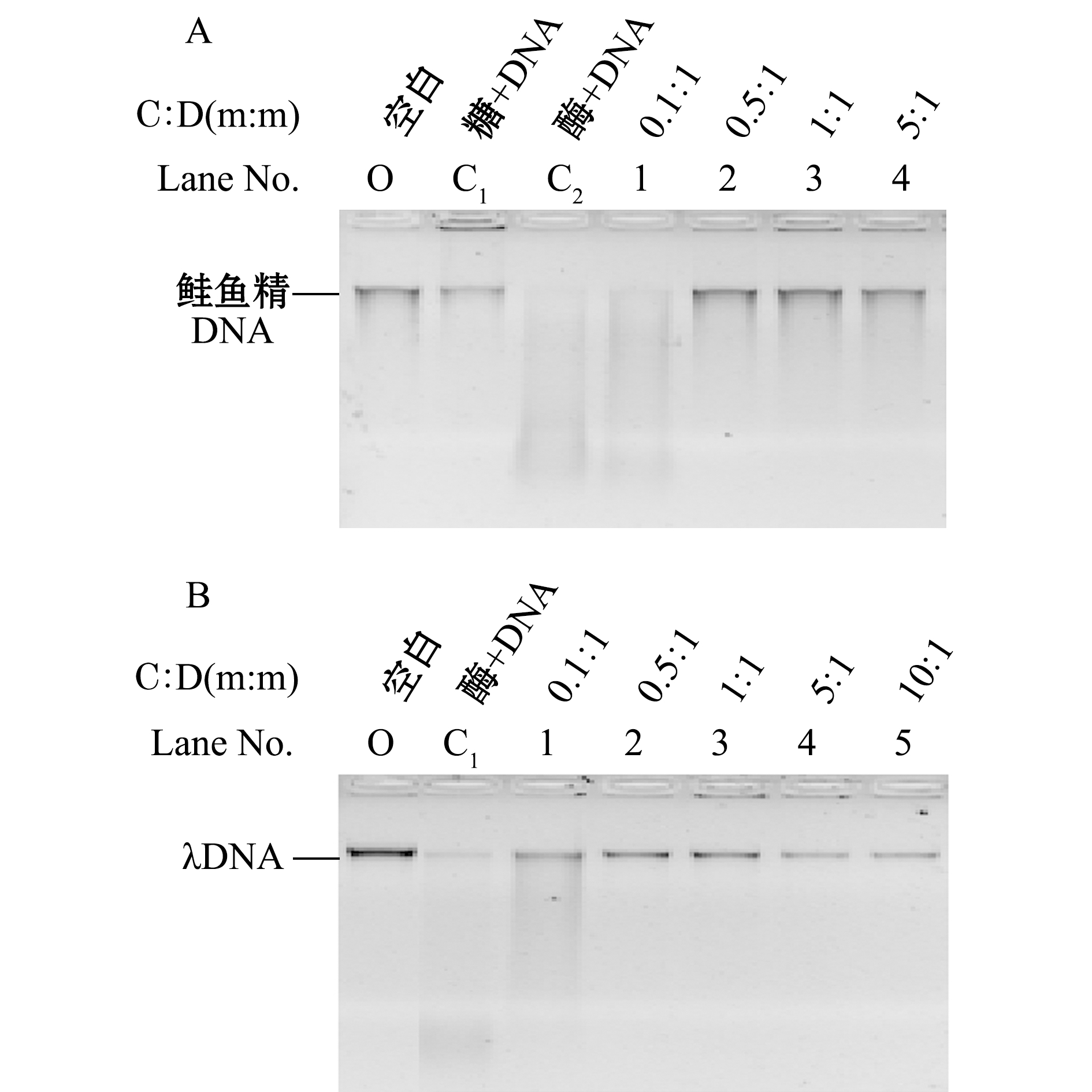
注:A为壳聚糖对胃蛋白酶降解鲑鱼精DNA的影响;B为壳聚糖对胃蛋白酶降解λDNA的影响;C∶D为壳聚糖与DNA质量比
Note:A, Effect of chitosan on digestion of salmon sperm DNA by pepsin; B, Effect of chitosan on digestion of λDNA by pepsin;C∶D shows the mass ratio of chitosan to DNA
图1 壳聚糖对胃蛋白酶降解DNA影响的电泳检测
Fig.1 Electropherogram of the effects of chitosan on DNA digestion by pepsin
从图1-A可见:随着壳聚糖与鲑鱼精DNA质量比的增大,DNA的降解逐渐被抑制;在泳道O中,只加入DNA(未加入胃蛋白酶与壳聚糖);泳道C1中,只加入壳聚糖和DNA(未加入胃蛋白酶);泳道C2中,只添加胃蛋白酶与DNA(未加壳聚糖);其他泳道(1~4)中,均添加1 mg/mL的胃蛋白酶、30 ng/μL的DNA和不同浓度的壳聚糖。泳道C1用来排除壳聚糖中混有核酸酶的可能。与泳道C2(不加糖只添加胃蛋白酶与DNA)相比,当壳聚糖与鲑鱼精DNA的质量比为0.5∶1(泳道2)时,DNA的降解即被完全抑制。鲑鱼精DNA条带有一定弥散,为了使试验结果更直观,排除这种抑制作用是个别现象,同时选取λDNA为研究对象,结果如图1-B所示,其反应规律与鲑鱼精DNA基本一致。当壳聚糖与λDNA质量比为0.5∶1时未检测到降解条带。说明当壳聚糖与DNA的质量比达到0.5∶1时,壳聚糖即可抑制胃蛋白酶对DNA的消化。但图1-B泳道2与泳道O(只加DNA)相比,DNA条带颜色变淡,而胶孔中对应出现条带,可能部分DNA与壳聚糖发生结合,滞留在胶孔,这种结合可能是壳聚糖抑制DNA消化的一个原因。这表明,当壳聚糖与DNA的质量比达到0.5∶1时,壳聚糖即可抑制胃蛋白酶对DNA的消化。
2.2 壳聚糖对胃蛋白酶与DNA结合的影响
从图2可见,在胃蛋白酶浓度为1 mg/mL条件下,随着壳聚糖浓度的升高,糖对胃蛋白酶的荧光猝灭率逐渐升高,且逐渐与壳聚糖、DNA(浓度为200 ng/μL)共存时对胃蛋白酶的荧光猝灭率趋于一致。当体系中只存在壳聚糖与胃蛋白酶时,随着壳聚糖浓度的升高(0~500 ng/μL),对胃蛋白酶的荧光猝灭率逐渐升高,当壳聚糖浓度为500 ng/μL时,猝灭率达到57.6%。这表明,胃蛋白酶与壳聚糖发生了结合作用。当壳聚糖浓度为0 ng/μL时,DNA(200 ng/μL)对胃蛋白酶的猝灭率为29.9%,而浓度为200 ng/μL的壳聚糖对胃蛋白酶的猝灭率为32.6%。这表明,壳聚糖和DNA与胃蛋白酶的结合程度相近。当体系中壳聚糖、DNA、胃蛋白酶三者共存时,壳聚糖浓度为100 ng/μL(对应电泳中壳聚糖与DNA的质量比为0.5∶1),体系中胃蛋白酶的荧光猝灭率接近0,表明壳聚糖优先与DNA结合。随着壳聚糖浓度增加(>300 ng/μL),壳聚糖和DNA对胃蛋白酶的荧光猝灭率逐渐与单独的壳聚糖对胃蛋白酶的荧光猝灭率相近,表明壳聚糖与DNA结合后,剩余的壳聚糖对胃蛋白酶起到猝灭作用。
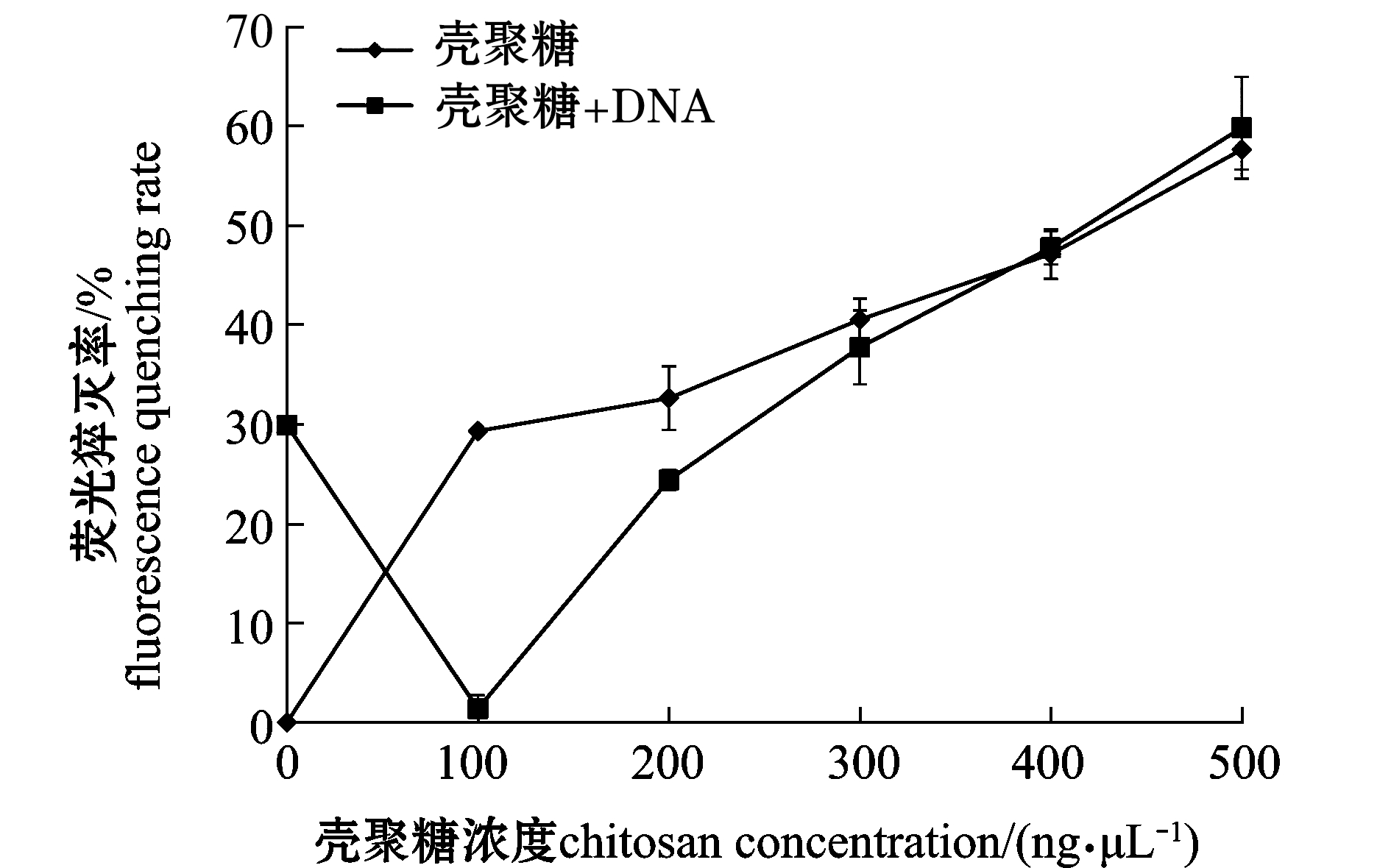
注:DNA浓度 200 ng/μL;胃蛋白酶浓度为1 mg/mL
Note: The concentration of DNA is 200 ng/μL and the concentration of pepsin is 1 mg/mL
图2 不同浓度的壳聚糖对DNA结合胃蛋白酶的影响
Fig.2 Effect of different concentrations of chitosan on DNA binding to pepsin
2.3 壳寡糖对胃蛋白酶消化DNA的影响
从图3可见,随着壳寡糖与DNA质量比的增大(0.1∶1~40∶1),DNA的降解逐渐被抑制。图3-A为壳寡糖对胃蛋白酶降解鲑鱼精DNA影响的电泳图,当壳寡糖与DNA质量比为5∶1时(泳道4)DNA的消化被完全抑制。图3-B为壳寡糖对胃蛋白酶降解λDNA影响的电泳图,与泳道C2(不加糖只添加胃蛋白酶与DNA)相比,泳道3(壳寡糖与λDNA的质量比为1∶1)即出现了明显的抑制,而当质量比达到5∶1时,DNA的消化完全被抑制,反应规律与图3-A一致。这表明,壳寡糖对胃蛋白酶降解DNA有抑制作用。
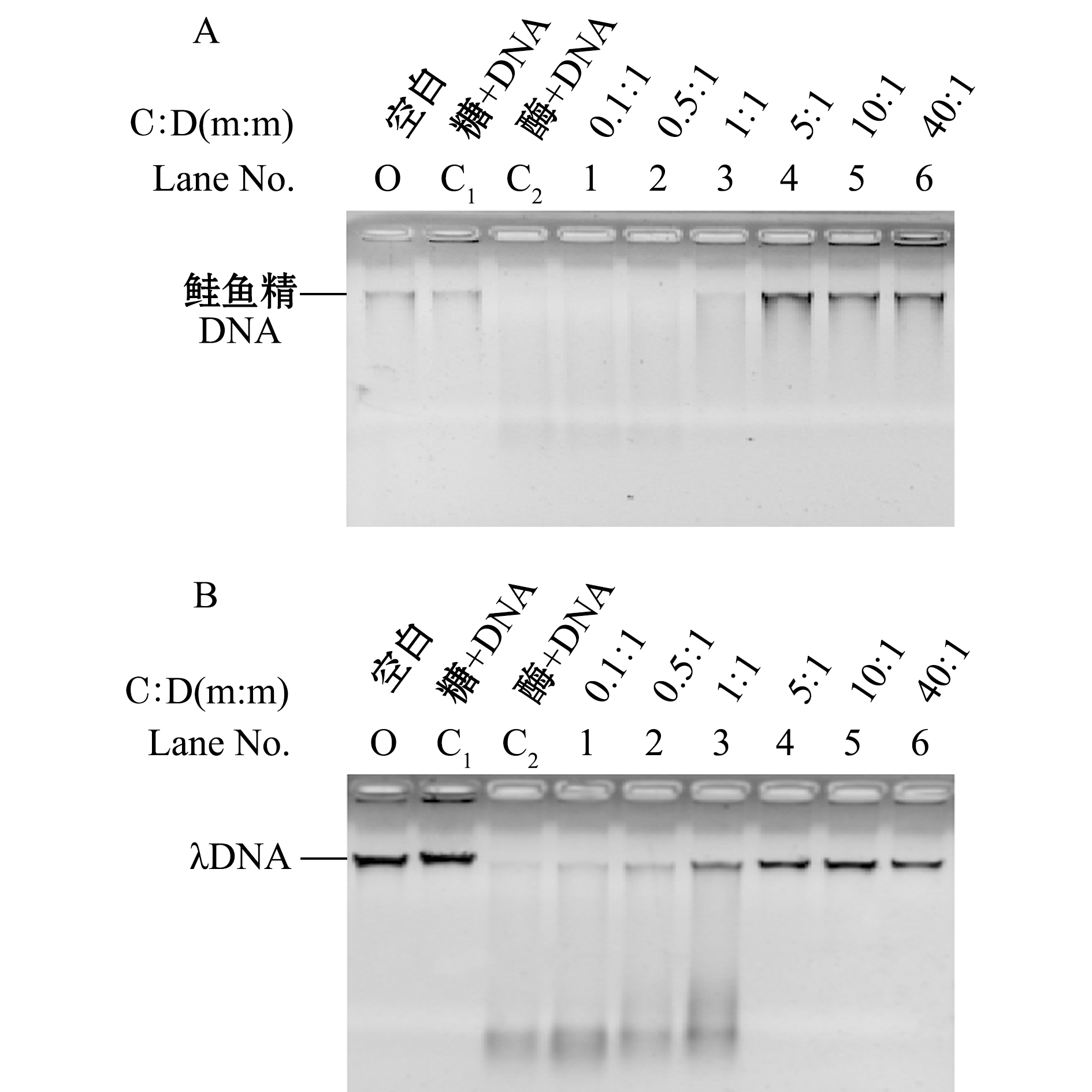
注:A为壳寡糖对胃蛋白酶降解鲑鱼精DNA的影响;B为壳聚寡糖对胃蛋白酶降解λDNA的影响;C∶D为壳寡糖与DNA质量比
Note: A, Effect of chitooligosaccharide on salmon sperm DNA digestion by pepsin; B, Effect of chitosan oligosaccharide on λDNA digestion by pepsin;C∶D shows the mass ratio of chitosan oligosaccharide to DNA
图3 壳寡糖对胃蛋白酶降解DNA影响的电泳检测
Fig.3 Electropherogram of the effects of chitosan oligosaccharide on DNA digestion by pepsin
2.4 氨基葡萄糖对胃蛋白酶消化DNA的影响
氨基葡萄糖是葡萄糖的一个羟基被一个氨基取代的化合物,是组成壳聚糖的重要单糖。从图4可见:氨基葡萄糖对胃蛋白酶降解DNA无影响;对比其他泳道与泳道C1、C2可以发现,氨基葡萄糖添加量与DNA质量比达到240∶1时(泳道5),氨基葡萄糖对胃蛋白酶降解DNA也没有抑制作用;当氨基葡萄糖与DNA质量比为240∶1时,氨基磷酸比(糖的氨基与DNA的磷酸基团的摩尔比)为360∶1,表明即使糖的正电荷与DNA的负电荷的摩尔比值很大,也不能对胃蛋白酶降解DNA产生抑制作用。
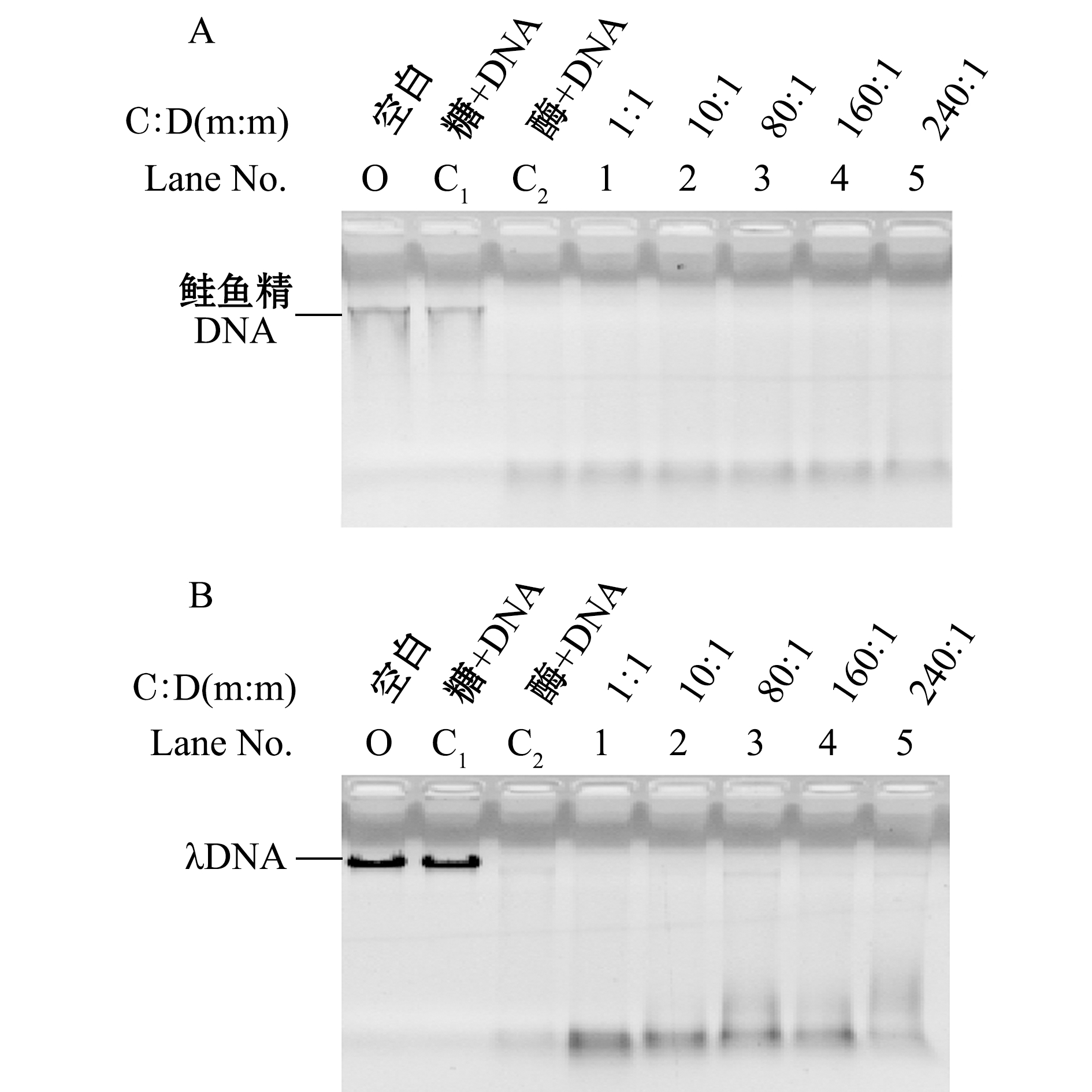
注:A为氨基葡萄糖对胃蛋白酶降解鲑鱼精DNA的影响;B为氨基葡萄糖对胃蛋白酶降解λDNA的影响;C∶D为氨基葡萄糖与DNA的质量比
Note: A, Effect of glucosamine on salmon sperm DNA digestion by pepsin; B, Effect of glucosamine on λDNA digestion by pepsin;C∶ D shows the mass ratio of glucosamine to DNA
图4 氨基葡萄糖对胃蛋白酶降解DNA影响的电泳检测
Fig.4 Electropherogram of the effects of glucosamine on DNA digestion by pepsin
2.5 N-乙酰葡糖胺对胃蛋白酶消化DNA的影响
N-乙酰葡糖胺是组成甲壳素、壳聚糖、壳寡糖的一种单糖,本研究中将其加入胃蛋白酶消化DNA的体系中,研究其对DNA消化的影响。如图5所示,将其他泳道与泳道C1、C2对比可以发现,随着 N-乙酰葡糖胺浓度的增加,在糖与DNA的质量比为1∶1~240∶1时,对胃蛋白酶降解DNA均无影响。
注:A为N-乙酰葡糖胺对胃蛋白酶降解鲑鱼精DNA的影响;B为N-乙酰葡糖胺对胃蛋白酶降解λDNA的影响;C∶D为N-乙酰葡糖胺与DNA的质量比
Note: A, Effect of N-acetylglucosamine on salmon sperm DNA digestion by pepsin; B, Effect of N-acetylglucosamine on λDNA digestion by pepsin;C∶D shows the mass ratio of N-acetylglucosamine to DNA
图5 N-乙酰葡糖胺对胃蛋白酶降解DNA影响的电泳检测
Fig.5 Electropherogram of the effects of N-acetylglucosamine on DNA digestion by pepsin
3 讨论
3.1 壳聚糖对胃蛋白酶消化DNA的影响
壳聚糖属于甲壳素类的氨基多糖,是水产品中富含的特征多糖。本研究中,壳聚糖对胃蛋白酶降解DNA有抑制作用。由于胃蛋白酶在激发波长为280 nm处,有最大荧光发射峰,而DNA和糖均无荧光光谱,故可以通过荧光光谱试验研究即添加壳聚糖后胃蛋白酶的荧光猝灭率的变化来表征糖对DNA与胃蛋白酶结合情况的影响。结果显示,壳聚糖可显著猝灭胃蛋白酶的荧光强度,表明壳聚糖可与胃蛋白酶结合,这与之前报道的胃蛋白酶与壳聚糖可以发生静电相互作用[9]的结果一致。结果同时显示,壳聚糖可显著抑制胃蛋白酶与DNA的结合。据文献报道,壳聚糖与DNA间的结合也是通过静电作用,高浓度的壳聚糖促使DNA发生了凝聚,形成复合物[10]。壳聚糖与DNA的结合作用减弱了DNA对胃蛋白酶的猝灭作用,即减少了DNA与胃蛋白酶结合,从而保护DNA免受胃蛋白酶的消化。DNA-壳聚糖复合物的形成是DNA消化受到抑制的重要原因。
Gamboa等[11]研究表明,聚阳离子(如壳聚糖)对DNA有保护作用,可以保护DNA免受核酸酶的降解;An等[12]研究表明,壳聚糖可以抑制DNA的非酶促脱嘌呤。结合本研究,表明壳聚糖可以减慢摄入DNA在胃中的降解。由此可见,在摄食含壳聚糖丰富的水产品时,DNA的生物利用度可能会降低。RNA与DNA在同阳离子聚合物相互作用方面性质相近,故可以推测,RNA的消化同样会受这些带正电荷的多糖的影响。
3.2 壳寡糖对胃蛋白酶消化DNA的影响
壳寡糖是由甲壳素和壳聚糖经降解得到的氨基葡萄糖以β-1, 4-糖苷键连接的碱性寡糖[13],其与壳聚糖在结构上的差异主要体现在相对分子质量与电荷量。由于壳聚糖在胃中可以同时被胃蛋白酶消化[14],产物壳寡糖在胃中对DNA消化的影响被进一步研究。本研究中发现,壳寡糖对胃蛋白酶降解DNA抑制作用弱于壳聚糖(质量比为5∶1时完全抑制)。电泳图3胶孔中滞留的DNA表明了壳寡糖与DNA结合,从而导致正负电荷中和,DNA不能在电场中移动。李小芳[15]运用光谱、电泳和电化学方法证明了壳寡糖与DNA间存在强而稳定的相互作用。故可推测壳寡糖能够保护DNA免受胃蛋白酶的降解,原因可能是壳寡糖与DNA形成了复合物。经计算,壳聚糖与DNA质量比为0.5∶1时,氨基磷酸比为 1∶1,而壳寡糖与DNA质量比为5∶1时,氨基磷酸比为10∶1,这说明壳聚糖对DNA的保护作用不仅与电荷量有关,还可能与壳聚糖的相对分子质量有关。Ma等[16]研究也发现,基因递送时,壳聚糖的分子量越高,与DNA的结合越紧密,这与本研究的结果一致。
3.3 组成壳聚糖的单糖对胃蛋白酶消化DNA的影响
N-乙酰葡糖胺与氨基葡萄糖均为组成壳聚糖的单糖,其中后者含量一般超过 80%[17]。壳聚糖主要通过其质子化氨基葡萄糖单元与DNA带负电荷的磷酸基团间的静电相互作用形成复合物[18]。N-乙酰葡糖胺与氨基葡萄糖对胃蛋白酶消化DNA的影响结果一致——在糖与DNA的质量比为1∶1~240∶1时对DNA降解没有影响。氨基葡萄糖在结构上与氨基酸有一定的相似性[19],推测这可能是胃蛋白酶能够降解壳聚糖的原因之一。Zhang等[20]研究表明,胃蛋白酶只能在特定位点切割DNA,促进胃蛋白酶与DNA间的结合有助于加速DNA的消化,壳寡糖和壳聚糖均可抑制胃蛋白酶消化DNA,而组成它们的单糖(氨基葡萄糖和N-乙酰葡糖胺)未表现出明显的抑制作用。猜测可能是由于单糖分子较小,不能与DNA结合形成复合物,也不能和胃蛋白酶结合,所以DNA不能被保护。
4 结论
壳聚糖、壳寡糖可抑制胃蛋白酶对DNA的消化,而组成它们的单糖(氨基葡萄糖和N-乙酰葡糖胺)对胃蛋白酶消化DNA无抑制作用。此结果说明水产品中富含的壳聚糖及其相关壳寡糖可对DNA的消化产生保护作用,这种作用可能主要与壳聚糖/壳寡糖-DNA复合物的形成有关,同时也可能与其同胃蛋白酶的结合有关。推测摄食含壳聚糖、壳寡糖丰富的水产品时,核酸的生物利用度将会有一定程度的降低。本研究结果可为使用壳聚糖保护口服核酸类药物,以提高在胃肠道中的稳定性提供理论依据。
[1] 李勇,徐美虹.核苷酸营养学[M].北京:北京大学医学出版社,2016:6.
[2] 张燕婉,鲁红军,王津生.高效液相色谱法测定食品中核苷酸的含量[J].食品科学,1994,15(6):59-62.
[3] 木全誠,石橋晃,鎌田寿彦.豚肉の理化学的成分と官能検査との関係[J].日本養豚学会誌,2001,38(2):45-51.
[4] 王海明,钟世彬,任玉翠,等.鱼精核蛋白的营养保健功效及产业应用[J].浙江省医学科学院学报,2000(3):37-38.
[5] 王海明,任玉翠,周彦刚,等.鱿鱼精核蛋白提取物的保健功能研究[J].东海海洋,2001,19(3):52-55.
[6] 张艳芳.胃蛋白酶的核酸降解活性及其降解特征研究[D].青岛:中国海洋大学,2016.
[7] Liu Yu,Zhang Yanfang,Dong Ping,et al.Digestion of nucleic acids starts in the stomach[J].Scientific Reports,2015,5:11936.
[8] Shobha M S,Gowda L R,Tharanathan R N.A novel catalysis by porcine pepsin in debranching guar galactomannan[J].Carbohydrate Polymers,2014,102:615-621.
[9] Boeris V,Micheletto Y,Lionzo M,et al.Interaction behavior between chitosan and pepsin[J].Carbohydrate Polymers,2011,84(1):459-464.
[10] Agudelo D,Kreplak L,Tajmir-Riahi H A.Microscopic and spectroscopic analysis of chitosan-DNA conjugates[J].Carbohydrate Polymers,2016,137:207-213.
[11] Gamboa J M,Leong K W.In vitro and in vivo models for the study of oral delivery of nanoparticles[J].Advanced Drug Delivery Reviews,2013,65(6):800-810.
[12] An Ran,Dong Ping,Komiyama M,et al.Inhibition of nonenzymatic depurination of nucleic acids by polycations[J].FEBS Open Bio,2017,7(11):1707-1714.
[13] 徐俊光,赵小明,白雪芳,等.两种海洋寡糖对植物病原真菌的抑制作用[J].大连水产学院学报,2007,22(2):153-155.
[14] Roncal T,Oviedo A,de Armentia I L,et al.High yield production of monomer-free chitosan oligosaccharides by pepsin catalyzed hydrolysis of a high deacetylation degree chitosan[J].Carbohydrate Research,2007,342(18):2750-2756.
[15] 李小芳.壳聚糖抑菌活性及机理研究[D].兰州:兰州大学,2009.
[16] Ma Peilian,Lavertu M,Winnik F M,et al.Stability and binding affinity of DNA/chitosan complexes by polyanion competition[J].Carbohydrate Polymers,2017,176:167-176.
[17] Liu Xiaofei,Guan Yunlin,Yang Dongzhi,et al.Antibacterial action of chitosan and carboxymethylated chitosan[J].Journal of Applied Polymer Science,2001,79(7):1324-1335.
[18] Ma Peilian,Lavertu M,Winnik F M,et al.New insights into chitosan-DNA interactions using isothermal titration microcalorimetry[J].Biomacromolecules,2009,10(6):1490-1499.
[19] 张思维,郑波,邹晓莉,等.高效阴离子色谱法测定保健食品中的盐酸氨基葡萄糖[J].色谱,2009,27(1):117-119.
[20] Zhang Yanfang,Li Chunchuan,Liu Yu,et al.Mechanism of extraordinary DNA digestion by pepsin[J].Biochemical and Biophysical Research Communications,2016,472(1):101-107.