根据2018年渔业统计年鉴显示,中国2017年海水养殖总产量为2000.7万t,其中,贝类养殖为1437.1万t,占海水养殖总产量的72%,而牡蛎的养殖产量最大,为487.9万t[1]。常见的牡蛎养殖品种有近江牡蛎Ostrea rivularis Gould、太平洋牡蛎Crassostrea gigas、大连湾牡蛎Ostrea talienwhanensis Crosse和褶牡蛎Ostrea plicatula 4种。其中,太平洋牡蛎是辽宁地区主要的牡蛎养殖品种,20世纪80年代初从日本引进,因其具有生长速度快、产量高、肥满度高等优点,推动了中国北方牡蛎养殖业的发展[2]。本研究团队于2018年6月底对大连庄河市某养殖场的牡蛎捕后流通状况进行了实地调研,太平洋牡蛎采用吊笼进行养殖,牡蛎经采捕船运输到岸后,先用海水冲洗表面泥沙,经过简单挑选分装到泡沫箱中,最上层覆盖淡水冰,封装后进行运输。运输方式主要为陆运,少数采用空运。陆运目的地为大连市、沈阳市等较近地区,当天便可送达。空运运输至上海及广东地区,2~3 d到达。
目前,国内外针对贝类活品品质研究较多,Duncan[3]、杨婷婷等[4]对虾夷扇贝捕后的生理代谢变化及捕后活品品质进行了评价;Albentosa等[5]、Anacleto等[6]研究了蛤仔在饥饿情况下品质的变化及不同运输方式对其品质的影响。而牡蛎活品流通方式主要以无水干藏为主,Kawabe等[7]研究了长牡蛎在不同温度贮藏过程中生理状况的变化,结果表明,在4、15、20 ℃下干藏,致死时间分别为 47.8、15.9、12.2 d,且发现渗透压会随着厌氧条件的存在而增强;Hu等[8]使用电子鼻(e-nose)对活品牡蛎在不同干藏条件下的品质变化进行了评价,结果表明,4 ℃下贮藏的牡蛎10 d后仍品质良好,但感官质量下降明显,而在7 ℃下储存10 d时的牡蛎达到了品质极限;郑尧等[9]研究了捕后虾夷扇贝闭壳肌免疫因子与活品品质。此外,也有研究报道,高压处理能减少太平洋牡蛎中微生物的数量[10],然而,关于牡蛎捕后处置对活品品质影响的研究较少,本研究中从捕后流通链调查入手,通过监测捕后不同阶段牡蛎肌肉中ATP及其关联物含量、AEC值、K值、pH、蛋白质、糖原、甘油三酯等能量物质的变化,探讨了捕后处理对牡蛎活品贮藏稳定性的影响,并对捕后流通过程中存在的问题进行了分析,旨在探讨提高牡蛎活品贮藏稳定性的方法。
1 材料与方法
1.1 材料
试验用太平洋牡蛎采捕于大连庄河市王家岛海域某牡蛎养殖场。
1.2 方法
1.2.1 样品处理 于采捕现场挑选生理状态良好的牡蛎用于试验,规格为(102.3 ±5.1)g,并在捕捞船上立刻取10个牡蛎开壳(计为零点,标示为0 h),分离闭壳肌、体腔液及剩余软体组织3部分(图1),分别用干冰速冻后带回实验室。另外,取100个牡蛎装于泡沫箱中,上层覆淡水冰保存,立即运回实验室用于模拟流通试验。
牡蛎经6 h运抵实验室后立即用海水冲洗,模拟市场流通情况,分成两组。其中一组摆放在托盘内,覆盖浸湿海水的毛巾,然后于4 ℃冰柜中进行无水干藏,为防止水分蒸发,每24 h更换毛巾一次,共贮藏4 d,即为干藏处理组(记为D组);另外一组,在干藏贮藏期间增加复水处理(每天取样前6 h用海水进行复水处理,每次复水1 h,充氧),其他贮藏条件同干藏组,同样进行4 d贮藏,即为干藏-复水处理组(记为D-W组)。详细操作参数如表1所示。
在牡蛎运抵实验室时刻(6 h)及此后每隔24 h取样一次。样品按照图1所示进行组织分离后,于-40 ℃下冻藏备用。其中,闭壳肌部分用于ATP及其关联化合物和pH分析,软体组织用于一般化学组成、蛋白质、甘油三酯及糖原含量分析。本试验中每个样品均设3个平行。
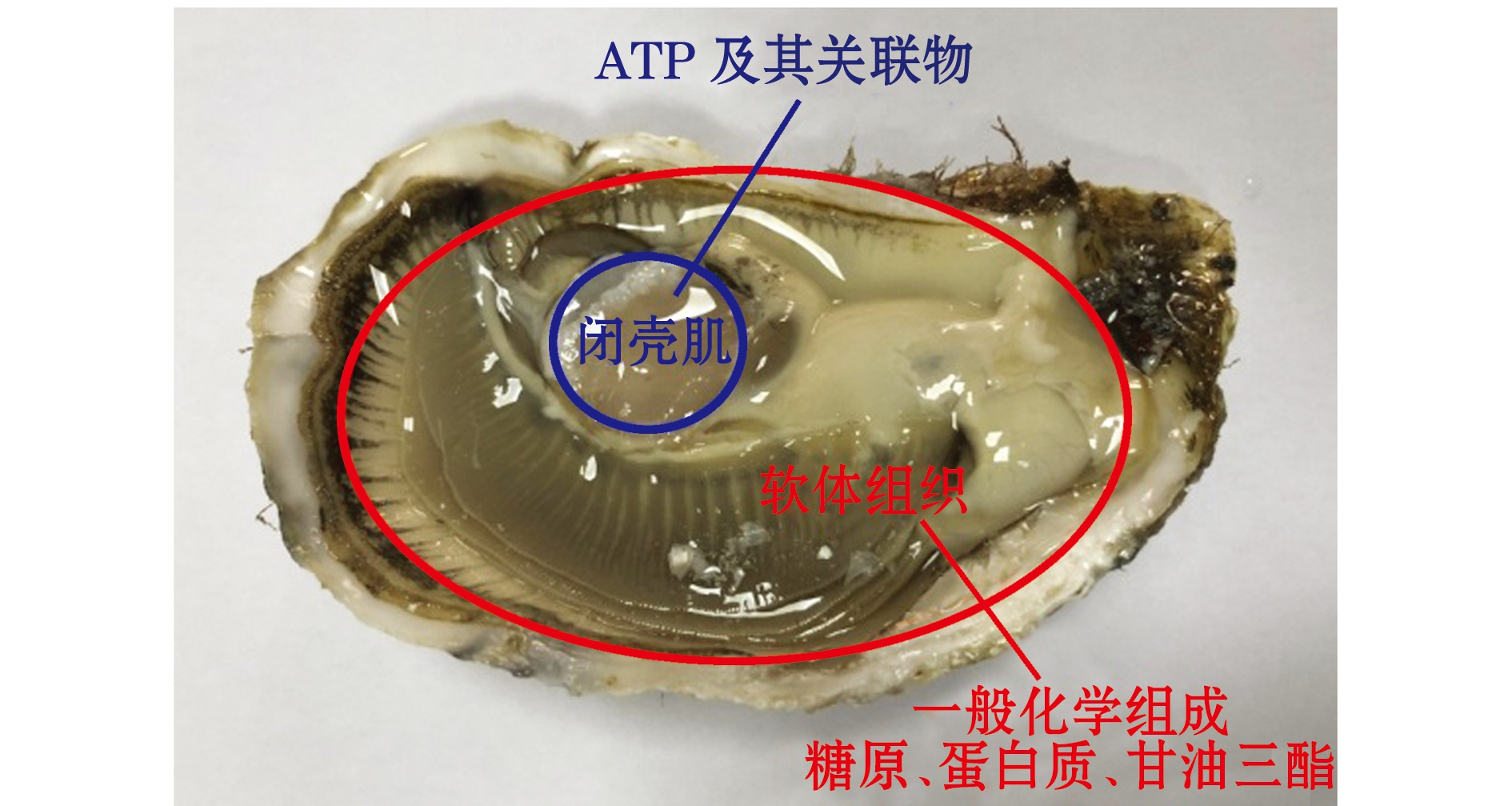
图1 太平洋牡蛎取样示意图
Fig.1 Sampling positions of Pacific oyster Crassostrea gigas
表1 太平洋牡蛎样品处理信息
Tab.1 Treatments of samples of Pacific oyster Crassostrea gigas in the experiment

捕后处置过程treatmentprocesspostharvest捕后历时/hperiodofpost-harvest处理组treatmentgroup操作handling条件conditions采捕自大连王家岛0对照组1取样干冰速冻运输transportation6—泡沫箱覆淡水冰密封运输干藏抵达实验室arrivedataLab.6对照组2取样,剩余分2组速冻、-40℃下贮藏干藏贮藏airexposurestorage6~96D组10只/盘×4(覆盖湿布)每24h取样4℃冷柜干藏-复水airexposure-re-water(wet)stor-age6~96D-W组10只/盘×4(覆盖湿布)每两次取样间复水,每24h取样4℃冷柜溶氧5~8mg/L,1h
1.2.2 质量组成和一般化学组成的测定 在每个取样点分别称取每只牡蛎的壳体、软体组织、闭壳肌、体腔液的质量。取0 h 样品对牡蛎软体部位匀浆后测定其一般化学组成的含量。按照GB 5009.3—2016《食品中水分的测定》、GB 5009.5—2016《食品中蛋白质的测定》、GB 5009.6—2016《食品中脂肪的测定》、GB 5009.4—2016《食品中灰分的测定》分别测定样品中水分、蛋白质、脂肪和灰分的含量。
1.2.3 甘油三酯含量的测定 样品中甘油三酯(Triglyceride,TG)含量使用北京索莱宝甘油三酯含量检测试剂盒进行测定。先称取1.0 g软体组织,加入10 mL正庚烷和异丙醇混合液,冰浴条件下以10 000 r/min均质3次,每次30 s,在8000 g、4 ℃下离心10 min;取上清40 μL,再次加入正庚烷和异丙醇混合液,充分摇均,加入KOH 25 μL,剧烈震荡30 s,静置;待分层后取上层溶液15 μL,加入过碘酸50 μL充分摇匀后,65 ℃下水浴3 min,再加入50 μL氯离子和50 μL乙酰丙酮,充分摇匀后,65 ℃下水浴15 min。移至96孔酶标板中,在420 nm处测定其吸光度值。根据甘油三酯标准曲线计算样品中TG含量。
1.2.4 糖原含量的测定 称取样品2.0 g,加入4 mL 30% KOH,煮沸后冷却至室温,加入20 mL无水乙醇,在3000 g下离心15 min;留沉淀弃上清,并向沉淀中加入15 mL无水乙醇、一滴饱和KCl和10 mL蒸馏水,在3000 g下离心15 min,弃上清,将沉淀定容至100 mL,静置10 min;取0.5 mL糖原稀释液加入4.5 mL蒸馏水,再取90 μL糖原稀释液,加入360 μL蒽酮显色液,混匀后冷却,煮沸10 min,冷却后在620 nm处测定其吸光度。根据葡萄糖标准曲线计算样品中糖原含量。
1.2.5 ATP及其关联物的测定 ATP及其关联物的提取参考Hu等[11]的方法。取牡蛎闭壳肌部分,称取1.0 g加入10 mL 5%的高氯酸(PCA),在高氯酸中使牡蛎肉破碎均匀后,加入2 mol/L的KOH调节pH至2.0~3.5,再加入超纯水定容至20 mL,在3000 g下离心10 min,取上清液过0.45 μm滤膜。取4 mL滤液加入1.0 mL 0.1 mol/L磷酸盐缓冲液(pH 7.5),整个试验过程在冰浴中进行。
ATP及其关联物含量的测定采用高效液相色谱法。色谱柱为日本岛津公司Shim-pack CLC-ODS(6.0 mm×150 mm,5 μm);检测波长为254 nm,温度为35 ℃,流速为1.5 mL/min;流动相为三乙胺溶液+乙腈溶液(二者体积比为4.2∶9),并用磷酸调pH至5.5。标准物质包括三磷酸腺苷(ATP)、二磷酸腺苷(ADP)、单磷酸腺苷(AMP)、肌苷酸(IMP)、次黄嘌呤苷酸(HxR)和次黄嘌呤(Hx)。
1.2.6 腺苷酸能荷(AEC)值和K值的计算 AEC值和K值均能在一定程度上反映水产品的品质和鲜度,其计算公式[12-13]为
1.2.7 pH值的测定 参考田元勇等[14]的测定方法,称取闭壳肌2.0 g,加入10 mL 20 mmol/L碘乙酸钠溶液,用玻璃棒充分搅拌,静置25 min,测定pH值。
2 结果与分析
2.1 太平洋牡蛎原料组成特性
2.1.1 一般质量组成 将刚捞上来的10只太平洋牡蛎,开壳后分离为软体组织(除闭壳肌的全软体部分)、闭壳肌和体腔液,各部分质量如表2所示,软体部分占总体的12.3%左右,其中闭壳肌占1.3%左右,除闭壳肌外的软体组织占11.0%左右,体腔液占10.7%左右。
表2 太平洋牡蛎原料一般质量组成(n=3)
Tab.2 Organizations information of raw Pacific oyster Crassostrea gigas(n=3)
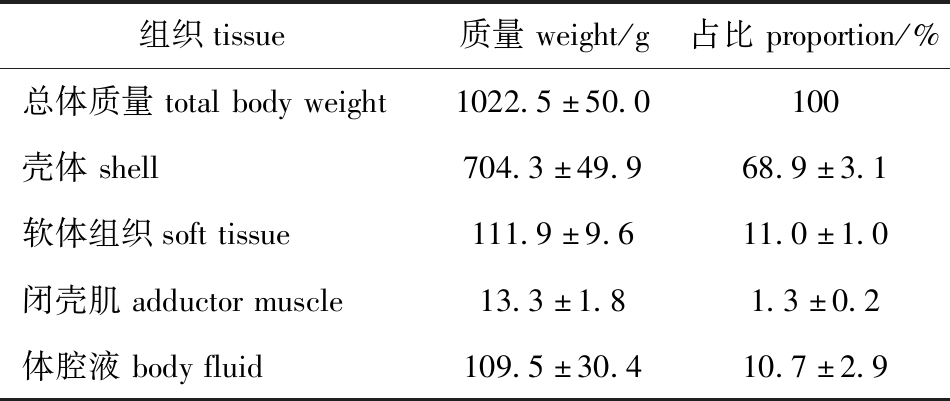
组织tissue质量weight/g占比proportion/%总体质量totalbodyweight1022.5±50.0100壳体shell704.3±49.968.9±3.1软体组织softtissue111.9±9.611.0±1.0闭壳肌adductormuscle13.3±1.81.3±0.2体腔液bodyfluid109.5±30.410.7±2.9
2.1.2 一般化学成分组成 太平洋牡蛎软体组织中水分含量为82.0%;其他物质占干基的比例,粗蛋白质含量为51.8%,糖原含量为11.6%,粗脂肪含量为4.7%,灰分含量为16.9%。
2.2 活品贮藏稳定性变化
2.2.1 蛋白质含量的变化 将运回实验室的太平洋牡蛎分为干藏组(D组)和干藏-复水组(D-W组)两种捕后处置组分别暂养96 h,软体组织中蛋白质含量的变化情况如图2所示,离水后时刻(0 h)样品的粗蛋白质含量为10.3 g/100 g,在96 h的干藏及干藏-复水处理过程中,D-W组粗蛋白质含量总体上无显著性变化,而D组则波动较大,96 h时D组蛋白质含量显著低于D-W组(P<0.05)。
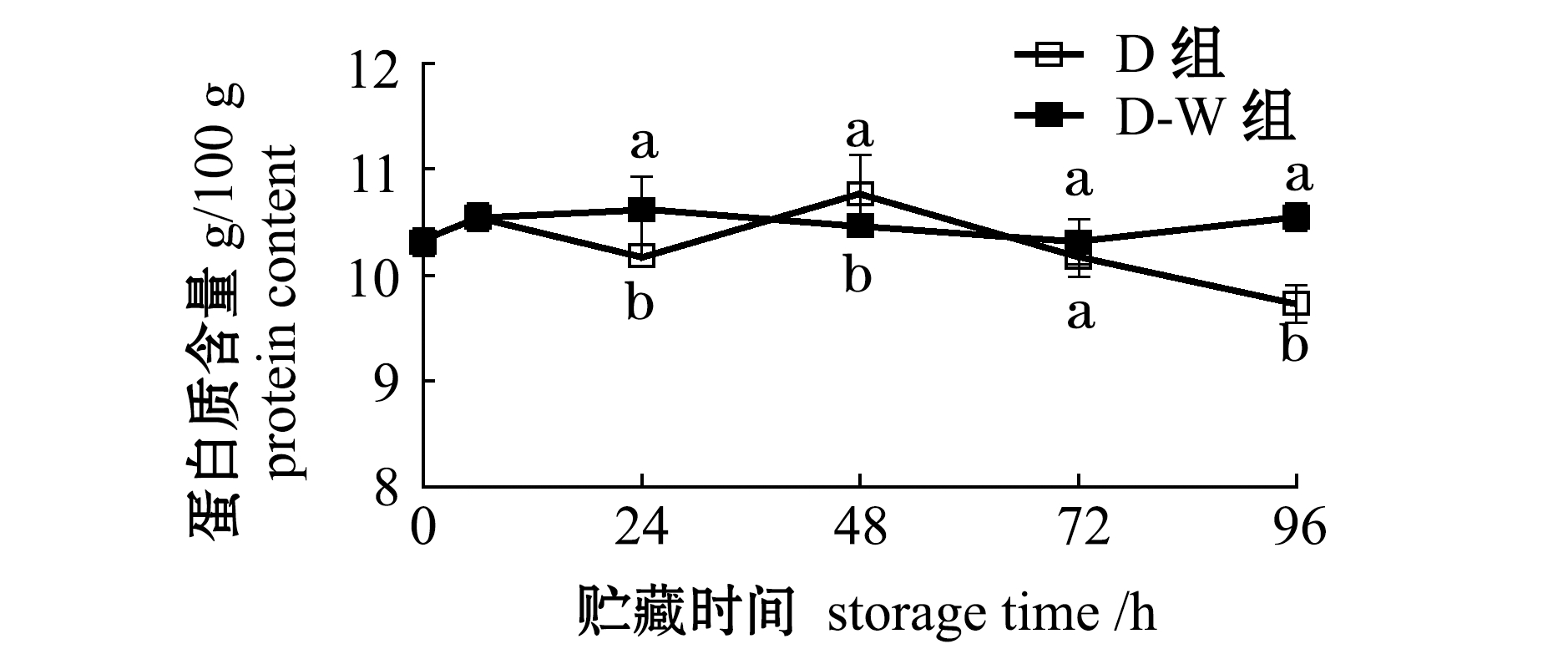
注:同一时间下,标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters are significantly different in the groups at same time at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图2 干藏及复水对太平洋牡蛎软体部分蛋白质含量的影响
Fig.2 Effect of air exposure storing and re-water on protein contents in soft part of Pacific oyster Crassostrea gigas
2.2.2 甘油三酯含量的变化 捕后干藏及复水对太平洋牡蛎软体组织中TG含量的影响如图3所示。从图3可见:离水时刻(0 h)TG含量为10.0 mg/g,运抵实验室(6 h)时,TG含量下降为7.5 mg/g;经过海水清洗处理后,在4 ℃干藏24 h后,D 组的TG含量基本恢复到初始状态;在持续干藏过程中,逐渐被消耗,至第96 h时, D组TG含量下降为8.4 mg/g;而在干藏过程中增加复水处理后的D-W组,延缓了TG恢复时间,恢复峰值出现在捕后48 h,且在96 h的含量略高于干藏处理的D组,但两组无明显差异(P>0.05)。
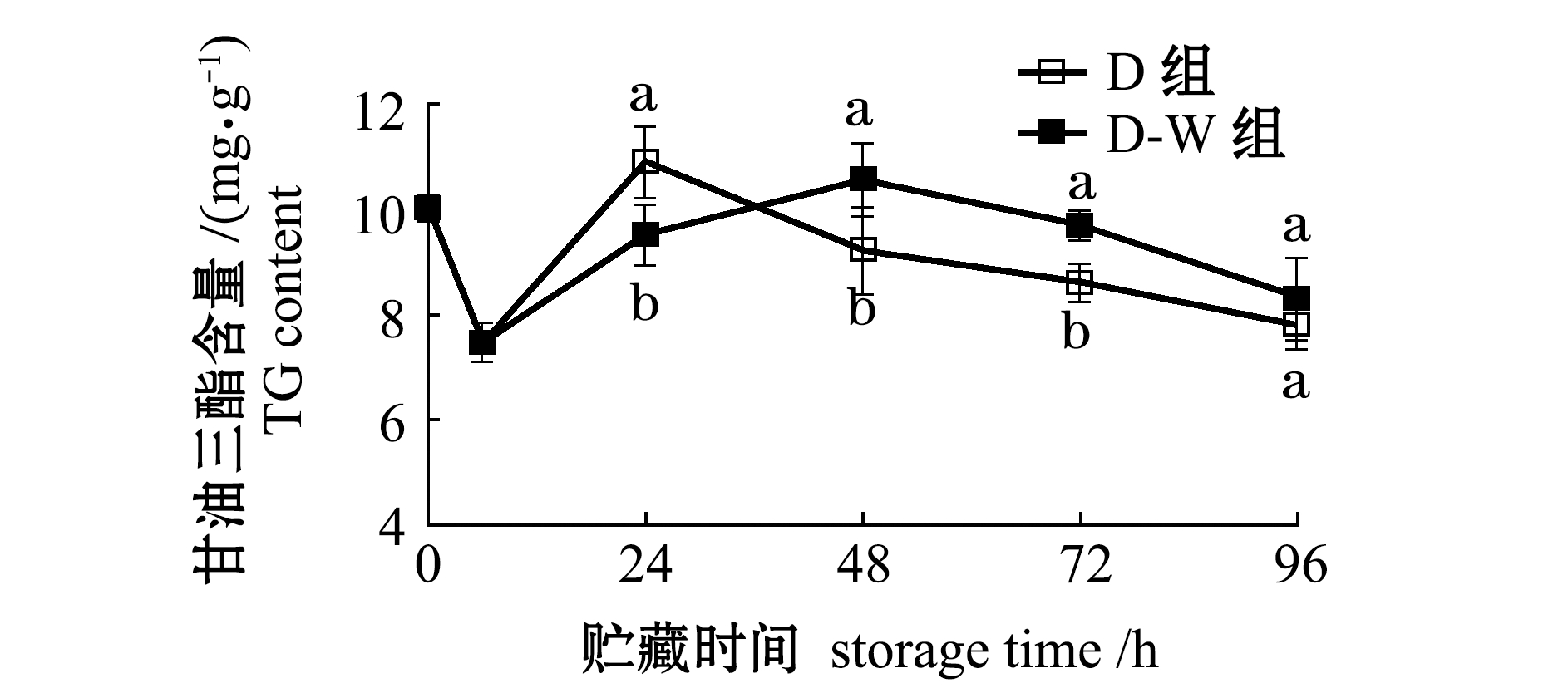
图3 干藏及复水对太平洋牡蛎软体部分甘油三酯含量的影响
Fig.3 Effect of air exposure storing and re-water on triglycerid contents in Pacific oyster Crassostrea gigas
2.2.3 糖原含量的变化 从图4可见:离水时刻(0 h)牡蛎软体组织中糖原含量为25.6 mg/g,运抵至实验室(6 h)时糖原含量下降至17.2 mg/g,可能是在干藏运输回实验室的过程中,消耗了体内糖原;到达实验室经过海水处理,然后干藏24 h后D组糖原回升至24 mg/g左右,在此后持续干藏过程中,D组又呈现下降趋势;而干藏过程中D-W组糖原含量和甘油三酯含量变化一致,复水对太平洋牡蛎的糖原恢复起到了重要作用。
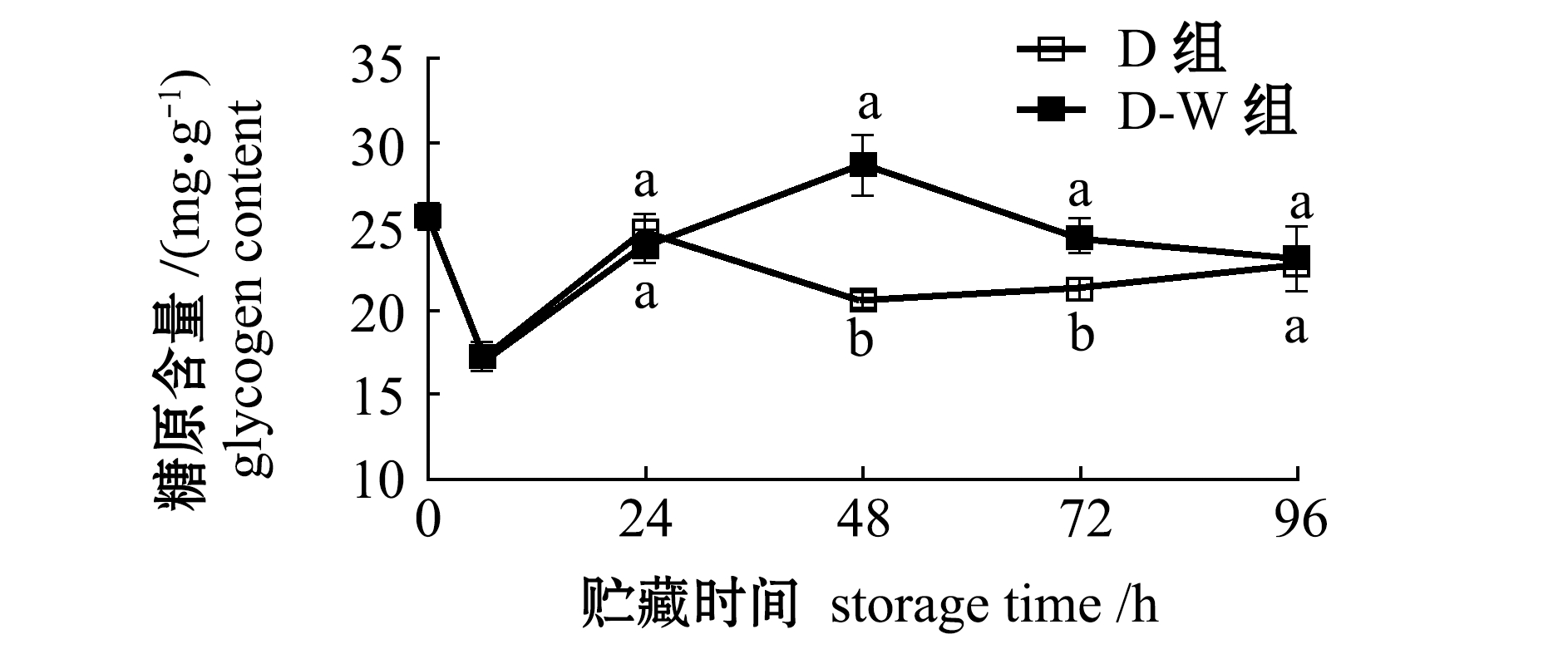
图4 干藏及复水对太平洋牡蛎软体部分糖原含量的影响
Fig.4 Effect of air exposure storing and re-water on glycogencontents in soft part of Pacific oyster Crassostrea gigas
2.2.4 ATP及其关联物的变化 本试验前首先对太平洋牡蛎闭壳肌、外套膜、软体组织中ATP及其关联物含量进行了初步分析,结果如图5所示。从图5可见:闭壳肌中ATP、ADP和AMP的含量明显高于外套膜及其他组织,因此,本试验中使用闭壳肌中ATP含量来评价牡蛎活品贮藏过程中的品质变化。
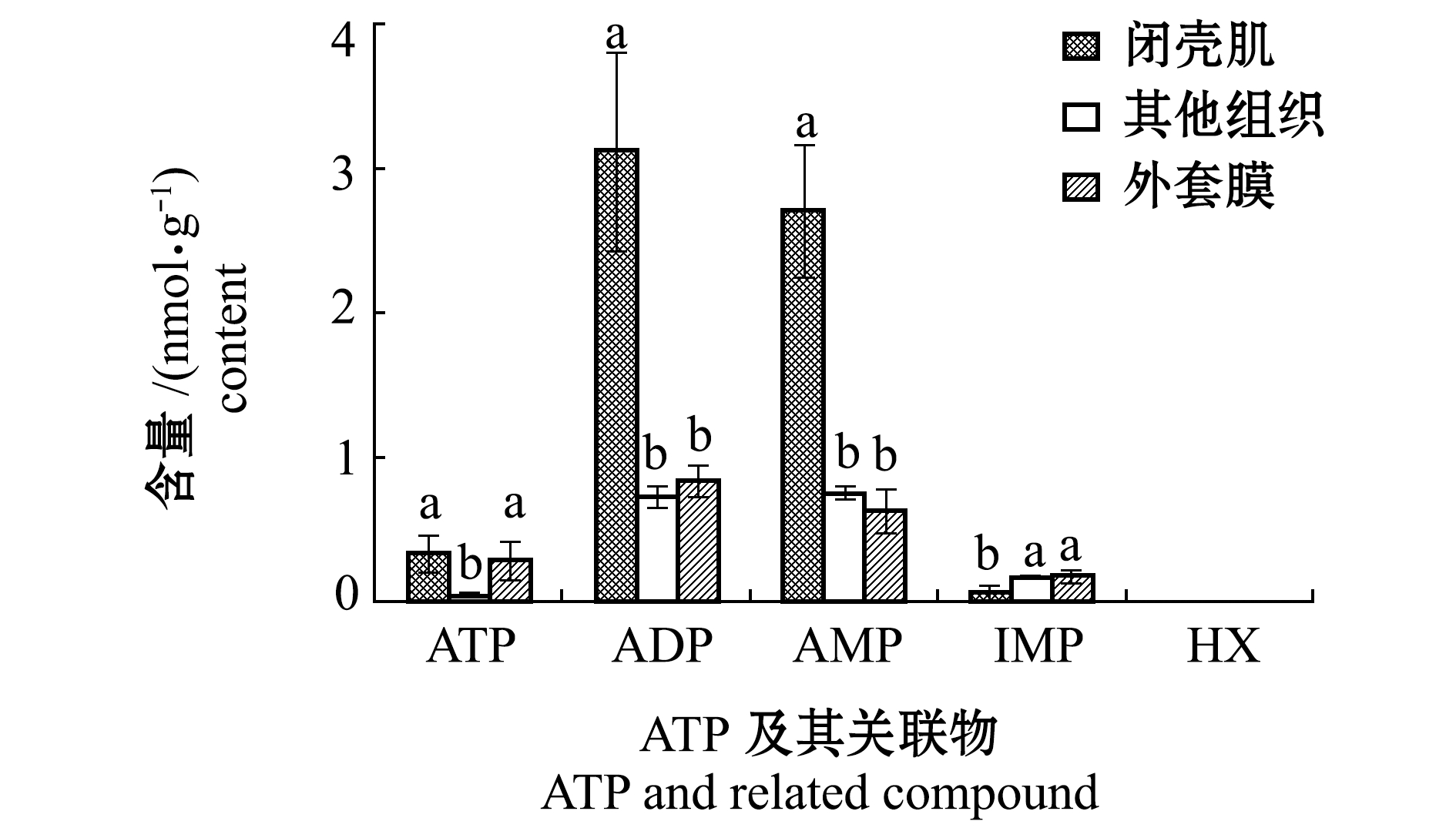
注:标有不同字母者表示同一指标下不同软组织间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note: The different letters show the significant differences in the different tissues in the same index(P<0.05), and means with the same letter shows no significant differences in different tissues(P>0.05)
图5 太平洋牡蛎各组织中ATP及其关联物的含量
Fig.5 Contents of ATP and related compounds in the tissues of Pacific oyster Crassostrea gigas
捕后干藏及复水条件下,闭壳肌中ATP含量的变化情况如图6所示,其中,太平洋牡蛎离水时刻(0 h)ATP含量为0.76 nmol/g,运抵实验室(6 h)时下降为0.53 nmol/g。在此后的干藏过程中,两组ATP含量均出现恢复趋势,但D-W组恢复情况优于D组。
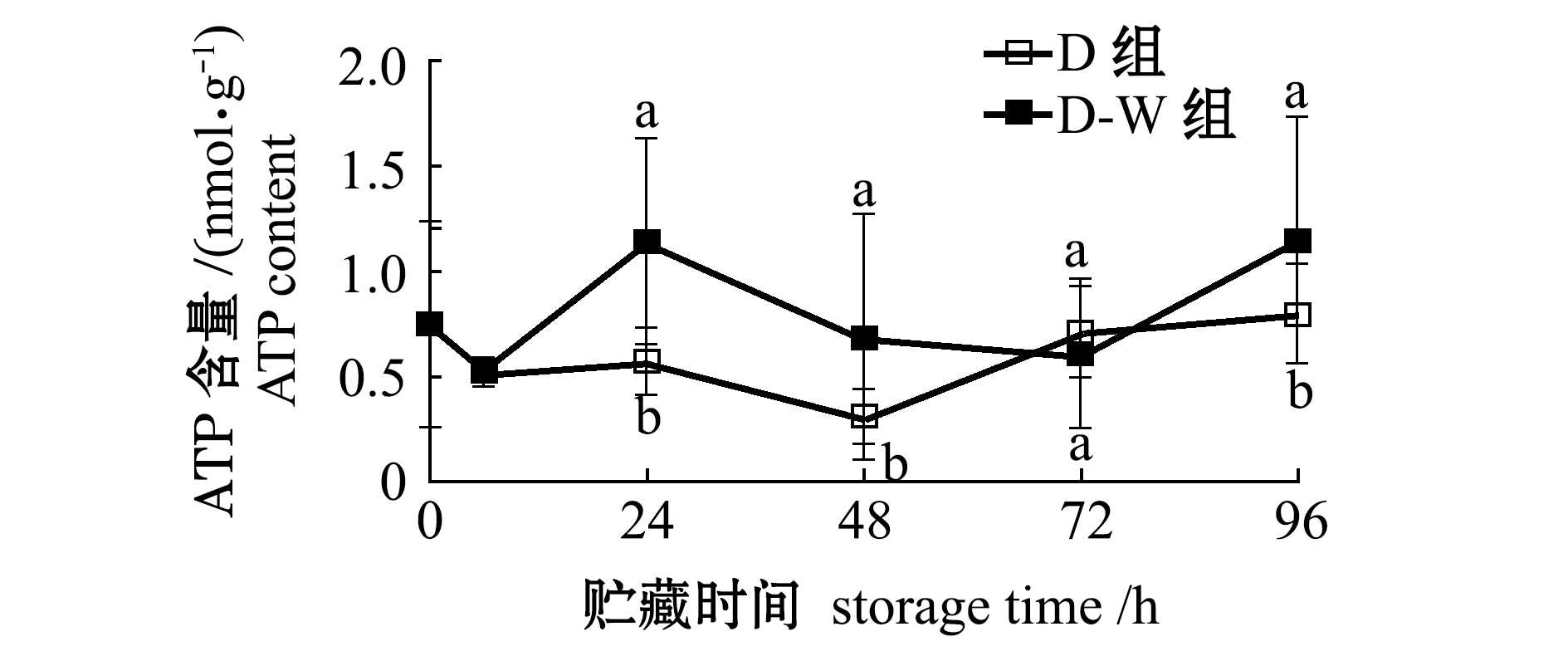
图6 干藏及复水对太平洋牡蛎闭壳肌中ATP的影响
Fig.6 Effect of air exposure storing and re-water on ATP contents in adductor of Pacific oyster Crassostrea gigas
2.2.5 AEC值和K值的变化 以AEC值和K值为指标对太平洋牡蛎捕后各阶段品质进行评价,结果如图7所示。从图7可见:太平洋牡蛎离水时刻(0 h)和抵达实验室时刻(6 h)闭壳肌AEC值均在63%左右,干藏期间的复水处理(D-W组)能提高AEC值;D组K值随着干藏时间的延长有明显升高,而增加复水处理能保证K值一直维持在较低水平。这进一步证明,干藏过程中复水处理对捕后的贮藏非常必要。
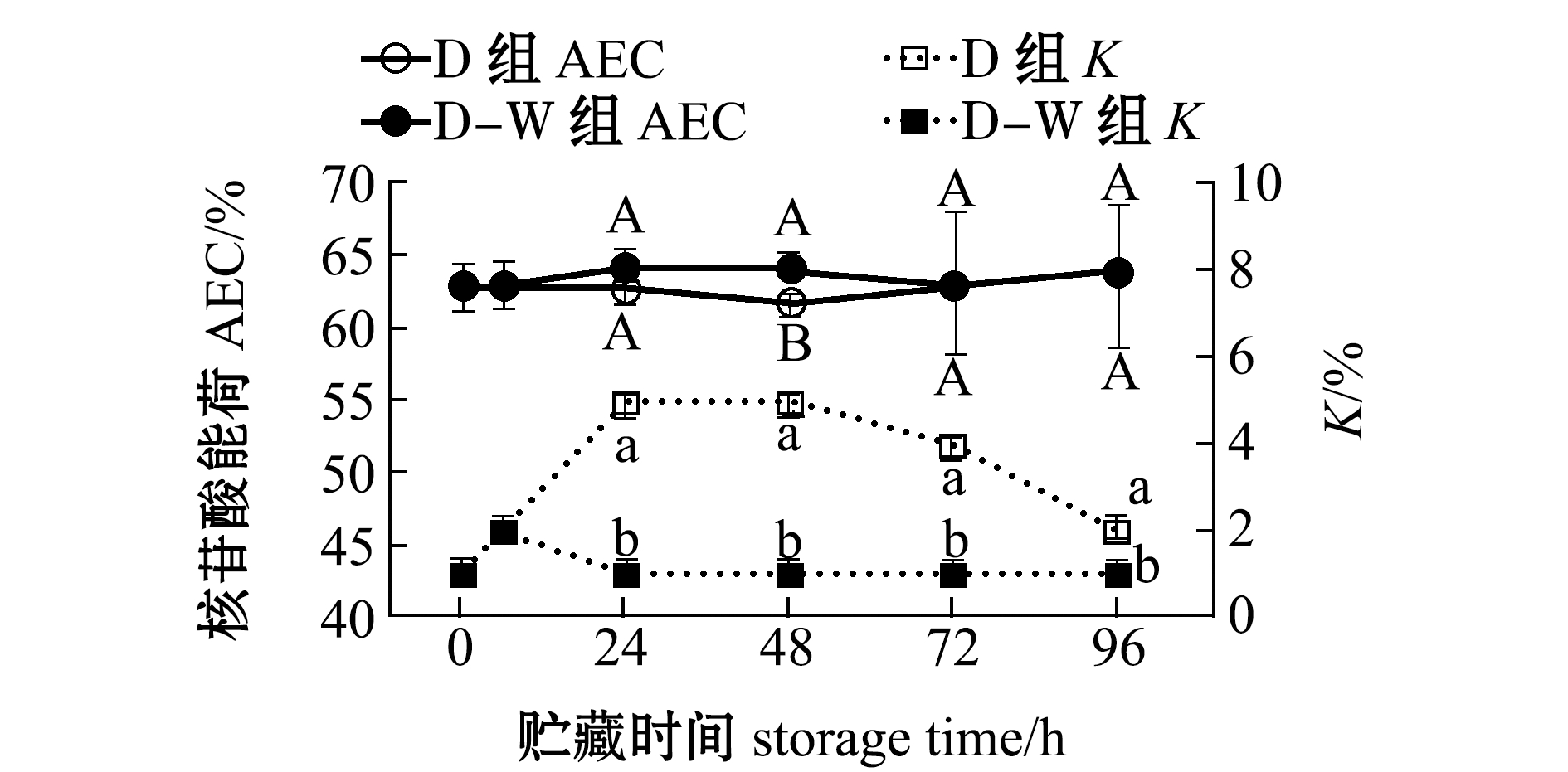
图7 干藏及复水对太平洋牡蛎闭壳肌中AEC值的影响
Fig.7 Effect of air exposure storing and re-water on AEC value of Pacific oyster Crassostrea gigas
2.2.6 pH值的变化 太平洋牡蛎闭壳肌中pH的变化情况如图8所示,其中,太平洋牡蛎离水时刻(0 h)pH值为6.8,抵达实验室(6 h)时pH值为6.7,贮藏96 h时D组呈现明显下降趋势,pH值降至6.49,而D-W组则延缓了pH的下降过程。
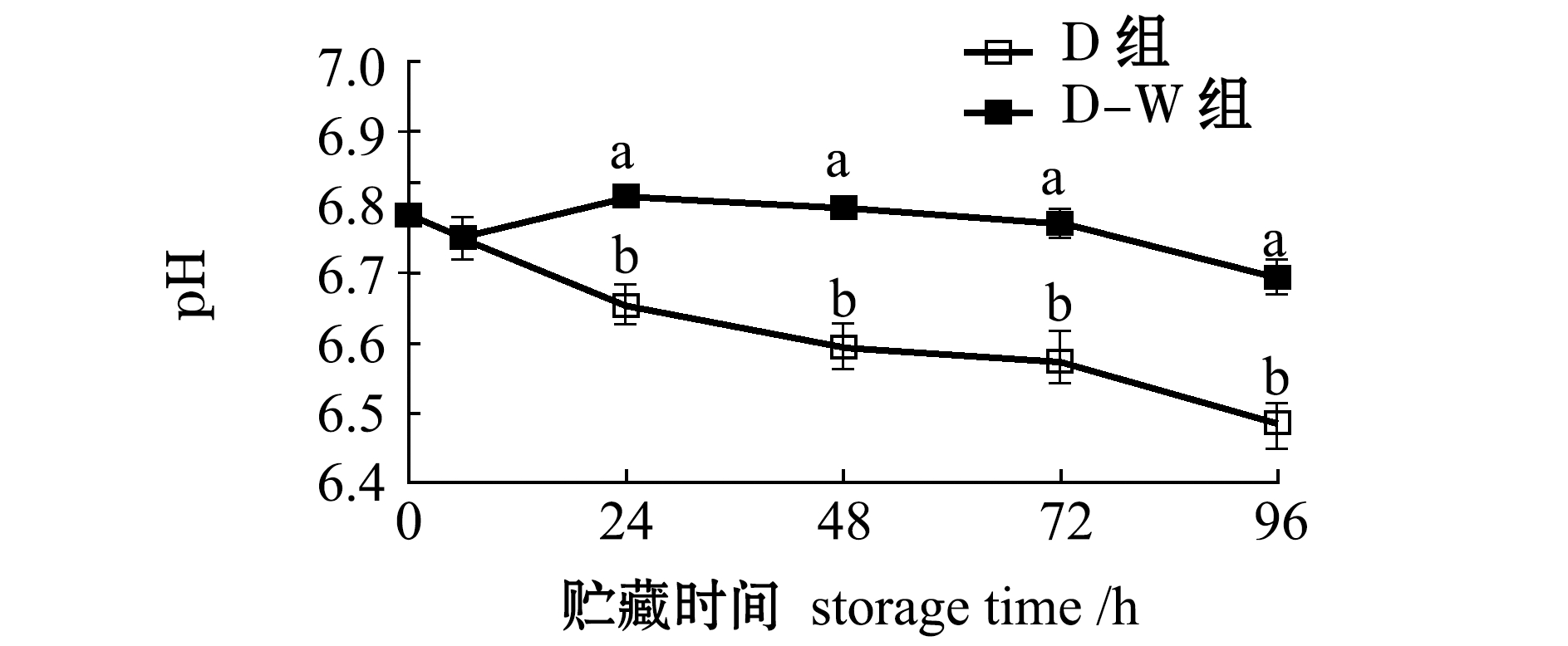
图8 干藏及复水对太平洋牡蛎pH的影响
Fig.8 Effect of air exposure storing and re-water on pH value of Pacific oyster Crassostrea gigas
3 讨论
3.1 淡水冰对牡蛎活品贮藏稳定性的影响
本研究中,太平洋牡蛎中软体部分占总质量的12.3%,体腔液占总质量的10.7%。体腔液在活品中占有较大比重,对于活品的干藏耐受时间及品质有较大影响。在干藏过程中增加复水处理,能提高蛋白质含量稳定性。本试验中,运输过程(0~6 h)中太平洋牡蛎软体组织中甘油三酯和糖原含量出现快速下降,分析是由于运输中泡沫箱中添加淡水冰的渗透压对牡蛎产生了较大影响。杨凤等[15]研究表明,淡水冰的盐度过低对牡蛎有致命的作用。在运输过程中淡水进入牡蛎体内使牡蛎能量物质降低。抵达实验室后,对牡蛎进行海水处理后,在后期干藏贮藏过程中(6~24 h)甘油三酯、糖原的含量均出现恢复趋势,分析可能是由于淡水胁迫得到解除,能量物质含量会得到部分恢复。由此可知,产业流通过程中使用淡水冰降温的方式虽然降低了成本,但是对品质产生了较大的影响。
3.2 干藏-复水处理对太平洋牡蛎生化特性的影响
杨婷婷等[16]、张智翠[17]的研究表明,在贮藏过程中糖原含量有所升高,这是由于饥饿过程中,消耗糖原的同时伴随着脂肪酸和氨基酸的糖异生反应。本研究中,采捕后的牡蛎活品经6 h运抵实验室用海水处理后,在继续干藏贮藏(24~96 h)的过程中,糖原和甘油三酯含量出现缓慢下降趋势,分析是由于缺少能量物质补充;但在干藏过程中增加复水处理,能减少贮藏过程中排泄的氨氮等物质的胁迫[18-19],故糖原和甘油三酯含量变化趋势更加平稳,这提示长距离的运输可能更有利。
闭壳肌和外套膜作为主要的运动器官,其中ATP含量较高。为得到牡蛎最初始的状态信息,在采捕船上进行了取样,闭壳肌中的ATP含量仅为0.76 nmol/g,Kawabe等[7]的研究中,牡蛎在冬季ATP含量为3.0 nmol/g左右,刘金洋等[20]研究中扇贝ATP含量为4.5 nmol/g,刘慧慧等[21]研究中菲律宾蛤仔ATP含量为1.5 nmol/g。本研究中ATP含量偏低,可能与牡蛎附着生活的习性有关。本研究中干藏组和干藏-复水组AEC值均为0.50~0.75,皆处于缓慢生长不能繁殖状态[22],该状态的牡蛎活品贮藏性较差。两组K值均在1%~6%之间,但干藏-复水较干藏的牡蛎鲜度更高。
4 结论
在牡蛎活品流通过程中,采捕后的前期处理不当对品质会产生较大影响。如淡水冰会导致糖原、甘油三酯等能量物质大量消耗。干藏过程中适当增加复水处理,能有效减少糖原、甘油三酯、ATP、AEC及pH等指标波动,可提高活品贮藏稳定性。
[1] 农业部渔业渔政管理局.2018中国渔业统计年鉴[M].北京:中国农业出版社,2018:21-23.
[2] 于瑞海,李琪,王照萍,等.我国北方太平洋牡蛎育苗及养殖现状[J].科学养鱼,2008(6):3-5.
[3] Duncan P F.Post-harvest physiology of the scallop Pecten maximus (L.)[D].Glasgow:University of Glasgow,1993:18-47.
[4] 杨婷婷,刘俊荣,沈建,等.活品底播虾夷扇贝(Patinopecten yessoensis)感官评价描述词的建立[J].食品科学,2014,35(19):16-22.
[5] Albentosa M,Fernández-Reiriz M J,Labarta U,et al.Response of two species of clams,Ruditapes decussatus and Venerupis pullastra,to starvation:physiological and biochemical parameters[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2007,146(2):241-249.
[6] Anacleto P,Maulvault A L,Barrento S,et al.Physiological responses to depuration and transport of native and exotic clams at different temperatures[J].Aquaculture,2013,408-409:136-146.
[7] Kawabe S,Takada M,Shibuya R,et al.Biochemical changes in oyster tissues and hemolymph during long-term air exposure[J].Fisheries Science,2010,76(5):841-855.
[8] Hu Xiaopei,Mallikarjunan P K,Vaughan D.Development of non-destructive methods to evaluate oyster quality by electronic nose technology[J].Sensing and Instrumentation for Food Quality and Safety,2008,2(1):51-57.
[9] 郑尧,刘俊荣,周晏琳,等.捕后虾夷扇贝闭壳肌免疫因子与活品品质评价初探[J].大连海洋大学学报,2017,32(2):217-223.
[10] Cao Rong,Xue Changhu,Liu Qi.Changes in microbial flora of Pacific oyster (Crassostrea gigas) during refrigerated storage and its shelf-life extension by chitosan[J].International Journal of Food Microbiology,2009,131(2-3):272-276.
[11] Hu Yaqin,Zhang Jiaqi,Ebitani K,et al.Development of simplified method for extracting ATP-related compounds from fish meat[J].Nippon Suisan Gakkaishi,2013,79(2):219-225.
[12] Atkinson D E.Energy charge of the adenylate pool as a regulatory parameter.Interaction with feedback modifiers[J].Biochemistry,1968,7(11):4030-4034.
[13] Pacheco-Aguilar R,Marquez-Ríos E,Lugo-Sánchez M E,et al.Postmortem changes in the adductor muscle of Pacific lions-paw scallop (Nodipecten subnodosus) during ice storage[J].Food Chemistry,2008,106(1):253-259.
[14] 田元勇,刘金洋,刘慧慧.捕后暂养对虾夷扇贝闭壳肌硬化的影响[J].水产学报,2017(6):888-895.
[15] 杨凤,谭文明,闫喜武.干露及淡水浸泡对菲律宾蛤仔稚贝生长和存活的影响[J].水产科学,2012,31(3):143-146.
[16] 杨婷婷,刘俊荣,俞微微,等.活品流通过程中虾夷扇贝风味品质的变化[J].水产学报,2015,39(1):136-146.
[17] 张智翠.太平洋牡蛎品质的季节性变化及贮藏过程中的生化变化[D].青岛:中国海洋大学,2006.
[18] Fitt W K,Coon S L.Evidence for ammonia as a natural cue for recruitment of oyster larvae to oyster beds in a Georgia salt marsh[J].Biological Bulletin,1992,182(3):401-408.
[19] 黄鹤忠,陈金凤,徐汗富,等.氨氮浓度对文蛤的能量代谢及死亡率的影响[C]//2009年全国海水养殖学术研讨会论文集.连云港:中国水产学会,2009.
[20] 刘金洋,刘俊荣,田元勇,等.捕后处置对活品底播虾夷扇贝生化代谢的影响[J].水产学报,2017,41(1):81-87.
[21] 刘慧慧,周晏琳,张晴,等.菲律宾蛤仔捕后干露处置对其复水湿藏稳定性的影响[J].大连海洋大学学报,2018,33(2):244-250.
[22] Picado A,Le Gal Y.Adenylate energy charge as a tool for evaluating sub-lethal toxicity[J].Qatar University Science Journal,1999,19:36-45.