超声波在复杂的水体环境中具有衰减慢和传播距离远的特点,因此,超声波生物遥测技术逐渐成为水下生物行为学研究的主要方法之一。1956年,美国首次通过超声波遥测对鱼类进行跟踪研究[1]。1970年前,超声波生物遥测技术的超声波信标(以下简称信标)受限于电池的续航能力问题,无法实现长期监测,随着科技的发展、电池技术的革新,长时间、大范围监测目标鱼的行为特征已成为可能[2]。目前,该技术主要用于研究鱼类的昼夜运动习性[3]、洄游路线[4]、产卵地变迁[5]等。中国也开始将该技术应用于珍稀鱼类的资源保护[6]及增殖放流鱼类在人工鱼礁的分布情况[7]等。超声波生物遥测技术,在信标植入或标记过程中需要对鱼体进行微创手术,因此,对鱼体产生的负面影响通常与试验鱼的体长、体质量等密切相关[8]。中国有关超声波信标植入对试验鱼负面影响的研究较为匮乏,关于植入后的生物“福利”问题还需进一步研究。目前,常见的信标植入方法有体外悬挂法、胃部植入法和外科手术体内植入法,目标对象种类、体型和体长不同会导致标记方法的差异性[9]。由于信标植入过程中鱼体需要麻醉才能进行手术,因此,选择快速、便捷的手术设备不仅能够降低手术时间,还可以减少麻醉剂所带来的负面影响。而手术缝合器(以下简称缝合器)体积小、操作方便,已广泛应用于不同部位的手术切口缝合[10]。后期临床研究表明,缝合器在切口缝合方面能够有效减少缝合时间和缝合后的红肿情况[11]。但目前有关缝合器用于鱼类微创切口的缝合尚未见报道,使用缝合器对切口进行缝合是否会影响鱼类的运动能力、存活率等还需进一步研究。
鱼类游泳能力作为主要的运动能力,与其摄食、洄游和躲避敌害等方面息息相关。传统上可将鱼类游泳能力分为有氧运动和无氧运动[12]。鱼类游泳能力评价指标多样,而临界游泳速度作为耐久游泳速度和持续游泳速度的分界[13],是鱼类最大的有氧运动游泳速度,常作为不同影响因子对鱼类游泳能力研究的指标之一[14]。为此,本研究中以绝对临界游泳速度作为鱼类运动行为的评估依据。
鲫Carassius auratus Linnaeus是中国重要淡水经济鱼类[15],为研究手术植入超声波信标对鱼体的负面影响,本试验中使用手术缝合器在信标植入鲫体后进行缝合,通过观察伤口愈合情况及测定鱼的游泳速度变化情况,分析手术植入超声波信标对鲫的影响,为鲫在野外环境的昼夜运动跟踪提供可行性分析,同时也为超声波生物遥测目标对象的选择及手术缝合器的推广提供数据参考。
1 材料与方法
1.1 材料
试验用鲫购自大连市某鲫养殖基地,筛选体长约为20 cm且体表无损伤的鲫作为试验对象,测量其体长、体质量数据后,置于水槽(3 m×2 m×1.5 m)中暂养,每天投喂专用饲料并于试验前24 h停止投喂。每天中午进行换水,更换现有水量的1/2,每次换水前吸除底部粪便,每天记录水温及试验鱼的死亡情况。
1.2 方法
1.2.1 试验设计 暂养2 d后选取15尾活泼健康的试验鱼,试验设置3组,每组5尾鱼。其中,对照组未进行信标植入;虚假组手术后不植入信标,使用缝合器缝合;信标组进行信标植入手术,使用缝合器缝合。最后,在术后2 h、1 d、3 d和7 d不同恢复时间对各组鱼分别进行绝对临界游泳速度测量和计算,同时记录试验鱼切口恢复情况。
1.2.2 超声波信标植入及手术步骤 试验用信标(FPX-1030)购自日本FUSION公司,发射频率为60 kHz,外观全长为35 mm,直径为10 mm,在空气中质量为5 g,在水中质量为2.8 g。发射频率为60 kHz,发射声压级为155 dB(re 1 μPa)。脉冲发射间隔可进行自主设置,其电池寿命最短为2 d,最长为7 d。
在手术植入前,手术设备进行消毒处理,信标经过75%酒精浸泡清洗消毒后,再使用蒸馏水进行冲洗,以减少植入后对鲫体壁产生不良刺激。手术步骤:选择一尾无损伤的鲫进行手术植入,使用MS-222(120 mg/L)对试验鱼进行麻醉处理,参照官曙光等[16]对鱼类麻醉程度分期,使试验鱼处于深度麻醉期。测量其体长、体质量后,将试验鱼腹部朝上安置于“V”形自制手术操作台中,确认信标植入的位置,拔除附近鳞片便于手术切开及后期缝合,手术植入方式参照Moore等[17]的方法,使用手术刀在试验鱼腹部泄殖孔前端1~2 cm处切开一个约为2 cm的切口,将信标从切口中植入,然后使用缝合器(P-PF 35W,普瑞德,中国)对切口进行缝合,缝合2 cm切口需要2枚缝合钉方可保持切口闭合。缝合后使用红霉素药膏对切口进行消毒,放入富氧水槽进行苏醒,恢复后放回原暂养水槽中。整个手术缝合时间需要在45 s内完成。
1.2.3 游泳能力测试装置 使用自制的水平Steffensen式[18]鱼类游泳能力测定水槽,水槽装置主要包括变频器、发动机、螺旋桨和游泳观察室。其工作原理为通过变频器调节频率改变发动机转速从而改变水流速度,通过流速计(FLOWATCH,瑞士)实时测量多孔整流栅整流后游泳室切面的水流速度。环形水槽规格为120 cm×65 cm×25 cm;多孔整流栅为聚乙烯材质,孔径为1 mm;发动机功率1.5 kW(YH90L-4,红旗,中国);游泳室(70 cm×20 cm×20 cm)使用亚克力板组成。
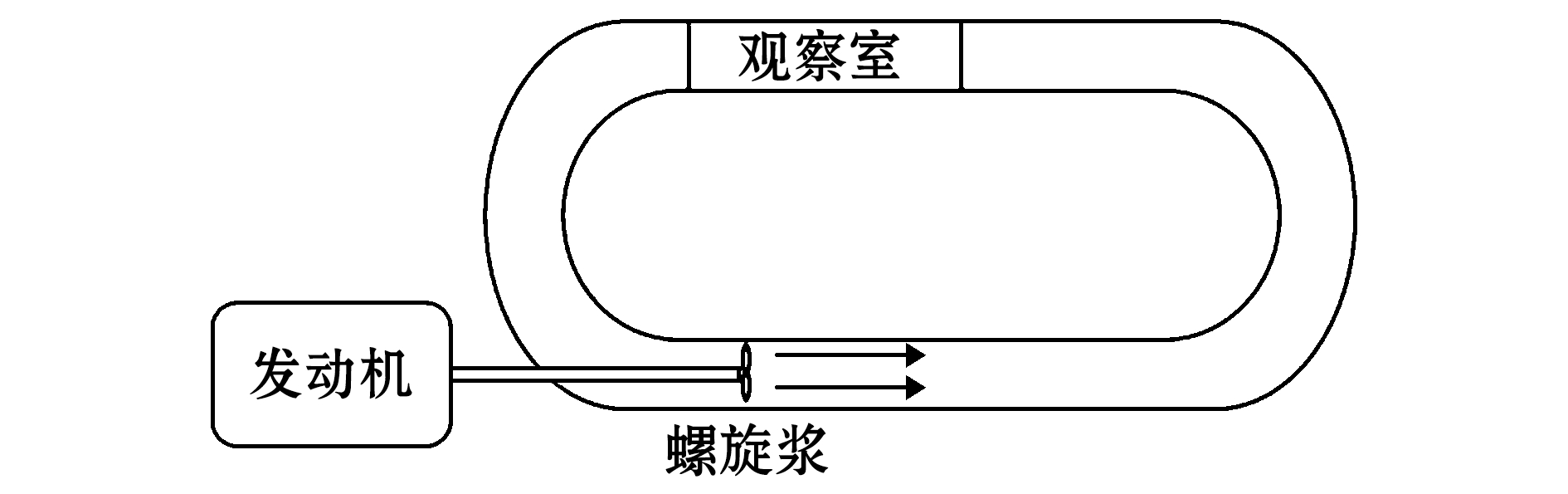
图1 游泳能力测试水槽
Fig.1 Test tank of swimming performance
1.2.4 绝对临界游泳速度的测量与计算 针对本次使用信标电池的寿命,分别对对照组、虚假组和信标组信标植入后2 h、1 d、3 d和7 d时试验鱼的绝对临界游泳速度进行测量。
绝对临界游泳速度测量方法:将试验鱼放入游泳室中,在7.6 cm/s低流速下适应1 h,改变变频器数值为10 Hz,此时流速为13.2 cm/s,确定此时为试验开始的时间。试验鱼在此流速下进行10 min的测量后,将水流流速提高4 cm/s,继续进行试验,如果试验鱼可持续游泳10 min,继续提高流速,直至试验鱼处于疲劳状态,停止游泳,记录此时试验鱼游泳结束的时间。试验鱼疲劳判定标准为试验鱼无法进行游泳行为,并停止于游泳室末端拦网上20 s以上[19]。
绝对临界游泳速度的计算:根据下式[18]计算试验鱼的绝对临界游泳速度:
vcrit=v1+(t1/t2)×v2。
其中:vcrit为试验鱼绝对临界游泳速度(cm/s);v1为鱼持续10 min时的最高水流速度(cm/s);v2为水流速度增量(4 cm/s);t1为试验鱼处于最大流速时的游泳时间(min);t2为时间间隔(10 min)。
1.2.5 切口评估 使用缝合器对切口进行缝合后,在信标植入7 d后对切口进行评估,以评价缝合器应用于鱼类切口缝合的可行性。将试验鱼进行麻醉处理后,使其腹部朝上,安置于“V”形水槽中,对其腹部的切口进行观察并记录。参照Deters等[20]对不同类型缝合线缝合切口的评估方法,根据缝合钉的保留情况,将其分为三级,Ⅰ级切口两个缝合钉脱落,Ⅱ级切口一个缝合钉脱落,Ⅲ级切口无缝合钉脱落。
此外,参照![]() ński等[21]方法对切口外部情况的评估,根据切口外部情况将其分为四级,Ⅰ级为切口清洁,Ⅱ级为部分红肿,Ⅲ级为发炎,Ⅳ级为感染、坏死。
ński等[21]方法对切口外部情况的评估,根据切口外部情况将其分为四级,Ⅰ级为切口清洁,Ⅱ级为部分红肿,Ⅲ级为发炎,Ⅳ级为感染、坏死。
1.3 数据处理
试验数据采用SPSS 17.0软件进行统计分析,对不同组的绝对临界游泳速度的测量值采用单因素协方差进行分析。
2 结果与分析
2.1 手术植入超声波信标对鲫存活的影响
试验鱼麻醉后测量其体长和体质量数据,信标组植入信标后计算信标与体质量比,测量结果如表1所示。在整个试验周期内,未发现鱼死亡的情况,此外,在7 d的试验中,无信标通过切口排出体外。这表明,手术植入信标不会对试验鱼产生致死性影响。
表1 试验鱼的体质量、体长及信标与体质量比
Tab.1 Body weight,body length and ratio of pinger to body weight in the test fish
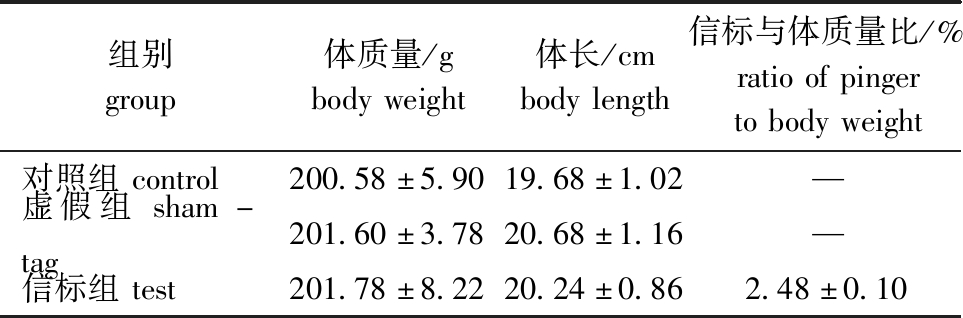
组别group体质量/gbodyweight体长/cmbodylength信标与体质量比/%ratioofpingertobodyweight对照组control200.58±5.9019.68±1.02—虚假组sham-tag201.60±3.7820.68±1.16—信标组test201.78±8.2220.24±0.862.48±0.10
2.2 缝合器缝合对切口愈合的影响
为研究缝合器缝合对切口产生的负面影响,对使用缝合器缝合切口的虚假组和信标组切口情况进行统计。在术后第7天,将试验鱼麻醉后对切口的状态进行观察。结果表明(表2):在为期7 d的试验中,用缝合器缝合的切口中有9尾鱼未出现缝合钉脱落情况,1尾鱼出现1枚缝合钉脱落,缝合钉保留率为95%;10尾试验鱼中,有3尾鱼切口部位出现红肿,7尾鱼保持切口清洁,未出现切口坏死和发炎的情况。
2.3 手术植入信标对鲫绝对临界游泳速度的影响
对不同恢复时间(2 h、1 d、3 d和7 d)试验鱼绝对临界游泳速度进行测量和计算,结果表明(图2):在植入信标2 h后,虚假组和信标组绝对临界游泳速度较对照组显著降低(P<0.05),其中信标组下降了14.06%;术后1 d,信标组绝对临界游泳速度恢复到(80.58±3.64)cm/s;术后3~7 d,各组鱼游泳速度无显著性差异(P>0.05)。
表2 缝合钉的脱落情况和切口的外部状态
Tab.2 Sutural nail retention and post-implantation incision situation
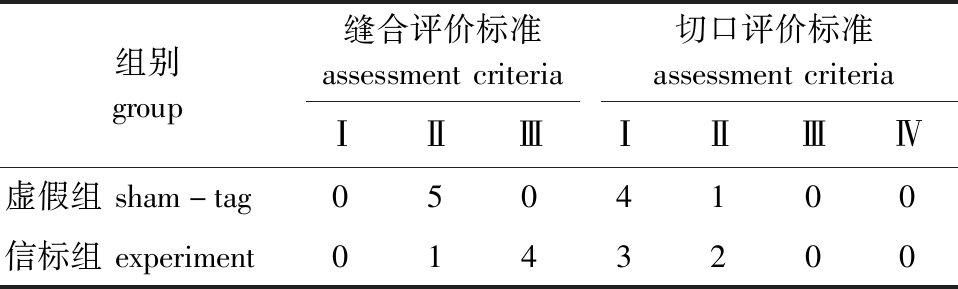
组别group缝合评价标准assessmentcriteria切口评价标准assessmentcriteriaⅠⅡⅢⅠⅡⅢⅣ虚假组sham-tag0504100信标组experiment0143200
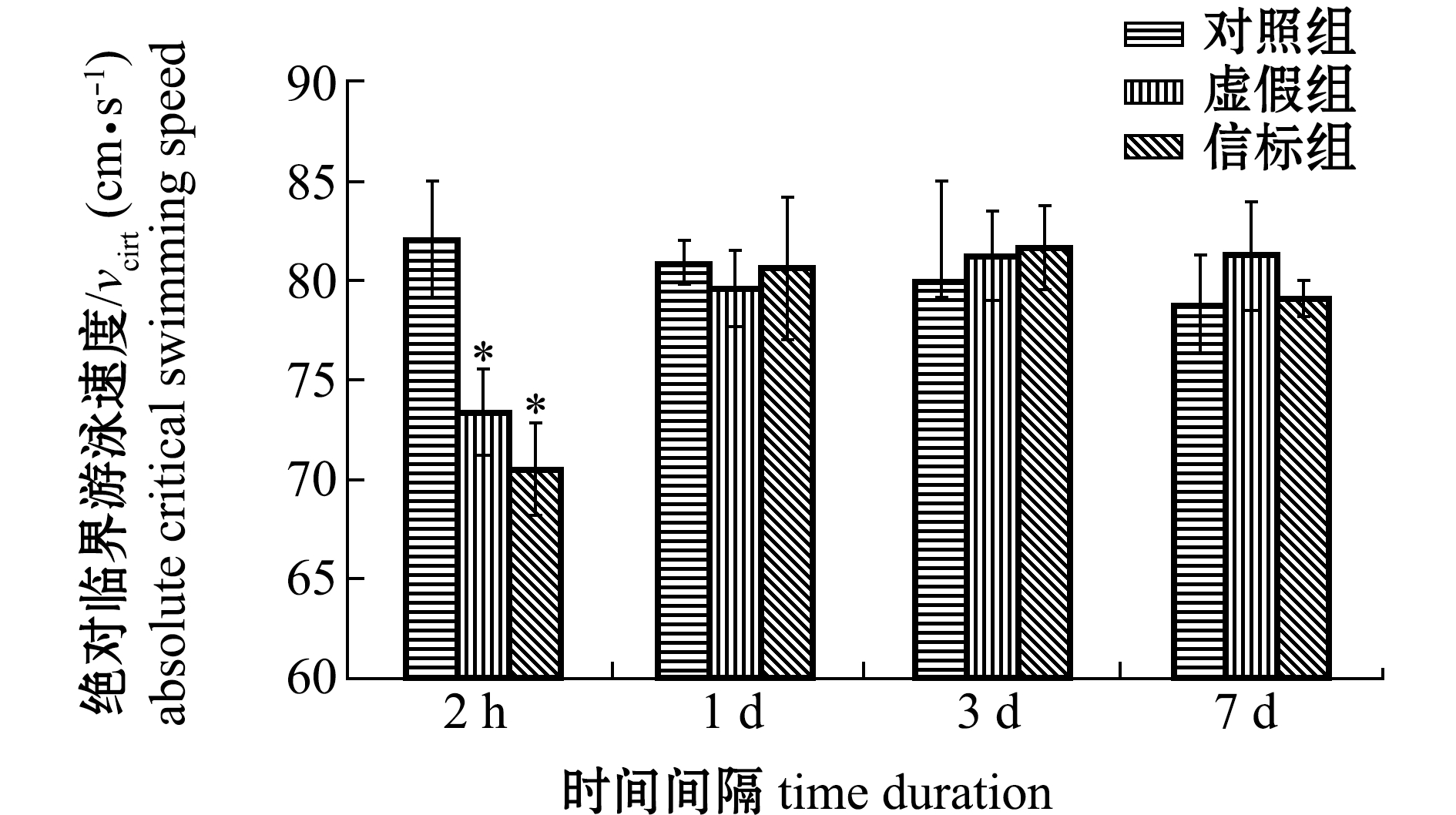
图2 术后不同恢复时间的绝对临界游泳速度
Fig.2 Absolute critical swimming speed of the experimental fish at different recovery time
3 讨论
3.1 超声波信标植入对鲫鱼游泳能力的影响
超声波生物遥测技术需要在试验鱼的腹部中线切开一个约为2 cm的切口后,方可植入信标。根据俞立雄等[22]的研究,切口需要经过7 d的时间才能愈合,与本次试验观察结果相似。信标植入鱼体后,可能导致试验鱼产生不适感而影响鱼的行为能力[23],本试验表明,植入信标后2 h鲫的绝对临界游泳速度降低,在植入后1 d恢复到(80.58±3.64)cm/s,其结果与俞立雄等[22]在草鱼的超声波标志试验中结果相似。Adams等[24]测量了两种不同体长的大鳞大马哈鱼Oncorhynchus tshawytscha体内植入信标的游泳能力,结果表明,叉长大于120 mm的试验鱼植入信标后具有较为优秀的游泳能力,这可能是因为体长大的鱼类在植入信标后需要耗费较小的能量来适应植入信标带来的不适感,并提出大鳞大马哈鱼植入信标的合适叉长应大于120 mm。不同体长的试验鱼对信标的适应性不同,在未来超声波遥测试验研究中,应针对鱼体实际体长、体质量而选择植入不同类型的信标,以保证遥测结果的科学性和准确性。
3.2 信标标记方法对鱼类游泳能力的影响
鲫体型呈纺锤形,本试验中鲫体长平均为20.24 cm,体质量平均为201.78 g,因此,使用外科手术体内植入信标的方法。Makiguchi等[25]以樱鳟Oncorhynchus masou为研究对象,比较了体外悬挂和外科手术体内植入信标在游泳能力方面的不同,结果表明,体外悬挂的方法会导致樱鳟游泳能力降低。Adams等[24]比较了体内植入和胃部植入对大鳞大马哈鱼的影响,结果表明,在大于21 d的超声波生物遥测研究中,大鳞大马哈鱼应用体外植入超声波标记的方法较优,短期行为研究中,胃部植入的方法更佳。这可能是因为外科手术产生的微创切口需要试验鱼一段时间进行自愈,恢复切口产生的负面影响,这也印证了本次通过外科手术植入标记信标2 h后,鲫绝对临界游泳速度降低的问题。因此,针对不同标记鱼的种类、体型、体长和体质量等特征而选择不同的标记方法,从而将信标植入对试验鱼产生的负面影响降到最低。
3.3 缝合器在鱼类微创切口缝合的优势
通过人类临床观察表明,缝合器能够有效减少缝合时间,缓解缝合后的疼痛感和切口发炎的情况[11]。目前,缝合器已经广泛应用于人体皮肤缝合[9]。通过外科手术植入信标需要对试验鱼进行外科手术,因此,在野外环境中,安全卫生、快速便捷的缝合工具及缝合方法能够有效减少手术时间,加快试验鱼术后恢复时间,提高超声波生物遥测的科学性和准确性。传统的外科手术植入方法多使用可吸收和不可吸收纤维线进行切口的缝合,Deters等[20]使用不同材料的可吸收和不可吸收纤维线缝合切口,并在术后比较了不同方法的切口开放性、发炎等情况,结果表明,不可吸收缝合线缝合的切口在后期引发伤口发炎和溃烂的程度较低。本试验表明,使用缝合器缝合能够保持切口的密闭性,并且在一周的时间内不会发生伤口的坏死和溃烂。试验鱼生活的水环境复杂多样,使用可吸收纤维线进行切口缝合时,在遥测过程中无法确认缝合线吸收时间和伤口愈合时间的前后关系,缝合线过早地吸收脱落会导致切口裂开,从而导致试验鱼死![]() ński等[21]在对鲈梭鱼进行信标标记时,使用了生物黏合剂进行缝合,但是切口在后期愈合情况较差,主要体现在切口开放性问题。此外,使用缝合器缝合的整个手术时间约为40 s左右,相比传统的缝合方式节省约1 min[23],降低了手术缝合的时间,并且操作简单,不需要经过复杂的缝合手法练习。因此,在未来的鱼类微创手术过程中,缝合器的使用能够保持切口密闭且减少缝合的时间,降低使用麻醉剂带来的负面影响。因此,在未来的研究中将对使用缝合器缝合的试验鱼进行更长时间观察,以期更好地评估缝合器应用于水生生物的优劣性。
ński等[21]在对鲈梭鱼进行信标标记时,使用了生物黏合剂进行缝合,但是切口在后期愈合情况较差,主要体现在切口开放性问题。此外,使用缝合器缝合的整个手术时间约为40 s左右,相比传统的缝合方式节省约1 min[23],降低了手术缝合的时间,并且操作简单,不需要经过复杂的缝合手法练习。因此,在未来的鱼类微创手术过程中,缝合器的使用能够保持切口密闭且减少缝合的时间,降低使用麻醉剂带来的负面影响。因此,在未来的研究中将对使用缝合器缝合的试验鱼进行更长时间观察,以期更好地评估缝合器应用于水生生物的优劣性。
4 结论
从试验结果来看,外科手术植入超声波信标会降低鲫早期的游泳能力,其临界游泳能力在植入信标1 d后恢复到正常的水平。因此,在进行超声波生物遥测的研究中,试验鱼应考虑暂养2 h后方可将其释放。此外,使用缝合器对切口进行缝合在7 d的观察试验中未发现切口坏死情况,这为缝合器应用于鱼类微创手术切口的缝合提供了可能性。
[1] 刘景,汤勇,邢彬彬,等.超声波生物遥测技术及其在现代渔业中的应用[J].渔业现代化,2018,45(5):75-80.
[2] 王成友,危起伟,杜浩,等.超声波遥测在水生动物生态学研究中的应用[J].生态学杂志,2010,29(11):2286-2292.
[3] Tang Y,Lin D,Zhang G,et al.Testing the tracking of behaviour of a caged Takifugu rubripes(Temminck & Schlegel,1850) using acoustic telemetry[J].Journal of Applied Ichthyology,2013,29(6):1456-1458.
[4] Burrell K H,Isely J J,Bunnell Jr D B,et al.Seasonal movement of brown trout in a southern Appalachian River[J].Transactions of the American Fisheries Society,2000,129(6):1373-1379.
[5] Kaseloo P A,Weatherley A H,LotimerJ,et al.A biotelemetry system recording fish activity[J].Journal of Fish Biology,1992,40(2):165-179.
[6] 危起伟,杨德国,柯福恩,等.长江中华鲟超声波遥测技术[J].水产学报,1998,22(3):211-217.
[7] 王志超,陈国宝,曾雷.基于声学标志和无线跟踪方法的鱼类行为研究[J].南方水产科学,2018,14(2):51-59.
[8] Jepsen N,Koed A,Thorstad E B,et al.Surgical implantation of telemetry transmitters in fish:how much have we learned?[J].Hydrobiologia,2002,483(1-3):239-248.
[9] Bridger C J,Booth R K.The effects of biotelemetry transmitter presence and attachment procedures on fish physiology and behavior[J].Reviews in Fisheries Science,2003,11(1):13-34.
[10] 牛春波,龚纯贵.试论手术用缝合器的发展及应用[J].当代医学,2016,22(22):5-7.
[11] 于迪迪.一次性皮肤缝合器在外科手术中的应用观察[J].实用临床护理学电子杂志,2017,2(12):104.
[12] 王萍,桂福坤,吴常文.鱼类游泳速度分类方法的探讨[J].中国水产科学,2010,17(5):1137-1146.
[13] 于晓明,张秀梅.鱼类游泳能力测定方法的研究进展[J].南方水产科学,2011,7(4):76-84.
[14] Hammer C.Fatigue and exercise tests with fish[J].Comparative Biochemistry and Physiology Part A:Physiology,1995,112(1):1-20.
[15] 康淑媛,王荻,卢彤岩.大蒜素对鲫非特异免疫指标影响的研究[J].大连海洋大学学报,2016,31(2):168-173.
[16] 官曙光,关健,刘洪军,等.MS-222麻醉许氏平鲉幼鱼的初步研究[J].海洋科学,2011,35(5):100-105.
[17] Moore A,Russell I C,Potter E C E.The effects of intraperitoneally implanted dummy acoustic transmitters on the behaviour and physiology of juvenile Atlantic salmon,Salmo salar L.[J].Journal of Fish Biology,1990,37(5):713-721.
[18] 于晓明,崔闻达,陈雷,等.水温、盐度和溶氧对红鳍东方鲀幼鱼游泳能力的影响[J].中国水产科学,2017,24(3):543-549.
[19] Lee C G,Farrell A P,Lotto A,et al.The effect of temperature on swimming performance and oxygen consumption in adult sockeye (Oncorhynchus nerka) and coho (O.kisutch) salmon stocks[J].Journal of Experimental Biology,2003,206(18):3239-3251.
[20] Deters K A,Brown R S,Carter K M,et al.Performance assessment of suture type,water temperature,and surgeon skill in juvenile chinook salmon surgically implanted with acoustic transmitters[J].Transactions of the American Fisheries Society,2010,139(6):888-899.
![]() ński M,Kapusta
ński M,Kapusta ![]() K,et al.The effects of surgically implanted dummy tags on the survival,growth performance,and physiology of pikeperch (Sander lucioperca)[J].Fish Physiology and Biochemistry,2017,43(4):999-1010.
K,et al.The effects of surgically implanted dummy tags on the survival,growth performance,and physiology of pikeperch (Sander lucioperca)[J].Fish Physiology and Biochemistry,2017,43(4):999-1010.
[22] 俞立雄,段辛斌,陈大庆,等.5种鱼类标志对草鱼临界游泳速度的影响[J].中国水产科学,2017,24(3):550-557.
[23] Smircich M G,Kelly J T.Extending the 2% rule:the effects of heavy internal tags on stress physiology,swimming performance,and growth in brook trout[J].Animal Biotelemetry,2014,2(1):16.
[24] Adams N S,Rondorf D W,Evans S D,et al.Effects of surgically and gastrically implanted radio transmitters on swimming performance and predator avoidance of juvenile chinook salmon (Oncorhynchus tshawytscha)[J].Canadian Journal of Fisheries and Aquatic Sciences,1998,55(4):781-787.
[25] Makiguchi Y,Ueda H.Effects of external and surgically implanted dummy radio transmitters on mortality,swimming performance and physiological status of juvenile masu salmon Oncorhynchus masou[J].Journal of Fish Biology,2009,74(1):304-311.