中间球海胆Strongylocentrotus intermedius又称虾夷马粪海胆,隶属于棘皮动物门Echinodermata海胆纲Echinoidea正形目Centrochinoidea球海胆科Strongylocentrotidae[1],原产于日本北方和俄罗斯远东等沿海区域,其性腺品质良好,生长速度快,在国际市场上广受欢迎,是海胆类中经济价值较高的种类之一。1989年,大连海洋大学将该种从日本引入中国,展开了中间球海胆的人工增养殖研究[2-4]。近年来,随着人们生活水平的提高,海胆的市场需求不断增加。目前,中国每年的苗种生产量已达亿枚以上,中间球海胆已成为中国主要的海胆养殖种类。然而,由于中间球海胆为冷水种,其海区增养殖和工厂化苗种暂养的成活率受到夏季海水高温的影响严重,海胆大规模死亡、幼苗活力下降等问题时有发生[2,5], 不耐受夏季高温已成为制约中间球海胆养殖业健康可持续发展的瓶颈。因此,改良海胆种质、培育耐高温的海胆品种,对中间球海胆增养殖业的持续健康发展极为重要。
远缘杂交是一种快速培育抗逆品种的动植物育种方法,用于远缘杂交的亲本往往需在同一性状上具备互补的优势,而杂交后代则被期望兼具父母本在该性状上的优点。在水产动物抗逆品种培育研究中,远缘杂交技术得到了较为广泛的应用。王楚松等[6]和林勇等[7]利用尼罗罗非鱼Oreochromis niloticus(♀)与奥利亚罗非鱼Oreochromisco aureus(♂)杂交获得的尼奥罗非鱼抗寒范围较不耐寒的尼罗罗非鱼扩大3 ℃左右,基本接近耐寒的奥利亚罗非鱼。Dang 等[8]研究表明,黑唇鲍Haliotis rubra和绿唇鲍Haliotis laevigata的种间杂交后代在抗弧菌能力方面极显著高于其亲本。Lafarga-De la Cruz等[9]对红鲍Haliotis rufescens(♀)与皱纹盘鲍Haliotis discus hannai(♂)进行了种间杂交,在热激下杂交后代HSP70基因的表达量高于双亲,说明杂交后代可能具有更高的耐高温能力。在海胆中,种间杂交有着较多的研究报道,如Osanai[10]、Masayoshi等[11]、亓守冰等[12]、王丽梅等[13]和周遵春[14]均繁育出中间球海胆和光棘球海胆Strongylocentrotus nudus的种间杂交后代,并对杂交后代的生长及形态特征做了研究。常亚青等[15]成功繁育出马粪海胆Hemicentrotus pulcherrimus(♀)×中间球海胆(♂)、中间球海胆(♀)×马粪海胆(♂)和马粪海胆(♀)×光棘球海胆(♂)等3种杂交海胆。经晨晨等[16]研究了中间球海胆与紫海胆Heliocidaris crassispina种间杂交受精和孵化的适宜温度。Ding等[17]研究认为,中间球海胆(♀)×紫海胆(♂)杂交后代在体质量生长方面具有56.12%的杂种优势,在性腺湿质量方面具有59.40%的杂种优势。目前,将种间杂交与海胆的抗逆性相联系的研究较少,仅田晓飞等[18]研究了中间球海胆与光棘球海胆杂交后代的耐高温性能,且认为杂交后代并无耐高温优势。因此,利用远缘杂交培育具备抗逆性强,尤其是广温性的海胆品种较为迫切。
马粪海胆广泛分布于中国沿海地区[19],该种海胆适温范围广,具有较高的耐高温能力,但相较于中间球海胆,该种海胆生长缓慢,部分个体性腺味苦。此两种海胆的杂交后代有望综合双亲的优势,成为培育良种的优良材料。为此,笔者已构建了中间球海胆与马粪海胆的杂交家系,并对家系早期生长比较和亲本的配合力进行了估计[20]。本研究中,进一步研究了两种海胆的杂交和自繁群体的耐高温能力,分析了杂交后代的杂种优势,旨在为分析海胆耐高温机制、培育海胆耐高温品种提供数据资料。
1 材料与方法
1.1 材料
试验用4种海胆分别为中间球海胆(Si)、马粪海胆(Hp)、中间球海胆(Si)♀×马粪海胆(Hp)♂和马粪海胆(Hp)♀×中间球海胆(Si)♂,均来自大连海洋大学农业农村部北方海水增养殖重点实验室人工繁育群体。其中,中间球海胆为2016年10月繁育,其他3种海胆为2017年4月繁育。培育方法见文献[20]。
1.2 方法
试验开始前,从Si、Hp、Si♀×Hp♂和Hp♀×Si♂群体中各取50只,体质量分别为(0.88±0.39)、(2.26±0.60)、(0.49±0.18)、(1.37±0.37) g,壳径分别为(12.03±1.98)、(17.34±1.78)、(9.94±1.28)、(14.41±1.55)mm,于20 ℃水温下暂养一周后开始试验。试验于循环水槽内进行,每种海胆分成5组,每组各10只。试验初始温度为20 ℃,温度在20~24 ℃时每天升温2 ℃,温度在24~28 ℃时每天升温1 ℃,28 ℃后每天升温0.5 ℃,升至32.5 ℃后停止,并维持此温度直至试验结束(图1)。试验过程中,每当有海胆开始死亡时立即停止升温,待该种海胆全部死亡后再开始升温。试验中每小时测温一次,及时捞出死亡个体,并记录每个个体的存活时间。当海胆全部死亡时停止试验。
试验过程中,盐度为31.01~32.56,pH值为8.01~8.20,溶解氧为8.10~8.26 mg/L,氨氮为0.097~0.235 mg/L,亚硝酸态氮为0.069~0.188 mg/L,均保持在正常范围内[21]。采用文献[22-23]中使用的耐热指数(Upper thermal tolerance, UTT)作为评定耐高温能力的指标,计算公式为
其中:Ti为第i h的温度(℃);T0为初始温度20 ℃;k为存活时间(h)。
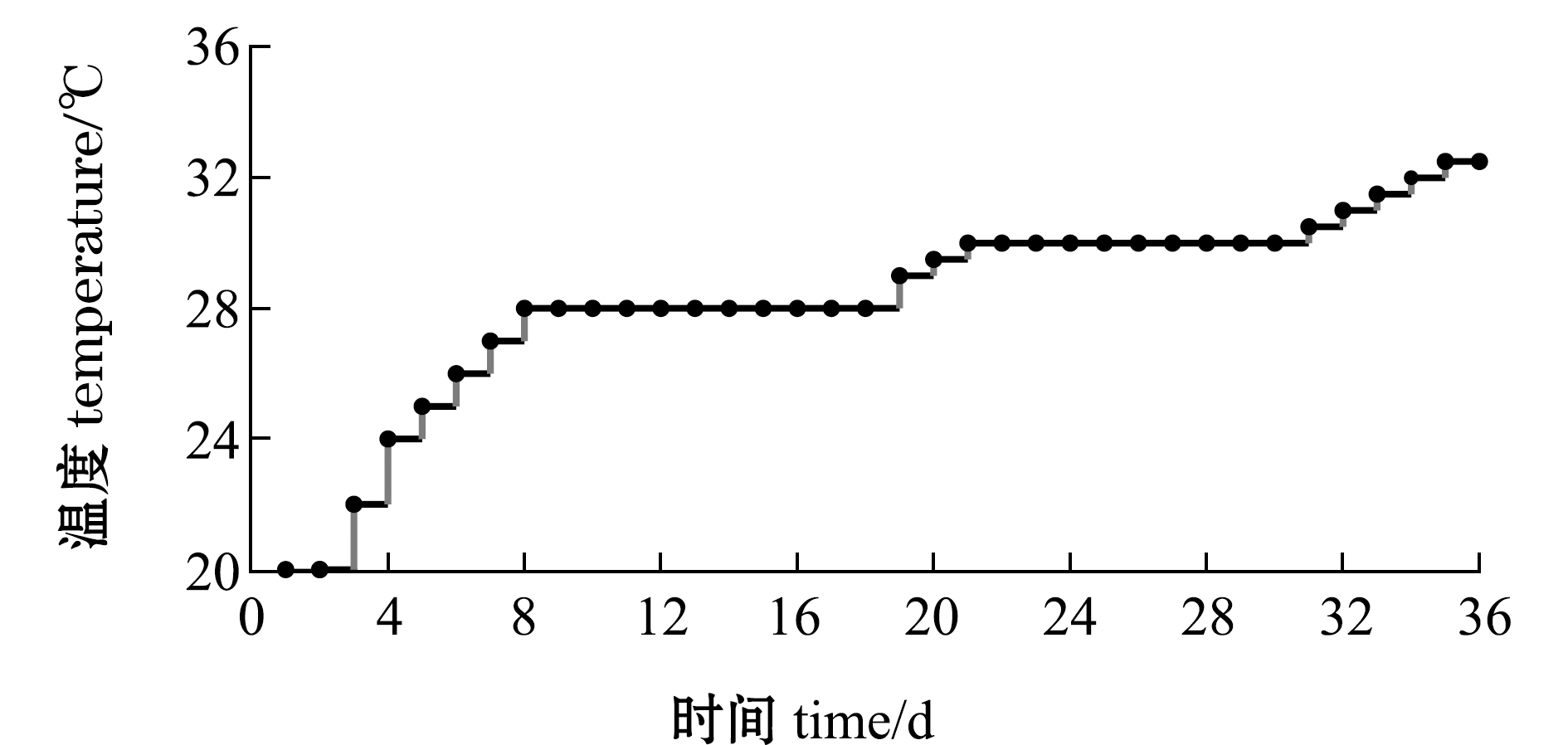
图1 升温示意图
Fig.1 Pattern of water warming
1.3 数据处理
采用Excel软件计算各组海胆的耐热指数平均值和标准差。利用SPSS 20.0 软件,采用Kaplan-Meier法进行生存分析,估计两亲本及杂交后代的生存时间平均值和中位数,利用Log Rank方法对各组海胆的总体生存时间分布进行差异显著性比较;对耐热性进行单因素方差分析,采用S-N-K法进行多重比较,显著性水平设为 0.05,极显著水平设为0.01。
杂交子代耐热性的中亲杂种优势计算公式为
其中:HMP为中亲杂种优势;F1为正反交、正交或反交组合子代各性状的平均值;P1、P2分别为两亲本海胆各性状的平均值[24]。
杂交子代的单亲杂种优势计算公式为
HSP=(F1-PX)/PX×100%。
其中:HSP为单亲杂种优势;F1为正反交、正交或反交组合子代各性状的平均值;PX为单个亲本自繁组子代各性状的平均值[24]。
2 结果与分析
2.1 两亲本及杂交后代的生存分析
4种海胆开始死亡时的温度由高到低依次为Hp(31.5 ℃)、Hp♀×Si♂(30 ℃)、Si♀×Hp♂(29.5 ℃)和Si(28 ℃),杂交后代Hp♀×Si♂和Si♀×Hp♂分别较中间球海胆高2 ℃和1.5 ℃,分别较马粪海胆低1.5 ℃和2 ℃。生存分析估计了两亲本及杂交后代生存时间平均值和中位数(表1),4种海胆生存时间平均值和中位数估计值由大到小依次为Hp>Hp♀×Si♂>Si♀×Hp♂>Si。
表1 两亲本及杂交后代生存时间平均值和中位数估计
Tab.1 Mean and mid-value for survival period of parental sea urchin and reciprocal hybrid cross groups
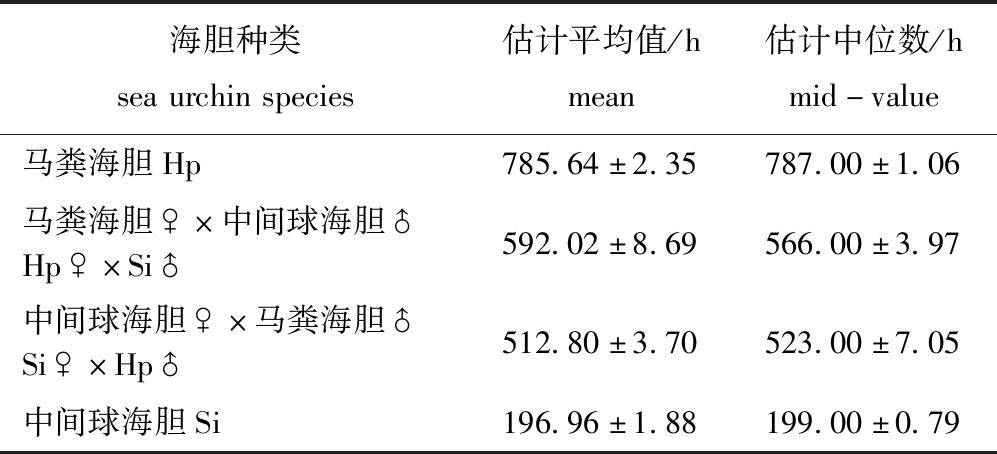
海胆种类seaurchinspecies估计平均值/hmean估计中位数/hmid-value马粪海胆Hp785.64±2.35787.00±1.06马粪海胆♀×中间球海胆♂Hp♀×Si♂592.02±8.69566.00±3.97中间球海胆♀×马粪海胆♂Si♀×Hp♂512.80±3.70523.00±7.05中间球海胆Si196.96±1.88199.00±0.79
从图2可见:中间球海胆在168 h开始死亡,并在215 h全部死亡;杂交海胆Si♀×Hp♂在452 h开始出现死亡,并在481 h后大量死亡,直到548 h时全部死亡;另一杂交组合Hp♀×Si♂在530 h出现死亡,548 h后开始大量死亡,在613 h死亡现象开始减缓,直至825 h全部死亡;马粪海胆在713 h开始出现死亡,并在778 h时开始爆发性死亡,最终在825 h全部死亡。4种海胆总体生存时间分布从长到短依次为Hp、Hp♀×Si♂、Si♀×Hp♂和Si,Log Rank检验表明,4种海胆的生存时间两两间均存在极显著性差异(P<0.01)。
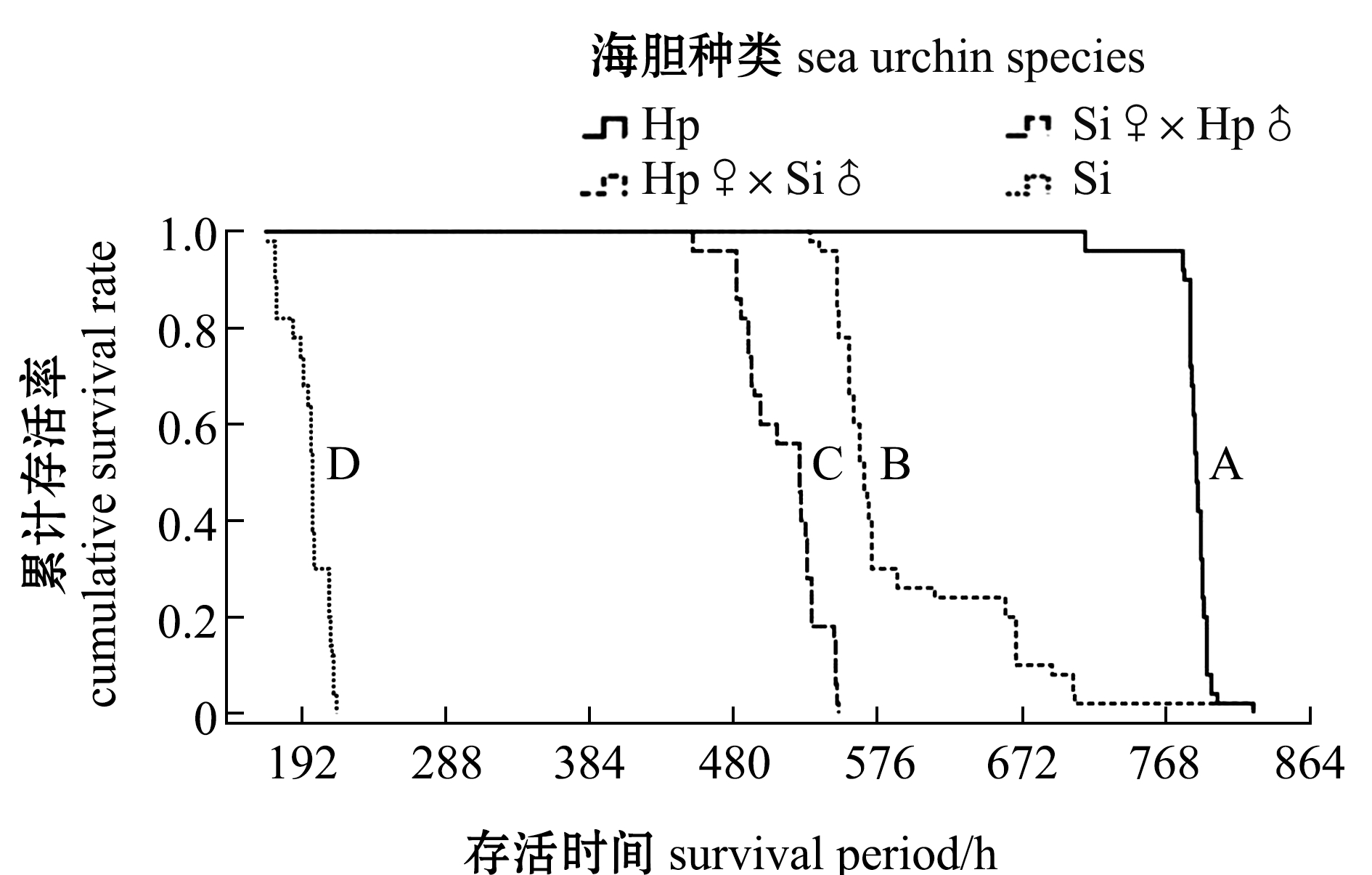
注:曲线右侧不同大写字母表示总体生存时间分布间有极显著性差异(P <0.01)
Note: Means with different capital letters on the right are very significant differences in survival rate between their overall survival period
图2 两亲本及杂交后代的生存曲线
Fig.2 Survival curves of parental sea urchin and their hybrid crosses groups
2.2 两亲本及杂交后代耐热性的比较
两亲本及杂交后代耐热性(耐热指数)的比较如图3所示,其中,中间球海胆的耐热性最差,耐热指数为(1167.72±97.33)℃·h,马粪海胆的耐热性最强,为(6864.44±141.00)℃·h,两种杂交海胆的耐热性介于父母本之间,分别为(4136.46±252.27)、(4955.42±254.19)℃·h,杂交组合Hp♀×Si♂的耐热性较高。方差分析结果表明,4种海胆的耐热性存在显著性差异(P<0.05)。
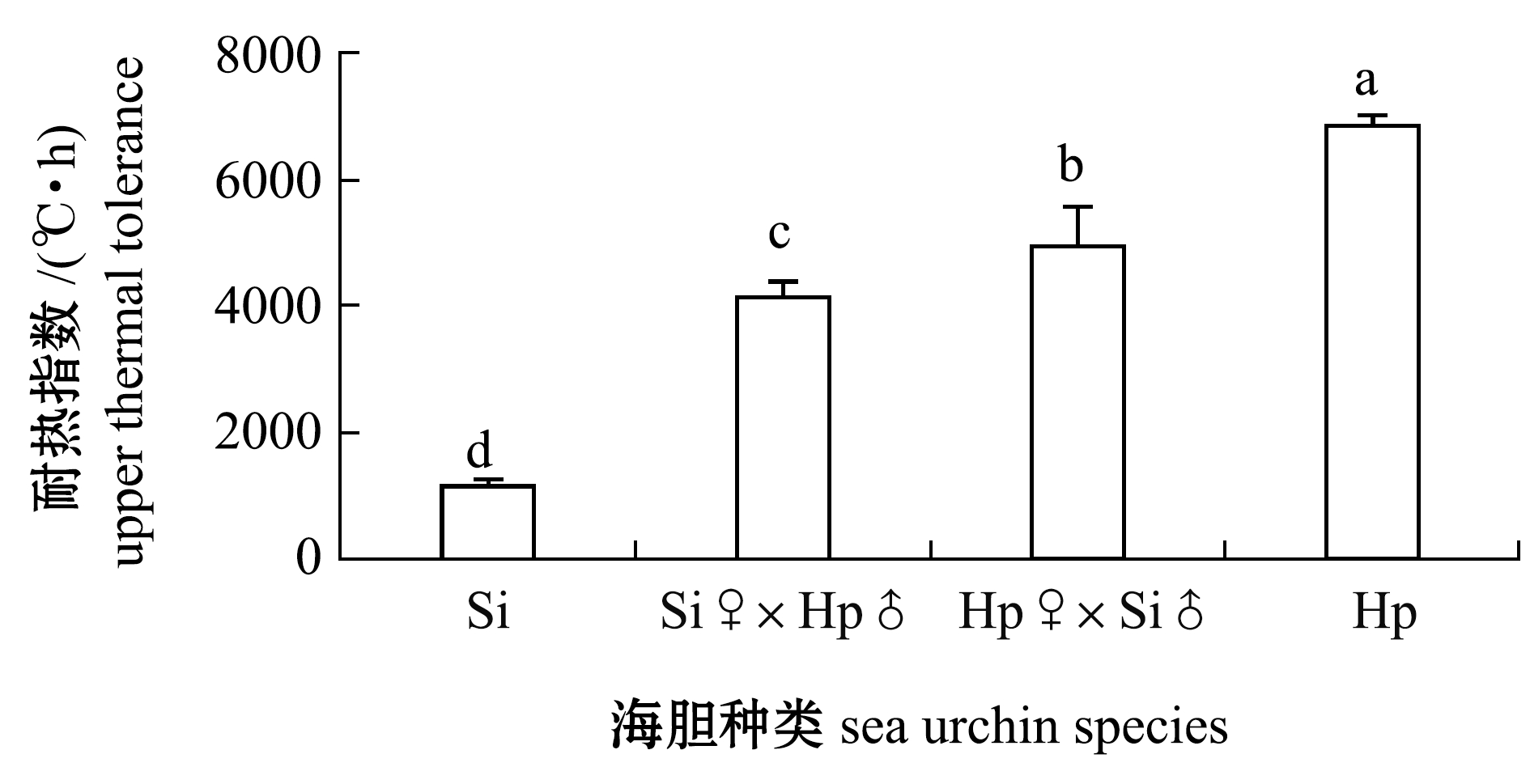
注:标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters are significantly different at the 0.05 probability level, and the means with the same letters are not significant differences
图3 两亲本及杂交后代的耐热性比较
Fig.3 Comparisons of upper thermal tolerance among parental sea urchin and reciprocal hybrid crosses groups
2.3 杂交海胆的杂种优势
两种杂交海胆的耐热性中亲杂种优势和单亲杂种优势如图4所示。两个杂交组合的耐热性相较于亲本均表现出中亲杂种优势,杂交组合Hp♀×Si♂的中亲杂种优势率更高,为 23.39%,杂交组Si♀×Hp♂的中亲杂种优势率较低,为 3.00%,正反交子代平均中亲杂种优势为 13.19%。
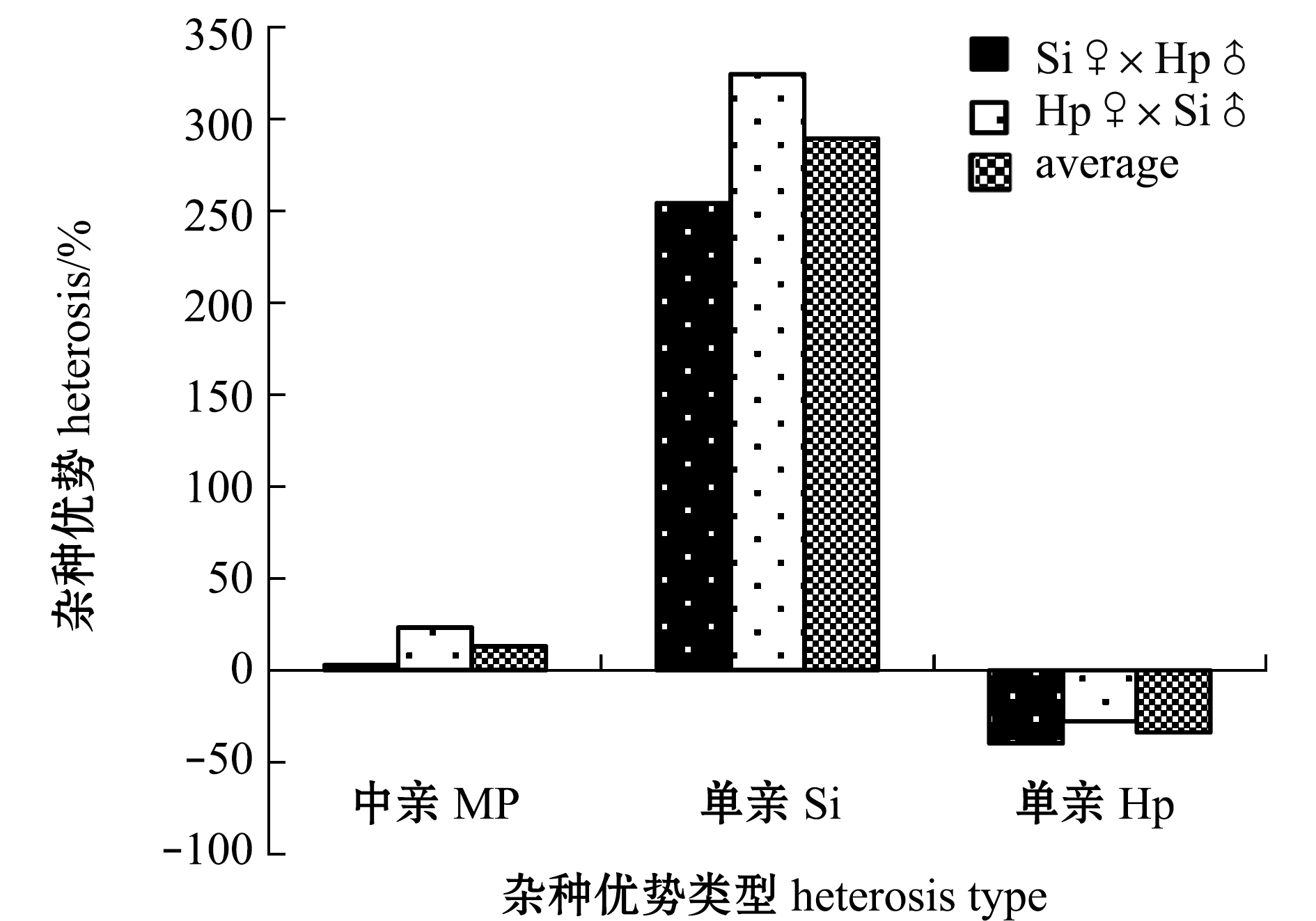
图4 杂交后代耐热性的中亲杂种优势和单亲杂种优势
Fig.4 Mid-parents heterosis and single-parent heterosis of reciprocal hybrid crosses for upper thermal tolerance (UTT)
两个杂交组合相对于单亲中间球海胆均具有极高的单亲杂种优势,其中以Hp♀×Si♂的单亲杂种优势更高,为324.37%,Si♀×Hp♂的单亲杂种优势较低,为254.23%,正反交子代相对于中间球海胆的平均单亲杂种优势为289.30%。
两个杂交组合相对于单亲马粪海胆均具有负的单亲杂种优势,即具有杂种劣势,其中以Si♀×Hp♂的单亲杂种劣势更高,为-39.74%,Hp♀×Si♂的单亲杂种劣势相对较低,为-27.81%,正反交子代相对于马粪海胆的平均单亲杂种劣势为-33.78%。
3 讨论
3.1 中间球海胆与马粪海胆耐高温能力的比较
中间球海胆属冷水种类,其自然分布于日本北海道及俄罗斯远东部分沿海,在北海道,中间球海胆的幼海胆在海水超过23 ℃后的死亡率高达50%以上[25]。自引入中国后,经过多年高温养殖环境的驯化,中间球海胆的耐高温范围较原产地有所提升,在水温升至24 ℃到25 ℃后开始出现死亡[26-27]。本研究中,急性升温下中间球海胆出现死亡的温度为28 ℃,高于以往的报道,这一方面是由于本研究中采用循环养殖系统,试验过程中各项水质因子保持良好,且系统中的紫外灭菌设备可杀灭养殖水体中的致病菌,很大程度上消除了由于水质、致病菌等不利条件造成海胆死亡的可能性[28-29];另一方面,由于本研究中采取急性升温的方法,虽然温度上升速度快,但是积温较低不能导致海胆死亡,因为海胆不耐高温死亡除与温度上限有关外,还可能与积温有关[27]。本研究中采取的耐热指数(UTT)即是计算积温的一种方法,该指标是评估耐热性的常用指标[30-31]。相较于中间球海胆,马粪海胆表现出明显高的耐热能力,其开始死亡温度为31.5 ℃,较中间球海胆高3.5 ℃,耐热指数为6864.44 ℃·h,是中间球海胆的5.9倍,这一结果与其广泛的自然分布相符(在中国最南分布至福建沿海)[19]。
3.2 海胆杂交有效提高了后代的耐高温能力
通过生存分析可知,两种杂交后代在快速升温胁迫下的生存时间(平均值和中位值),均较不耐高温的中间球海胆有较大提高,而更偏向于耐高温的马粪海胆。同样,从生存曲线也可看出,两种杂交子代的总体生存时间分布均极显著高于中间球海胆,无论是Hp♀×Si♂还是Si♀×Hp♂杂交后代的生存曲线均更接近于耐高温的马粪海胆,这说明中间球海胆与马粪海胆间的杂交有效提高了后代的耐高温能力。
一般认为,杂种优势的产生主要基于杂交后显性有利基因将会掩盖隐性不利基因的表现[32]。本研究中,正反交两种杂交海胆的耐热指数均表现出相对于父母本平均值的中亲杂种优势,这说明杂交海胆基因组中马粪海胆的耐热基因对中间球海胆的相关基因起到了显性作用,使得杂交后代较父母均值具有了更强的耐热能力。在存活、抗逆等性状上,其他一些水产动物中如不同地理群体的海湾扇贝[24,33]、刺参[34]、皱纹盘鲍和红鲍[9]等的杂交子代也均得到了中亲杂种优势。而在海胆研究中,目前仅有关于生长性状杂种优势的报道[17,35],而尚无关于抗逆性状尤其是耐热性状杂种优势的报道,本研究结果可为进一步研究海胆对高温的适应机制提供数据资料。两种杂交组合在耐热性上相对于中间球海胆均具有极高的单亲杂种优势(254.23%~324.37%),而相对于马粪海胆均具有较高的杂种劣势(-39.74%~-27.81%),这进一步表明,亲本马粪海胆具有较高的耐高温能力,无论作为父本还是作为母本与中间球海胆进行杂交,均可使杂交后代的耐高温能力大幅超过中间球海胆。同样,中间球海胆无论作为父本还是母本,也均会将其不耐高温的特性遗传给后代,这使得杂交后代的耐热性处于父母本之间,这一结果与长牡蛎和近江牡蛎杂交后代在高盐度下的存活率表现相一致[36]。
3.3 杂交在海胆育种中的应用
杂交后代Hp♀×Si♂具有更高杂种优势,可作为耐高温海胆培育的候选种类。相较于Hp♀×Si♂,Si♀×Hp♂的杂种优势较低,但是相较于中间球海胆,Si♀×Hp♂仍具有较高的单亲杂种优势,且其热致死温度提高了1.5 ℃,这对于部分养殖海域来说,已足够应付夏季的高水温环境,因此,Si♀×Hp♂也可作为耐高温海胆培育候选种类。
从生存曲线的分布可知,两种杂交组合生存时间的分布相对于两亲本尤其是中间球海胆更宽,这说明杂交后代个体间的耐热性表型具有更高的变异水平,这符合杂交可提高后代遗传变异的遗传学规律[33]。尤其是在Hp♀×Si♂中,虽然大部分个体(约70%)在水温升至30 ℃时开始死亡,但小部分个体(约30%)表现出了更高的耐高温能力,甚至有个别个体具有与马粪海胆同等的耐高温能力。这一现象可能与两亲本各自具有的耐高温相关基因型有关,即如果杂交的两亲本所具有的耐高温相关基因型存在互补关系而产生显性效应或加性效应,杂交后代则有可能获得更多和更优秀的耐高温相关基因,也就可能具有更高的耐高温能力,甚至超过两亲本获得超亲优势。目前,水产动物中已有关于杂交后代在耐高温、抗病方面超亲优势的报道[37-38]。基于以上推测,有必要在杂交前分别对两种海胆亲本进行选择,以期获得更高的杂种优势。
杂交海胆是否可作为新的养殖对象,除了具备耐高温能力外,其生长性状还需进一步评价,鉴于海胆的可食部分仅为生殖腺,其生殖腺的产量和品质也需进一步评价。
[1] 常亚青,丁君,宋坚,等.海参、海胆生物学研究与养殖[M].北京:海洋出版社,2004.
[2] 王子臣,常亚青.虾夷马粪海胆人工育苗的研究[J].中国水产科学,1997,4(1):60-67.
[3] 常亚青,王子臣,孙丕海,等.虾夷马粪海胆的海区渡夏、室内中间培育及工厂化养成[J].中国水产科学,1999,6(2):66-69.
[4] 韩奋杰,张伟杰,秦宇博,等.中间球海胆幼体及稚海胆生长性状的遗传参数估计[J].大连海洋大学学报,2017,32(2):145-149.
[5] 高绪生,孙勉英,胡庆明,等.温度对光棘球海胆不同发育阶段的影响[J].海洋与湖沼,1993,24(6):634-640.
[6] 王楚松,夏德全,胡玫,等.奥尼鱼(S.nilotica♀×S.aurea♂)杂种优势利用的研究[J].淡水渔业,1989(6):14-15.
[7] 林勇,卢其西,杨慧赞,等.八种品系罗非鱼及其尼奥罗非鱼耐寒性能的比较试验[J].华北农学报,2011,26(S1):278-282.
[8] Dang V T,Speck P,Doroudi M,et al.Variation in the antiviral and antibacterial activity of abalone Haliotis laevigata,H.rubra and their hybrid in South Australia[J].Aquaculture,2011,315(3-4):242-249.
[9] Lafarga-De la Cruz F,Nú ez-Acu
ez-Acu a G,Gallardo-Escárate C.Hybridization between Haliotis rufescens and Haliotis discus hannai:evaluation of fertilization,larval development,growth and thermal tolerance[J].Aquaculture Research,2013,44(8):1206-1220.
a G,Gallardo-Escárate C.Hybridization between Haliotis rufescens and Haliotis discus hannai:evaluation of fertilization,larval development,growth and thermal tolerance[J].Aquaculture Research,2013,44(8):1206-1220.
[10] Osanai K.Interspecific hybridization of sea urchins,Strongylocentrotus nudus and Strongylocentrotus intermedius[J].Bulletin of the Marine Biological Station of Asamushi,1974,15(1):37-45.
[11] Masayoshi H,Osanai K.Phenotypic analyses of sea urchin species interspecifically hybridized between Strongylocentrotus nudus and Strongylocentrotus intermedius[J].Bulletin of the Marine Biological Station of Asamushi,1994,19:65-78.
[12] 亓守冰,张伟杰,常亚青,等.中间球海胆(♀)与光棘球海胆(♂)种间杂交及自繁后代生长与表型特征比较[J].大连海洋大学学报,2015,30(5):461-466.
[13] 王丽梅,韩家波,许伟定,等.中间球海胆与光棘球海胆杂交及子一代人工育苗技术[J].水产科学,2003,22(2):9-11.
[14] 周遵春.中间球海胆与光棘球海胆的杂交及分子遗传学研究[D].青岛:中国海洋大学,2006.
[15] 常亚青,王子臣,宋坚,等.四种海胆杂交的可行性及子代的早期发育[J].水产学报,2000,24(3):211-216.
[16] 经晨晨,张伟杰,宋坚,等.中间球海胆与紫海胆种间杂交的受精、孵化和幼体发育研究[J].大连海洋大学学报,2015,30(6):620-626.
[17] Ding Jun,Chang Yaqing,Wang Changhai,et al.Evaluation of the growth and heterosis of hybrids among three commercially important sea urchins in China:Strongylocentrotus nudus,S. intermedius and Anthocidaris crassispina[J].Aquaculture,2007,272(1-4):273-280.
[18] 田晓飞,常亚青,张伟杰,等.中间球海胆、光棘球海胆自繁和杂交后代幼体发育及对高温的反应[J].大连海洋大学学报,2014,29(5):431-438.
[19] 高绪生,常亚青.中国经济海胆及其增养殖[M].北京:中国农业出版社,1999.
[20] 张伟杰,韩奋杰,陈顺,等.中间球海胆与马粪海胆杂交家系早期生长比较和亲本配合力估计[J].中国水产科学,2017,24(5):1035-1044.
[21] 雷衍之.养殖水环境化学[M].北京:中国农业出版社,2004.
[22] Cnaani A,Gall G A E,Hulata G.Cold tolerance of tilapia species and hybrids[J].Aquaculture International,2000,8(4):289-298.
[23] Perry G M L,Martyniuk C M,Ferguson M M,et al.Genetic parameters for upper thermal tolerance and growth-related traits in rainbow trout (Oncorhynchus mykiss)[J].Aquaculture,2005,250(1-2):120-128.
[24] Zheng Huaiping,Zhang Guofan,Guo Ximing,et al.Heterosis between two stocks of the bay scallop,Argopecten irradians irradians Lamarck (1819)[J].Journal of Shellfish Research,2006,25(3):807-813.
[25] Agatsuma Y.Strongylocentrotus intermedius[M]//Lawrence J M.Sea Urchins:Biology and Ecology.Amsterdam:Elsevier,2013:437-447.
[26] 常亚青,王子臣,王国江.温度和藻类饵料对虾夷马粪海胆摄食及生长的影响[J].水产学报,1999,23(1):69-76.
[27] Chang Yaqing,Tian Xiaofei,Zhang Weijie,et al.Family growth and survival response to two simulated water temperature environments in the sea urchin Strongylocentrotus intermedius[J].International Journal of Molecular Sciences,2016,17(9):1356.
[28] Tajima K,Shimizu M,Miura K,et al.Seasonal fluctuations of Flexibacter sp. the causative bacterium of spotting disease of sea urchin Strongylocentrotus intermedius in the culturing facilities and coastal area[J].Fisheries Science,1998,64(1):6-9.
[29] 王斌,李岩,李霞,等.中间球海胆“红斑病”病原弧菌致病机理的研究[J].大连水产学院学报,2005,20(1):11-15.
[30] Perry G M L,Danzmann R G,Ferguson M M,et al.Quantitative trait loci for upper thermal tolerance in outbred strains of rainbow trout (Oncorhynchus mykiss)[J].Heredity,2010,86(3):333-341.
[31] 李丽君,宋晓红,林瑶琼,等.日本囊对虾耐热性状及其与凡纳滨对虾、脊尾白虾的比较[J].中国水产科学,2015,22(3):418-425.
[32] 盛志廉,陈瑶生.数量遗传学[M].北京:科学出版社,1999.
[33] Wang Chunde,Li Zhaoxia.Improvement in production traits by mass spawning type crossbreeding in bay scallops[J].Aquaculture,2010,299(1-4):51-56.
[34] 谭杰,王亮,高菲,等.中国刺参(Apostichopus japonicus)与韩国刺参杂交子一代生长和抗病力比较[J].渔业科学进展,2015,36(4):109-115.
[35] 王丽梅,韩家波,董颖,等.中间球海胆与光棘球海胆杂交子一代的生长比较研究[J].水产科学,2004,23(2):1-3.
[36] 姚托,王昭萍,闫喜武,等.盐度对长牡蛎和近江牡蛎及其杂交稚贝生长和存活的影响[J].生态学报,2015,35(5):1581-1586.
[37] Liang Shuang,Luo Xuan,You Weiwei,et al.The role of hybridization in improving the immune response and thermal tolerance of abalone[J].Fish & Shellfish Immunology,2014,39(1):69-77.
[38] Liang Shuang,Luo Xuan,You Weiwei,et al.Hybridization improved bacteria resistance in abalone:evidence from physiological and molecular responses[J].Fish & Shellfish Immunology,2018,72:679-689.