巴西龟Trachemys scripta elegans又称红耳龟、巴西彩龟、七彩龟等,具有生长速度快、繁殖率高等特点,除具有观赏价值外,还有较高的药用和食用价值[1]。近年来,人工龟鳖养殖规模逐渐扩大,由于放养密度过大、水质下降及饲养管理不当等原因,龟鳖养殖中疾病频繁发生,造成严重的经济损失。据报道,龟鳖发病死亡主要由细菌、真菌和病毒等引起,其中细菌性疾病主要包括雷氏普罗威登斯菌Providencia retgeri[2]和嗜水气单胞菌Aeromonas hydrophila[3]等多种病原菌。但是,针对弗氏柠檬酸杆菌Citrobacter freundii感染龟鳖的病例目前鲜有报道[4-5]。
弗氏柠檬酸杆菌属于肠杆菌科Enterbacteriaceae柠檬酸杆菌属Citrobacter[6],该菌在土壤、水体、食物中广泛分布,目前,已成为检测水体污染的细菌学指标之一[7]。对人类和哺乳动物而言,一般认为,弗氏柠檬酸杆菌属于肠道的正常菌群,有时作为一种条件致病菌,当机体免疫力下降或侵入肠道外组织时,可引起机会性感染发病[8]。研究表明,弗氏柠檬酸杆菌也可引起蛙、鳖、鱼和蟹等多种水产动物发病[4-5,9-10],尤其对鱼、蛙等有较强致病性,常导致败血症或急性死亡。本研究中,从患病巴西龟肝脏、脾脏和眼鼻黏膜病灶中分离到1株优势细菌,通过细菌形态学观察、生理生化鉴定,并结合16S rDNA、gyrB测序鉴定、动物感染和药物试验等系统研究,以期确定该病原菌的致病性及其药敏特性,旨在为巴西龟细菌性疾病防治提供参考依据。
1 材料与方法
1.1 材料
患病巴西龟为天津市某宠物龟养殖基地送检病例,体长为(15±1)cm。人工感染试验用20只健康巴西龟(体长为6.0 cm±1.0 cm)购自天津市某水产养殖场,置于塑料箱(20 cm×10 cm ×10 cm)中暂养,饲养水温为(26±1)℃。
细菌生化鉴定管、药敏纸片和LB培养基均购自滨和微生物试剂(杭州)有限公司,PCR Mix购自天根生化科技(北京)有限公司,pMD18-T购自TaKaRa公司,DNA胶回收试剂盒(离心柱型)购自百泰克生物技术(北京)有限公司。
1.2 方法
1.2.1 细菌的分离与纯化 参照叶明皓等[2]的方法,取患病龟肝脏、脾脏和眼鼻病灶组织等,无菌划线接种于LB平板,于28 ℃下培养18~24 h,分离与纯化菌株。
1.2.2 细菌生理生化试验 参照《常见细菌鉴定手册》[11]进行分离生理生化鉴定,于28 ℃下培养36~72 h观察结果,采用K-B纸片扩散法进行药物敏感性检测。
1.2.3 细菌基因组DNA提取及16S rDNA基因克隆 细菌基因组DNA提取、pMD18-T载体基因克隆参照陆梦莹等[12]的方法进行,引物为16S rDNA基因(27F:5′AGAGTTTGATCATGGCTCAG 3′,1492R:5′GGTTACCTTGTTACGACTT 3′)和gyrB基因(F:5′GTGGCATCAAGGCGTTTGTT 3′,R:5′CTGCGTCGCGTTGTATTCAG 3′),PCR反应退火温度分别为55、58 ℃。筛选分离16S rDNA、gyrB阳性克隆,送金唯智生物科技(苏州)有限公司测序,通过NCBI-Blast在线软件检索分析,应用MEGA6软件构建系统进化树。
1.2.4 人工回归感染试验 对健康龟人工回归感染试验参照叶明皓等[2]的方法,将每只健康龟腹腔注射浓度为2.4×108 cfu/mL的菌液100 μL,连续观察28 d巴西龟发病情况。
2 结果与分析
2.1 患病巴西龟病原菌的分离及理化特性
2.1.1 临床症状 患病巴西龟主要表现为反应迟钝、精神不振,食欲减退甚至停止摄食,眼睛肿胀、黏液增多,口鼻皮肤溃烂等,发病后期身体瘦弱衰竭而死,解剖感染病死龟体腔内有恶臭气味、浑浊腹水,肺脏发黑,肠道淡黄色、无内容物且有大量淡黄色黏液等症状(图1)。
2.1.2 分离菌形态 从发病龟体内分离获得1株优势细菌,菌株编号为TC-1,该菌在28 ℃下培养18 h后,在普通琼脂平板上呈现乳白色,有光泽,边缘整齐,中央稍隆起的圆形菌落,直径为1~2 mm(图2-A),革兰氏染色镜检为阴性短杆菌(图2-B)。
2.1.3 细菌的生理生化特性 细菌生理生化试验结果表明,分离菌株TC-1能利用葡萄糖产气,与硝酸盐还原、鸟氨酸脱羧酶、半乳糖等、甘露醇反应为阳性,与苯丙氨酸、赖氨酸脱羧酶、麦芽糖等反应为阴性,符合《常见细菌系统鉴定手册》[11]中描述的弗氏柠檬酸杆菌细菌特征(表1)。
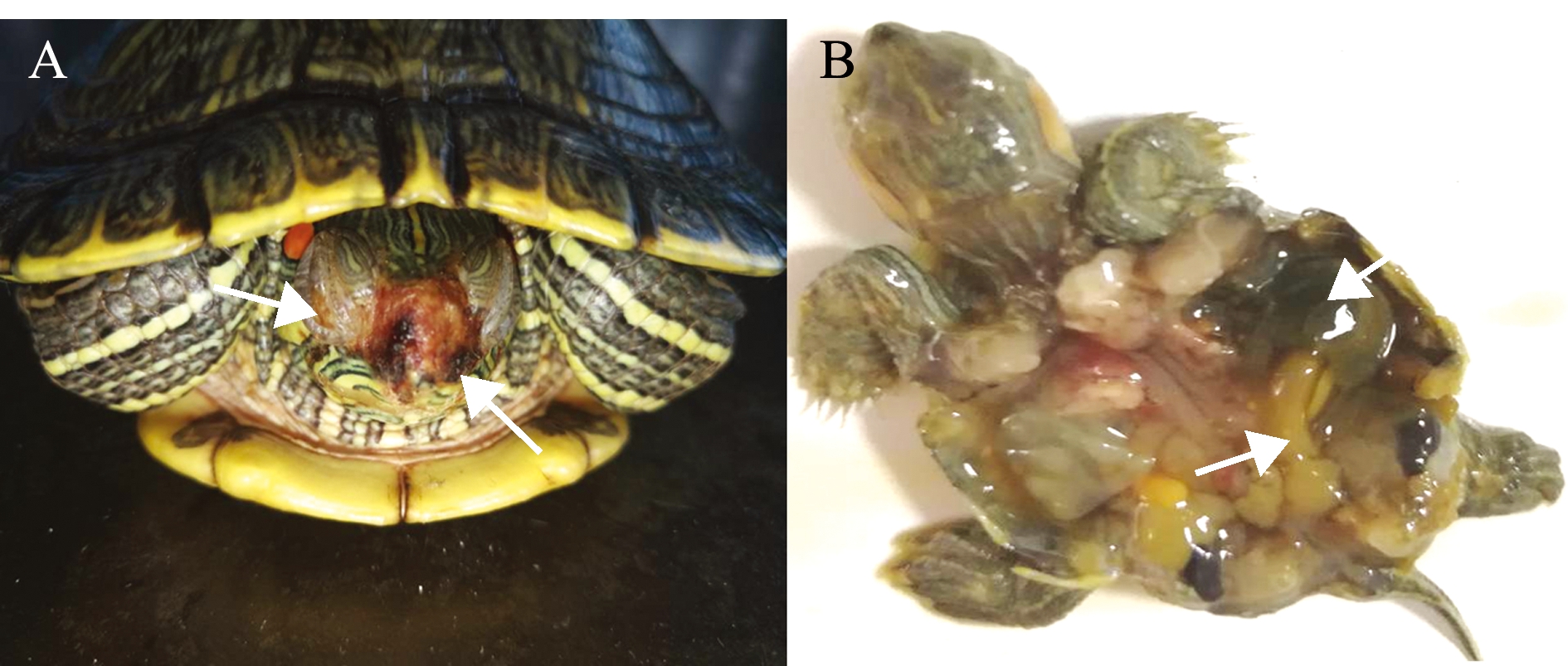
注:A,眼结膜发炎、眼睛肿大闭眼(左箭头),鼻黏膜糜烂(右箭头);B,解剖感染病龟肺脏变黑(右箭头),肠道发黄、无内容物(左箭头)
Note:A showing eye conjunctiva inflammation, and swollen and closed eyes (left arrow), erosion of nasal mucosa (right arrow); B, lungs showing blackening (right arrow), yellow intestine became and empty(left arrow)
图1 自然发病巴西龟的主要临床症状
Fig.1 Main clinical symptoms of naturally diseased turtle Trachemys scriptaelegans
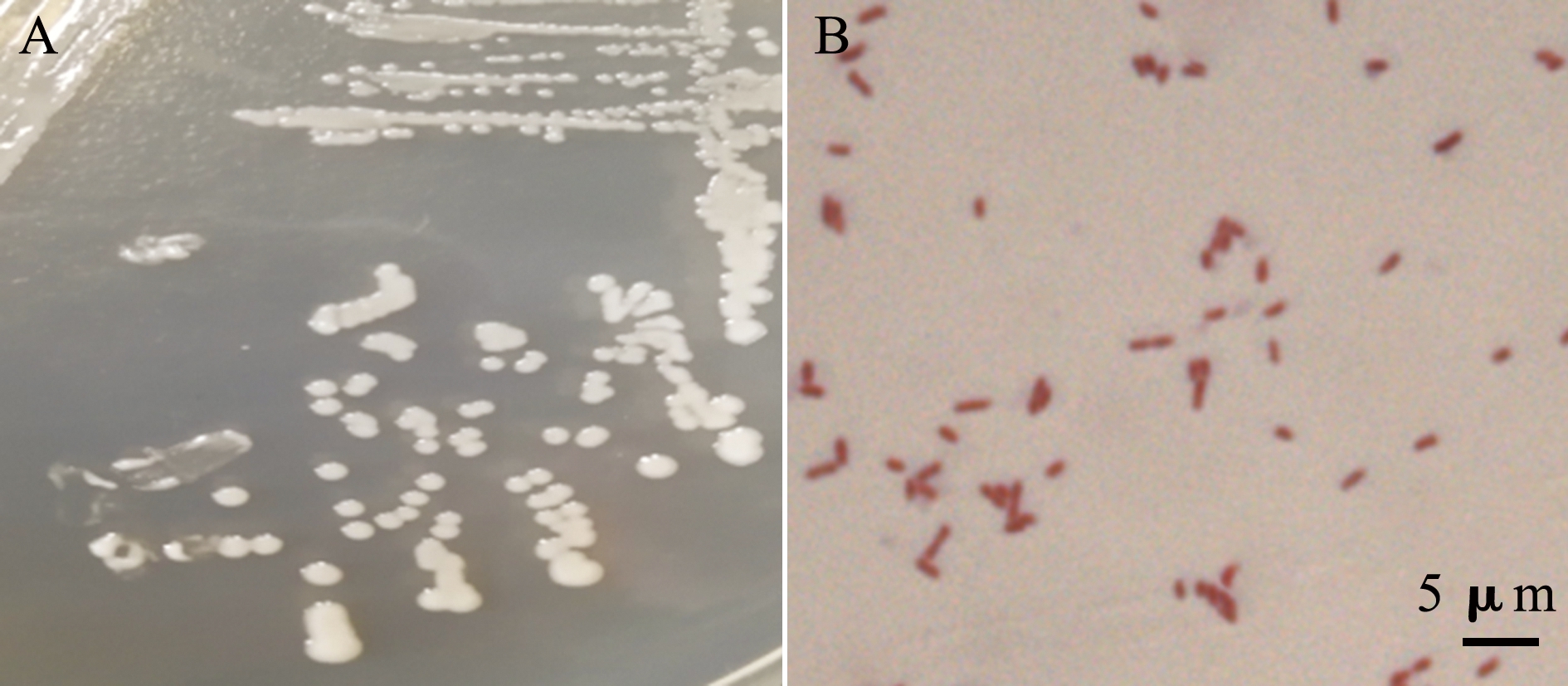
注:A,分离菌株TC-1的菌落形态;B,分离菌株TC-1的革兰氏染色
Note:A,colony morphology of strain TC-1;B,gram staining micrograph of strain TC-1
图2 菌株TC-1形态观察
Fig.2 Morphological observation of strain TC-1
2.2 分离菌株16S rDNA、gyrB基因序列及系统进化树分析
采用PCR方法扩增分离菌株TC-1的16S rDNA、gyrB基因序列,进行琼脂糖凝胶电泳检测,结果显示,在1500 bp左右(图3,泳道1)及1000 bp左右(图3,泳道4)呈现出单一目的条带。将16S rDNA基因PCR产物与pMD18-T载体连接,转化至大肠杆菌DH5α中,筛选阳性克隆(图3,泳道2、3),测得其序列长度为1503 bp,gyrB基因测序长度为989 bp。将测序所得序列在NCBI中进行Blast比对,结果显示,分离菌株的16S rDNA和gyrB基因序列与Citrobacter freundii(AJ233408.1)、C.freundii(KM509081.1)的同源性分别为99.60%、98.80%。进一步基于16S rDNA
表1 分离菌株TC-1的生理生化特性
Tab.1 Physiological and biochemical characteristics of the strain TC-1

生化项目physiologicalandbiochemicalindex菌株TC-1strainTC-1生化项目physiologicalandbiochemicalindex菌株TC-1strainTC-1葡萄糖酸盐-七叶苷+葡萄糖产气+鼠李糖+赖氨酸脱羧酶-木糖+鸟氨酸脱羧酶+果糖+硝酸盐还原+麦芽糖-OFF乳糖+水杨素-纤维二糖-丙二酸盐-松二糖-苦杏仁苷-山梨糖-枸橼酸盐-蕈糖+尿素-蜜二糖+葡萄糖胺+半乳糖+硫化氢+山梨醇+糊精-侧金盏花醇-胆汁七叶苷+甘露醇+β-半乳糖苷ONPG-赤藓醇-酒石酸盐-卫矛醇-N-乙酰葡萄糖胺+肌醇-KCN+木醇-M.R.试验+葡萄糖+V.P.试验-棉子糖+苯丙氨酸脱氨酶-松三糖+蛋白胨水-甘露糖+
注:+表示阳性,-表示阴性,F表示发酵型
Note:+,positive; -,negative; F,fermentative type
序列构建系统进化树,结果显示,分离菌株TC-1与模式菌株C.freundii(AJ233408.1)序列亲缘关系最近,自然聚类为一支(图4),并且gyrB基因系统进化树与模式菌株C.freundii(KM509081.1)序列亲缘关系最近,自然聚类为一支(图5)。因此,根据分离菌的生理生化特性及分子测序鉴定,最终确定分离菌株TC-1为弗氏柠檬酸杆菌C.freundii。
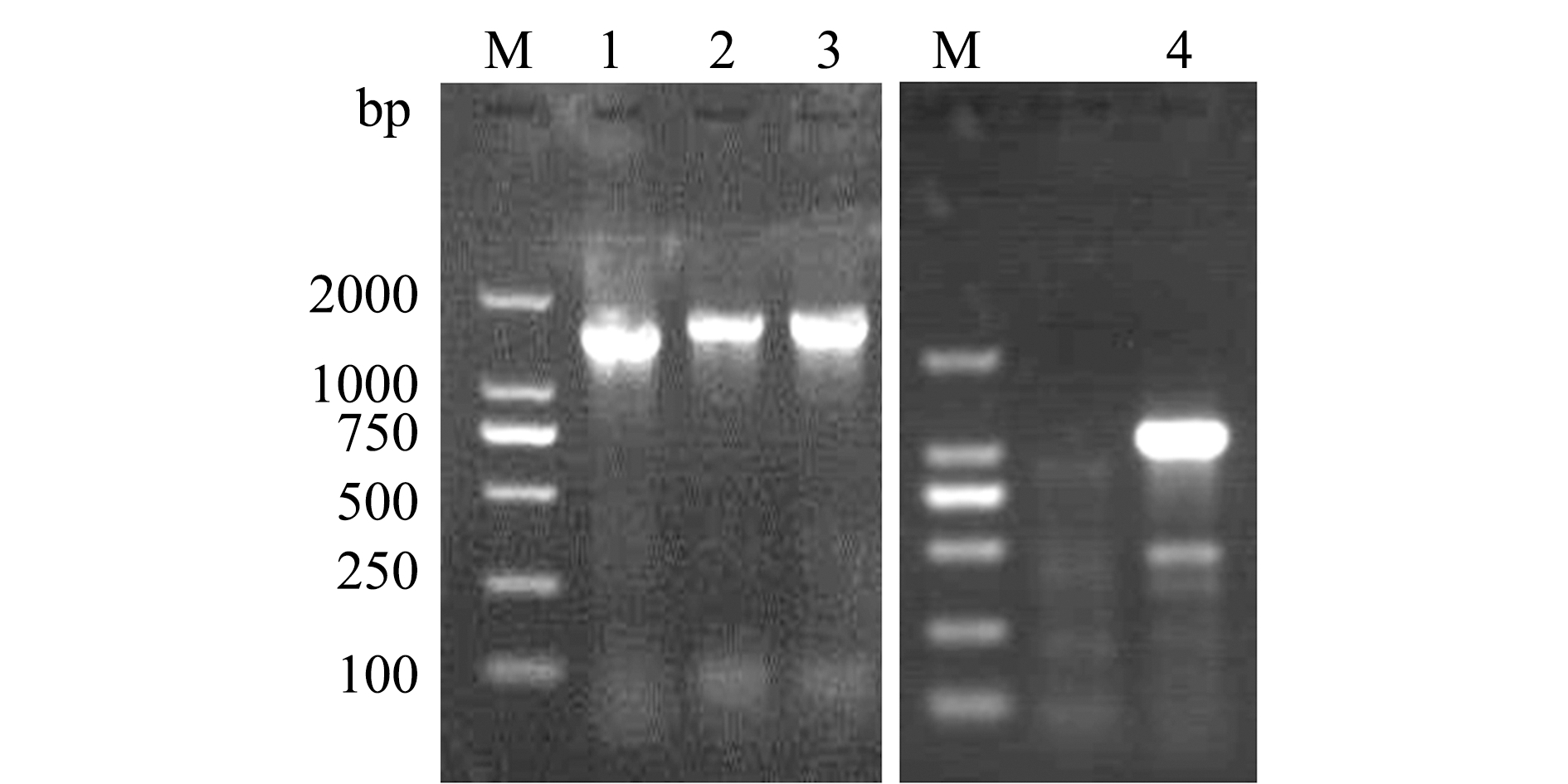
注:M为DL 2000 DNA标准;泳道1为16S rDNA;泳道2~3为pMD18-T 16S rDNA阳性克隆;泳道4为gyrB基因
Note:M, DL 2000 DNA standard; Lane 1,16S rDNA;Lanes 2 and 3,positive PMD18-T 16S rDNA clones;Lane 4,gyrB gene
图3 分离菌株TC-1的16S rDNA和gyrB基因的PCR扩增电泳及阳性克隆检测
Fig.3 PCR amplification and detection of 16S rDNA and gyrB positive clone in the strain TC-1
2.3 分离菌株TC-1药敏特性
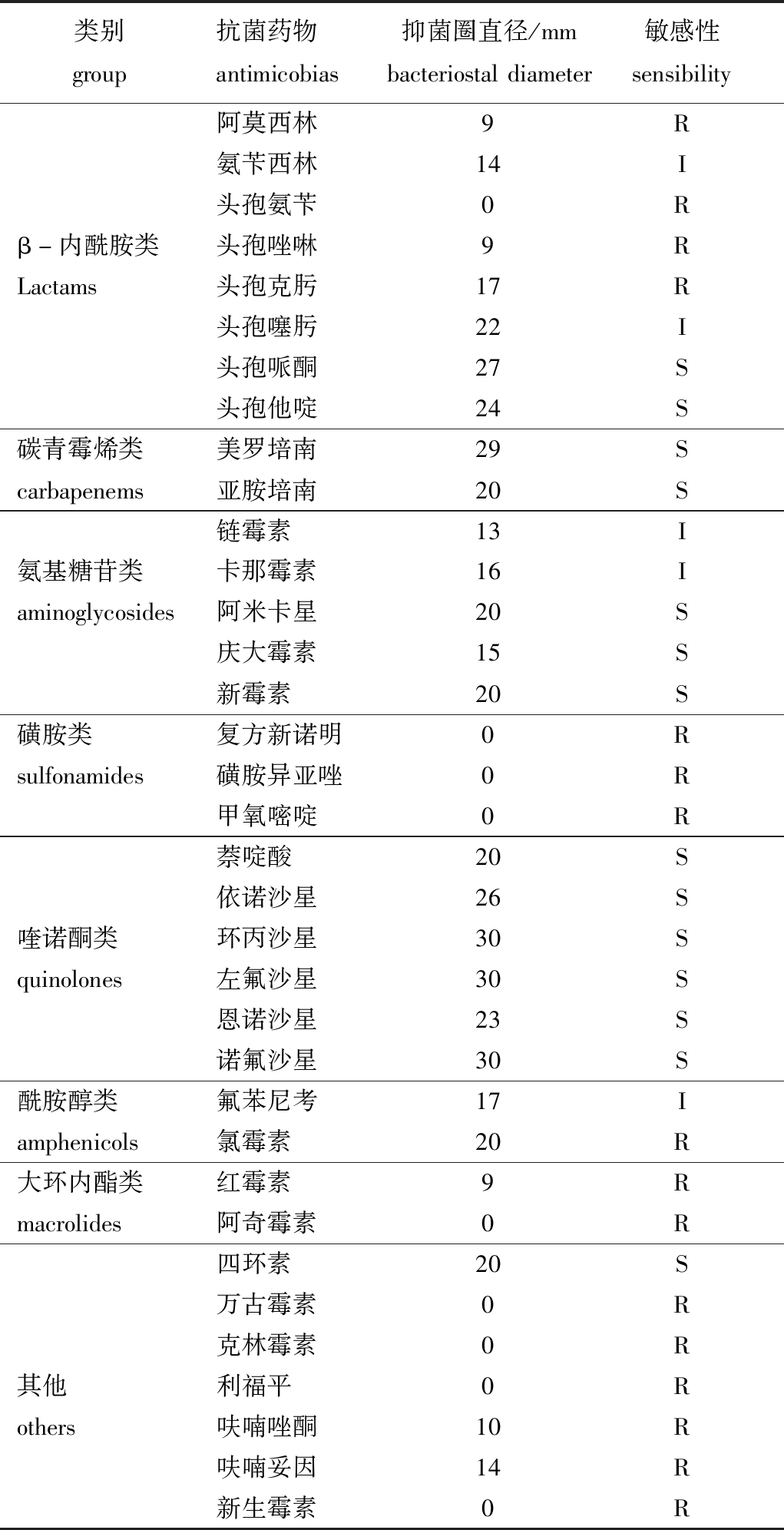
对TC-1菌株的药敏试验结果表明,分离菌株对第三代头孢菌素类(头孢哌酮、头孢他啶、头孢噻肟),喹诺酮类(萘啶酸、恩诺沙星、诺氟沙星、依诺沙星、环丙沙星、左氟沙星),氨基糖苷类(链霉素、卡那霉素、阿米卡星、庆大霉素、新霉素),碳青霉烯类(美罗培南、亚胺培南)等药物敏感,对阿莫西林、头孢氨苄、磺胺类(磺胺异亚唑、甲氧嘧啶、复方新诺明)等耐药(表2)。
2.4 人工回归感染试验
人工回归感染试验结果表明,腹腔注射分离菌株TC-1 3 d后巴西龟开始出现死亡现象,在感染28 d后累计死亡率达60%(6/10)(图6),并与自然发病龟临床症状基本一致,对发病死亡龟肝脏、脾脏和肾脏等组织进行病原细菌再分离,可获得形态特征和生长特性与分离菌株TC-1完全一致的菌落。观察对照组龟28 d后均正常,无发病死亡症状发生。
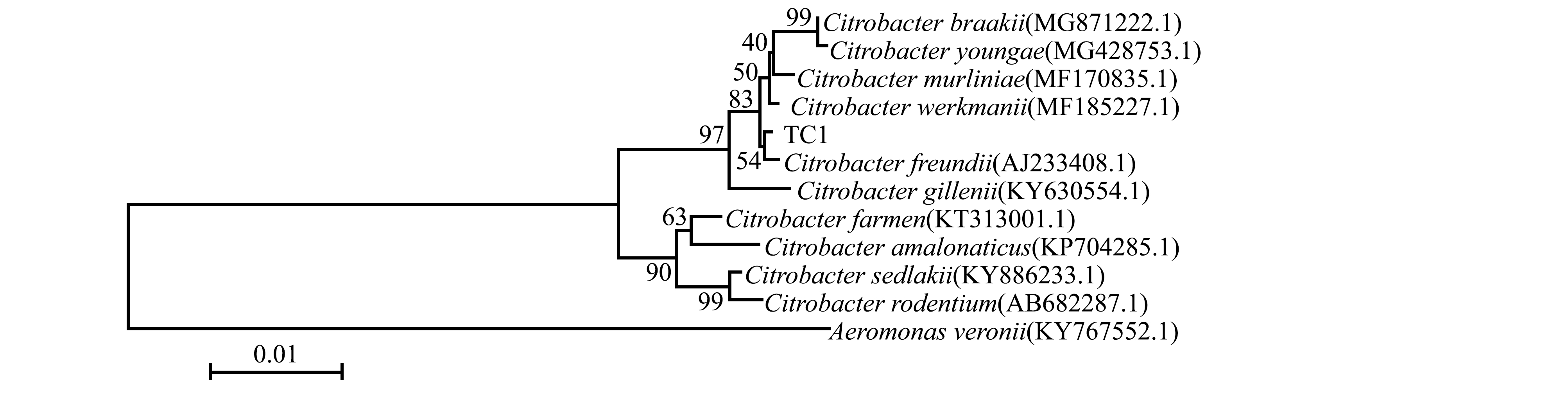
图4 分离菌株TC-1的16S rDNA基因
Fig.4 Phylogenetic tree of strain TC-1 based on gene sequence of 16S rDNA

图5 gryB基因的Neighbor-Joining系统进化树
Fig.5 Phylogenetic tree of strain TC-1 based on gyrB gene by the Neighbour-Joining method
表2 分离菌株TC-1的药敏试验结果
Tab.2 Antimicrobial susceptibility of the isolate TC-1
类别group抗菌药物antimicobias抑菌圈直径/mmbacteriostaldiameter敏感性sensibility阿莫西林9R氨苄西林14I头孢氨苄0Rβ-内酰胺类头孢唑啉9RLactams头孢克肟17R头孢噻肟22I头孢哌酮27S头孢他啶24S碳青霉烯类美罗培南29Scarbapenems亚胺培南20S链霉素13I氨基糖苷类卡那霉素16Iaminoglycosides阿米卡星20S庆大霉素15S新霉素20S磺胺类复方新诺明0Rsulfonamides磺胺异亚唑0R甲氧嘧啶0R萘啶酸20S依诺沙星26S喹诺酮类环丙沙星30Squinolones左氟沙星30S恩诺沙星23S诺氟沙星30S酰胺醇类氟苯尼考17Iamphenicols氯霉素20R大环内酯类红霉素9Rmacrolides阿奇霉素0R四环素20S万古霉素0R克林霉素0R其他利福平0Rothers呋喃唑酮10R呋喃妥因14R新生霉素0R
注:S为高度敏感;I为中度敏感;R为不敏感
Note:S,susceptible; I,intermediately susceptible;R,resistant
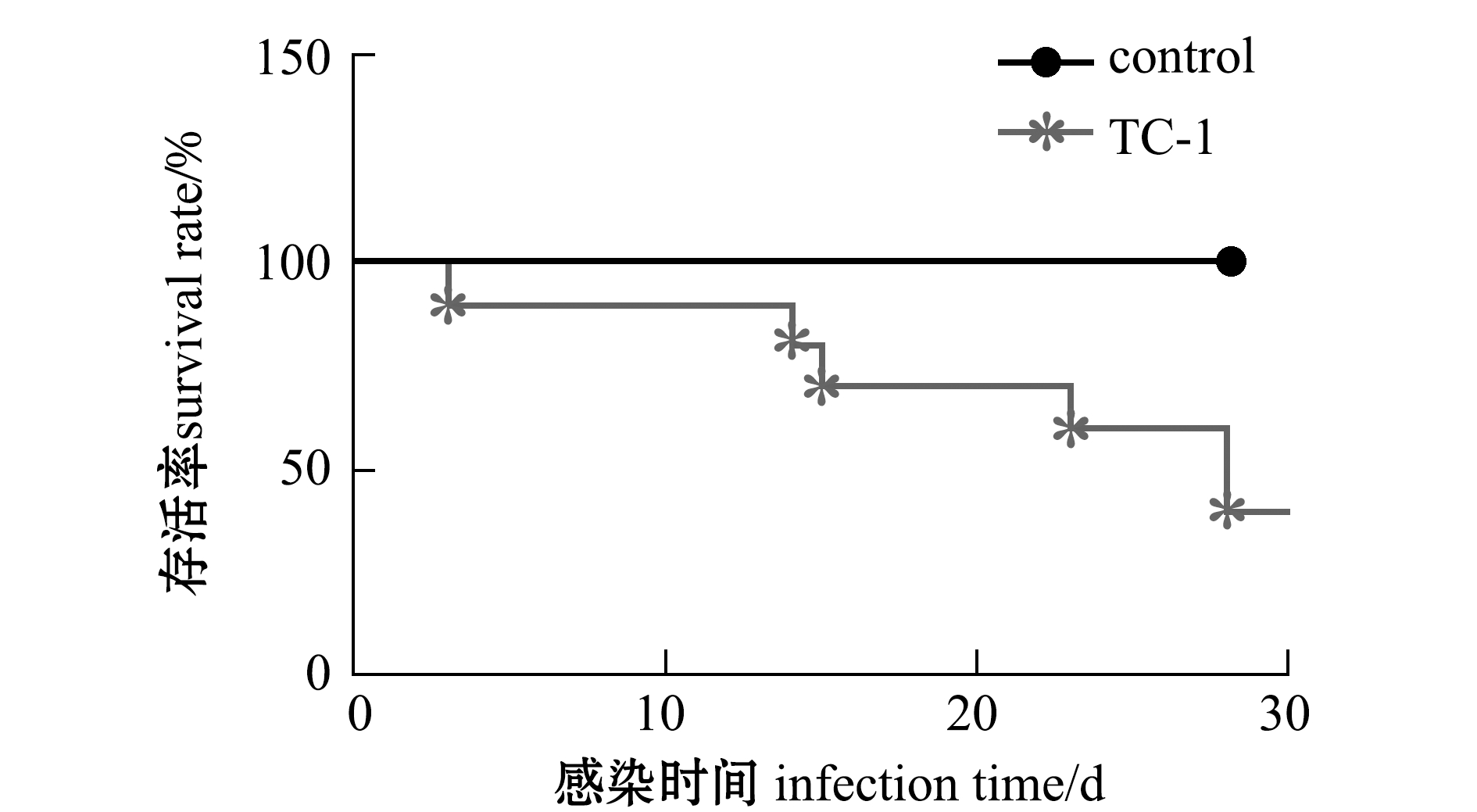
图6 人工回归感染试验龟死亡情况(n=10)
Fig.6 Survival rates of artificial infection tests in turtle challenged by Citrobacter freundii isolates(n=10)
3 讨论
3.1 弗氏柠檬酸杆菌的致病性
研究表明,柠檬酸杆菌属主要包括弗氏柠檬酸杆菌C.freundii、法氏柠檬酸杆菌C.farmeri、布氏柠檬酸杆菌C.braakii、吉氏柠檬酸杆菌C.gillienii、默氏柠檬酸杆菌C.murliniae、魏氏柠檬酸杆菌C.werkmanii和科氏柠檬酸杆菌C.koseri等[13]。弗氏柠檬酸杆菌过去常常被认为是肠道致病菌,但近年来也有弗氏柠檬酸杆菌强菌株吸附侵入肠道黏膜,进而扩散传播至全身,引起机体严重感染,且不仅仅局限于肠道感染[14]。除腹泻[15]外,弗氏柠檬酸杆菌还可引起坏死性筋膜炎[16]、急性甲状腺炎[17]等多种疾病。近几年,关于弗氏柠檬酸杆菌感染水产动物的研究报道日渐增多,可感染燕鱼Pterophyllum scalare[5]、三疣梭子蟹Portunus trituberculatus[10]、克氏原螯虾Procambarus clarkii[18]和中华绒螯蟹Eriocheir sinensis[19]等。弗氏柠檬酸杆菌常常感染养殖鱼类暴发疾病并导致大量死亡,主要表现为皮肤腐烂,肝胰腺等器官发生不同程度病理变化,发病后期引发败血症甚至死亡[9]。Bandeira等[20]对弗氏柠檬酸杆菌感染银鲶Rhamdia quelen的研究显示,被感染鲶出现再生障碍性贫血、淋巴细胞增多和嗜中性粒细胞减少等,也是导致患病鱼高死亡率的主要原因。研究表明,弗氏柠檬酸杆菌感染鱼类败血症可能与该菌胞外结构有关,鞭毛和菌毛可帮助细菌侵入机体后黏附于宿主细胞表面,促进感染侵袭[21]。当致病菌大量繁殖并进入血液循环系统时,可导致组织和细胞损伤,严重时可导致多器官功能衰竭或败血症[22]。此外,弗氏柠檬酸杆菌被认为是一种人、兽、鱼的条件致病菌,因此,对人类健康生活危害性不可忽视。在本试验中,从发病巴西龟体内及病灶部位分离到一株菌株TC-1,证实对健康巴西龟具有较强致病性;根据生理生化特性、表型特征,以及16S rDNA、gyrB序列测序鉴定,最终确定分离菌株TC-1为弗氏柠檬酸杆菌。本研究结果表明,TC-1菌株可引起巴西龟皮肤出血溃烂、肺炎和肠道感染等病理变化,这与林启存等[23]报道弗氏柠檬酸杆菌感染中华鳖引起败血症的临床症状基本一致。以上研究结果不仅为弗氏柠檬酸杆菌感染巴西龟病害防治提供科学参考,而且为进一步阐明其致病机制提供了数据资料。
3.2 弗氏柠檬酸杆菌的药敏特性
目前,应用抗生素是水产养殖过程中预防和控制疾病的主要手段,但病原菌耐药性是药物治疗过程中面临的困难问题[24]。陈红莲等[18]研究报道,克氏原螯虾弗氏柠檬酸杆菌对喹诺酮类(萘啶酸、依诺沙星、诺氟沙星、恩诺沙星)、氨基糖苷类(新霉素、卡那霉素、庆大霉素、链霉素)、头孢他啶、复方新诺明等药物敏感,对克林霉素、头孢氨苄和新生霉素等耐药。有研究表明,中华绒螯蟹弗氏柠檬酸杆菌对头孢噻肟、头孢他啶、左氟沙星、氧氟沙星、庆大霉素、复方新诺明、甲氧嘧啶、甲氧苄啶等药物敏感,对青霉素G、头孢氨苄、克林霉素等耐药[15,19]。本研究表明,巴西龟弗氏柠檬酸杆菌TC-1分离菌株对第三代头孢菌素类(头孢哌酮、头孢他啶、头孢噻肟等),喹诺酮类(萘啶酸、恩诺沙星、诺氟沙星、左氟沙星),氨基糖苷类(新霉素、庆大霉素、卡那霉素、链霉素)等药物敏感,而对阿莫西林、头孢氨苄和磺胺类(磺胺异亚唑、甲氧嘧啶、复方新诺明)等药物耐药。以上研究结果表明,水产致病性弗氏柠檬酸杆菌对第三代头孢菌素类、喹诺酮类、氨基糖苷类等多种药物敏感,对青霉素类、磺胺类药物等敏感性较差[15,18-19]。值得注意的是,本研究中药敏试验结果与其他学者报道弗氏柠檬酸杆菌对喹诺酮类、三代头孢菌素类药物敏感基本一致,但对磺胺类等药物敏感性存在差异,这可能与细菌寄主及所处地域使用的抗菌药物不同导致耐药菌株不同有关[25]。此外,本研究中在35种药物中发现,分离菌株TC-1对磺胺类等多种药物耐药。有研究表明,弗氏柠檬酸杆菌能分泌一种可水解青霉素类、头孢菌素类及单环类抗生素的CTX-M型超广谱β-内酰胺酶(ESBL),并证明其是导致弗氏柠檬酸杆菌产生多重耐药性的主要原因[7]。水产病原菌耐药性的产生,多数是由于不规范使用和过度使用抗菌药物造成的,且大量使用各种广谱抗菌药物,进一步加速了对耐药菌筛选形成。
为防止细菌耐药性的产生,应杜绝不合理用药和非对症用药。作者建议在防治水产动物细菌性疾病时应采取科学的方法筛选敏感药物,并加强微生态制剂的研究与使用,改善养殖环境以抑制病原菌的滋生。在水产养殖过程中,依据药敏试验结果不仅可为选择用药提供参考,而且为准确有效地利用药物临床治疗提供了一定帮助。
[1] 景水才,魏杰.浅谈北方地区巴西龟的养殖技术[J].水产科学,2006,25(9):477-479.
[2] 叶明皓,胡秀彩,吕爱军,等.巴西龟眼炎病原菌的分离鉴定及组织病理学研究[J].大连海洋大学学报,2018,33(5):564-569.
[3] 朱凝瑜,郑晓叶,曹飞飞,等.鳖源嗜水气单胞菌的耐药性研究[J].浙江农业学报,2017,29(9):1445-1450.
[4] Goldberg D W,Fernandes M R,Sellera F P,et al.Genetic background of CTX-M-15-producing Enterobacter hormaechei ST114 and Citrobacter freundii ST265 co-infecting a free-living green turtle (Chelonia mydas)[J].Zoonoses and Public Health,2019,doi:10.1111/zph.12572.
[5] Gallani S U,De A Sebastião F,Valladão G M R,et al.Pathogenesis of mixed infection by Spironucleus sp.and Citrobacter freundii in freshwater angelfish Pterophyllum scalare[J].Microbial Pathogenesis,2016,100:119-123.
[6] 高正勇,曾令兵,孟彦,等.患病大鲵中弗氏柠檬酸杆菌的分离与鉴定[J].微生物学报,2012,52(2):169-176.
[7] 刘恭植.微生物学和微生物学检验[M].北京:人民卫生出版社,1994:172-174.
[8] 周加利.柠檬酸杆菌O抗原基因簇RFLP分型及5个O血清型基因簇的破译[D].天津:南开大学,2011.
[9] 郑善坚.弗氏柠檬酸杆菌引起鱼、蛙溃烂病的防治案例[J].科学养鱼,2017(2):68-69.
[10] 阎斌伦,张晓君,梁利国,等.三疣梭子蟹病原弗氏柠檬酸杆菌的分离鉴定及定居因子抗原基因检测[J].水产学报,2012,36(3):391-398.
[11] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[12] 陆梦莹,胡秀彩,吕爱军,等.鲶源维氏气单胞菌的分离鉴定及药敏特性[J].大连海洋大学学报,2017,32(5):563-567.
[13] 赵克义,阚方琦.柠檬酸杆菌的分类近况[J].中国卫生检验杂志,2001,11(2):252-255.
[14] 薛巧,赵战勤,刘会胜,等.弗氏柠檬酸杆菌对动物和人致病性研究进展[J].动物医学进展,2015,36(7):81-85.
[15] 闫革彬,隋吉林,芦丹,等.一起弗氏柠檬酸杆菌所致食源性疾病调查[J].疾病监测,2013,28(3):247-248.
[16] Chuang Y M,Tseng S P,Teng L J,et al.Emergence of cefotaxime resistance in Citrobacter freundii causing necrotizing fasciitis and osteomyelitis[J].Journal of Infection,2006,53(3):e161-e163.
[17] Mohi G K,Datta P,Chander J,et al.Citrobacter freundii as a cause of acute suppurative thyroiditis in an immunocompetent adult female[J].Indian Journal of Pathology & Microbiology,2017,60(2):282-284.
[18] 陈红莲,宋光同,何吉祥,等.克氏原螯虾弗氏柠檬酸杆菌的分离鉴定与药敏试验[J].淡水渔业,2014,44(1):73-77.
[19] 陈翠珍,张晓君,房海,等.中华绒螯蟹病原弗氏柠檬酸杆菌的鉴定[J].中国人兽共患病杂志,2006,22(2):136-141.
[20] Bandeira Junior G,Dos Santos A C,De Freitas Souza C,et al.Citrobacter freundii infection in silver catfish (Rhamdia quelen):hematological and histological alterations[J].Microbial Pathogenesis,2018,125:276-280.
[21] Friedlander R S,Vlamakis H,Kim P,et al.Bacterial flagella explore microscale hummocks and hollows to increase adhesion[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(14):5624-5629.
[22] Cohen J.The immunopathogenesis of sepsis[J].Nature,2002,420(6917):885-891.
[23] 林启存,朱丽敏,李忠全,等.中华鳖弗氏柠檬酸杆菌败血症病原分离鉴定与药敏试验[J].水产科学,2008,27(1):42-43.
[24] Watts J E M,Schreier H J,Lanska L,et al.The rising tide of antimicrobial resistance in aquaculture:sources,sinks and solutions[J].Marine Drugs,2017,15(6):158.
[25] 石征宇,易弋,黄德生,等.一株弗氏柠檬酸杆菌的分离鉴定及致病性研究[J].中国畜牧兽医,2018,45(2):479-485.