南极气温非常低,降水量小而蒸发量大,常年为冰雪覆盖,冰量占世界总量的90%左右,被称为第七大陆[1]。南大洋与其他大洋相比,鱼类种类非常有限,目前共发现的南极鱼种类有322种[2],集中分布在南大洋的中层和底层。在这些南极鱼中,以南极鱼科鱼类占主导地位。革首南极鱼Notothenia coriiceps和伯氏肩孔南极鱼Trematomus bernacchii均属硬骨鱼纲Osteichthyes、鲈形目Perciform、南极鱼科Nototheniidae,均分布在0~550 m南极海洋水体中。两种南极鱼因其具有重要的商业价值和科学研究意义受到全球关注[2]。
南极的极端环境使南极微生物产生了诸多适应性变化。近年来,对南极微生物多样性、特殊生理生化性质、低温酶等的研究已成为许多专家学者的重点研究方向。如Miller等[3]在南极土壤中对一株嗜冷细菌进行了分离并研究了其化学性质;Brambilla等[4]对南极McMurdo站附近湖泊中不可培养和可培养的原核生物进行了初步分析;丁新彪等[5]利用16S rRNA研究了南极普里兹及邻近海域沉积物微生物的多样性;肖昌松等[6]对南极半岛及舍得兰群岛海底沉积物的低温菌进行了分析鉴定。这些研究均证实,南极海域具有丰富的微生物多样性。
鱼类皮肤是抵御环境微生物侵害的第一道防线,研究鱼类皮肤微生物的种类与多样性,可以直接反映出环境水体对鱼类的影响。通过探知鱼类皮肤微生物的优势菌群与不同鱼类皮肤微生物菌群的差异,将有助于探究不同鱼类对环境微生物的免疫应答机制[7-8]。而目前对于南极鱼皮肤微生物多样性的研究尚未见报道。
最初的微生物多样性研究依赖于人工培养技术。而自然界中大量微生物无法利用现有方法进行培养,可培养的微生物种类还不足1%[9]。随着分子生物学技术的发展,出现了基于16S rDNA的分析技术。通过16S rDNA序列多样性直接在分子层面研究微生物多样性,突破了微生物可培养性的限制,已成为细菌系统分类研究中最常用的分子标记[10]。本试验中,针对中山站采集的伯氏肩孔南极鱼和长城站采集的革首南极鱼,提取鱼体皮肤的总DNA,以16S rDNA为分子标记,采用高通量测序技术分析了两种南极鱼皮肤的微生物多样性,初步了解南极鱼皮肤微生物的种类与菌群结构,旨在为后续对鱼类皮肤微生物功能研究提供参考数据。
1 材料与方法
1.1 材料
样本来自雪龙号第 27~28次南极科考项目,为南极中山站外海生物调查取样的伯氏肩孔南极鱼和长城站采集的革首南极鱼。两种南极鱼采集后立即冻存于-80 ℃的超低温冰箱中备用。
1.2 方法
1.2.1 样本总DNA的提取 将保存于-80 ℃的革首南极鱼(以下简记为NC)和伯氏肩孔南极鱼(以下简记为TB)取出。分别取两种南极鱼各3个样本的相同部位、相同质量的鱼体皮肤,包括皮肤黏液、鱼鳞、鱼体皮肤组织,分别记为NC1、NC2、NC3,TB1、TB2、TB3,用于总DNA的提取。利用天根海洋动物组织基因组DNA提取试剂盒提取两种鱼体皮肤总DNA。提取的总DNA经10 g/L琼脂糖凝胶电泳检测完整性,用超微量分光光度计(Thermo Nano Drop 2000)检测浓度。检测合格后于-80 ℃保存,用于后续试验。
1.2.2 16S rDNA序列扩增 参考徐爱玲等[11]利用不同通用引物对污泥中微生物多样性分析的研究,通过预试验发现,利用V3引物的扩增效率最好。因此,本试验中选用通用引物338F~806R扩增细菌16S rDNA序列片段V3区。所用引物序列为338F:5′ACTCCTACGGGAGGCAGCAG 3′,806R:5′GGACTACHVGGGTWTCTAAT 3′。在此段引物中加入不同的Barcode以区别不同的样本。PCR扩增长度为300~500 bp。PCR反应采用S1000TM Thermal Cycler,20 μL反应体系,DNA模板1000 ng。PCR反应程序为:95 ℃下预变性3 min;95 ℃下变性30 s,55 ℃下退火30 s,72 ℃下延伸45 s,共进行27个循环;最后在72 ℃下延伸10 min。每个样本设3个重复,重复样本PCR产物合并后经10 g/L琼脂糖凝胶电泳检测,浓度和特异性合格后用于后续高通量测序。
1.2.3 16S rDNA PCR产物高通量测序 利用第二代DNA高通量测序技术进行16S rDNA PCR产物测序,由上海美吉生物医药科技有限公司完成测序。
1.3 测序原始数据处理
MiSeq测序得到双端序列数据,以fastq格式存储,分为fq1和fq2两个文件。根据文件中存储的每条 read的质量值信息,去除测序质量较低的碱基。方法是在每条read尾部设置50 bp的窗口,若平均质量分数低于20,截去末端碱基。根据序列配对关系进行拼接,最小重叠长度为10 bp,最大错配率为0.2。拼接后得到优化序列,根据引物和索引序列区分不同样本。
为便于分析,将相似的优化序列进行聚类。相似性高于97%的序列归为一个分类单元,即一个OTU(Operational Taxonomic Units, OTUs)。在聚类过程中去除嵌合体。采用 RDP classifier贝叶斯算法对97%相似水平的 OTU代表序列进行分类学分析,选用Silva核糖体数据库。利用上海美吉线上分析平台Trimmomatic和FLASH软件获得clean data,用Usearch和 RDP Classifier软件进行OUT聚类。分析两种南极鱼皮肤微生物菌群的多样性与微生物菌群差异性等。
2 结果与分析
2.1 两种南极鱼皮肤微生物多样性
2.1.1 测序数据 对所提取的6个南极鱼皮肤样本进行16S rDNA高通量测序,一共得到有效序列378 517条,平均长度为442 bp。在97%相似性水平上进行聚类,共得到740个OTU。TB包括356个,NC包括615个。TB和NC的共有OTU数目为231个,TB特有的OTU数目为384个,NC特有的OTU数目为125(图1)。
对序列进行随机抽样,统计抽样样本的序列数和OTU数目,绘制稀释曲线(Rarefaction curve)。稀释曲线可以用来反映测序量是否能够足够反映样品中的大部分微生物,即物种丰度。NC和TB的曲线都较平坦,稀释曲线已经接近平台期,说明更大的测序量不会引起OTU数目的显著增长。可见,基于现有数量的分析结果准确可靠(图2)。
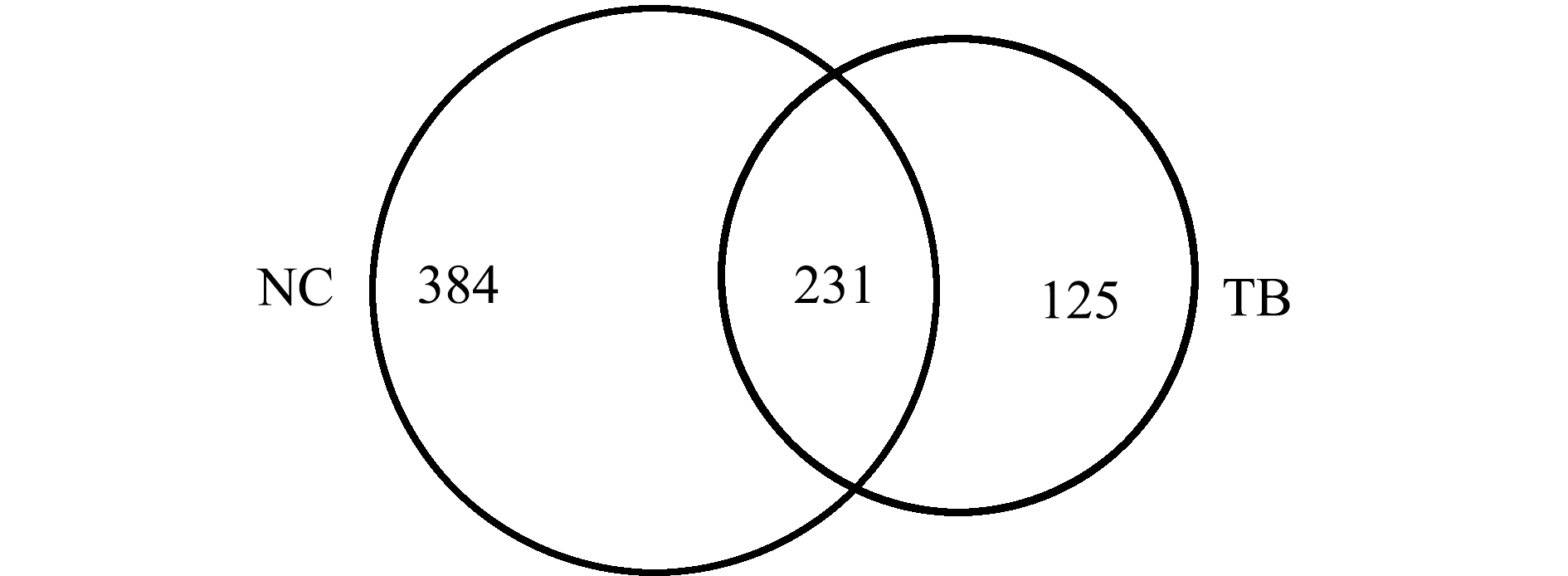
图1 OTU分布韦恩图
Fig.1 Venn diagram showing the distribution of OTUs
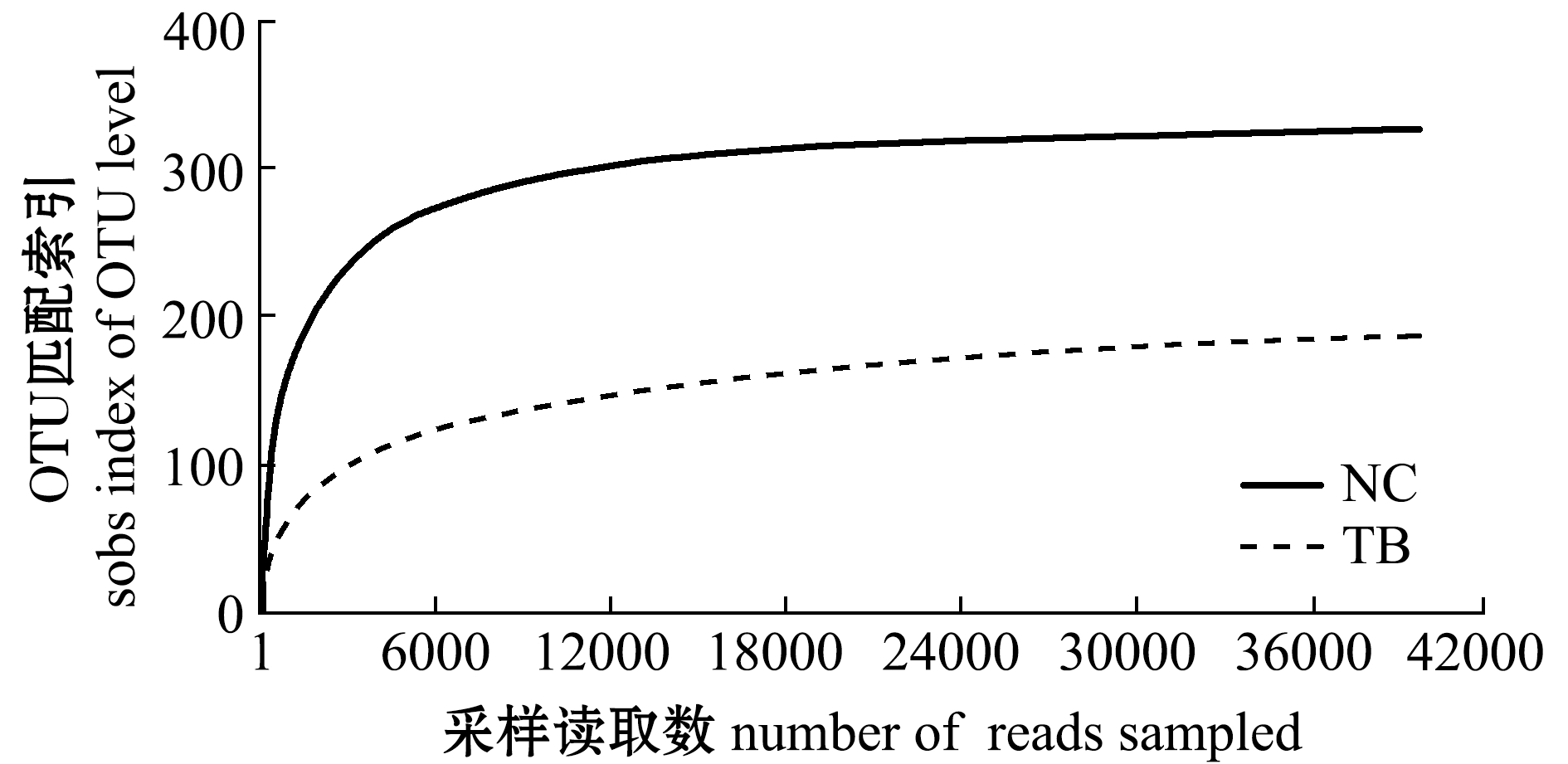
图2 OTU稀释曲线
Fig.2 Rarefaction curve of OTUs
2.1.2 两种南极鱼皮肤微生物多样性分析 测序结果及微生物多样性分析可以用不同的指数来表示[12]。常用的多样性指数包括Shannon、Simpson、Ace指数等。Shannon指数是用来估算样本中微生物多样性的指数之一,其值越大说明群落多样性越高。Simpson指数在生态学中常用来定量描述一个区域的生物多样性,其值越大说明群落多样性越低。Ace指数是用来估计群落中OTU的数目。Chao指数也是用来估计样本中所含OTU的数目。
两种南极鱼的6个皮肤样本中微生物多样性测序结果(表1)显示:测序覆盖率均在99%以上,这表明测序结果可以反映样本中微生物的真实情况;4个多样性指数在6个样本中呈现一定范围的波动性变化。
表1 6个样本的多样性指数
Tab.1 Diversity indices of the six samples
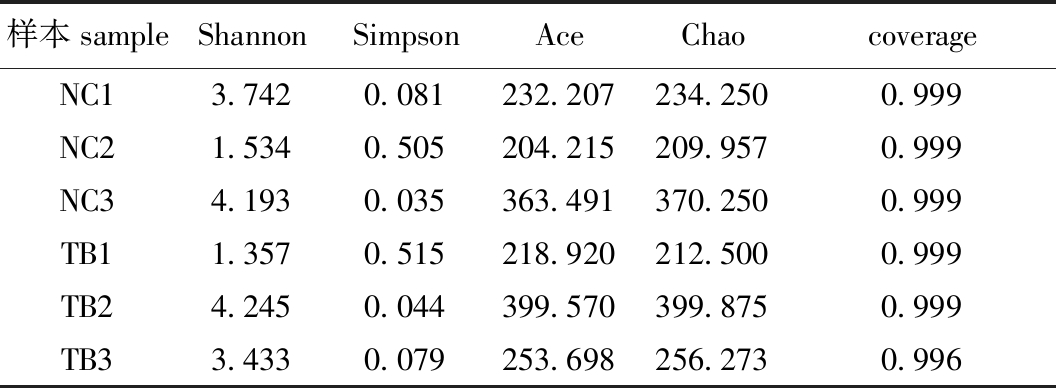
样本sampleShannonSimpsonAceChaocoverageNC13.7420.081232.207234.2500.999NC21.5340.505204.215209.9570.999NC34.1930.035363.491370.2500.999TB11.3570.515218.920212.5000.999TB24.2450.044399.570399.8750.999TB33.4330.079253.698256.2730.996
2.2 两种南极鱼皮肤优势菌群比较
2.2.1 门水平上优势菌群比较 从图3-A可见,在伯氏肩孔南极鱼(TB)和革首南极鱼(NC)皮肤中共检测出6个菌门和1个未分类菌门,包括厚壁菌门Firmicutes、变形菌门Proteobacteria、异常球菌-栖热菌门Deinococcus-Thermus、拟杆菌门Bacteroidetes、软壁菌门Tenericutes、放线菌门Actinobacteria和未分类菌门。
从图3-B可见,伯氏肩孔南极鱼皮肤菌群中,厚壁菌门占比最多,为58.80%,其次为变形菌门,占32.27%,软壁菌门最少,仅占1.85%。从图3-C可见,革首南极鱼皮肤菌群中,变形菌门占比最多,为43.27%,其次为厚壁菌门,占34.77%,异常球菌-栖热菌门最少,仅占1.02%。
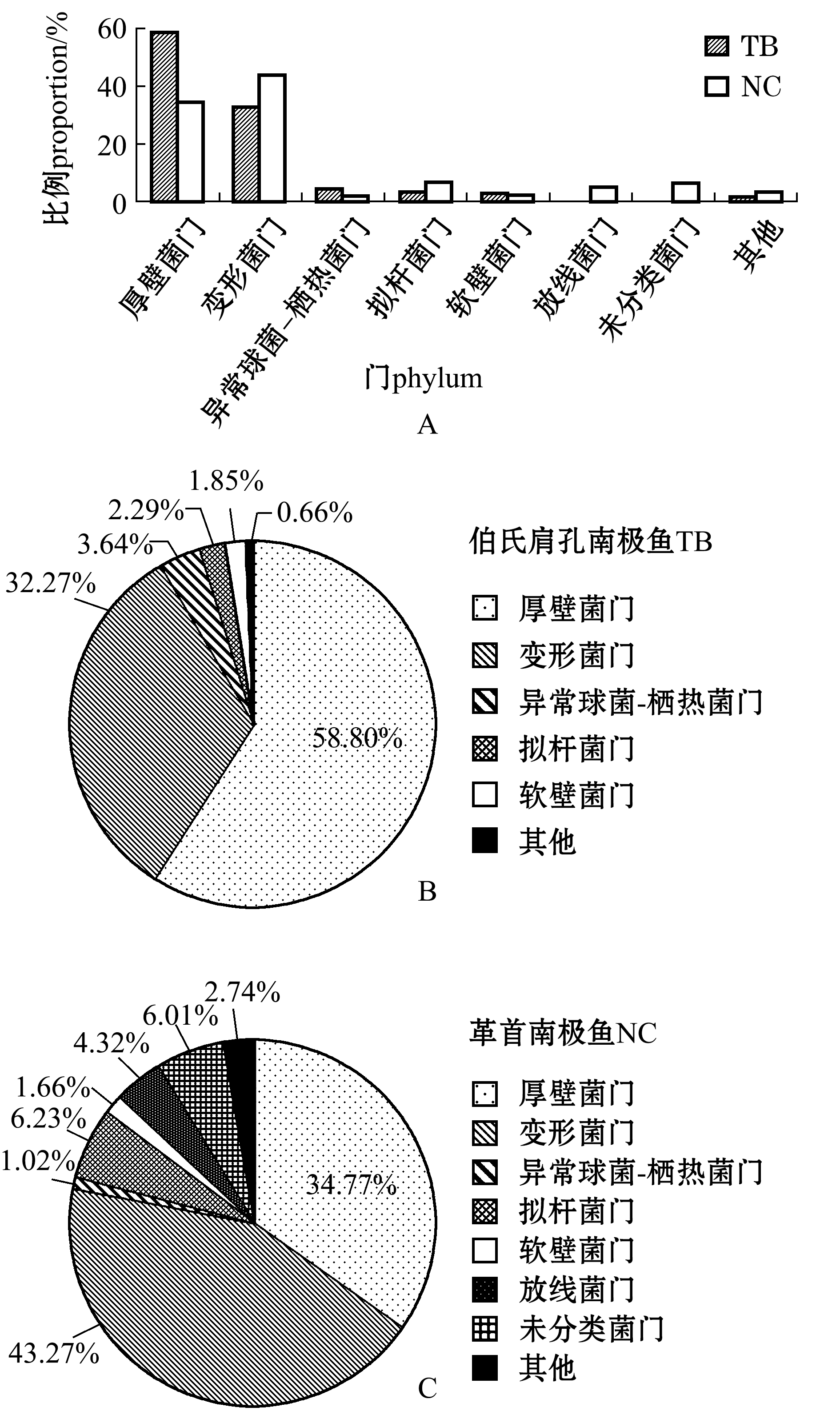
注:A,门水平上对两种南极鱼皮肤微生物菌群结构分析;B,南极鱼TB皮肤微生物优势菌群;C,南极鱼NC皮肤微生物的优势菌群
Note:A,analysis of microflora structure of skin microflora in two species of Antarctic fish by phylum level;B,dominant bacterial flora of TB skin in Antarctic fish;C,dominant microflora of NC skin of Antarctic fish
图3 伯氏肩孔南极鱼(TB)和革首南极鱼(NC)在门水平的皮肤优势菌群分布
Fig.3 Dominant bacterial population profile in the skin of Antarctic fishes Trematomus bernacchii (TB) and Notothenia coriiceps (NC) at phylum level
2.2.2 属水平上优势菌群比较 从图4可见,在两种南极鱼皮肤中共检测出8个菌属和1个未分类属,包括厌氧芽孢杆菌属Anoxybacillus、火山岩菌属Vulcaniibacterium、芽孢杆菌属Bacillus、嗜冷杆菌属Psychrobacter、青枯菌属Ralstonia、短波单胞菌属Brevundimonas、假单胞菌属Pseudomonas、嗜甲基菌属Methylophilus和未分类属。
两种南极鱼皮肤在属水平上的优势菌群的分布呈现一定的差异。伯氏肩孔南极鱼皮肤的优势菌群集中为厚壁菌门的厌氧芽孢杆菌属,所占比例高达50.34%,其次为火山岩菌属和嗜冷杆菌属,所占比例分别为9.00%和6.15%。革首南极鱼皮肤的绝对优势菌群也是厌氧芽孢杆菌属,占比为12.14%,另外4种优势菌属为芽孢杆菌属、青枯菌属、假单胞菌属、嗜甲基菌属,其比例分别为8.75%、5.84%、4.41%和4.45%。两种南极鱼皮肤中的主导微生物菌群为厌氧芽孢杆菌属。
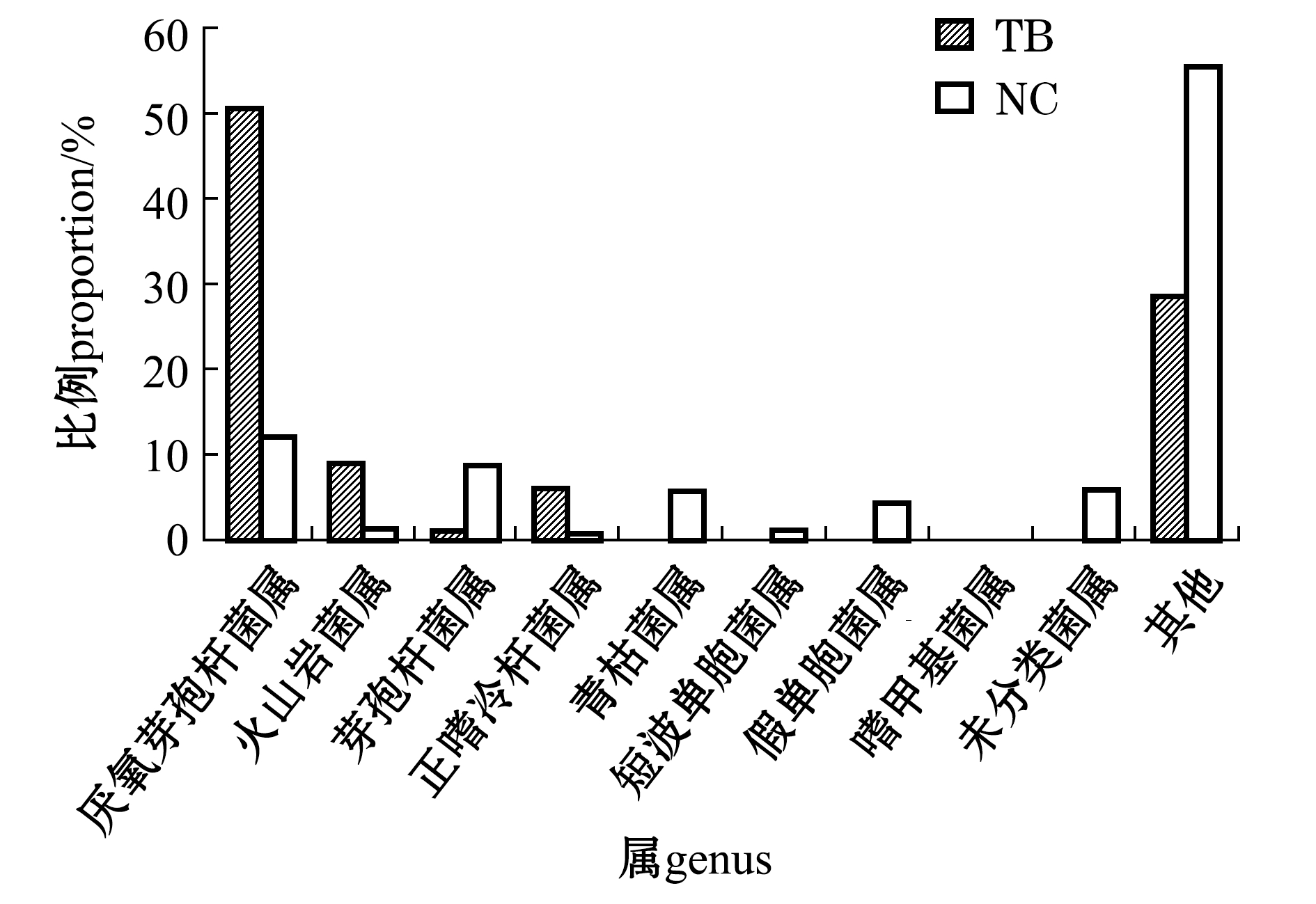
图4 伯氏肩孔南极鱼(TB)和革首南极鱼(NC)在属水平的皮肤优势菌群分布
Fig.4 Dominant bacterial population in the skin of TB and NC in genus level
2.3 南极鱼个体间及物种间皮肤微生物菌群比较
2.3.1 同种鱼不同个体间微生物菌群比较 从图5可见:基于OTUs水平的主成分分析显示,以主成分2(PCA2)为纵坐标轴,对检测到的总微生物的代表性贡献率为9.81%,以主成分1(PCA1)为横坐标,贡献率为82.15%;3个革首南极鱼个体(NC1、NC2、NC3)呈明显聚类,而伯氏肩孔南极鱼中有一个样本(TB2)不能与其他两个个体(TB1、TB3)明显聚类,这表明3个革首南极鱼个体的皮肤微生物菌落组成相似,而两个伯氏肩孔南极鱼(TB1、TB3)皮肤微生物群落的组成相似。
2.3.2 不同种鱼之间微生物菌群差异分析 采用Wilcoxon秩和检验法,分别在门水平和属水平上对两种南极鱼皮肤菌群进行双尾检验。从图6可见,两组间在门水平和属水平上,各种菌群的P值均大于0.05。这表明,两种南极鱼皮肤的微生物种群间无显著性差异。
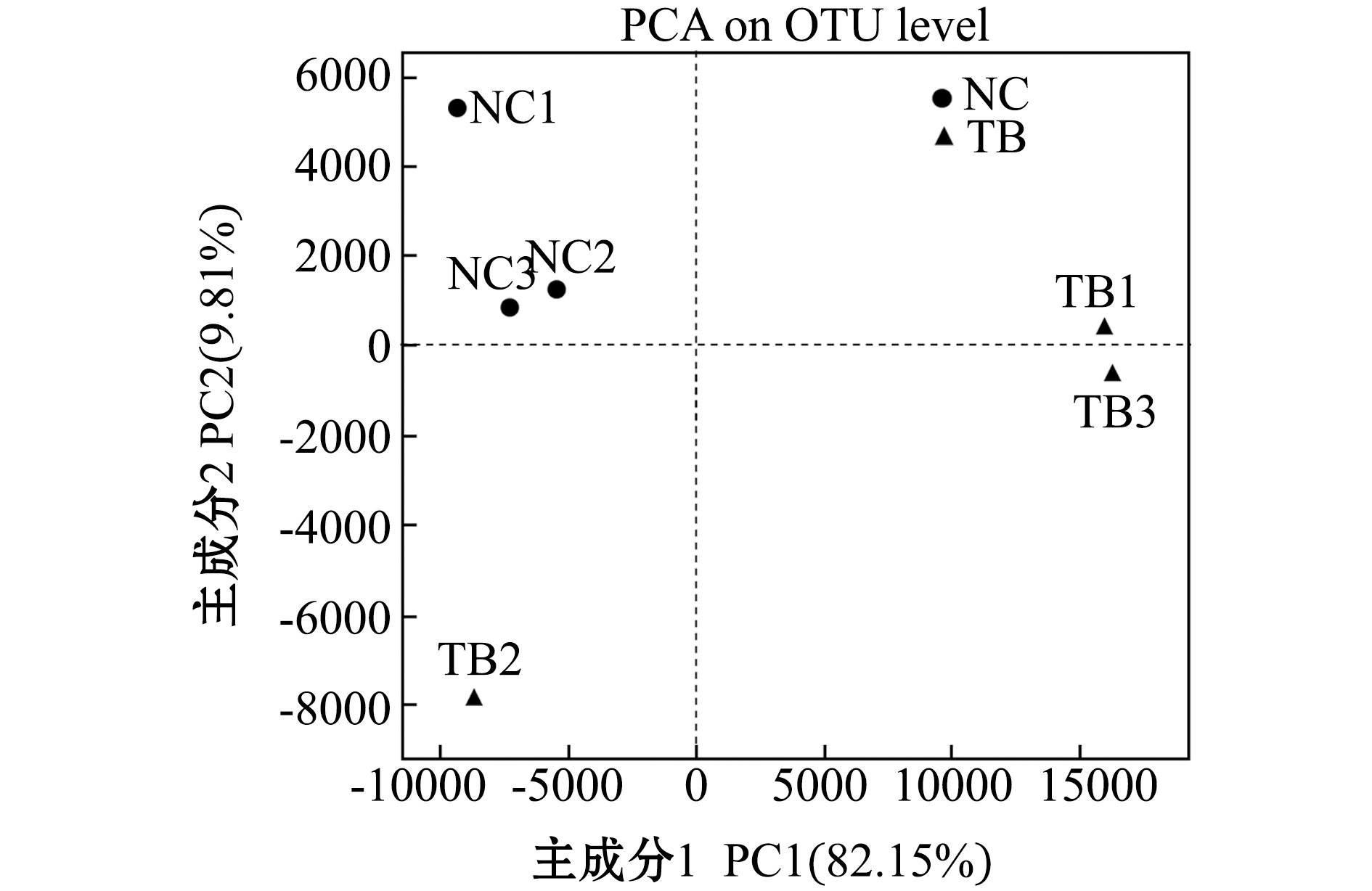
图5 主成分分析结果
Fig.5 Result of principal component analysis(PCA)
3 讨论
南极环境特殊,与南极其他生物相比,微生物具有较强的环境适应性,微生物的种类和数量是南极生态结构和物质能量循环中的重要环节[13]。南极鱼类皮肤微生物的种类与多样性,可以直接反映出南极环境水体对鱼类的影响。本研究中针对南极中山站的伯氏肩孔南极鱼和长城站的革首南极鱼,利用16S rDNA分子标记进行微生物多样性分析,结果显示,伯氏肩孔南极鱼皮肤微生物优势菌群包括厚壁菌门、变形菌门、异常球菌-栖热菌门、拟杆菌门、软壁菌门等5个菌门,革首南极鱼皮肤微生物优势菌群包括变形菌门、厚壁菌门、拟杆菌门、放线菌门、软壁菌门、异常球菌-栖热菌门等6个菌门。据张丽珉等[14]的研究可知,南极罗斯海海域可培养微生物为放线菌门、厚壁菌门、变形菌门和拟杆菌门等4个门,与本研究所得到的南极鱼皮肤微生物所属门类相似,两种南极鱼皮肤微生物的优势菌群包含了南极罗斯海海域可培养的4种微生物门类。可以推测,南极鱼皮肤与环境海洋水体直接接触,皮肤的微生物类群与其生活的海洋环境水体密切相关。需要指出的是,张丽珉等[14]所获得的南极罗斯海海域微生物菌群是通过分离培养来实现的,而本研究中是直接通过高通量测序获得,故所获得的微生物菌群也更完整一些。
目前,关于海洋鱼类皮肤的微生物多样性研究仅有少数的报道。Chiarello等[15]研究了44种珊瑚菌纲Alphaproteobacteria、蓝藻纲Cyanobacteria、礁鱼的皮肤微生物多样性,珊瑚鱼皮肤中的微生物主要为γ-变形菌纲Gammaproteobacteria、α-变形黄杆菌纲Flavobacteria、梭菌纲Clostridia、拟杆菌纲Bacteroidetes、酸微菌纲Acidimicrobiia、疣微菌纲Verrucomicrobiae、β-变形菌纲Betaproteobacteria、ε-变形菌纲Epsilonproteobacteria、鞘脂杆菌纲Sphingobacteria、纤维粘网菌纲Cytophagia、梭杆菌纲Fusobacteria、放线菌纲Actinobacteria、δ-变形菌纲Deltaproteobacteria、浮霉菌纲Planctomycetacia、芽孢杆菌纲Bacilli、丰祐菌纲Opitutae等。Doane等[16]研究表明,正常长尾鲨皮肤微生物菌群为变形菌门Proteobacteria、拟杆菌门Bacteroidetes、浮霉菌门Planctomycetes、放线菌门Actinobacteria、厚壁菌门Firmicutes、子囊菌门Ascomycota、蓝藻门Cyanobacteria、疣微菌门Verrucomicrobia、病毒viruses和绿菌门Chlorobi等。Karlsen等[17]对北极海水浴场中健康大西洋鲑皮肤微生物菌群和长有皮肤溃疡个体的皮肤微生物菌群进行了比较,结果表明,健康鲑皮肤微生物菌群的多样性高于溃疡部位,溃疡部位微生物菌群多样性高于溃疡边缘部位。进一步分析显示,鲑皮肤微生物菌群主要为黄杆菌科Flavobacteriaceae、弯曲菌科Campylobacteraceae、弧菌科Vibrionaceae、动球菌科Planococcaceae、丛毛单胞菌科Comamonadaceae等菌群。Lowrey等[18]研究了虹鳟皮肤微生物菌群主要有酸杆菌门Acidobacteria、放线菌门Actinobacteria、装甲菌门Armatimonadetes、拟杆菌门Bacteroidetes、绿菌门Chlorobi、绿弯菌门Chloroflexi、蓝藻门Cyanobacteria、厚壁菌门Firmicutes、梭杆菌门Fusobacteria、芽单胞菌门Gemmatimonadetes、浮霉菌门Planctomycetes、变形菌门Proteobacteria、柔膜菌门Tenericutes和疣微菌门Verrucomicrobia等。综上分析可以发现,厚壁菌门、拟杆菌门和变形菌门在珊瑚礁鱼、长尾鲨、鲑鱼、虹鳟及两种南极鱼的皮肤样本中都存在,说明这3种微生物菌门普遍存在于水生生物皮肤中。变形菌门在这两种南极鱼皮肤微生物中占有非常大的优势,是革首南极鱼皮肤的第一大优势菌群,所占比例高达43.27%,在伯氏肩孔南极鱼皮肤中占比达32.7%,仅次于厚壁菌门成为第二大菌群。通过比较后不难发现,南极鱼皮肤特有异常球菌-栖热菌门、软壁菌门两大类菌群,推测这两大类菌群与南极海洋环境密切相关。
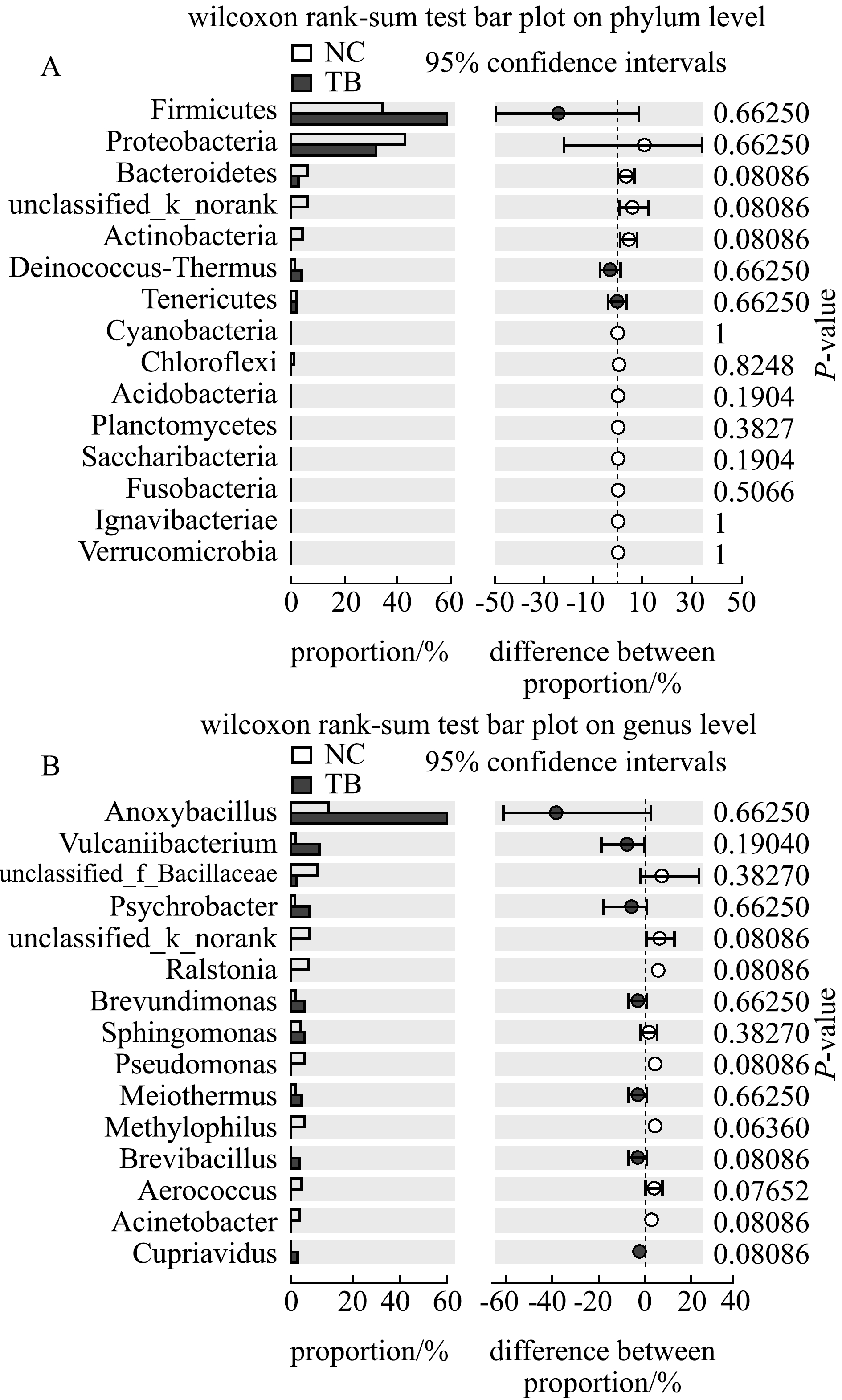
注:A为两种南极鱼皮肤微生物在门水平的组间检验;B为两种南极鱼皮肤微生物在属水平的组间检验
Note:A,Skin microbes are compared between the two Antarctic fish species at phylum level;B,Skin microbes are compared between the two Antarctic fish species at the genus level
图6 两种南极鱼皮肤微生物在门、属水平的组间检验
Fig.6 Intergroup test of microorganisms in skins of two Antarctic fishes at the levels of phylum and genus
Carda-Diéguez等[19]研究指出,鱼体皮肤微黏膜微生物是自然进化过程中形成的水生黏膜生态位,可以推测,两种南极鱼皮肤微生物菌群可能已形成了一个较为固定的微生态位。虽然伯氏肩孔南极和革首南极鱼分别来自南极中山站、长城站附近海域,但本研究中并未检测出两种南极鱼皮肤微生物具有显著性差异,推测可能是南极中山站和长城站附近海域的环境微生物比较接近的缘故。
[1] 严立恩.南极乔治王岛陆地和潮间带放线菌多样性研究[D].青岛:中国海洋大学,2015.
[2] Eastman J T.The nature of the diversity of Antarctic fishes[J].Polar Biology,2005,28(2):93-107.
[3] Miller K J,Leschine S B,Huguenin R L.Characterization of a halotolerant-psychroloterant bacterium from dry valley Antarctic soil[J].Advances in Space Research,1983,3(8):43-47.
[4] Brambilla E,Hippe H,Hagelstein A,et al.16S rDNA diversity of cultured and uncultured prokaryotes of a mat sample from Lake Fryxell,McMurdo Dry Valleys,Antarctica[J].Extremophiles,2001,5(1):23-33.
[5] 丁新彪,丛柏林,张扬,等.南极普里兹湾及邻近海域沉积物微生物多样性与生理生化研究[J].海洋科学进展,2014,32(2):209-218.
[6] 肖昌松,周培瑾,王大珍.南极地区海底沉积物中低温菌的鉴定与生长温度特征[J].微生物学报,1990,30(4):233-242.
[7] Schloss P D.An integrated view of the skin microbiome[J].Nature,2014,514(7520):44-45.
[8] 吕爱军,胡秀彩,孙敬锋,等.鱼类皮肤免疫应答及蛋白质组学[J].水产科学,2016,35(3):302-307.
[9] 闫慧敏,姜薇.人类皮肤微生物群和皮肤疾病[J].中国皮肤性病学杂志,2015,29(12):1292-1294.
[10] Cogen A L,Nizet V,Gallo R L.Skin microbiota:a source of disease or defence?[J].British Journal of Dermatology,2008,158(3):442-455.
[11] 徐爱玲,吴等等,宋志文,等.引物选择对污泥微生物多样性分析的影响[J].环境科学,2013,34(9):3620-3626.
[12] 李明,刘继晨,孙雪莹,等.育苗阶段虾夷扇贝幼体中可培养细菌的多样性[J].大连海洋大学学报,2016,31(4):374-379.
[13] 张锐.南极阿德雷岛沉积物细菌多样性及环境意义[D].厦门:国家海洋局第三海洋研究所,2003.
[14] 张丽珉,赵琳,丛柏林.南极罗斯海区域可培养微生物分离鉴定及产低温酶能力初步筛选[J].海洋学报,2018,40(8):152-164.
[15] Chiarello M,Auguet J C,Bettarel Y,et al.Skin microbiome of coral reef fish is highly variable and driven by host phylogeny and diet[J].Microbiome,2018,6:147.
[16] Doane M P,Haggerty J M,Kacev D,et al.The skin microbiome of the common thresher shark (Alopias vulpinus) has low taxonomic and gene function β-diversity[J].Environmental Microbiology Reports,2017,9(4):357-373.
[17] Karlsen C,Ottem K F,Brevik Ø J,et al.The environmental and host-associated bacterial microbiota of Arctic seawater-farmed Atlantic salmon with ulcerative disorders[J].Journal of Fish Diseases,2017,40(11):1645-1663.
[18] Lowrey L,Woodhams D C,Tacchi L,et al.Topographical mapping of the rainbow trout (Oncorhynchus mykiss) microbiome reveals a diverse bacterial community with antifungal properties in the skin[J].Applied and Environmental Microbiology,2015,81(19):6915-6925.
[19] Carda-Diéguez M,Ghai R,Rodríguez-Valera F,et al.Wild eel microbiome reveals that skin mucus of fish could be a natural niche for aquatic mucosal pathogen evolution[J].Microbiome,2017,5:162.