强壮硬毛藻Chaetomorpha valid隶属于绿藻门Chlorophyta绿藻纲Chlorophyceae刚毛藻目Cladophorales刚毛藻科Cladophoraceae硬毛藻属Chaetomorpha,被确认为是外来入侵种[1-2]。该藻常年滋生在养殖池塘相对静止的水体中,因不易被动物直接摄食、不易腐烂,在刺参养殖池中大量繁殖,每年5—9月暴发,藻垫厚度可达20~30 cm[3],可将刺参缠绕致死,且藻体衰亡又能导致水体理化性质变化,引起一定的生态与经济问题,严重制约着刺参健康养殖业的发展[4]。研究掌握强壮硬毛藻生长规律,探索其暴发的生态原因,是对其进行生态防控措施的前提,对健康养殖、环境科学养护和管理具有重要意义。
藻类是初级生产者,无机元素是促其生长必需生源要素之一,其中氮和磷是藻类生长繁殖所需的大量元素[4]。氮是藻类生长繁殖最重要的必需营养元素之一,是构成细胞内蛋白质、核酸和叶绿素等的基本元素,不同氮源的获得、吸收和同化速率对藻的生长均有一定的影响[5]。海水中的无机氮主要为![]() 种形态,在近岸海域水体中,尤其是人工养殖海域水体,
种形态,在近岸海域水体中,尤其是人工养殖海域水体,![]() 的浓度通常高于
的浓度通常高于![]() 和
和![]() 浓度,在中国部分沿海海域占溶解态无机氮的比例高达50%~76%[6]。不同的氮磷比也会对藻类的生长和生化组成结构有着明显的作用,影响天然浮游植物群落结构组成[7]。Lenton等[8]研究表明,氮磷比16∶1是藻类生长的最适氮磷比例,氮磷比低于16∶1时被认为是氮限制,而氮磷比高于16∶1时被认为是磷限制。但不同种类藻细胞的元素组成不尽相同[9-10],对各类营养物质的需求也存在差异[11]。除了营养盐,环境因素也会对藻类生长产生影响。适宜盐度可促进藻类的正常生长繁殖,盐度过高或过低超出了正常调节范围时,藻类细胞会受损或凋亡。Taylor等[12]研究发现,在不同盐度下不同藻类的生长速率不同,盐度会影响叶绿素的合成,从而影响其光合作用;刘春光等[13]利用水族馆微宇宙研究发现,藻类在不同人为pH下生长及叶绿素浓度均有所变化。可见,环境因素对不同藻类生长影响的差异和重要性。目前,已有关于温度和光照对生长于湖泊中的强壮硬毛藻生长和繁殖影响的相关研究[14-15],但未见其他因素及其交互作用对养殖池塘中生长的强壮硬毛藻生长和光合作用影响的研究报道。
浓度,在中国部分沿海海域占溶解态无机氮的比例高达50%~76%[6]。不同的氮磷比也会对藻类的生长和生化组成结构有着明显的作用,影响天然浮游植物群落结构组成[7]。Lenton等[8]研究表明,氮磷比16∶1是藻类生长的最适氮磷比例,氮磷比低于16∶1时被认为是氮限制,而氮磷比高于16∶1时被认为是磷限制。但不同种类藻细胞的元素组成不尽相同[9-10],对各类营养物质的需求也存在差异[11]。除了营养盐,环境因素也会对藻类生长产生影响。适宜盐度可促进藻类的正常生长繁殖,盐度过高或过低超出了正常调节范围时,藻类细胞会受损或凋亡。Taylor等[12]研究发现,在不同盐度下不同藻类的生长速率不同,盐度会影响叶绿素的合成,从而影响其光合作用;刘春光等[13]利用水族馆微宇宙研究发现,藻类在不同人为pH下生长及叶绿素浓度均有所变化。可见,环境因素对不同藻类生长影响的差异和重要性。目前,已有关于温度和光照对生长于湖泊中的强壮硬毛藻生长和繁殖影响的相关研究[14-15],但未见其他因素及其交互作用对养殖池塘中生长的强壮硬毛藻生长和光合作用影响的研究报道。
强壮硬毛藻常年滋生于养殖池塘水体中,于5—7月暴发,而此时期池塘堤坝之隔的沿海却出现的是石莼、浒苔等丝状藻类暴发现象[16],可能池塘环境有促进该藻快速生长的因素存在。养殖环境中氮元素多以氨态氮的形式存在,其存在状态相对于其他形态氮极其不稳定。氨及铵离子的含量取决于水体中的pH和温度[17],pH的改变会影响水体中离子的浓度,进而影响盐度的变化,对水生生物的生存存在不同程度的影响。因此,刺参养殖池塘水体中氨态氮、pH和盐度等单因素及其交互作用可能会影响强壮硬毛藻快速生长,促进暴发进程。为此,本研究中通过室内培养试验,测定了强壮硬毛藻在以氨氮为唯一氮源时,氮磷比、盐度及pH等单因素试验和正交试验条件下的细胞形态、特定生长率和叶绿素荧光参数Fv/Fm,研究了盐度、pH和氮磷比及其交互作用对强壮硬毛藻生长和光合作用的影响,探究促进强壮硬毛藻在刺参养殖池塘快速生长的环境因子,为该藻暴发预警、生态防控和池塘环境科学养护和管理提供参考。
1 材料与方法
1.1 材料
强壮硬毛藻采自山东烟台某刺参养殖池塘,低温4 h内带回实验室去除附着的杂物,用灭菌海水冲洗干净,室温(25 ℃)下暂养于灭菌海水中[18-20]备用。
1.2 方法
1.2.1 培养海水及氨氮溶液的配制 培养海水采用去除Na2SiO3·9H2O和NaNO3的ESAW培养基,具体配方参照文献[21],其中磷含量为0.035 mmol/L。根据ESAW培养基中的氮含量,配制0.55 mol/L的NH4Cl贮备液备用。
1.2.2 单因素试验 取生长状况良好的实验室暂养的强壮硬毛藻,切成2.5 cm的藻段备用。将培养海水分别按照氮磷比8∶1、16∶1、40∶1、80∶1、120∶1(此时氨氮浓度分别为0.27、0.55、1.40、2.80、4.20 mmol/L)加入NH4Cl贮备液,每个培养皿加入25 mL对应氮磷比的培养海水。用蒸馏水和NaCl调节盐度,分别按照盐度24、28、30、32、34、36、40配制不同盐度的培养海水。用0.5 mol/L的NaOH和HCl溶液调节pH,分别按照pH 6.5、7.0、7.5、8.0、8.5配制不同pH的培养海水。按照10段/皿的密度放入藻段,每个处理设置3组平行。将培养皿放入光照恒温培养箱中持续培养,培养箱温度设置为25 ℃,pH为8.0,盐度为32,光照强度为148 μmol photo/(m2·s),光暗比为12 L∶12 D。每两天测定一次,并全部更新相应培养海水。培养试验共进行20 d。
(1)镜检。从每个培养皿中随机挑取藻段,显微镜(10×10)下观察强壮硬毛藻细胞状态,记录并拍照。
(2)生长指标。用直尺测量强壮硬毛藻的长度,每个培养皿中藻段以其特定增长率(SGR,%/d)[17]表示,其计算公式为
SGR=(lnLf-lnL0)/t×100%。
其中: Lf为强壮硬毛藻培养第t天时的长度(cm);L0为强壮硬毛藻初始长度(cm);t为培养时间(d)。
(3)最大光量子产量。将加有藻段的培养皿暗处理20 min之后,用掌上水体叶绿素荧光仪AquaPen-P AP-P 100(捷克Photon Systems Instruments公司)测定每个培养皿中藻段的最大光量子产量(Fv/Fm,Fv为可变荧光,Fm为最大荧光)。
1.2.3 正交试验 在单因素试验的基础上,选用正交表L27(313)考察盐度×氮磷比和pH×氮磷比之间的交互作用对硬毛藻生长的影响,进行3因素3水平的正交试验,各因素及水平见表1,以强壮硬毛藻的特定生长率[22]为考察指标。
表1 正交试验因素与水平表
Tab.1 Table of factors and levels in the orthogonal experiment
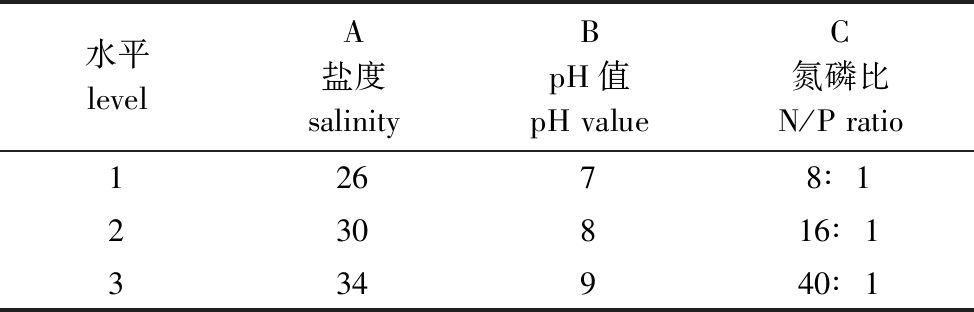
水平levelA盐度salinityBpH值pHvalueC氮磷比N/Pratio12678∶1230816∶1334940∶1
1.3 数据处理
试验数据采用平均值±标准差(mean±S.D.)表示,采用SPSS 19.0进行单因素方差分析,显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 单因素试验结果
2.1.1 氮磷比对强壮硬毛藻生长和光合作用的影响
(1)强壮硬毛藻形态。初始状态下,藻体颜色较深,细胞长度较短,细胞长度主要集中在130~250 μm(图1-A);氮磷比为8∶1和16∶1时,强壮硬毛藻颜色逐渐变浅(图1-B、C),试验末期(培养16 d之后)氮磷比为8∶1时仍有细胞处于分裂状态,细胞长度不一,细胞长度在130~420 μm之间均有分布(图1-D),而氮磷比为16∶1时细胞变得细长(图1-E),细胞大小均匀;氮磷比为40∶1、80∶1、120∶1时强壮硬毛藻在试验过程中颜色逐渐加深(图1-F);试验末期有的藻段细胞质萎缩,细胞呈灰白色,藻体极易断裂(图1-G)。
(2)特定生长率。图2为不同氮磷比下强壮硬毛藻SGR在20 d内的变化情况。培养周期内,不同氮磷比下强壮硬毛藻长度均呈现先迅速上升后逐步平稳的变化趋势(氮磷比8∶1除外),且在不同氮磷比下,强壮硬毛藻藻段的增长速度有明显的不同(P<0.01)。从整体来看,氮磷比为8∶1和16∶1时强壮硬毛藻长势较好,从第16天开始,氮磷比为8∶1时的强壮硬毛藻SGR超过氮磷比为16∶1时,从第18天开始,氮磷比为16∶1时的强壮硬毛藻SGR变化缓慢;氮磷比为40∶1时,在前16 d强壮硬毛藻的生长情况和氮磷比为8∶1的生长情况相似,第16天之后强壮硬毛藻开始消亡;氮磷比为80∶1和120∶1时,强壮硬毛藻生长较缓慢,SGR明显低于其他组(图2)。这表明,氮磷比直接影响强壮硬毛藻的生长速度及长度,氮磷比为8∶1和16∶1时可促进强壮硬毛藻生长,而氮磷比为80∶1和120∶1对强壮硬毛藻的生长最不利。

注:A,藻初始状态;B,氮磷比8∶1前16 d;C,氮磷比16∶1前16 d;D,氮磷比8∶1后4 d;E,氮磷比16∶1后4 d;F,色素加深藻细胞;G,枯萎藻细胞;比例尺为300 μm
Note:A,initial state of alga; B, the first 16 days at ratio of nitrogen to phosphorus = 8∶1; C,the first 16 days at ratio of nitrogen to phosphorus = 16∶1; D, the later 4 days at 8∶1; E,the later 4 days at 16∶1; F,algal cells with deep pigments; G,withered algal cells; bar scale=300 μm
图1 氮磷比对强壮硬毛藻形态的影响(显微镜放大倍数10 × 10)
Fig.1 Effect of N/P ratio on morphology of the seaweed Chaetomorpha valid (10×10)
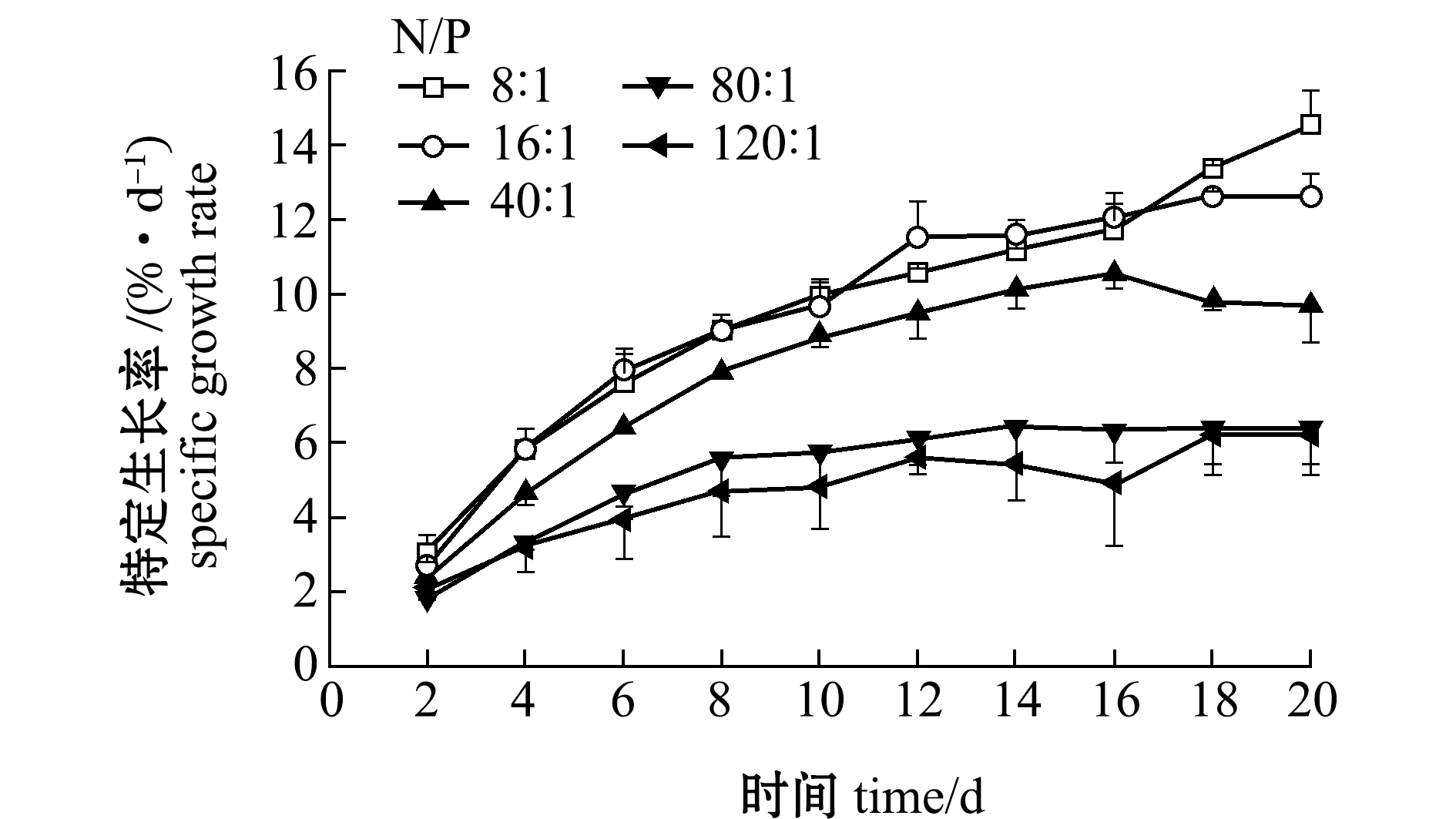
图2 氮磷比对强壮硬毛藻特定生长率的影响
Fig.2 Effect of N/P ratio on the SGR of sea weed Chaetomorpha valid
(3)最大光量子产量。从图3可见:第16天时不同氮磷比之间的最大光量子产量有极显著性差异(P<0.01),其他时间下不同氮磷比之间的最大光量子产量均无显著性差异(P>0.05);培养第4天时,Fv/Fm随着氮磷比的增高而降低(除40∶1外),氮磷比为80∶1和120∶1时Fv/Fm值在0.50左右,氮磷比为8∶1、16∶1和40∶1时的Fv/Fm值在0.60左右,可见,高氮磷比对强壮硬毛藻的光合作用产生了抑制;培养至第8天时,除了氮磷比为8∶1和16∶1,其他3组强壮硬毛藻的Fv/Fm均有所增高,说明强壮硬毛藻对高氮磷比有所适应;第10天时相较于第6天强壮硬毛藻的Fv/Fm变化较小,且Fv/Fm值在0.60左右;但在第12天时5组强壮硬毛藻的Fv/Fm都有所下降;培养至第16天时,除了氮磷比8∶1时强壮硬毛藻Fv/Fm相对第14天时有大幅度增加外,其他组都已降低至0.40左右,说明从第12天开始这些氮磷比下强壮硬毛藻开始消亡或者增长速度降低,除氮磷比为8∶1外,其他组的生长周期基本为12 d左右。
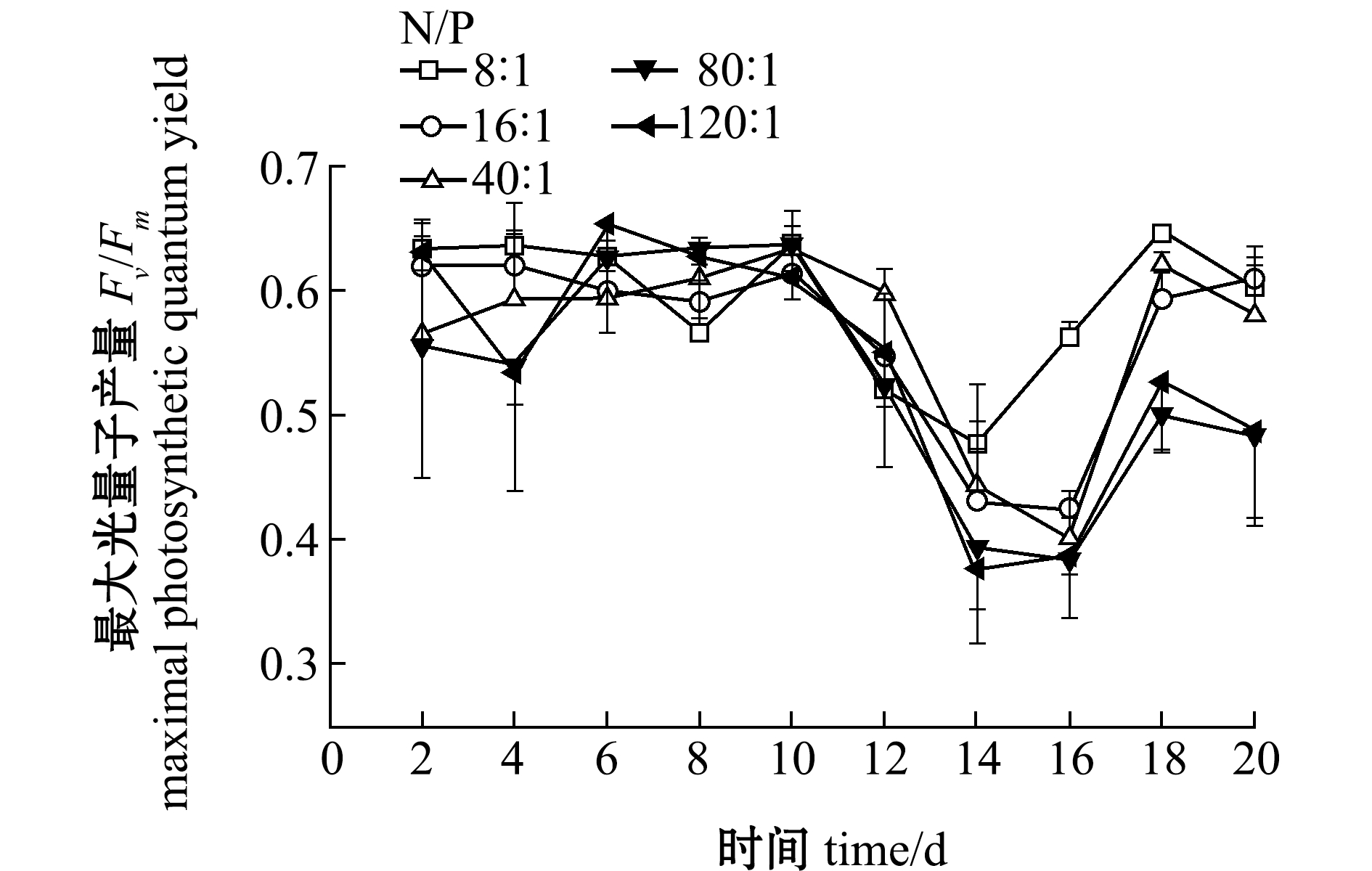
图3 氮磷比对强壮硬毛藻最大光量子产量Fv/Fm的影响
Fig.3 Effect of N/P ratio on the maximal photosynthetic quantum yield of sea weed Chaetomorpha valid
2.1.2 盐度对强壮硬毛藻生长和光合作用的影响
(1)特定生长率。从图4可见:培养周期内,不同盐度下强壮硬毛藻长度均随着培养时间的延长逐步增加;高盐度36和40之间无显著性差异(P>0.05),24、28、30、32、34盐度之间也无显著性差异(P>0.05),但高盐度(36和40)和其他盐度之间的差异极显著(P<0.01),而且盐度36和40下强壮硬毛藻SGR较低,这说明盐度24~34均可促进该藻生长。
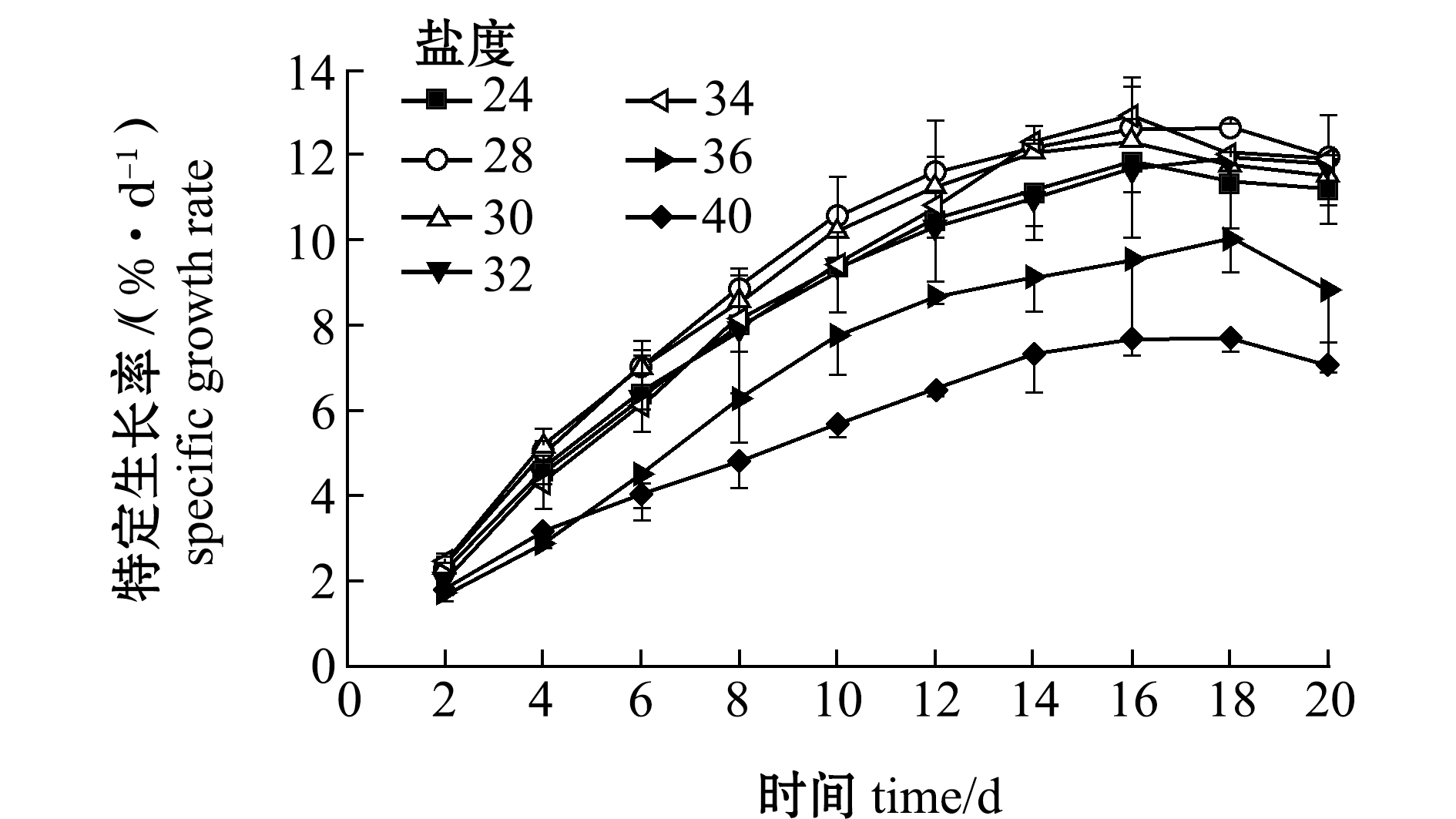
图4 盐度对强壮硬毛藻特定生长率的影响
Fig.4 Effect of salinity on the SGR of sea weed Chaetomorpha valid
(2)最大光量子产量。盐度对强壮硬毛藻的最大光量子产量(Fv/Fm)的影响无显著性影响(P>0.05),故本研究中只列出培养初始(第4天)和培养结束(第20天)时的测定结果,如表2所示。培养第4天时,Fv/Fm随着盐度的增加无显著性变化(P>0.05),不同盐度下Fv/Fm均在0.6~0.7之间,该藻保持较好的光合作用,可见培养初期不同盐度对强壮硬毛藻的光合作用并未产生太大影响;培养至第20天时,相较于培养初期的Fv/Fm值有所降低,但不同盐度之间也无显著性差异(P>0.05)(表2)。
表2 盐度对强壮硬毛藻最大光量子产量Fv/Fm的影响
Tab.2 Effect of salinity on the maximal photosynthetic quantum yield of sea weed Chaetomorpha valida
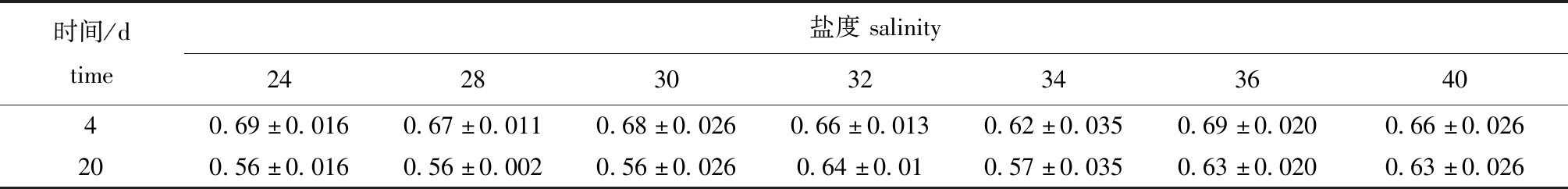
时间/dtime盐度salinity2428303234364040.69±0.0160.67±0.0110.68±0.0260.66±0.0130.62±0.0350.69±0.0200.66±0.026200.56±0.0160.56±0.0020.56±0.0260.64±0.010.57±0.0350.63±0.0200.63±0.026
2.1.3 pH对强壮硬毛藻生长和光合作用的影响
(1)特定生长率。从图5可见:培养前4 d,各pH组的增长幅度基本相同,且斜率最大,SRG增加最快,可能是由于培养初期pH对强壮硬毛藻影响不显著(P>0.05);培养第4天后,不同pH条件下,强壮硬毛藻SGR发生了明显变化,pH为8时强壮硬毛藻藻段长势最好,SGR增加最快,其他pH下强壮硬毛藻的长度均无显著性差异(P>0.05),pH为6.5时强壮硬毛藻生长缓慢;培养16 d后,SGR基本无明显变化,长度稳定在(20±1.0)cm。这表明,在试验设定的pH条件下,pH为8时能促进强壮硬毛藻的生长,pH为8.5和7.5时次之。
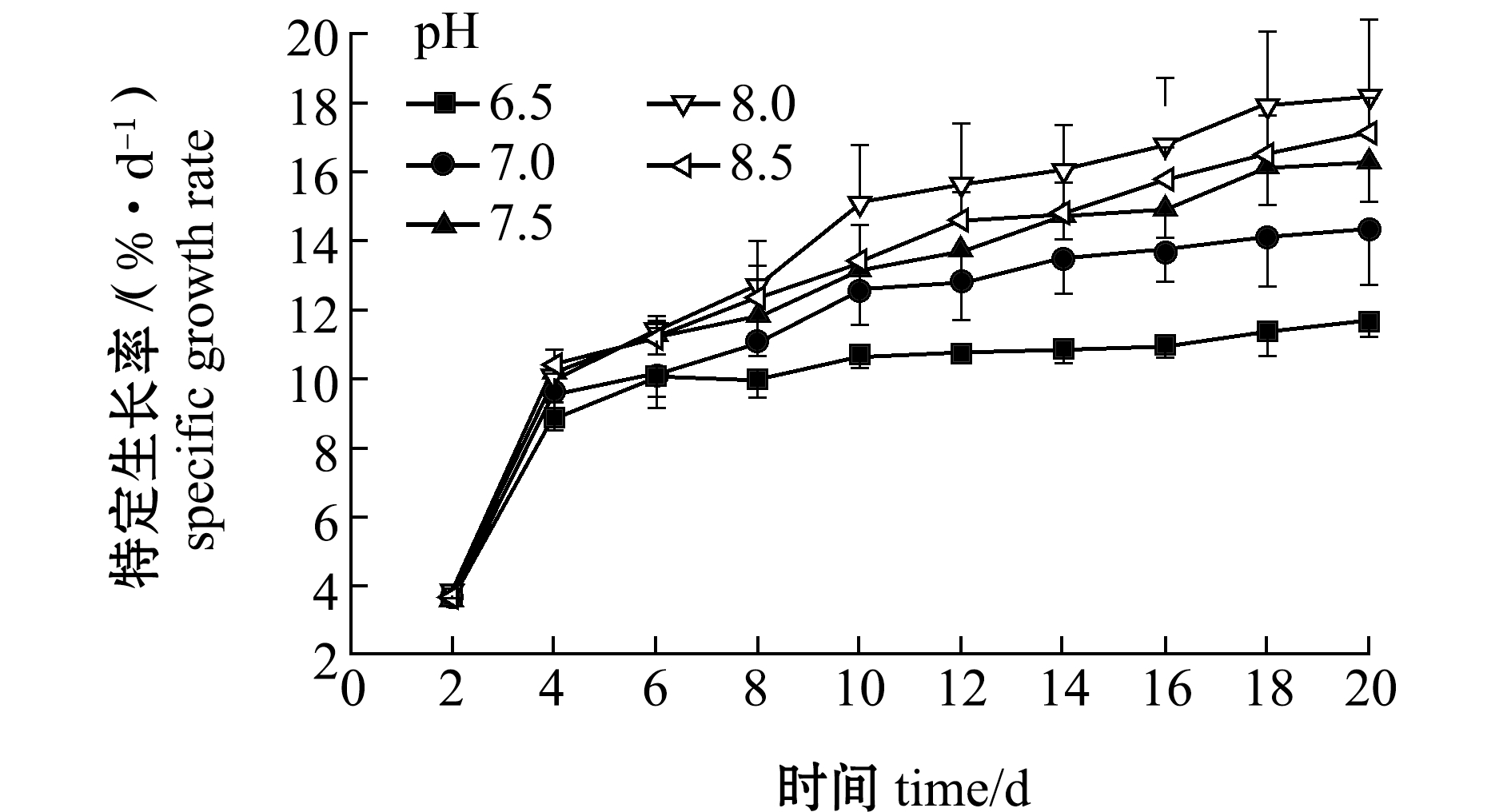
图5 pH对强壮硬毛藻特定生长率的影响
Fig.5 Effect of pH on the SGR of sea weed Chaetomorpha valid
(2)最大光量子产量。从图6可见:只有pH 6.5下强壮硬毛藻Fv/Fm值缓慢降低,其他pH下强壮硬毛藻的Fv/Fm值并无显著性差异(P>0.05),Fv/Fm值一直为0.65±0.05,藻处于良好的光合作用。这表明,pH为7.0~8.5的弱碱性环境能促进该藻的生长。
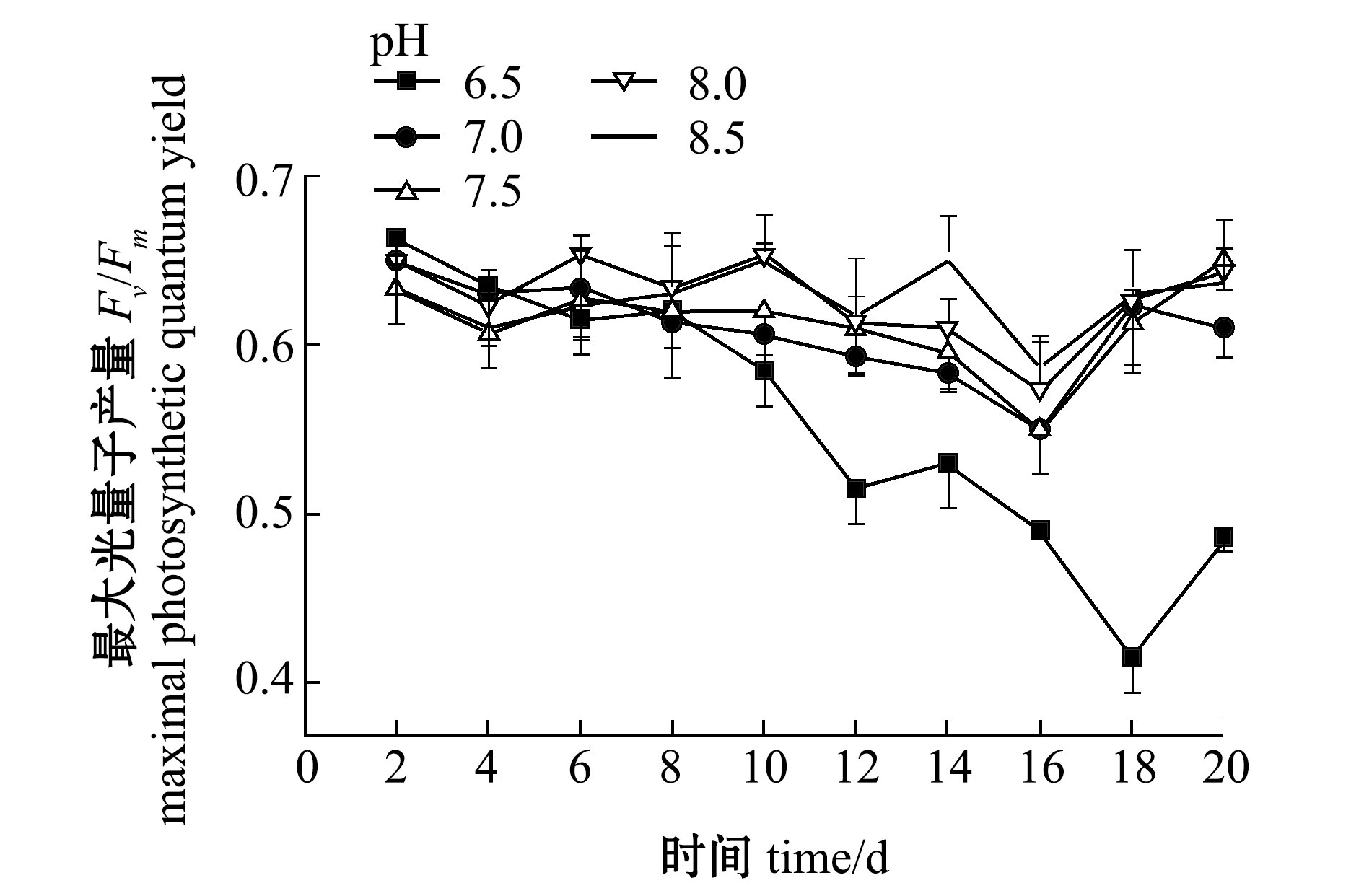
图6 pH对强壮硬毛藻最大光量子产量Fv/Fm的影响
Fig.6 Effect of pH on the maximal photosynthetic quantum yield of sea weed Chaetomorpha valid
2.2 正交试验结果
从表3可见:极差值大小依次分别为氮磷比(3.641)>pH(2.791)>氮磷比与pH的交互作用(1.498)>pH与盐度的交互作用(0.833)>盐度(0.553)>氮磷比与盐度的交互作用(0.416),最优理论组合为25号试验组,即盐度为34、pH为9、氮磷比为8∶1时,SGR最高,为18.42 %/d。
表3 正交试验设计及试验结果
Tab.3 Design and results of the orthogonal experiment
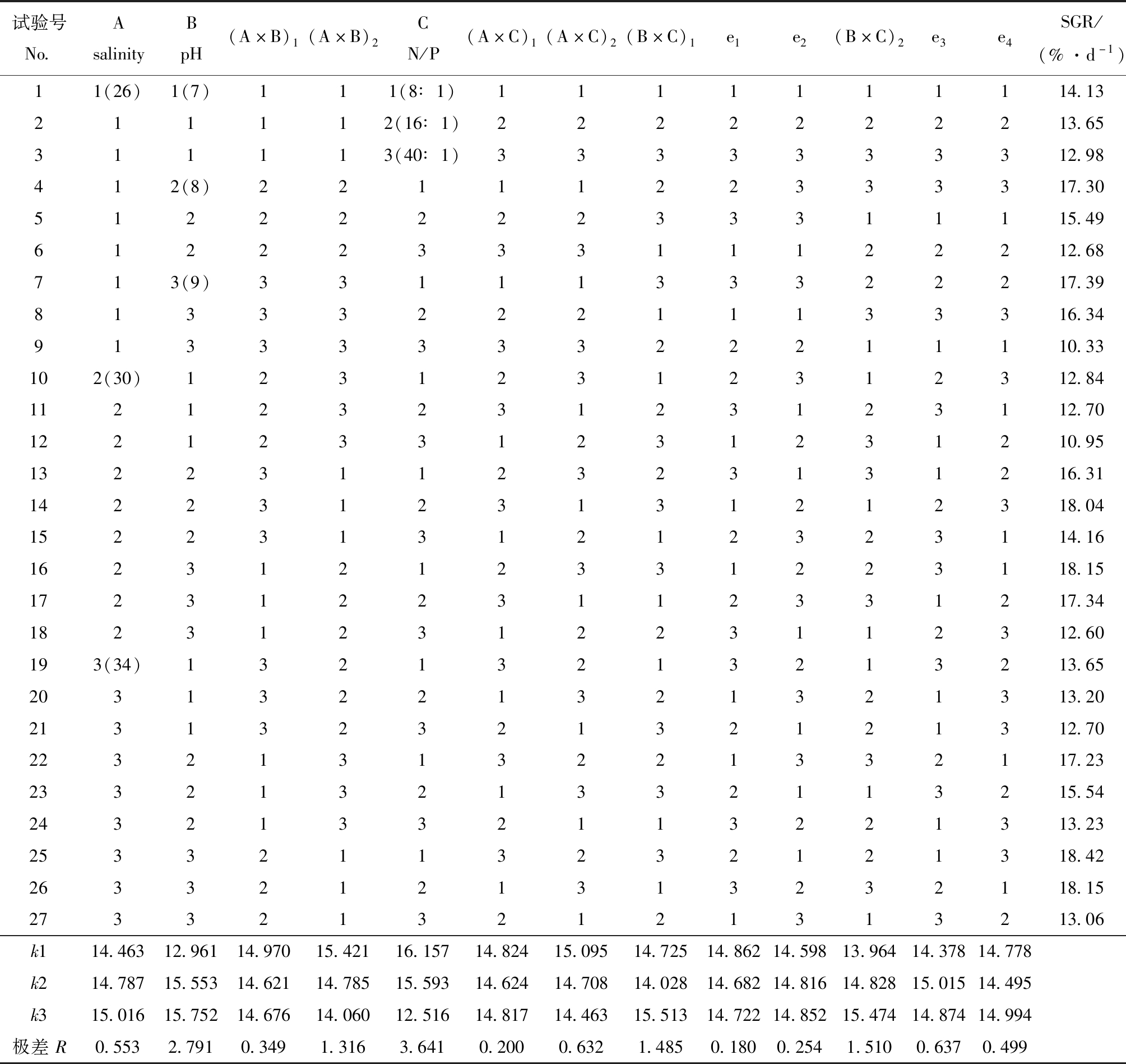
试验号No.AsalinityBpH(A×B)1(A×B)2CN/P(A×C)1(A×C)2(B×C)1e1e2(B×C)2e3e4SGR/(%·d-1)11(26)1(7)111(8∶1)1111111114.13211112(16∶1)2222222213.65311113(40∶1)3333333312.98412(8)2211122333317.305122222233311115.496122233311122212.68713(9)3311133322217.398133322211133316.349133333322211110.33102(30)12312312312312.8411212323123123112.7012212331231231210.9513223112323131216.3114223123131212318.0415223131212323114.1616231212331223118.1517231223112331217.3418231231223112312.60193(34)13213213213213.6520313221321321313.2021313232132121312.7022321313221332117.2323321321332113215.5424321332113221313.2325332113232121318.4226332121313232118.1527332132121313213.06k114.46312.96114.97015.42116.15714.82415.09514.72514.86214.59813.96414.37814.778k214.78715.55314.62114.78515.59314.62414.70814.02814.68214.81614.82815.01514.495k315.01615.75214.67614.06012.51614.81714.46315.51314.72214.85215.47414.87414.994极差R0.5532.7910.3491.3163.6410.2000.6321.4850.1800.2541.5100.6370.499
方差分析(表4)显示,氮磷比、pH、氮磷比与pH、盐度与pH的交互作用对强壮硬毛藻SGR均有极显著性影响(P<0.01),说明这4项因素均为SGR生长的主要影响因素。因此,环境因素为氮磷比8∶1、pH 9和盐度34时,能显著促进强壮硬毛藻生长,甚至暴发。
表4 方差分析结果
Tab.4 Results of variance analysis
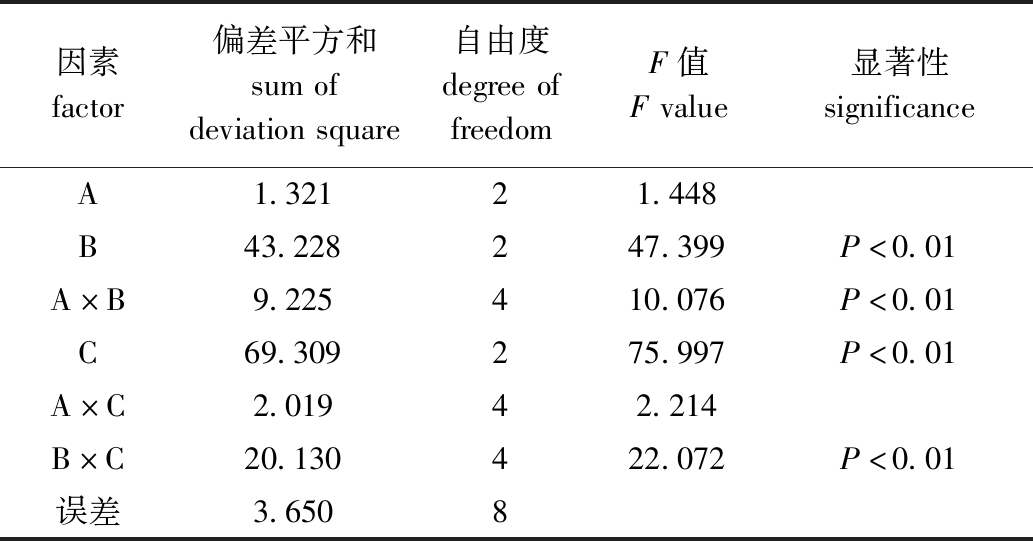
因素factor偏差平方和sumofdeviationsquare自由度degreeoffreedomF值Fvalue显著性significanceA1.32121.448B43.228247.399P<0.01A×B9.225410.076P<0.01C69.309275.997P<0.01A×C2.01942.214B×C20.130422.072P<0.01误差3.6508
Note:F0.05=4.460,F0.01=8.650
3 讨论
3.1 氮磷比对强壮硬毛藻生长的影响
近海海域水体中无机氮原本以![]() 为主体,随着养殖业的发展、氮肥的使用增多,
为主体,随着养殖业的发展、氮肥的使用增多,![]() 含量逐渐增加,成为近海海域的主要成分[23]。大量研究也表明,藻类对氮源是选择性吸收,一般优先吸收利用
含量逐渐增加,成为近海海域的主要成分[23]。大量研究也表明,藻类对氮源是选择性吸收,一般优先吸收利用![]() 因为藻类可以直接吸收
因为藻类可以直接吸收![]() 作为合成氨基酸的底物,而
作为合成氨基酸的底物,而![]() 和
和![]() 需要在硝酸还原酶和亚硝酸还原酶的作用下,再还原转化为
需要在硝酸还原酶和亚硝酸还原酶的作用下,再还原转化为![]() 才能被藻类利用,以作为氮源是一种经济的竞争策略[24]。强壮硬毛藻能够在以
才能被藻类利用,以作为氮源是一种经济的竞争策略[24]。强壮硬毛藻能够在以![]() 为唯一氮源的海水中生长。高氮磷比下强壮硬毛藻颜色更深,可能加速叶绿素的合成积累,在某些藻类中也有类似的研究报道[25-29]。过多的氮源可能以叶绿素作为氮库的形式储存起来,强壮硬毛藻能够存活,但生长缓慢,为适宜环境到来时候的生长和繁殖准备,具有潜在的引发池塘丝状绿藻潮暴发的危害。
为唯一氮源的海水中生长。高氮磷比下强壮硬毛藻颜色更深,可能加速叶绿素的合成积累,在某些藻类中也有类似的研究报道[25-29]。过多的氮源可能以叶绿素作为氮库的形式储存起来,强壮硬毛藻能够存活,但生长缓慢,为适宜环境到来时候的生长和繁殖准备,具有潜在的引发池塘丝状绿藻潮暴发的危害。
本研究表明,低氮磷比更能促进强壮硬毛藻的生长,光合效率也相对较高,而高氮磷比80∶1、120∶1下强壮硬毛藻生长缓慢,试验后期光合效率也极低。此结果与不少学者的研究结果有相似之处。Chang等[30]研究了在以![]() 为唯一氮源的海水中微小亚历山大藻的生长情况,发现当
为唯一氮源的海水中微小亚历山大藻的生长情况,发现当![]() 超过50 μmol/L时微小亚历山大藻的生长速率远远低于
超过50 μmol/L时微小亚历山大藻的生长速率远远低于![]() 为6.0、12.5、25.0 μmol/L时,而当
为6.0、12.5、25.0 μmol/L时,而当![]() μmol/L时微小亚历山大藻停止生长;Yan等[31]研究发现,高浓度(550 μmol/L)
μmol/L时微小亚历山大藻停止生长;Yan等[31]研究发现,高浓度(550 μmol/L)![]() 对大部分藻(微小细柱藻Leptocylindrus minimus、海洋角管藻Cerataulina pelagica、中肋骨条藻Skeletonema costatum、海洋原甲藻Prorocentrum micans和微小原甲藻Prorocentrum minimum的生长有抑制作用,只有赤潮易弯藻对高浓度
对大部分藻(微小细柱藻Leptocylindrus minimus、海洋角管藻Cerataulina pelagica、中肋骨条藻Skeletonema costatum、海洋原甲藻Prorocentrum micans和微小原甲藻Prorocentrum minimum的生长有抑制作用,只有赤潮易弯藻对高浓度![]() 有良好的适应性;李靖等[32]、王正方等[33]的研究也有相似的结果。但整体来看,不同的藻类耐受
有良好的适应性;李靖等[32]、王正方等[33]的研究也有相似的结果。但整体来看,不同的藻类耐受![]() 的能力不同,本研究中强壮硬毛藻耐受的氨氮浓度为1.4 mmol/L,说明该藻可耐受较高
的能力不同,本研究中强壮硬毛藻耐受的氨氮浓度为1.4 mmol/L,说明该藻可耐受较高![]() 浓度,而较低的
浓度,而较低的![]() 浓度下,强壮硬毛藻生长较快,说明即使生存环境中营养盐浓度不高,强壮硬毛藻依然可以生长存活,成为常年滋生于养殖池塘的原因,一旦其他条件合适,比如温度升高、光照充足,具有引发绿潮的潜在可能性。
浓度下,强壮硬毛藻生长较快,说明即使生存环境中营养盐浓度不高,强壮硬毛藻依然可以生长存活,成为常年滋生于养殖池塘的原因,一旦其他条件合适,比如温度升高、光照充足,具有引发绿潮的潜在可能性。
叶绿素荧光技术是研究藻类光合作用的良好探针,能够快速地检测光系统Ⅱ的光合生理状态,具有灵敏、无损伤的优点[34]。最大光量子产量(Fv/Fm),又称为原初光化学的最大产量、PSⅡ光化学反应的潜在产量,是常用的叶绿素荧光参数之一,是光系统Ⅱ完整性的重要指证[26],已被广泛用于藻类的光合生理学研究,藻体在正常生理状态下Fv/Fm比较稳定,在遭受外界胁迫后Fv/Fm会有一定程度的下降[35-36]。本研究中氮磷比试验结果显示,强壮硬毛藻的最大光量子产量Fv/Fm在正常生理状态下为0.65左右,随着培养时间的延长,氮磷比为8∶1和16∶1两组变化较小,从第14天时下降幅度较大,但在第16天时,氮磷比为8∶1时Fv/Fm有所回升,氮磷比为40∶1、80∶1和120∶1的3组呈现先升高后降低的趋势;培养结束时,强壮硬毛藻的Fv/Fm均有不同程度的下降,其中变化最小的是氮磷比为8∶1这一组。可见,高氮磷比对强壮硬毛藻并不是有利的光合效率条件,过高的氮磷比导致PSⅡ氧化端受到损失,阻碍原初电子受体Q还原和光合电子的传递,从而抑制了光合作用原初反应的进行。而且高氮磷比对光合作用的抑制并不能在短时间内体现出来,随着培养时间的增加,这种抑制表现得更加明显。在探究氮浓度对盐生杜氏藻Dunaliella salina、纤细角毛藻Chaetoceros gracilis和绿色巴夫藻Pavlova viridis Tseng Fv/Fm的影响时,也发现氮浓度只有在一定范围内,才可促进微藻的光合作用,使PSⅡ的最大光化学效率保持在较高的水平上[37-38]。而金色奥杜藻Scenedesmus acuminatus、产油尖状栅藻Fv/Fm均随氮素限制而显著下降[25-26]。这表明,存在氮源种类、浓度及藻种属等差异性。因此,这些Fv/Fm在不同氮磷比条件下的差异,由氮源种类、浓度及藻种属等因素决定。
3.2 盐度对强壮硬毛藻生长的影响
生长在不同盐度环境中的藻类对于盐度的适应情况不同,个体差异明显[39]。硬毛藻主要分布于热带和亚热带的海水环境中,很少出现在淡水环境中[40],一般暴露于岩石与其他藻类混合生长,强壮硬毛藻主要生长在养殖池塘、湖泊、水湾中[2],由于上述环境盐度经常大幅度变化,所以硬毛藻一般有较广的盐度耐受性。本试验中发现,相对于高盐度(36和40)下,强壮硬毛藻在盐度为24~34时显著生长,这一盐度范围包含了刺参养殖池塘盐度波动范围[41],为强壮硬毛藻的暴发提供了适宜的盐度条件,可能是该藻在池塘中快速生长的环境因素之一,容易导致其在养殖池塘中暴发。
对于藻类细胞而言,能量过多地用于维持藻类正常活动的渗透压,维持正常的离子浓度,而无法将更多的能量应用于自身的生长,因此,可能导致在较高盐度下强壮硬毛藻的生长缓慢甚至停滞。高盐度可能是控制强壮硬毛藻生长的限制条件之一。本研究中,盐度对强壮硬毛藻Fv/Fm影响并不显著,Fv/Fm均在0.60以上,说明强壮硬毛藻在本试验盐度条件下均可进行良好的光合作用。但较高盐度对强壮硬毛藻的生长有抑制作用,对其光合作用没有影响,这表明,盐度对该藻生长速率的影响不是由于光合作用产生的,可能受其他机制影响。但目前未有强壮硬毛藻抗高盐机制的研究,这为之后的研究提供了方向。
3.3 pH对强壮硬毛藻生长的影响
pH对与于浮游生物的组成及分布有重要影响,pH不但影响藻类光合作用利用二氧化碳的效率,并且影响细胞代谢过程中的酶活性及生长环境营养盐的溶解率等不同因素[42-43]。本试验结果表明,弱碱性更有利于强壮硬毛藻的生长,除pH为8时强壮硬毛藻藻段长势最好,除pH为6.5时强壮硬毛藻Fv/Fm值降低之外,其他pH下的强壮硬毛藻的Fv/Fm值差异并不显著。王宪等[44]研究报道了不同藻类对酸碱度条件的要求和适应情况不同。本试验结果表明,强壮硬毛藻在酸化水体中生长能力较弱,适宜在中性或者弱碱性水体中生活。水体弱酸或者过碱都会对强壮硬毛藻的细胞产生一定的伤害,使其破坏或死亡,影响其生长;酸碱性会影响水对大气中二氧化碳的捕捉,碱性水体更易于吸收大气中二氧化碳,更利于该藻的光合作用,二氧化碳也是藻类进行光合作用必不可少的原料。迟爽[41]调查研究发现,刺参养殖池塘pH范围为7.83~8.37,这与强壮硬毛藻快速生长的pH范围相符。长期保持弱碱性pH的刺参养殖池塘环境可能是该藻保持常年滋生甚至暴发的原因之一。
3.4 环境因子的交互作用对强壮硬毛藻生长的影响
氮是藻类生长繁殖不可或缺的必需营养元素之一,同样是构成细胞内蛋白质、核酸和叶绿素等的基本元素,与藻类生长密切相关[45]。氮磷比作为首要影响因素促进强壮硬毛藻的生长。pH影响水体中二氧化碳的浓度、细胞代谢过程中各种酶类,以及影响藻类生长代谢的其他不同因素(如营养盐)[42-43],与藻类生长繁殖密切相关,是影响该藻生长的重要因素。本试验中使用NH4Cl作为氮源,平衡时氨及铵离子的含量取决于水的pH值:pH小于7时,大部分以![]() 存在,pH大于11时,几乎都以NH3存在,pH在7~11之间,两者都存在,且随pH升高,氨的浓度越高,氨对水生生物具有毒性,而铵离子形式相对安全[46]。因此,铵存在时pH对于藻生长是有利的,本试验中除酸性pH为6.5时,强壮硬毛藻的生长较缓慢,其余pH时对藻类生长都有不同程度的促进作用,当以NH4Cl作为氮源时,氮磷比与pH之间的交互作用对于该藻生长的影响因素十分重要。本研究中单因素盐度试验表明,盐度显著(或极显著)影响强壮硬毛藻特定生长率,但对Fv/Fm影响不显著,正交试验结果却发现,在试验因素交互影响的情况下,盐度对该藻特定生长率影响不显著,更进一步说明,强壮硬毛藻对生存环境中盐度的变化幅度适应范围很大,导致强壮硬毛藻对于盐度的耐受力大大提高。Tsutsui等[22]研究表明,硬毛藻属种类多数是广盐性,部分种类可以在盐度3~90时生长。pH变化影响刺参养殖池塘中不同离子存在形式,因而可能影响盐度变化,盐度和pH之间存在交互作用,并对该藻生长影响极显著,综上所述这些是强壮硬毛藻常年滋生在养殖池塘甚至暴发的部分原因。本研究中正交试验结果表明,在盐度34、pH 9、氮磷比8∶1时,强壮硬毛藻的特定生长率最大,此条件与刺参养殖池塘中的环境因素范围相符合,是强壮硬毛藻在刺参养殖池塘中快速生长甚至暴发的主要因素。
存在,pH大于11时,几乎都以NH3存在,pH在7~11之间,两者都存在,且随pH升高,氨的浓度越高,氨对水生生物具有毒性,而铵离子形式相对安全[46]。因此,铵存在时pH对于藻生长是有利的,本试验中除酸性pH为6.5时,强壮硬毛藻的生长较缓慢,其余pH时对藻类生长都有不同程度的促进作用,当以NH4Cl作为氮源时,氮磷比与pH之间的交互作用对于该藻生长的影响因素十分重要。本研究中单因素盐度试验表明,盐度显著(或极显著)影响强壮硬毛藻特定生长率,但对Fv/Fm影响不显著,正交试验结果却发现,在试验因素交互影响的情况下,盐度对该藻特定生长率影响不显著,更进一步说明,强壮硬毛藻对生存环境中盐度的变化幅度适应范围很大,导致强壮硬毛藻对于盐度的耐受力大大提高。Tsutsui等[22]研究表明,硬毛藻属种类多数是广盐性,部分种类可以在盐度3~90时生长。pH变化影响刺参养殖池塘中不同离子存在形式,因而可能影响盐度变化,盐度和pH之间存在交互作用,并对该藻生长影响极显著,综上所述这些是强壮硬毛藻常年滋生在养殖池塘甚至暴发的部分原因。本研究中正交试验结果表明,在盐度34、pH 9、氮磷比8∶1时,强壮硬毛藻的特定生长率最大,此条件与刺参养殖池塘中的环境因素范围相符合,是强壮硬毛藻在刺参养殖池塘中快速生长甚至暴发的主要因素。
影响藻生长的因素有很多,本研究中报道了氮磷比、盐度、pH及其3者的交互作用对强壮硬毛藻生长的影响,可能还受温度等其他单因素及其与氮磷比互作的影响,还有待进一步研究探讨。
4 结论
(1)低氮磷比、弱碱性更利于强壮硬毛藻的生长。高氮磷比对强壮硬毛藻并不是有利的光合效率条件,本试验中强壮硬毛藻耐受的总氨氮浓度为1.4 mmol/L,说明该藻可耐受较高![]() 浓度,但低氮磷比更利于强壮硬毛藻生长,强壮硬毛藻生长较快,说明即使生存环境中营养盐浓度不高,强壮硬毛藻也具有引发绿潮的潜在可能性,强壮硬毛藻依然可以生长存活。
浓度,但低氮磷比更利于强壮硬毛藻生长,强壮硬毛藻生长较快,说明即使生存环境中营养盐浓度不高,强壮硬毛藻也具有引发绿潮的潜在可能性,强壮硬毛藻依然可以生长存活。
(2)盐度为24~34时可促进强壮硬毛藻生长,但盐度对强壮硬毛藻的光合作用的影响并不显著,盐度对该藻生长速率的影响不是由于光合作用产生的,可能受其他机制影响。
(3)正交试验结果显示,氮磷比、pH、氮磷比与pH、盐度与pH的交互作用对强壮硬毛藻特定生长率均有极显著性影响,极差值依次降低,在盐度为34、pH为9、氮磷比为8∶1环境条件下,强壮硬毛藻的特定生长率最大,此条件与刺参养殖池塘中的环境因素范围相符合,是强壮硬毛藻在刺参养殖池塘中快速生长、常年滋生甚至暴发的主要环境因素。
[1] 邓蕴彦.硬毛藻及其附生藻的实验分类学[D].青岛:中国科学院研究生院(海洋研究所),2010.
[2] 迟永雪,王丽梅,栾日孝,等.中国硬毛藻属新记录种—强壮硬毛藻[J].水产科学,2009,28(3):162-163.
[3] Gao Li,Zhang Luhua,Hou Jinzhi,et al.Decomposition of macroalgal blooms influences phosphorus release from the sediments and implications for coastal restoration in Swan Lake,Shandong,China[J].Ecological Engineering,2013,60:19-28.
[4] 石岩峻.赤潮藻对营养盐的吸收及生长和相关特性研究[D].北京:北京化工大学,2004.
[5] Vitousek P M,Howarth R W.Nitrogen limitation on land and in the sea:how can it occur?[J].Biogeochemistry,1991,13(2):87-115.
[6] 李俭平.浒苔对氮营养盐的响应及其氮营养盐吸收动力学和生理生态研究[D].青岛:中国科学院研究生院(海洋研究所),2011.
[7] 颜天,周名江,邹景忠,等.香港及珠江口海域有害赤潮发生机制初步探讨[J].生态学报,2001,21(10):1634-1641.
[8] Lenton T M,Watson A J.Redfield revisited:1.Regulation of nitrate,phosphate,and oxygen in the ocean[J].Global Biogeochemical Cycles,2000,14(1):225-248.
[9] Tyrrell T.The relative influences of nitrogen and phosphorus on oceanic primary production[J].Nature,1999,400(6744):525-531.
[10] Ho T Y,Quigg A,Finkel Z V,et al.The elemental composition of some marine phytoplankton[J].Journal of Phycology,2003,39(6):1145-1159.
[11] 林昱,庄栋法,陈孝麟,等.初析赤潮成因研究的围隔实验结果Ⅱ.浮游植物群落演替与甲藻赤潮[J].应用生态学报,1994,5(3):314-318.
[12] Taylor R,Fletcher R L,Raven J A.Preliminary studies on the growth of selected “green tide” algae in laboratory culture:effects of irradiance,temperature,salinity and nutrients on growth rate[J].Botanica Marina,2001,44(4):327-336.
[13] 刘春光,金相灿,孙凌,等.水体pH和曝气方式对藻类生长的影响[J].环境污染与防治,2006,28(3):161-163.
[14] Deng Y Y,Tang X R,Huang B X,et al.Effect of temperature and irradiance on the growth and reproduction of the green macroalga,Chaetomorpha valida (Cladophoraceae,Chlorophyta)[J].Journal of Applied Phycology,2012,24(4):927-933.
[15] 邓蕴彦,汤晓荣,黄冰心,等.强壮硬毛藻(Chaetomorpha valida)的温度性质及其在中国海藻区系中的扩散潜力[J].海洋与湖沼,2011,42(3):404-408.
[16] 祁峰,李晓东,赵艳红,等.盐度、光照度和温度对漂浮刚毛藻光合作用的影响[J].大连水产学院学报,2008,23(5):382-386.
[17] 付莹,赵玉蓉.氨氮对鱼类的毒性及鱼类应对氨氮毒性的策略[J].水产学杂志,2018,31(3):49-54.
[18] 张宇,宫庆礼,李景玉.环境条件对线形硬毛藻营养盐吸收影响的季节变化[J].海洋湖沼通报,2015(1):50-62.
[19] 魏权,邵雪琳,高丽.硬毛藻生长的最适磷含量及磷素吸收动力学特征[J].海洋环境科学,2014,33(4):514-519.
[20] 丁兰平,李雯诗,谭华强,等.温度和盐度对短节硬毛藻(Chaetomorpha brachygona Harvey)生长发育的影响研究[J].海洋与湖沼,2015,46(1):191-196.
[21] Berges J A,Franklin D J,Harrison P J.Evolution of an artificial seawater medium:improvements in enriched seawater,artificial water over the last two decades[J].Journal of Phycology,2001,37(6):1138-1145.
[22] Tsutsui I,Miyoshi T,Aue-umneoy D,et al.High tolerance of Chaetomorpha sp. to salinity and water temperature enables survival and growth in stagnant waters of central Thailand[J].International Aquatic Research,2015,7(1):47-62.
[23] 乔倩.不同氮源对典型赤潮藻类生长的影响[D].广州:暨南大学,2016.
[24] McCarthy J J,Wynne D,Berman T.The uptake of dissolved nitrogenous nutrients by Lake Kinneret (Israel) microplankton[J].Limnology and Oceanography,1982,27(4):673-680.
[25] 王璐瑶,桑敏,李爱芬,等.不同缺氮营养水平对金色奥杜藻生长及光合生理的影响[J].中国生物工程杂志,2012,32(6):48-56.
[26] 汪亚俊,孙明哲,李爱芬,等.不同氮素水平对产油尖状栅藻生长及光合生理的影响[J].中国生物工程杂志,2014,34(12):51-58.
[27] 孙军,刘东艳,陈宗涛,等.不同氮磷比率对青岛大扁藻、新月柱鞘藻和米氏凯伦藻生长影响及其生存策略研究[J].应用生态学报,2004,15(11):2122-2126.
[28] 刘东艳,孙军,陈宗涛,等.不同氮磷比对中肋骨条藻生长特性的影响[J].海洋湖沼通报,2002(2):39-44.
[29] 刘皓,高永利,殷克东,等.不同氮磷比对中肋骨条藻和威氏海链藻生长特性的影响[J].热带海洋学报,2010,29(6):92-97.
[30] Chang F H,McClean M.Growth responses of Alexandrium minutum (Dinophyceae) as a function of three different nitrogen sources and irradiance[J].New Zealand Journal of Marine and Freshwater Research,1997,31(1):1-7.
[31] Yan T,Zhou M J,Qian P Y.Effects of four nitrogen substrates on growth of several red tide species[J].Acta Oceanologica Sinica,2002,21(3):461-467.
[32] 李靖,敖新宇,李宁云,等.铵氮和硝氮胁迫下金鱼藻对氮素的利用[J].江西农业大学学报,2012,34(2):409-413.
[33] 王正方,张庆,卢勇,等.氮、磷、维生素和微量金属对赤潮生物海洋原甲藻的增殖效应[J].东海海洋,1996,14(3):33-38.
[34] Bradbury M,Baker N R.A quantitative determination of photochemical and non-photochemical quenching during the slow phase of the chlorophyll fluorescence induction curve of bean leaves[J].Biochimica et Biophysica Acta (BBA)-Bioenergetics,1984,765(3):275-281.
[35] 盛子彤,南国宁,张迪,等.山东半岛鼠尾藻不同地理种群的光合生理学比较[J].烟台大学学报:自然科学与工程版,2017,30(1):17-25.
[36] 赵会杰,邹琦,于振文.叶绿素荧光分析技术及其在植物光合机理研究中的应用[J].河南农业大学学报,2000(3):248-251.
[37] 尹翠玲,梁英,冯力霞,等.氮浓度对盐生杜氏藻和纤细角毛藻叶绿素荧光特性及生长的影响[J].海洋湖沼通报,2007(1):101-110.
[38] 梁英,金月梅,田传远.氮磷浓度对绿色巴夫藻生长及叶绿素荧光参数的影响[J].海洋湖沼通报,2008(1):120-128.
[39] 徐宁,吕颂辉,陈菊芳,等.温度和盐度对锥状斯氏藻生长的影响[J].海洋环境科学,2004,23(3):36-38.
[40] 钱树本,刘东艳,孙军.海藻学[M].青岛:中国海洋大学出版社,2005.
[41] 迟爽.刺参池塘水质与底质的周年变化及底质改良剂的研发[D].烟台:烟台大学,2013.
[42] 蒋文凯,张国庆,邓湘云,等.初始pH和碳酸氢钠对威氏海链藻生长的影响[J].海洋渔业,2014,36(1):51-56.
[43] 陈峰,姜悦.微藻生物技术[M].北京:中国轻工业出版社,1999.
[44] 王宪,李文权.盐度、pH对海洋藻类光合作用速率的影响[J].海洋环境科学,1991,10(1):37-40.
[45] 乔倩,王朝晖,郭鑫.不同氮源对中肋骨条藻(Skeletonema costatum)生长的影响[J].生态学杂志,2016,35(8):2110-2116.
[46] 丁庆秋,彭建华.水产健康养殖的水质管理[J].养殖与饲料,2014(9):25-29.