硬骨鱼类体液中的渗透压浓度与其生活的水体盐度相差很大, 但硬骨鱼自身渗透压浓度却维持相对稳定[1]。肾脏和鳃是海水鱼类进行渗透调节的重要器官, 其组织结构、功能的变化对于其渗透调节具有很大意义[2];而皮肤是鱼类机体和外界水环境相接触的最直接的地方, 因此,皮肤在不同水环境中结构的变化对鱼类渗透调节也具有重要的意义[3]。无论生活在高盐还是低盐的水环境中, 鱼类都要进行渗透压调节, 这一过程需要消耗能量。当盐度发生变化时, 鳃丝Na+/K+-ATP酶活力可为鱼类渗透压调节提供能量[4]。海水鱼类渗透压调节能力的强弱决定其对盐度变化的耐受力, 进而对性腺发育、胚胎孵化、生长发育、摄食消化等生理功能都产生影响[5]。
对半滑舌鳎Cynoglossus semilaevis幼鱼的研究显示,高盐度处理下其血液渗透压明显升高, 低盐度处理下则明显降低, 且变化幅度随盐度突变范围的增大而增大[6];对克氏双锯鱼Amphiprion clarkii研究显示,从对照盐度突变至低盐度时, 24 h后后Na+/K+-ATP酶活力提升效果较为显著[7]; 对史氏鲟Acipenser schrenckii的研究表明,血清渗透压随着盐度的增加而上升, 血清中的 Na+、Cl-浓度随着盐度的增大而增大,而血清中K+的浓度则与对照组无显著性差异[8]; 褐牙鲆Paralichthys olivaceus幼鱼血浆渗透压随盐度的增加而增大[9];梭鱼Liza haematocheila幼鱼血清Na+、K+、Cl-离子含量随盐度的升高整体呈上升趋势[10]。
黄条鰤Seriola aureovittata隶属于鲈形目Perciformes鲹科Carangidae鰤属Seriola, 是一种全球性分布的海洋中上层暖温性远洋洄游鱼类, 在朝鲜半岛、日本、非洲南部、澳大利亚、美国、印度、南非海域及印度洋均有分布, 其中在中国主要分布在黄渤海、东海、南海[11]。黄条鰤生长速度快、个体大、肉质鲜美、营养丰富, 具有很高的经济价值和食用价值, 深受广大消费者喜爱, 世界范围内消费需求不断增加, 是中国发展深海鱼类养殖的优良品种[12-13]。有关黄条鰤的研究逐步兴起,包括线粒体全基因组特征、黄条鰤早期生长机制、早期发育形态特征、免疫机制等[14-17]。本研究中,对黄条鰤幼鱼进行了盐度突变试验, 通过检测Na+/K+-ATP酶活性、渗透压、Na+、 K+、Cl-浓度等指标, 初步探讨了黄条鰤幼鱼对盐度突变的适应性, 旨在为研究黄条鰤对不同盐度的适应机制和养殖生产提供参考依据。
1 材料与方法
1.1 材料
试验在大连富谷水产有限公司进行, 试验用鱼为2013年在黄海北部捕获的黄条鰤幼鱼, 经网箱养殖和室内工厂化越冬, 2017年早春成功产卵后人工培育出批量苗种, 将人工苗种培育到体长为19~23 cm, 体质量为80~120 g, 用于试验。
1.2 方法
1.2.1 试验设计 苗种养殖期间,海水水温为20~27 ℃,盐度为29, 每天投喂鲜杂鱼3~4次, 投喂量为鱼体质量的3%~5%。试验开始前所有暂养的试验用鱼停食24 h后再放入各盐度组, 试验期间不投饵。
各试验组的盐度调节:用1000 L塑料桶作为自来水曝气池, 连续充气、曝气 24 h 以上, 用以调节盐度低于自然海水的各盐度组;高盐度组的海水使用自然海水加食盐进行人工配置。
试验设置盐度为35、29(对照)、15、10、5、0共6个盐度组, 试验开始时, 将黄条鰤幼鱼直接放入各盐度组后, 持续观察鱼的适应情况,取样时间为6、12、24、48、72、96、120 h,并分别取各组织样品。每个盐度组在1000 L试验桶放入30尾黄条鰤幼鱼, 用纳米充气石持续充气保证溶氧充足, 每天晚上18:00换等盐度海水1次, 每次换水量为50%。试验期间水温为22~23 ℃, 溶解氧为6.4~6.6 mg/L, 总氨氮为0.1~0.2 mg/L。升高或降低盐度采取逐渐换水的方式, 盐度测定采用比重计, 其水温高于17.5 ℃时, 其计算公式如下:
S=1305(比重记示数-1)+(T-17.5)×0.3。
其中:S为盐度;T为温度(℃)。
1.2.2 样品制备
(1)血清。每次在取样时间点随机从不同盐度的试验桶中捞取3尾鱼取样。 用麻醉剂将黄条鰤幼鱼麻醉, 用无菌 1 mL 注射器快速从尾部采血, 置于1.5 mL无菌离心管中, 在冰水混合物静置 30 min 后, 4 ℃条件下以5000 r/min 离心10 min, 取上清即为血清。
(2)血浆。事先用微量肝素溶液(10 mg/L)浸湿注射器内壁和1.5 mL无菌离心管, 尾部取血后置于多个1.5 mL无菌离心管中, 在冰水混合液中静置30 min 后, 4 ℃条件下以5000 r/min 离心10 min, 取上清液即为血浆。
(3)尿液。参考Linhart等[18]方法, 将鱼体表水用干毛巾擦干, 用蒸馏水浸湿后的脱脂棉将尿殖孔擦干净, 挤压鱼腹部后缘的膀胱, 使尿流入采样皿中。
(4)鳃、皮肤、肾脏。用液氮保存的鳃丝样品用于测定Na+/K+-ATPase活性及渗透压变化。用灭菌的解剖工具取试验结束时对照组、盐度5组和盐度35组试验鱼的鳃丝、皮肤和肾脏样品,置于2.5%戊二醛固定液中0~4 ℃下保存, 用于电镜分析。
1.2.3 指标测定 使用扫描电镜观察对照组、盐度5组和35组的黄条鰤鳃丝、皮肤和肾脏固定的样品。以黄条鰤鳃丝组织匀浆液为材料测定 Na+/K+-ATP酶活性。将匀浆液于4 ℃下以3500 r/min离心10 min, 取上清液用定磷法测定ATPase活性(A070-6, 南京建成生物工程研究所超微量Na+/K+-ATPase测定试剂盒);蛋白质含量用双缩脲测试盒(A045-1, 南京建成生物工程研究所)测定, 以每小时鳃丝组织蛋白中ATPase分解ATP产生1 mol的量为1个ATP酶活力单位。
采用比浊法测定黄条鰤尿、血浆和血清中的Na+离子含量(C002, 南京建成生物工程研究所钠测试盒);采用微板法测定尿、血浆和血清中的K+离子含量(C001-2, 南京建成生物工程研究所钾测试盒);采用微板法测定尿、血浆和血清中的Cl-离子含量(C003-2, 南京建成生物工程研究所氯测试盒)。使用全自动冰点渗透压计(FM-8P, 上海医大仪器厂)测定黄条鰤尿和血浆中的渗透压。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,使用SPSS 17.0软件进行单因素方差分析(One-way ANOVA)和Duncan’s多重比较分析,显著性水平设为0.05。
2 结果与分析
2.1 盐度突变下鱼类的应激行为
试验开始时, 将试验鱼从盐度29直接放入不同的盐度组, 盐度为0的试验组鱼反应强烈, 快速游动, 15 min时出现侧倒现象, 25 min时部分死亡, 持续到50 min左右时全部死亡(该组试验终止);盐度5的试验组鱼刚放入不久有个别鱼出现侧游, 游动迟缓, 数小时候后逐渐正常游动, 未出现死亡;其他各盐度组未出现明显应激反应和死亡。故以下仅测定了非0盐度组的各项指标变化。
2.2 不同盐度下黄条鰤幼鱼鳃丝Na+/K+-ATP酶活力的变化
黄条鰤幼鱼急性进入不同盐度的海水中, 在经过6~120 h后其鳃丝Na+/K+-ATP酶活力变化情况如图1所示。盐度5、10、15组黄条鰤鳃丝Na+/K+-ATP酶活力随着处理时间的延长总体上呈逐渐降低趋势, 在各时间点下与对照组(盐度29)有显著性差异(P<0.05), 在96 h时达到最低值,之后趋于稳定;盐度35组开始时鳃丝Na+/K+-ATP酶活力显著低于对照组(P<0.05), 之后随处理时间的延长又逐渐上升, 72 h时达到峰值且显著高于对照组 (P<0.05), 96 h后又降低至对照组相近水平, 并保持稳定。从各个不同处理时间点看, 48 h之内各盐度组鳃丝Na+/K+-ATP酶活力变化明显, 且低盐度组盐度相差越大, 酶活力差异就越显著, 在72 h或96 h后基本趋于稳定, 在此之后的各个时间点鳃丝Na+/K+-ATP酶活力根据盐度的不同呈现“U”形分布。
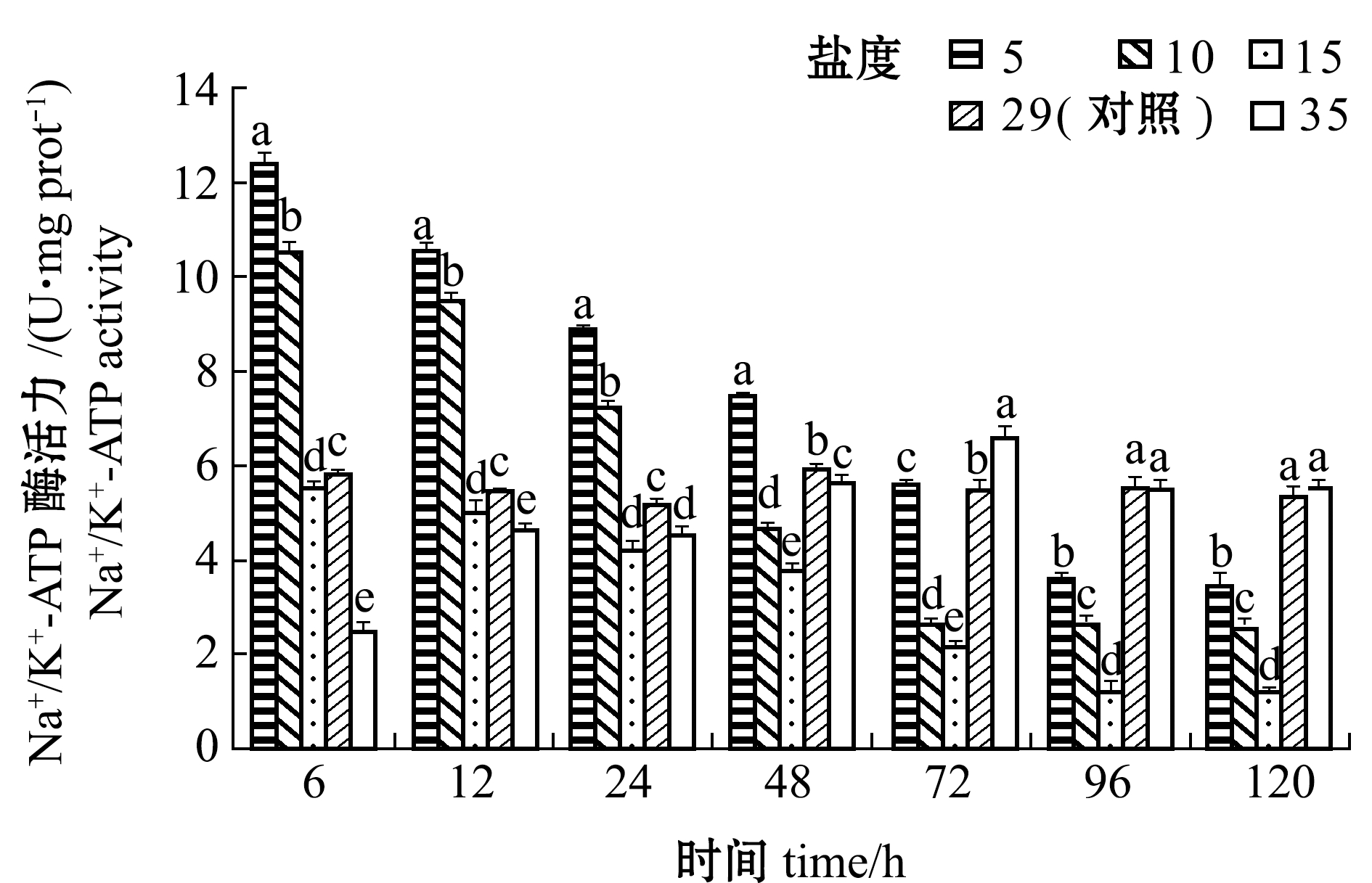
注:标有不同字母者表示相同时间点下不同盐度组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note: Means with different letters are significant differences at the same time in different salinity groups(P<0.05), and the means with the same letters are not significant differences, et sequentia
图1 不同盐度对鳃丝Na+/K+-ATP酶活力的影响
Fig.1 Effect of the different salinities on Na+/K+-ATPase activity in gill filaments
2.3 不同盐度下黄条鰤幼鱼离子浓度的变化
2.3.1 尿、血浆和血清中Na+含量变化 从图2可见:盐度5、10、15组黄条鰤幼鱼尿中Na+含量总体上随处理时间的延长而降低, 各时间点下均显著低于对照组(P<0.05);盐度35组尿中Na+含量随处理时间的延长而增加, 在6 h时与对照组无显著性差异(P>0.05), 之后各时间点下均显著高于其他盐度组(P<0.05), 72 h后趋于稳定,达到186.989 mmol/L。

图2 不同盐度对尿中Na+含量的影响
Fig.2 Effect of the different salinities on urine Na+ content
从图3可见:盐度5、10、15组血浆中Na+含量随着处理时间的延长而降低, 且相同时间点下Na+含量随着处理盐度的降低而降低;盐度35组血浆中Na+含量随着处理时间的延长而增加, 各时间点下Na+含量均显著高于其他盐度组(P<0.05);各盐度组Na+含量均在96 h后保持稳定。
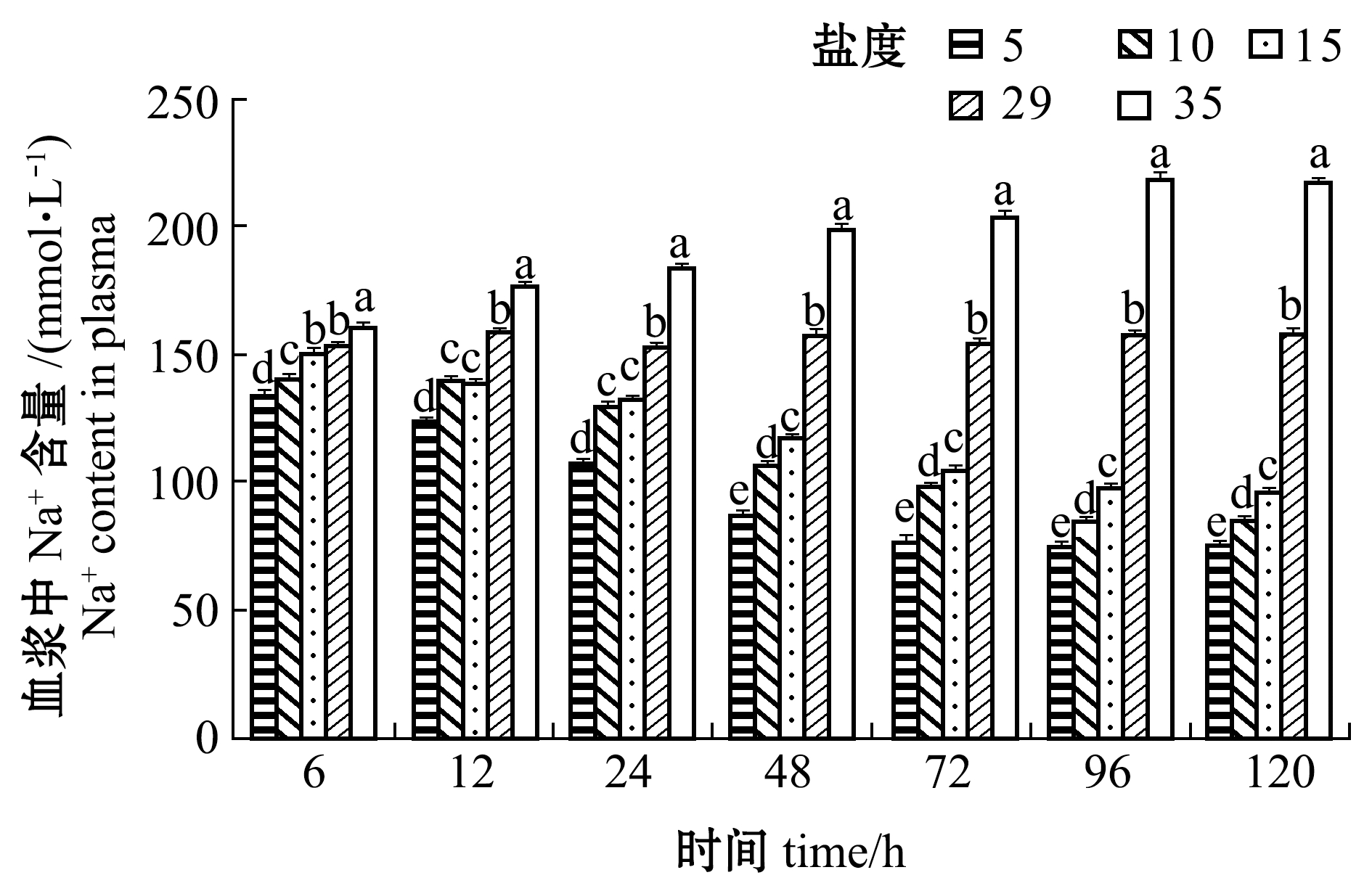
图3 不同盐度对血浆中Na+含量的影响
Fig.3 Effect of the different salinities on plasma Na+ content
从图4可见:盐度5、10、15组幼鱼血清中Na+含量总体上随着处理时间的延长而降低;且相同时间点下Na+含量随盐度的降低而降低;盐度35组血清中Na+含量随处理时间的延长而增加, 12 h后各时间点下Na+含量均显著高于其他盐度组(P<0.05);各盐度组Na+含量均在96 h后趋于稳定。
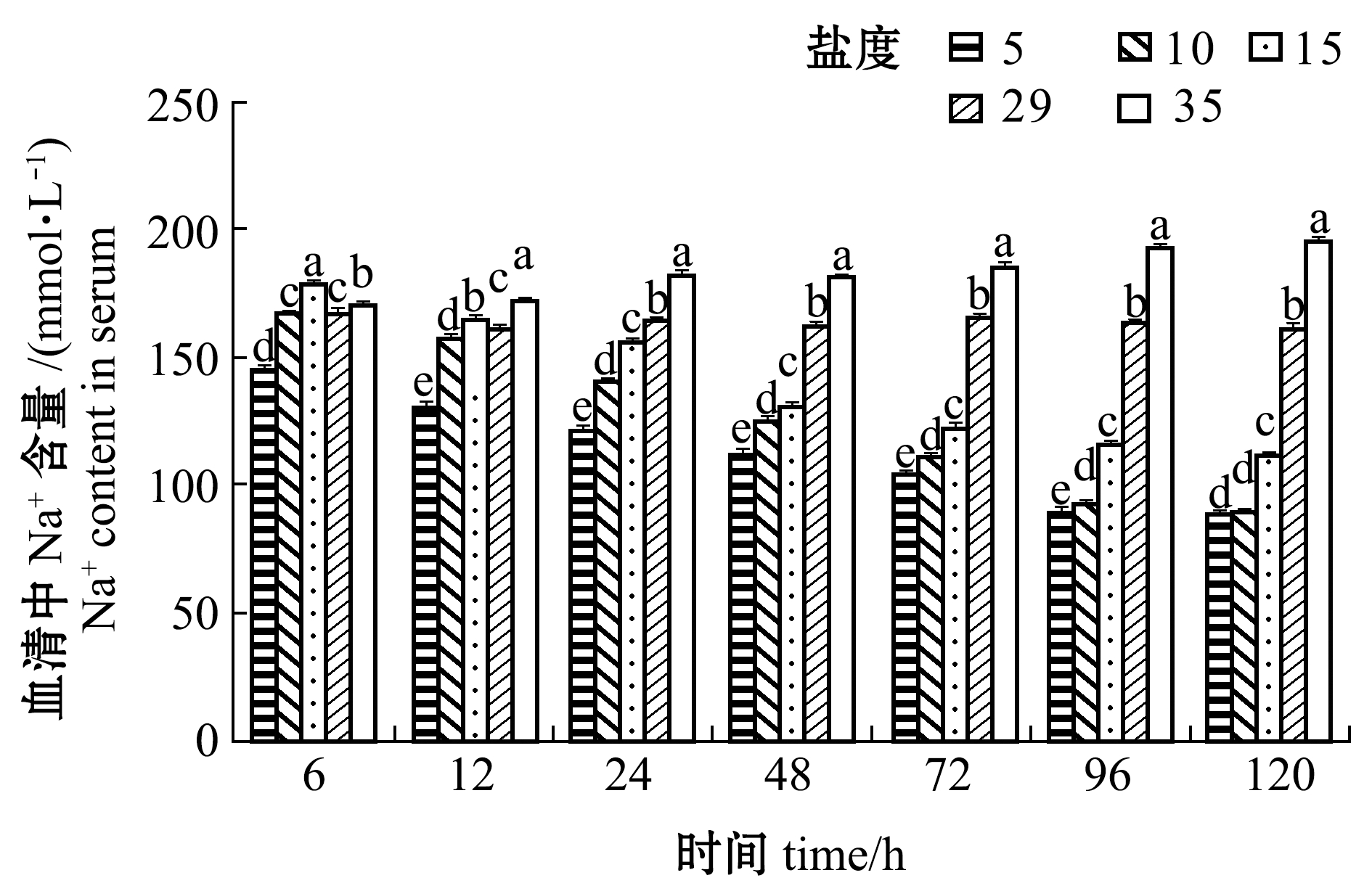
图4 不同盐度对血清中Na+含量的影响
Fig.4 Effect of different salinities on serum Na+ content
2.3.2 尿、血浆和血清中K+含量变化 从图5可见:盐度5、10、15组黄条鰤幼鱼尿中K+含量总体上随处理时间的延长而降低, 96 h后趋于稳定, 且在相同时间点下总体上K+含量随着盐度的降低而降低; 盐度35组尿中K+含量随着处理时间的延长而升高, 72 h再次升高之后趋于稳定, 且各时间点下均显著高于其他盐度组(P<0.05)。
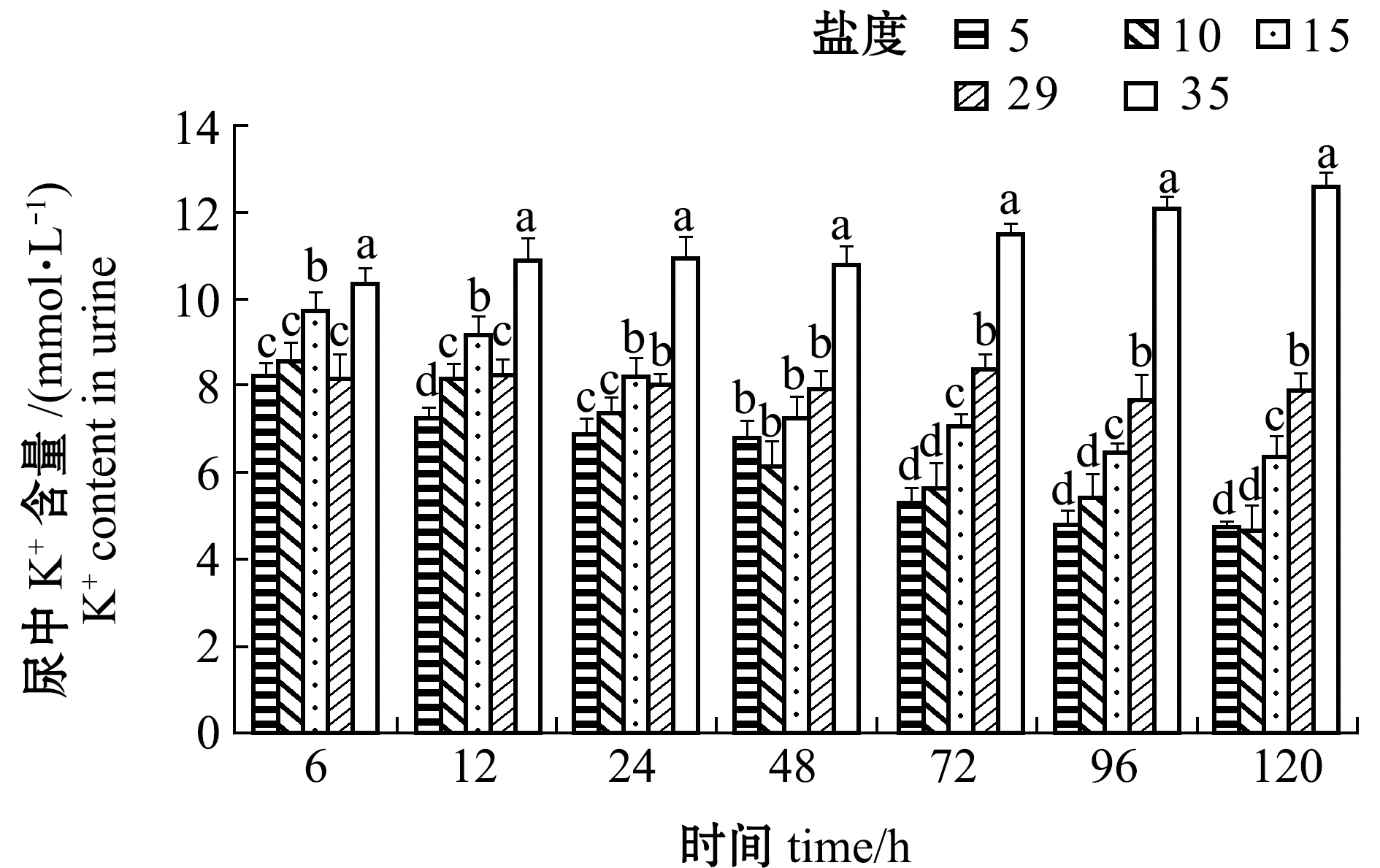
图5 不同盐度对尿中K+含量的影响
Fig.5 Effect of the different salinities on urine K+ content
从图6可见:血浆中K+含量在6 h时各组间无明显差异(P>0.05), 从12 h开始盐度5、10、15组K+含量随处理时间的延长总体上呈降低趋势,96 h后趋于稳定;盐度35组血浆中K+含量随着时间的延长而增加, 72 h后趋于稳定,24 h后的各时间点下K+含量均显著高于其他盐度组(P<0.05)。
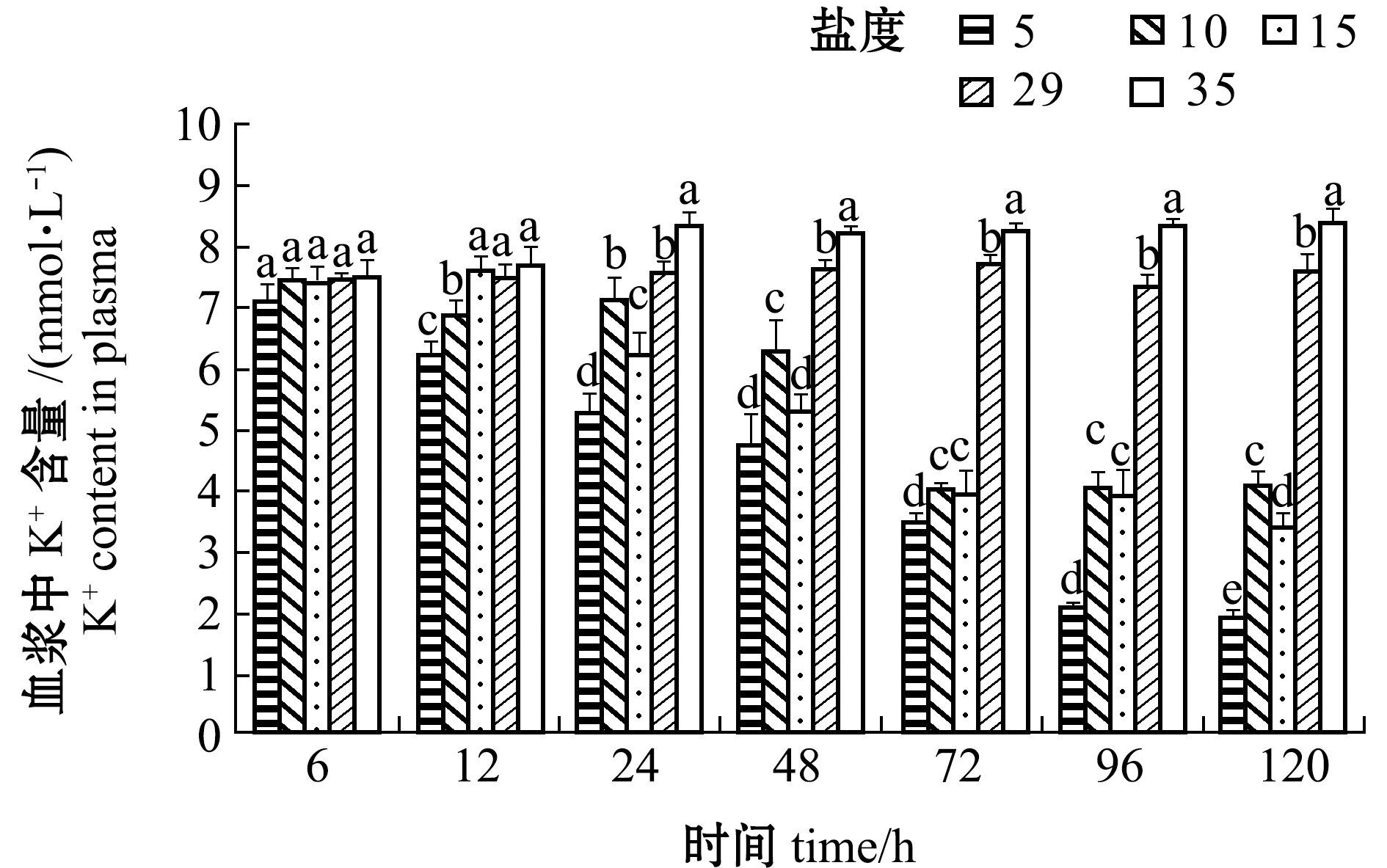
图6 不同盐度对血浆中K+含量的影响
Fig.6 Effect of the different salinities on plasma K+ content
从图7可见:盐度5、10、15组血清中K+含量均随处理时间的延长而降低, 总体上各时间点下K+含量随盐度的降低而降低, 96 h后趋于稳定;盐度35组血清中K+含量随着处理时间的延长而增加, 96 h后趋于稳定,24 h后的各时间点下K+含量均显著高于其他盐度组(P<0.05)。
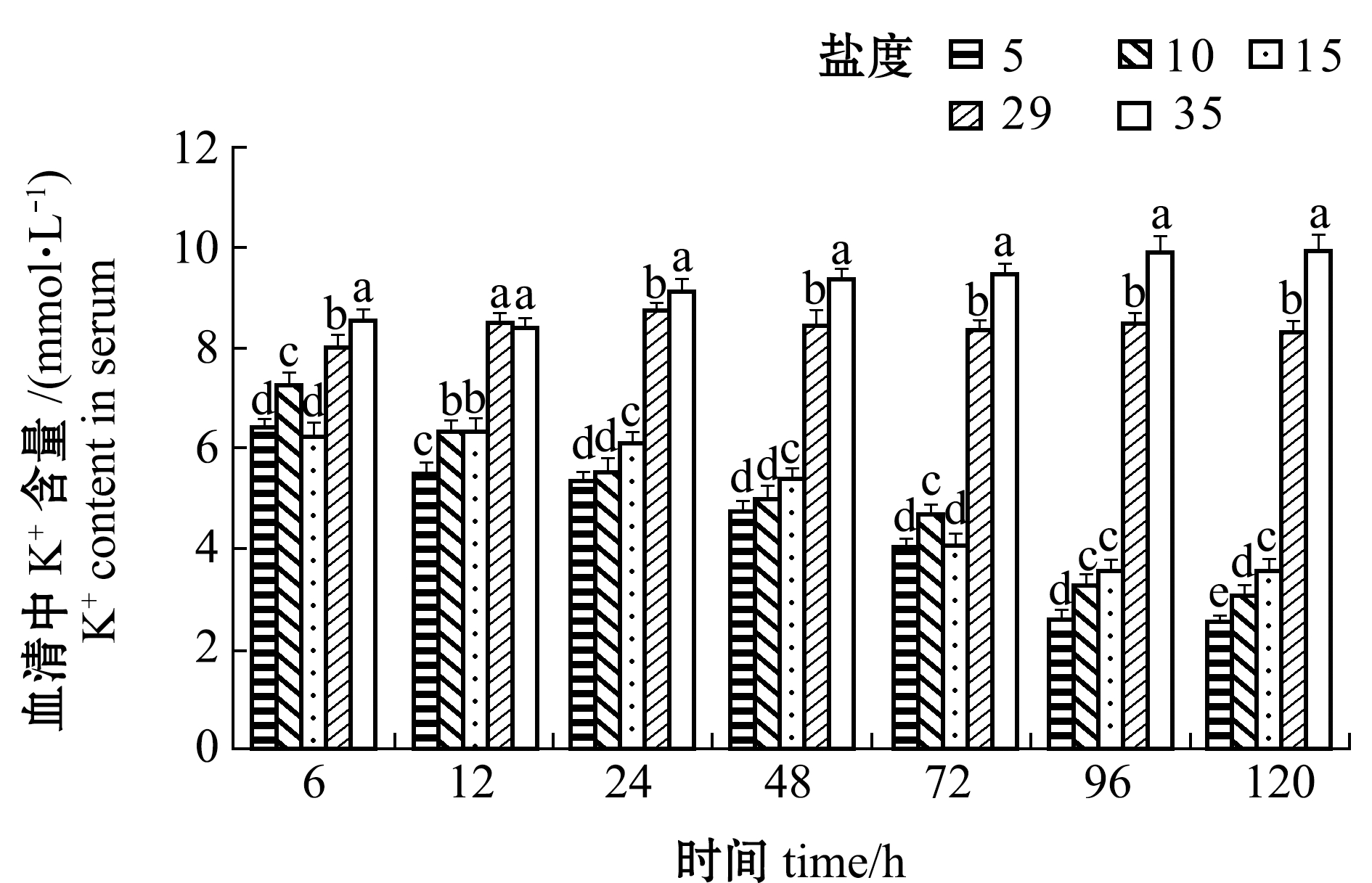
图7 不同盐度对血清中K+含量的影响
Fig.7 Effect of the different salinities on serum K+ content
2.3.3 尿、血浆和血清中Cl-含量变化 从图8可见:盐度5、10、15组黄条鰤幼鱼尿中Cl-含量随处理时间的延长而降低, 且在相同时间点下随着盐度的降低而降低;盐度35组尿中Cl-含量随着时间的延长而增加, 96 h后趋于稳定,各时间点下Cl-含量均显著高于其他盐度组(P<0.05)。
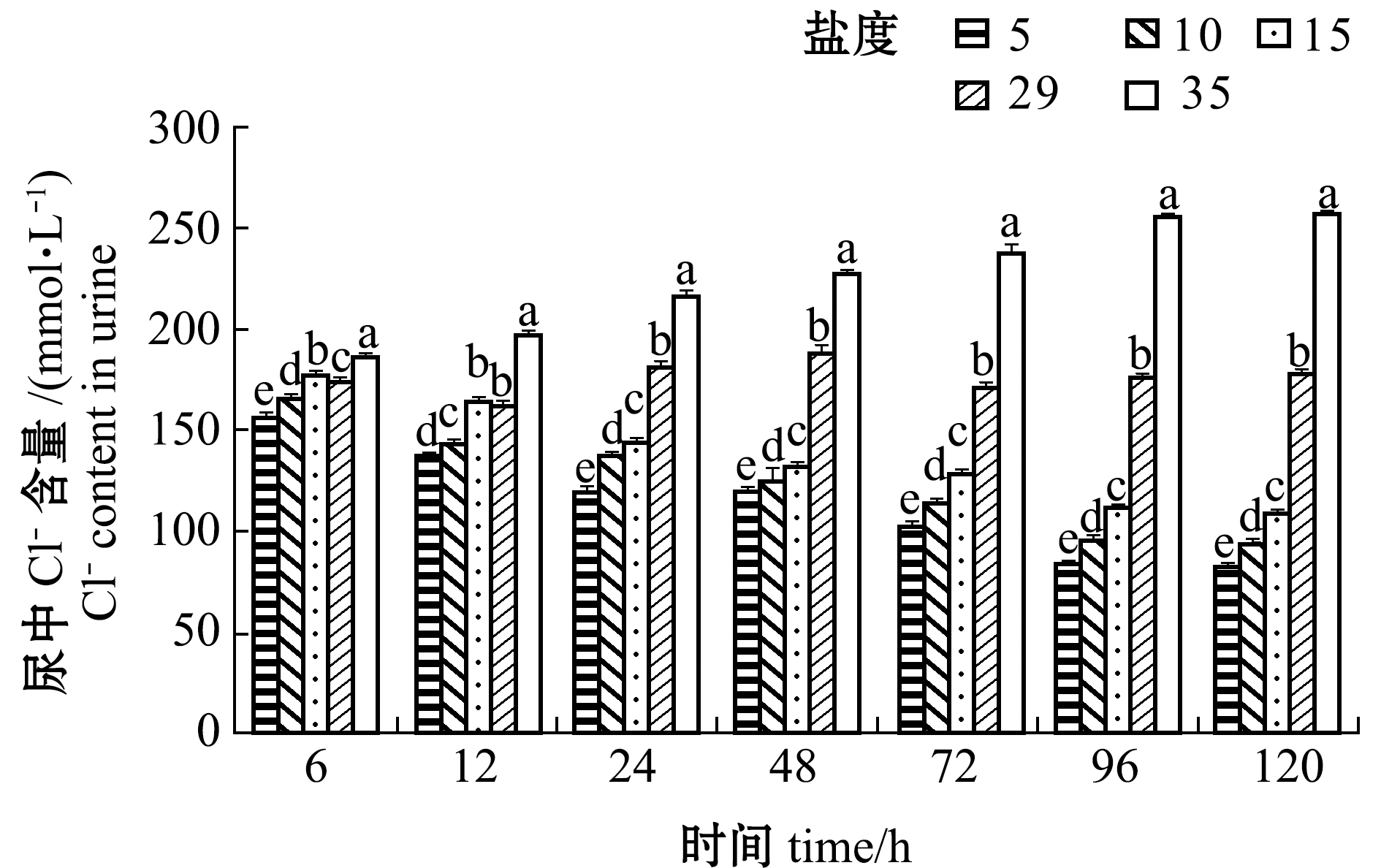
图8 不同盐度对尿中Cl-含量的影响
Fig.8 Effect of the different salinities on urine Cl- content
从图9可见:盐度5、10、15组血浆中Cl-含量总体上随处理时间的延长而降低,且在同一时间点下,Cl-均随着盐度的降低而降低;盐度35组血浆中Cl-含量随着处理时间的延长而增加, 96 h趋于稳定,12 h后各时间点下Cl-含量显著高于其他盐度组(P<0.05)。
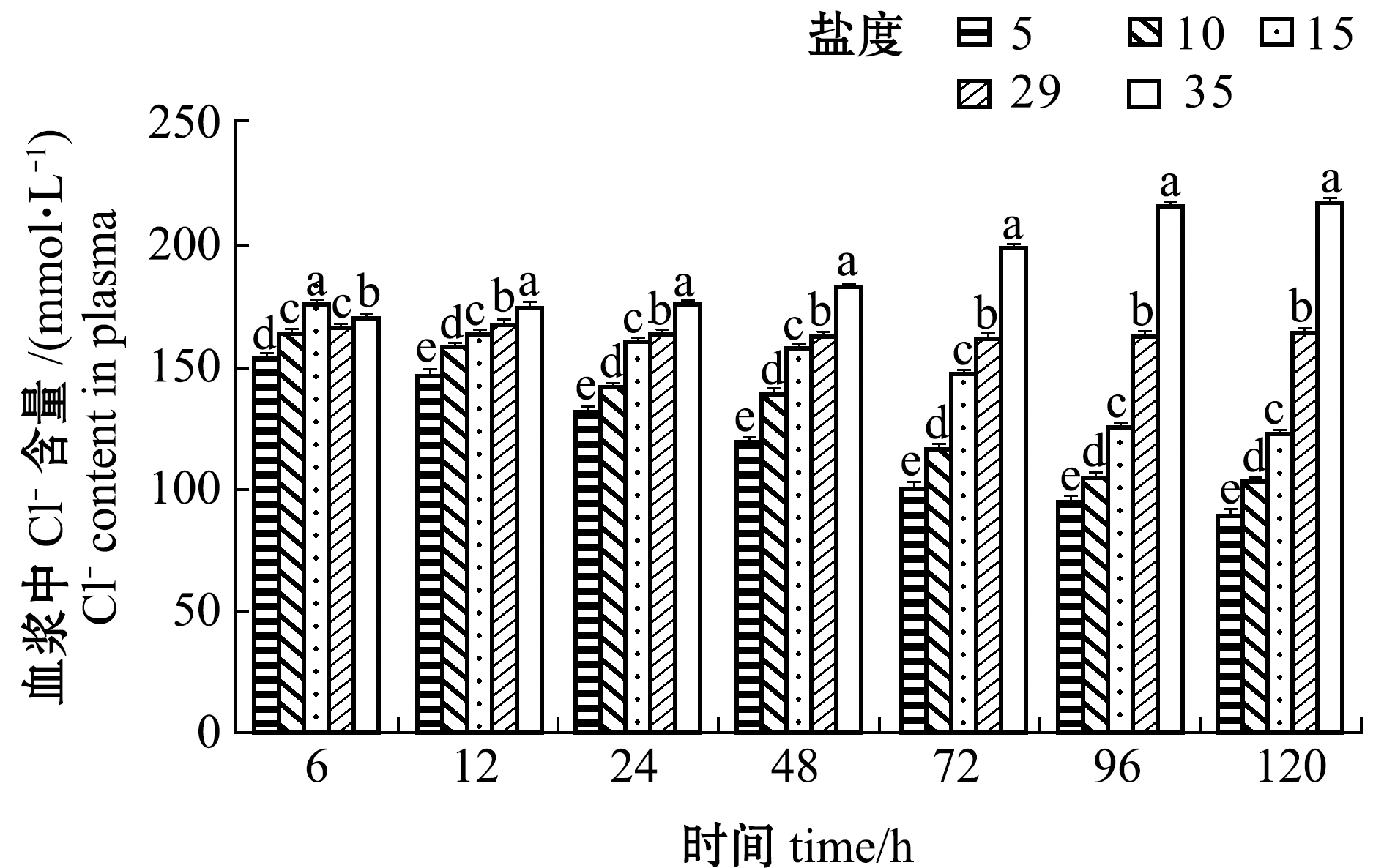
图9 不同盐度对血浆中Cl-含量的影响
Fig.9 Effect of the different salinities on plasma Cl- content
从图10可见:盐度5、10、15组血清中Cl-含量均随着处理时间的延长而降低,且在相同时间点下,Cl-含量均随盐度的降低而降低,96 h后趋于稳定;盐度35组血清中Cl-含量随处理时间的延长而增加, 72 h后趋于稳定,各时间点下Cl-含量均显著高于其他盐度组(P<0.05)。
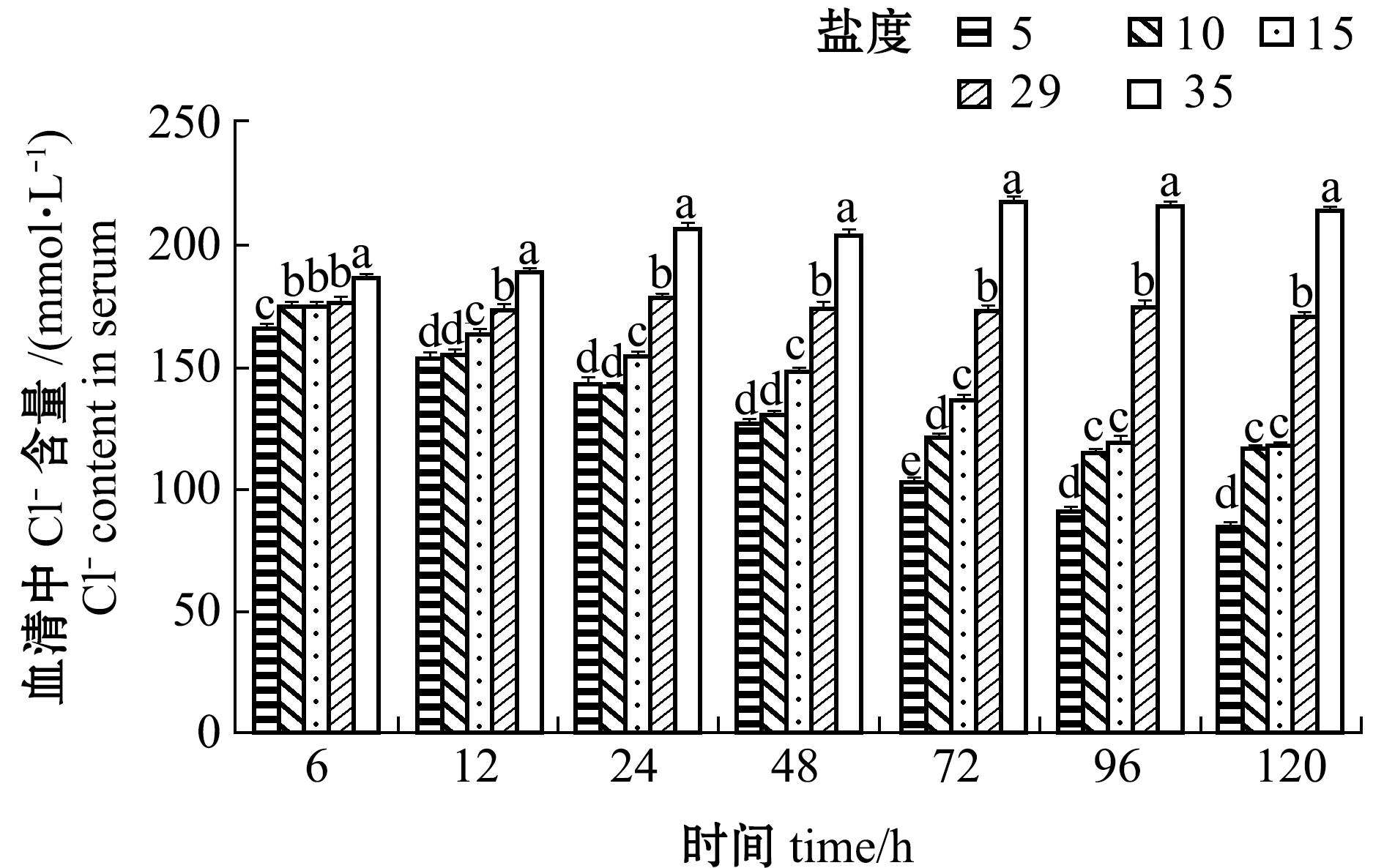
图10 不同盐度对血清中Cl-含量的影响
Fig.10 Effect of the different salinities on serum Cl- content
2.4 不同盐度下黄条鰤幼鱼尿和血浆渗透压的变化
从图11、图12可看出:盐度对黄条鰤幼鱼尿和血浆渗透压具有显著性影响(P<0.05);盐度5、10、15组尿和血浆的渗透压随盐度的降低和时间的延长总体上呈下降趋势, 与对照组总体上有显著性差异(P<0.05), 并且随盐度差的增大, 其渗透压的差距也逐渐增大;而盐度35组黄条鰤尿和血浆的渗透压随着处理时间的延长而升高,12 h后的各时间点下其渗透压显著高于其他盐度组(P<0.05)。这表明,低盐度或高盐度处理时, 鱼体通过降低或升高自身的渗透压以适应外界的盐度环境;各盐度组在试验进行到96 h后, 尿和血浆的渗透压整体上开始趋于稳定。
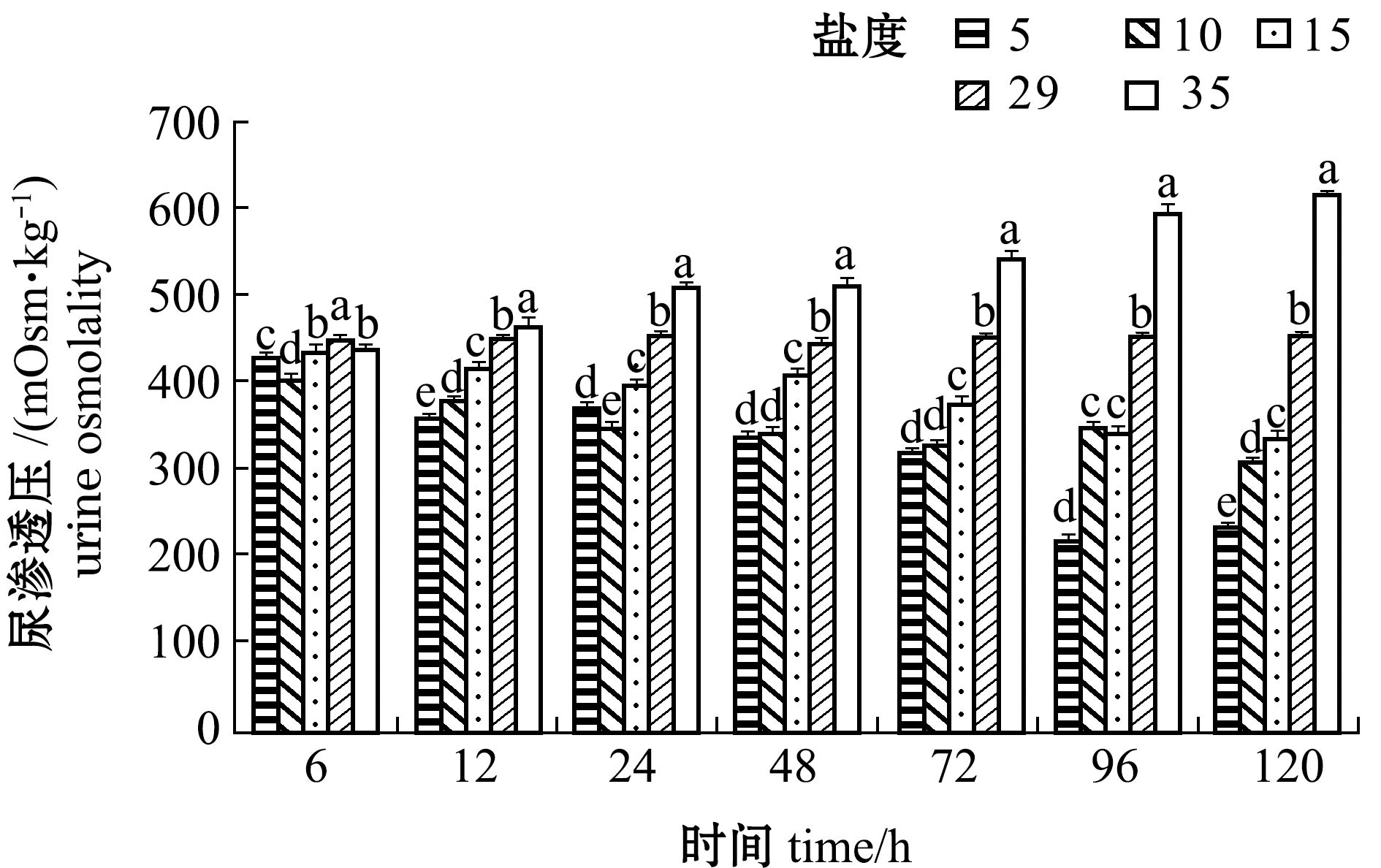
图11 不同盐度下尿的渗透压变化
Fig.11 Changes in urine osmolality at different salinities
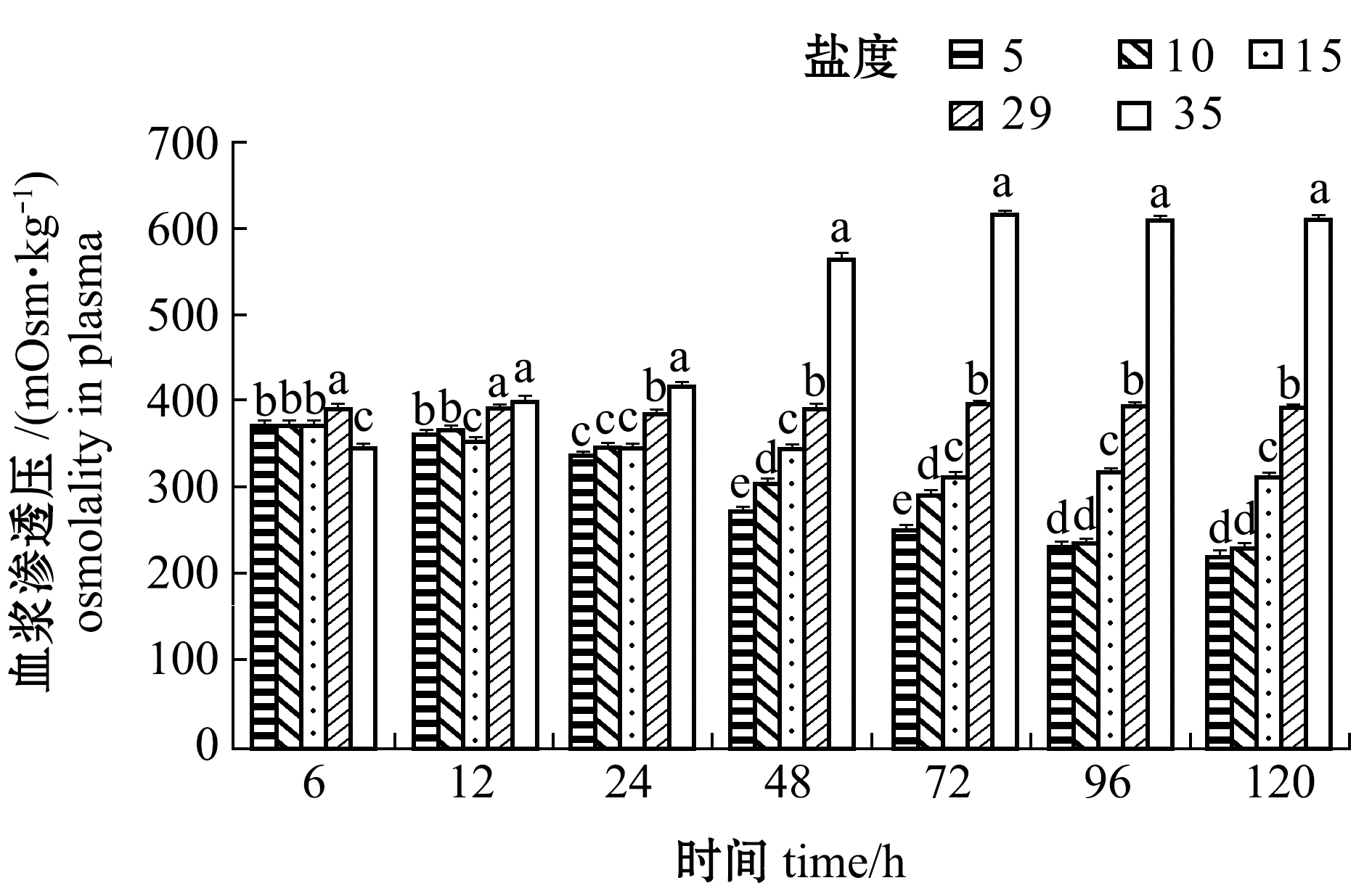
图12 不同盐度下血浆的渗透压变化
Fig.12 Changes in plasma osmolality at different salinities
2.5 组织扫描电镜观察
试验结束时, 扫描电镜观察比较盐度为5的低盐度组和盐度为35的高盐度组鱼的鳃丝、皮肤和肾脏组织结构变化情况。结果表明:对照组黄条鰤幼鱼鳃丝上每个鳃小片大小相似且排列均匀(图13-A);而在试验的120 h时,盐度5组鳃丝上的鳃小片明显紧贴在一起, 且从根部就出现弯曲, 鳃丝表面褶皱多而明显, 显得粗糙, 出现病理学损伤(图13-D);120 h时,盐度35组鳃丝上鳃小片稍有皱缩, 也出现弯曲且相近的2~3个鳃小片有相互靠近的趋势(图13-G)。从鱼的皮肤看, 对照组皮肤表面较为光滑, 箭头所示的黏液物质较少(图13-B);在试验的120 h时,盐度5组皮肤表面产生了大量黏液物质, 几乎布满皮肤表面(图13-E);在120 h时,盐度35组皮肤表面产生了少量黏液物质(图13-H)。从鱼肾脏的表皮组织看, 对照组肾脏表面较为平整无特殊结构(图13-C);在试验的120 h时,盐度5组肾脏表面此时则出现明显破损, 露出大量颗粒状物质(图13-F);120 h时盐度35组肾脏表皮几乎未有病理损伤(图13-I)。这表明,盐度5处理组对黄条鰤幼鱼的渗透相关组织造成了破坏性损伤, 而盐度35处理组基本未造成明显的损伤。

注:A,对照组(盐度29)鳃丝(×400);B,对照组皮肤(×700);C,对照组肾脏(×900);D,盐度5组鳃丝(×500);E,盐度5组皮肤(×1000);F,盐度5组肾脏(×500);G,盐度35组鳃丝(×220);H,盐度35组皮肤(×1500);I,盐度35组肾脏(×900);GL,鳃小片;MS,黏液物质;GM,颗粒状物质
Note: A,gill filaments in control group(a salinnity of 29)(×400);B,skin in control group(×700);C,kidney in control group(×900);D,gill in salinity 5 group(×500);E,skin in salinity 5 group(×1000);F,kidney in salinity 5 group(×500);G,gill in salinity 35 group(×220);H,skin in salinity 35 group(×1500);I,kidney in salinity 35 group(×900);GL,gill lamellae;MS,mucosubstance;GM,granular material
图13 不同盐度组黄条鰤幼鱼鳃丝、皮肤、肾的超微结构观察
Fig.13 Scanning-electron micrographs of gill, skin and kidney in yellowtail kingfish Seriola aureovittata exposed to various salinities
3 讨论
3.1 盐度突变对黄条鰤鳃丝Na+/K+-ATP 酶活力的影响
鳃丝Na+/K+-ATP酶活力的变化是广盐性鱼类参与渗透调节的一项重要监测指标, 主要通过每次消耗一个ATP为细胞内泵出3个Na+和泵入2个K+, 以保持膜内高钾、膜外高钠的分布, 进而保持细胞内环境渗透压正常, 细胞可维持正常生命活性。本研究中盐度5、10和15组随着处理时间的增加, 黄条鰤幼鱼鳃丝Na+/K+-ATP酶活力逐渐降低, 与对照组(盐度29)黄条鰤幼鱼鳃丝Na+/K+-ATP酶活力有显著性差异, 这种被动的应激反应阻止了Na+和Cl-流入。96 h时达到最低值之后保持稳定, 推测黄条鰤幼鱼开始进入主动渗透调节阶段。Mckenzie等[19]将意大利鲟Acipenser naccarii放入盐度20的水环境下发现,鳃丝Na+/K+-ATP 酶活力提升了3倍。胡静等[7]将克氏双锯鱼从盐度35突变至盐度15时, 24 h后Na+/K+-ATP 酶活力提升3~4倍。赵峰等[8]在阶段性盐度递增研究中发现, 史氏鲟幼鱼在盐度为10条件下24 h后鳃丝中Na+/K+-ATP 酶活力提升了2.0~2.5倍。本研究中盐度35组黄条鰤鳃丝Na+/K+-ATP 酶活力在120 h的盐度突变试验中先升高后降低, 96 h后保持稳定。Boeuf等[20]研究表明,水环境中的盐度越高即与鱼类体内渗透压相差越大时, Na+/K+-ATP酶活力越大, 需要消耗更多ATP来维持渗透压平衡。故鱼类需要通过适应过高或过低的盐度来确保ATP在机体内的适当消耗。本研究中在各盐度下黄条鰤幼鱼鳃丝Na+/K+-ATP酶活力在72 h或96 h之后基本趋于稳定, 在此之后鳃丝Na+/K+-ATP酶活力根据盐度的不同均呈现“U”形分布, 这与对点篮子鱼Siganus guttatus的研究结果相似[1], 这也说明黄条鰤幼鱼能够在盐度突变情况下调节体内离子平衡, 进行正常的渗透调节。
3.2 盐度突变对黄条鰤渗透相关离子浓度和渗透压的影响
鱼类适应不同盐度的能力最终取决于它从环境中摄取及排出离子的能力和维持机体水分平衡的能力[21]。屈亮等[22]对俄罗斯鲟A.gueldenstaedtii幼鱼的研究中发现, 在刚进入高盐度环境中由于体液渗透压低于外界环境渗透压, 细胞开始逐渐失水, 为保持细胞活性, 幼鱼开始呑饮海水, 但同时也通过肠道吸收了大量的Na+和Cl-, 体液中离子含量也随之升高。同俄罗斯鲟的研究结果类似, 在本研究中6 h时35盐度组黄条鰤尿、血浆和血清中Na+和Cl-明显高于对照组, 而在此应激条件下, 盐度35组黄条鰤幼鱼鳃丝 Na+/K+-ATP 酶活性显著低于对照组, Na+/K+-ATP 酶活力的降低可能导致鳃丝上细胞膜的通透性相对降低, 减少了Na+和Cl-的流入, 防止体液内离子浓度过高。有研究显示,史氏鲟的高盐度应激反应时间较短, 可很快转入主动调节阶段, 在此过程中鳃丝 Na+/K+-ATP酶活力逐步升高, 离子外排机制被激活, 离子含量逐渐降低最终趋于稳定[8]。本研究中高盐度组(盐度35)黄条鰤幼鱼鳃丝Na+/K+-ATP 酶活力虽升高, 但Na+和Cl-含量仍然缓慢升高并趋于稳定, 未出现降低现象, 可能是因为本试验周期较短, 黄条鰤离子外排机制未完全被激活。
在低盐度组黄条鰤尿、血浆和血清中Na+、Cl-和K+浓度均随处理时间的延长而降低, 且普遍存在盐度越高的组其离子浓度越高的现象;Na+和Cl-离子明显高于K+浓度, 而且Na+和Cl-浓度变化均十分显著, 但K+浓度则变化不明显。Altinok等[23]报道了墨西哥鲟A.oxyrinchus de sotoi幼鱼在96 h盐度胁迫下血清K+浓度有先上升后下降最后趋于淡水组初始值的趋势。但是, He等[24]在盐度10以下对中华鲟A.sinensis Gray幼鱼的研究中发现,24 h内 K+含量显著升高, 随后有所降低, 但直至20 d试验结束时K+含量仍然显著高于淡水组。但有关K+在鱼类渗透调节中的作用还不明确, 针对黄条鰤K+浓度的变化规律需进一步研究。章龙珍等[1]认为,不同的鱼类甚至是同一种类的鱼, 血清渗透压因其生活的环境不同而呈现差别,如水环境、温度的不同及个体大小的差异等。Na+、K+和 Cl-等离子是硬骨鱼类渗透压调节过程中的主要参与者, 一般来说广盐性海洋硬骨鱼类渗透压的变化趋势与血浆中 Na+和Cl-随环境盐度变化趋势近似。本研究中黄条鰤渗透压变化的趋势与之相符合, 并发现较低或较高的盐度对黄条鰤Na+、K+、Cl-和渗透压均有较大影响。
3.3 盐度突变对黄条鰤行为学和渗透相关组织形态学的影响
本研究中发现, 黄条鰤急性进入淡水(盐度为0)时反应强烈, 在水中快速游动, 并试图跳出试验桶, 15 min时出现侧倒现象(将侧倒的鱼移入正常海水后逐渐恢复正常), 试验进行到25 min时开始死亡, 并持续到50 min左右时死亡率达到100%。根据这一现象, 在进行黄条鰤淡水浴时的浸泡时间建议在5~10 min之内。在盐度为5试验组中,试验开始时黄条鰤的反应弱于淡水试验, 但是出现鱼体倾斜, 游动迟缓, 反应能力较低。其他盐度组试验鱼在行为特征上未有明显变化。在对点篮子鱼盐度突变的研究中,淡水组中试验鱼第9天开始出现死亡, 到第27天时死亡率达到100%, 其余各盐度组未出现异常现象[1]。出现这种差异可能与不同鱼类对盐度变化的适应能力和调节能力的差异有关。
鱼类组织器官的形态学变化也是判断鱼类对盐度适应性的重要表现。本研究中对照组黄条鰤每个鳃小片大小相似且排列均匀, 盐度5组的鳃小片在试验的120 h时明显紧贴在一起。Allen等[2]的研究显示,中吻鲟A.medirostris可通过封闭鳃丝表面富含线粒体细胞来减少表面积, 以降低被动运输离子和水。结合本研究结果推测,黄条鰤鳃丝可以根据外界盐度变化相应的吸水和缩水,以及调解细胞微结构来维持内外渗透压稳定。皮肤与外界水环境直接接触, 是保护鱼类机体免受外界环境干扰的天然屏障[3]。本研究中对照组皮肤表面较为光滑, 黏液物质较少, 但是盐度5组在试验的120 h时皮肤表面则产生了大量黏液物质, 几乎布满皮肤表面,而同时期盐度35组皮肤表面则产生了少量黏液物质。黏液的出现可能是为了隔离皮肤和外界变化的水环境, 以减少盐度变化对鱼体的影响。Abraham等[25]的研究也显示,在环境盐度变化时鲤Cyprinus carpio皮肤表面覆盖的黏液显著增加。另外, 本研究中对照组肾脏表面较为平整, 而盐度5组在试验的120 h时肾脏出现明显破损, 露出大量颗粒状物质。这说明盐度差异过大的突然变化对黄条鰤的鳃、皮肤和肾脏的表皮均产生了胁迫和损伤, 有一定的破坏作用。本研究开始时发现,过低盐度虽然对黄条鰤幼鱼未造成死亡, 但对游泳行为造成影响, 故仅取样观察盐度5和盐度35组鱼的渗透相关组织的结构变化, 试验未对其他盐度组鱼进行组织学观察分析, 今后应系统完善盐度对鱼的渗透相关组织结构影响研究。
[1] 章龙珍,罗集光,赵峰,等.盐度对点篮子鱼血清渗透压、离子含量及鳃丝Na+/K+-ATP酶活力的影响[J].海洋渔业,2015,37(5):449-456.
[2] Allen P J,McEnroe M,Forostyan T,et al.Ontogeny of salinity tolerance and evidence for seawater-entry preparation in juvenile green sturgeon,Acipenser medirostris[J].J Comp Physiol B,2011,181(8):1045-1062.
[3] Shen Wanpin,Horng J L,Lin L Y.Functional plasticity of mitochondrion-rich cells in the skin of euryhaline medaka larvae (Oryzias latipes) subjected to salinity changes[J].Am J Physiol Regul Integr Comp Physiol,2011,300(4):R858-R868.
[4] Evans D H.The Physiology of Fishes[M].Boca Raton:CRC Press,1993:315-343.
[5] 张晨捷,施兆鸿,王建钢,等.盐度影响海水硬骨鱼类渗透压调节机理的研究与展望[J].海洋渔业,2013,35(1):108-116.
[6] 田相利,王国栋,董双林,等.盐度突变对半滑舌鳎血浆渗透压和鳃丝Na+/K+-ATP酶活性的影响[J].海洋科学,2011,35(2):27-31.
[7] 胡静,叶乐,吴开畅,等.急性盐度胁迫对克氏双锯鱼幼鱼血清皮质醇浓度和Na+-K+-ATP酶活性的影响[J].南方水产科学,2016,12(2):116-120.
[8] 赵峰,庄平,章龙珍,等.盐度驯化对史氏鲟鳃Na+/K+-ATP酶活力、血清渗透压及离子浓度的影响[J].水产学报,2006,30(4):444-449.
[9] 潘鲁青,唐贤明,刘泓宇,等.盐度对褐牙鲆(Paralichthys olivaceus)幼鱼血浆渗透压和鳃丝Na+-K+-ATPase活力的影响[J].海洋与湖沼,2006,37(1):1-6.
[10] 税春,张海明,施永海,等.盐度对梭鱼幼鱼生长、渗透生理和体成分组成的影响[J].大连海洋大学学报,2015,30(6):634-640
[11] 刘静,陈咏霞,马琳.黄渤海鱼类图志[M].北京:科学出版社,2015:172.
[12] 柳学周,徐永江,李荣,等.黄条鰤(Seriola aureovittata)肌肉营养组成分析与评价[J].渔业科学进展,2017,38(1):128-135.
[13] 史宝,刘永山,柳学周,等.黄条鰤(Seriola aureovittata)染色体核型分析[J].渔业科学进展,2017,38(1):136-141.
[14] 史宝,柳学周,刘永山,等.黄条鰤线粒体全基因组测定及结构特征分析[J].中国水产科学,2019,26(3):4-14.
[15] 孙冉冉,史宝,柳学周,等.黄条鰤PTEN基因克隆、组织分布及早期发育阶段的表达分析[J].大连海洋大学学报,2019,34(1):47-55.
[16] 徐永江,张正荣,柳学周,等.黄条鰤早期生长发育特征[J].中国水产科学,2019,26(1):172-182.
[17] Muncaster S,Kraakman K,Gibbons O,et al.Antimicrobial peptides within the yellowtail kingfish (Seriola lalandi)[J].Dev Comp Immunol,2018,80:67-80.
[18] Linhart O,Walford J,Sivaloganathan B,et al.Effects of osmolality and ions on the motility of stripped and testicular sperm of freshwater- and seawater-acclimated tilapia,Oreochromis mossambicus[J].J Fish Biol,1999,55(6):1344-1358.
[19] McKenzie D J,Cataldi E,Di Marco P,et al.Some aspects of osmotic and ionic regulation in Adriatic sturgeon:II.Morpho-physiological adjustments to hyperosmotic environments[J].J Appl Ichthyol,1999,15(4-5):61-66.
[20] Boeuf G,Payan P.How should salinity influence fish growth?[J].Comp Biochem Physiol Part C:Toxicol Pharmacol,2001,130(4):411-423.
[21] Singer T D,Ballantyne J S.Sturgeon and paddlefish metabolism[M]//LeBreton G T O,William F,Beamish H,et al.Sturgeons and Paddlefish of North America.Dordrecht:Springer,2005,27:167-194.
[22] 屈亮,庄平,章龙珍,等.盐度对俄罗斯鲟幼鱼血清渗透压、离子含量及鳃丝Na+/K+-ATP酶活力的影响[J].中国水产科学,2010,17(2):243-251.
[23] Altinok I,Galli S M,Chapman F A.Ionic and osmotic regulation capabilities of juvenile Gulf of Mexico sturgeon,Acipenser oxyrinchus de sotoi[J].Comp Biochem Physiol Part A:Mol Integr Physiol,1998,120(4):609-616.
[24] He Xugang,Zhuang Ping,Zhang Longzhen,et al.Osmoregulation in juvenile Chinese sturgeon (Acipenser sinensis Gray) during brackish water adaptation[J].Fish Physiol Biochem,2009,35(2):223-230.
[25] Abraham M,Iger Y,Zhang L.Fine structure of the skin cells of a stenohaline freshwater fish Cyprinus carpio exposed to diluted seawater[J].Tissue Cell,2001,33(1):46-54.