扑草净(prometryn)是一种选择内吸传导型三嗪类除草剂,在中国农业生产和水产养殖中应用广泛。自2012年起,日本在中国进口的活蛤蜊等水产品中连续检出扑草净残留超过基准值(0.01 mg/kg),并实施持续检查[1-2],直到2019年7月产品因超标而废弃、退货的现象还在不断出现[3],极大地影响了中国水产品的贸易出口,引起了相关研究者的关注。欧盟已于2004年1月全面禁止扑草净作为农药进行销售和使用。作为可疑的内分泌干扰物(EDS)[4],2010年农业农村部第1435号公告将扑草净(水产用)列入了《兽药试行标准废止目录》,主要原因是其在鱼体内的代谢情况不明,不能进行安全性评价故不予转正[2,5]。
扑草净在环境和动植物体内经复杂的降解代谢转化途径产生了结构多样的代谢中间产物,但目前对其分子结构命名不统一影响了进一步对其毒性评估和风险监测;扑草净虽属急性致死毒性低和无潜在致癌性的除草剂,但对机体的内分泌干扰作用不可忽视。本研究中重点对扑草净的毒性和代谢物的结构及命名进行了总结,以期为开展扑草净对人体健康和生态环境潜在危害的研究和进行准确安全性评价提供依据。
1 扑草净及其代谢物的结构、性质、合成和储存稳定性
扑草净及其代谢降解物的结构(表1):扑草净在20 ℃水中溶解度为33 mg/L(低水溶性不易渗入土层下面);亨利定律常数为2.75×10-7;蒸汽压为0.133 mPa(不易蒸发);辛醇-水分配系数lgKow为3.51(脂溶性中等);25 ℃时酸度系数pKa值为4.05(在水溶液中具弱碱性)。扑草净分子结构中甲硫基被取代时会极大地影响其酸碱度,如羟基取代甲硫基形成化合物GS-11526的pKa值大于5,其被土壤强烈吸附并难以在土壤中移动。
扑草净的性质:剂型为50%和80%可湿性扑草净粉剂,常和乙草胺联合使用以扩大杀草谱。扑草净经植物根部吸收并经非共质体途径传导到分生组织和叶面,作用靶标是植物光合作用系统Ⅱ的受体蛋白,从而抑制了电子传递(Hills反应)和氧化磷酸化。扑草净可被0~5 cm深度的土壤吸附形成药层,能选择性地使杂草在出苗见光后产生中毒作用致死,由于在非靶标作物体内的降解代谢或在谷胱甘肽-S-转移酶等作用下轭合成活性较低的解毒产物,故作物的耐性增强。对人类和动物确切的作用机制未知,可能影响了机体内三羧酸循环并抑制氧化磷酸化作用[6]。
表1 扑草净及其降解代谢物的结构
Tab.1 Structure of prometryn and its metabolites
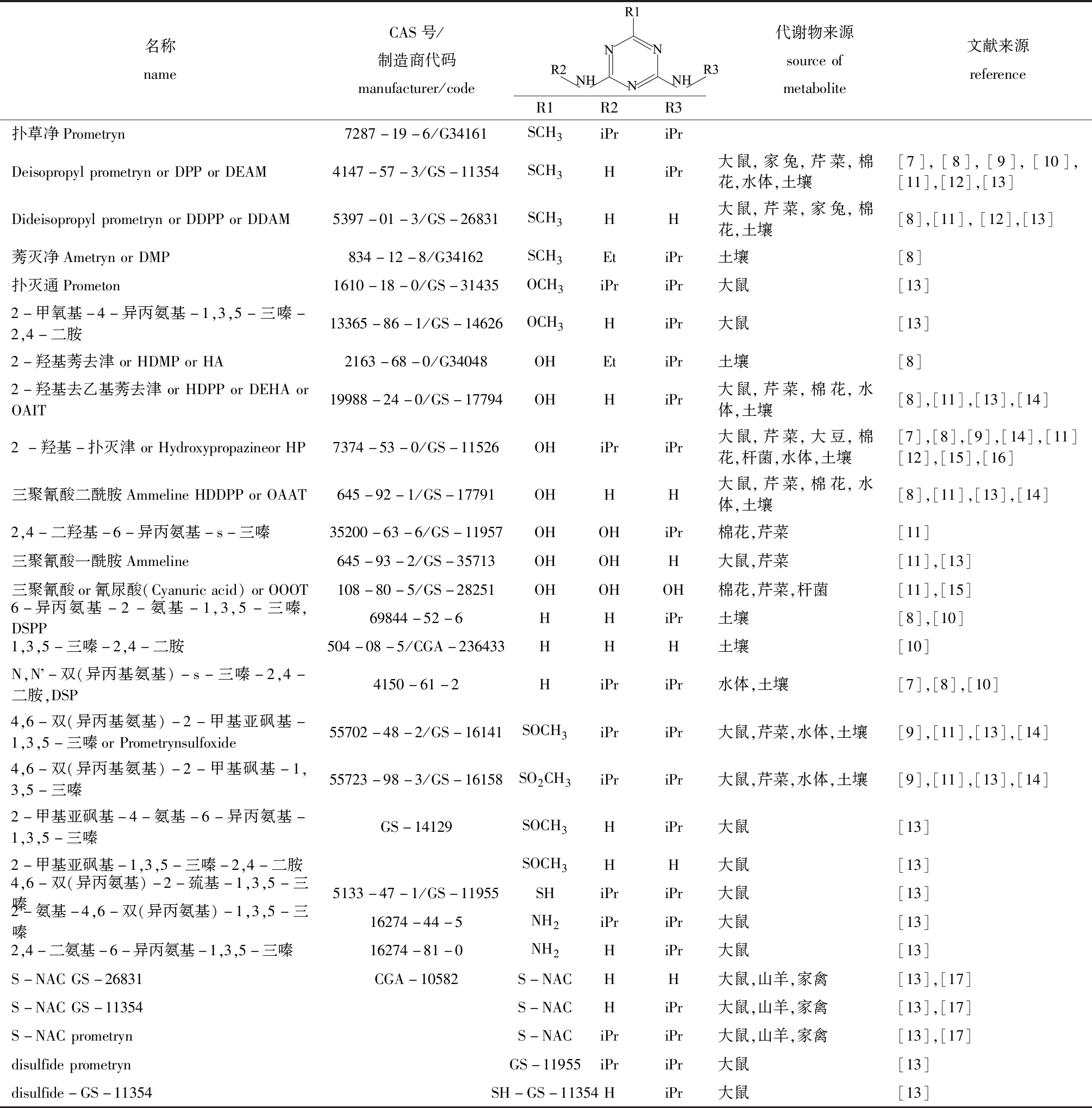
名称nameCAS号/制造商代码manufacturer/codeR1R2R3代谢物来源sourceofmetabolite文献来源reference扑草净Prometryn7287-19-6/G34161SCH3iPriPrDeisopropylprometrynorDPPorDEAM4147-57-3/GS-11354SCH3HiPr大鼠,家兔,芹菜,棉花,水体,土壤[7],[8],[9],[10],[11],[12],[13]DideisopropylprometrynorDDPPorDDAM5397-01-3/GS-26831SCH3HH大鼠,芹菜,家兔,棉花,土壤[8],[11],[12],[13]莠灭净AmetrynorDMP834-12-8/G34162SCH3EtiPr土壤[8]扑灭通Prometon1610-18-0/GS-31435OCH3iPriPr大鼠[13]2-甲氧基-4-异丙氨基-1,3,5-三嗪-2,4-二胺13365-86-1/GS-14626OCH3HiPr大鼠[13]2-羟基莠去津orHDMPorHA2163-68-0/G34048OHEtiPr土壤[8]2-羟基去乙基莠去津orHDPPorDEHAorOAIT19988-24-0/GS-17794OHHiPr大鼠,芹菜,棉花,水体,土壤[8],[11],[13],[14]2-羟基-扑灭津orHydroxypropazineorHP7374-53-0/GS-11526OHiPriPr大鼠,芹菜,大豆,棉花,杆菌,水体,土壤[7],[8],[9],[14],[11][12],[15],[16]三聚氰酸二酰胺AmmelineHDDPPorOAAT645-92-1/GS-17791OHHH大鼠,芹菜,棉花,水体,土壤[8],[11],[13],[14]2,4-二羟基-6-异丙氨基-s-三嗪35200-63-6/GS-11957OHOHiPr棉花,芹菜[11]三聚氰酸一酰胺Ammeline645-93-2/GS-35713OHOHH大鼠,芹菜[11],[13]三聚氰酸or氰尿酸(Cyanuricacid)orOOOT108-80-5/GS-28251OHOHOH棉花,芹菜,杆菌[11],[15]6-异丙氨基-2-氨基-1,3,5-三嗪,DSPP69844-52-6HHiPr土壤[8],[10]1,3,5-三嗪-2,4-二胺504-08-5/CGA-236433HHH土壤[10]N,N -双(异丙基氨基)-s-三嗪-2,4-二胺,DSP4150-61-2HiPriPr水体,土壤[7],[8],[10]4,6-双(异丙基氨基)-2-甲基亚砜基-1,3,5-三嗪orPrometrynsulfoxide55702-48-2/GS-16141SOCH3iPriPr大鼠,芹菜,水体,土壤[9],[11],[13],[14]4,6-双(异丙基氨基)-2-甲基砜基-1,3,5-三嗪55723-98-3/GS-16158SO2CH3iPriPr大鼠,芹菜,水体,土壤[9],[11],[13],[14]2-甲基亚砜基-4-氨基-6-异丙氨基-1,3,5-三嗪GS-14129SOCH3HiPr大鼠[13]2-甲基亚砜基-1,3,5-三嗪-2,4-二胺SOCH3HH大鼠[13]4,6-双(异丙氨基)-2-巯基-1,3,5-三嗪5133-47-1/GS-11955SHiPriPr大鼠[13]2-氨基-4,6-双(异丙氨基)-1,3,5-三嗪16274-44-5NH2iPriPr大鼠[13]2,4-二氨基-6-异丙氨基-1,3,5-三嗪16274-81-0NH2HiPr大鼠[13]S-NACGS-26831CGA-10582S-NACHH大鼠,山羊,家禽[13],[17]S-NACGS-11354S-NACHiPr大鼠,山羊,家禽[13],[17]S-NACprometrynS-NACiPriPr大鼠,山羊,家禽[13],[17]disulfideprometrynGS-11955iPriPr大鼠[13]disulfide-GS-11354SH-GS-11354HiPr大鼠[13]
注:Et表示乙基;iPr表示异丙基;NAC表示乙酰半胱氨酸
Note:Et,ethyl;iPr,isopropyl;NAC,N-acetylcysteine
扑草净的合成:一般以三聚氯氰、异丙胺和甲硫醇钠为原料,以三氯乙烯为溶剂,经一取代胺化反应,二取代反应得到产物扑灭津,最后蒸出三氯乙烯,抽滤,105 ℃下干燥2 h后得到最终的三取代反应产物扑草净。在较佳的反应条件下,扑草净的收率和纯度通常达86%和87%[18]。
储存稳定性:扑草净粉剂在正常温度和湿度条件下(暗处)可保存5年或更久[6];而芹菜和棉籽中的扑草净和脱烷基代谢物GS-11354及GS-26831含量在-20 ℃条件下可稳定保持37个月[17]。
2 扑草净在动植物体内的生物富集
分析绿藻Chlorophyta reinhardtii对2.5~12.5 μg/L扑草净的富集和降解发现,富集系数(BCF)在低浓度时要比高浓度时还高,最高达到700多倍。初始2 d时不积累,可能是因代谢速率远高于蓄积速率,但代谢饱和后开始快速积累并在第4天时达到最高值(1.47 mg/kg鲜质量),然后停止积累,这表明触发了氧化应激机制[19]。
扑草净在植物如土豆、甜菜和洋葱中积累程度低但达到了可检测浓度。土豆在含0.01~0.64 mg/kg扑草净的土壤中残留量为0~0.08 mg/kg;土壤用1.5~3 kg/hm2扑草净处理,胡萝卜呈中度积累浓度,可达0.02~0.15 mg/kg。蔬菜加工(切割、清洗、烹饪)可使浓度降低75%~100%[6]。
扑草净在水生生物体内的富集较为温和,如淡水鱼体内的扑草净浓度为周围环境水浓度的9~10倍,蓝鳃太阳鱼连续暴露于0.05 mg/L扑草净达28 d时,富集系数BCF为85[17]。海参、菲律宾蛤仔和文蛤于浓度为1.00 μg/L的扑草净水中,BCF分别为4.70、40.3、22.9[20-22],菲律宾蛤仔的BCF相对较高,与其具有开放式循环系统直接滤食海水中的浮游藻类为食物有关。
3 扑草净在环境中的降解和动植物体内的代谢
3.1 扑草净在水体中的降解和光解
扑草净在淡水中光降解的平均半衰期为28 d,海水中为55~70 d[6]。用UPLC-Q-ToF-MS/MS法测定100 ng/L扑草净在消毒饮用水(0.9 mg/L次氯酸钠)中新产物的形成,扑草净较快降解,经1 h和5 h分别形成第一、二种副产物,22 h后产生少量的第三、四种副产物;反应前后溶液对细胞的半数最大效应浓度EC50由26 mg/L变为5.2 mg/L,显示副产物毒性比母体化合物提高了5倍;主要反应产物是甲硫基氧化物(砜GS-16158和亚砜GS-16141),次要成分为羟基化合物(GS-11526、GS-17794和三聚氰酸二酰胺)[14]。
扑草净在自然水体中的光降解,暗反应可以忽略不计,降解速率遵循一级动力学。结合串联质谱分析表明,存在多种复杂而相互联系的降解途径,即甲硫基裂解形成DSP和羟基化合物GS-11526,或者经单-N-脱烷基化形成GS-11354[7]。
3.2 扑草净在土壤中的降解和光解
扑草净在土壤中半衰期为274~316 d,微生物和生物降解的存在可缩短半衰期,其中,细菌起主要降解作用,真菌起次要作用,同时光降解仍然是重要的途径[6]。
土壤中扑草净的降解途径主要是通过羟基化、脱烷基化和脱甲硫基进行的。脱烷基化的途径首先脱去单侧异丙基产生GS-11354,同时也是脱甲基形成DMP莠灭净后脱乙基的产物,GS-11354再脱去另一侧异丙基得到低分子量的GS-26831;脱甲硫基的途径是首先分别脱去甲硫基和侧链异丙基形成DSP和GS-11354,再进一步脱异丙基形成降解物DSPP;羟基化途径为羟基取代甲硫基并先后形成GS-11526、HDMP和GS-17794,最终产物是三聚氰酸二酰胺[8]。
Khan等[9]分别采用GC和GC/MS法对现场处理的土壤进行了检测,结果发现:羟基产物GS-11526和去异丙基产物GS-11354是田间样品中唯一可提取的降解物,此外,研究还观察到微量瞬态硫氧化物如砜和亚砜,并水解成为羟基化合物GS-11526;随时间的推移扑草净残留量减少的同时可提取的GS-11526含量增加;田间土壤在使用2.24、4.48 kg/hm2的扑草净345 d后,GS-11526含量分别为0.8、0.9 mg/kg,且随GS-11526的增加GS-11354含量几乎保持不变。
用TLC、GC和GC/MS法分析土壤中扑草净光降解产物,发现降解过程在1.5 h内迅速完成。扑草净降解途径有两条,其一是失去甲硫基形成90%的DSP,然后脱去一条侧链异丙基形成DSPP后,再脱去一个异丙基形成最终降解产物CGA-236433;途径之二是失去一个侧链异丙基形成10%的GS-11354,然后迅速损失甲硫基形成DSPP,再经另一个侧链异丙基的断裂最终也生成CGA-236433[10]。
3.3 扑草净的微生物降解
扑草净的降解主要经脱甲硫基、侧链烷基和羟基化等不同途径,目前尚不能确定复杂的降解产物在自然环境中潜在的危害和微生物的最终修复能力。研究者已经分离了多个能降解扑草净的菌株。分离自河北和吉林工业废水的27个菌株(Arthrobacter属和Pseudomonas假单胞菌属)中有24个含编码三嗪水解酶的trzN基因,可降解扑草净结构中的甲硫基,同时有11个菌株含trzN-atzBC基因可将氰尿酸降解成CO2和NH3,但该菌株不含编码氰尿酸水解酶的atzD或trzD基因,表明可能有新的负责降解氰尿酸的基因[23]。从活性污泥中分离到的白色杆菌以扑草净作为碳和能量的唯一来源,降解过程几乎在2 h内完成,具有trzN基因编码脱甲硫基的三嗪水解酶,可将100 mg/L扑草净转化为羟基化合物GS-11526和甲硫醇,再脱氨基转化为最终产物三聚氰酸[15]。
3.4 扑草净在动植物体内的代谢
外源化合物在动植物体内的代谢一般涉及两个阶段:Ⅰ相代谢主要经氧化、还原或水解,改变原有非极性基团或增加新的功能基团如羟基、巯基、氨基等,通常产生比原形更易溶于水且毒性较小的产物或Ⅱ相代谢的适当底物;Ⅱ相代谢中主要与生物内源性物质如葡萄糖醛酸、氨基酸、谷胱甘肽等结合,或经乙酰化、甲基化生成易从机体排泄的水溶性结合产物[24]。
3.4.1 扑草净在植物体内的代谢 研究C14标记的扑草净在棉花(中度敏感)和大豆(高度敏感)的吸收、转运和代谢发现,在大豆茎中放射性含量比根部高得多,而棉花中则相反;主要代谢产物为羟基代谢物GS-11526;研究认为,扑草净在棉花和大豆中的不同转运是敏感性差异的主要因素[16]。
对扑草净在棉花和芹菜(Celery)中代谢的研究表明[11]:未成熟棉秆中有机可溶物主要为扑草净、GS-11354、GS-26831和GS-17794,成熟棉茎极性组分GS-11526、GS-17794、GS-11957、三聚氰酸二酰胺和三聚氰酸只占总残留物的2%;而芹菜中检出的十几种代谢物包括羟基化合物(GS-11526、GS-17794、GS-11957、三聚氰酸二酰胺、三聚氰酸一酰胺和三聚氰酸)、侧链羟基氧化物(MCO-III-25和MCO-IV-34)、硫氧化物(亚砜GS-16141和砜GS-16158)和侧链脱烷基产物(GS-11354和GS-26831)。可见,扑草净在植物中的代谢途径复杂,产物繁多。
3.4.2 扑草净在动物体内的代谢 给家兔灌胃10 mL浓度为150 g/L的扑草净,发现较快去异丙基代谢为GS-11354和GS-26831,其半衰期t1/2为13.49 h,tmax为0.5 h,Cmax为3.482 μg/mL[12]。
美国环保局研究发现,扑草净在山羊和家禽体内的代谢物主要由扑草净、GS-11354和GS-26831三种化合物的N-乙酰半胱氨酸结合物及GS-11354、三聚氰酸二酰胺和GS-17794三种降解产物的半胱氨酸结合物组成[17]。
Michard等[13]进行了大鼠口服0.5、500 mg/kg[C14]扑草净的代谢研究,结果表明,在大鼠体内广泛代谢,主要通过N-脱烷基化反应、硫氧化、羟基取代氨基和甲硫基、形成二硫键,以及与半胱氨酸、谷胱甘肽或葡萄糖醛酸等的结合物来完成。
联合采用液相色谱、气质联用和薄层色谱法等分析尿中主要的代谢物及比例:GS-11354、GS-26831和扑草净的N-乙酰半胱氨酸结合物占30%;扑草净和GS-11354的二硫化物占19%;扑草净、脱烷基物GS-11354和GS-26831占12%;羟基代谢物GS-11526、三聚氰酸二酰胺和GS-17794占7%;硫氧化物(砜和亚砜)占5%,及少量葡萄糖醛酸和谷胱甘肽结合物等;粪便中代谢物与尿液相似但种类少。尿和粪便回收总量达90%~98%。
总之,扑草净在大鼠体内的主要代谢物GS-11354-N-乙酰半胱氨酸结合物含量虽然大于10%(占总尿量的16%),但因为是与氨基酸结合的简单反应,可认为毒性较小,不必单独进行代谢物毒性评价[25]。扑草净在大鼠体内的次要代谢物为硫氧化物砜和亚砜类占不到5%,其毒性往往比原形增加5~10倍[14],不过亚砜GS-16141很容易氧化成砜GS-16158,随后在S-位和谷胱甘肽或葡萄糖醛酸形成毒性小的水溶性结合物排出。
由此可见,扑草净在水体、土壤和动植物体内形成了数量广泛、种类繁多、降解代谢不完全的复杂中间产物,多数化合物的三氮苯环最终不裂解。
4 扑草净毒理学研究
人体经口摄入735 mg/kg剂量的扑草净表现有恶心和喉咙痛呕吐,精神萎靡不振,胃肠道症状伴低钾血症,体内丙酮酸和乳酸水平升高并引发高阴离子间隙(47.5 mmol/L)代谢性酸中毒[6,26];通过呼吸道吸入则角膜上皮细胞受损,存在不同程度的眼部不适感,如眼痛、流泪、异物感等[27]。
4.1 扑草净对水生动物早期发育的影响
研究发现,144 μg/L的扑草净能影响淡水螯虾的早期发育,使体质量明显减轻,性成熟和繁殖周期延迟,而0.51 μg/L的环境水域引起虾的鳃和肝胰腺组织病理学变化[28];鲤暴露于1200 μg/L的扑草净则影响早期个体发育,孵化率和胚胎存活率显著降低(P<0.01)[29]。
4.2 扑草净的免疫和内分泌毒性
采用流式细胞分析小鼠暴露于扑草净(185、375、555 mg/kg)28 d时,对小鼠脾细胞、胸腺细胞和淋巴结细胞凋亡和坏死的免疫毒性。发现所有剂量的处理组和对照组脾脏细胞凋亡率无明显变化,但最低剂量组胸腺和淋巴结细胞早期凋亡增加,坏死无显著增加,中等剂量触发的淋巴结细胞晚期凋亡增加,最高剂量导致胸腺和淋巴结细胞凋亡和坏死百分比均显著增加[30]。
扑草净对大鼠前列腺中睾酮的转化和对代谢物5α-二氢睾酮(由5α-DHT还原酶5α-R形成,其与特定受体相互作用而变得完全活性)即5α-DHT受体复合物形成的影响表明,116 μg/L扑草净明显改变了大鼠前列腺中5α- R酶活性和显著抑制了5α-DHT的形成(P<0.05),干扰了大鼠正常的生殖活动[31]。
0.25 mg/L扑草净能引起两栖动物蝌蚪明显的生长发育延缓,暴露第14天时开始出现畸形并呈时间-反应关系,蝌蚪变态发育缺陷程度增加[32]。
4.3 扑草净的细胞和遗传毒性
用50~200 μmol/L扑草净处理人非小细胞肺癌细胞系(A549)和人支气管上皮样细胞(BEAS-2B),发现A549细胞发生G1期阻滞,BEAS-2B细胞S期阻滞,细胞增殖速度和细胞周期进程均受阻,明显诱导了DNA的氧化损伤和造成DNA双链断裂并呈剂量-反应关系;200 μmol/L扑草净使BEAS-2B细胞胞内活性氧生成増多[33]。
绿藻暴露于5.0~12.5 μg/L扑草净时细胞内持续产生活性氧ROS,其攻击生物大分子如核酸、蛋白质或脂质等,诱导了氧化应激机制。活性氧的产生和负责清除自由基的抗氧化物酶活性密切相关,发现4种抗氧化物酶(SOD、CAT、APX和GST)的水平随扑草净浓度的增加呈明显剂量-反应关系,使基因表达上调[19]。
用25 mg/L扑草净处理远志Polygala tenuifolia Willd草本中药材,则引起远志幼苗氧化胁迫,根系中活性氧![]() 和H2O2的含量呈显著增加趋势,膜脂过氧化程度加剧,细胞膜完整性破坏,引起细胞内各种电解质外渗,根系活力下降,抑制了远志幼苗的生长发育[34]。用2、3、4、6 g/L浓度的扑草净处理洋葱根尖细胞,发现有丝分裂指数显著降低,异常细胞百分率显著提高,DNA含量明显降低,其微核形成与DNA损伤呈正相关[35]。
和H2O2的含量呈显著增加趋势,膜脂过氧化程度加剧,细胞膜完整性破坏,引起细胞内各种电解质外渗,根系活力下降,抑制了远志幼苗的生长发育[34]。用2、3、4、6 g/L浓度的扑草净处理洋葱根尖细胞,发现有丝分裂指数显著降低,异常细胞百分率显著提高,DNA含量明显降低,其微核形成与DNA损伤呈正相关[35]。
克氏原螯虾Procambarus clarkii暴露于0.51 μg/L浓度的扑草净中没有显示细胞的氧化损伤,但氧化应激指数(TBARS)和抗氧化酶(SOD、CAT、GR)活性均有显著变化(P<0.01),从而造成DNA损伤[36]。
采用彗星试验分析小鼠经口亚慢性暴露扑草净是否能诱导血液中白细胞的DNA损伤,发现处理组的DNA断裂定量参数如Olive尾矩、尾长和尾部强度等值均普遍增加,并与处理剂量及暴露时间成正比。认为扑草净或其代谢残留物有可能对小鼠体内的白细胞产生遗传毒性作用[37]。
5 扑草净对人类健康和生态环境的安全评价方法
有两种安全评价方法[38],评估值大于1表明对人体健康和生态环境存在风险。
a)基于危险商HQ的人体健康非致癌风险评估:
HQ=CDI/RfD。
其中:CDI为每日慢性摄入量,代表每kg体质量摄入的扑草净估计值;RfD为扑草净通过口服暴露的参考剂量,取为0.04 mg/(kg·d)。
b)基于风险商RQ的生态毒理学风险评估:
RQ=MEC/PNEC。
其中:MEC为扑草净在环境中的实际浓度(水体中位数浓度和最大检测浓度分别作为一般和最坏情况的RQm和RQex);PNEC为应用最敏感物种的无效应浓度NOEC值和评估因子得出的生态安全阈值。
对希腊水域2382个样品进行了残留检测并实施了风险优先排序。根据危险商(HQ达1487)、PBT分数(即持久性、生物积累性、毒性和潜在内分泌干扰特性的综合分数)和检出频率排名,得出扑草净在302个农药中均排到了前三位,表明扑草净对水域生态危害值得高度关注[39]。此外,检测希腊河流和湖泊416个样品的147种农药发现,扑草净频繁检出达12.5%,平均生态风险商RQm为1.9,最高RQex达30.0,MEC远超过可接受的PNEC风险值 0.02 μg/L,但是对人体健康非致癌风险HQ最高达0.030 8,远小于1[38]。说明扑草净存在严重的生态风险,然而单纯通过饮用水口服暴露途径对人类健康不会产生危害。
6 存在问题及展望
(1)加强对扑草净内分泌干扰特性的基础研究和生态调查工作。内分泌干扰物(EDS)的定义是通过模拟体内自然激素与细胞受体结合或改变受体的数量、对抗激素功能等,阻碍细胞、组织和器官的正常激素表达,并对机体和后代的生长发育、免疫功能等造成损害及产生癌症的风险,表现在动物早期发育(如配子发生或胎体发育期)就已经导致受多种激素介导的生长障碍,虽然在半衰期内可能已经清除了侵入机体内的全部或大部分外源化合物,但EDS对某些组织器官已经造成了损害,继而产生了各种不良健康后果[40]。目前只有很少文献[28-30]研究了扑草净的内分泌毒性,对扑草净内分泌干扰方面需要大量细致的基础性研究工作。国外研究发现,扑草净在环境中频繁检出,在众多农药风险排名中居首远高于可接受的生态风险值,其长期暴露可能已经对动物的生殖发育和环境的生态种群衰退产生了重大的不良影响,而国内对扑草净开展生态调查及风险监测研究较少,需引起有关部门的充分重视。
(2)研究扑草净植物代谢及选择性除草的作用机制。普遍认为除草剂选择性和其在植物体内的代谢作用密切相关,抗性植物能降解扑草净成无活性或活性较弱的产物,从而减少毒性增加耐受性。植物代谢的复杂性为研究代谢途径带来了难度。如何更有效地从植物体内提取到结合态扑草净和复杂多样不同极性的代谢产物,开发植物体内相关代谢酶的提取及分离技术,将有利于阐述扑草净对植物的毒性机制和选择性除草机理。
(3)进一步开展扑草净及降解产物的毒理学研究。三嗪类除草剂R1取代基为Cl、S-CH3和O-CH3时分别称津、净和通类。扑草净、莠去津和特丁通等结构类似物在环境中的降解途径通常是R1基被取代或者侧链烷基部分或完全损失,平行或先后形成不同侧链的共同混合物直到松开所有的侧链形成最终降解产物三聚氰酸一酰胺或三聚氰酸等。如扑草净脱异丙基、莠灭净脱乙基的代谢产物均为GS-11354;莠去津在超纯水中光解的羟基降解产物为三聚氰酸二酰胺和GS-17794[11];莠灭净在大鼠、哺乳期山羊和产蛋鸡中形成脱烷基代谢物GS-11354和GS-26831[41],虽然扑草净在生物体和环境中的多数代谢降解物的毒性降低了,但是某些中间产物如砜及亚砜的毒性却大大增加;一些代谢物如扑灭通和莠灭净等毒性与扑草净相当或更高(扑草净对大鼠急性经口LD50是3150~3750 mg/kg,扑灭通为2980 mg/kg,莠灭净673 mg/kg);又如降解产物氰尿酸会造成肾组织损伤,包括肾小管上皮细胞坏死或增生,中性粒细胞浸润,以及矿化和纤维化。最终使人类暴露于自然界诸多复杂除草剂及代谢降解物的健康和环境风险中。目前对各代谢降解产物的理化性质、潜在毒性效应(致突变、内分泌干扰特性等)、在环境和生物体内的稳定性和分布特点等尚不清楚,需要开展扑草净降解产物的毒理学研究。
[1] 李庆鹏,秦达,崔文慧,等.我国水产品中农药扑草净残留超标的警示分析[J].食品安全质量检测学报,2014,5(1):108-112.
[2] 付晓苹,刘巧荣,许玉艳,等.扑草净对人体健康及水生环境的安全性评价[J].中国农学通报,2015,31(35):49-57.
[3] 2019年7月输日食品违反日本食品卫生法情况(7月汇总)[EB/OL].食品资讯中心.http://news.foodmate.net/2019/08/528758.html
[4] PAN.The List of Lists:A Catalogue of Lists of Pesticides Identifying Those Associatedwith Particularly Harmfulor Environmental Impacts[M].3rd ed.London:Pesticide Action Network,2009.
[5] 农业农村部.中华人民共和国农业部公告1435号[EB/OL].[2018-08-23].http://www.moa.gov.cn/govpublic/SYJ/201008/t20100823_1622639.htm.
![]() P.Encyclopedia of Toxicology(volumn 3)[EB/OL].http://dx.doi.org/10.1016/B978-0-12-386454-3.00533-9,2014-09-01.
P.Encyclopedia of Toxicology(volumn 3)[EB/OL].http://dx.doi.org/10.1016/B978-0-12-386454-3.00533-9,2014-09-01.
[7] Evgenidou E,Fytianos K.Photodegradation of triazine herbicides in aqueous solutions and natural waters[J].Journal of Agricultural and Food Chemistry,2002,50(22):6423-6427.
[8] Jiang Chen,Li Xuejing,Wang Yaru,et al.Assessment of photodegradation of herbicide prometryn in soil[J].Water,Air,& Soil Pollution,2017,228(4):135.
[9] Khan S U,Hamilton H A.Extractable and bound (nonextractable) residues of prometryn and its metabolites in an organic soil[J].Journal of Agricultural and Food Chemistry,1980,28(1):126-132.
[10] Kiss A,Rapi S,Csutorás C.GC/MS studies on revealing products and reaction mechanism of photodegradation of pesticides[J].Microchemical Journal,2007,85(1):13-20.
[11] Le Baron H L,Ma Farland J M,Burnside O B.The triazine herbicides 50 years revolutionizing agriculture[EB/OL].[2018-12-12].http://www.doc88.com/p-6981369759079.html.
[12] 高利娜.六元杂环类除草剂的高效检测及毒物代谢动力学研究[D].沈阳:中国医科大学,2015.
[13] Maynard M S,Brumback D,Itterly W,et al.Metabolism of [14C] prometryn in rats[J].Journal of Agricultural and Food Chemistry,1999,47(9):3858-3865.
[14] Brix R,Bahi N,de Alda M J L,et al.Identification of disinfection by-products of selected triazines in drinking water by LC-Q-ToF-MS/MS and evaluation of their toxicity[J].Journal of Mass Spectrometry,2009,44(3):330-337.
[15] Liu Junwei,Hua Rimao,Lv Pei,et al.Novel hydrolytic de-methylthiolation of the s-triazine herbicide prometryn by Leucobacter sp.JW-1[J].Science of The Total Environment,2017,579:115-123.
[16] Sikka H C,Davis D E.Absorption,translocation,and metabolism of prometryne in cotton and soybean[J].Weed Science,1968,16(4):474-477.
[17] U.S.EPA (Environmental Protection Agency).Reregistration Eligibility Decision(RED) Prometryn[R].Washington,D.C,US:EPA,1996.
[18] 辛世崇,薛连海,于海富,等.合成扑草净的工艺研究(I)[J].吉林化工学院学报,2006,23(1):1-3.
[19] Jin Zhenpeng,Luo Kai,Zhang Shuang,et al.Bioaccumulation and catabolism of prometryne in green algae[J].Chemosphere,2012,87(3):278-284.
[20] 田秀慧,宫向红,徐英江,等.除草剂扑草净在海参中的生物富集与消除效应研究[J].现代食品科技,2013,29(7):1580-1585.
[21] 刘丽娟,王玮云,张华威,等.菲律宾蛤仔对扑草净的生物富集与消除规律[J].食品科学,2016,37(21):252-256.
[22] 张望,范广宇,陈秀开.扑草净在文蛤体内的生物富集与消除规律研究[J].水产科学,2018,37(3):399-403.
[23] 郭巧云,牛淑敏,赵化冰,等.工业废水中阿特拉津降解细菌的遗传和生理多样性[J].微生物学通报,2014,41(5):839-848.
[24] 蔡富才,李艳楠,赵欢,等.多毛类动物对多环芳烃的毒性响应及代谢研究进展[J].大连海洋大学学报,2017,32(1):119-126.
[25] Bergmann A,Berger E,Coja T,et al.Impact of metabolic and degradation processes on the toxicological properties of residues of pesticides in food commodities[J].EFSA Supporting Publications,2010,7(5):1-189.
[26] Brvar M,Okrajšek R,Kosmina P,et al.Metabolic acidosis in prometryn (triazine herbicide) self-poisoning[J].Clinical Toxicology,2008,46(3):270-273.
[27] 高云,何芳.接触扑草净工人眼部影响的调查[J].眼外伤职业眼病杂志,2000,22(2):193-194.
[28] Velisek J,Stara A,Koutnik D,et al.Effect of prometryne on early life stages of marbled crayfish (Procambarus fallax f.virginalis)[J].Neuroendocrinology Letters,2014,35(S2):93-98.
[29] Velisek J,Stara A,Koutnik D,et al.Effects of prometryne on early life stages of common carp(Cyprinus carpio L.)[J].Pesticide Biochemistry and Physiology,2015,118:58-63.
![]() S,Remenar A,et al.Effects of prometryne on apoptosis and necrosis in thymus,lymph node and spleen in mice[J].Environmental Toxicology and Pharmacology,2009,27:182-186.
S,Remenar A,et al.Effects of prometryne on apoptosis and necrosis in thymus,lymph node and spleen in mice[J].Environmental Toxicology and Pharmacology,2009,27:182-186.
[31] Kniewald ![]() V,Gojmerac T,et al.Effect of s-triazine compounds on testosterone metabolism in the rat prostate[J].Journal of Applied Toxicology,1995,15(3):215-218.
V,Gojmerac T,et al.Effect of s-triazine compounds on testosterone metabolism in the rat prostate[J].Journal of Applied Toxicology,1995,15(3):215-218.
[32] Saka M,Tada N,Kamata Y.Chronic toxicity of 1,3,5-triazine herbicides in the postembryonic development of the western clawed frog Silurana tropicalis[J].Ecotoxicology and Environmental Safety,2018,147:373-381.
[33] 刘巧云.除草剂扑草净的细胞毒性作用及相关机制研究[D].杭州:浙江大学,2017.
[34] 温银元,郭平毅,尹美强,等.扑草净对远志幼苗根系活力及氧化胁迫的影响[J].生态学报,2012,32(8):2506-2514.
[35] Karaismailoglu M C.Investigation of the potential toxic effects of prometryne herbicide on Allium cepa root tip cells with mitotic activity,chromosome aberration,micronucleus frequency,nuclear DNA amount and comet assay[J].Caryologia,2015,68(4):323-329.
[36] Stará A,Kouba A,Velíšek J.Effect of chronic exposure to prometryne on oxidative stress and antioxidant response in red swamp crayfish (Procambarus clarkii)[J].Bio Med Research International,2014,2014:680131.
![]() Ž L,Anica R,et al.The effects of prometryne on subchronically treated mice evaluated by SCGE assay[J].Acta Biologica Hungarica,2009,60(1):35-43.
Ž L,Anica R,et al.The effects of prometryne on subchronically treated mice evaluated by SCGE assay[J].Acta Biologica Hungarica,2009,60(1):35-43.
[38] Papadakis E N,Vryzas Z,Kotopoulou A,et al.A pesticide monitoring survey in rivers and lakes of northern Greece and its human and ecotoxicological risk assessment[J].Ecotoxicology and Environmental Safety,2015,116:1-9.
[39] Tsaboula A,Papadakis E N,Vryzas Z,et al.Environmental and human risk hierarchy of pesticides:a prioritization method,based on monitoring,hazard assessment and environmental fate[J].Environment International,2016,91:78-93.
[40] McKinlay R,Plant J A,Bell J N B,et al.Endocrine disrupting pesticides:implications for risk assessment[J].Environment International,2008,34(2):168-183.
[41] Wu J,Liu D D W,Robinson R A,et al.Ametryn in rats,lactating goats,and laying hens[J].ACS Symposium Series,1992,503:168-189.