南极磷虾通常是指南极大磷虾Euphausia superba Dana 1850(以下简称磷虾),为磷虾目下86种海洋物种中体型最大的物种之一[1],隶属于节肢动物门Arthropoda、软甲纲Malacostraca、磷虾科Euphausiidae、磷虾属Euphausia[2],广泛分布于南大洋,为南极食物网中的关键物种[3],其一方面摄食硅藻、小型浮游动物等,另一方面也是顶级捕食者如鲸鱼、海豹和企鹅等的主要摄食对象。此外,磷虾是重要的商业性捕捞对象,支撑着南大洋的主要渔业[4-5]。2017年,世界磷虾总产量达23.7万t,其中中国磷虾产量为3.8万t[6]。
考虑到磷虾的商业价值和生态作用日益提升,目前对该物种的关注度也不断增加,尤其是其营养动力学及其摄食生态学[1,7]。磷虾的食性研究最早可追溯至70年前,但研究结果各不相同[8]。磷虾的摄食存在着较为显著的季节性及区域性差异[3]。用各种技术手段所分析的结果也存在较大差异,如利用胃含物分析手段可在显微镜下观察食物颗粒,是最直接的方法,但磷虾个体间消化率的不同导致观察结果仅能代表近期摄入的食物[8];同位素分析法可以了解磷虾的食物来源多样性及营养等级等特征,但并不能准确地将食物来源区分[9]。相比较而言,脂肪酸营养标志物分析有助于解释营养相互作用,大量研究已证实,脂肪酸组成是一个具有潜在价值的摄食指标,尤其当脂类保留其摄食来源的特征时[10]。这些特定的摄食对象体现了当前的摄食环境与生物体征和行为间的联系。多种常见特征脂肪酸已被认可用于食物网研究[11-19],鉴于此,本研究中采用气相色谱法对磷虾脂肪酸组成和含量进行研究,进而分析其摄食对象的类群,旨在了解夏秋季南极磷虾的脂肪酸组成特征及其食性。
1 材料与方法
1.1 调查时间与海域
本研究样本由登临磷虾大型拖网船“龙腾”号的科学观察员收集。采样时间为2016年1—4月,调查海域为南极半岛周边水域(图1)。当磷虾拖网抵达渔船甲板时,科学观察员依照南极海洋生物资源养护委员会(CCAMLR)的《科学观察员手册》[20],从各个站点随机选取样本200尾。测定其体长、体质量并鉴定性别后,再从中随机选取20尾放入塑料试管中,置于-20 ℃下冷冻保存,以便回国后进行后续分析。样品运送回国后,立即转移至超低温冰箱(-80 ℃)中保存。与直接将样品置于-80 ℃速冻法相比,此方法对磷虾脂肪酸最终测定结果影响不大,Schmidt等[3]的研究中,也采用了此方法,即在渔船上将磷虾置于-20 ℃下保存并在3周后转移至南乔治亚岛上的-80 ℃冷冻条件下保存,以此开展磷虾食性分析。在陆基实验室内,由构建的样品库中随机选取28个采样站位,其中4个站位各随机选取2只磷虾样本,其他24个站位各选取1只磷虾样本,共计32个样本用于脂肪酸测定。
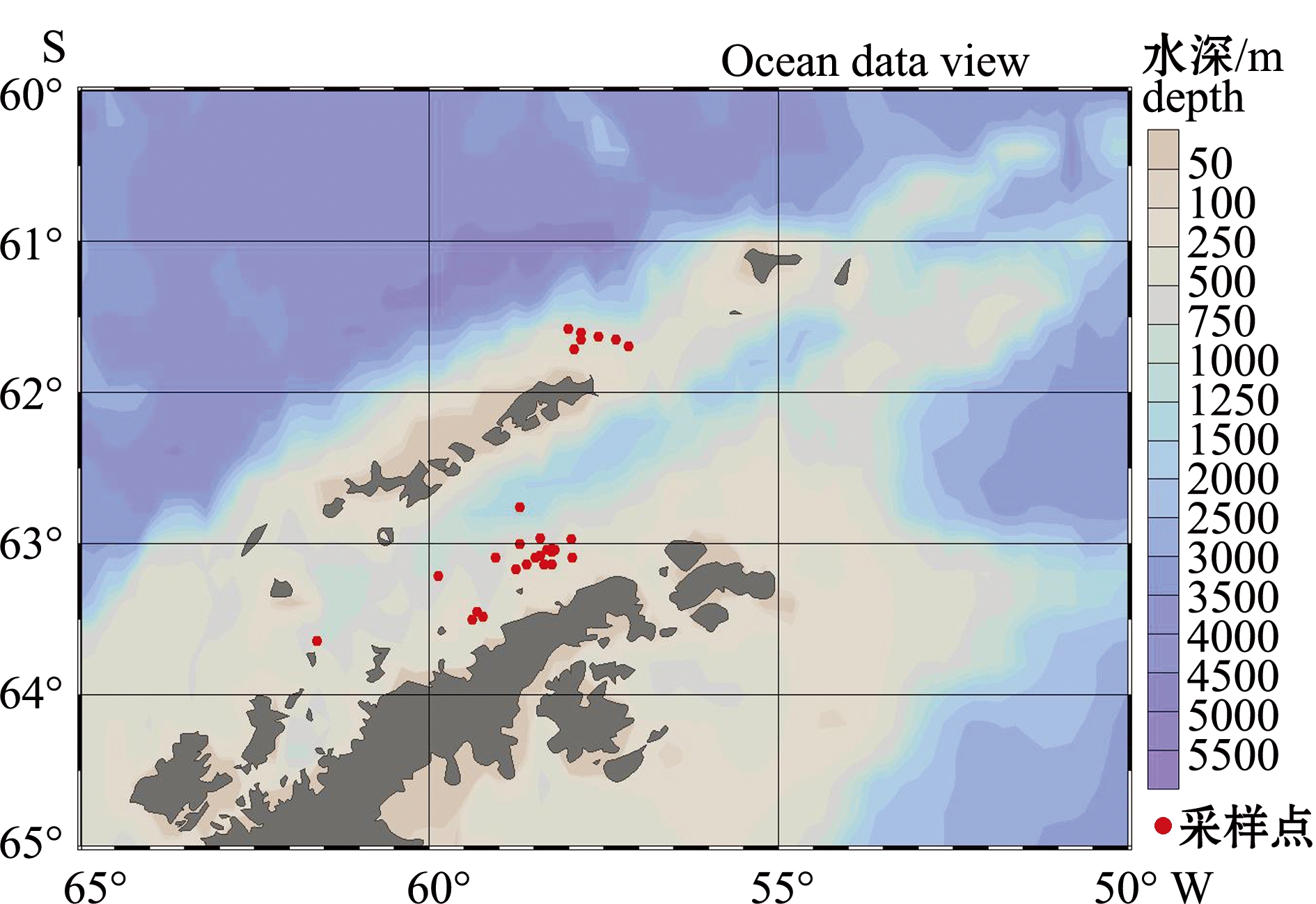
图1 调查海域及采样站位
Fig.1 Surveyed area showing sampling locations
1.2 方法
1.2.1 生物学测量 样本在实验室解冻后分别测定其标准体长、体质量,并鉴定其性别和性成熟度[21]。体长测量使用精度为0.01 mm的电子游标卡尺,体质量测定使用精度为0.001 g的电子天平。基础生物学数据测量结束后,将磷虾去头、去壳,保留肌肉组织,用于脂肪酸的测定。
1.2.2 粗脂肪提取 据已有研究表明,动物的食物组成可由其特征脂肪酸指示(表1)。因此,为了解磷虾摄食来源及食性,本研究中测定了磷虾个体的脂肪酸种类及含量。将单个磷虾肌肉组织清洗后冷冻干燥,用混合型球磨仪(MM400)研磨成粉并保存于干燥箱中。用电子天平称量磷虾粉的质量后置于离心管中,加入10 mL三氯甲烷-甲醇溶液(体积比2∶1)浸泡20 h以上。过滤到新离心管中,再用5 mL三氯甲烷-甲醇溶液润洗滤纸壁,在过滤完的离心管中加入4 mL 0.9%的氯化钠溶液,静置 2 h。取下清液移入圆底烧瓶中,蒸发得到粗脂肪。
表1 常见特征脂肪酸及其来源
Tab.1 Specific fatty acids and their corresponding sources

特征脂肪酸 specific fatty acid来源/指征 source/indicator文献来源 referenceC20∶5n3硅藻Parrish等[13]C16∶1n7硅藻Viso等[14]C16∶4n1硅藻Viso等[14]C16∶1/C16∶0>1.6硅藻Parrish等[13]ΣC16/ΣC18>2硅藻Parrish等[13]C20∶5n3/C22∶6n3>1硅藻Parrish等[13]C22∶6n3鞭毛藻Pond等[15]C18∶4n3鞭毛藻Pond等[15]C20∶5n3/C22∶6n3<1鞭毛藻Parrish等[13]ΣC15+ΣC17浮游细菌Rajendran等[16]C18∶1n7浮游细菌Rajendran等[16]C20∶1+C22∶1浮游动物Kattner等[17]C18∶1n9;C22∶6n3浮游动物Kattner等[17]C20∶4n6底栖生物Stowasser等[18]C18∶1n7底栖生物Stowasser等[18]PUFA/SFA较高营养级较高Rossi等[19]C22∶6n3/C20∶5n3较高营养级较高Rossi等[19]
注:表中ΣC16表示所有C16型脂肪酸含量之和,其他类同
Note: ΣC16 in the table shows the sum for the content of all of C16-type fatty acids, et sequentia
1.2.3 脂肪酸甲酯化 在圆底烧瓶中加入4 mL浓度为0.5 mol/L的氢氧化钾-甲醇溶液,连接水浴回流装置,水浴加热8 min后加入4 mL三氟化硼溶液,继续加热25 min后加入4 mL正己烷回流萃取2 min,冷却后加入10 mL氯化钠饱和溶液混匀,移入试管中静置30 min。吸取约1 mL上层溶液于样品瓶中,用于TRACE GC Ultra气相色谱-质谱联用仪(GC-MS;Thermo Fisher,安捷伦公司)分析。
1.2.4 脂肪酸的测定与计算 以37种脂肪酸混标及内标19烷酸甲酯标品作为标准,通过比对保留时间对脂肪酸进行定性分析,采用内标法对脂肪酸进行定量分析[20]。使用以下内标法公式计算脂肪酸的质量分数:
Xi=Fi×Ai×m19/(A19×m)。
其中: Xi为待测样品中组分i的含量(mg/g);Ai为组分i的峰面积;m是样品的质量(g);m19为内标物十九烷酸甲酯的质量(mg);A19为待测样品中加入内标物的峰面积;Fi为组i与内标物的校正因子之比,称为相对校正因子。
单位湿质量磷虾中每种脂肪酸含量计算公式:
xi=最终浓度×0.004/m。
其中:xi为待测样品中脂肪酸i的含量(mg/g);m为样品的体质量(g);最终浓度为每升样品溶液中溶解的脂肪酸i的质量(mg/L)。
1.3 数据处理
脂肪酸质量浓度以平均值±标准差(mean±S.D.)表示。利用Excel 2017软件进行统计分析,磷虾样本的体长与体质量关系用幂指数函数表示,用回归分析检验磷虾体长与体质量关系是否显著。用双样本t检验分析不同脂肪酸类型间及其与体长间是否存在显著性差异。显著性水平设为0.05。
2 结果与分析
2.1 磷虾的基础生物学分析
32尾磷虾样本的体长范围为36.06~55.83 mm,平均体长为(44.78±5.75) mm,体质量范围为0.262~1.190 g,平均体质量为(0.593±0.271) g。体长(L)与体质量(W)关系(图2)为
W=1.5237×10-6×L3.3654,
R2=0.8663,n =32,P<0.01。
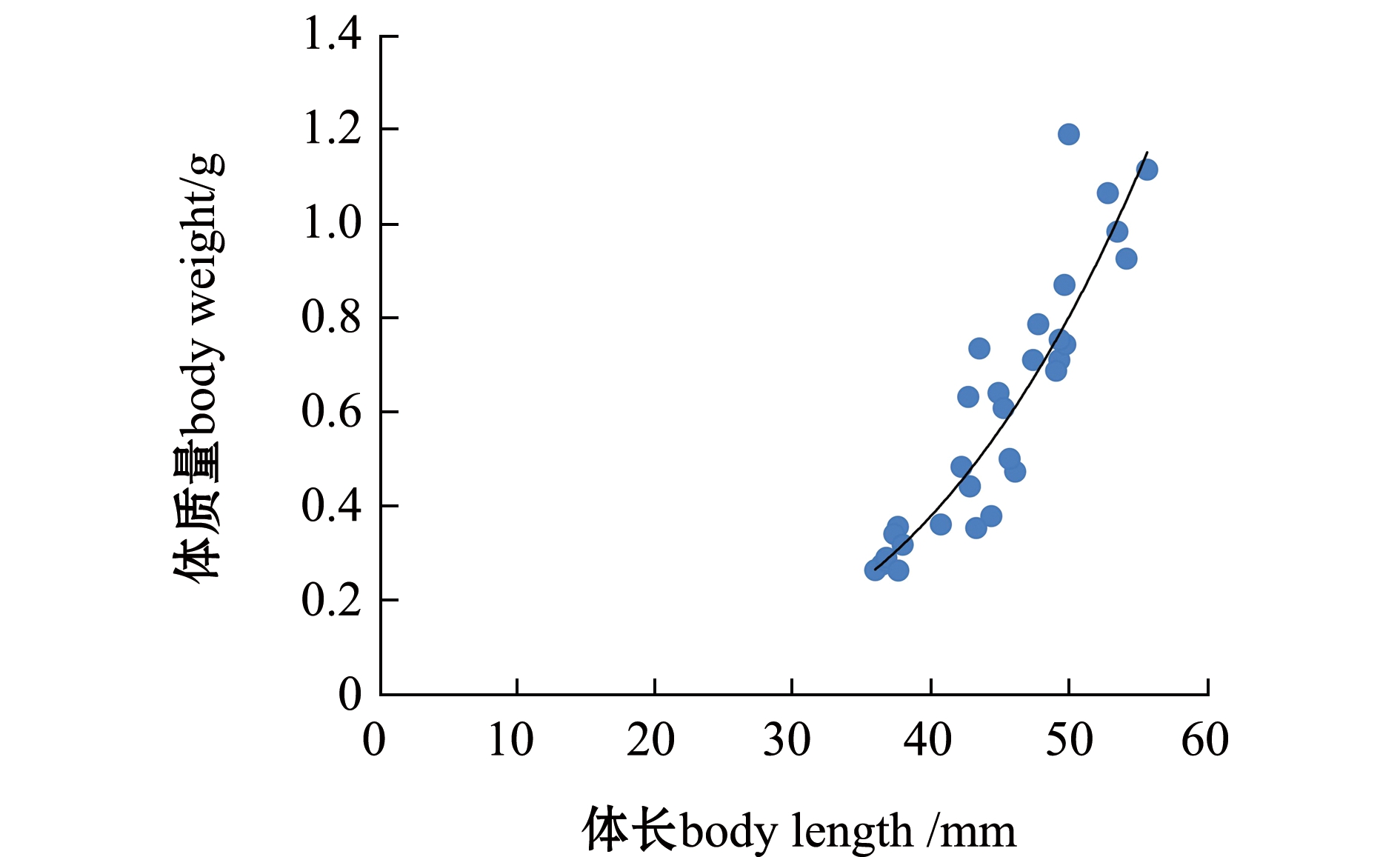
图2 磷虾体长-体质量关系
Fig.2 Relationship between body length and wet body weight in Antarctic krill
2.2 磷虾脂肪酸组成
从表2可见:从磷虾体内共检测出35种脂肪酸,其中含量较高的脂肪酸包括C16∶0、C20∶5n3(EPA)和C22∶6n3(DHA),其含量分别为(1.67±1.49)、(0.91±0.98)、(0.62±0.64) mg/g;饱和脂肪酸(SFA)共有15种,其总含量为(3.58±2.44) mg/g,主要为C16∶0、C14∶0、C18∶0;单不饱和脂肪酸(MUFA)包括9种,总含量为(1.51±1.03) mg/g,主要为C18∶1n9c、C16∶1n7;多不饱和脂肪酸(PUFA)包括11种,总含量为(2.89±1.97) mg/g,主要为C20∶5n3、C22∶6n3。磷虾肌肉组织中含量最高为饱和脂肪酸,其次为多不饱和脂肪酸,单不饱和脂肪酸含量最少。双样本t检验结果显示:SFA与MUFA,t=6.64,P<0.001;PUFA与MUFA,t=5.68,P<0.001,即饱和脂肪酸和多不饱和脂肪酸含量均极显著高于单不饱和脂肪酸(P<0.001)。
从百分含量来看,磷虾肌肉组织中饱和脂肪酸总量占总脂肪酸含量的44.64%,占比较高的主要为C16∶0(20.82%)、C14∶0(6.36%)、C18∶0(6.36%);单不饱和脂肪酸总量占总脂肪酸含量的18.83%,占比较高的主要为C18∶1n9c(6.86%)、C16∶1n7(3.99%);多不饱和脂肪酸总量占脂肪酸含量的36.04%,占比较高的主要为C20∶5n3(11.35%)、C22∶6n3(7.73%)、C22∶2n6(4.49%)。饱和脂肪酸与不饱和脂肪酸含量之比(ΣSFA/ΣUFA)为0.81。虽然总体上EPA质量分数小于DHA,但每尾磷虾的EPA/DHA值并非均小于1。
2.3 磷虾脂肪酸特征分析
从表2可以看出,35种脂肪酸中,有27种脂肪酸含量与体长间存在着显著的线性关系(y=ax+b),其中,饱和脂肪酸种类最多,有13种,单不饱和脂肪酸和多不饱和脂肪酸均有7种。显著相关的磷虾肌肉组织脂肪酸含量与体长的线性拟合表明,这些脂肪酸的含量与体长均呈负相关,即随着体长的增加脂肪酸含量下降。在所有磷虾脂肪酸中,显著性最高的为C21∶0(R2=0.605,P<0.001,n=32),C20∶0、C20∶3n6、C22∶1n9拟合程度也较好。鉴定出可用于指示磷虾食性的特征脂肪酸共8种,分别为C16∶1n7、C18∶1n9、C20∶1、C20∶4n6、C20∶5n3、C22∶6n3、ΣC16+ΣC18、ΣC15+ΣC17。其中,仅C20∶0、C20∶4n6、ΣC15+ΣC17与体长具有显著相关性。
由脂肪酸构成来看,磷虾的多不饱和脂肪酸主要为Σω3和Σω6,分别占总脂肪酸含量的21.58%和13.46%,两者呈显著的正相关关系(R2=0.977 6,P<0.001),Σω6和Σω3质量分数的比值为0.62。ΣC16和ΣC18的含量分别占总脂肪酸的21.84%和21.58%,所有磷虾个体的∑C16/∑C18值范围为0.32~4.02,但绝大多数个体的∑C16/∑C18比值小于2。75%的个体EPA/DHA比值大于1。
3 讨论
3.1 磷虾脂肪酸组成比较
已有研究表明,磷虾总脂含量会随着性别与性成熟度的不同而变化,幼体比成体含有更多的脂质[21]。由此可以推断,磷虾的总脂肪酸含量可能也与个体性别和性成熟度(或体长)有关。在不同季节磷虾的脂肪酸含量也会有所不同,在某些特定区域,空间差异对脂肪酸含量的影响甚至会超过性别和性成熟度的影响[8]。
表2 磷虾脂肪酸组成及其与体长之间的线性关系
Tab.2 Fatty acid composition, and linear relationship between fatty acid content and standard body length in Antarctic krill
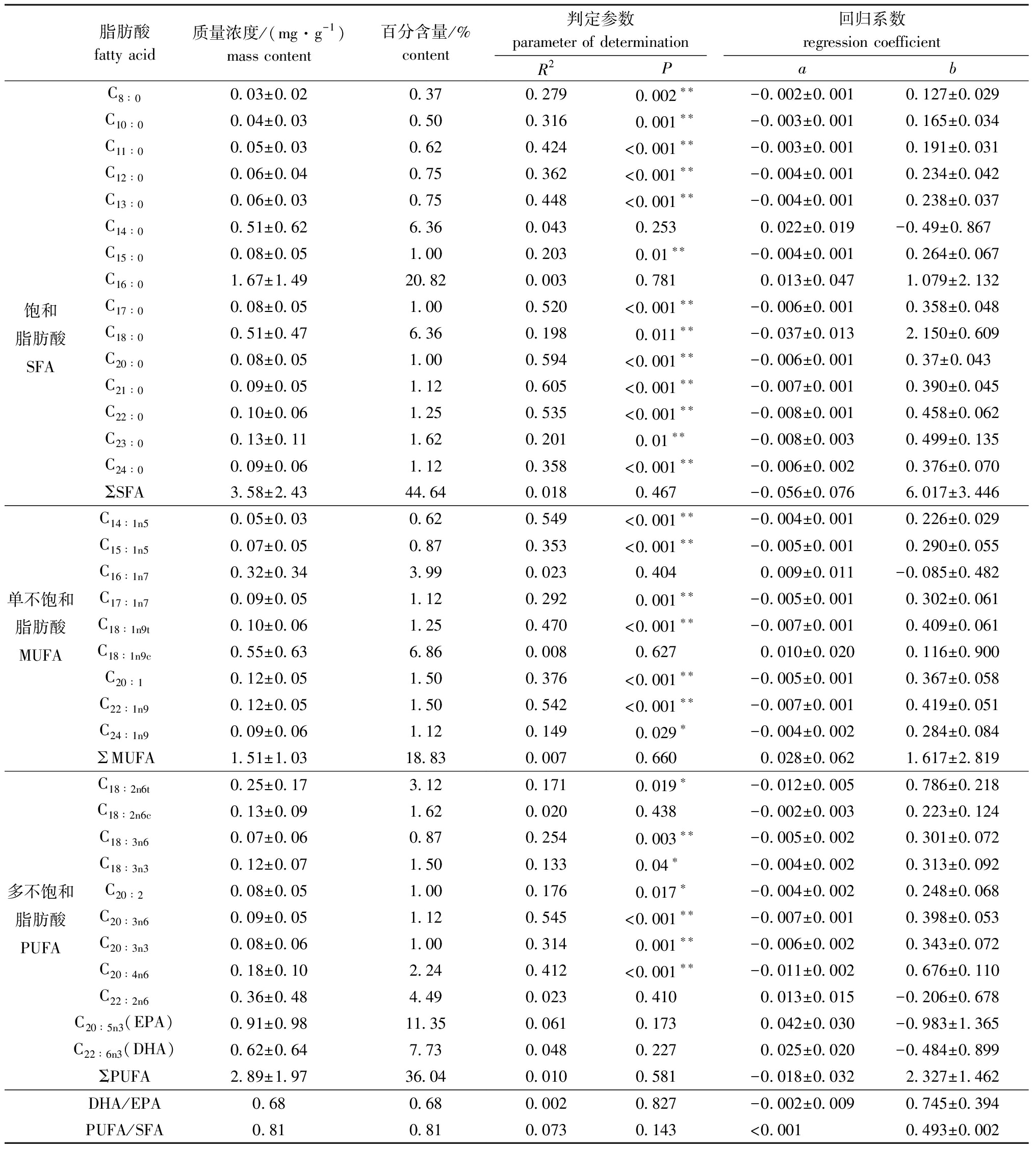
脂肪酸fatty acid质量浓度/(mg·g-1)mass content百分含量/%content判定参数parameter of determination回归系数regression coefficientR2PabC8∶00.03±0.02 0.37 0.279 0.002∗∗-0.002±0.0010.127±0.029C10∶00.04±0.030.50 0.316 0.001∗∗-0.003±0.0010.165±0.034饱和脂肪酸SFAC11∶00.05±0.030.62 0.424 <0.001∗∗-0.003±0.0010.191±0.031C12∶00.06±0.040.750.362 <0.001∗∗-0.004±0.0010.234±0.042C13∶00.06±0.030.750.448<0.001∗∗-0.004±0.0010.238±0.037C14∶00.51±0.626.36 0.043 0.253 0.022±0.019-0.49±0.867C15∶00.08±0.051.00 0.203 0.01∗∗-0.004±0.0010.264±0.067C16∶01.67±1.4920.820.003 0.781 0.013±0.0471.079±2.132C17∶00.08±0.051.00 0.520<0.001∗∗-0.006±0.0010.358±0.048C18∶00.51±0.476.36 0.198 0.011∗∗-0.037±0.0132.150±0.609C20∶00.08±0.051.00 0.594 <0.001∗∗-0.006±0.0010.37±0.043C21∶00.09±0.051.12 0.605 <0.001∗∗-0.007±0.0010.390±0.045C22∶00.10±0.061.250.535 <0.001∗∗-0.008±0.0010.458±0.062C23∶00.13±0.111.620.201 0.01∗∗-0.008±0.0030.499±0.135C24∶00.09±0.061.120.358 <0.001∗∗-0.006±0.0020.376±0.070ΣSFA3.58±2.4344.640.018 0.467 -0.056±0.0766.017±3.446C14∶1n50.05±0.03 0.62 0.549 <0.001∗∗-0.004±0.0010.226±0.029C15∶1n50.07±0.05 0.87 0.353 <0.001∗∗-0.005±0.0010.290±0.055C16∶1n70.32±0.34 3.99 0.023 0.404 0.009±0.011-0.085±0.482单不饱和脂肪酸MUFAC17∶1n70.09±0.05 1.12 0.292 0.001∗∗-0.005±0.0010.302±0.061C18∶1n9t0.10±0.06 1.25 0.470 <0.001∗∗-0.007±0.0010.409±0.061C18∶1n9c0.55±0.63 6.86 0.008 0.627 0.010±0.0200.116±0.900C20∶10.12±0.05 1.50 0.376 <0.001∗∗-0.005±0.0010.367±0.058C22∶1n90.12±0.05 1.50 0.542 <0.001∗∗-0.007±0.0010.419±0.051C24∶1n90.09±0.06 1.12 0.149 0.029∗-0.004±0.0020.284±0.084MUFA1.51±1.0318.830.0070.660 0.028±0.0621.617±2.819多不饱和脂肪酸PUFAC18∶2n6t0.25±0.17 3.12 0.171 0.019∗-0.012±0.0050.786±0.218C18∶2n6c0.13±0.09 1.62 0.020 0.438 -0.002±0.0030.223±0.124C18∶3n60.07±0.06 0.87 0.254 0.003∗∗-0.005±0.0020.301±0.072C18∶3n30.12±0.07 1.50 0.133 0.04∗-0.004±0.0020.313±0.092C20∶20.08±0.05 1.00 0.176 0.017∗-0.004±0.0020.248±0.068C20∶3n60.09±0.05 1.12 0.545 <0.001∗∗-0.007±0.0010.398±0.053C20∶3n30.08±0.06 1.00 0.314 0.001∗∗-0.006±0.0020.343±0.072C20∶4n60.18±0.10 2.24 0.412 <0.001∗∗-0.011±0.0020.676±0.110C22∶2n60.36±0.48 4.49 0.023 0.410 0.013±0.015-0.206±0.678C20∶5n3(EPA)0.91±0.98 11.35 0.061 0.173 0.042±0.030-0.983±1.365C22∶6n3(DHA)0.62±0.64 7.730.048 0.227 0.025±0.020-0.484±0.899ΣPUFA2.89±1.97 36.040.010 0.581 -0.018±0.0322.327±1.462DHA/EPA0.680.680.002 0.827 -0.002±0.0090.745±0.394PUFA/SFA0.810.810.073 0.143 <0.0010.493±0.002
注: *表示显著相关(P<0.05), **表示极显著相关(P<0.01);R2为回归方程拟合优度的度量;利用F检验法判定磷虾脂肪酸含量与体长间是否存在显著线性关系(y=ax+b),其中a、b为回归方程系数
Note: * means significant correlations(P<0.05); **means very significant correlations(P<0.01);R2 means coefficient of determination;F test is used to determine whether there is a significant linear relationship (y=ax+b) between fatty acid content and body length in Antarctic krill,where both a and b are the coefficients of regression equation
不同区域及研究者对磷虾脂肪酸的研究比较如表3所示。Cripps等[10]对南乔治亚岛夏季(1月)磷虾脂肪酸组成进行了研究,鉴定出磷虾含20种脂肪酸,本研究中测定的脂肪酸含量与其略有不同。相同之处是两个研究鉴定出的脂肪酸中相同种类有C14∶0、C15∶0、C16∶0、C16∶1n7、C18∶0、C18∶1n9、C18∶2n6、C18∶3n3、C20∶4n6、C20∶5n3和C22∶6n3等11种,且两研究中的C16∶0、C20∶5n3、C22∶6n3和C14∶0等4种脂肪酸含量均较高。不同之处是,本研究中C15∶0、C18∶0、C18∶2n6、C18∶3n3和C20∶4n6含量较Cripps等[10]测得的数据偏高,而C16∶1n7的含量偏低。但配对t检验结果显示,两研究中共有的脂肪酸种类的含量不存在显著性差异(t=0.932,P=0.373>0.05,n=11)。Cripps等[10]的研究中,C20∶5n3和C22∶6n3之和占总脂肪酸含量的30.27%,PUFA/SFA值为1.1。而本研究中,C20∶5n3和C22∶6n3之和占总脂肪酸含量的19.08%,PUFA/SFA值为0.81,两研究中DHA/EPA比值较为接近。此外,两研究中所鉴定出的脂肪酸种类存在一定差异,这可能与使用样品的体长范围、性别组成、性成熟度和采样时间差异有关,而地理位置、空间分布、栖息环境等也会对磷虾脂肪酸组成产生影响[22]。
楼乔明等[2]利用GC-MS对磷虾的脂肪酸组成进行了分析,共鉴定出27种脂肪酸,主要为C16∶0、C16∶1n9、C18∶1n9、C18∶1n7、C20∶5n3和C22∶6n3。其中,饱和脂肪酸占27.83%,与口虾蛄Oratosquilla oratoria(25.3%~28.5%)[23]相近,但略低于凡纳滨对虾Litopenaeus vannamei(31.03%~31.89%)[24]和中国对虾Fenneropenaeus chinensis(33.69%)[25],主要为C16∶0(20.51%)和C14∶0(5.03%),但C18∶0(0.88%)含量较低。本研究中,饱和脂肪酸中占比较高的C16∶0(20.82%)和C14∶0(6.36%)与楼乔明等[2]的结果较为接近,但C18∶0(6.36%)含量明显较楼乔明等[2]的结果更高。孙甜甜等[26]采用氯仿甲醇法对磷虾脂质进行了提取,鉴定出脂质中有45.52%的饱和脂肪酸,其中,C16∶0含量最高。这与本研究的结果更为接近,本研究饱和脂肪酸总量为44.64%,占比最高的为C16∶0。此外,楼乔明等[2]的研究中,磷虾肌肉总脂中EPA和DHA总量高达40.64%,本研究与之相比较低,为19.08%,但仍为多不饱和脂肪酸中含量最多的两个种类,其总和占ΣPUFA 的52.94%。DHA和EPA能够在一定程度上预防和治疗糖尿病等疾病,对人体健康非常重要[27],由于其是人体自身不能合成的脂肪酸,因而受到越来越多的关注。磷虾含有较高的EPA和DHA,表明其在脂质方面具有较高的营养价值,可认为是人类膳食和动物饲料中多不饱和脂肪酸的重要来源。
表3 磷虾脂肪酸组成比较
Tab.3 Comparison of fatty acid compositions of Antarctic krill in different studies
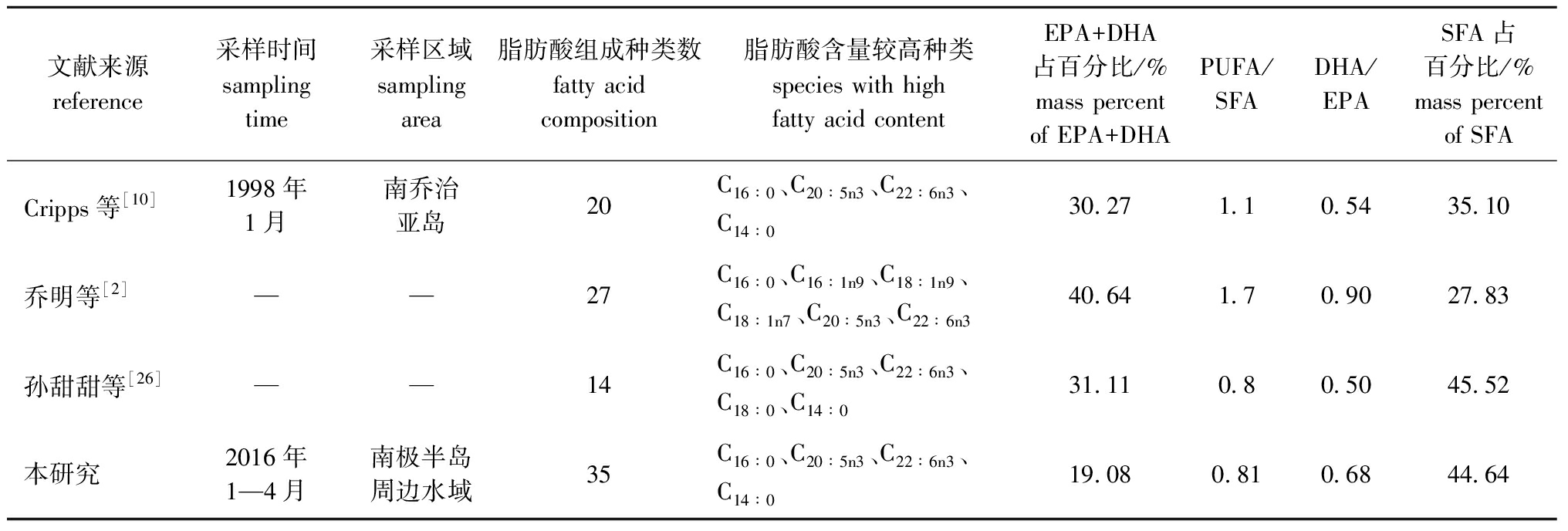
文献来源reference采样时间samplingtime采样区域samplingarea脂肪酸组成种类数fatty acid composition脂肪酸含量较高种类species with highfatty acid contentEPA+DHA 占百分比/%mass percent of EPA+DHAPUFA/SFADHA/EPASFA占百分比/%mass percent of SFACripps等[10]1998年1月南乔治亚岛20C16∶0、C20∶5n3、C22∶6n3、C14∶030.271.10.5435.10乔明等[2]——27C16∶0、C16∶1n9、C18∶1n9、C18∶1n7、C20∶5n3、C22∶6n340.641.70.9027.83孙甜甜等[26]——14C16∶0、C20∶5n3、C22∶6n3、C18∶0、C14∶031.110.80.5045.52本研究2016年1—4月南极半岛周边水域35C16∶0、C20∶5n3、C22∶6n3、C14∶019.080.810.6844.64
3.2 特征脂肪酸及其食性指示
磷虾的摄食行为较为复杂,它不仅滤食浮游植物和原生动物,还捕食其他浮游动物,并从海冰下刮食冰藻和潜入海床摄食碎屑等[28-30]。磷虾的主要摄食对象为硅藻,但有时也会表现出一定的杂食性。Hopkins[31]最先描述了磷虾胃含物中的原生动物和后生动物外观,由此说明了磷虾的杂食性;该研究显示,磷虾会定期摄食沙壳纤毛虫、甲鞭毛虫、放射虫、硅鞭毛虫、无脊椎动物卵、腔肠动物、桡足类和磷虾碎屑[32]。Schmidt等[3]对南乔治亚岛、拉扎列夫海和斯科舍海的磷虾食性进行了研究,发现硅藻和鞭毛虫是磷虾的主要摄食对象,胃含物分析结果表明,其平均占磷虾胃含物的71%±29%,原生动物和后生动物约占胃含物的四分之一,自养成分的占比较少。该研究进一步显示,拉扎列夫海的磷虾摄食桡足类或硅藻、刺硅藻的混合物,以及有孔虫、异养鞭毛虫、刺胞动物和无节幼体等异养生物;南乔治亚岛的磷虾会摄食桡足类和海床上的底栖生物,此外也包括硅藻、沙壳纤毛虫和异养鞭毛虫,南乔治亚岛的磷虾在夏季比冬季摄食更多的异养生物;拉扎列夫海的磷虾在夏季比冬季摄食更多的藻类,斯科舍海的磷虾则通常在春季和夏季更多地体现为植食性。Stübing等[32]的混合摄食试验表明,磷虾摄食一定程度的浮游动物有助于其生长,这也是磷虾杂食性的一个佐证。此外,实地观察也表明,磷虾白天摄食浮游植物,并于夜间转向摄食大型桡足类,体现出肉食性[33]。总的来讲,磷虾的摄食对象涵盖以下几类。
(1)硅藻。根据Cripps等[34]的研究,当硅藻生物量丰富时,磷虾摄食硅藻,而当藻类生物量较低且小型细胞占优势时,磷虾摄食浮游动物或忍受饥饿。脂肪酸组成已被证明能反映多种浮游动物的摄食情况[34],这是由于浮游动物自身几乎不能合成脂类,其体内的脂类物质绝大部分来源于摄食。根据Parrish等[13]的研究,硅藻通常含有较高含量的C20∶5n3;此外,C16∶1n7和C16∶4n1为硅藻独有的特征脂肪酸[14];而当C16∶1/C16∶0>1.6、ΣC16/ΣC18>2、C20∶5n3/C22∶6n3>1时,也可指示其食物来源为硅藻(表1)。本研究中,磷虾体内C20∶5n3的百分含量为11.35%,是多不饱和脂肪酸中含量最高的种类;75%个体的C20∶5n3/C22∶6n3比值大于1,且含有特征脂肪酸C16∶1n7,说明磷虾主要摄食硅藻。
(2)鞭毛藻。鞭毛藻类含有较高的C22∶6n3和C18∶4n3[15],当C20∶5n3/C22∶6n3<1时,也可指示其食物来源为鞭毛藻[13]。本研究中,C22∶6n3含量较高(7.73%),且C20∶5n3/C22∶6n3比值并非均大于1,有25%的个体C20∶5n3/C22∶6n3比值小于1,说明磷虾对鞭毛藻有一定的摄食。
(3)浮游细菌。ΣC15+ΣC17是指示自然界中浮游细菌的特征脂肪酸,C18∶1n7也可作为浮游细菌的指示标志[16]。虽然本研究中未鉴定出C18∶1n7,但ΣC15+ΣC17占脂肪酸总质量分数的3.99%,尽管含量较小,但说明磷虾对浮游细菌也有少量的摄食。一方面,这可能是本研究处于夏末秋初,此时浮游植物已过了春季暴发期,丰度降低,秋季日照减少,温度降低,食物短缺,磷虾会扩大摄食对象范围,转而摄食浮游细菌、海底碎屑等,表现出杂食性;另一方面,磷虾集群生活,以悬浮物为食,其摄食必然会包括各种植物和动物组织[33]。
(4)桡足类。C20∶1+C22∶1可作为植食性桡足类的特征脂肪酸,C18∶1n9和C22∶6n3也可用作为浮游动物的标志[17],C18∶1n9和C22∶6n3含量越高说明其肉食性越强。本研究中,C20∶1+C22∶1的质量分数为1.50%,C22∶6n3和C18∶1n9含量均较高,质量分数分别为7.73%和8.11%,表明磷虾摄食一定的桡足类,具有肉食性。在Cripps等[10]的研究中,采样区域为南乔治亚岛,其浮游植物和桡足类丰度高于南大洋许多区域,即使在夏季浮游植物丰度较高的环境下,磷虾也会摄食一部分鞭毛虫和桡足类,考虑到肉食性越强,C22∶6n3含量越高。因此,这也部分说明了Cripps等[10]的研究中C22∶6n3和PUFA占总脂肪酸含量为何高于本研究。
(5)底栖生物。C20∶4n6和C18∶1n7常作为底栖生物的指示标志[18],C20∶4n6还可以指示大型藻类和微型浮游动物,如纤毛虫等[35]。本研究中磷虾的C20∶4n6含量较少,说明对底栖生物有少量的摄食,较少摄食大型藻类。
PUFA/SFA和DHA/EPA比值可以用于评估食物组成的营养级大小[19],本研究中PUFA/SFA和DHA/EPA比值均较低,绝大多数个体样品的比值小于1,说明磷虾的营养级较低。 Σω6/Σω3比值可以用来估算腐生食物链对于高营养级捕食者的贡献比例是否高于捕食食物链[36],本研究中Σω6/Σω3的比值较低(0.62 ),说明腐生食物链对于高营养级捕食者的贡献远小于捕食食物链。
3.3 磷虾体长对脂肪酸及食性的影响
本研究中,磷虾肌肉中的多种脂肪酸含量与其体长存在着显著的负相关关系,如C15∶0、C18∶1n9t、C20∶1和C20∶4n6等。其中,C20∶1为指示植食性桡足类的特征脂肪酸,说明随着体长的增加,南极半岛夏秋季磷虾对桡足类的摄食呈下降趋势。Atkinson等[35]发现,夏季南乔治亚岛的幼体磷虾能迅速捕食快速运动的食物,尤其是小型桡足类,表明即使在浮游植物丰富的夏季,幼体磷虾也会摄食桡足类,尽管本研究中无磷虾幼体样本,但桡足类特征脂肪酸含量与体长的显著负相关关系,这与Atkinson等[35]的研究大致相同。而在Schmidt等[3]的研究中,冬季磷虾的桡足类特征脂肪酸含量与体长呈正相关关系,这可能与采样季节、采样区域的不同有关,但仔体后期磷虾的桡足类特征脂肪酸含量仍显著高于预期的磷虾仔体后期个体体长相关性。存在显著负相关的脂肪酸还有指示底栖生物的特征脂肪酸C20∶4n6,说明体长越大的磷虾越多地生活于海表层或在中上层摄食,较少摄食底栖生物。Clarke等[37]发现,南大洋深海存在摄食活跃的磷虾,其中许多为抱卵雌体,表明在夏季一些雌性磷虾会潜入海底摄食底栖生物,而大多数磷虾仍以海表丰富的硅藻和浮游动物为主要摄食来源。此外,本研究中,指示浮游细菌的特征脂肪酸ΣC15+ΣC17含量与体长也存在显著负相关。Oarkes[38]认为,幼体会摄食自然水体中的海冰微生物,从而在冬季满足最低的能量需求,O’Brien等[39]的研究也显示,带叉幼体期阶段磷虾含有更高比例的细菌源脂肪酸。本研究中指示硅藻的特征脂肪酸C20∶5n3、C16∶1n7和C20∶5n3/C22∶6n3含量均与体长呈正相关关系,但不显著。同样地,Schmidt等[3]的研究中,拉扎列夫海、斯科舍海和南乔治亚岛夏秋季磷虾的硅藻特征脂肪酸C16∶4n1含量与体长均不存在显著相关性,表明在以硅藻为主要摄食对象的夏季,不同体长磷虾个体对硅藻的摄食量并无较大差异。
Polito等[40]通过稳定同位素分析认为,尽管浮游植物仍然为磷虾重要的摄食对象,但在某些区域,随着个体发育成熟,磷虾会扩大其摄食生态位,以获取更高营养级的食物来源。成体磷虾更广泛地摄食生态位能帮助减缓近年来由于气候所导致的浮游植物群落的变化,这对主要依赖自养生物的仔体或稚体会产生负面影响。磷虾由幼体到成体阶段形成的摄食生态位的扩大会导致摄食对象和食性的变化,从而改变其脂肪酸含量,这也解释了脂肪酸含量与磷虾体长的相关性。
致谢:感谢中国水产总公司“龙腾”号各位船员,以及上海海洋大学观察员符小明、胡士国在试验过程中给予的帮助!本研究得到南极海洋生物资源开发利用项目、上海市应用型本科专业建设项目、上海市大学生创新项目及上海海洋大学优秀本科生进实验室项目的部分资助。
[1] Schmidt K,Atkinson A.Feeding and Food Processing in Antarctic krill (Euphausia superba Dana)[C]//Siegel V,ed.Biology and Ecology of Antarctic krill.Switzerland:Springer International Publishing,2016:175-224.
[2] 楼乔明,王玉明,刘小芳,等.南极磷虾脂肪酸组成及多不饱和脂肪酸质谱特征分析[J].中国水产科学,2011,18(4):929-935.
[3] Schmidt K,Atkinson A,Pond D W,et al.Feeding and overwintering of Antarctic krill across its major habitats:the role of sea ice cover,water depth,and phytoplankton abundance[J].Limnology & Oceanography,2014,59(1):17-36.
[4] 朱国平,冯春雷,吴强,等.南极磷虾调查CPUE指数变动的影响因素初步分析[J].海洋渔业,2010,32(4):368-373.
[5] 朱国平,朱小艳,孟涛,等.2012年秋冬季利文斯顿岛南极磷虾渔业CPUE指标变动及其影响因素[J].大连海洋大学学报,2013,28(4):399-405.
[6] CCAMLR.CCAMLR Statistical Bulletin,Vol.29[EB/OL].https://www.ccamlr.org/en/system/files/CCAMLR_2017_Statistical_Bulletin_Volume_29_Data_Files.zip.2017
[7] 朱国平,朱小艳.南极磷虾种群生物学研究进展Ⅲ—摄食[J].水生生物学报,2014,38(6):1152-1160.
[8] Schmidt K,Atkinson A,Petzke K J,et al.Protozoans as a food source for Antarctic krill,Euphausia superba:complementary insights from stomach content,fatty acids,and stable isotopes[J].Limnology and Oceanography,2006,51(5):2409-2427.
[9] Michener R M.Stable isotope ratios as tracers in marine aquatic food webs[J].Stable Isotopes in Ecology & Environmental Science,1994.
[10] Cripps G C,Atkinson A.Fatty acid composition as an indicator of carnivory in Antarctic krill[J].Canadian Journal of Fisheries & Aquatic Sciences,2000,57(1):31-37.
[11] CCAMLR.Scientific Observers Manual[EB/OL].https://www.ccamlr.org/en/system/files/obsman.pdf.2011.
[12] Makarov R R,Denys C J.Stages of sexual maturity of Euphausia superba Dana[M]//BIOMASS Handbook.Cambridge:Scientific Committee on Antarctic Research,1980:1-13.
[13] Parrish C C,Abrajano T A,Budge S M,et al.Lipid and Phenolic Biomarkers in Marine Ecosystems:Analysis and Applications[M].Berlin,Heidelberg:Springer,2000:193-223.
[14] Viso A C,Marty J C.Fatty acids from 28 marine microalgae[J].Phytochemistry,1993,34(6):1521-1533.
[15] Pond D W,Bell M V,Harris R P,et al.Microplanktonic polyunsaturated fatty acid markers:a mesocosm trial[J].Estuarine Coastal & Shelf Science,1998,46(2):61-67.
[16] Rajendran N,Suwa Y,Urushigawa Y.Distribution of phospholipid ester-linked fatty acid biomarkers for bacteria in the sediment of Ise Bay,Japan[J].Marine Chemistry,1993,42(1):39-56.
[17] Kattner G,Hagen W.Lipids in marine copepods:latitudinal characteristics and perspective to global warming[M]//Guschina I A,Harwood J L,Kainz M,et al.eds.Lipids in Aquatic Ecosystems.New York:Springer International Publishing,2009:257-280.
[18] Stowasser G,Pond D W,Collins M A.Using fatty acid analysis to elucidate the feeding habits of Southern Ocean mesopelagic fish[J].Marine Biology,2009,156(11):2289-2302.
[19] Rossi S,Youngbluth M,Jacoby C A,et al.Fatty acid trophic markers and trophic links among seston,crustacean zooplankton and the siphonophore Nanomia cara in Georges Basin and Oceanographer Canyon (NW Atlantic)[J].Scientia Marina,2008,72(2):403-416.
[20] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 22223-2008 食品中总脂肪、饱和脂肪(酸)、不饱和脂肪(酸)的测定 水解提取-气相色谱法[S].北京:中国标准出版社,2008.
[21] Mayzaud P,Albessard E,Cuzin-Roudy J.Changes in lipid composition of the Antarctic krill Euphausia superba in the Indian sector of the Antarctic Ocean:influence of geographical location,sexual maturity stage and distribution among organs[J].Marine Ecology Progress Series,1998,173(8):149-162.
[22] Stübing D,Hagen W.Fatty acid biomarker ratios-suitable trophic indicators in Antarctic euphausiids[J].Polar Biology,2003,26(12):774-782.
[23] 张强,荆剂荣,刘雪梅.虾蛄脂肪酸分析[J].分析化学,2002,30(12):1473-1476.
[24] 梁萌青,王士稳,韩庆炜,等.海水养殖和低盐养殖凡纳滨对虾脂肪酸分析比较[J].渔业科学进展,2009,30(1):87-91.
[25] 陈丽花,肖作兵,周培根.中国对虾的脂肪酸分析及其营养价值评价[J].上海海洋大学学报,2010,19(1):125-129.
[26] 孙甜甜,薛长湖,薛勇,等.南极磷虾脂质提取方法的比较[J].食品工业科技,2012,33(16):115-117.
[27] 曾晓雄,罗泽民.DHA和EPA的研究现状与趋势[J].天然产物研究与开发,1997,9(1):65-70.
[28] Clarke A.Lipid content and composition of Antarctic krill,Euphausia superba Dana[J].Journal of Crustacean Biology,1984,4(5):285-294.
[29] Price H J,Boyd K R,Boyd C M.Omnivorous feeding behavior of the Antarctic krill Euphausia superba[J].Marine Biology,1988,97(1):67-77.
[30] Stretch J,Hamner P,Hamner W,et al. Foraging behavior of Antarctic krill Euphausia superba on sea ice microalgae[J].Marine Ecology Progress Series,1988,44(2):131-139.
[31] Hopkins T L.Food web of an Antarctic midwater ecosystem[J].Marine Biology,1985,89(2):197-212.
[32] Stübing D,Hagen W,Schmidt K.On the use of lipid biomarkers in marine food web analyses:an experimental case study on the Antarctic krill,Euphausia superba[J].Limnology & Oceanography,2003,48(4):1685-1700.
[33] Hagen W,Yoshida T,Virtue P,et al. Effect of a carnivorous diet on the lipids,fatty acids and condition of Antarctic krill,Euphausia superba[J].Antarctic Science,2007,19(2):183-188.
[34] Cripps G,Watkins J,Hill H,et al.Fatty acid content of Antarctic krill Euphausia superba at South Georgia related to regional populations and variations in diet[J].Marine Ecology Progress Series,1999,181(3):177-188.
[35] Atkinson A,Meyer B,Stübing D,et al.Feeding and energy budgets of Antarctic krill Euphausia superba at the onset of winter-II.Juveniles and adults[J].Limnology and Oceanography,2002,47:953-966.
[36] Fukuda Y,Naganuma T.Potential dietary effects on the fatty acid composition of the common jellyfish Aurelia aurita[J].Marine Biology,2001,138(5):1029-1035.
[37] Clarke A,Tyler P A.Adult Antarctic krill feeding at abyssal depths[J].Current Biology,2008,18(4):282-285.
[38] Oakes S A.Winter ecology of young Antarctic krill,Euphausia superba:feeding on the sea ice microbial community with implications for growth models[D].Santa Barbara:University of California,2008.
[39] O’Brien C,Virtue P,Kawaguchi S,et al.Aspects of krill growth and condition during late winter-early spring off East Antarctica (110-130°E)[J].Deep-Sea Research Part II,2011,58(9):1211-1221.
[40] Polito M J,Reiss C S,Trivelpiece W Z,et al.Stable isotopes identify an ontogenetic niche expansion in Antarctic krill (Euphausia superba) from the South Shetland Islands,Antarctica[J].Marine Biology,2013,160(6):1311-1323.