虾夷扇贝Patinopecten yessoensis是中国重要的海水养殖贝类。据统计,2017年中国贝类海水养殖产量达到1420.75万t,其中扇贝产量为186.05万t[1]。虾夷扇贝因个体大、味道鲜美,故经济价值较高,目前市场上主要以活品形式进行流通。
近年来,国内对活品虾夷扇贝捕后品质的研究陆续被报道。最初的研究围绕底播养殖虾夷扇贝供应链可追溯现状开展,涵盖活品虾夷扇贝从育苗、养殖、采捕、加工到销售的全部过程[2]。随后,有关活品虾夷扇贝的感官品质及其评价方法、活品流通过程中的风味品质变化规律,以及捕后处置对其生化代谢的影响等研究陆续被报道[3-7]。此外,还有专门针对其挥发性气味特征[8-9]、供应链各环节肠道菌群变化方面的研究[10]。本研究团队前期研究发现,活品虾夷扇贝捕后品质变化并非线性下降趋势,在胁迫因素得到缓解后,品质会出现部分恢复[3]。目前,活品虾夷扇贝研究中,主要跟踪三磷酸腺苷(ATP)、磷酸精氨酸(ArP)等能量物质的变化,但不能充分揭示活品的品质变化规律。Ivanina等[11]研究了牡蛎Crassostrea virginica面对低氧和镉胁迫时糖代谢相关酶(己糖激酶、柠檬酸合酶、细胞色素c氧化酶、醛缩酶)的应答效应。Brokordt等[12]对扇贝Euvola zizac在逃避过程中能量物质(糖原、ATP、ArP),以及糖原磷酸化酶(GP)、丙酮酸激酶(PK)、磷酸果糖激酶(PFK)、章鱼碱脱氢酶(OpDHs)、精氨酸激酶(AK)、线粒体酶和柠檬酸合成酶(CS)的变化进行了探讨。国内也有李泽健[13]研究了中华绒螯蟹Eriocheir sinensis在低氧胁迫下能量物质(糖原、丙酮酸)及相关代谢酶(AK)的变化。此外,对无脊椎动物的无氧代谢途径也有相关研究[14]。综合研究结果,对海洋无脊椎动物糖代谢途径及关键酶进行总结(图1),无氧条件下糖酵解产物丙酮酸不能进入三羧酸循环,而是经OpDHs产生章鱼碱等物质。Baldwin等[15]研究表明,海洋无脊椎动物无氧糖酵解过程选择OpDHs,而不是乳酸脱氢酶(Lactate dehydrogenase,LDH),其中,ODH活性远高于LDH。
本研究中,以虾夷扇贝捕后对其品质影响最大的干露胁迫为模型,以主要供能物质糖原、能量物质ATP及ArP含量,以及代谢产物丙酮酸、章鱼碱的含量变化为品质指标,对海洋无脊椎动物能量代谢过程中常用几个重要的糖代谢酶(磷酸果糖激酶、Opines脱氢酶、柠檬酸合酶)和品质变化的关联性进行了初步探讨,旨在建立虾夷扇贝活品品质评价指标。
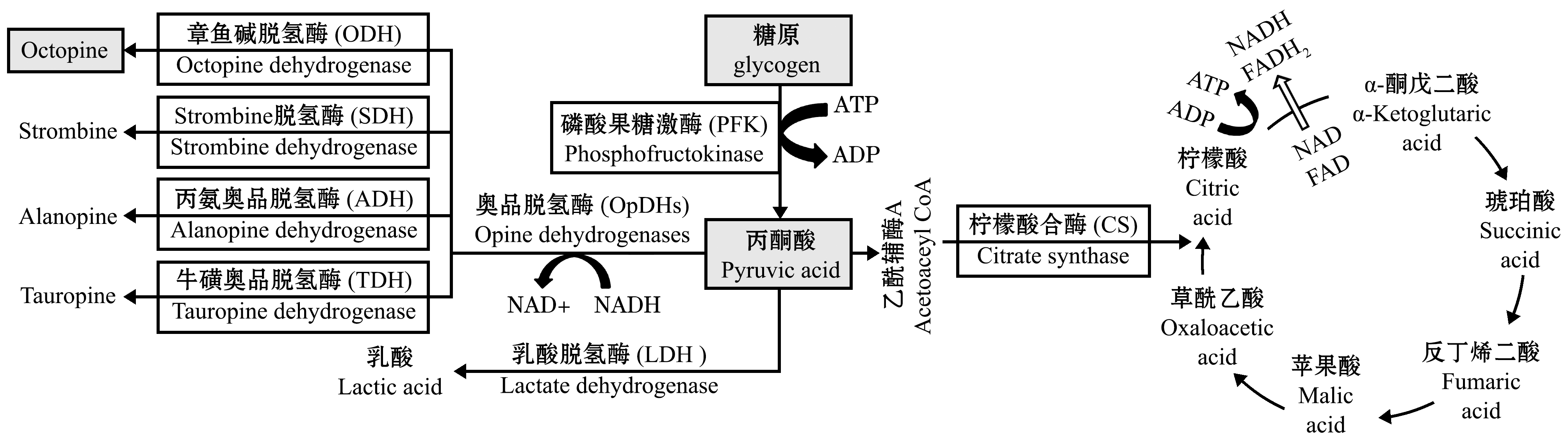
图1 海洋无脊椎动物主要糖代谢途径
Fig.1 Major pathways of sugar metabolism in marine invertebrates
1 材料与方法
1.1 材料
试验用虾夷扇贝于2018年4月购自大连獐子岛集团股份有限公司金贝广场。
试验仪器:Agilent1260高效液相色谱仪(美国Agilent公司);800s匀浆机(美国WARING公司);HG-200均质机(日本HSIANGTAI公司);高速离心机(德国HERMLE Labortechnik GmbH公司);UV-1800PC紫外分光光度计(上海美谱达仪器有限公司)。
试验试剂:色谱级甲醇、乙腈购自美国Sigma公司;分析纯Tris、盐酸、氯化钠、氢氧化钾、氯化钾、高氯酸、浓硫酸、无水乙醇、磷酸、蒽酮均购自国药集团化学试剂有限公司。
1.2 方法
1.2.1 干藏及样品处理 试验用扇贝运抵实验室后随机取6个扇贝迅速取其闭壳肌,作为对照组,记为0 d。剩余扇贝置于托盘中湿布覆盖,在冰箱(4 ℃)中分别于干露条件下贮藏1、2、3 d后,分离闭壳肌用液氮速冻保存备用。
1.2.2 糖原提取及测定 参考刘慧慧等[16]的方法,取2.0 g闭壳肌加入30% KOH溶液,在沸水浴中消化20 min,冷却后加入20 mL无水乙醇,并在3000 g条件下离心15 min,取沉淀作为粗糖原并采用蒽酮比色法测定糖原含量。
1.2.3 三磷酸腺苷(ATP)及其关联化合物的提取及测定 参考Hu等[17]的方法,称取1.0 g贝肉并以1∶10比例加入5%的高氯酸(PCA),于冰浴中充分捣碎后加入2 mol/L KOH调pH至2.0~3.5,加超纯水定容至20 mL,在3000 g条件下离心5 min,取上清液用0.45 μm滤膜过滤。取4 mL滤液并加入1 mL 0.1 mol/L磷酸盐缓冲液(pH 7.5)。整个过程均在冰浴条件下进行。
采用高效液相色谱法进行分析。色谱柱购自大连依利特公司(SinoChrom ODS-BP 5 μm,4.6 mm×250 mm);检测器为二极管阵列检测器(DAD),检测波长为254 nm;温度为35 ℃,流速为0.7 mL/min,进样量为0.02 mL;流动相A为0.05 mol/L K2HPO4-KH2PO4缓冲液(pH 6.5),流动相B为流动相A∶甲醇溶液=8∶2。
1.2.4 磷酸精氨酸(ArP)的提取及测定 ArP的提取与ATP及其关联物的提取方法相同。参考Matsumoto等[18]的方法,使用高效液相法进行定量分析。色谱柱购自日本岛津公司(Shim-pack CLC-NH26.0×150 mm Shimadzu);流动相为10 mmol/L磷酸缓冲液(pH 2.6)∶乙腈=8∶2;流速为1 mL/min,柱温为40 ℃,检测波长为205 nm。
1.2.5 丙酮酸的提取及测定 采用2,4-二硝基苯肼比色法[19]。按照Solarbio公司试剂盒说明书操作步骤进行测定,称取1.0 g闭壳肌,加入5.0 mL提取液,进行冰浴匀浆,静置30 min,在8000 g条件下常温离心10 min,取上清溶液75 μL,加入25 μL 0.1% 2,4-二硝基苯肼混匀,静置2 min后加入1.5 mol/L NaOH混匀后在520 nm波长处测定其吸光度并进行计算。
1.2.6 章鱼碱含量的测定 章鱼碱的提取与ATP的提取方法相同,含量测定参考王聪[20]的方法并稍做修改。取50 μL章鱼碱样品(标准品),加入50 μL碳酸盐缓冲液和130 μL衍生试剂茐甲氧羰酰氯(FMOC),震荡均匀后于60 ℃水浴避光反应30 min,每5 min震荡一次,取出冷却至室温后加入150 μL醋酸钠缓冲液终止反应,过0.45 μm滤膜后用正己烷萃取过量衍生试剂(1∶1),重复两次取下层溶液进行分析。
使用高效液相法进行定量分析。色谱柱购自大连依利特公司(SinoChrom ODS-BP 5 μm,4.6 mm×250 mm);流动相为0.6%三乙胺(pH 6.3)∶甲醇=40∶60;流速为0.6 mL/min,柱温为35 ℃,检测波长为263 nm,进样量为20 μL。
1.2.7 糖代谢相关酶的提取及活性测定
Opines脱氢酶(OpDHs )粗酶的提取:取闭壳肌3.0 g,加入5倍体积经预冷的0.1 mol/L NaCl和20 mmol/L Tris-HCl(pH 7.5)缓冲溶液。以10 000 r/min均质3次,每次30 s,间隔1 min。然后于10 000 g条件下离心10 min,上清液即为粗酶,用于后续酶活分析。用双缩脲法[21]测定粗酶蛋白含量。整个提取过程均在4 ℃下进行。
磷酸果糖激酶(PFK)、柠檬酸合酶(CS)粗酶的提取:与上述方法相同并稍做修改,其中PFK的缓冲液为pH 8.0,CS的缓冲液为pH 9.0。
PFK酶活性的测定:参考管玉霞等[22]的方法并稍做修改,反应体系中包括50 mmol/L Tris-HCl (pH 8.0)、5 mmol/L MgCl2、1 mmol/L EDTA、1 mmol/L果糖-6-磷酸和0.2 mmol/L ATP。
OpDHs酶活性的测定:参考Sato等[23]的方法并稍做修改,反应体系包含0.2 mmol/L NADH、氨基酸底物、5 mmol/L丙酮酸和100 mmol/L磷酸盐缓冲溶液(pH 6.6)。
CS酶活性的测定:参考Hirai等[24]的方法并稍做修改,反应体系中包含40 mmol/L Tris-HCl (pH 9.0)、40 μmol/L DTNB和80 μmol/L AcCoA。
酶活性均使用动力学方法连续测定,按上述方法向反应液中添加粗酶以启动反应,其中,Opines脱氢酶及CS酶动力学连续测定10 min(间隔10 s)内的OD340 nm值,PFK酶则在412 nm下进行动力学连续测定。
2 结果与分析
2.1 干露贮藏期间闭壳肌中主要能量物质及代谢产物含量的变化
虾夷扇贝在干露条件贮藏3 d内,闭壳肌中主要能量物质及代谢产物含量的变化结果如表1所示。
糖原含量:虾夷扇贝刚运抵实验室时,闭壳肌中糖原含量为16.38 mg/g,干露贮藏1 d后,糖原含量显著降为10.12 mg/g(P<0.05)。此后,继续干露贮藏2 d和3 d后糖原含量与1 d时并无明显差别(P>0.05)。
ATP含量:闭壳肌中ATP含量在初始0 d时为3.88 μmol/g,在干露贮藏1 d后,下降为3.75 μmol/g(P>0.05),干露贮藏2 d后,迅速下降为2.59 μmol/g(P<0.05),3 d后基本完全被消耗。
ADP、AMP含量:闭壳肌中产生的ADP与AMP含量呈现逐渐增加的趋势,且在干露贮藏2、3 d时显著增加(P<0.05)。
ArP含量:闭壳肌中ArP含量初始值为3.66 μmol/g,随着干藏时间的延长逐渐被消耗,在干露贮藏3 d时几乎完全耗尽。
表1 干露贮藏期间虾夷扇贝闭壳肌中主要能量物质及代谢物含量变化
Tab.1 Changes in major energy substances and metabolite contents in adductor muscle of live yesso scallop during air esposure storage
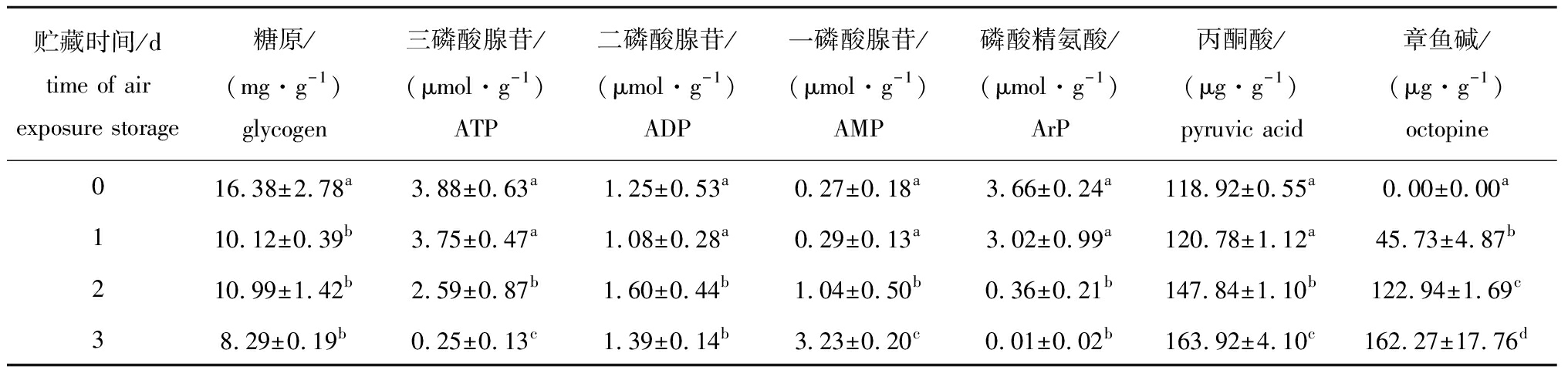
贮藏时间/dtime of airexposure storage糖原/(mg·g-1)glycogen三磷酸腺苷/(μmol·g-1)ATP二磷酸腺苷/(μmol·g-1)ADP一磷酸腺苷/(μmol·g-1)AMP磷酸精氨酸/(μmol·g-1)ArP丙酮酸/(μg·g-1)pyruvic acid章鱼碱/(μg·g-1)octopine016.38±2.78a3.88±0.63a1.25±0.53a0.27±0.18a3.66±0.24a118.92±0.55a0.00±0.00a110.12±0.39b3.75±0.47a1.08±0.28a0.29±0.13a3.02±0.99a120.78±1.12a45.73±4.87b210.99±1.42b2.59±0.87b1.60±0.44b1.04±0.50b0.36±0.21b147.84±1.10b122.94±1.69c38.29±0.19b0.25±0.13c1.39±0.14b3.23±0.20c0.01±0.02b163.92±4.10c162.27±17.76d
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letters within the same column are not significant differences
丙酮酸含量:虾夷扇贝在干露贮藏条件下,作为糖酵解产物的丙酮酸随着干露贮藏时间的延长逐渐积累。初始0 d时为118.92 μg/g,干露贮藏3 d时含量显著上升为163.92 μg/g(P<0.05)。
章鱼碱含量:章鱼碱作为无氧代谢标志物,其含量变化与预测结果相同,随着干露贮藏时间的延长,无氧糖酵解的终产物章鱼碱也逐步积累。在初始0 d时未检测到章鱼碱,随着干露贮藏时间的延长,贮藏3 d时其含量显著上升为162.27 μg/g。
2.2 干露贮藏期间闭壳肌中重要糖代谢酶活性的变化
2.2.1 磷酸果糖激酶 从图2可见:在整个干露贮藏期间PFK酶活力处于一个较低的水平,呈波动变化趋势;初始0 d时仅检测到0.16 U/mg的活力,干露贮藏2 d时与初始并无显著性变化(P>0.05),但干露贮藏3 d时与初始存在显著性差异(P<0.05)。PFK活性的较低水平及非线性变化,并不适用于作为虾夷扇贝在干露贮藏期间的活品品质评价指标。
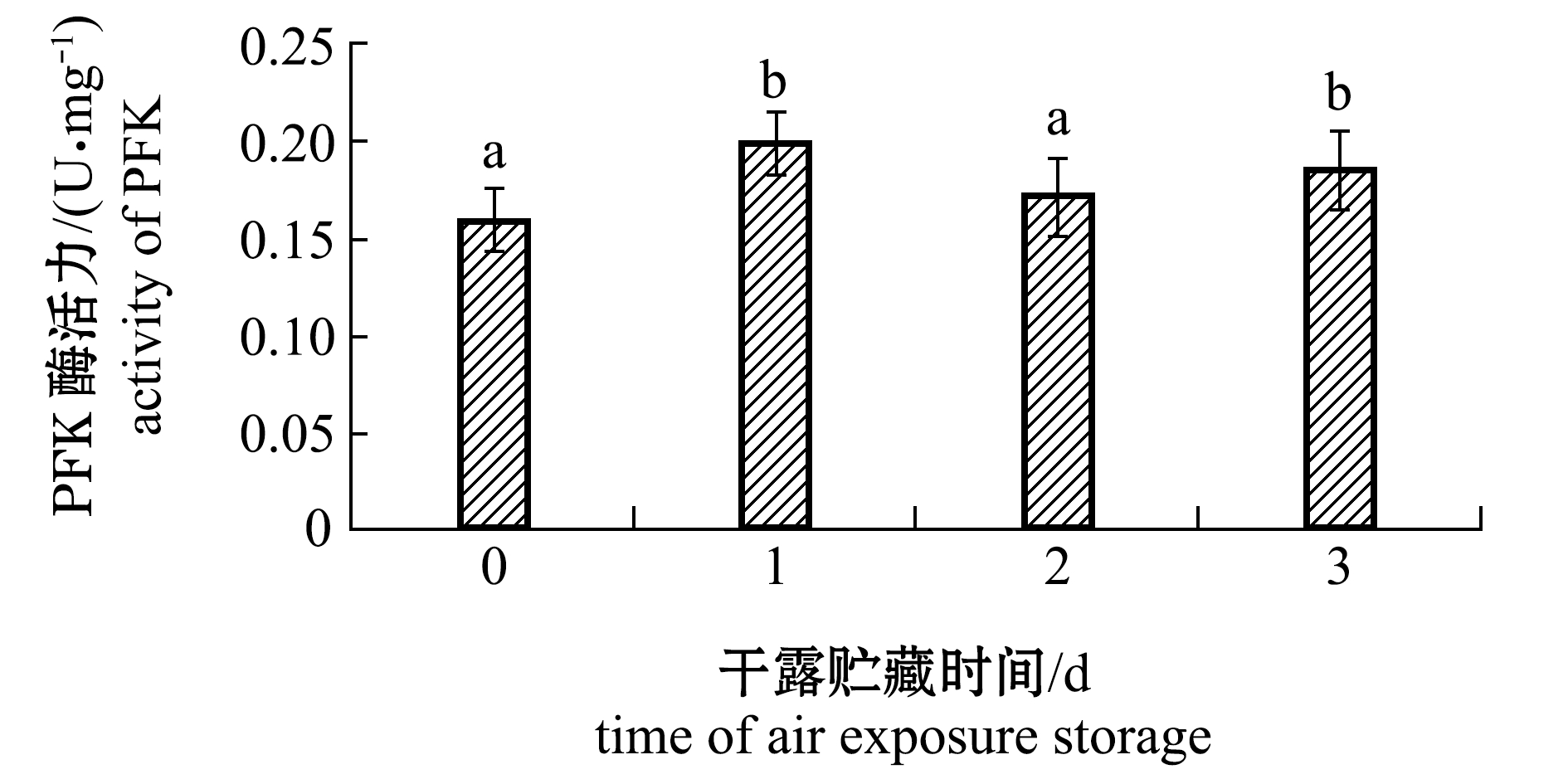
注:标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图2 干露贮藏期间虾夷扇贝闭壳肌中磷酸果糖激酶活性变化
Fig.2 Changes in PFK activity in adductor muscle of live yesso scallop during air exposure storage
2.2.2 Opines脱氢酶 从图3可见:ODH酶活力最大,其在0 d时活力为1.74 U/mg,随着干露贮藏时间的延长,ODH酶活力相比于0 d时均有显著升高(P<0.05),推测ODH酶活力对干露胁迫存在胁迫应答;而ADH、TDH、SDH酶活力始终保持在一个较低的水平,对无氧代谢的作用不显著(P>0.05)。
2.2.3 柠檬酸合酶 从图4可见:CS初始活力就比较低,在0 d时仅为0.093 U/mg,随着干露贮藏时间的延长,其活力还在继续下降;贮藏3 d后其活力显著降到0.026 U/mg(P<0.05),推测在干露贮藏过程中,虾夷扇贝以无氧代谢为主,糖酵解产生的丙酮酸不能进入三羧酸循环参与有氧代谢。
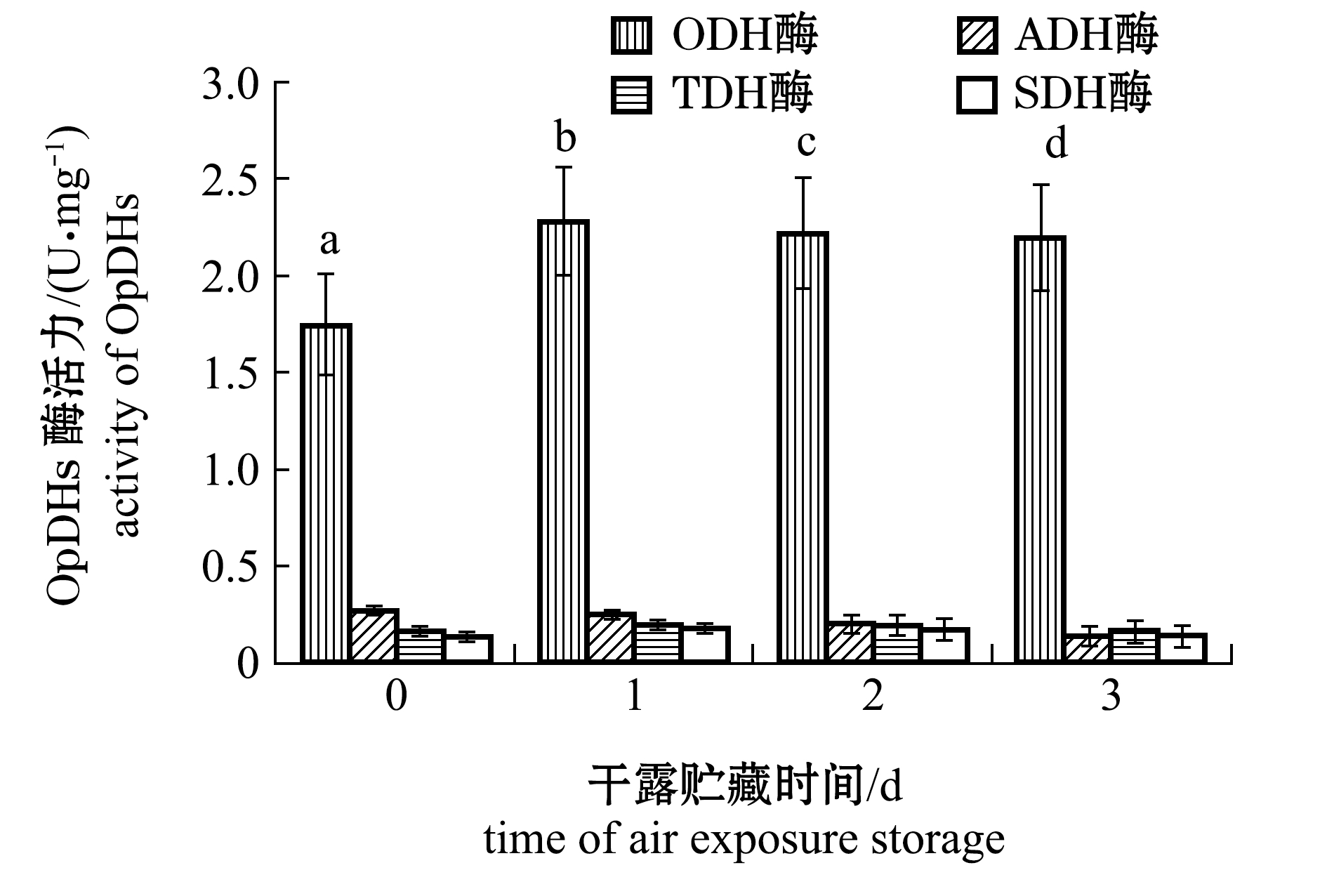
图3 干露贮藏期间虾夷扇贝闭壳肌中OpDHs活性变化
Fig.3 Changes in OpDHs activity in adductor muscle of live yesso scallop during air exposure storage
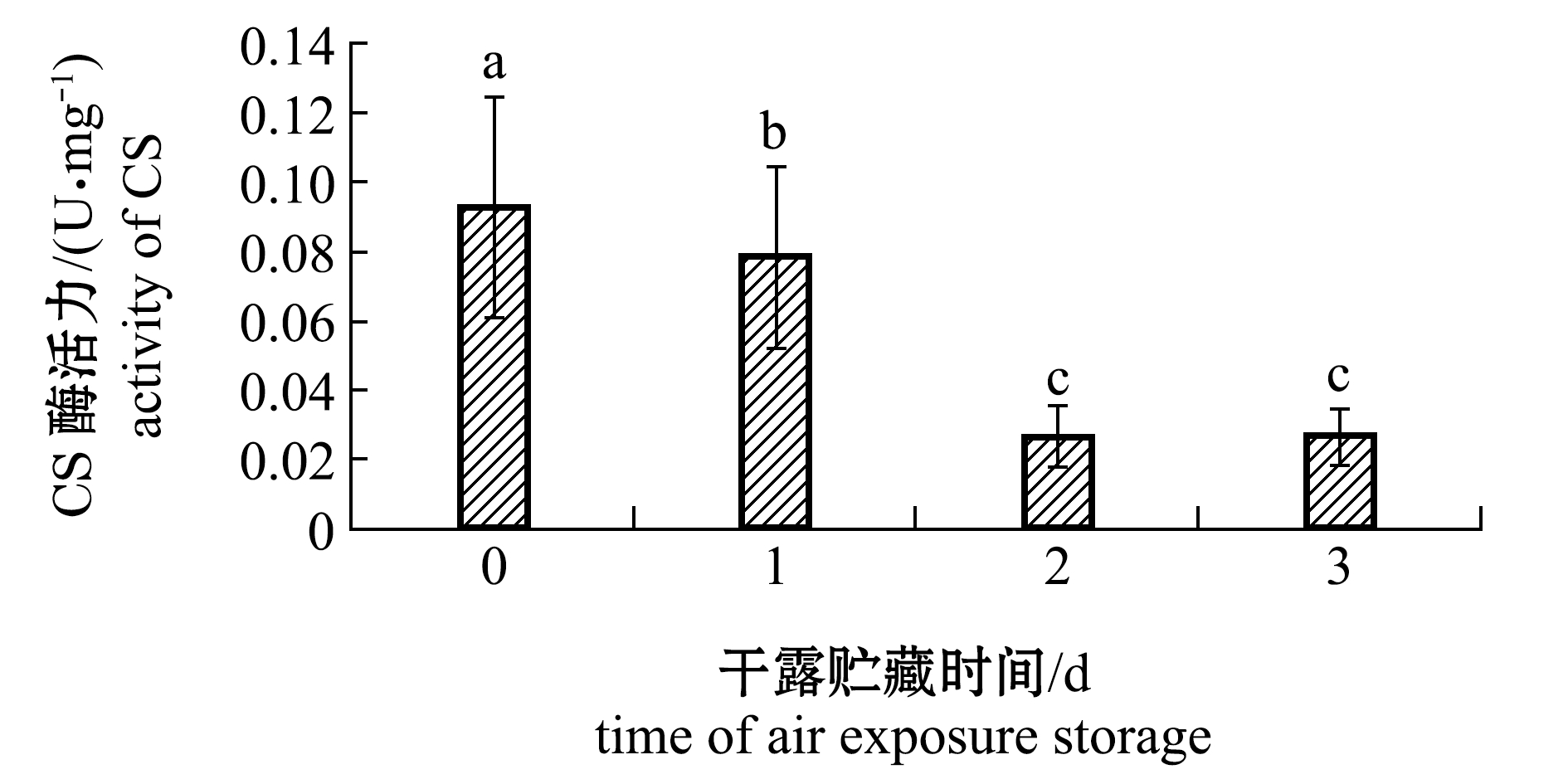
图4 干露贮藏期间虾夷扇贝闭壳肌中柠檬酸合酶活性变化
Fig.4 Changes in CS activity in adductor muscle of live yesso scallop during air exposure storage
3 讨论
3.1 虾夷扇贝在干露贮藏期间闭壳肌中主要能量物质的变化
活品贝类的商业流通主要包括采捕、净化、运输和销售几个环节,各环节中存在的露空、温变、震荡和高氨氮等胁迫因素影响到其生理状态,导致贝类品质不断下降[5]。糖原作为动物体内的主要储能物质,常被用作评价生理状态的指标[25]。在虾夷扇贝干藏初期,糖原含量有明显的下降,但随着干露贮藏时间的延长,扇贝代谢能力减慢,导致后期糖原的消耗减弱。ArP是无脊椎动物体内主要的磷酸原,虾夷扇贝闭壳肌中ArP含量在干露贮藏过程中也呈逐渐下降趋势,而ATP含量在干露贮藏初始阶段(0~1 d)并无明显变化,但在干露贮藏2 d后,ATP含量迅速下降,在第3 天时几乎完全消耗。推测可能在干露贮藏初期ArP补充了ATP消耗,维持了ATP含量的平衡,所以在干藏1 d时ATP含量没有明显的消耗,随着干露贮藏时间的延长,ArP完全消耗,ATP含量下降趋势加快,在第3天时ATP也完全消耗。Takeda等[26]也报道过ArP在精氨酸激酶的作用下,可以将高能磷酸盐转移给ADP,从而合成ATP,此时ArP起到了ATP“缓冲池”作用,ArP变化相对于ATP能从更早的阶段灵敏、准确地反映活品品质。通常,ATP主要通过三羧酸循环产生,而在干露贮藏下长期处于氧不足条件无法进行有氧呼吸,为维持能量平衡,迫使扇贝通过产能效率较低的无氧代谢来产生能量[14]。
3.2 虾夷扇贝在干露贮藏期间主要代谢产物及酶活性的变化
为评价虾夷扇贝在干露贮藏条件下,无氧代谢的情况,进一步对糖代谢过程中两个主要的代谢产物进行了分析。丙酮酸和章鱼碱的含量均随着干露贮藏时间延长呈现上升的趋势,Chih 等[27]也提到了在无氧代谢过程中,丙酮酸含量与章鱼碱水平存在正相关。由于丙酮酸是有氧代谢和无氧代谢都要经历的阶段,在干露贮藏0 d时,检测到了丙酮酸含量,而未检测到章鱼碱含量。根据Hiltz[28]的研究可知,在鲜活的物种中几乎检测不到章鱼碱,而随着动物体无氧代谢的增强章鱼碱的含量会逐渐升高。磷酸果糖激酶是在糖酵解初期糖原酵解为丙酮酸过程中的重要限速酶,其活性在干露贮藏期间无明显的变化。柠檬酸合酶活性随着干露贮藏时间的延长逐渐降低,表明在整个干露贮藏过程中,没有足够的氧气,丙酮酸无法进入三羧酸循环;OpDHs中ODH酶发挥主要作用,其他几种酶由于活性较低并无明显作用,干露贮藏1 d时,ODH酶的活性明显高于初始0 d,之后一直维持在较高的活性。表明在整个干露贮藏过程中无氧代谢一直在持续。无氧糖酵解酶ODH对干露胁迫存在酶应答效应,ODH有成为评价虾夷扇贝活品品质变化的指标潜力,而柠檬酸合酶由于其初始活性较低,其酶应答效应还需进一步验证。
与生长阶段相比,贝类捕后应激反应要剧烈得多,其能量代谢关系到活品品质。今后的研究需要通过代谢产物跟踪分析揭示捕后代谢规律,完善贝类捕后活品代谢基础理论研究,为指导经济贝类活品品质调控提供理论支撑。
[1] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2018中国渔业统计年鉴[M].北京:中国农业出版社,2018.
[2] 于笛,刘俊荣,杨君德,等.海水养殖虾夷扇贝供应链可追溯管理体系的探讨[J].水产科学,2013,32(2):117-124.
[3] 杨婷婷.采捕后活品虾夷扇贝(Patinopecten yessoensis)的风味变化[D].大连:大连海洋大学,2014.
[4] 杨婷婷,刘俊荣,沈建,等.活品底播虾夷扇贝(Patinopecten yessoensis)感官评价描述词的建立[J].食品科学,2014,35(19):16-22.
[5] 杨婷婷,刘俊荣,俞微微,等.活品流通过程中虾夷扇贝风味品质的变化[J].水产学报,2015,39(1):136-146.
[6] 刘金洋,刘俊荣,田元勇,等.捕后处置对活品底播虾夷扇贝生化代谢的影响[J].水产学报,2017,41(1):81-87.
[7] 周晏琳,郑尧,刘慧慧,等.干露对活品虾夷扇贝闭壳肌SOD酶活性及其性质的影响[J].大连海洋大学学报,2018,33(5):651-657.
[8] 傅润泽,沈建,王锡昌,等.GC-MS鉴别保活流通过程中虾夷扇贝气味特征变化[J].食品科学,2016,37(4):93-97.
[9] 傅润泽.虾夷扇贝保活流通过程中气味特征模式识别与品质快速评价[D].上海:上海海洋大学,2016.
[10] 刘世永.虾夷扇贝(Patinopecten yessoensis)活品运输中菌群结构的变化[D].大连:大连海洋大学,2014.
[11] Ivanina A V,Froelich B,Williams T,et al.Interactive effects of cadmium and hypoxia on metabolic responses and bacterial loads of eastern oysters Crassostrea virginica Gmelin[J].Chemosphere,2011,82(3):377-389.
[12] Brokordt K B,Himmelman J H,Nusetti O A,et al.Reproductive investment reduces recuperation from exhaustive escape activity in the tropical scallop Euvola zizac[J].Marine Biology,2000,137(5-6):857-865.
[13] 李泽健.低氧胁迫对中华绒螯蟹能量代谢、呼吸代谢及抗氧化代谢的影响[D].保定:河北大学,2012.
[14] Grieshaber M K,Hardewig I,Kreutzer U,et al.Physiological and metabolic responses to hypoxia in invertebrates[M]//Reviews of Physiology,Biochemistry and Pharmacology.Berlin,Heidelberg:Springer,1993:43.
[15] Baldwin J,Opie A M.On the role of octopine dehydrogenase in the adductor muscles of bivalve molluscs[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1978,61(1):85-92.
[16] 刘慧慧,周晏琳,张晴,等.菲律宾蛤仔捕后干露处置对其复水湿藏稳定性的影响[J].大连海洋大学学报,2018,33(2):244-250.
[17] Hu Yaqin,Zhang Jia,Ebitani K,et al.Development of simplified method for extracting ATP-related compounds from fish meat[J].Nippon Suisan Gakkaishi,2013,79(2):219-225.
[18] Matsumoto M,Yamanaka H.Studies on rigor-mortis of kuruma prawn muscle[J].Nippon Suisan Gakkaishi,1991,57(11):2121-2126.
[19] 张龙翔,张庭芳,李令媛.生化实验方法和技术[M].2版.北京:高等教育出版社,1997:422-427.
[20] 王聪.章鱼中肉碱、章鱼肉碱检测方法研究[D].青岛:中国海洋大学,2011.
[21] Gornall A G,Bardawill C J,David M M.Determination of serum proteins by means of the Biuret reaction[J].Journal of Biological Chemistry,1949,177(2):751-766.
[22] 管玉霞,张洪秀,邢莉丽.反相高效液相色谱法测定磷酸果糖激酶的活性[J].分析科学学报,2009,25(2):211-213.
[23] Sato M,Takeuchi M,Kanno N,et al.Distribution of opine dehydrogenases and lactate dehydrogenase activities in marine animals[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1993,106(4):955-960.
[24] Hirai M,Ueno I.Development of citrus fruits:fruit development and enzymatic changes in juice vesicle tissue[J].Plant and Cell Physiology,1977,18(4):791-799.
[25] 刘金洋.虾夷扇贝在活品流通过程中的代谢变化[D].大连:大连海洋大学,2016.
[26] Takeda T,Sakurai I,Maekawa K,et al.Estimating the threshold amount of adductor muscle arginine phosphate content required for recovery of vitality in the scallop Mizuhopecten yessoensis[J].Nippon Suisan Gakkaishi,2015,81(4):694-700.
[27] Chih C P,Ellington W R.Control of glycolysis during contractile activity in the phasic adductor muscle of the bay scallop,Argopecten irradians concentricus:identification of potential sites of regulation and a consideration of the control of octopine dehydrogenase activity[J].Physiological Zoology,1986,59(5):563-573.
[28] Hiltz D F,Dyer W J.Octopine in postmortem adductor muscle of the sea scallop (Placopecten magellanicus)[J].Journal of the Fisheries Research Board of Canada,1971,28(6):869-874.