裙带菜Undaria pinnatifida Suringar为温带性多年生经济褐藻[1],富含几十种常量元素及多种微量元素[2],是一种口味极佳的天然矿物质海洋食品。袍子叶是裙带菜的生殖器官,位于裙带菜茎部靠近假根的部分[3],已有研究发现,裙带菜孢子叶富含膳食纤维和褐藻多糖等,具有良好的生物活性和保健功能[4]。裙带菜褐藻聚糖硫酸酯(Fucoidan)是一类水溶性多糖[5],因其具有抗凝血[6]、降血脂[7]、抗肿瘤[8]、抗炎[9]、抗肥胖[10]、抗氧化[11]、免疫调节[12-13]等多种生物学活性,备受国内外学者关注。裙带菜袍子叶含有的褐藻聚糖硫酸酯是一类大分子杂多糖,其构成十分复杂。因此,为了对此类杂多糖的活性进行更加深入的研究,有必要对其进行一定的分离和纯化,从而获得不同的纯化组分。目前,对包括裙带菜在内的大多数褐藻的褐藻聚糖硫酸酯粗提物大多采用离子交换色谱法[14]和凝胶色谱法进行分离纯化,但该法使用的分离胶成本较高,且处理量较低,仅限于实验室研究。而大孔吸附或离子交换树脂具有理化性质稳定、处理量大、吸附速度快、成本低等优点,被普遍用来对天然产物进行工业化分离纯化[15]。目前,采用不同种类树脂对于褐藻聚糖硫酸酯的分离效果比较的相关报道较少,此方法可以作为分离纯化此类多糖的一个途径。此外,近年来植物来源的自由基清除剂成为研究的一个热点,而褐藻聚糖硫酸酯正是植物源的天然抗氧化剂,有很好的应用前景,有待深入研究与开发。
本研究中,以裙带菜袍子叶褐藻聚糖硫酸酯(UPS-FUC)为原料,通过选取不同种类的树脂分别进行静态吸附和动态洗脱试验,从而选出分离纯化效果较好的树脂并确定其最佳分离纯化条件,对纯化后各组分进行纯度和单糖组成测定,并进行抗氧化活性研究,旨在为进一步分离纯化和研究UPS-FUC的活性提供参考依据。
裙带菜孢子叶褐藻聚糖硫酸酯粗品(UPS-FUC)来自国家海藻加工技术研发分中心。
试验试剂:弱碱性树脂D315、D301-T、D301-R、D380,强碱性树脂D280、201×4、D290,大孔树脂ADS-5、ADS-7、AB-8、D3520,均购自天津南开和成科技有限公司;单糖标准品(岩藻糖、半乳糖、木糖、鼠李糖、甘露糖、葡萄糖、葡萄糖醛酸)、DPPH均购自Sigma-Aldrich公司;乙腈、甲醇 (色谱纯) 均购自美国Muskegon公司;其他试剂均为国产分析纯。
试验仪器:SBS-100型数控计滴自动部分收集器(上海沪西分析仪器厂)、酶标仪(美国伯腾仪器有限公司)、ScientZ-30D型真空冷冻干燥机(宁波新芝生物科技有限公司)、1260型高效液相色谱仪(美国Agilent公司)。
1.2.1 多糖含量的测定 采用苯酚-硫酸法对多糖含量进行测定[16]。本方法主要利用在硫酸条件下多糖可以被水解为单糖,脱水后生成的糖醛衍生物能与苯酚生成淡黄色化合物,在波长490 nm条件下测定其吸光度并确定其含量。
1.2.2 硫酸基团含量的测定 采用明胶-氯化钡法对硫酸基团含量进行测定[17]。准确称取一定量的样品在105 ℃条件下利用盐酸进行酸解,经过脱色处理,调节滤出液的pH值。配制K2SO4标准溶液并绘制其标准曲线。按照标准方法测出样品的吸光值,依据标准曲线计算样品中硫酸基团含量。
1.2.3 树脂的预处理 分别称取各类型阴离子树脂50 mL置于烧杯中,于去离子水中浸泡24 h,大孔树脂于95%乙醇中浸泡24 h。弱碱性树脂处理方法:先用浓度为4%的盐酸浸泡4 h,用去离子水洗至中性;再用2%的NaOH溶液浸泡4 h,用去离子水洗涤至中性,冲洗3遍。强碱性树脂处理方法:用体积分数为2%的NaOH溶液浸泡4 h,用离子水洗至中性;再用4%的盐酸浸泡4 h,用去离子水洗至中性,处理3遍。大孔树脂的处理方法:用体积分数为4%的盐酸浸泡4 h,最后经去离子水洗至中性。
1.2.4 静态吸附试验
(1) 树脂的筛选。 准确量取预处理后的各类树脂5 mL分别加到100 mL锥形瓶中,而后加入20 mL浓度为5 mg/mL的 UPS-FUC溶液,于水浴振荡器中常温振摇12 h后,分别测定上清液中多糖的质量浓度和硫酸基团的浓度,计算交换容量。
树脂的多糖或硫酸基团交换容量E(mg/mL)计算公式为
E=(C-C0)×V/V0。
(1)
其中:C为起始时上清液中多糖或硫酸基团的浓度(mg/mL);C0为吸附平衡后上清液中多糖或硫酸基团的浓度(mg/mL);V为多糖或硫酸基团溶液的体积(mL);V0为湿树脂的体积(mL)。
(2) pH值对树脂交换容量的影响。 取5 mL经过预处理的分离纯化树脂分别置于250 mL三角瓶内,分别加入50 mL浓度为0.02 mol/L的缓冲液(pH值分别为6.0、6.5、7.0、7.5、8.0),静置12 h,以平衡树脂的pH。将pH值分别为6.0、6.5、7.0、7.5、8.0的浓度为5 mg/mL UPS-FUC溶液各20 mL加入相应pH缓冲液处理的树脂中,经水浴振荡器振荡,于室温下吸附12 h至平衡。测定上清液中多糖及硫酸基团的浓度,计算出交换容量,从而确定吸附的最佳pH值。
1.2.5 动态洗脱试验 选取静态吸附试验中效果最好的树脂,以及与之相对应的最佳值,采用上述步骤中的方法进行预处理,按照彭雍博等[18]的方法进行动态洗脱试验,并略有调整。取0.3 g UPS- FUC粗品,溶于20 mL 浓度为0.02 mol/L的磷酸盐缓冲液(pH 7.4)中,溶液经DEAE-Sepharose Fast Flow弱阴离子交换色谱柱( 26 mm×300 mm) 分离,经磷酸盐缓冲液和0~2.5 mol/L的NaCl溶液梯度洗脱。设定流速为1 mL/min,每管收集3 mL。以洗脱管数为横坐标,多糖浓度(测定方法同多糖测定)和NaCl浓度为纵坐标,绘制褐藻聚糖硫酸酯梯度洗脱曲线。根据梯度洗脱曲线确定分离组分并分别收集、透析、冷冻干燥。
1.2.6 回收率的计算 回收率计算公式为
W=M1/M2×100%。
(2)
其中:M1为上样粗多糖的质量(g);M2为分离纯化后各组分冻干后的质量(g)。
1.2.7 单糖组成测定 称取一定量的各单糖标准品(甘露糖、鼠李糖、葡萄糖、半乳糖、木糖、岩藻糖、葡萄糖醛酸)配制成浓度为1.0 mmol/L混合溶液,待测样品溶解于超纯水中并溶胀过夜。利用三氟乙酸(TFA)溶液进行酸解,酸解后的样品经1-苯基-3-甲基-吡唑啉酮(PMP)衍生化反应,反应终止后利用三氯甲烷反复萃取,除去溶液中的有机相,过水系膜后进行高效液相色谱分析。
检测条件:使用装有Agela·Venusil XBP-C18(2)色谱柱和紫外检测器(DAD)的 Agilent 1260高效液相色谱仪,流动相A为15%乙腈+50 mmol/L磷酸盐缓冲液(pH 6.0),流动相B为40% 乙腈+50 mmol/L的磷酸盐缓冲溶液(pH 6.0)。进样量为20 μL,流速为1.0 mL/min,柱温为30 ℃。
1.2.8 各分离组分对羟基自由基(·OH)的清除作用 采用Feton反应[19]测定各组分多糖对·OH的清除作用,以维生素C(VC)为标准对照物。清除率的计算公式为
·OH清除率=(A0-Ai)/A0×100%。
(3)
其中:A0为空白对照溶液吸光度;Ai为样品溶液吸光度。
1.2.9 各分离组分对超氧阴离子![]() 的清除作用 采用邻苯三酚自氧化法[20]测定各组分多糖对超氧阴离子的清除能力,同时以VC为标准对照物。超氧阴离子抑制率(P)计算公式为
的清除作用 采用邻苯三酚自氧化法[20]测定各组分多糖对超氧阴离子的清除能力,同时以VC为标准对照物。超氧阴离子抑制率(P)计算公式为
P=(A0-Ai)/A0×100%。
(4)
其中:A0为空白对照溶液吸光度;Ai为样品溶液吸光度。
2.1.1 多糖交换容量对树脂筛选的影响 从图1可见:对于弱碱性阴离子交换树脂,多糖交换容量最大的是D315,交换容量为13.19 mg/mL;对于强碱性阴离子交换树脂,多糖交换容量最大的是D290,交换容量为11.84 mg/mL;对于大孔吸附树脂,多糖交换容量最大的是ADS-7,交换容量为11.65 mg/mL;交换容量较大的树脂分别为D315、D310-R、D301-T、D290。
2.1.2 硫酸基团交换容量对树脂筛选的影响 从图2可见:对于弱碱性阴离子交换树脂,硫酸基团交换容量最大的是D315,交换容量为3.9 mg/mL;硫酸基团交换容量较大的4种树脂依次为D315>D290>D301-T>D310-R。综合考虑上述树脂对多糖和硫酸基团的交换容量,选择D315、D290、D301-T、D310-R这4种树脂进行下一步试验,以确定分离纯化UPS-FUC上样液的最适pH值。

注:与交换容量最小的ADS-5组相比, **表示有极显著性差异(P<0.01),*表示有显著性差异(P<0.05)
Note: ** indicates a very significant difference (P<0.01), * indicates significant difference (P<0.05),compared with the ADS-5 group with the minimal switching capacity
图1 不同树脂对多糖交换容量的影响
Fig.1 Exchange capacity of different kinds of resin for polysaccharides
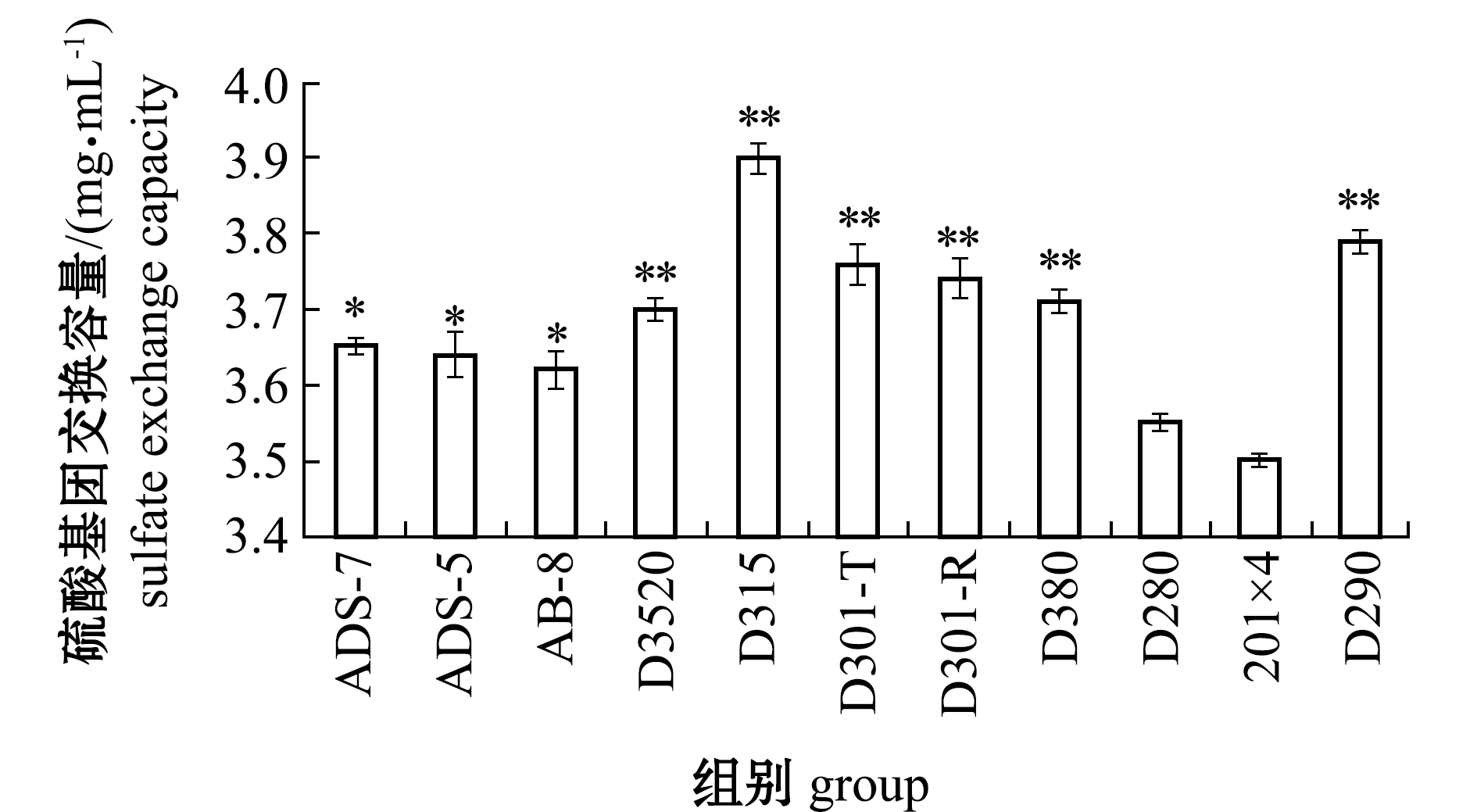
注:与交换容量最小的201×4组相比,**表示有极显著性差异(P<0.01),*表示有显著性差异(P<0.05)
Note: ** indicates a very significant difference (P<0.01), * indicates significant difference (P<0.05),compared with the 201×4 group with the minimal switching capacity,
图2 不同树脂对硫酸基团交换容量的影响
Fig.2 Exchange capacity of different kinds of resin for sulfate
2.1.3 pH对树脂交换容量的影响 从图3可见:当溶液的pH为6.0时,树脂D315对褐藻聚糖硫酸酯中多糖交换容量最大,为10.01 mg/mL,但随着pH值的升高,D315对多糖的交换容量小幅减少;树脂D290对多糖的交换容量在各pH值处均小于树脂D315,当pH值为6时,其交换容量最大,为9.36 mg/mL;在pH 为6~8的范围内,树脂D310-T和D301-R的多糖交换容量均小于上述两种树脂。
从图3还可见:当溶液的pH为6.0时,树脂D315对褐藻聚糖硫酸脂中硫酸基团的交换容量最大,为3.96 mg/mL;树脂D290的硫酸基团交换容量均小于树脂D315,其最大交换容量值出现在pH为8.0时,为3.90 mg/mL;未见D301-T和D301-R的交换容量随pH值变化而变化的趋势。因此,选取树脂D315和树脂D290进行动态洗脱试验,综合pH对多糖和硫酸基团交换容量的影响结果,选取树脂D315在pH 6.0和8.0条件下,以及树脂D290在pH 6.0条件下的动态洗脱效果,以确定分离纯化效果最好的树脂及其上样液pH值条件。
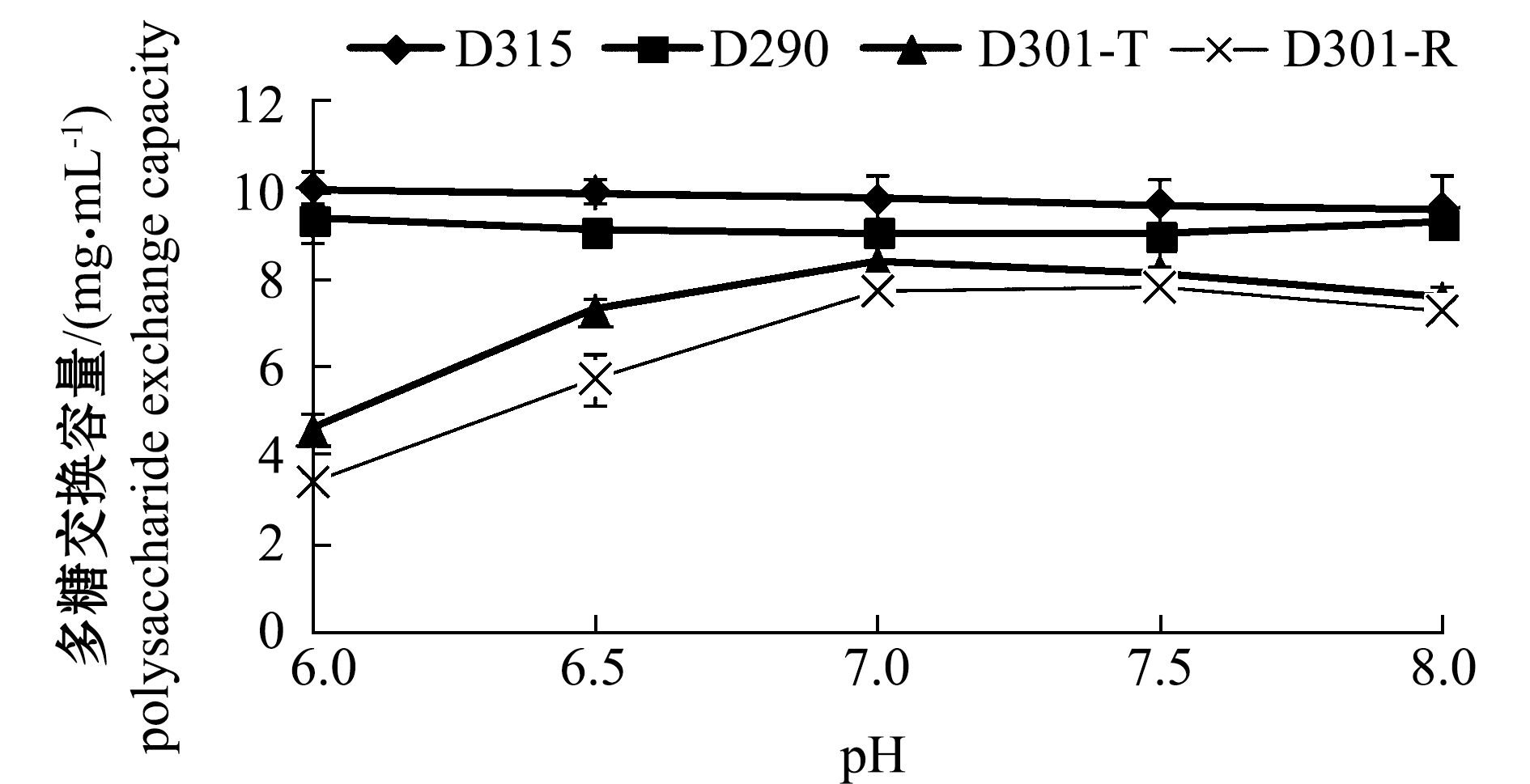
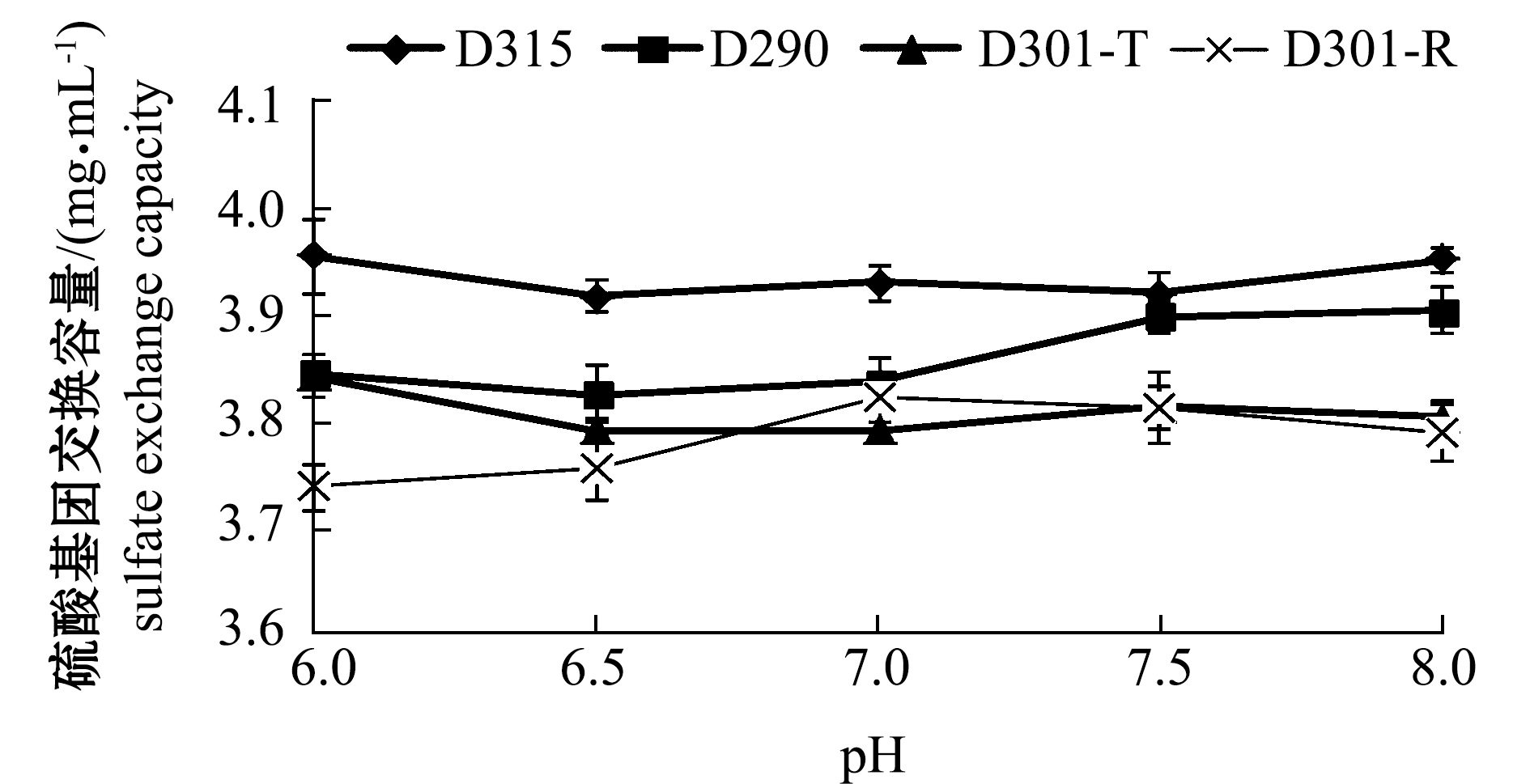
图3 pH对褐藻聚糖硫酸酯中多糖和硫酸基团交换容量的影响
Fig.3 Effect of pH value on exchange capacity of polysaccharide and sulfate in fucoidan by resin
2.2.1 弱碱性阴离子交换树脂分离纯化UPS-FUC 从图4可见:UPS-FUC分离纯化后共得到两个组分,第一个组分为流出峰,第二个组分为NaCl梯度洗脱峰;其后持续增加NaCl溶液浓度,也无多糖被洗脱流出。由于洗脱后得到的糖峰少,仅有一个,未将裙带菜褐藻聚糖硫酸酯组分分离开来,说明弱碱性阴离子交换树脂D315在pH为6.0条件下不宜对裙带菜褐藻聚糖硫酸酯进行动态洗脱。
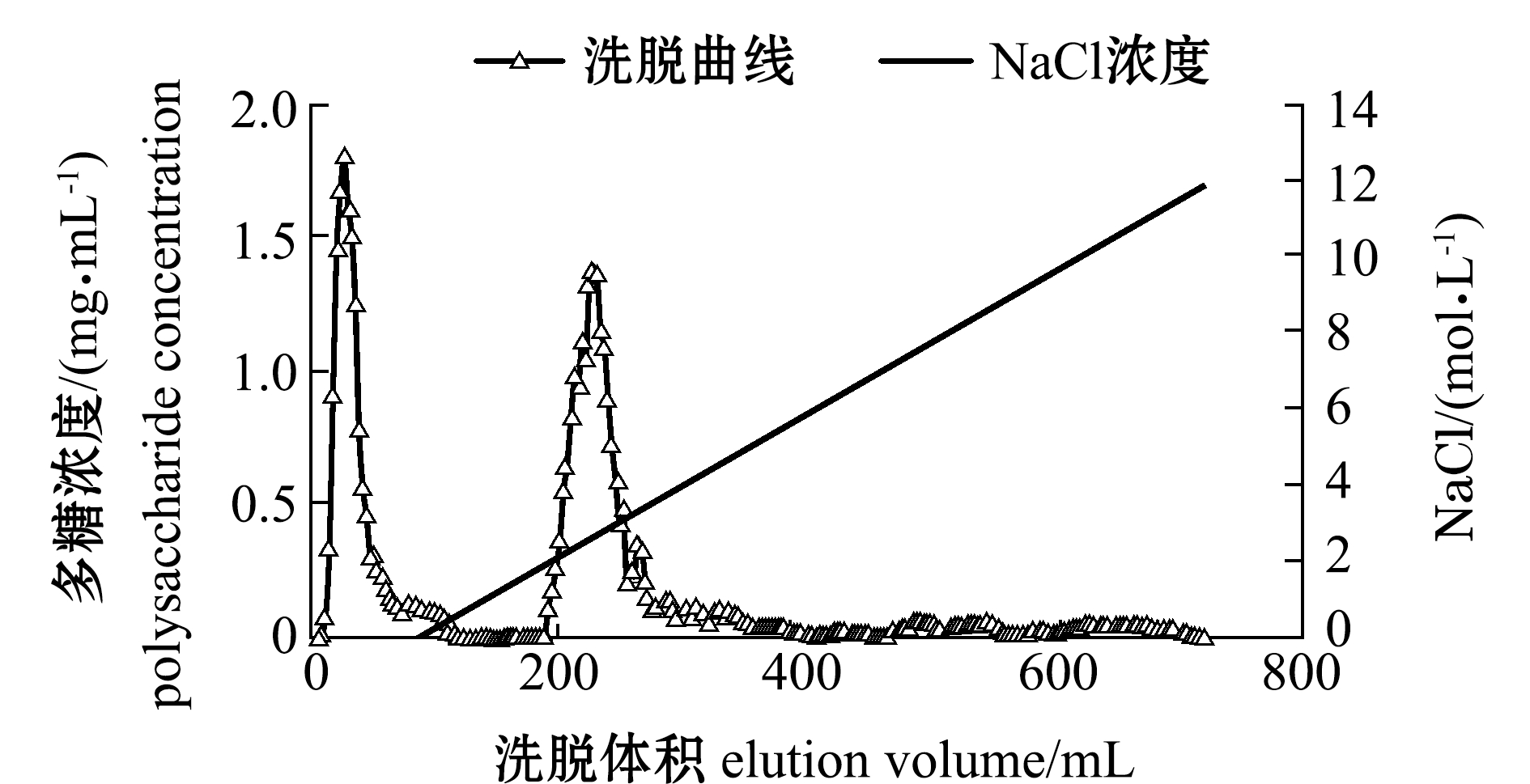
图4 D315 (pH 6.0)条件下梯度洗脱曲线
Fig.4 Elution curve of fucoidan on resin D315(pH 6.0)
从图5可见:UPS-FUC分离纯化后共得到2个洗脱峰;水洗得到第1个糖峰,继续用NaCl溶液梯度洗脱只得到1个混合的糖峰,从图中可见,这个峰有明显重叠现象,重叠部分大体包含3~5个峰。因此,pH值为6.0也不是树脂D290的最佳动态洗脱条件。
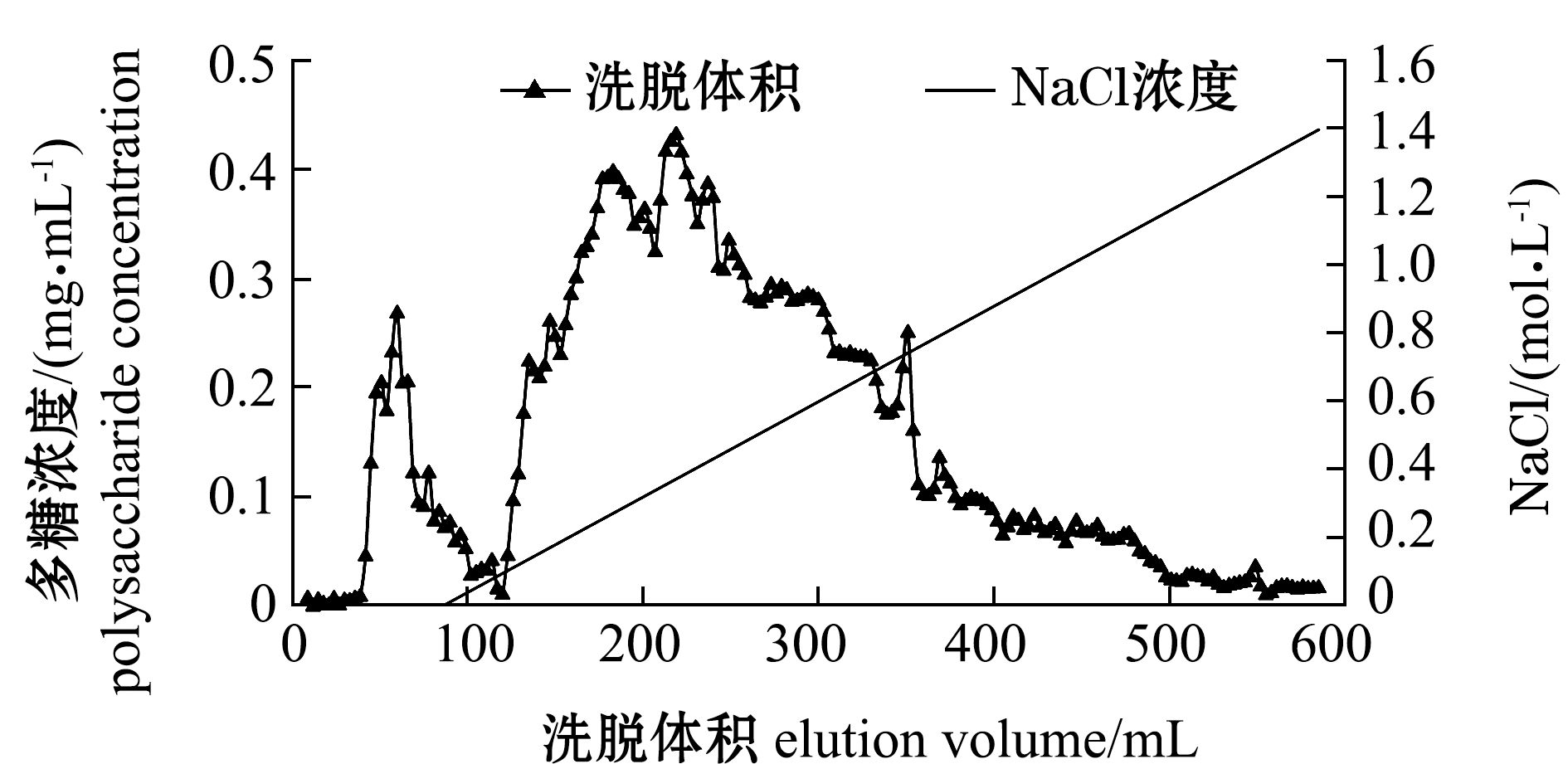
图5 D290 (pH 6.0)条件下梯度洗脱曲线
Fig.5 Elution curve of fucoidan on resin D290(pH 6.0)
从图6可见,UPS-FUC经纯化后共得到5个洗脱峰,分别命名为F1、F2、F3、F4和F5,其中F1为流出峰,其他4个峰为盐梯度洗脱峰,各峰形尖锐对称,可以认为D315在上样液pH为8.0的条件下可以对裙带菜的褐藻聚糖硫酸酯进行更好的动态洗脱。分别收集各组分、透析、冷冻干燥备用。
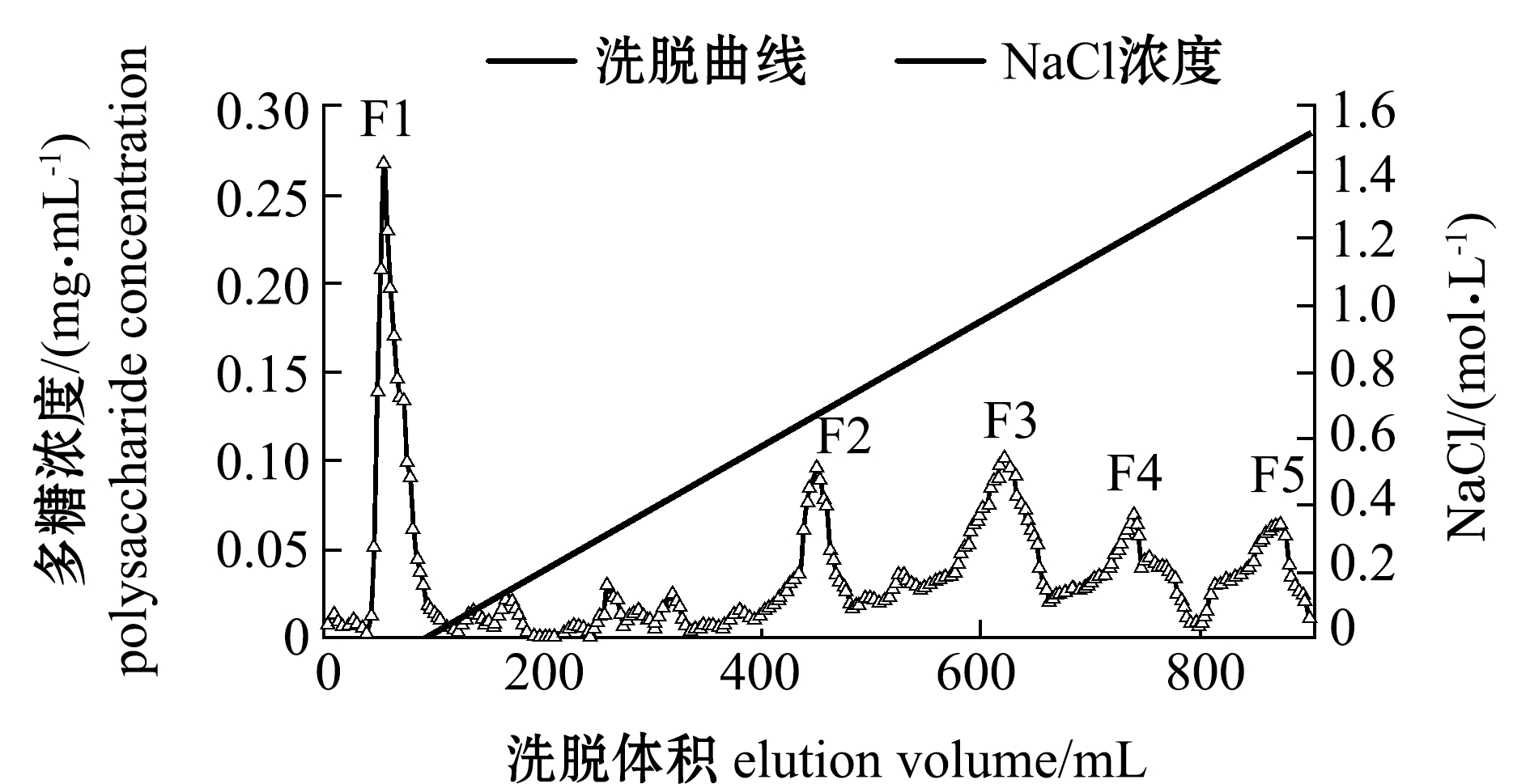
图6 D315(pH 8.0)条件下的梯度洗脱曲线
Fig.6 Elution curve of fucoidan on resin D315(pH 8.0)
2.2.2 各组分理化性质分析 从表1可见:用D315树脂在pH为8.0条件下对UPS-FUS分离纯化得到的5个组分中,组分F3的硫酸基团含量最高,为21.72%;组分F1的多糖含量最高,达到了69.95%;组分F3的得率最高,为17.21%,而纯化组分F2的得率最低,只有11.45%;组分F2的硫酸基团含量、多糖含量及得率均较高,褐藻聚糖硫酸酯的纯度为80.19%,为5个组分中的最高值。
表1 褐藻聚糖硫酸酯中各组分理化性质分析
Tab.1 Physical and chemical properties of each fraction in fucoidan%
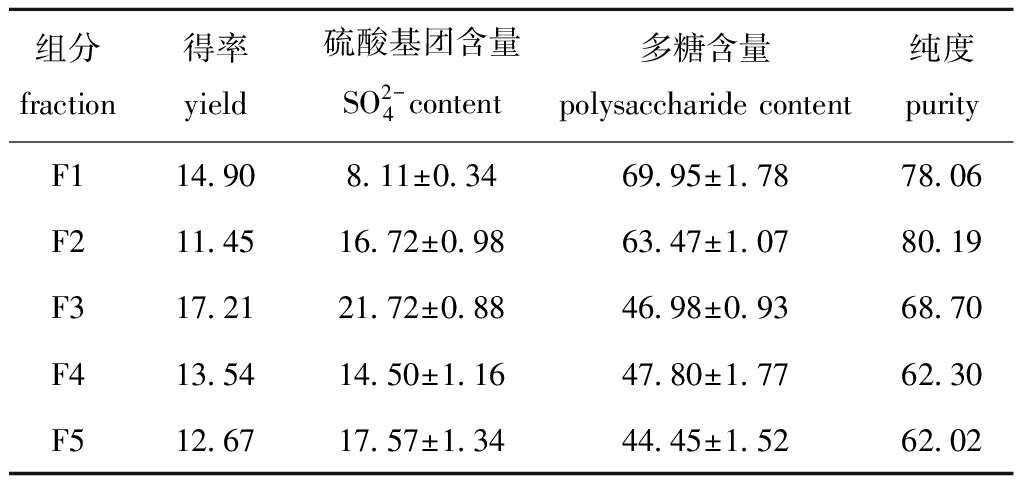
组分 fraction得率 yield硫酸基团含量 SO2- 4content多糖含量 polysaccharide content纯度 purityF114.908.11±0.3469.95±1.7878.06F211.4516.72±0.9863.47±1.0780.19F317.2121.72±0.8846.98±0.9368.70F413.5414.50±1.1647.80±1.7762.30F512.6717.57±1.3444.45±1.5262.02
从表2可见:水洗脱的组分F1单糖组成是以半乳糖和岩藻糖为主;而NaCl洗脱的组分F2、F3、F4、F5,其单糖组成中岩藻糖和半乳糖含量依次增加,而甘露糖含量依次降低,其中F2、F3、F4单糖组成以甘露糖、半乳糖和岩藻糖为主,F5单糖组成以半乳糖和岩藻糖为主:相比较F1和F5的组成均以半乳糖和岩藻糖为主,F1中的半乳糖和岩藻糖占比略高于F5。
表2 褐藻聚糖硫酸酯中各组分单糖组成比例
Tab.2 Composition ratios of neutral monosaccharide in each fraction in fucoidan %
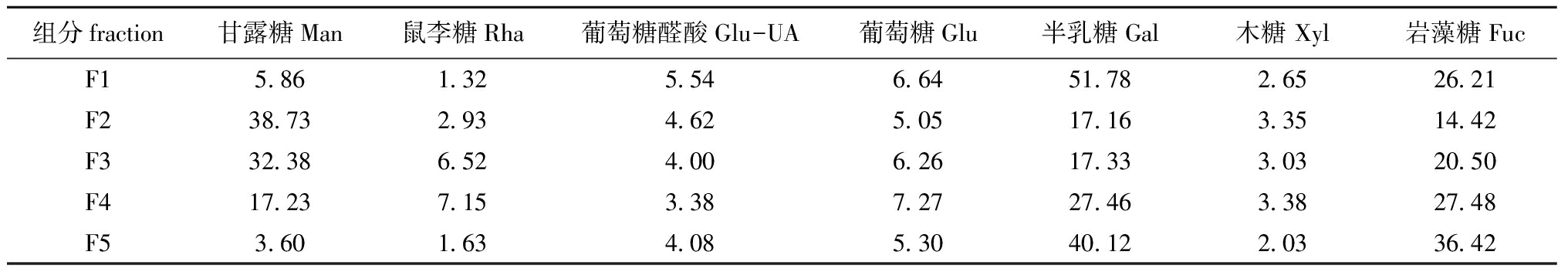
组分fraction甘露糖Man鼠李糖Rha葡萄糖醛酸Glu-UA葡萄糖Glu半乳糖Gal木糖 Xyl岩藻糖FucF15.861.325.546.6451.782.6526.21F238.732.934.625.0517.163.3514.42F332.386.524.006.2617.333.0320.50F417.237.153.387.2727.463.3827.48F53.601.634.085.3040.122.0336.42
2.4.1 各组分对羟基自由基的清除作用 从图7可见:随着各组分样品浓度的增加,对于羟基自由基的清除能力也在逐渐增强;当浓度为1 mg/mL时,各组抑制率迅速提升,当F1的浓度达到9 mg/mL时,其清除率为91.34%,成为清除效果最好的组分,而F2、F3、F4、F5组分对羟基自由基的清除能力也依次增强。而VC质量浓度在1~9 μg/mL时,抑制率也迅速增加到77.79%。计算得出,F1、F2、F3、F4、F5各组分清除·OH的IC50值分别为1.13、2.78、3.48、3.08、4.40 mg/mL,其中F1清除·OH的IC50值最小,而VC的IC50值为8.49 μg/mL。结果表明,各组分对于羟自由基的清除能力虽均低于VC,但也表现出了较好的清除效果。

图7 褐藻聚糖硫酸酯各组分对羟基自由基的清除作用
Fig.7 Scavenging effects of fucoidan fractions on·OH
2.4.2 各组分对超氧阴离子的清除作用 从图8可见:5个组分在所选的浓度范围内,对于超氧阴离子均有一定的清除作用,且随着浓度的升高,清除能力在逐渐增大;当各组分浓度为9 mg/mL时,清除率达到最大,而后趋于稳定;F1清除效果最好,达到了82.56%,F2、F3、F4、F5组分对超氧阴离子清除能力依次增强。而VC在质量浓度为1~6 μg/mL时,清除率迅速达到68.63%,浓度为9 μg/mL时,清除率达到了94.12%。计算得出F1、F2、F3、F4、F5各组分的IC50值分别为2.95、3.26、4.87、3.33、9.24 mg/mL,其中F1的IC50值最小,而VC的IC50值为4.40 μg/mL,说明各组分对于![]() 的清除能力均不如VC,但也表现出了良好的清除作用。
的清除能力均不如VC,但也表现出了良好的清除作用。
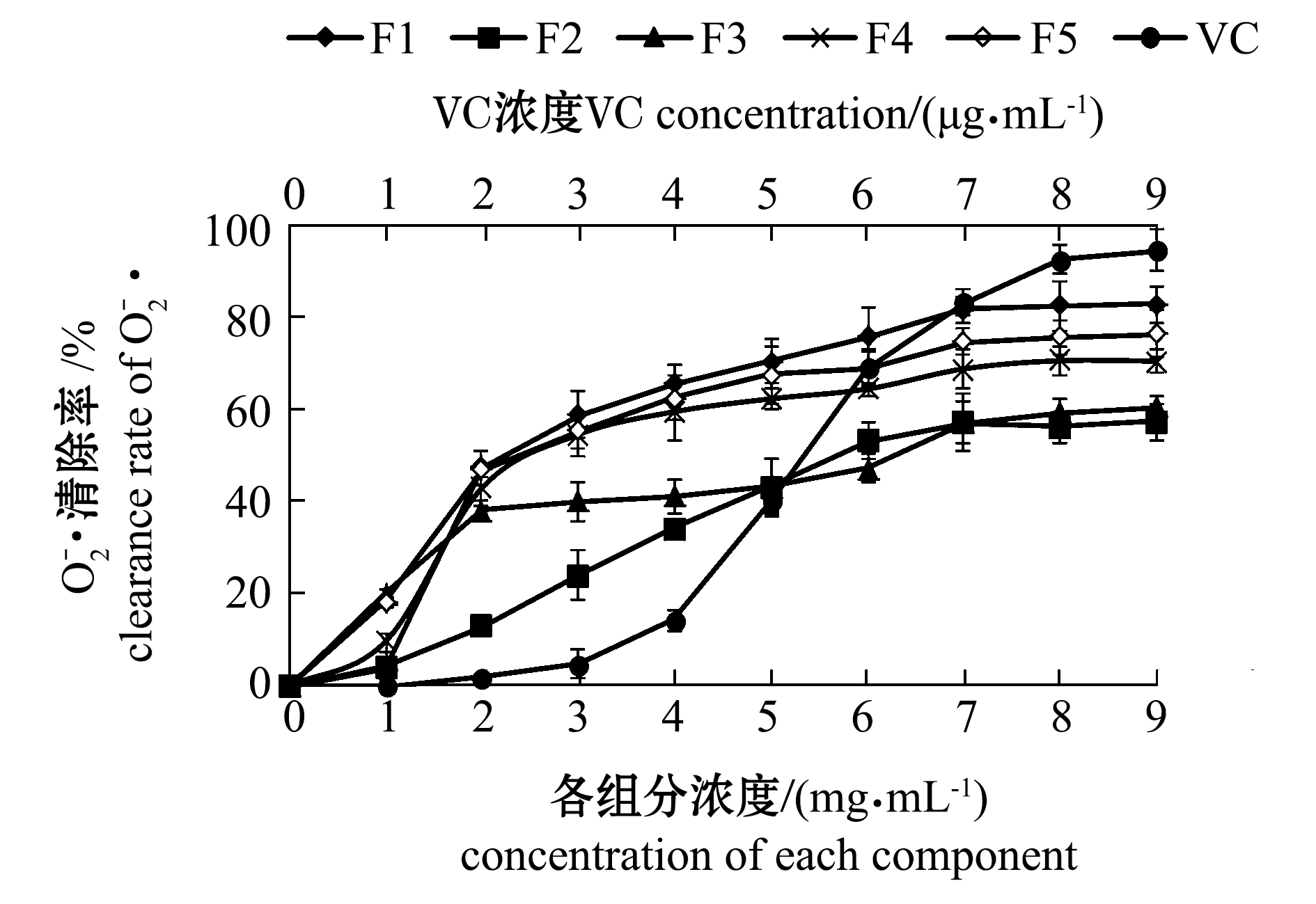
图8 褐藻聚糖硫酸酯各组分对超氧阴离子的清除作用
Fig.8 Scavenging effects of fucoidan fractions on ![]()
张婷等[21]采用弱碱性阴离子树脂分离海带褐藻聚糖硫酸酯,当上样液的pH约为 7.0、操作流速为1.5 mL/min时,采用纯水、0.5 mol/L NaCl、1 mol/L NaCl溶液分部洗脱,共得到两个组分,分离效果一般,且筛选树脂类型仅为弱碱性阴离子树脂,而本试验中选取了强碱性和弱碱性阴离子树脂,以及大孔树脂共11种进行筛选,研究更加系统和全面,且分离出5个组分。
本研究中,由静态吸附试验和动态洗脱试验得到的各组数据可知,采用弱碱性阴离子交换树脂D315,在pH为8.0的条件下分离纯化褐藻聚糖硫酸酯粗品效果最好。分离纯化共得到5个组分,最大得率为17.21%,多糖含量最高为69.95%,硫酸根含量最高为21.72%。钱垂文等[22]采用DEAE-Sepharose Fast Flow弱阴离子交换层析的方法对裙带菜褐藻聚糖硫酸酯粗提取物进行分离纯化,共得到两个纯化组分,其组分的多糖最高含量为31.06%,均明显低于本试验分离得到的5个组分,但其组分UPPS-2.2的硫酸基团含量为26.33,要高于本研究最高组分硫酸基团的含量(21.72%),这可能是由于采用不同分离方法所得到的组分有所差异。张海霞等[23]研究表明,马尾藻褐藻多糖硫酸酯中主要含有甘露糖、半乳糖、岩藻糖。姜龙等[24]纯化树皮藻岩藻聚糖硫酸酯得到的4个组分中,主要由岩藻糖和半乳糖组成。于龙等[25]从北大西洋瓜参体壁中提取岩藻聚糖硫酸酯,其单糖组成为岩藻糖、半乳糖、氨基葡萄糖、氨基半乳糖,物质的量比为1∶0.22∶0.07∶0.07。本试验中裙带菜袍子叶分离纯化后共得到5个组分,主要由岩藻糖和半乳糖组成,其中F1组分的岩藻糖含量最高,F5 组分的半乳糖含量最高,本研究结果的单糖组成与上述文献结果一致,但具体含量有所差异。
许瑞波等[26]通过超声法提取的裙带菜粗多糖对于·OH和![]() 的IC50值分别为23.31、16.50 mg/mL,均明显高于本研究分离纯化组分多糖的IC50最大值4.40、9.24 mg/mL,说明经过树脂D315分离纯化后的多糖仍保持较强的抗氧化活性。Je等[27]研究结果显示,褐藻聚糖硫酸酯对于·OH的清除能力强于对
的IC50值分别为23.31、16.50 mg/mL,均明显高于本研究分离纯化组分多糖的IC50最大值4.40、9.24 mg/mL,说明经过树脂D315分离纯化后的多糖仍保持较强的抗氧化活性。Je等[27]研究结果显示,褐藻聚糖硫酸酯对于·OH的清除能力强于对![]() 的清除能力,这与本试验结果一致。Ajisaka等[28]发现,硫酸基团的增加并不能导致抗氧化活性增加,本试验结果也证明了这点。而De Souza等[29]发现,墨角藻Fucus vesiculosus中的褐藻聚糖硫酸酯的抗氧化活性和硫酸基含量呈正相关,这可能是海藻的种类及提取分离工艺不同而产生的差别。本试验中分离纯化得到的各组分多糖的抗氧化活性显示出与多糖含量的正相关关系,且与其中的单糖组成有一定关系,半乳糖和岩藻糖含量高的多糖其抗氧化活性较强,即各组分多糖的抗氧化活性与半乳糖和岩藻糖含量也呈正比关系。
的清除能力,这与本试验结果一致。Ajisaka等[28]发现,硫酸基团的增加并不能导致抗氧化活性增加,本试验结果也证明了这点。而De Souza等[29]发现,墨角藻Fucus vesiculosus中的褐藻聚糖硫酸酯的抗氧化活性和硫酸基含量呈正相关,这可能是海藻的种类及提取分离工艺不同而产生的差别。本试验中分离纯化得到的各组分多糖的抗氧化活性显示出与多糖含量的正相关关系,且与其中的单糖组成有一定关系,半乳糖和岩藻糖含量高的多糖其抗氧化活性较强,即各组分多糖的抗氧化活性与半乳糖和岩藻糖含量也呈正比关系。
[1] 王彩,施松善,王顺春.裙带菜多糖研究进展[J].时珍国医国药,2010,21(1):206-208.
[2] 韩玲,张淑平,刘晓慧.海藻生物活性物质应用研究进展[J].化工进展,2012,31(8):1794-1800.
[3] 李红艳,王颖,刘天红,等.裙带菜孢子叶营养成分分析及品质评价[J].南方农业学报,2018,49(9):1821-1826.
[4] 刘山,李冬梅,许喆,等.裙带菜孢子叶多糖体外降血脂活性的研究[J].食品工业,2016,37(11):177-179.
[5] 王鸿,张甲生,严银春,等.褐藻岩藻多糖生物活性研究进展[J].浙江工业大学学报,2018,46(2):209-215.
[6] Athukorala Y,Jung W K,Vasanthan T,et al.An anticoagulative polysaccharide from an enzymatic hydrolysate of Ecklonia cava[J].Carbohydrate Polymers,2006,66(2):184-191.
[7] 李鸶鸶,汪秋宽,何云海,等.多肋藻岩藻聚糖硫酸酯的提取及其降血脂作用研究[J].大连海洋大学学报,2013,28(1):94-98.
[8] Ahn J H,Yang Y I,Lee K T,et al.Dieckol,isolated from the edible brown algae Ecklonia cava,induces apoptosis of ovarian cancer cells and inhibits tumor xenograft growth[J].Journal of Cancer Research and Clinical Oncology,2015,141(2):255-268.
[9] ChoiH J,Park J H,Lee B H,et al.Suppression of NF-κB by dieckol extracted from Ecklonia cava negatively regulates LPS induction of inducible nitric oxide synthase gene[J].Applied Biochemistry and Biotechnology,2014,173(4):957-967.
[10] KimK B W R,Jung J Y,Cho J Y,et al.Lipase inhibitory activity of ethyl acetate fraction from Ecklonia cava extracts[J].Biotechnology and Bioprocess Engineering,2012,17(4):739-745.
[11] Ahn G N,Kim K N,Cha S H,et al.Antioxidant activities of phlorotannins purified from Ecklonia cava on free radical scavenging using ESR and H2O2-mediated DNA damage[J].European Food Research and Technology,2007,226(1-2):71-79.
[12] Heim G,O’Doherty J V,O’Shea C J,et al.Maternal supplementation of seaweed - derived polysaccharides improves intestinal health and immune status of suckling piglets[J].Journal of Nutritional Science,2015,4:e27.
[13] Lee K W,Jeong D,Na K.Doxorubicin loading fucoidan acetate nanoparticles for immune and chemotherapy in cancer treatment[J].Carbohydrate Polymers,2013,94(2):850-856.
[14] 张雪迪,宋悦凡,汪秋宽,等.苷苔岩藻聚糖硫酸酯分离纯化及结构研究[J].大连海洋大学学报,2017,32(6):740-746.
[15] 宫江宁,吴晓涵.D101树脂分离纯化龙胆草多糖的工艺研究[J].贵州师范大学学报:自然科学版,2018,36(5):79-84.
[16] 郭峰君,胡靖,赵雪.海带岩藻聚糖硫酸酯降解及基本结构分析[J].食品工业科技,2014,35(18):93-97.
[17] 刘玉凤,贾淑颖,刘飞飞,等.不同取代度的硫酸化肠浒苔多糖抗氧化活性研究[J].食品工业科技,2016,37(19):142-147,152.
[18] 彭雍博,宋悦凡,武龙,等.厚叶海带岩藻聚糖硫酸酯分离纯化及其体外肿瘤抑制活性研究[J].食品工业科技,2017,38(17):283-287.
[19] 刘旭,曲桂燕,周裔彬,等.泡叶藻及海带藻渣中岩藻聚糖硫酸酯的提取及其抗氧化活性[J].海洋科学,2013,37(12):34-39.
[20] 王晓楠,王茂剑,张健,等.8种海藻和3类海带的色素抗氧化活性的研究[J].食品工业科技,2018,39(3):65-70.
[21] 张婷,汪秋宽,刘建伟,等.用弱碱性阴离子树脂分离纯化海带岩藻聚糖硫酸酯工艺的研究[J].大连水产学院学报,2008,23(2):153-156.
[22] 钱垂文,张志东,王一飞.裙带菜酸性多糖的分离纯化与鉴定[J].食品与发酵工业,2010,36(11):161-165.
[23] 张海霞,汪秋宽,何云海,等.马尾藻褐藻多糖硫酸酯的分离纯化及结构研究[J].大连海洋大学学报,2016,31(5):559-562.
[24] 姜龙,宋悦凡,罗宣,等.树皮藻岩藻聚糖硫酸酯的纯化及其化学结构研究[J].大连海洋大学学报,2017,32(1):73-78.
[25] 于龙,薛长湖,宿玮,等.北大西洋瓜参岩藻聚糖硫酸酯分离纯化及结构分析[J].食品科学,2012,33(19):83-87.
[26] 许瑞波,周洪英,巩建龙,等.盐渍裙带菜多糖的超声提取工艺及生物活性研究[J].食品科学,2012,33(24):101-106.
[27] Je J Y,Park P J,Kim E K,et al.Antioxidant activity of enzymatic extracts from the brown seaweed Undaria pinnatifida by electron spin resonance spectroscopy[J].LWT-Food Science and Technology,2009,42(4):874-878.
[28] Ajisaka K,Yokoyama T,Matsuo K.Structural characteristics and antioxidant activities of fucoidans from five brown seaweeds[J].Journal of Applied Glycoscience,2016,63(2):31-37.
[29] De Souza M C R,Marques C T,Dore C M G,et al.Antioxidant activities of sulfated polysaccharides from brown and red seaweeds[J].Journal of Applied Phycology,2007,19(2):153-160.