在自然界中,光是影响生物体生长、发育的重要环境因子之一,其包括光周期、光质和光强三要素。已有研究表明,由于光在水域中的分布和鱼类栖息环境等特点,不同光色会对鱼类诸多生理特性产生影响,如生长、发育、繁殖、行为等[1-3]。不同深度的水层光谱的分布不同,在较浅海域以红色光为主导,随着海水深度的增加,入射光会快速衰减,蓝光占据主体地位。此外,鱼类会根据周围环境调整其感光敏感度,在不同光色下长期生活的鱼类,已经适应了其栖息环境。因此,生活在不同深度海域的鱼类对光环境的选择具有种属特异性[4]。对鱼类的研究发现,由于栖息地环境特点及自身特定的视觉功能差异,不同光谱会对其诸多生理特性产生影响[5]。研究表明,蓝色光和绿色光对硬骨鱼类大西洋鲑Salmon salar的褪黑素形成有抑制作用。但同时也有研究表明,光对硬骨鱼类欧洲舌齿鲈Dicentrauchus labrar和北大西洋鳕Melanogrammus aeglefinus褪黑素形成的影响未有明确的结论[6]。
在工业化生产中,许多地区正在为养鱼业开发二极管(LED),LED具有发光效率高、耗电量少、安全可靠性强、环保等优点。近年来,LED照明在水产养殖领域的应用也逐渐增多,其优势得到了广泛认可。LED灯具与光特性的结合必将促进水产养殖业的健康发展。有研究表明,光谱对鱼类生长有影响,如蓝色和绿色光可促进条斑星鲽Verasper moseri 的生长,但红色光却对其产生抑制作用[7]。也有报道表明,蓝色和绿色光对北大西洋鳕[6]和石斑鱼Epinephelu ssp.[8]的生长有促进作用。红鳍东方鲀Takifugu rubripes是中国、日本、韩国等国家养殖最为广泛的水产动物之一,具有较大的商业价值。然而,光谱对红鳍东方鲀仔稚鱼生长、发育影响的研究几乎未见报道。本试验中研究了光谱(LED单色光)对室内养殖红鳍东方鲀仔稚鱼体长、体质量,以及生长激素基因GH(Growth hormone)、生长激素受体1型基因GHR1(Growth hormone receptor 1)、类胰岛素生长因子1型基因IGF1(Insulin-like growth factor 1)、生长激素释放激素1型基因GHRH1(Growth hormone-relasing hormone 1)和生长激素抑制激素1型基因SS1(Somatostatin 1)表达量的影响,以期为室内养殖红鳍东方鲀提供理论支持。
1 材料与方法
1.1 材料
红鳍东方鲀受精卵购自大连天正实业有限公司。
1.2 方法
1.2.1 试验设计及饲养管理 红鳍东方鲀受精卵在设施渔业教育部重点实验室孵化,按其生长时期分别投喂轮虫(约10 ind./mL)、卤虫(约5 ind./mL),每2天换水一次,每次换水50%。选取200尾14日龄体质量为(1.86±0.48)mg、体长为(4.09±0.39)mm的红鳍东方鲀仔鱼用于试验,分养于圆形桶(直径80 cm、水深50 cm)中。微曝气,水温控制在22 ℃,海水盐度为31~32,pH为7.5±0.1,光周期为16L∶8D,光辐射照度为200 mW/m2,试验为期22 d。
试验共设5种LED光谱处理组,分别为白光(λ400~780 nm)、蓝光(λ450~455 nm)、绿光(λ525~530 nm)、黄光(λ590~595 nm)和红光(λ625~630 nm),每组设两个平行,试验在室内10个圆形桶中进行,每桶投放200尾个体大致相同的仔稚鱼。试验期间,为避免自然光干扰,均用遮光布遮挡。为保持光强的稳定性,每天8:00测定光照强度,试验开始前24 h停止投喂,测量仔稚鱼体长、体质量作为初始值。分别在第12天、第22天取样,每个平行取30尾仔稚鱼,其中10尾用于测定体长和体质量,其余20尾用液氮速冻后并保存于冰箱(-80 ℃)中用于基因表达量的测定。
1.2.2 总RNA的提取和生长相关基因表达量的测定 将冻存样品鱼取出后,按照UNIQ-10柱式Trizol总RNA抽提试剂盒的操作说明进行总RNA的提取。利用微量分光光度计(SMA4000,merinton)所测定的RNA样品OD260 nm及OD280 nm值确定其浓度,根据 OD260 nm/OD280 nm 的比值判断总RNA 纯度。用15 g/L琼脂糖凝胶电泳检测RNA 质量。
根据 RevertAid Premium Reverse Transcriptase试剂盒操作说明,将提取的总 RNA 进行反转录扩增获得 cDNA。反转录产物于-20 ℃下保存备用。使用Light Cycler 480 Ⅱ(Roche罗氏)仪器和 SG Fast qPCR Master Mix(2X)(BBI,Roche罗氏)试剂盒进行Real-timequantitative PCR 试验。根据GenBank中的cDNA全序列设计特异性引物,GHR1、IGF1、GHRH、SS1、GH基因引物序列参考Kim等[9]的研究(表1)。PCR反应条件为:95 ℃下预变性 3 min;95 ℃下变性 3 s,60 ℃下退火/延伸 30 s,共进行45 个循环;试验结束后对溶解曲线进行分析。所有PCR过程中,每个RNA样品均设3个重复,采用RT-qPCR (2-ΔΔCt)相对荧光定量法[10]对生长相关基因表达量进行计算。
表1 Real-time PCR 引物序列
Tab.1 Primer sequences for Real-time quantitative PCR

基因gene序列(5′~3′)sequence(5′-3′)基因文库序列号GenBank accession No.GHF: CTCATCAAGGCCAGTCAGGATR: CTCCACCTTGTGCATGTCCTXM_003968318 GHR1F: TTGGGTCAACACGGACTTCTR: CTTCAGGATCTTTTGCCTTCTTXM_011615550.1IGF1F:GGCAAACAGCGTGAATGAGR:TCAACACGGAAGCCAGGAAB465576.1SS1F:GGGCAACAAACAGGAAATGAR:CTCTCGGGGAGTGAGGAAAGXM_003968318GHRHF:ACAGCGTCATCTGCTCACCTR:CTGCGTGTCTTTCCGTTCTTDQ65933β-actinF:AGAGGGAAATCGTGCGTGACR:GAGGAAGGAAGGCTGGAAAAGXM_003964421.2
1.3 数据处理
试验数据均以平均值±标准误(means±S.E.)表示,采用SPSS 17.0软件进行单因素方差分析(One-Way ANOVE),采用Duncan多重比较法检验不同处理组间基因表达量的差异,显著性水平设为0.05。
2 结果与分析
2.1 LED光谱对红鳍东方鲀仔稚鱼体长、体质量及存活的影响
从表2可见:经过LED光谱处理后对红鳍东方鲀仔稚鱼体长、体质量有显著的影响;蓝光、黄光组体长显著高于绿光组(P<0.05),但白光组与这3组间无显著性差异(P>0.05);黄光组仔稚鱼的体质量显著高于蓝光、绿光、白光组(P<0.05)。在试验第12天时,红光下仔稚鱼在取样后存活个体极少,其他光色组也有死亡现象,但相对于红光组死亡较少。在试验第22天时,各光色组存活个体依次为黄光组>蓝光组>白光组>绿光组。
表2 LED光谱对红鳍东方鲀体长、体质量的影响(22 d)
Tab.2 Effects of LED spectra on body length and body weight of tiger puffer Takifugu rubripes(22 d)

光谱 spectrum体长 body length/mm 体质量 body weight/g 蓝光 blue绿光 green黄光 yellow白光 white10.538 ±0.562a7.850 ±0.495b11.985±1.372a9.700±0.478ab0.037± 0.007b0.022± 0.004b0.124 ±0.05a0.032±0.003b
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note: The means with different letters within the same column are significant differences in different group at the 0.05 probability level, and the means with the same column are not significant differences
2.2 不同发育时期GH基因表达变化
从图1可见:第12天时,红光组GH基因的相对表达量最高,且显著高于蓝光、黄光、白光组(P<0.05),蓝光组GH基因的表达量最低,但与绿光、黄光、白光组间无显著性差异(P>0.05);第22天时,绿光组GH基因表达量与白光组无显著性差异(P>0.05),但显著高于蓝光、黄光组(P<0.05)。
2.3 不同发育时期GHR1基因表达变化
从图2可见:第12天时,绿光组GHR1基因相对表达量最高,且显著高于其他光色组(P<0.05),黄光组GHR1基因表达量显著高于白光组(P<0.05),但黄光、白光组与蓝光、红光组间无显著性差异(P>0.05);第22天时,绿光组GHR1基因相对表达量最高,但各光色处理组间均无显著性差异(P>0.05)。
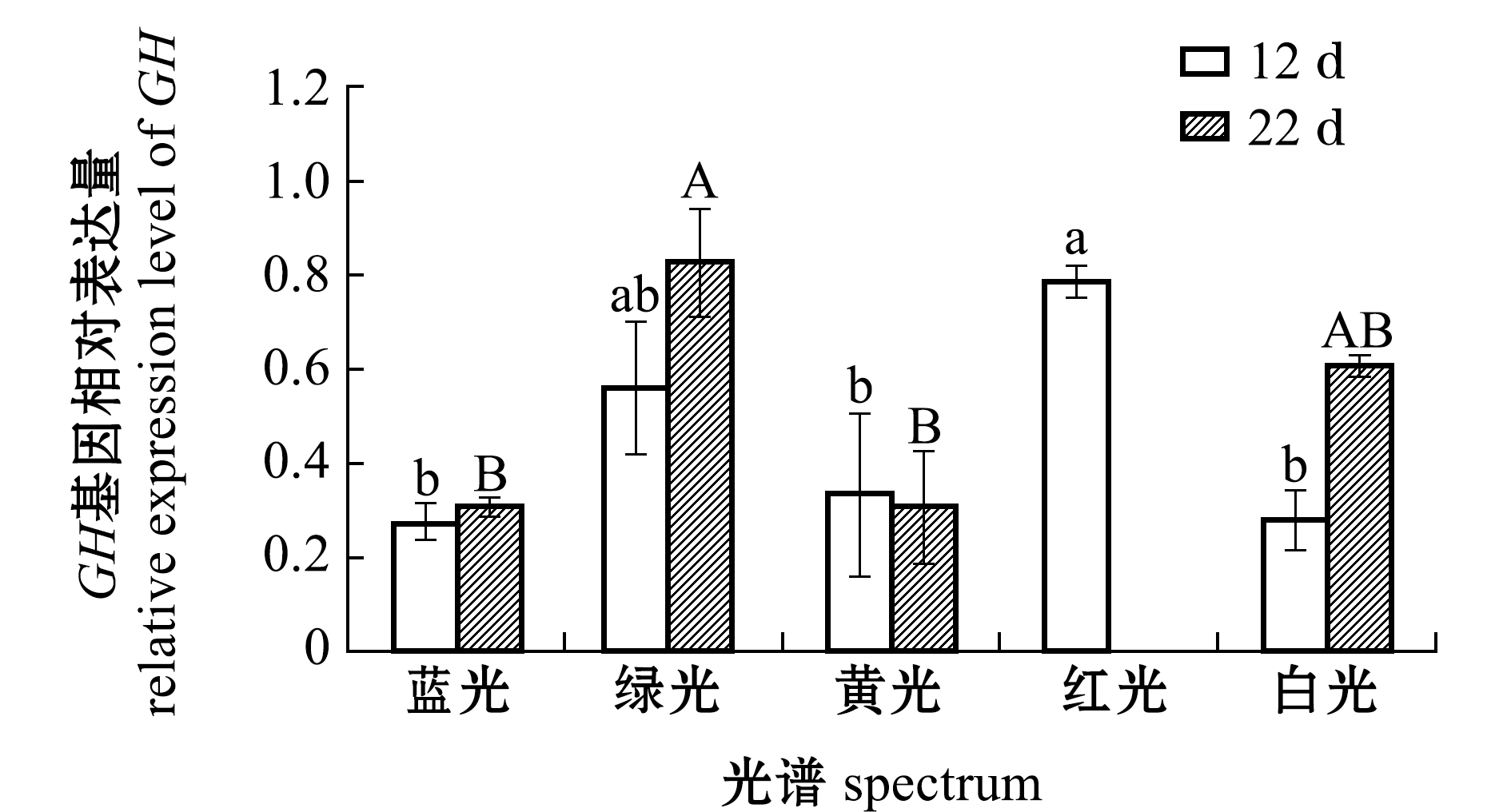
注:标有不同小写、大写字母者分别表示12 d和22 d时不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note: The means with different lowercase and uppercase letters are significant differences in different groups at 12 d and 22 d at the 0.05 probability level, respectively, and the means with the same letters are not significant differences, et sequentia
图1 12 d和22 d时光谱对红鳍东方鲀GH基因相对表达水平的影响
Fig.1 Effect of spectrum on the relative expression level of GH gene in tiger puffer Takifugu rubripes exposed to various spectra for 12 d and 22 d
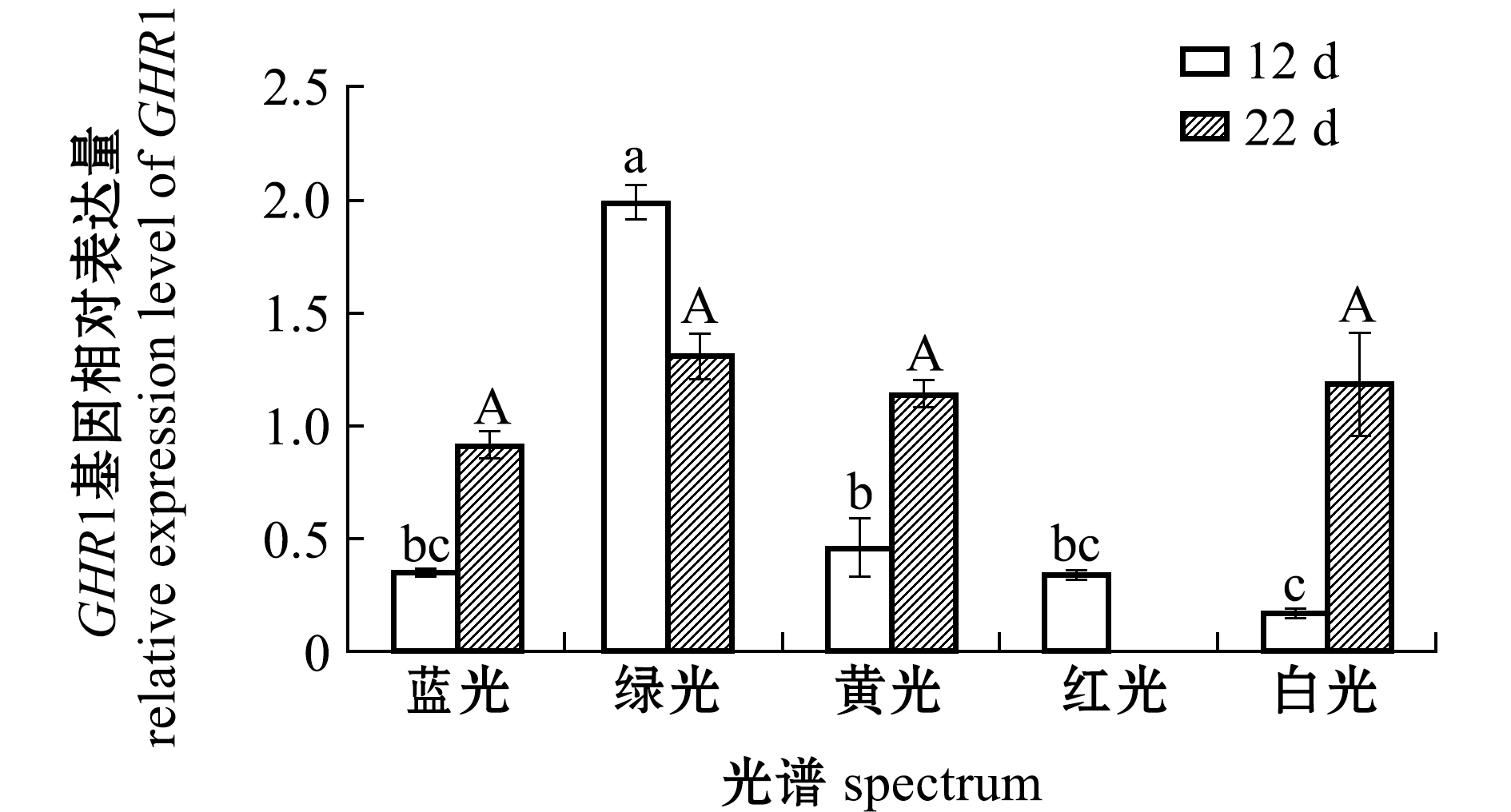
图2 12 d 和22 d时光谱对红鳍东方鲀GHR1基因相对表达水平的影响
Fig.2 Effect of spectrum on the relative expression level of GHR1 gene in tiger puffer Takifugu rubripes exposed to various spectra for 12 d and 22 d
2.4 不同发育时期IGF1基因表达变化
从图3可见:第12天时,绿光、黄光、红光各组仔稚鱼的IGF1基因相对表达量均显著高于白光组(P<0.05),但这3种光色处理组的表达量间无显著性差异(P>0.05),白光组IGF1基因表达量最低,且显著低于蓝光组(P<0.05);第22天时,绿光组仔稚鱼IGF1基因表达量显著高于其他光色组(P<0.05),黄光和白光处理组IGF1基因表达量也较高,均显著高于蓝光组(P<0.05),但黄光组与白光组间无显著性差异(P>0.05)。
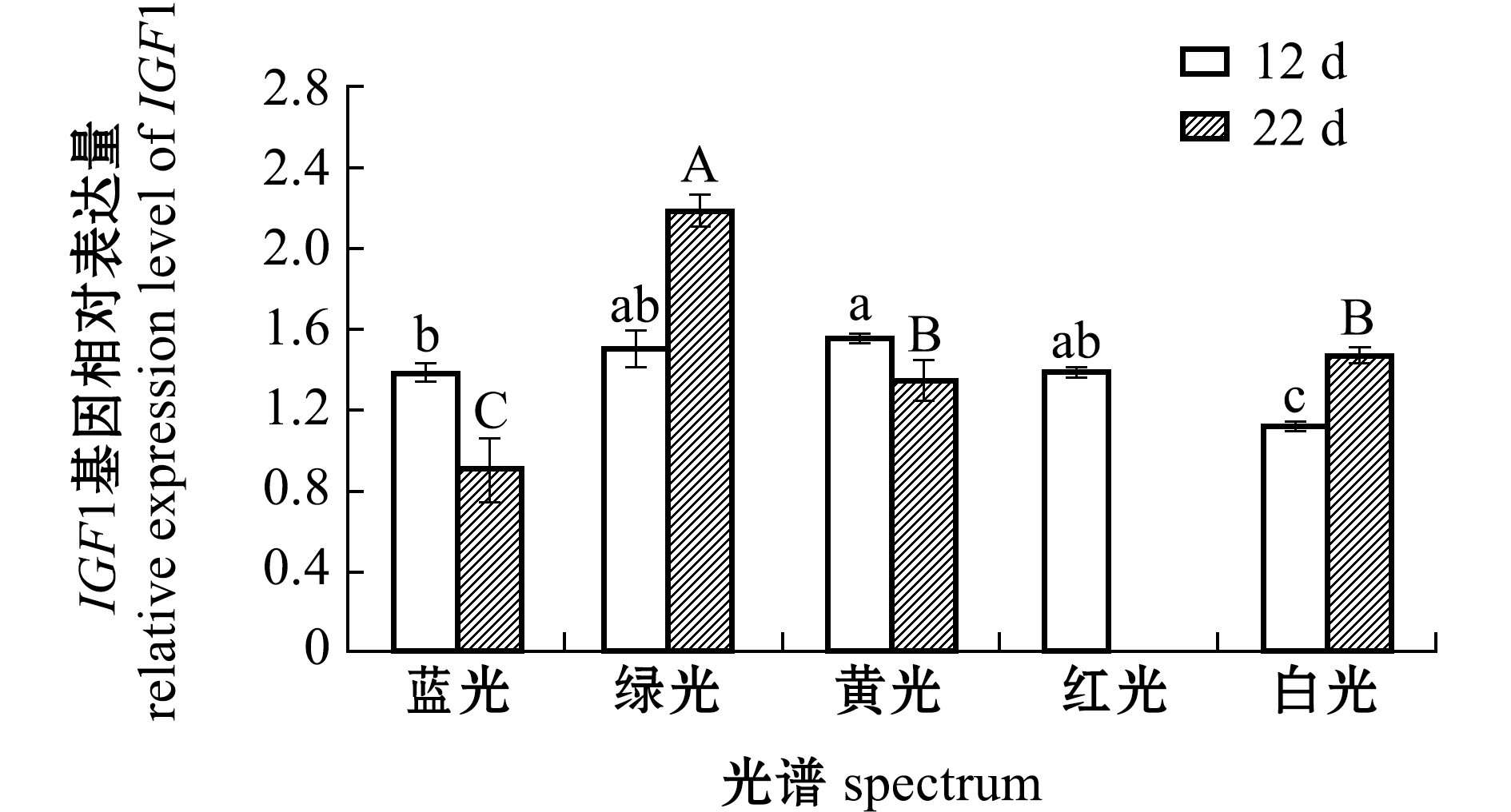
图3 12 d和22 d时光谱对红鳍东方鲀IGF1基因相对表达水平的影响
Fig.3 Effect of spectrum on the relative expression level of IGF1 gene in tiger puffer Takifugu rubripes exposed to various spectra for 12 d and 22 d
2.5 不同发育时期GHRH1基因表达变化
从图4可见:第12天时,绿光组仔稚鱼GHRH1基因表达量最高,且显著高于蓝光、黄光、白光组(P<0.05),但与红光组间无显著性差异(P>0.05),红光组GHRH1基因表达量也较高,且显著高于黄光和白光组P<0.05),白光组表达量最低(P<0.05);第22天时,白光组仔稚鱼GHRH1基因表达量较高,各组间表达量均无显著性差异(P>0.05)。
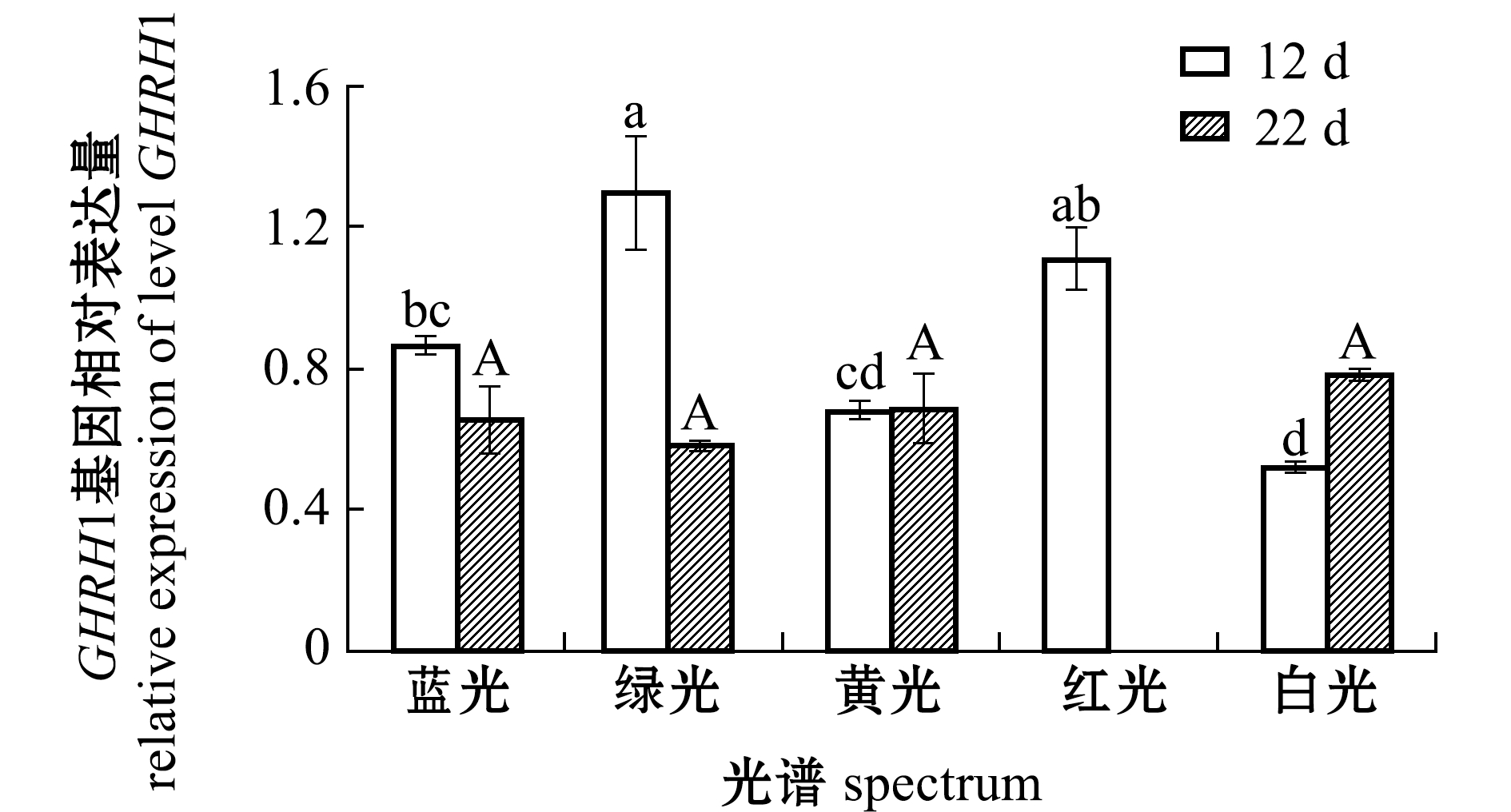
图4 12 d和22 d时光谱对红鳍东方鲀GHRH1基因相对表达水平的影响
Fig.4 Effect of spectrum on the relative expression level of GHRH1 gene in tiger puffe Takifugu rubripes exposed to various spectra for 12 d and 22 d
2.6 不同发育时期SS1基因表达变化
从图5可见:第12天时,红光组仔稚鱼SS1基因表达量显著高于其他光色组(P<0.05),蓝光SS1基因表达量与绿光、白光组无显著性差异(P>0.05),但与黄光组间有显著性差异(P<0.05),黄光组SS1基因表达量最低;第22天时,黄光组仔稚鱼SS1基因表达量显著高于其他光色组(P<0.05),蓝光组与白光组显著高于绿光组(P<0.05),但蓝光组和白光组间无显著性差异(P>0.05)。
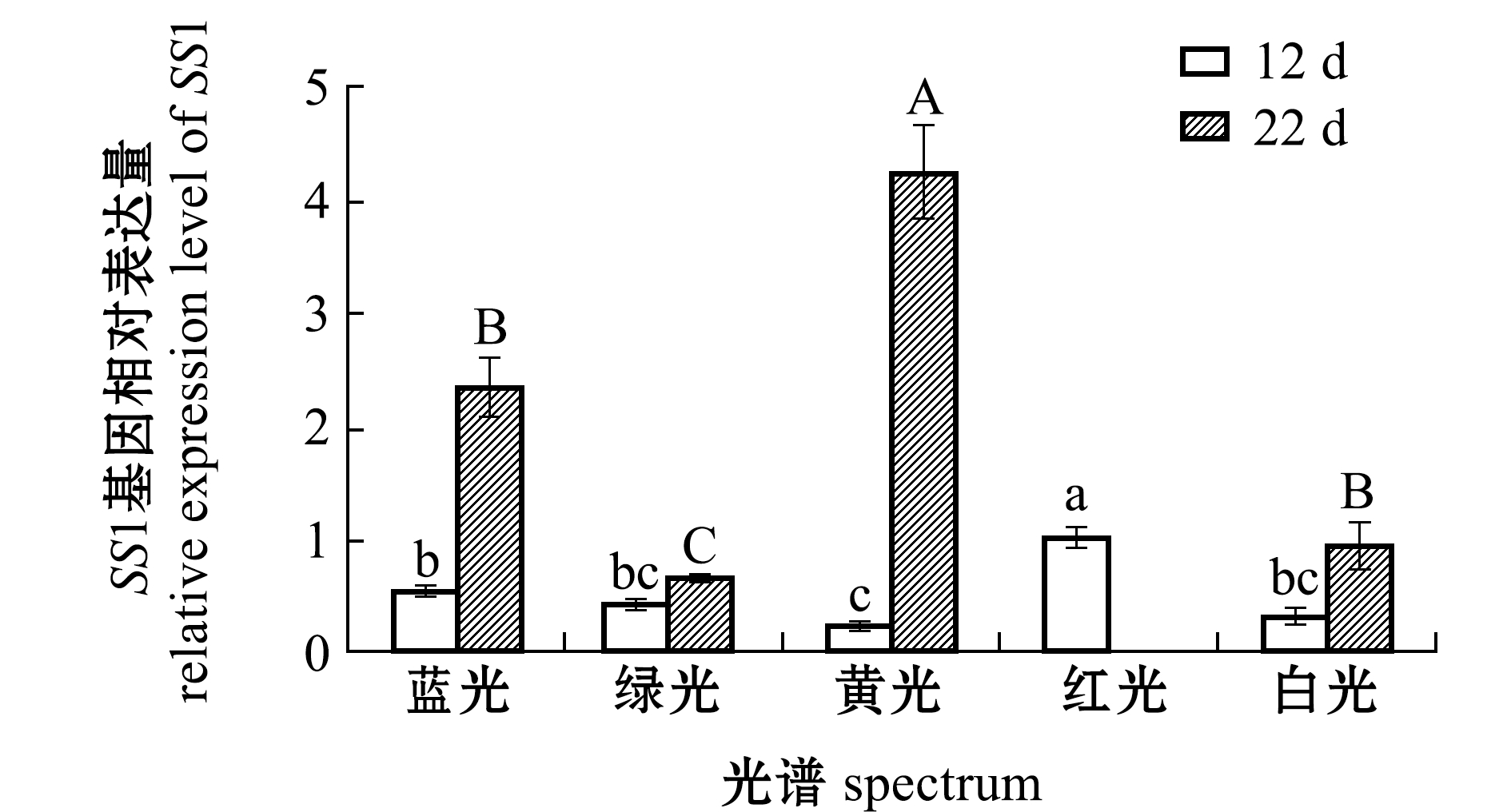
图5 12 d和22 d时光谱对红鳍东方鲀SS1基因相对表达水平的影响
Fig.5 Effect of spectrum on the relative expression level of SS1 gene in tiger puffe Takifugu rubripes exposed to various spectra for 12 d and 22 d
3 讨论
3.1 光谱对红鳍东方鲀仔稚鱼生长的影响
近年来,光谱对鱼类生长发育、繁殖、行为等影响的研究逐渐增多[11-13]。Villamizar等[14]研究表明,欧洲舌齿鲈仔稚鱼在蓝光下体长、体质量增加较多,而红光和蓝光生长则较缓慢。Ruchin[15]研究表明,蓝色光谱对虹鳉Poeoilia reticulata的生长有促进作用。本研究表明,红鳍东方鲀仔稚鱼在黄光下体长和体质量比其他光色下增加较多,蓝光次之,这与Villamizar等[14]的研究结果一致。但Karakatasouli等[16]研究指出,蓝光会抑制虹鳟Oncorhynchus mykiss的生长,并伴随着葡萄糖的减少和多巴胺的增加。这说明光谱对鱼类生长发育的影响具有种属特异性。
3.2 光谱对红鳍东方鲀仔稚鱼生长相关基因表达量的影响
在非哺乳脊椎动物中,光信号通过神经通路从视网膜传递到松果体,这些信号控制着各种激素的分泌[17-20]。脊椎动物垂体释放的生长激素(GH)具有促进生长的作用,而GH的分泌主要是由生长激素释放激素(GHRH)和生长激素抑制激素(SS)控制。这两种调节激素GHRH和SS具有相反的作用功能:GHRH增强体内和体外垂体GH的释放,而SS抑制其在许多硬骨鱼类中的分泌[21]。本研究中,红光处理下的红鳍东方鲀仔稚鱼在第12 天时 SS1基因表达量明显高于其他光色组,这与Kim等[9]的光谱对红鳍东方鲀生长的影响研究结果相一致,其研究中红色光下SS1基因表达量比蓝光、绿光处理下的相对表达量高,但红色光下未出现死亡情况。本试验中红鳍东方鲀仔稚鱼身体各部位尚未发育完全,对外界红光环境刺激反应较大,无法正常生长,故出现大量死亡现象。在第12 天时黄色光处理下,SS1基因相对表达量最低,而GHRH1基因黄光组相对表达量与蓝光、白光组无显著性差异,在第12 天时黄光组GH基因相对表达量虽未与蓝光、白光组间有显著性差异,但在第22 天时,黄光组SS1基因表达量显著高于其他光色组。Ayson等[17]分析认为,光谱成分对水生动物的影响因发育阶段的不同而异;Fanjul-Moles等[22]研究表明,龙虾Procambaras clarkii生长发育小于4周时只对蓝光有反应,大于4周时对红光出现反应。已知红鳍东方仔稚鱼在约12 d时,背鳍、尾鳍、臀鳍已经完全分化,此时在黄色光下红鳍东方鲀仔稚鱼生长可能受到抑制,故SS1基因表达量较高,具体原因还有待进一步证实。
对于生长而言,主要的内分泌途径是其中垂体分泌的GH与靶器官表面的生长激素受体(GHR)结合后激发肝脏分泌IGF1(GH-IGF轴)。在目标组织中,IGF1开启了一系列与生长有关的细胞过程,如细胞增殖和分化,最终导致生物体的整体生长[23]。本研究中,在第12天时,在红光、绿光、黄光、蓝光下IGF1基因相对表达量无显著性差异,在第22天时,绿色光谱下IGF1基因表达量显著高于其他光色组,但在体长、体质量上未表现出生长优势。本试验过程中还发现,红光、绿光下红鳍东方鲀仔稚鱼出现大量死亡现象,在第22天时,红光下仔稚鱼几乎无存活个体。本研究中,黄光条件下可促进红鳍东方鲀仔稚鱼早期生长、发育,虽然红、绿光条件下也有促进生长的迹象,但是出现大量死亡,证明并不适合红鳍东方鲀仔稚鱼的存活。所以,建议在红鳍东方鲀养殖场育苗过程中,使用黄色光谱会更有利于仔稚鱼的生长发育,关于光谱对其生长内分泌系统的影响机制还有待进一步研究。
[1] Bayarri M J,Madrid J A,Sánchez-Vázquez F J.Influence of light intensity,spectrum and orientation on sea bass plasma and ocular melatonin[J].Journal of Pineal Research,2002,32(1):34-40.
[2] Downing G.Impact of spectral composition on larval haddock,Melanogrammus aeglefinus L.,growth and survival[J].Aquaculture Research,2010,33(4):251-259.
[3] Naor A,Segev N,Bressler K,et al.The influence of the pineal organ and melatonin on the reproductive system and of light intensity and wavelength on melatonin in the gilthead sea bream (Sparus aurata)[J].Israeli Journal of Aquaculture,2003,55:230.
[4] Kusmic C,Gualtieri P.Morphology and spectral sensitivities of retinal and extraretinal photoreceptors in freshwater teleosts[J].Micron,2000,31(2):183-200.
[5] 高霄龙.光照对皱纹盘鲍生长、行为、生理的影响及其机制研究[D].青岛:中国科学院海洋研究所,2016.
[6] Vera L M,Davie A,Taylor J F,et al.Differential light intensity and spectral sensitivities of Atlantic salmon,European sea bass and Atlantic cod pineal glands ex vivo[J].General and Comparative Endocrinology,2010,165(1):25-33.
[7] Yamanome T,Mizusawa K,Hasegawa E I,et al.Green light stimulates somatic growth in the barfin flounder Verasper moseri[J].Journal of Experimental Zoology Part A:Ecological Genetics and Physiology,2009,311(2):73-79.
[8] Shin H O,Hoe M A,Heo G.The effect of LED light wavelength on the growth of fingerling Sebastes inermis[J].Journal of the Korean Society of Fisheries Technology,2015,51(2):179-187.
[9] Kim B H,Hur S P,Hur S W,et al.Relevance of light spectra to growth of the rearing tiger puffer Takifugu rubripes[J].Development & Reproduction,2016,20(1):23-29.
[10] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J].Methods,2001,25(4):402-408.
[11] Volpato G L,Barreto R E.Environmental blue light prevents stress in the fish Nile tilapia[J].Brazilian Journal of Medical and Biological Research,2001,34(8):1041-1045.
[12] Volpato G L,Bovi T S,De Freitas R H A,et al.Red light stimulates feeding motivation in fish but does not improve growth[J].PLoS One,2013,8(3):e59134.
[13] Bapary M A J,Amin M N,Takeuchi Y,et al.The stimulatory effects of long wavelengths of light on the ovarian development in the tropical damselfish,Chrysiptera cyanea[J].Aquaculture,2011,314(1-4):188-192.
[14] Villamizar N,García-Alcazar A,Sánchez-Vázquez F J.Effect of light spectrum and photoperiod on the growth,development and survival of European sea bass (Dicentrarchus labrax) larvae[J].Aquaculture,2009,292(1-2):80-86.
[15] Ruchin A B.Influence of colored light on growth rate of juveniles of fish[J].Fish Physiology and Biochemistry,2004,30(2):175-178.
[16] Karakatsouli N,Papoutsoglou S E,Pizzonia G,et al.Effects of light spectrum on growth and physiological status of gilthead seabream Sparus aurata and rainbow trout Oncorhynchus mykiss reared under recirculating system conditions[J].Aquacultural Engineering,2007,36(3):302-309.
[17] Ayson F G,Takemura A.Daily expression patterns for mRNAs of GH,PRL,SL,IGF-I and IGF-Ⅱ in juvenile rabbitfish,Siganus guttatus,during 24-h light and dark cycles[J].General and Comparative Endocrinology,2006,149(3):261-268.
[18] Hur S P,Takeuchi Y,Esaka Y,et al.Diurnal expression patterns of neurohypophysial hormone genes in the brain of the threespot wrasse Halichoeres trimaculatus[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2011,158(4):490-497.
[19] Iigo M,Furukawa K,Hattori A,et al.Ocular melatonin rhythms in the goldfish,Carassius auratus[J].Journal of Biological Rhythms,1997,12(2):182-192.
[20] Revel F G,Saboureau M,Masson-Pévet M,et al.Kisspeptin mediates the photoperiodic control of reproduction in hamsters[J].Current Biology,2006,16(17):1730-1735.
[21] Canosa L F,Chang J P,Peter R E.Neuroendocrine control of growth hormone in fish[J].General and Comparative Endocrinology,2007,151(1):1-26.
[22] Fanjul-Moles M L,Miranda-Anaya M,Fuentes-Pardo B.Effect of monochromatic light upon the ergcrcadian rhythm during ontogeny in crayfish (Procambarus clarkii)[J].Comparative Biochemistry and Physiology Part A:Physiology,1992,102(1):99-106.
[23] 万蓁蓁.红鳍东方鲀幼体发育和消化生理的研究[D].青岛:中国海洋大学,2005.