传染性胰脏坏死病毒(Infectious pancreatic necrosis virous,IPNV)隶属于双RNA病毒科Birnaviridae、水生双RNA病毒属Aquabirnavirus,可引起严重的鱼类急性传染病[1]。该病主要危害鲑鳟幼鱼,也可造成成年鲑鳟和许多其他鱼类严重的急性感染,流行范围遍及亚洲、欧洲、美洲各国[2]。IPNV病毒颗粒直径约为65 nm,是裸露的单壳二十面体,其基因组包含由A和B两个片段组成的线性双链RNA(dsRNA)分子[3],A链含有两个开放阅读框(Open Reading Frame,ORF),较小的ORF编码非结构蛋白VP5,较大的ORF编码一个大蛋白,由VP2、VP3和VP4组成[4]。其中,VP2蛋白是IPNV的主要外衣壳蛋白,含有主要的病毒抗原表位,在病毒和细胞受体的识别和整合中起着重要的作用[5]。目前,许多关于IPNV检测[6]、血清学分类[7]和疫苗开发[8]的研究均基于VP2蛋白。
酵母表面展示系统是可以将外源蛋白展示在酵母表面的一种真核细胞表达系统,目的蛋白基因被整合在酵母表达载体中Aga2基因下游后,转化进酵母细胞进行表达,表达的Aga2-目的蛋白融合蛋白在信号肽的作用下会被运送至酵母细胞外。融合蛋白中的Aga2蛋白亚基识别酵母表面的Aga1蛋白亚基,并通过二硫键相结合,从而将与之融合的目的蛋白间接地锚定在酵母细胞表面[9]。由于抗原蛋白展示于细胞表面,且酵母细胞可对表达的外源蛋白进行修饰,使得所表达的蛋白结构更接近天然病毒表面蛋白[10],利用其进行免疫更容易被免疫系统识别。酿酒酵母Saccharomyces cerevisiae是高蛋白单细胞食品级微生物,其细胞壁主要成分β-葡聚糖可增强免疫刺激性,这些优势均使得该酵母展示系统可作为一种开发口服疫苗的工具,弥补了以酿酒酵母菌株YH501只能对IPNV(血清型为WB)VP2蛋白进行菌内表达而非表面展示的不足[11]。
本研究中以中国云南虹鳟养殖场分离的IPNV分离株ChRtm213(血清型Jasper)[12]为研究对象,利用酵母表面展示系统将其VP2蛋白高效展示于酵母细胞表面,旨在为以酵母作为活载体的新型口服疫苗的研制提供科学依据。
1 材料与方法
1.1 材料
大鳞大麻哈鱼胚胎细胞(Chinook salmon embryo cells,CHSE-214)由中国水产科学研究院长江水产研究所鱼类病害教研室曾令兵教授惠赠;酿酒酵母菌株EBY100(Trp-,Leu-)和酵母展示载体pYD1 (Invitrogen Life Technologies,V835-01)由中国水产科学研究院黄海水产研究所黄倢研究员惠赠;鼠抗IPNV VP2蛋白抗体由中国水产科学研究院黑龙江水产研究所养殖室制备。
大肠杆菌E.coli DH5α、克隆载体pMD19-T simple、T4 DNA连接酶、限制性内切酶、DNA Marker DL2000、DL15000购自宝生物工程(大连)有限公司;质粒DNA提取试剂盒、胶回收试剂盒购自OMEGA公司;羊抗鼠IgG抗体H&L(HRP)和羊抗鼠IgG抗体(FITC)购自Abcam公司;其他化学试剂均为分析纯。
1.2 方法
1.2.1 VP2基因克隆及pYD1-VP2载体构建 根据IPNV ChRtm213 VP2基因序列(GenBank accession:KX234591),结合表达载体pYD1多克隆位点设计引物。上游引物VP2-F带有Kpn Ⅰ酶切位点(5′GGTACCAATGAGCACATCCAAGGCAACCGC 3′)下游引物VP2-R带有NotⅠ酶切位点(5′GCGGCCGCTGCCTTTGAGGTTGGTAGGTCAC 3′)引物由哈尔滨博仕生物公司合成。以实验室保存的IPNV ChRtm213 RNA为模板,利用RT-PCR克隆获得VP2基因。将VP2基因连入pMD19-T克隆载体,进行序列测定。将测序完全正确的片段双酶切连入pYD1载体,阳性重组质粒命名为pYD1-VP2。
1.2.2 酵母EBY100感受态细胞的制备 将酿酒酵母菌种接种于YPD固体培养基上,30 ℃下静置培养直至长出饱满湿润的单菌落。挑取单菌落于10 mL YPD液体培养基中培养,于30 ℃下培养至酵母菌液OD600 nm=1~2,4 ℃条件下以3000 r/min离心5 min,在沉淀中加入50 mL YPD液体培养基,30 ℃下培养至酵母菌液OD600 nm=2~3。离心后的酵母细胞用25 mL无菌水洗涤后加入1 mL 0.1 mol/L乙酸锂混匀,将悬浮液转至1.5 mL离心管中,4 ℃条件下以3000 r/min离心5 min,向沉淀中加入0.5 mL 0.1 mol/L乙酸锂混合后室温放置10 min。在50 μL酵母EBY100感受态细胞中加入250 μL 15%无菌甘油混匀后转入1.5 mL离心管中,于-80 ℃条件下保存[13]。
1.2.3 电转化和阳性转化子的筛选 向50 μL酵母EBY100感受态细胞中加入5 μg pYD1-VP2质粒混匀并转移至电转杯,调整参数后电击并加入1 mL 1 mol/L预冷的山梨醇,将电击后的酵母EBY100感受态细胞转移至1.5 mL无菌管。在YNB选择培养基(含亮氨酸但不含色氨酸)上筛选阳性转化子,并对转化子进行菌液PCR鉴定,含有pYD1-VP2的酵母细胞命名为EBY100/pYD1-VP2。
1.2.4 酵母细胞表达VP2蛋白 将挑取的阳性单菌落接种于含2%葡萄糖YNB-CAA液体培养基中,于30 ℃条件下培养直至酵母菌液OD600 nm=2~5,离心收集酵母细胞并重悬于含2%半乳糖的YNB-CAA培养基中,调整培养菌液吸光度OD600 nm=0.5~1.0,于30 ℃下诱导表达VP2蛋白,分别在诱导后24、36、48 h取样,于4 ℃下保存备用。
1.2.5 酵母表面VP2蛋白的Western Blotting鉴定 离心收集诱导表达蛋白48 h后的酵母细胞并提取酵母细胞表面蛋白。首先将细胞重悬于0.1 mol/L NaOH溶液,重悬后的细胞经室温孵育5 min后,以12 000 r/min离心10 min[14],细胞重悬于100 mmol/L Tris-HCl(pH 6.8)、4% SDS(十二烷基硫酸钠)、0.2%溴酚蓝和20%甘油混合液中,在95 ℃下温育5 min后,将样品以3000 r/min离心10 min,收集上清液,该上清液即含有酵母细胞表面蛋白。
将提取的酵母细胞表面蛋白进行SDS-PAGE凝胶电泳,凝胶电泳结束后采用湿式转膜法将蛋白转移硝酸纤维素膜,加入5%脱脂奶粉对纤维素膜室温封闭3 h;封闭结束后使用PBST(pH 6.8)溶液洗涤3次,每次5 min,将鼠抗VP2蛋白抗体稀释5000倍作为一抗,37 ℃下孵育1 h,使用PBST溶液洗涤3次;将HRP标记羊抗鼠IgG(H&L)稀释1000倍作为二抗,37 ℃下孵育1 h,使用PBST溶液洗涤3次后再使用PBS溶液洗涤3次;将纤维素膜置于ChemiScope 6000 Touch一体式化学发光成像仪,取ECL发光液A、B等量混匀,滴加在膜正面,暗室显色5 min后曝光,根据Western Blotting检测鉴定VP2蛋白表达情况。
1.2.6 酵母表面VP2蛋白的免疫荧光检测 离心收集诱导表达24、36、48 h后的EBY100/pYD1-VP2酵母细胞及诱导48 h的EBY100/pYD1酵母细胞,酵母细胞不做透化处理而直接采用鲜活酵母细胞进行孵育,以鉴定VP2蛋白确实展示于细胞膜表面。首先将酵母细胞用PBS(pH 6.8)溶液洗涤3次,将鼠抗VP2蛋白抗体稀释1000倍作为一抗,加入细胞混匀,于37 ℃下孵育1 h,再使用PBS溶液洗涤细胞;将羊抗鼠IgG抗体(FITC)稀释500倍作为二抗,37 ℃下孵育1 h。离心收集孵育后的细胞用PBS溶液洗涤,取少量酵母细胞滴于载玻片,置于倒置荧光显微镜下检测酵母表面VP2蛋白的免疫荧光信号。
2 结果与分析
2.1 VP2基因克隆及pYD1-VP2展示载体的构建
以提取IPNV病毒悬液的RNA为模板,VP2-F/VP2-R为引物扩增目的基因,扩增产物进行10 g/L琼脂糖凝胶电泳,经RT-PCR扩增出与VP2基因大小相符的特异性条带(1311 bp),阴性对照组未显示任何条带(图1)。VP2基因连入PYD1载体后提取质粒进行酶切鉴定,单一酶切产物条带位于5000~7500 bp之间,与预期重组载体大小(5009 bp)相符,双酶切产物泳道出现与预期大小相符的特异性条带(1311 bp)(图2)。这表明,VP2目的基因已经成功连接到pYD1载体,将该重组质粒命名为pYD1-VP2。
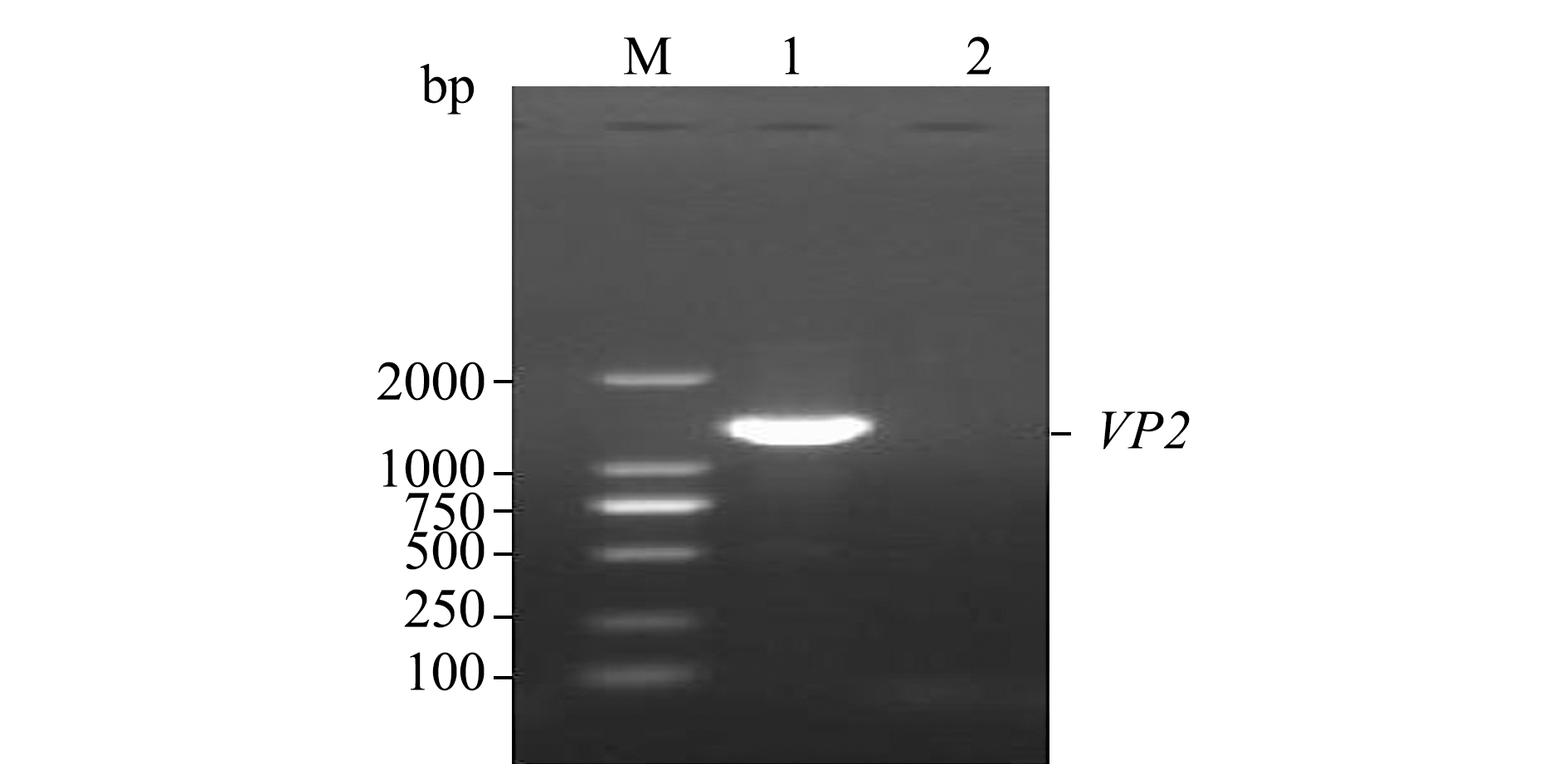
注:M为DL 2000 DNA分子量标准;1为VP2基因的PCR产物;2为阴性对照
Note: M, DL 2000 DNA Marker;1, PCR product of VP2 gene;2, negative control
图1 VP2基因的PCR扩增
Fig.1 Amplification of the VP2 gene by PCR
2.2 电转化和阳性转化子的筛选
将pYD1-VP2重组质粒转化至酵母EBY100感受态细胞,涂布于YNB选择培养基,利用菌液PCR鉴定方法筛选阳性转化子。凝胶电泳结果显示出现与目的条带大小相符的单一特异性条带(1311 bp),而转化pYD1空质粒的对照组无任何条带(图3)。这表明,含有VP2基因的重组质粒pYD1-VP2成功转化至酵母EBY100中,将该阳性菌株命名为EBY100/pYD1-VP2,转化pYD1空质粒的对照组菌株命名为EBY100/pYD1。
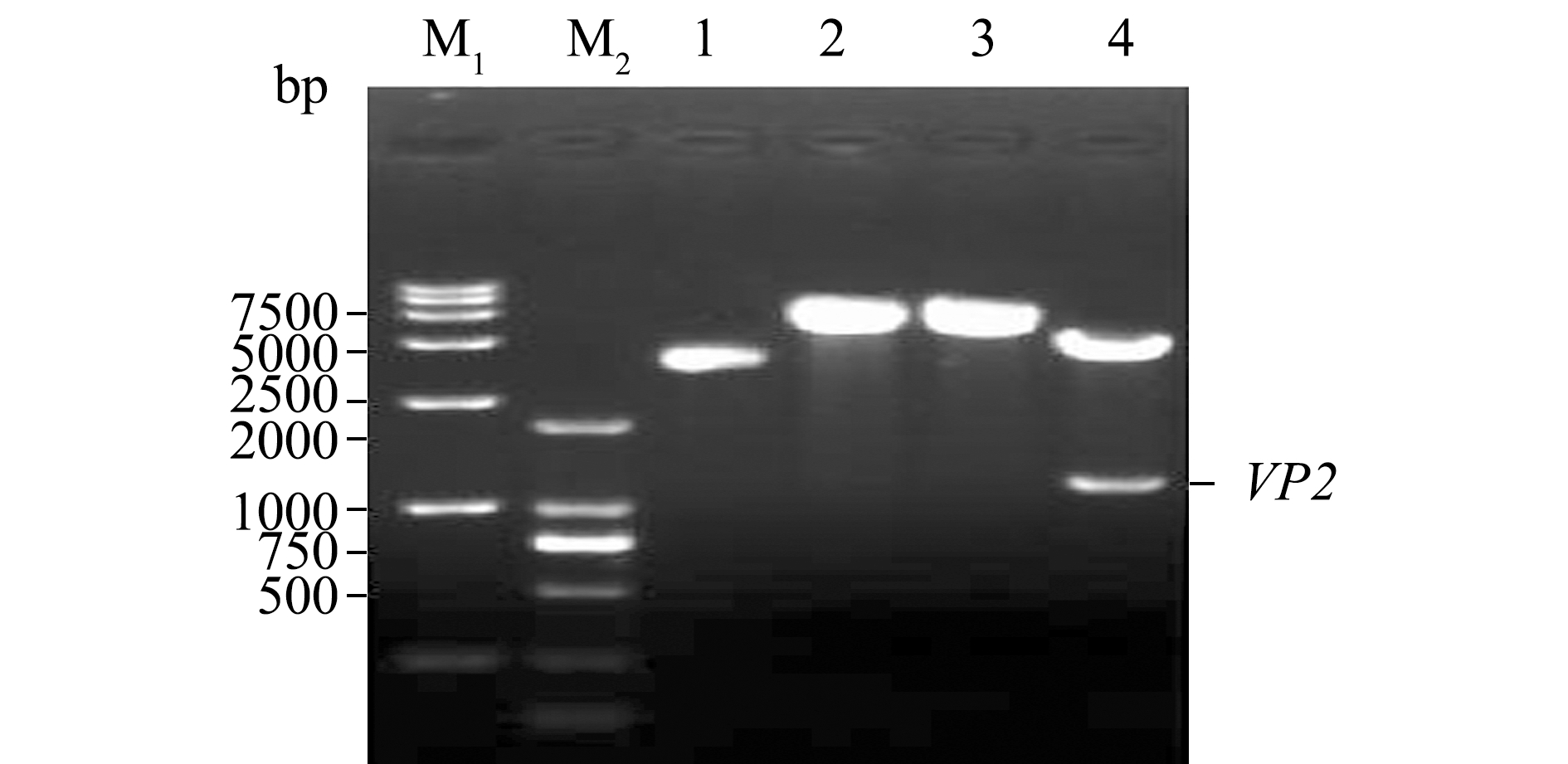
注:M1为 DL 15 000 DNA分子量标准;M2为DL 2000 DNA分子量标准;1为pYD1-VP2;2、3 为单酶切;4为双酶切
Note:M1,DL 15 000 DNA Marker;M2, DL 2000 DNA Marker;1,pYD1-VP2;2 and 3, single-digestion;4, dual-digestion
图2 pYD1-VP2重组质粒的酶切鉴定
Fig.2 Identification of recombinant plasmid pYD1-VP2 by enzymatic digestion
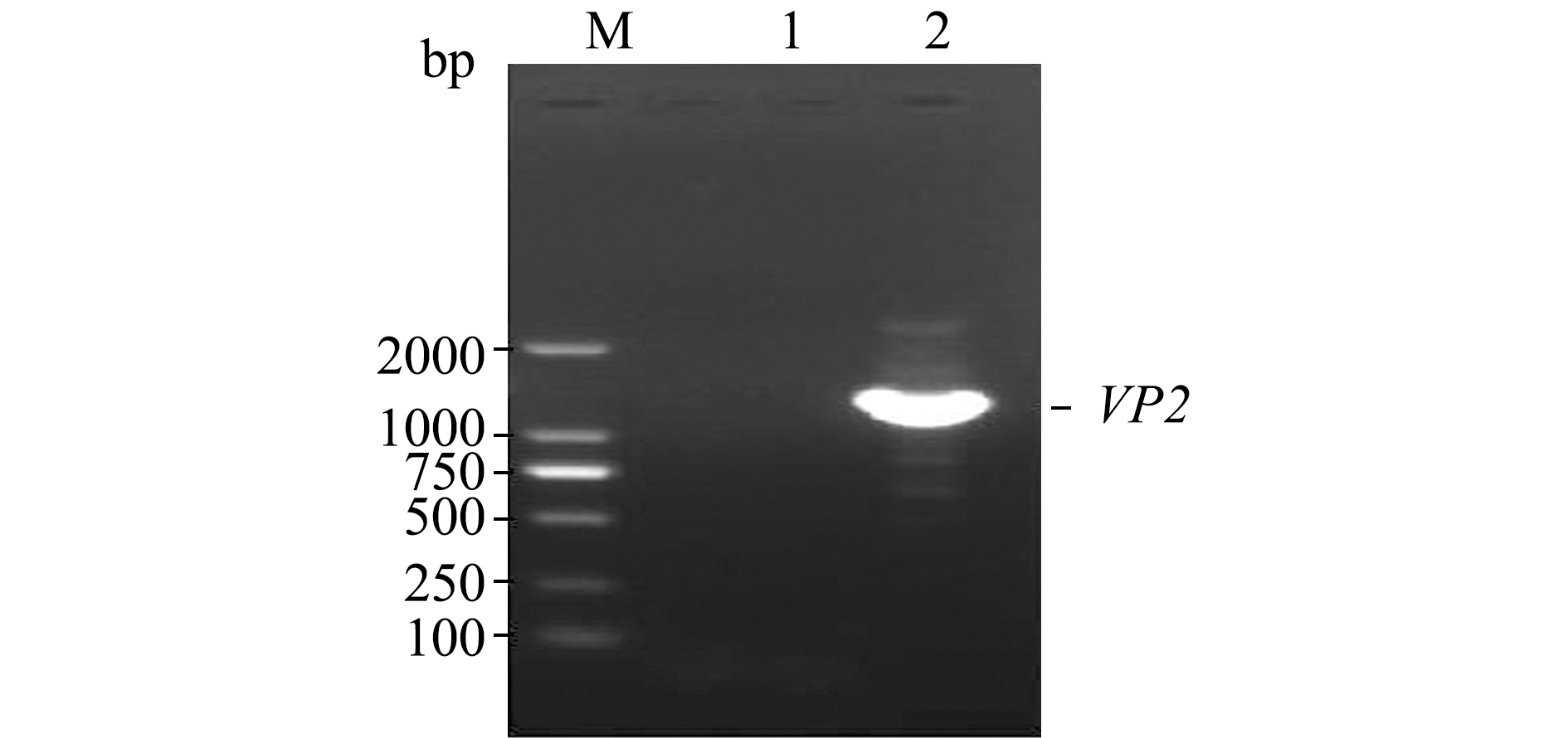
注:M为 DL 2000 DNA分子量标准;1为阴性对照;2为阳性转化子
Note:M, DL 2000 DNA Marker;1, negative control; 2, PCR product of positive clone
图3 EBY100/pYD1-VP2酵母细胞的PCR鉴定
Fig.3 PCR identification of EBY100/pYD1-VP2 yeast
2.3 酵母表面VP2蛋白的Western Blotting鉴定
Western Blotting分析显示,经半乳糖诱导后,EBY100/pYD1-VP2酵母表面蛋白提取物出现了特异性的反应条带,而对照组EBY100/pYD1酵母细胞诱导产物并未出现条带(图4)。重组酵母表达的VP2蛋白以Aga2p-VP2融合蛋白形式展示于酵母细胞表面,其中VP2的理论分子量为46 500,Aga2p的理论分子量为15 800,因此,融合蛋白Aga2p-VP2的理论分子量为62 300,从图4可见, Western Blotting检测到特异性条带介于75 000和55 000之间,与融合蛋白理论分子量一致,这表明酵母细胞成功表达了VP2蛋白。

注:M为蛋白分子量标准;1为Aga2-VP2;2为 EBY100/pYD1表面蛋白
Note:M, pre-stained protein ladder;1, Aga2-VP2;2,surface protein of EBY100/pYD1
图4 酵母展示VP2蛋白的Western Blotting鉴定
Fig.4 Western Blotting analysis of EBY100 displayed VP2 protein
2.4 酵母表面VP2蛋白的免疫荧光检测
从图5可见,对照组EBY100/pYD1酵母细胞未出现特异性绿色荧光,而EBY100/pYD1-VP2酵母细胞在诱导24、36、48 h后均出现特异性荧光。利用Image Pro Plus软件对免疫荧光镜检视野(n=10)进行分析可知,对照组EBY100/pYD1荧光酵母细胞所占比例平均值为0.8%,EBY100/pYD1-VP2诱导24、36、48 h荧光酵母细胞所占比例平均值分别为30.9%、55.4%、71.3%,且各组间荧光酵母比例有显著性差异(P<0.05)。这表明,VP2蛋白被成功地展示于酵母细胞表面,且成功展示的酵母细胞比例随时间的延长而增加。
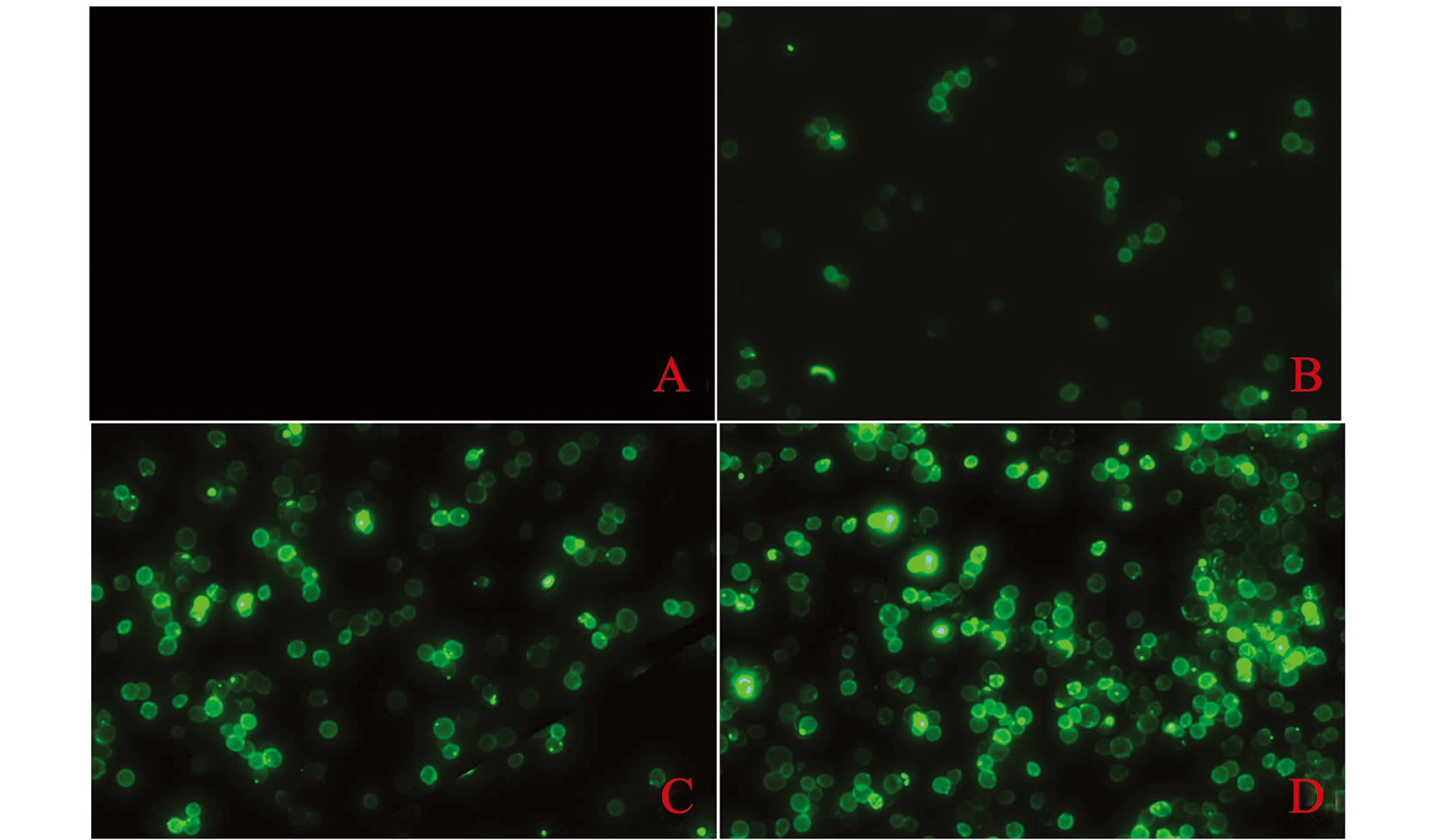
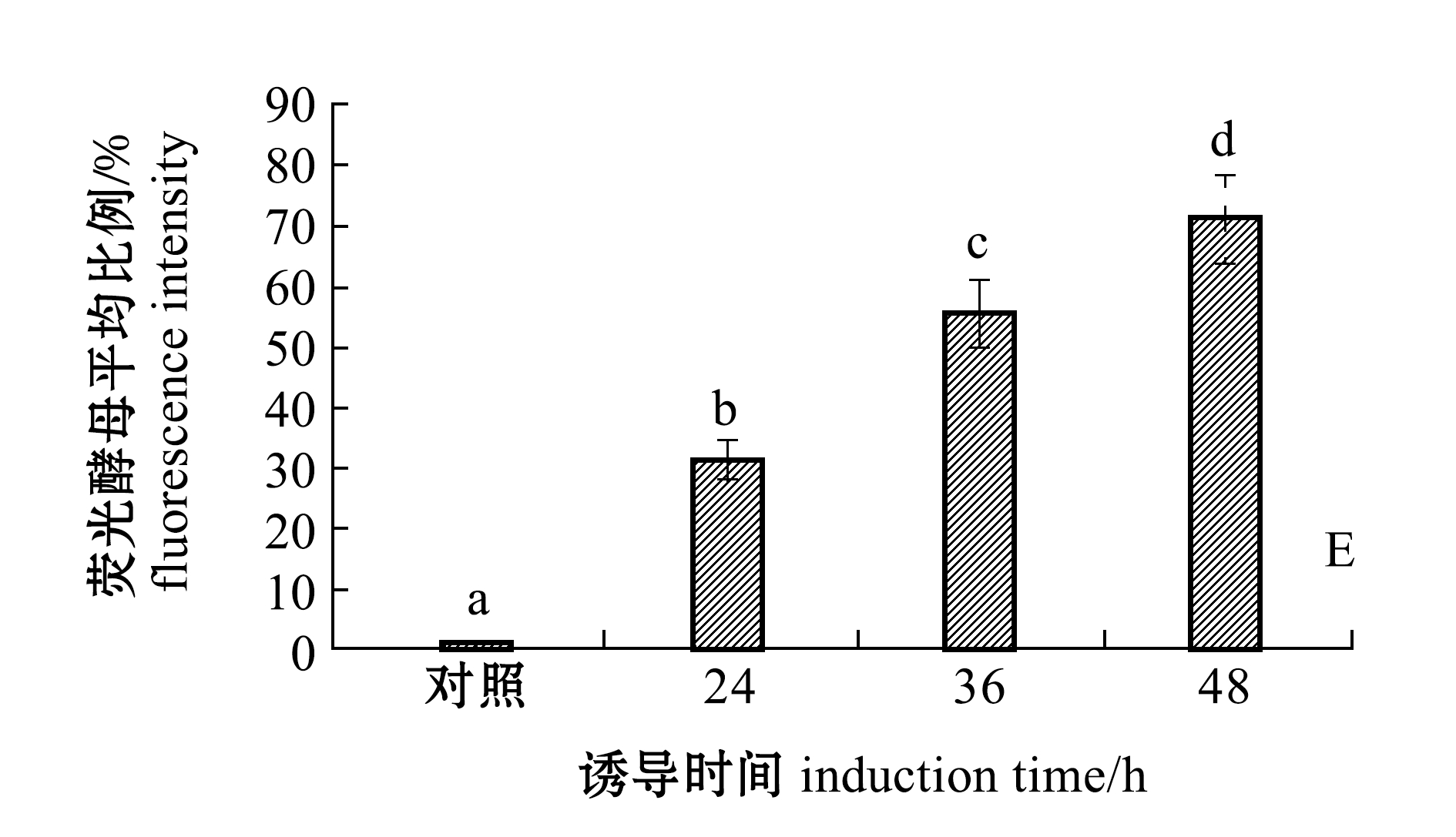
注:A为EBY100/pYD1诱导后48 h(对照);B~D分别为EBY100/pYD1-VP2诱导后24、36、48 h;E图中,标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note: A, EBY100/pYD1 induced for 48 h(cortrol);B-D, EBY100/pYD1-VP2 induced for 24, 36, and 48 h;E,the means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letters are not significant differences
图5 EBY100/pYD1-VP2表面VP2蛋白的免疫荧光检测及荧光酵母比例
Fig.5 Fluorescence detection and yeast proportion of EBY100/pYD1-VP2 expressed VP2 protein
3 讨论
3.1 中国流行的IPNV血清型和疫苗现状
1986年在中国山西省虹鳟鱼场首次暴发传染性胰脏坏死病,虹鳟鱼苗损失90%~95%[15],随后山东、甘肃和东北地区接连报道IPN疫情的暴发[16-18],而后再无相关报道,直到2011年,辽宁省的虹鳟鱼养殖场再次分离到一株IPNV[19],这些报道中分离的IPNV毒株均属于A2血清型(Spajarup,Sp)[16-19]。本研究中所利用的毒株为课题组于2013年在中国云南省某虹鳟养殖场分离的IPNV毒株ChRtm213[12],其血清型为A9(Jasper,Ja)。2016年,四川省某虹鳟养殖场再次暴发了IPN[20],其血清型与本研究中所用的ChRtm213相同,均为A9血清型。由此可知,A9血清型的IPNV毒株很可能为中国现行毒株。因此,利用A9血清的ChRtm213毒株开展的此项研究具有广泛的代表性。
目前,针对IPNV的疫苗研制主要有DNA疫苗、亚单位疫苗等。临床上常注射接种全病毒灭活油佐剂疫苗,由于传染性胰腺坏死病易爆发于密集养殖的幼龄鲑鳟鱼,因此,注射免疫十分困难,易造成幼鱼机械损伤并导致继发感染[5]。采用群体口服免疫操作便捷,更适宜对幼鱼免疫,是最理想的接种方式[9],IPNV DNA口服疫苗的研究有很多,其保护效果却不一致[8,21-22],并且IPNV DNA疫苗在中国未商品化,其他国家许可生产的IPNV DNA疫苗无法引入国内,以乳杆菌表达IPNV(A2血清型)VP2-VP3重组蛋白制备的口服疫苗取得了较高的保护率[23]。酵母展示系统同样能对IPNV抗原基因进行真核表达,其优点在于酵母展示系统是将抗原蛋白展示于酵母菌表面而不是菌体内部。
3.2 IPNV VP2蛋白酵母展示系统的建立
以往的研究主要是利用原核表达系统表达IPNV VP2蛋白,原核表达不能对表达的蛋白进行翻译后加工修饰[24],且原核表达的VP2蛋白多为包涵体[25]。酵母表达能够弥补原核表达系统不能对目的蛋白进行糖基化修饰的缺陷,使得表达后的异源蛋白能够具有类似于天然状态的生物学活性。目前,已经成功展示于酵母表面并用于疫苗开发的病原包括:高致病禽流感病毒(Highly pathogenic H5N1 avian influenza viruses)血凝素蛋白(hemagglutinin,HA)[26]、草鱼呼肠孤病毒(Grass carp reovirus,GCRV)衣壳蛋白VP7[27]、巨型虎虾斑节对虾Penaeus monodon病毒结合蛋白Rab7、白斑综合征病毒(White spot syndrome virus,WSSV)包膜蛋白VP28[28]、艾美耳球虫Eimeria tenella EtMic1多肽[29]等。此外,Zhao等[30]将大肠杆菌来源的传染性造血器官坏死病毒(Infectious hematopoietic necrosis virus,IHNV)G蛋白与已经展示G蛋白的酵母共同培养,通过Aga1和Aga2亚基之间的两个二硫键锚定更多大肠杆菌来源的G蛋白,以增加酵母细胞表面G蛋白含量,其研究结果显示酵母表面的抗原蛋白能够诱导宿主产生更强的免疫应答。上述研究表明,酵母细胞表面上展示的病毒抗原能够刺激机体产生特异性抗体。
本研究中采用的酵母细胞a-凝集素展示系统可将目的蛋白融合表达在凝集素Aga-2亚基的C末端,融合蛋白表达后被前导信号肽运送至酵母细胞外,然后Aga-2亚基通过二硫键与酵母细胞表面的Aga-1结合,从而将与之融合的目的蛋白展示在酵母细胞的表面[10]。本研究中将IPNV VP2蛋白基因克隆至展示载体pYD1中Aga-2亚基基因下游,拟通过诱导表达将VP2蛋白展示于酵母表面。Western Blotting和细胞免疫荧光鉴定结果均表明,VP2蛋白成功展示在酵母表面,且随着诱导时间的延长,VP2蛋白的表达量逐渐增加,该结果表明VP2蛋白已经被酵母细胞特异性的表达,且在一定时间内表达量与诱导时间成正相关。因此,在实际应用中可以通过调整诱导时间来优化VP2蛋白的表达量。
[1] Wolf K,Snieszko S F,Dunbar C E,et al.Virus nature of infectious pancreatic necrosis in trout[J].Proceedings of the Society for Experimental Biology and Medicine,1960,104:105-108.
[2] Ruane N M,McCleary S J,Mccarthy L J,et al.Phylogenetic analysis of infectious pancreatic necrosis virus in Ireland reveals the spread of a virulent genogroup 5 subtype previously associated with imports[J].Archives of Virology,2015,160(3):817-824.
[3] Dobos P.Size and structure of the genome of infectious pancreatic necrosis virus[J].Nucleic Acids Research,1976,3(8):1903-1924.
[4] Dobos P.The molecular biology of infectious pancreatic necrosis virus (IPNV)[J].Annual Review of Fish Diseases,1995,5:25-54.
[5] Guo Mengting,Shi Wen,Wang Yanxue,et al.Recombinant infectious hematopoietic necrosis virus expressing infectious pancreatic necrosis virus VP2 protein induces immunity against both pathogens[J].Fish & Shellfish Immunology,2018,78:187-194.
[6] Vázquez D,López-Vázquez C,Olveira J G,et al.Quantitative flow cytometry to measure viral production using infectious pancreatic necrosis virus as a model:a preliminary study[J].Applied Sciences,2018,8(10):1734.
[7] 刘淼,徐黎明,赵景壮,等.虹鳟传染性胰脏坏死病毒的分离鉴定及聚类分析[J].大连海洋大学学报,2017,32(1):56-61.
[8] Ahmadivand S,Soltani M,Behdani M,et al.VP2 (PTA motif) encoding DNA vaccine confers protection against lethal challenge with infectious pancreatic necrosis virus (IPNV) in trout[J].Molecular Immunology,2018,94:61-67.
[9] Patterson R,Eley T,Browne C,et al.Oral application of freeze-dried yeast particles expressing the PCV2b Cap protein on their surface induce protection to subsequent PCV2b challenge in vivo[J].Vaccine,2015,33(46):6199-6205.
[10] 郭钦,张伟,阮晖,等.酿酒酵母表面展示表达系统及应用[J].中国生物工程杂志,2008,28(12):116-122.
[11] 崔敏,郭冉,夏辉.用饲料酵母替代鱼粉对大菱鲆幼鱼生长及免疫机能的影响[J].大连海洋大学学报,2012,27(1):58-63.
[12] Ji Feng,Zhao Jingzhuang,Liu Miao,et al.Complete genomic sequence of an infectious pancreatic necrosis virus isolated from rainbow trout (Oncorhynchus mykiss) in China[J].Virus Genes,2017,53(2):215-225.
[13] 叶玲,刘建伟,刘静.酿酒酵母感受态细胞的低温保存及酵母菌落PCR-快速筛选鉴定[J].生物化学与生物物理进展,2003,30(6):956-959.
[14] Andreu C,del Olmo M.Yeast arming by the Aga2p system:effect of growth conditions in galactose on the efficiency of the display and influence of expressing leucine-containing peptides[J].Applied Microbiology and Biotechnology,2013,97(20):9055-9069.
[15] 江育林,徐伯亥,李伟,等.虹鳟传染性胰脏坏死病病毒(IPNV)的初步研究[J].水生生物学报,1989,13(4):353-358.
[16] 童裳亮,Hetrick F M.山东虹鳟暴发传染性胰脏坏死病(IPN)[J].海洋通报,1989,8(1):118.
[17] 牛鲁祺,赵志壮.东北地区虹鳟IHN和IPN流行病学的初步研究[J].水产学报,1988,12(4):327-332.
[18] 刘兴发,王熹洲,娄淑杰,等.虹鳟鱼传染性胰腺坏死病毒的分离与鉴定[J].中国兽医科技,1991,21(6):11-14.
[19] 胡晓利,李伟,肇慧君,等.虹鳟鱼传染性胰脏坏死病病毒的分离与鉴定[J].中国动物检疫,2012,29(3):27-30.
[20] Zhu Ling,Wang Xingli,Wang Kaiyu,et al.OUTBREAK of infectious pancreatic necrosis virus (IPNV) in farmed rainbow trout in China[J].Acta Tropica,2017,170:63-69.
[21] Munang'Andu H M,Fredriksen B N,Mutoloki S,et al.Comparison of vaccine efficacy for different antigen delivery systems for infectious pancreatic necrosis virus vaccines in Atlantic salmon (Salmo salar L.) in a cohabitation challenge model[J].Vaccine,2012,30(27):4007-4016.
[22] Reyes M,Ramírez C, ancucheo I,et al.A novel “in-feed” delivery platform applied for oral DNA vaccination against IPNV enables high protection in Atlantic salmon (Salmon salar)[J].Vaccine,2017,35(4):626-632.
ancucheo I,et al.A novel “in-feed” delivery platform applied for oral DNA vaccination against IPNV enables high protection in Atlantic salmon (Salmon salar)[J].Vaccine,2017,35(4):626-632.
[23] 刘佳琪,高帅,段可馨,等.鱼源植物乳杆菌表达IPNV VP2-VP3重组蛋白及其口服免疫程序[J].水产学报,2017,41(4):622-627.
[24] 刘学光,郑怀东,郭欣硕,等.传染性造血器官坏死病毒糖蛋白的原核表达及多克隆抗体的制备[J].大连海洋大学学报,2013,28(3):254-258.
[25] Dadar M,Memari H R,Peyghan R,et al.Isolation and expression of recombinant viral protein (VP2) from Iranian isolates of Infectious Pancreatic Necrosis Virus (IPNV) in Escherichia coli[J].Iranian Journal of Fisheries Sciences,2014,13(4):856-868.
[26] Lei Han,Jin Sha,Karlsson E,et al.Yeast surface-displayed H5N1 avian influenza vaccines[J].Journal of Immunology Research,2016.http://dx.doi.org/10.1155/2016/4131324
[27] Luo Shaoxiang,Yan Liming,Zhang Xiaohua,et al.Yeast surface display of capsid protein VP7 of grass carp reovirus:fundamental investigation for the development of vaccine against hemorrhagic disease[J].Journal of Microbiology and Biotechnology,2015,25(12):2135-2145.
[28] Ananphongmanee V,Srisala J,Sritunyalucksana K,et al.Yeast surface display of two proteins previously shown to be protective against white spot syndrome virus (WSSV) in shrimp[J].PLoS One,2015,10(6):e0128764.
[29] Sun Hui,Wang Longjiang,Wang Tiantian,et al.Display of Eimeria tenella EtMic2 protein on the surface of Saccharomyces cerevisiae as a potential oral vaccine against chicken coccidiosis[J].Vaccine,2014,32(16):1869-1876.
[30] Zhao Jingzhuang,Xu Liming,Liu Miao,et al.Preliminary study of an oral vaccine against infectious hematopoietic necrosis virus using improved yeast surface display technology[J].Molecular Immunology,2017,85:196-204.