香港牡蛎Crossostrea sikamea广泛分布于中国广东、广西海域,其肉质鲜美、营养丰富全面,素有“海洋牛奶”之美名[1]。牡蛎是第一批入选食药同源的食物,其具有抗氧化[2]、免疫[3]、抗疲劳[4]、抗肿瘤[5]、抑菌[6]、改善记忆[7]、解酒护肝[8]等功能活性,这为进行创伤愈合研究奠定了理论基础,但尚未有对其进行深入的营养保健或药用价值相关报道,因此,有必要对牡蛎的功能价值进行充分开发利用。
皮肤是人体最大的器官,结构复杂,可以保护身体免受外部环境、病原体和物理的侵害[9]。由于皮肤总是暴露在外部环境中,故受伤概率较大。伤口通常是由正常组织的结构和功能被破坏引起,导致皮肤破裂造成身体伤害。创伤愈合是一个动态的交互过程,包含止血/炎症、增殖和组织重塑3个重叠阶段,这些阶段的任何异常都将导致慢性伤口或严重的组织纤维化[10]。而治疗慢性伤口可能较为持久,不仅需要特定的医疗技能,对当代医学已构成巨大挑战,同时,全世界约有两千万人受慢性伤口的困扰。由于人口老龄化,以及肥胖和糖尿病等人群不断上升,这一数字可能会显著增加[11]。因此,加速创伤愈合对身体健康至关重要。传统的创伤愈合活性物质,包括生长因子、细胞因子、从植物中获得的化合物,以及其他免疫调节因子,都难以将其转化成临床促愈疗法[12]。近年来,与高成本且存在安全性和递送问题的药物相比,具有高活性、特异性和稳定性的生物活性肽在相关研究领域引起了研究人员的兴趣[13]。随着国内外对海洋来源活性肽功能作用的深入研究,已发现部分活性肽在皮肤组织创伤愈合方面具有较高的潜在应用价值,如海洋胶原蛋白肽[14,5]、鱼皮胶原蛋白肽[15]等。
本研究中,采用可控酶法制备牡蛎酶解产物(enzymolysis products of oyster,EPO),开展EPO促进小鼠皮肤软组织创伤愈合作用探讨,旨在为进一步深入研究其机制提供理论参考。
1 材料与方法
1.1 材料
试验用牡蛎肉购自广西钦州。试验用SPF级昆明小鼠体质量为(20±2)g,雄性,购自山东省济南朋悦实验动物繁育有限公司,实验单位使用许可证编号 SYXK(粤)2014-0053。云南白药购自云南白药集团。抗菌试验所需菌株由广东省水产品加工与安全重点实验室提供。
试验试剂:动物蛋白酶(3万 U/g)购自广西南宁庞博生物工程有限公司;白介素-6(interleukin 6,IL-6)、白介素-10(interleukin 10,IL-10)、生长因子转化生长因子β(transforming growth factor-β,TGF-β)、碱性成纤维细胞生长因子(fibroblast growth factor 2,FGF-2)、表皮细胞生长因子(epidermal growth factor,EGF)、细胞生长周期素1(Cyclin D1,CCND1)和羟脯氨酸测定试剂盒购自南京建成生物工程研究所。
试验仪器:Lynx 6000型高速冷冻离心机、多功能酶标仪购自Thermo公司;BSA224S-CW型万分之一电子天平购自赛多利斯科学仪器(北京)有限公司;FE28型pH计购自梅特勒—托利多仪器(上海)有限公司;DF-101T集热氏恒温加热磁力搅拌器购自上海精宏实验设备有限公司;FDU-1110型冷冻干燥机购自上海爱朗仪器有限公司;SW-CJ-2FD型双人超级操作台,苏州净化设备有限公司。
1.2 方法
1.2.1 EPO制备工艺 将牡蛎肉清洗、打浆, pH值调至7.0,加入1000 U/g(蛋白)的动物蛋白酶,酶解5 h,灭酶10 min,以8000 r/min离心,浓缩,冷冻干燥[16]。采用凯氏定氮法[17]、甲醛滴定法[17]和双缩脲法分别测定蛋白质含量、水解度和肽含量。
1.2.2 EPO体外抗菌试验 采用微量径向扩散法和半数稀释法[18]测定EPO对6中革兰氏阳性菌和7种革兰氏阴性菌的抗菌活性。
1.2.3 EPO体表促凝血试验 用断尾法[19]测定EPO对小鼠体表创口出血时间和出血量的影响。
1.2.4 EPO急性皮肤毒性试验 选取SPF 级昆明小鼠10只,随机分成空白对照组和EPO涂抹组。试验方法参考文献[20]。
1.2.5 动物分组及创伤模型建立 选取SPF清洁级昆明雄性小鼠60只,随机分为3组,每组20只,分别为阴性对照组、云南白药阳性对照组和EPO给药组。将小鼠用10%水合氯醛腹腔麻醉后,背部剃毛、消毒。在小鼠背部剪去直径约0.8 cm的全层皮肤,造成全皮层创伤动物模型。 每只小鼠均分笼饲养,给药组每天涂抹30~35 mg EPO(肽含量为1.5~2.5 mg),阳性对照组每天涂抹2~3 mg云南白药,阴性对照组不做任何处理。每2天对小鼠创伤口面观察、拍照、测量伤口大小,并记录结果。
1.2.6 愈合率及瘢痕缩小率 每隔2 d用游标卡尺测量创面直径大小一次,计算创伤愈合率:
创伤愈合率=(第0天创面直径-第n天创面
直径)/第0天创面直径×100%,
瘢痕缩小率=(第0天创面直径-第14天瘢痕
长度)/第0天创面直径×100%。
1.2.7 瘢痕组织中生化指标测定 小鼠创面组织匀浆液制备参考文献[21],分装于-80 ℃下保藏待测。IL-6、IL-10、TGF-β、FGF-2、EGF、CCND1和羟脯氨酸含量的检测均按照试剂盒说明书进行。
1.3 数据处理
试验数据采用平均值±标准差表示(mean±S.D.),每组试验至少重复3次,采用SPSS 20软件进行统计学分析。组间比较采用LSD检验,显著性水平设为0.05。
2 结果与分析
2.1 牡蛎酶解产物(EPO)的基本性质
本试验中自制的EPO主要质量指标为加酶量为1000 U/g,蛋白的牡蛎酶解液水解度为26.33%,EPO的蛋白质含量为43.54 g/100 g,肽含量为25.26%。
2.2 体外抗菌试验结果
采用微量径向扩散法和半数稀释法测定EPO对常见的13种菌株的抑制作用,其中6种革兰氏阳性菌株分别为金黄色葡萄球菌Staphyloccocus aureus、芽孢杆菌Bacillus、李斯特菌Listeria monocytogenes、海豚链球菌Streptococcus iniae、格氏乳球菌Lactococcus garviea和无乳链球菌Streptococcus agalactiae,7种革兰氏阴性菌分别为大肠杆菌Escherichia coli、铜绿假单胞菌Pseudomonas aeruginosa、溶藻弧菌Vibrio alginolyticus、副溶血性弧菌V.Parahemolyticus、海藻希瓦氏菌Shewanella algae、哈氏弧菌V.harveyi和嗜水气单胞菌Aeromonas hydrophila。体外抗菌试验结果显示,EPO无抗菌活性。
2.3 体表促凝血试验结果
EPO对小鼠体表创口出血时间和出血量的影响如表1所示,与阴性对照组相比,EPO可缩短出血时间和减少出血量,但无显著性差异(P>0.05),而云南白药阳性对照组则极显著好于其他组(P<0.01)。这表明,EPO不具有促凝血作用。
表1 EPO对小鼠断尾创口出血时间和出血量的影响(n=5)
Tab.1 Effect of EPO on bleeding time and blood loss of mouse tail wound (n=5)
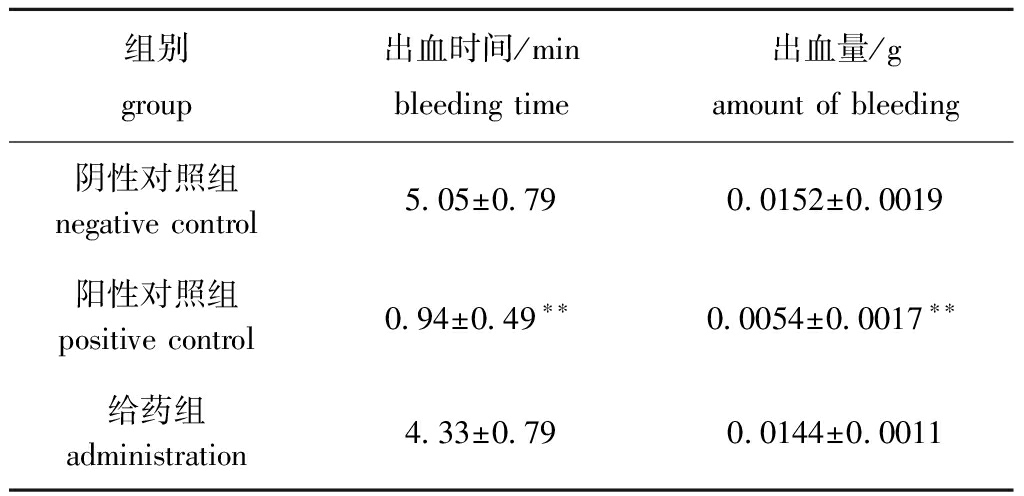
组别group出血时间/minbleeding time出血量/gamount of bleeding阴性对照组negative control5.05±0.790.0152±0.0019阳性对照组positive control0.94±0.49∗∗0.0054±0.0017∗∗给药组administration4.33±0.790.0144±0.0011
注:**表示与阴性对照组有极显著性差异(P<0.01)
Note: **means very significant difference compared with the negative control(P<0.01)
2.4 EPO急性皮肤毒性试验结果
连续涂抹EPO 3 d后,所有小鼠均未出现红斑和水肿现象。停药后继续观察2 d,也未出现红斑和水肿,且均未出现动物体质量下降、站立不稳、精神萎靡等其他异常变化。这表明,EPO对小鼠无毒性。
2.5 EPO对小鼠皮肤伤口愈合作用的影响
2.5.1 创面形态变化观察 各组愈合情况如图1所示,造模后第2天,各试验组动物皆已结痂,伤口周围出现红肿,无液体渗出,伤口收缩均不明显。第2、4天时,各组创面结痂局部不断变硬,创伤周围表面不平整,创缘皮肤收缩较明显。第6、8、10天时,阴性对照组伤口结痂不断变厚,呈黑红色,但瘢痕面积变化小;阳性对照组伤口缩小,并开始部分脱痂、缩痂明显;EPO给药组在第6天时已掉痂,缩痂明显优于两对照组。第12天时,各组皆已掉痂,愈合处开始长出毛发,其中给药组进一步缩痂。第14天时,阴性对照组的多数伤口直径小于2 mm,各给药组伤口直径均小于1 mm,呈现肉红色新生皮肤,新生肉色组织完整。 给药组较阴性对照组愈合情况良好,无增生性瘢痕及瘢痕疙瘩生成。
2.5.2 愈合率 从表2可见:造模后第6天时,EPO给药组的伤口愈合率均在35%以上,与阴性对照组相比,高出21%(P<0.05);造模后第10天时,给药组显著高于阴性对照组(P<0.05),高出40%;第14天时,给药组愈合率达94.17%,较阴性对照组高出14%(P<0.05)。

图1 EPO对小鼠创面的影响
Fig.1 Effect of EPO on wound of mice
由图2可知,给药组瘢痕缩小率显著高于阴性对照组(P<0.05)。给药组和阳性对照组在创伤愈合时期,创伤愈合速率均显著高于阴性对照组(P<0.05),但给药组与阳性对照组相比无显著性差异(P>0.05)。创伤愈合后期(14 d),各试验组创伤愈合速率逐渐趋于平衡,给药组效果突出(表2)。
云南白药(粉)是中国最著名的专利药之一,主要由中草药三七[22]开发,传统上用于止血和改善创伤性损伤的循环[23]。其中三七皂苷表现出抗炎、抗糖尿病、抗氧化和抗肿瘤特性,所以云南白药(粉)可能是通过加快止血,促进血液循环和消炎作用以实现促进创伤愈合。虽然阳性对照组与给药组创伤愈合速率无显著性差异,但EPO给药组效果更好,瘢痕较小,几乎达到无痕状态。成分检测结果显示,EPO主要成分是蛋白质,而其中肽含量较高,且具有膜透过性好、激活细胞活性、修复人体变性细胞等生物活性[18],推测EPO具有相关功能活性肽并起主要作用。
表2 EPO对小鼠皮肤创伤愈合的影响(愈合率)
Tab.2 Effect of EPO on skin wound healing (healing rate) in mice %

组别 group0 d6 d10 d14 d阴性对照 negative control014.17±2.89b35.86±8.66b80.42±6.17b阳性对照 positive control035.83±6.88a56.67±17.02a92.92±6.41a给药组 administration035.83±12.27a75.00±4.33a94.17±10.10a
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note: The means with different letters within the same column are significant differences at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
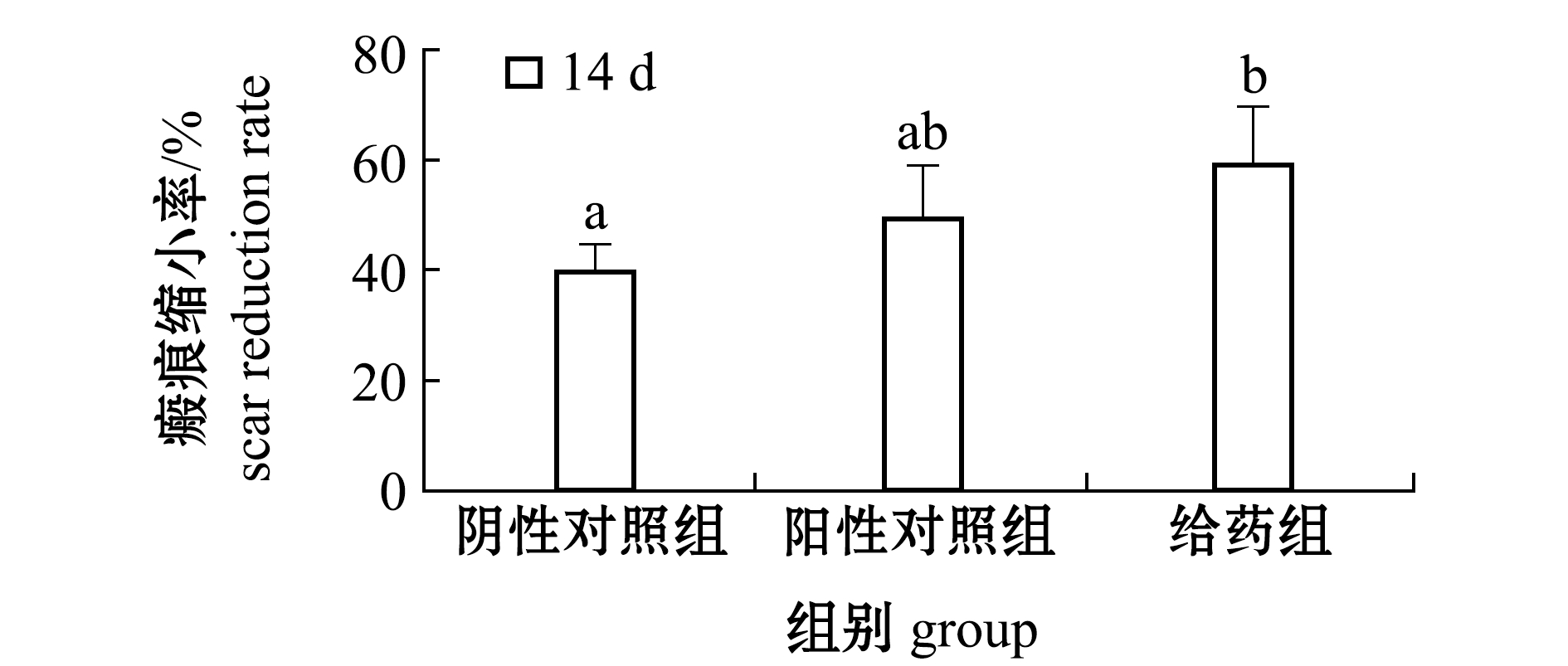
注:标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note: The means with different letters are significant differences at the 0.05 probability level, and the means with the same letters are not significant differences
图2 EPO对小鼠皮肤创伤瘢痕生成的影响
Fig.2 Effect of EPO on scar formation of skin wounds in mice
2.5.3 炎症因子测定 根据环境刺激,巨噬细胞具有广泛的功能,特别是通过释放多种因素来调节先天免疫反应。目前,巨噬细胞已被初步分为分泌IL-6等促炎症因子的M1型和分泌IL-10等抗炎症因子的M2型[24]两个主要表型。于是,本研究中选择造模后第3、5、7天时的IL-6与IL-10含量进行测定,结果如图3和图4所示。
从图3可见:第3、7天时,给药组IL-6含量与两个对照组均无显著性差异(P>0.05);第5天时,阳性对照组与阴性对照组有显著性差异(P<0.05)。这表明,EPO对小鼠创伤皮肤组织中炎症因子IL-6含量生成无影响。
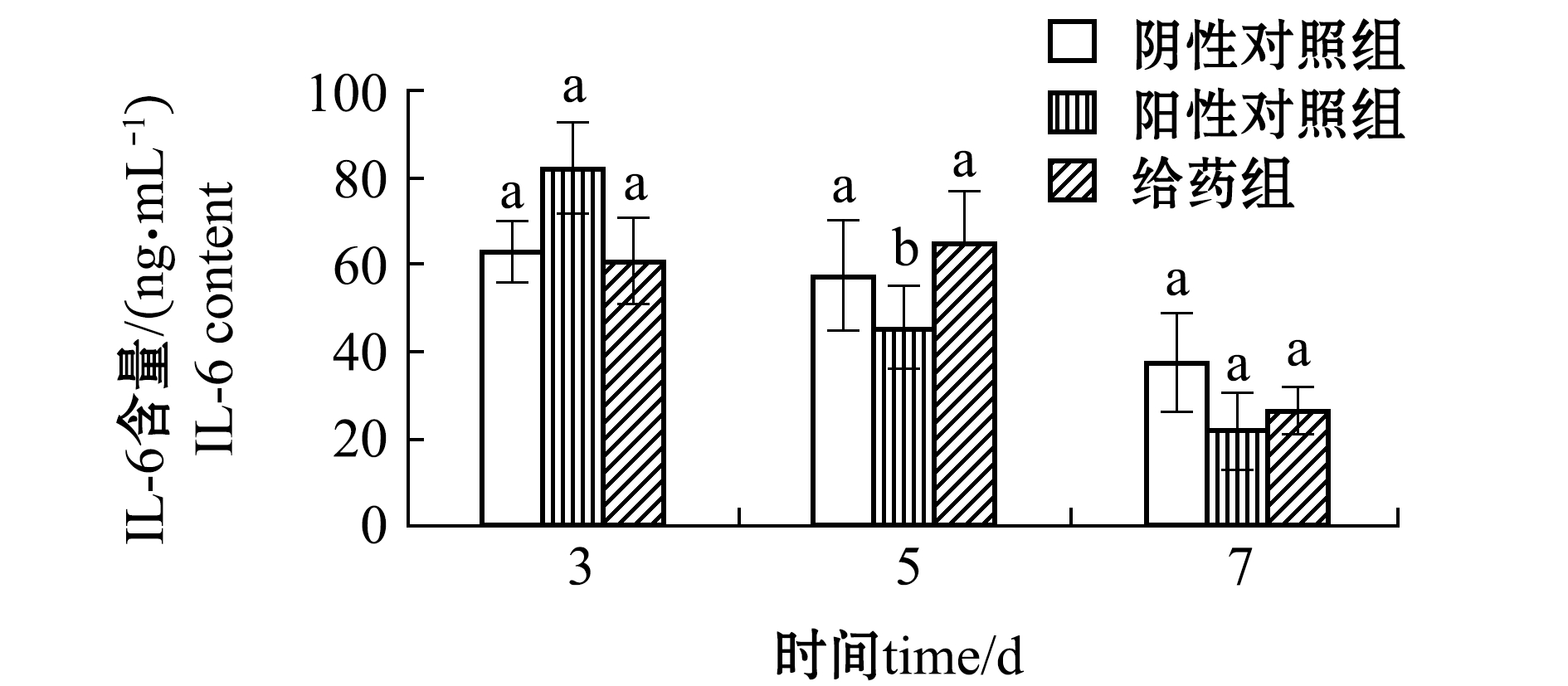
注:同一时间下,标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note: The means with different letters within the same time are significant differences at the 0.05 probability level, and the means with the same letters within the same time are not significant differences, et sequentia
图3 EPO对创伤皮肤组织中炎症因子IL-6含量的影响
Fig.3 Effect of EPO on levels of inflammatory factor IL-6 in wound skin tissue
从图4可见:第3天时,给药组和阳性对照组IL-10含量均显著高于阴性对照组(P<0.05);第5天时,阳性对照组IL-10含量显著高于其他组(P<0.05);第7天时,阳性对照组和给药组IL-10含量均显著低于阴性对照组(P<0.05)。
Du等[25]报道,M1巨噬细胞的浸润在损伤后第1天时炎症因子显著增加,在第3天时达到峰值,随后降低;M2巨噬细胞的数量在第3天时也迅速增加,在第5天时达到最大值,在第7天和第9天时逐渐减少,而M2巨细胞在损伤后第5天时取代M1巨噬细胞作为伤口中的主要巨噬细胞。本研究结果与此研究结果一致。
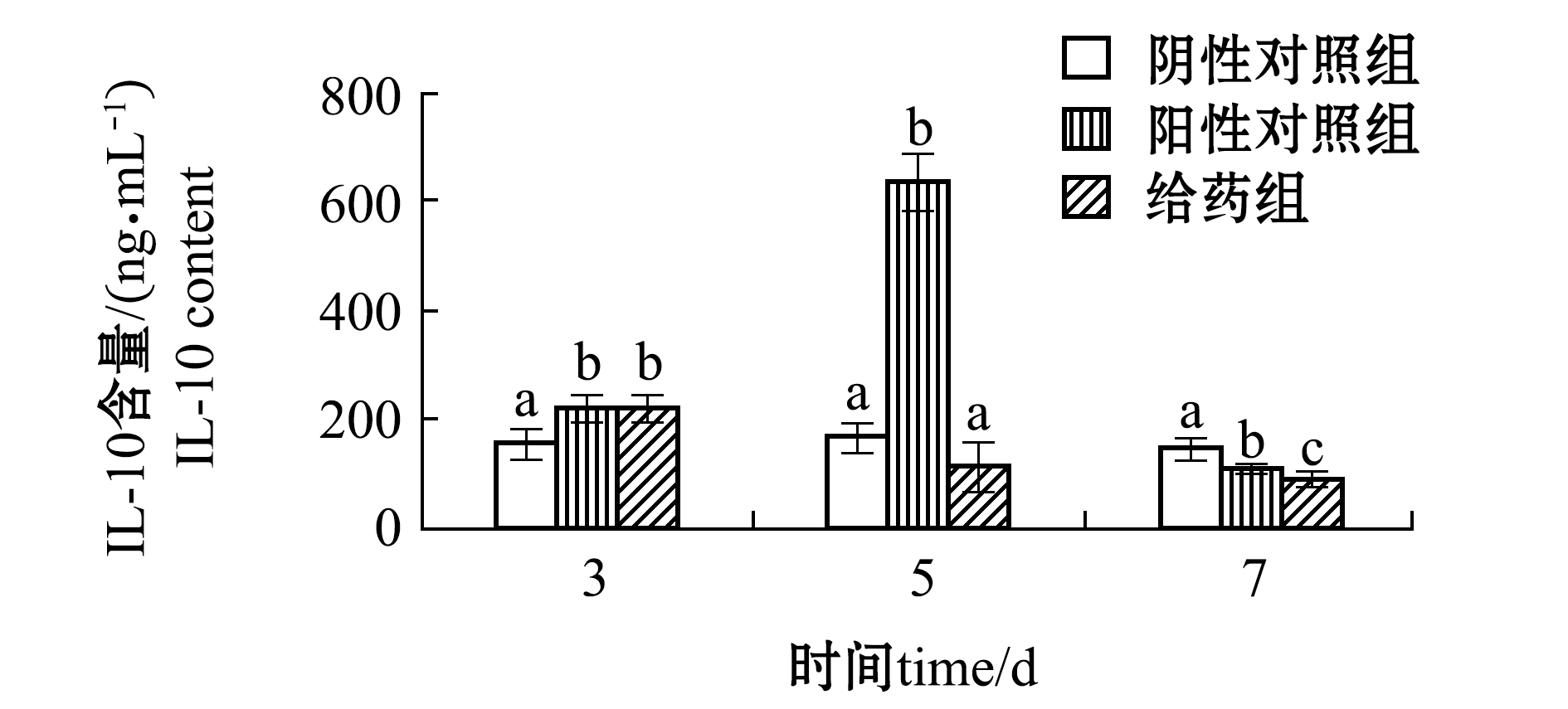
图4 EPO对创伤皮肤组织中抗炎症因子IL-10含量的影响
Fig.4 Effect of EPO on levels of anti-inflammatory factor IL-10 in wound skin tissue
2.5.4 生长因子 FGF-2具有有效的促血管生成功能,并参与各种细胞功能,包括应激后的分化、迁移、增殖等作用[26-27]。TGF-β是一种主要的细胞因子,参与瘢痕组织中发生的过度胶原合成,还可通过增强细胞迁移和信号传导起到帮助伤口愈合的良性作用[28-29]。CCND1主要功能是促进细胞增殖[30-31]。EGF促进创面愈合最主要的作用是促进创面组织的增殖和分化,增殖和分化形成的新细胞代替衰老和已经死亡的细胞[32]。
从表3可见,给药组FGF-2含量显著低于两个对照组(P<0.05),TGF-β含量显著高于阴性对照组(P<0.05),CCND1含量显著高于两个对照组(P<0.05),而EGF含量高于阴性对照组,但无显著性差异(P>0.05)。由此可以推测,EPO促进创面愈合的过程中通过加速细胞因子TGF-β的分泌促进成纤维细胞分泌胶原、增加胞外基质沉积、促进新血管形成及表皮细胞生长。同时,也通过加速细胞周期调控蛋白CCND1的表达促进成纤维细胞等细胞周期向分裂期转化,从而加速细胞的有丝分裂以实现同愈合率结果一致的创伤愈合。这表明,涂抹EPO在增殖期可通过促进TGF-β和CCND1的分泌,从而加快小鼠皮肤创伤愈合。
表3 EPO对创伤皮肤组织中生长因子的影响
Tab.3 Effect of EPO on growth factors in wound skin tissue ng/mL
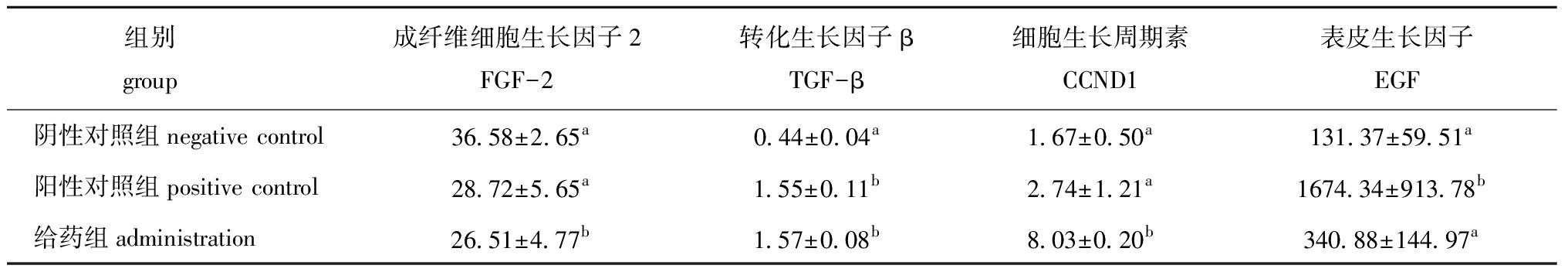
组别 group 成纤维细胞生长因子2FGF-2转化生长因子βTGF-β细胞生长周期素CCND1表皮生长因子EGF阴性对照组negative control36.58±2.65a0.44±0.04a1.67±0.50a131.37±59.51a阳性对照组positive control28.72±5.65a1.55±0.11b2.74±1.21a1674.34±913.78b给药组administration26.51±4.77b1.57±0.08b8.03±0.20b340.88±144.97a
2.5.5 羟脯氨酸含量 创伤愈合的最后阶段是重塑阶段,成纤维细胞分化成收缩的肌成纤维细胞,其收缩伤口并且在增殖期期间沉积的胶原蛋白Ⅲ被交换为具有更高拉伸强度的胶原蛋白Ⅰ,加快创面组织中胶原蛋白与其他蛋白质分子形成紧密的交联[33],可通过测定羟脯氨酸含量来反映胶原蛋白含量的变化情况。
从表4可见:造模后第7天时,给药组羟脯氨酸含量低于阴性对照组但无显著性差异(P>0.05),略高于阳性对照组(P>0.05);造模后第14天时,给药组羟脯氨酸含量高于阴性对照组,但给药组与两个对照组间均无显著性差异(P>0.05)。这表明,EPO具有一定促进胶原蛋白的分泌、沉积和交联的作用。这与创面愈合照片、愈合率、瘢痕缩小率和FGF-2含量结果一致,但羟脯氨酸含量测定结果并不理想,在后续试验中可通过调整测定指标进行进一步的验证和阐释。
3 结论
本研究中针对皮肤创伤愈合全阶段试验指标的选择,进行体外试验及涂抹给药的动物试验,结果表明,在皮肤创伤愈合过程中,涂抹牡蛎酶解产物通过抑制炎症作用,促进生长因子分泌及胶原蛋白的沉积与交联,从而加快了小鼠软组织开放性创伤愈合,且对浅表瘢痕增生具有一定的抑制作用。本研究发现并开拓了皮肤创伤愈合活性物质的来源,但其具体作用功能因子尚不确定且机理不明,后续试验将对牡蛎酶解产物进行分离纯化,以进一步阐释其机理。
表4 EPO对创伤皮肤组织中羟脯氨酸含量的影响
Tab.4 Effect of EPO on hydroxyproline level in wound skin tissueμg/mL
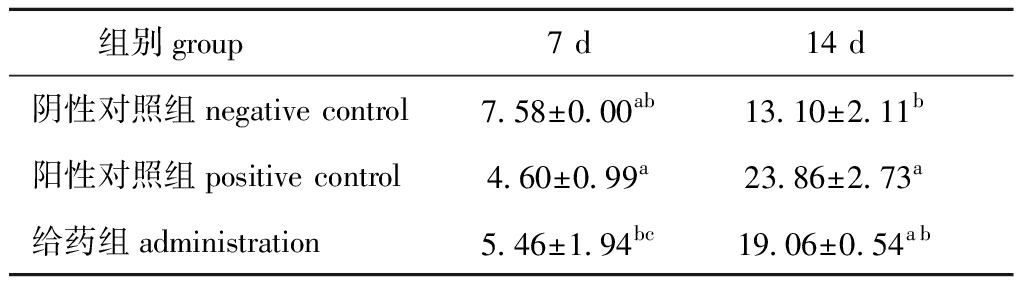
组别group7 d14 d阴性对照组negative control7.58±0.00ab13.10±2.11b阳性对照组positive control4.60±0.99a23.86±2.73a给药组administration5.46±1.94bc19.06±0.54ab
[1] 刘慧,秦小明,林华娟,等.牡蛎蛋白酶解液脱腥技术的研究[J].中国食品学报,2012,12(9):78-86.
[2] 汪秋宽,宋琳琳,徐玲,等.牡蛎抗氧化活性肽的酶解工艺研究[J].大连海洋大学学报,2009,24(2):95-99.
[3] 李婉,曹文红,章超桦,等.牡蛎酶解产物的组成特点及其体外免疫活性[J].食品工业科技,2017,38(16):35-42.
[4] 常格.牡蛎蛋白酶解产物抗疲劳作用研究及新产品研发[D].湛江:广东海洋大学,2016.
[5] 蒋杨.近江牡蛎糖胺聚糖体内抗肿瘤活性、毒理评价及口服液的研制[D].湛江:广东海洋大学,2013.
[6] Seo J K,Lee M J,Nam B H,et al.cg Molluscidin,a novel dibasic residue repeat rich antimicrobial peptide,purified from the gill of the Pacific oyster,Crassostrea gigas[J].Fish & Shellfish Immunology,2013,35(2):480-488.
[7] 林海生.牡蛎蛋白肽的酶法制备及其改善小鼠学习记忆功能的研究[D].湛江:广东海洋大学,2013.
[8] 张自然.牡蛎肉的醒酒作用及其醒酒机理的研究[D].湛江:广东海洋大学,2009.
[9] Theoret C.Tissue engineering in wound repair:the three “R”s—repair,replace,regenerate[J].Veterinary Surgery,2009,38(8):905-913.
[10] Lei Zhiyong,Chen Jingjing,Cao Zhijian,et al.Efficacy of Aeschynomene indica L.leaves for wound healing and isolation of active constituent[J].Journal of Ethnopharmacology,2019,228:156-163.
[11] Kucharzewski M,Rojczyk E,Wilemska-Kucharzewska K,et al.Novel trends in application of stem cells in skin wound healing[J].European Journal of Pharmacology,2019,843:307-315.
[12] Larouche J,Sheoran S,Maruyama K,et al.Immune regulation of skin wound healing:mechanisms and novel therapeutic targets[J].Advances in Wound Care,2018,7(7):209-231.
[13] Li Xiaojie,Wang Ying,Zou Zhirong,et al.OM-LV20,a novel peptide from odorous frog skin,accelerates wound healing in vitro and in vivo[J].Chemical Biology & Drug Design,2018,91(1):126-136.
[14] 梁锐,张召锋,赵明,等.海洋胶原肽对剖宫产大鼠伤口愈合促进作用[J].中国公共卫生,2010,26(9):1144-1145.
[15] Hu Z,Yang P,Zhou C X,et al.Marine collagen peptides from the skin of Nile tilapia(Oreochromis niloticus):characterization and wound healing evaluation[J].Marine Druges,2017,15(102):1-11.
[16] 左光扬,章超桦,高加龙,等.企鹅珍珠贝肉酶解产物的制备及其醒酒作用的初步研究[J].食品工业科技,2012,33(15):145-148.
[17] 杨发明,林海生,秦小明,等.珍珠贝外套膜酶解产物促进小鼠皮肤创伤愈合作用研究[J].大连海洋大学学报,2019,34(4):492-498.
[18] Lin Haisheng,Ishizaki S,Na Y,et al.Exploration of the antibacterial proteins in pearl oyster Pinctada fucata induced by bacterial inoculation[J].Fisheries Science,2017,83(3):489-498.
[19] 程沁园.壳聚糖止血活性及其生物安全性评价研究[D].无锡:江南大学,2013.
[20] 李密,李和生,张丽媛,等.乌贼眼透明质酸的体外抗氧化性及对小鼠创愈性质的研究[J].中国食品学报,2017,17(10):30-36.
[21] 赵秉江.黄芪多糖促进皮肤伤口愈合的作用及其相关机制的研究[D].兰州:兰州大学,2017:16.
[22] Dai Chen,Liang Yan,Hao Haioing,et al.Global detection and identification of components from Yunnan Baiyao based on liquid chromatography hybrid ion trap time-of-flight mass spectrometry[J].Journal of Separation Science,2013,36(12):1935-1944.
[23] Ladas E J,Karlik J B,Rooney D,et al.Topical Yunnan Baiyao administration as an adjunctive therapy for bleeding complications in adolescents with advanced cancer[J].Supportive Care in Cancer,2012,20(12):3379-3383.
[24] Das A,Sinha M,Datta S,et al.Monocyte and macrophage plasticity in tissue repair and regeneration[J].The American Journal of Pathology,2015,185(10):2596-2606.
[25] Du Yu,Ren Peng,Wang Qi,et al.Cannabinoid 2 receptor attenuates inflammation during skin wound healing by inhibiting M1 macrophages rather than activating M2 macrophages[J].Journal of Inflammation,2018,15:25.
[26] Subramaniam N,Petrik J J,Vickaryous M K.VEGF,FGF-2 and TGFβ expression in the normal and regenerating epidermis of geckos:implications for epidermal homeostasis and wound healing in reptiles[J].Journal of Anatomy,2018,232(5):768-782.
[27] Lu Lu,Wang Dongtao,Shi Ying,et al.Astragalus polysaccharide improves muscle atrophy from dexamethasone- and peroxide-induced injury in vitro[J].International Journal of Biological Macromolecules,2013,61:7-16.
[28] Choi S Y,Kim B H,Huh B K,et al.Tranilast-delivery surgical sutures to ameliorate wound healing by reducing scar formation through regulation of TGF-β expression and fibroblast recruitment[J].Journal of Industrial and Engineering Chemistry,2018,67:469-477.
[29] Demidova-Rice T N,Hamblin M R,Herman I M.Acute and impaired wound healing:pathophysiologyand current methods for drug delivery,part 2:role of growth factors in normal and pathological woundhealing:therapeutic potential and methods of delivery[J].Advances in Skin & Wound Care,2012,25(8):349-370.
[30] Li Lake,Hai Jie,Li Zhiqiang,et al.Resveratrol modulates autophagy and NF-κB activity in a murine model for treating non-alcoholic fatty liver disease[J].Food and Chemical Toxicology,2013,63:166-173.
[31] Qin Qiaojing,Niu Jiangying,Wang Zhaoxia,et al.Astragalusmembranaceus inhibits inflammation via phospho-P38 mitogen-activated protein kinase (MAPK) and nuclear factor (NF)-kappa B pathways in advanced glycation end product-stimulated macrophages[J].International Journal of Molecular Sciences,2012,13(7):8379-8387.
[32] He Xiaojuan,Niu Xuyan,Li Jian,et al.Immunomodulatory activities of five clinically used Chinese herbal polysaccharides[J].Journal of Experimental and Integrative Medicine,2012,2(1):15-27.
[33] Dekker A,Davis F M,Kunkel S L,et al.Targeting epigenetic mechanisms in diabetic wound healing[J].Translational Research,2019,204:39-50.