青虾Macrobrachium nipponense学名日本沼虾,又名河虾,隶属于甲壳纲Crustacea、十足目Decapoda、沼虾属Macrobrachium,广泛分布于中国内陆淡水水域[1]。青虾具有繁殖力高、适应性强、食性杂、营养丰富、肉味鲜美等优点,含有抗氧化、抗肿瘤、预防心脑血管疾病的虾青素,是深受大众喜爱的名贵水产品,也是中国重要的淡水养殖虾类[2]。目前,随着青虾养殖规模不断扩大,养殖水质不断恶化,青虾病害频发,其成活率不断下降,极大地影响了青虾养殖产业的可持续发展。
在水产养殖中,改良水质、防治疾病的传统手段主要依靠抗生素和化学类药物,但长期使用这些药物易导致耐药性、环境污染、药物残留等问题,给养殖业和人类健康带来严重的危害[3]。近年来,人们提出了益生菌作为添加剂来替代抗生素和化学类药物的使用,益生菌是通过调控动物肠道微生物区系平衡从而有效促进宿主动物健康和生长的微生物活菌制剂,具有无毒、无副作用、无污染、不产生抗药性等优点,是肠道内的优势菌群[4]。目前已作为水质改良剂或免疫增强剂的益生菌有光合细菌[5]、芽孢杆菌[6]、乳酸菌[7]、硝化/反硝化细菌[8]和酵母菌[9]等几大类。凝结芽孢杆菌 Bacillus coagulans是一类能产乳酸的芽孢杆菌,于1932年被首次发现[10],目前已被中国农业农村部列入质量保护期内的新型饲料添加剂。凝结芽孢杆菌既能在无氧条件下产乳酸,又具有芽孢杆菌丰富的酶系统及抗逆性强、耐高温高压和稳定的储存特性[11],近年来逐渐成为益生菌研究的热点。但凝结芽孢杆菌在青虾养殖中的应用目前鲜有报道,鉴于此,本研究中初步探讨了凝结芽孢杆菌对青虾养殖水质、免疫力和抗病力的影响,以期为凝结芽孢杆菌在青虾养殖中的应用提供数据参考。
1 材料与方法
1.1 材料
试验用青虾购自江苏省宿迁市泗阳县为民阳光水产养殖专业合作社,选择体质健壮、规格统一,体质量为(2.50±0.32)g的青虾600尾暂养于实验室。试验用凝结芽孢杆菌分离自池塘底泥,经分子鉴定后用甘油管保存于超低温冰箱(-80 ℃)中。试验用基础饲料为对虾配合饲料,购自射阳六和饲料有限公司。
1.2 方法
1.2.1 菌株活化和发酵 取甘油保存的凝结芽孢杆菌100 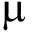 L接种于TYG培养基平板上,置于50 ℃恒温培养箱中培养,待菌落长出后挑取单菌落接种于TYG液体培养基进行发酵培养,于50 ℃下培养48 h,将培养液以6500 r/min离心10 min,去掉上清液,将固体用无菌PBS溶液重悬即为凝结芽孢杆菌菌液。
L接种于TYG培养基平板上,置于50 ℃恒温培养箱中培养,待菌落长出后挑取单菌落接种于TYG液体培养基进行发酵培养,于50 ℃下培养48 h,将培养液以6500 r/min离心10 min,去掉上清液,将固体用无菌PBS溶液重悬即为凝结芽孢杆菌菌液。
1.2.2 试验设计 青虾在实验室暂养1周后,随机分为4组,分别记为A0、A1、A2、A3组,每组设3个重复,每个重复放50尾虾。A0组为对照组,水体中不添加凝结芽孢杆菌,A1、A2、A3组向水体中添加凝结芽孢杆菌至终浓度分别为105 、 106 、107 CFU/mL。
1.2.3 饲养管理 养殖试验在江苏省农科院宿迁农科所恒温循环水养殖系统中进行。各组试验虾投喂基础饲料,每天8:00、17:00投喂,投饲量为虾体质量的6%,每周调整一次投喂量。每天早上投喂前排出粪便和残饵,每7 d换水一次,换水量为水体体积的1/3,换水后各试验组补充一定量的凝结芽孢杆菌菌液至试验所需浓度。试验期间保持水温为(25±1)℃,pH为6.5~7.5,溶解氧>6 mg/L,养殖试验周期为28 d。
1.2.4 样品采集和指标测定
(1) 水体氮磷指标。在养殖试验过程中的第7、14、21和28天换水前取各组养殖水体,检测水样中氮磷含量。采用纳氏试剂分光光度法、盐酸-萘乙二胺分光光度法和紫外分光光度法分别测定总氨氮、亚硝酸盐氮和硝酸盐氮含量,采用过硫酸钾-硼酸-氢氧化钠加压联合消化法测定总氮、总磷含量。
(2) 青虾肠道菌群数量。养殖试验结束后测定青虾肠道细菌总数及弧菌数、乳酸杆菌和双歧杆菌数量。从各组分别取5尾虾,采用稀释涂布法,在无菌条件下取出青虾肠道,去除内容物后用PBS溶液漂洗,然后把肠道置于匀浆器中研磨,制成匀浆液,用PBS溶液将匀浆液按梯度稀释成10-4、10-5和10-6浓度。取200 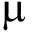 L稀释后的匀浆液分别涂布于2216E琼脂培养基、TCBS琼脂培养基、MRS琼脂培养基和BSM琼脂培养基上,以计数细菌总数、弧菌数、乳酸杆菌数和双歧杆菌数。
L稀释后的匀浆液分别涂布于2216E琼脂培养基、TCBS琼脂培养基、MRS琼脂培养基和BSM琼脂培养基上,以计数细菌总数、弧菌数、乳酸杆菌数和双歧杆菌数。
(3) 免疫酶活性。养殖结束后将青虾饥饿处理24 h,从每个重复随机取5尾虾采血,将采集的血样放入无菌EP管中。将含有血样的EP管置于冰上4 h,于4 ℃下以5000 r/m离心10 min,收集血清。分装后置于冰箱(-80 ℃)中保存备用。碱性磷酸酶(ALP)、酸性磷酸酶(ACP)、超氧化物歧化酶(SOD)和溶菌酶(LZM)活性测定所用试剂盒均购于南京建成生物工程研究所。
(4) 抗病力检测。养殖结束后用嗜水气单胞菌对各组试验虾进行攻毒试验。将嗜水气单胞菌 Aeromonas hydrophila接种于LB培养基中,培养、离心、冲洗、计数后,用0.65%生理盐水调节菌液浓度为108 CFU/mL。每组随机选取30尾虾进行攻毒试验,向每尾青虾的第二腹节肌肉中注射50 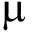 L嗜水气单胞菌液,攻毒后观察并记录各组青虾死亡情况,攻毒试验持续48 h,期间及时捞出死虾。试验结束后记录各组青虾的死亡情况并计算存活率。
L嗜水气单胞菌液,攻毒后观察并记录各组青虾死亡情况,攻毒试验持续48 h,期间及时捞出死虾。试验结束后记录各组青虾的死亡情况并计算存活率。
1.3 数据处理
试验数据采用SPSS 19.0软件进行单因素方差(One-way ANOVA)分析,试验结果以平均值±标准差(mean±S.D.)表示,当差异显著(P<0.05)时,进行Duncan多重比较。
2 结果与分析
2.1 各组养殖水体氮磷指标的变化
2.1.1 总氨氮、亚硝酸盐氮、硝酸盐氮、总无机氮含量 从图1可见:第0~12天时各组养殖水体的总氨氮含量无明显差异(P>0.05),第16~28天时各试验组总氨氮含量均显著低于对照组(P<0.05),且A3组含量最低;第0~16天时各组水体中亚硝酸盐氮含量无明显差异(P>0.05),第20~28天时各试验组水体亚硝酸盐氮含量均低于对照组,其中A3组含量最低且显著低于对照组(P<0.05);第0~8天时各组水体硝酸盐氮含量无明显差异(P>0.05),第12~20天时各组水体硝酸盐氮含量迅速增加,各试验组含量显著低于对照组(P<0.05),第24~28天时各组水体硝酸盐氮含量均有下降趋势,至第28天时A2和A3组含量较低且均显著低于对照组(P<0.05);第0~12天时各组总无机氮含量无明显差异(P>0.05),第16~28天时对照组水体总无机氮含量迅速增高,显著高于各试验组(P<0.05),且A3组含量最低。
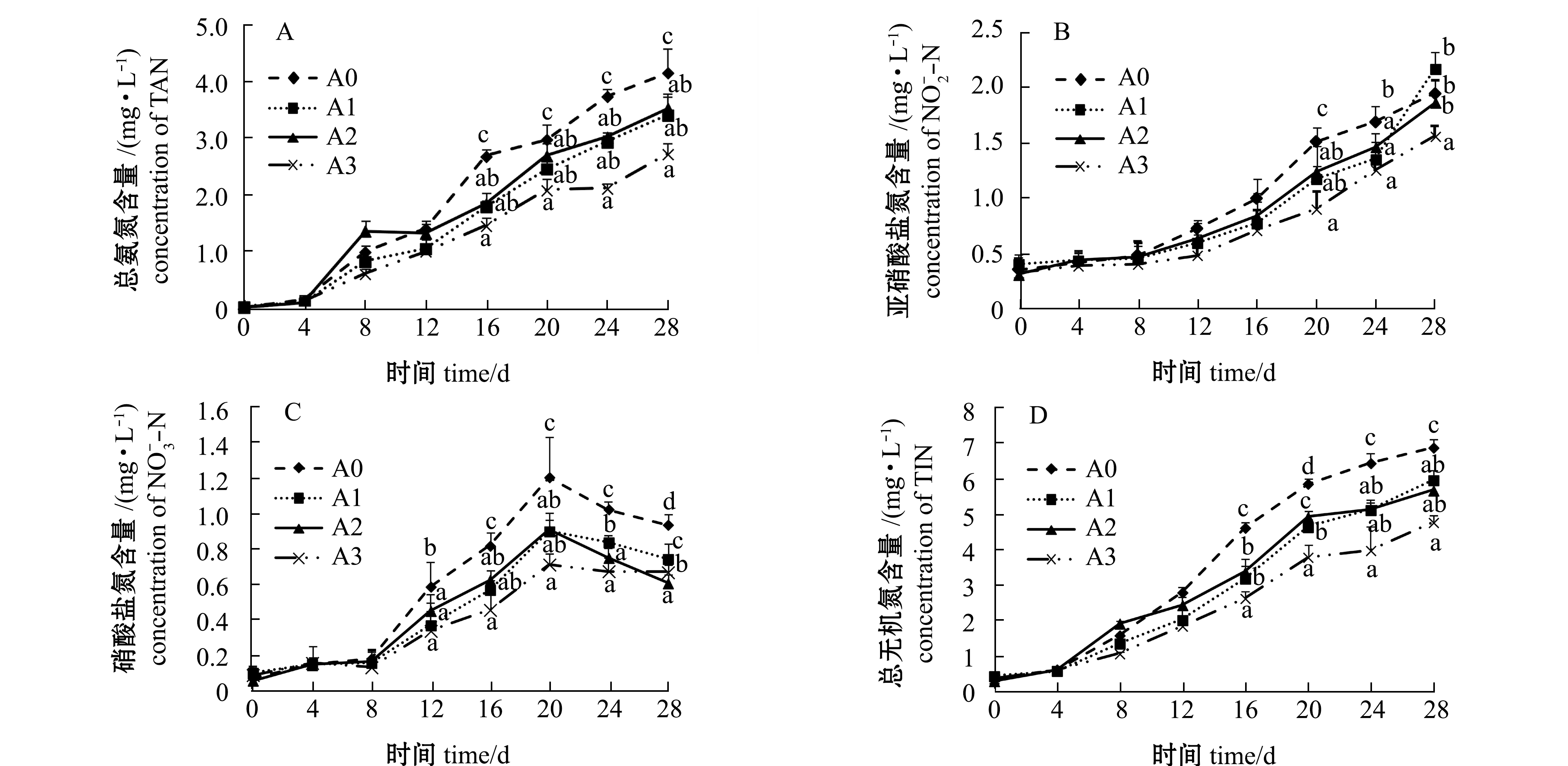
注:同一时间下,标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note: The means with different letters in different group in same time are significant differences at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图1 凝结芽孢杆菌对水体总氨氮、亚硝酸盐氮、硝酸盐氮和总无机氮含量的影响
Fig.1 Effect of Bacillus coagulans on contents of ammonia nitrogen, nitrite nitrogen, nitrate nitrogen and total inorganic nitrogen in water
2.1.2 正磷酸盐和总磷含量 从图2可见:第0~16天时各组水体正磷酸盐含量无明显差异(P>0.05),第20~28天时对照组正磷酸盐含量显著高于各试验组(P<0.05),且A3组含量保持较低;第0~8天时各试验组水体总磷含量低于对照组,第12~28天时对照组水体总磷含量迅速增高,显著高于各试验组(P<0.05),而A3组含量增加趋势最缓,且明显低于其他组。
2.2 青虾肠道可培养细菌数量
从表1可见:试验组较对照组总菌数均有增加,但仅A2组显著高于对照组(P<0.05);试验组弧菌数量较对照组均有降低,但仅A2、A3组显著低于对照组(P<0.05),分别较对照组降低15.6%和18.4%;各试验组乳酸杆菌数量较对照组略有增加,但无显著性差异(P>0.05),其中A1和A3组分别比对照组增加7.4%和15.8%;A1、A2和A3组双歧杆菌数分别比对照组增加6.4%、16.2%和9.9%,仅A2组显著高于对照组(P<0.05)。
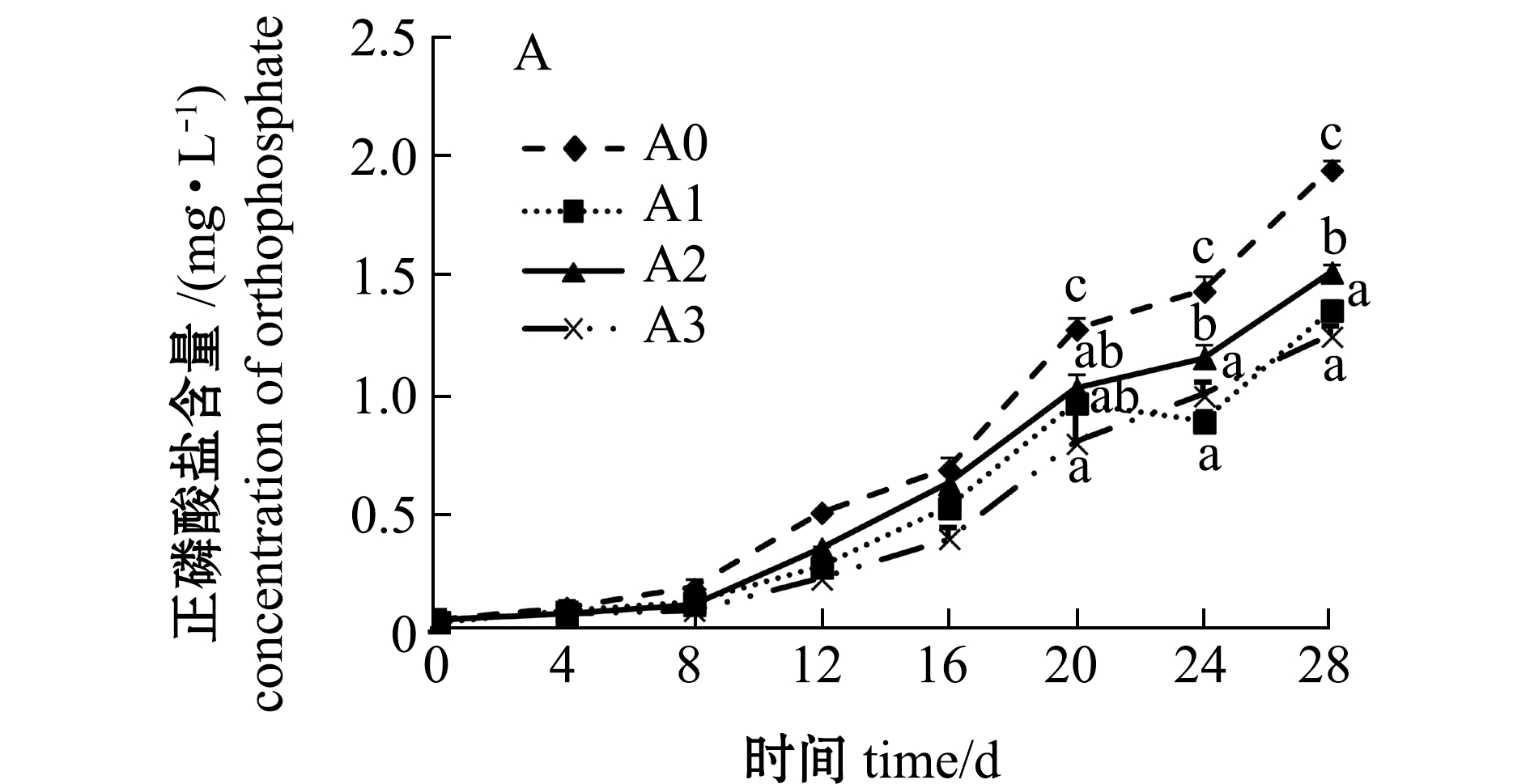
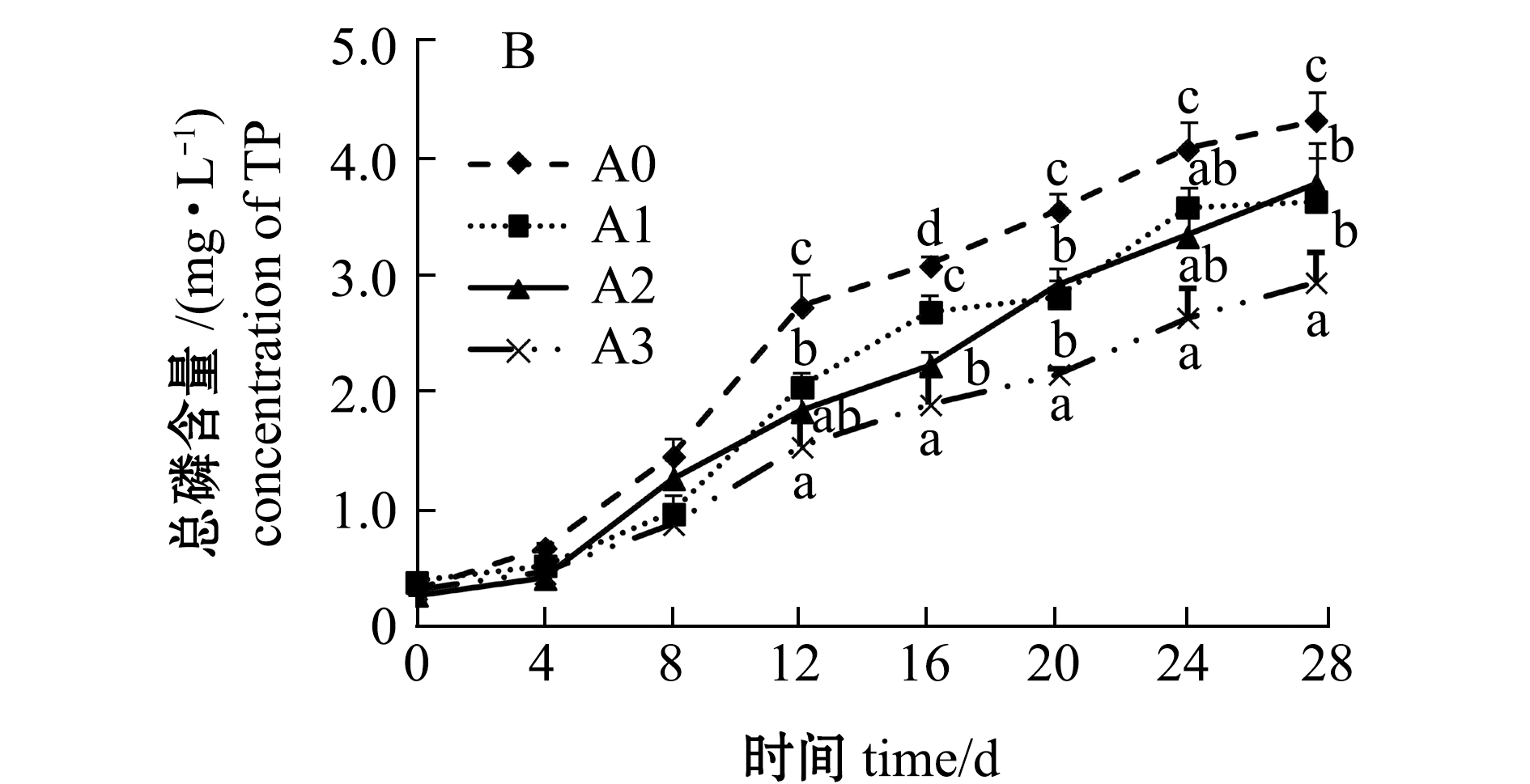
图2 凝结芽孢杆菌对水体磷酸盐和总磷含量的影响
Fig.2 Effect of Bacillus coagulans on contents of orthophosphate and total phosphorus in water
2.3 青虾血清免疫酶活性
从表2可见:凝结芽孢杆菌对青虾血清ACP、
表1 青虾肠道可培养细菌数量
Tab.1 Total culturable bacterial counts in intestinal tract of oriental river prawn Macrobrachium nipponense
lg CFU/g
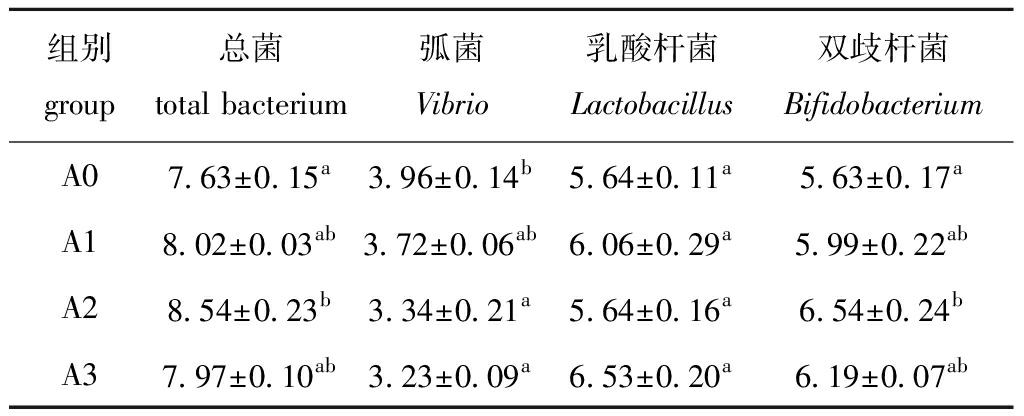
组别group总菌total bacterium弧菌Vibrio乳酸杆菌Lactobacillus双歧杆菌BifidobacteriumA07.63±0.15a3.96±0.14b5.64±0.11a5.63±0.17aA18.02±0.03ab3.72±0.06ab6.06±0.29a5.99±0.22abA28.54±0.23b3.34±0.21a5.64±0.16a6.54±0.24bA37.97±0.10ab3.23±0.09a6.53±0.20a6.19±0.07ab
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
表2 凝结芽孢杆菌对青虾血清免疫酶活性的影响
Tab.2 Effects of Bacillus coagulans on serum immune enzyme activities in oriental river prawn Macrobrachium nipponense
U/mL
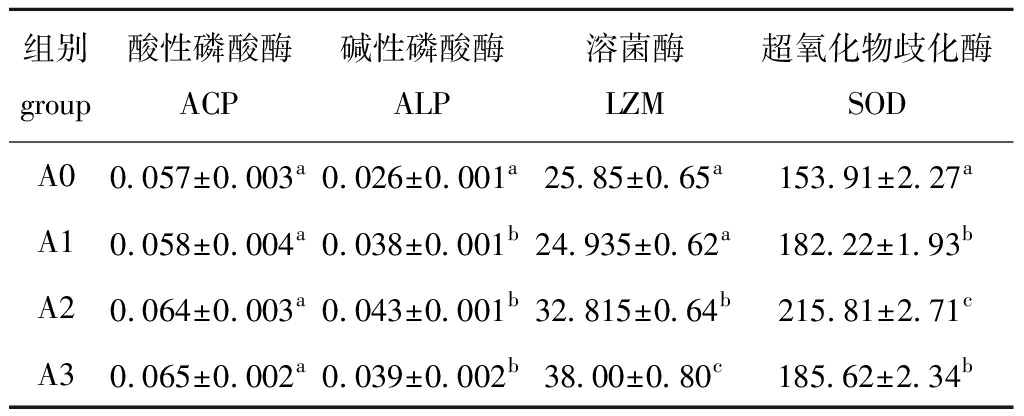
组别group酸性磷酸酶ACP碱性磷酸酶ALP溶菌酶LZM超氧化物歧化酶SODA00.057±0.003a0.026±0.001a25.85±0.65a153.91±2.27aA10.058±0.004a0.038±0.001b24.935±0.62a182.22±1.93bA20.064±0.003a0.043±0.001b32.815±0.64b215.81±2.71cA30.065±0.002a0.039±0.002b38.00±0.80c185.62±2.34b
ALP、LZM和SOD活性均有不同程度的提高;各试验组ACP活性较对照组略有所提高,但无显著性差异(P>0.05);试验组ALP活性均显著高于对照组(P<0.05);A2和A3组LZM活性显著高于对照组和A1组(P<0.05);试验组SOD活性均显著高于对照组(P<0.05)。
2.4 嗜水气单胞菌感染后青虾的成活率
从图3可见:凝结芽孢杆菌能显著提高青虾感染嗜水气单胞菌后的成活率;攻毒后A0组青虾成活率显著低于试验组(P<0.05),A3组抗病性最好,成活率达60%,显著高于其他各组(P<0.05)。
3 讨论
3.1 凝结芽孢杆菌对青虾养殖水体水质的影响
在水产养殖过程中,水体污染物的主要来源是残饵、粪便和水生生物尸体等,这些有机物经水体中微生物分解成含氮无机物,如氨氮和亚硝酸盐氮等,而水体中含氮无机物含量过高不仅损害养殖动物的组织器官,影响机体氧气运输和正常呼吸,还会降低养殖动物免疫力,促进某些条件致病菌的增殖,增加病害发生率,严重影响水产养殖效益,因此,可以说养殖水体中含氮无机物含量是评价水体污染程度的关键指标之一[12-13]。有研究表明,益生菌能在一定程度上降低水体中含氮无机物含量,改善水质,其原理是利用益生菌自身的代谢活动或产生的代谢产物,对水体中含氮无机物进行氨化、氧化和硝化等作用,降解水体中含氮无机物[14],且益生菌还能分泌抑菌物质和竞争生态位以抑制致病菌的增殖[15],从而达到改善水质的目的。
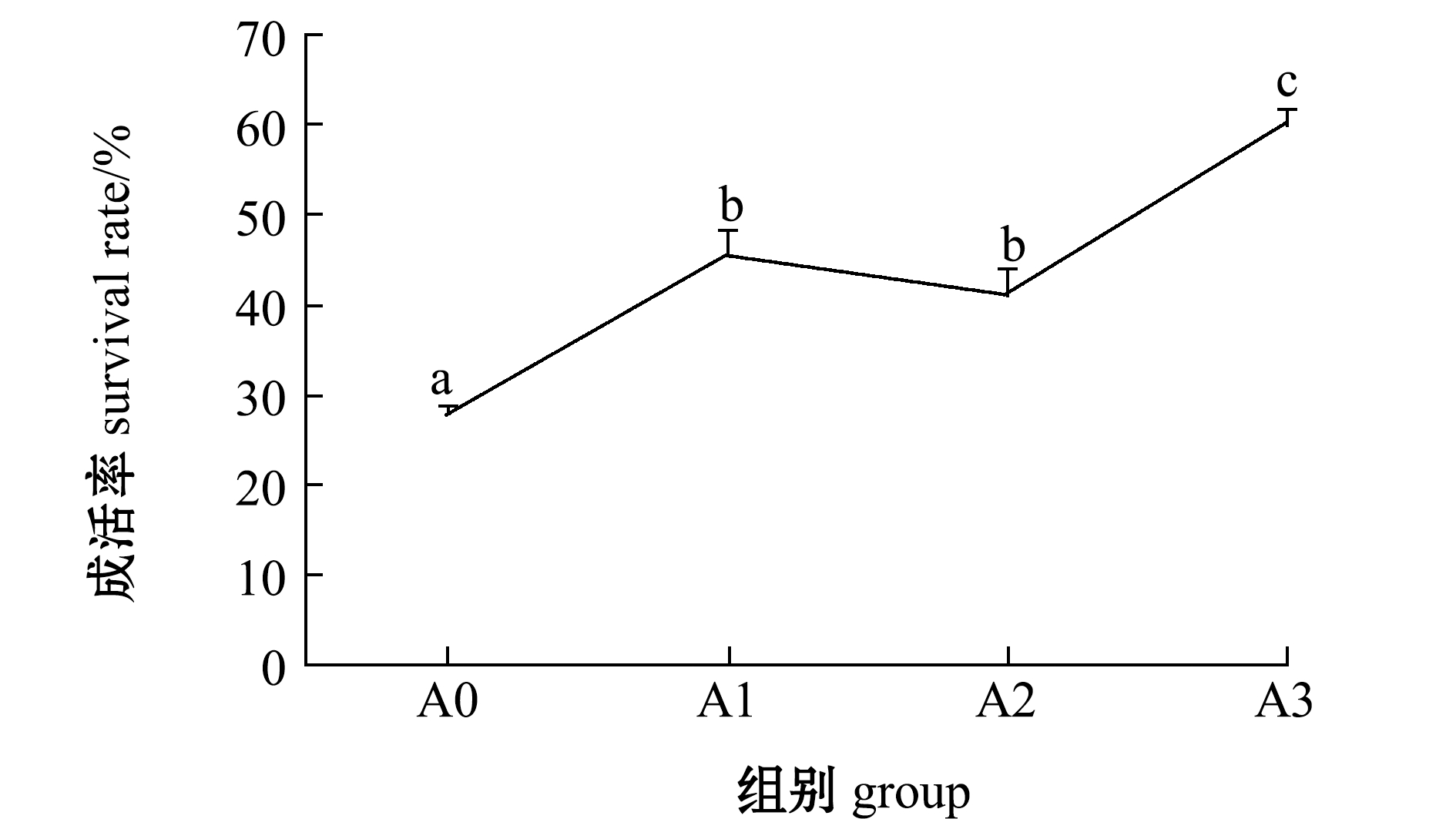
注:标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note: The means with different letters are significant differences at the 0.05 probability level, and the means with the same letters are not significant differences
图3 凝结芽孢杆菌对青虾感染嗜水气单胞菌后成活率的影响
Fig.3 Effect of Bacillus coagulans on survival rates of oriental river prawn challenged with Aeromonas hydrophila
本试验中,添加凝结芽孢杆菌的各试验组水质氮磷指标均明显低于对照组,且各组除硝酸盐氮外,其他指标均随养殖时间的延长而升高,这说明凝结芽孢杆菌能一定程度地降解水体中的无机氮和磷,这与Wang等[16]将凝结芽孢杆菌添加到凡纳滨对虾养殖池中,水中氨氮和亚硝酸盐氮含量随时间有下降趋势的结果不一致,这可能是因为不同菌株间改善水质能力不一样,或者由于试验环境的不同影响菌株发挥作用。Zokaeifar等[17]将芽孢杆菌L10和G1以同比例加入凡纳滨对虾养殖水体中,结果表明,这两株芽孢杆菌均能显著降低水体中的氨氮、亚硝酸盐氮和硝酸盐氮含量。Liu等[18]将芽孢杆菌E20添加到凡纳滨对虾饲料中,结果显示,试验组和对照组的氨氮和亚硝酸盐氮含量无显著性差异,出现不同结果的原因可能是不同菌株的功能性有所不同,或者芽孢杆菌在试验过程中可能受到营养或者环境等因素的影响,也可能是由于菌种添加方式不同。
3.2 凝结芽孢杆菌对青虾肠道菌群的影响
肠道菌群是机体重要的“微生物器官”,正常情况下,机体肠道中有益菌和有害菌处于动态平衡,这种平衡维持着机体肠道内环境的稳定性,从而可以帮助机体有效抑制外源致病菌的入侵,同时,也可增强机体非特异性免疫[19]。
乳酸菌和弧菌是存在于人和动物肠道内的优势菌群,在肠道内最重要的乳酸菌是乳酸杆菌和双歧杆菌,它们在人和动物胃肠道健康中发挥着重要的作用[20],乳酸杆菌和双歧杆菌在机体肠道内可以通过竞争生存空间和营养来抑制致病菌在肠道内繁殖和生长,并与其他有益菌构成了外源致病菌入侵的屏障[21-22],因此,它们也被认为是机体健康的重要指标之一。弧菌是存在于机体肠道内的条件致病菌,随着机体生理状况和外界环境的变化,肠道内的弧菌可以引起机体发病,弧菌病是在水产养殖动物中普遍流行且危害最大的细菌性疾病,对水产养殖业造成了严重的经济损失[23-24]。
沈锦玉等[25]研究表明,枯草芽孢杆菌可显著增加翘嘴红鲌、异育银鲫和日本沼虾肠道内乳酸杆菌和双歧杆菌等有益菌群的数量。张盛静等[26]研究表明,将地衣芽孢杆菌添加到凡纳滨对虾饲料中,对虾肠道细菌总数在养殖中后期显著高于对照组,且在整个养殖期间,试验组对虾肠道弧菌数量显著低于对照组。孟霄鹏等[27]以类芽孢杆菌和双歧杆菌为复合益生菌,添加到凡纳滨对虾饲料中饲喂对虾,随后用变性梯度凝胶电泳检测对虾肠道,结果显示,对照组对虾肠道细菌种类以变形菌门Proteobacteria为主,试验组对虾肠道细菌种类属于厚壁菌门Firmicutes、放线菌门Actinobacteria、拟杆菌门Bacteroidetes和变形菌门Proteobacteria,这说明益生菌可明显改变对虾肠道菌群结构,并且可以增加肠道中有益菌的数量。本试验结果表明,添加凝结芽孢杆菌能对青虾肠道菌群产生有益调节,肠道乳酸杆菌数量有所增加,可致培养细菌总数和双歧杆菌数量显著增加,这与沈锦玉等[25]的研究结果相同;而肠道有害菌群如弧菌数量受到显著抑制,这与张盛静等[26]的研究结果一致。这说明凝结芽孢杆菌能改善青虾肠道菌群的数量,调节青虾肠道微生态环境。
3.3 凝结芽孢杆菌对青虾非特异性免疫力的影响
虾的免疫系统主要依靠非特异性免疫酶和因子抵制外源病原菌和疾病,维持机体正常免疫功能和生理机能[28],而非特异性免疫酶的评价指标主要是血细胞和血淋巴中的碱性磷酸酶(ALP)、酸性磷酸酶(ACP)、溶菌酶(LZM)和超氧化物歧化酶(SOD)等的活性。益生菌作为免疫激活剂在水产养殖中的应用已经得到广泛研究[29],其原理可能是通过细菌本身及其代谢产物,或者细胞壁成分加快机体免疫系统发育和成熟,刺激非特异性免疫系统发挥作用,从而增强机体免疫机能[30]。目前,凝结芽孢杆菌对机体非特异性免疫影响的研究较多,尽管益生菌的益生效应比较明显,但许多研究结果并不相同,这可能是由于动物种类、菌株特性、添加浓度或环境因素等存在差异。周慧慧等[31]从刺参肠道中分离出两株芽孢杆菌,并将其用于稚参养殖中,结果表明,芽孢杆菌可显著提高稚参体组织中的酚氧化酶(PO)、LZM、ACP和SOD活性。汪波等[32]将凝结芽孢杆菌按不同比例添加到凡纳滨对虾饲料中,结果表明,试验组SOD、ALP和ACP活性显著高于对照组,但PO和过氧化物酶(POD)活性均与对照组无显著性差异。袁丰华等[33]研究结果显示,凝结芽孢杆菌对尖吻鲈的血清ALP、POD和SOD含量未有显著性影响,且试验组ALP和POD含量均比对照组低。本研究结果显示,凝结芽孢杆菌可显著提高青虾血清ALP、LZM和SOD含量,血清ACP含量有所提高,但与对照组无显著性差异。
3.4 凝结芽孢杆菌对青虾抗病力的影响
大量研究表明,芽孢杆菌应用于水产养殖中可使养殖水体和动物肠道中的有益菌比例提高,并通过竞争营养和生存空间抑制有害菌的生长繁殖;芽孢杆菌在代谢过程中能分泌抗菌活性物质(比如抗菌肽和细菌素等),这些活性物质经过一系列作用可诱导病原菌细胞凋亡或抑制其细胞壁合成;芽孢杆菌进入机体后可以分泌抗氧化酶,或者自身作为激活剂促进机体免疫酶和抗氧化酶的分泌,增强机体免疫力,从而提高养殖动物的成活率[29,34-35]。本试验中给试验虾注射一定剂量的嗜水气单胞菌,48 h后可见芽孢杆菌试验组青虾成活率显著高于对照组,其中,添加107 CFU/mL凝结芽孢杆菌可将青虾攻毒后成活率提高至60%,显著高于其他组,本试验结果表明,添加凝结芽孢杆菌可显著提高青虾抗病力,这与刘君等[36]的研究结果一致。综合以上试验结果,推测凝结芽孢杆菌可能是通过改善养殖水质,调节青虾肠道有益菌和致病菌数量,以及增强非特异性免疫力等的综合作用,从而提高青虾抗病力。
王明阳等[37]将凝结芽孢杆菌按5.0×109、1.0×1010、5.0×1010和1.0×1011 CFU/kg 的浓度添加到饲料中饲喂凡纳滨对虾,用副溶血弧菌Vibrio parahaemolyticus攻毒后显示,5.0×109、1.0×1011 CFU/kg处理组对虾累积死亡率显著低于对照组,而1.0×1010、5.0×1010 CFU/kg处理组与对照组无显著性差异。Zokaeifar等[38]研究表明,饲料中添加芽孢杆菌后凡纳滨对虾抵抗哈维氏弧菌Vibrio harveyi感染的能力显著增强,试验组凡纳滨对虾累积死亡率显著低于对照组。刘龙镇等[39]研究了微生态制剂不同添加方式对凡纳滨对虾抵抗副溶血弧菌的感染能力,结果表明,除拌服微生态制剂组外,喷涂复合菌制剂组、复合菌酶颗粒组和固体发酵制剂组对虾的累积死亡率均显著低于对照组。本试验为水体中泼洒益生菌,因此,不同的益生菌添加方式对凡纳滨对虾抗病力的影响也不相同。
4 结论
本研究结果表明,在水体中添加适量的凝结芽孢杆菌可以降解青虾养殖中产生的无机氮和磷,改善养殖水质,调节青虾肠道微生态环境,增加有益菌数量,降低弧菌数量,提高血清免疫酶(ACP、ALP、LZM和SOD)活性,从而增强青虾免疫力,提高抗病力。
[1] 刘瑞玉,梁象秋,严生良.中国长臂虾亚科的研究Ⅰ:沼虾属、瘦虾属和拟瘦虾属[M]//甲壳动物学论文集.北京:科学出版社,1990:102-134.
[2] 傅洪拓,万山青,付春鹏,等.青虾生长性状相关的微卫星标记筛选[J].水生生物学报,2010,34(5):1043-1048.
[3] Oke A O,Olaoye O J,Nnali K E.Recent advances in fish diseases treatment:probiotics as alternative therapy to antibiotics in aquaculture “a review”[J].Advances in Agriculture,Sciences and Engineering Research,2013,3(2):668-676.
[4] Arena M P,Russo P,Capozzi V,et al.Probiotic abilities of riboflavin-overproducing Lactobacillus strains:a novel promising application of probiotics[J].Applied Microbiology and Biotechnology,2014,98(17):7569-7581.
[5] Wang Y.Use of probiotics Bacillus coagulans,Rhodopseudomonas palustris and Lactobacillus acidophilus as growth promoters in grass carp (Ctenopharyngodon idella) fingerlings[J].Aquaculture Nutrition,2011,17(2):e327-e378.
[6] 程远,黄凯,黄秀芸,等.饲料中添加枯草芽孢杆菌对吉富罗非鱼幼鱼生长性能、免疫力和抗氧化功能的影响[J].动物营养学报,2014,26(6):1503-1512.
[7] 黄燕华,周晓波,王国霞,等.5种乳酸菌对奥尼罗非鱼免疫和抗病力的影响[J].水产科学,2014,33(10):601-605.
[8] 邢国伟,李彦芹,李凤超,等.一株反硝化细菌与光合细菌对养殖海水的净化效果[J].生物技术通报,2014(3):151-154.
[9] Yu H H,Han F,Xue M,et al.Efficacy and tolerance of yeast cell wall as an immunostimulant in the diet of Japanese seabass (Lateolabrax japonicus)[J].Aquaculture,2014,432:217-224.
[10] Sarles W B,Hammer B W.Observations on Bacillus coagulans[J].Journal of Bacteriology,1932,23(4):301-314.
[11] Ozório R,Kopecka-Pilarczyk J,Peixoto M J,et al.Dietary probiotic supplementation in juvenile rainbow trout (Oncorhynchus mykiss) reared under cage culture production:effects on growth,fish welfare,flesh quality and intestinal microbiota[J].Aquaculture Research,2016,47(9):2732-2747.
[12] 韩天坤,杨凤,贾甲,等.总氨态氮对菲律宾蛤仔早期生长发育的影响[J].大连海洋大学学报,2018,33(2):210-216.
[13] 李波.氨氮和亚硝酸盐对黄颡鱼的毒性研究[D].武汉:华中农业大学,2010.
[14] 李咏梅,任贻超,姜森灏,等.渔源乳酸菌降解养殖水体氨氮的效果研究[J].水产科学,2018,37(4):499-504.
[15] 吴保承,沈国强,杨春霞,等.微生态制剂在水质净化中的应用现状及展望[J].环境科学与技术,2010,33(S2):408-410.
[16] Wang Jun,Zhao Lin.Study on the application of Bacillus coagulans to purify aquaculture water[J].Advanced Materials Research,2012,343-344:988-993.
[17] Zokaeifar H,Babaei N,Saad C R,et al.Administration of Bacillus subtilis strains in the rearing water enhances the water quality,growth performance,immune response,and resistance against Vibrio harveyi infection in juvenile white shrimp,Litopenaeus vannamei[J].Fish & Shellfish Immunology,2014,36(1):68-74.
[18] Liu C H,Chiu C S,Ho P L,et al.Improvement in the growth performance of white shrimp,Litopenaeus vannamei,by a protease-producing probiotic,Bacillus subtilis E20,from natto[J].Journal of Applied Microbiology,2009,107(3):1031-1041.
[19] 宋增福,吴天星.鱼类肠道正常菌群研究进展[J].水产科学,2007,26(8):471-474.
[20] Ishibashi N,Yaeshima T,Hayasawa H.Bifidobacteria:their significance in human intestinal health[J].Malaysian Journal of Nutrition,1997,3:149-159.
[21] Ringø E,Gatesoupe F J.Lactic acid bacteria in fish:a review[J].Aquaculture,1998,160(3-4):177-203.
[22] Rani V U,Pradeep B V.Application of anticancer agents from fermentation of soy using Bifidobacterium and Lactobacillus sp.,a review[J].Academic Journal of Cancer Research,2014,7(3):185-192.
[23] 安伟,张海强,高晓华.上海地区虾源弧菌分离鉴定及分子分型研究[J].中国农学通报,2018,34(36):140-145.
[24] 闫茂仓,陈少波,单乐州,等.海水养殖动物致病弧菌的研究进展[J].水产科学,2009,28(8):475-481.
[25] 沈锦玉,沈智华,尹文林,等.饲喂枯草芽孢杆菌对银鲫等水生动物肠道菌群及消化酶活性的影响[J].水产学报,2004,28(S1):146-150.
[26] 张盛静,赵小金,宋晓玲,等.饲料添加益生菌对凡纳滨对虾肠道菌群、Toll受体及溶菌酶基因表达及抗感染的影响[J].中国水产科学,2016,23(4):846-854.
[27] 孟霄鹏,孟阳,王悦,等.益生菌对凡纳滨对虾免疫功能及肠道菌群的影响[J].水产科学,2017,36(1):60-65.
[28] Duan Yafei,Liu Ping,Li Jitao,et al.Molecular responses of calreticulin gene to Vibrio anguillarum and WSSV challenge in the ridgetail white prawn Exopalaemon carinicauda[J].Fish & Shellfish Immunology,2014,36(1):164-171.
[29] Gomez-Gil B,Roque A,Turnbull J F.The use and selection of probiotic bacteria for use in the culture of larval aquatic organisms[J].Aquaculture,2000,191(1-3):259-270.
[30] 胡毅,谭北平,麦康森,等.饲料中益生菌对凡纳滨对虾生长、肠道菌群及部分免疫指标的影响[J].中国水产科学,2008,15(2):244-251.
[31] 周慧慧,马洪明,张文兵,等.仿刺参肠道潜在益生菌对稚参生长、免疫及抗病力的影响[J].水产学报,2010,34(6):775-783.
[32] 汪波,曾佳丽,黎于汾,等.凝结芽孢杆菌对凡纳滨对虾生长和免疫的影响[J].西北农业学报,2015,24(6):10-15.
[33] 袁丰华,林黑着,李卓佳,等.凝结芽孢杆菌对尖吻鲈的生长、消化酶及非特异性免疫酶的影响[J].上海海洋大学学报,2010,19(6):792-797.
[34] Verschuere L,Rombaut G,Sorgeloos P,et al.Probiotic bacteria as biological control agents in aquaculture[J].Microbiology and Molecular Biology Reviews,2000,64(4):655-671.
[35] 沈文英,李卫芬,梁权,等.饲料中添加枯草芽孢杆菌对草鱼生长性能、免疫和抗氧化功能的影响[J].动物营养学报,2011,23(5):881-886.
[36] 刘君,宋晓玲,刘莉,等.2株消化道优势菌对凡纳滨对虾免疫酶活性和抗白斑综合征病毒感染力的影响[J].水产学报,2012,36(3):444-450.
[37] 王明阳,田相利,刘龙镇,等.饲料中添加凝结芽孢杆菌对凡纳滨对虾生长、血清非特异性免疫指标及抗病力的影响[J].中国海洋大学学报,2018,48(S1):8-15.
[38] Zokaeifar H,Balcázar J L,Saad C R.Effects of Bacillus subtilis on the growth performance,digestive enzymes,immune gene expression and disease resistance of white shrimp,Litopenaeus vannamei[J].Fish & Shellfish Immunology,2012,33(4):683-689.
[39] 刘龙镇,田相利,王明阳,等.不同复合微生态制剂添加方式对凡纳滨对虾生长、非特异性免疫及抗病力的影响[J].中国海洋大学学报,2018,48(12):23-31.