刺参Apostichopus japonicus是中国北方海水养殖的重要经济动物,主要分布于北纬35~44 ℃的西北太平洋沿海,是典型的温带海洋物种[1]。刺参适宜的生长温度范围为10~20 ℃[2],当水温过高时刺参会进入夏眠状态[3]。但经一定的高温驯化,可显著提高刺参耐热上限[4]。在北方夏季高温时节,户外刺参养殖水域的日平均水温持续高于20 ℃,刺参通常会长时间处于夏眠状态[5-6],加之冬季低温影响,一年之中刺参的最适生长期只有不到半年的时间,因此,培育生长速度快、高温耐受力强的刺参新品种已成为目前中国刺参良种选育工作的重点之一。
中国刺参新品种选育的方法以杂交育种和选择育种为主,如通过杂交育种的方法培育出“水院1号”[7-8],通过选择育种方法所培育出“崆峒岛1号”[9]、“高抗1号”[10]、“安源1号”,这些刺参新品种具备生长速度快、棘刺数量多、抗病能力强等优点。刺参“东科1号”是本研究团队经多年选育,并于2017年通过全国水产原种和良种审定委员会审定的刺参新品种。该新品种采用群体选育技术,以2005年夏季山东当地野生刺参群体繁育的养殖群体为基础来源,从中收集并筛选出棘刺坚挺、体表无损伤且处于活动和摄食状态的大规格(体质量约200 g/头)亲参,构建了育种基础群体,并从2006年4月开始对各世代苗种实施高温淘汰和速生性状筛选,经多代选育而成。前期研究结果[11-12]显示,该选育品系具有生长速度快、夏季高温耐受力强、高温期成活率高、夏眠期短等优点,目前已进入示范推广阶段。目前,对刺参耐温性能的研究主要包括高温胁迫下的存活率、热休克蛋白基因Hsp表达量及免疫酶活性等方面,这些指标能反映其耐高温性能,但不能真正反映高温期的生长情况。观察发现,经过选育的耐高温品系在夏季高温期存在明显的进入夏眠晚、解除夏眠早等特点。刘石林[11]研究发现,定向选育的刺参第二世代群体在高温期粪便质量与体质量的比值(粪便相对质量)随着水温下降而显著上升,对高温的耐受能力提高0.77~1.00 ℃。根据夏眠刺参出现肠道退化、排空、摄食停止等现象,可通过统计高温期刺参群体中排粪个体数量比例和粪便相对质量,进而分析高温期的摄食情况。本研究中,对刺参“东科1号”选育过程中第四、第三世代(G4、G3)生长性能及高温期摄食性能进行分析,旨在为新品种选育工作提供试验数据和理论依据。
1 材料与方法
1.1 材料
试验选用的亲本为经选育的“东科1号”速生耐高温刺参品系G3、G2两个世代群体。试验地点为山东东方海洋科技股份有限公司国家级海藻与海参工程技术研究中心。
1.2 方法
1.2.1 试验设计及饲养管理 以G3和G2两个世代群体各自繁育而得的G4、G3代群体为试验组(记为G4、G3组),以同期未经选育的普通刺参群体作为对照组(control),每组设3个平行,每个平行50 头刺参。试验前期在60 L的PVC塑料水桶中养殖,随着刺参个体的不断生长,中后期逐渐转至玻璃钢水槽(200、500 L)和水泥池(3.0 m×1.5 m×1.0 m)中进行,并投放适量的附着基。试验用水为车间养殖用水,每天换水1次,每次1/3~1/2,定期倒池清污。投喂养殖生产配合饲料和海泥,保证刺参食物充足。
1.2.2 样品的采集及指标的计算 试验于2015年8月15日开始至2017年10月15日结束。初始投放体质量为(1.00±0.05)g/头的4月龄幼参,随后每隔(60±3)d对刺参个体进行称重记录,计算增重率(WGR)。分别于2017年6月15日、7月5日、7月25日、8月15日、9月5日和9月25日记录当日水温,从每个平行组随机挑选26~30月龄、体质量为80~100 g/头的10~15头刺参作为样本,分别置于装满海水的桶(10 L)内,每桶1只,24 h后统计排粪便个体的数量,将粪便阴干后称重,同时称量对应刺参个体体质量。生长指标计算公式:
增重率(WGR)=(W1-W0)/W0×100%,
粪便相对质量(RFM)=粪便干质量/刺参体质量,
排粪个体数量比例=排粪个体数/样本量×100%。
其中:W1为该次记录刺参平均体质量(g);W0为前一次记录刺参平均体质量(g)。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,采用SPSS 13.0软件进行单因素方差分析(One-way ANOVA),采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 3组刺参体质量对比
从图1可见:2015年8月—2016年4月(4~12月龄),幼参体质量持续增长,3组刺参的体质量变化趋势一致,此时幼参体质量均未达到20 g;3组刺参的体质量在2016年5—6月(13~14月龄)期间开始出现分化,直至试验终末,G4、G3两组刺参体质量始终极显著大于对照组普通刺参(P<0.01),G4组刺参体质量始终大于G3组,但两组间无显著性差异(P>0.05);在2016年6—10月(14~18月龄)、2017年4—8月(24~28月龄)两段高温时期内,G4、G3组刺参体质量表现出比对照组更大的增长幅度,反映了G4、G3组刺参比对照组普通刺参生长速率更快。3组刺参体质量峰值(表1)均出现在2017年8月(28月龄)期间,随后夏季高温期来临,成参进入夏眠,到夏眠结束时终末体质量有所下降。
2.2 不同时间段3组刺参的增重率
从图2可见:试验各时间段3组刺参增重率最大值均出现在2015年10—12月(6~8月龄),表明这一时期刺参生长最为旺盛,但3组间无显著性差异(P>0.05),此时刺参处于幼参阶段,平均体质量不足20 g;在2015年8—10月(4~6月龄)、2016年2—10月(10~18月龄)和2017年4—10月(24~30月龄)的同时间段内,3组刺参增重率出现显著性差异(P<0.05),其他时间段3组刺参增重率无显著性差异(P>0.05),这3个时期内多数情况下G4与G3两组增重率无显著性差异(P>0.05),但均显著高于对照组(P<0.05)。
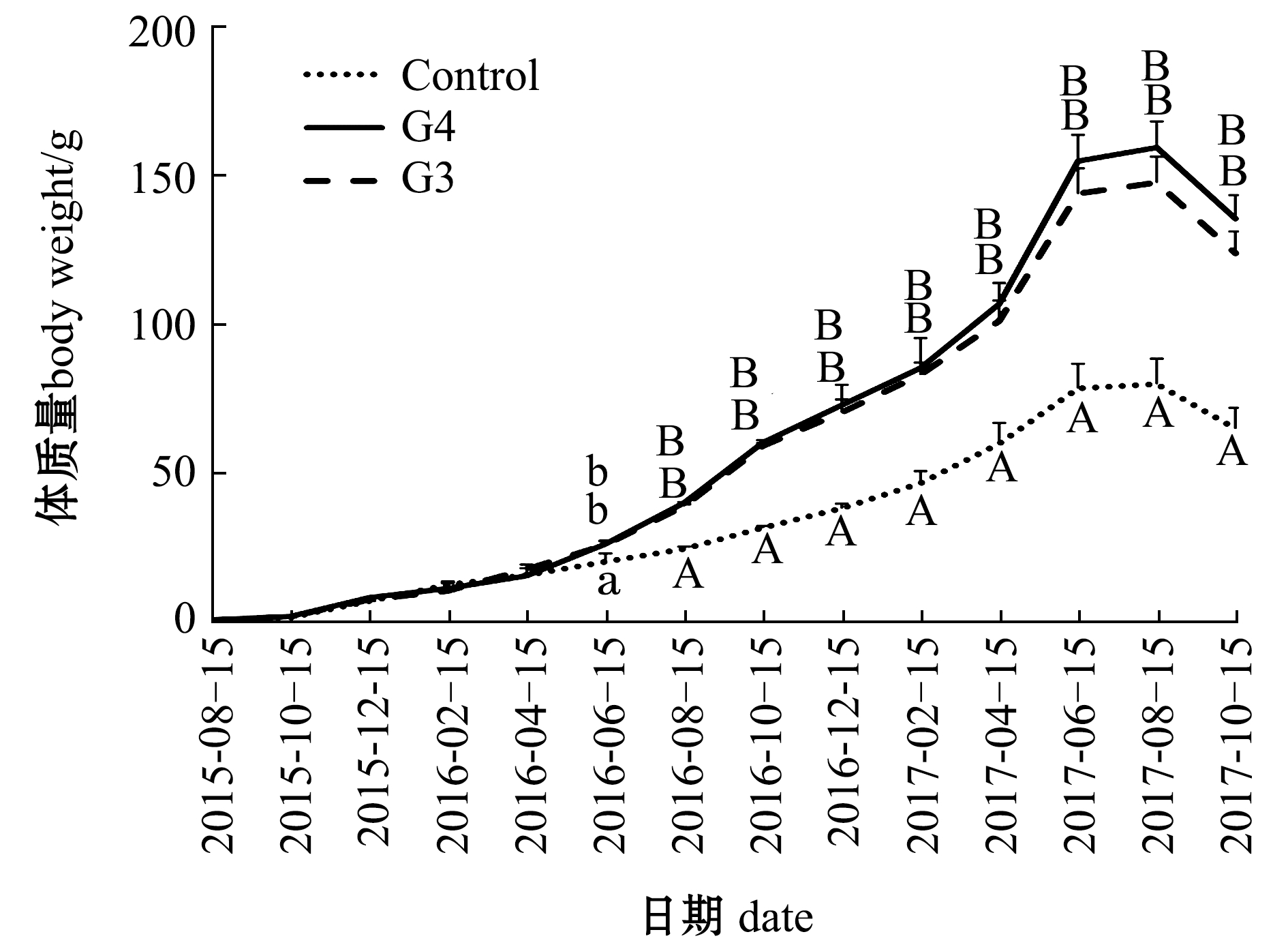
注:同一时间下,标有不同大写字母者表示组间有极显著性差异(P<0.01),标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05)
Note:The means with different capital letters are very significantly different among the groups in same time at the 0.01 probability level, means with different letters being significantly different at the 0.05 probability level, and the means with the same letters are not significant differences
图1 3组刺参体质量随时间的变化
Fig.1 Changes in body weight of sea cucumber in three groups
表1 3组刺参体质量峰值和终末值
Tab.1 Maximal and final values of body weight of sea cucumber in three groups g
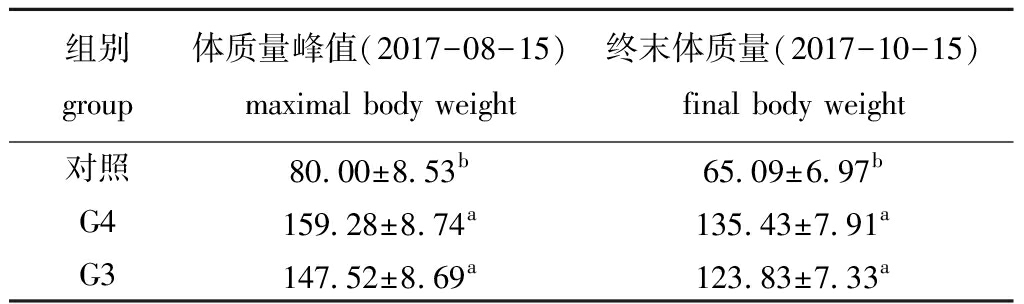
组别group体质量峰值(2017-08-15)maximal body weight终末体质量(2017-10-15)final body weight对照80.00±8.53b65.09±6.97bG4159.28±8.74a135.43±7.91aG3147.52±8.69a123.83±7.33a
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
从图2、表2可见:2017年6月(26月龄),G4、G3、普通刺参的个体平均体质量分别为154.71、143.82、78.55 g,均已达到成参规格,并随着日平均水温升高而逐渐进入夏眠期,刺参增重率显著低于其他各个时期(P<0.05),并在2017年8—10月(28~30月龄)表现为负增长;G4、G3两组夏眠期增重率绝对值均显著小于对照组(P<0.05),表明速生耐高温刺参品系G4、G3世代在夏眠期体质量减少程度要小于普通刺参。
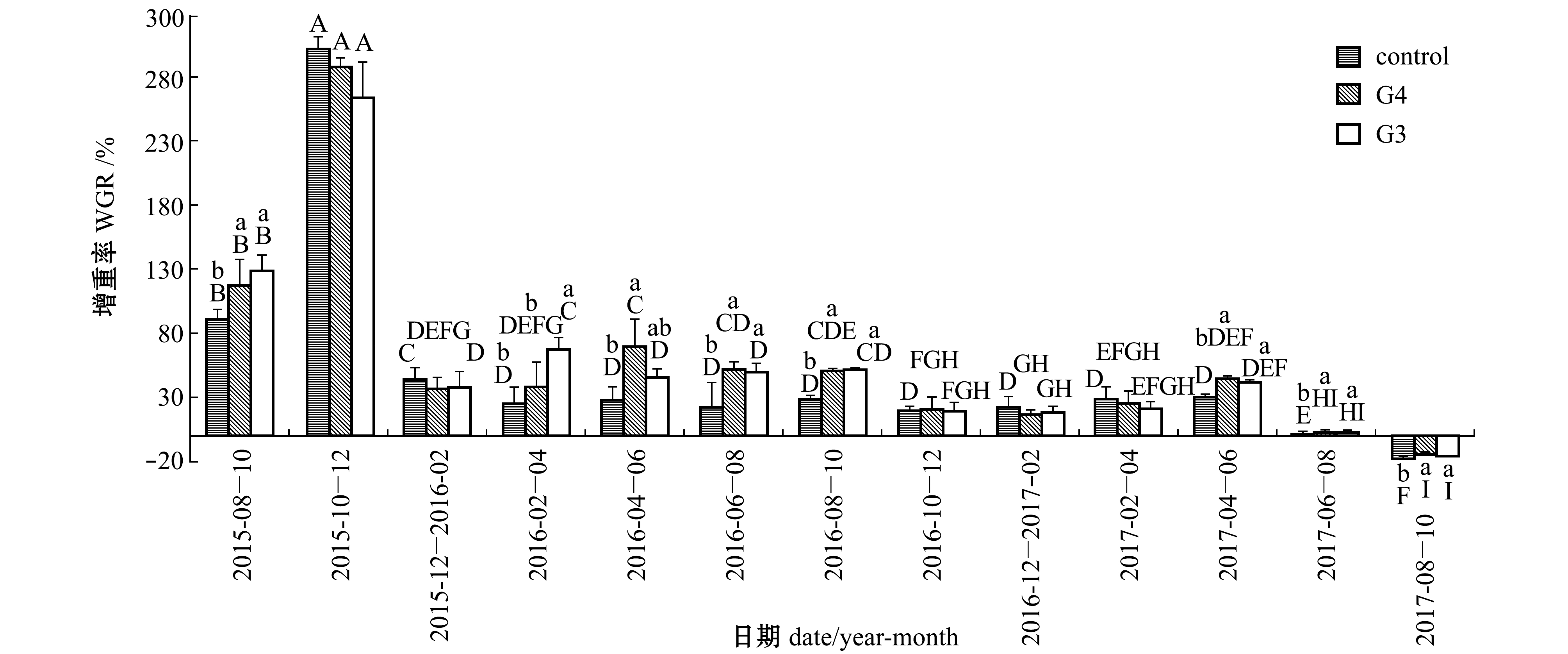
注:标有不同大写字母者表示同一组不同时期有显著性差异(P<0.05),标有不同小写字母者表示同一时期不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note: The means with different capital letters are significantly different among different time in the same group at the 0.05 probability level,and means with different letters being significantly different among different groups in the same time at the 0.05 probability level, and the means with the same letters are not significant differences,et sequentia
图2 3组刺参增重率随时间的变化
Fig.2 Weight gain rate of sea cucumber in three groups in various periods
2.3 不同时间段3组刺参排粪个体数量比例
对2017年各取样时间对应的排粪刺参体质量(数值略)进行统计分析,结果显示,3组刺参体质量均无显著性差异(P>0.05)。排粪个体数量比例反映了该温度下仍保持摄食状态的刺参个体百分比。从图3可见:水温从23.3 ℃开始升高的过程中,同组刺参不同时间的排粪个体数量比例持续下降,呈显著性差异(P<0.05),同一时间下G4、G3组始终高于对照组;当水温升至26.4 ℃时,G4和G3组的排粪个体数量比例分别为46.31%、43.33%,两者显著高于对照组(37.86%)(P<0.05);当水温超过27.6 ℃,并在随后下降至26.6 ℃的过程中,同组刺参不同时间的排粪个体数量比例无显著性差异(P>0.05),同一时间下G4和G3组排粪个体数量比例始终高于对照组,但无显著性差异(P>0.05);当水温降至23.8 ℃时,G4、G3组排粪个体数量比例分别为20.33%、13.97%,两者显著高于对照组3.05%(P<0.05)。
表2 3组刺参夏眠期增重率峰值和夏眠期增重率对比
Tab.2 Comparison of the maximal WGR with the WGR during estivation in three groups of sea cucumber during estivation
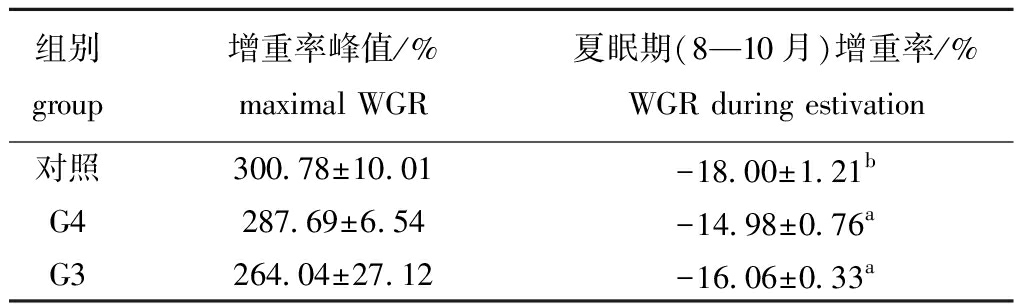
组别group增重率峰值/%maximal WGR夏眠期(8—10月)增重率/%WGR during estivation 对照300.78±10.01-18.00±1.21bG4287.69±6.54-14.98±0.76aG3264.04±27.12-16.06±0.33a
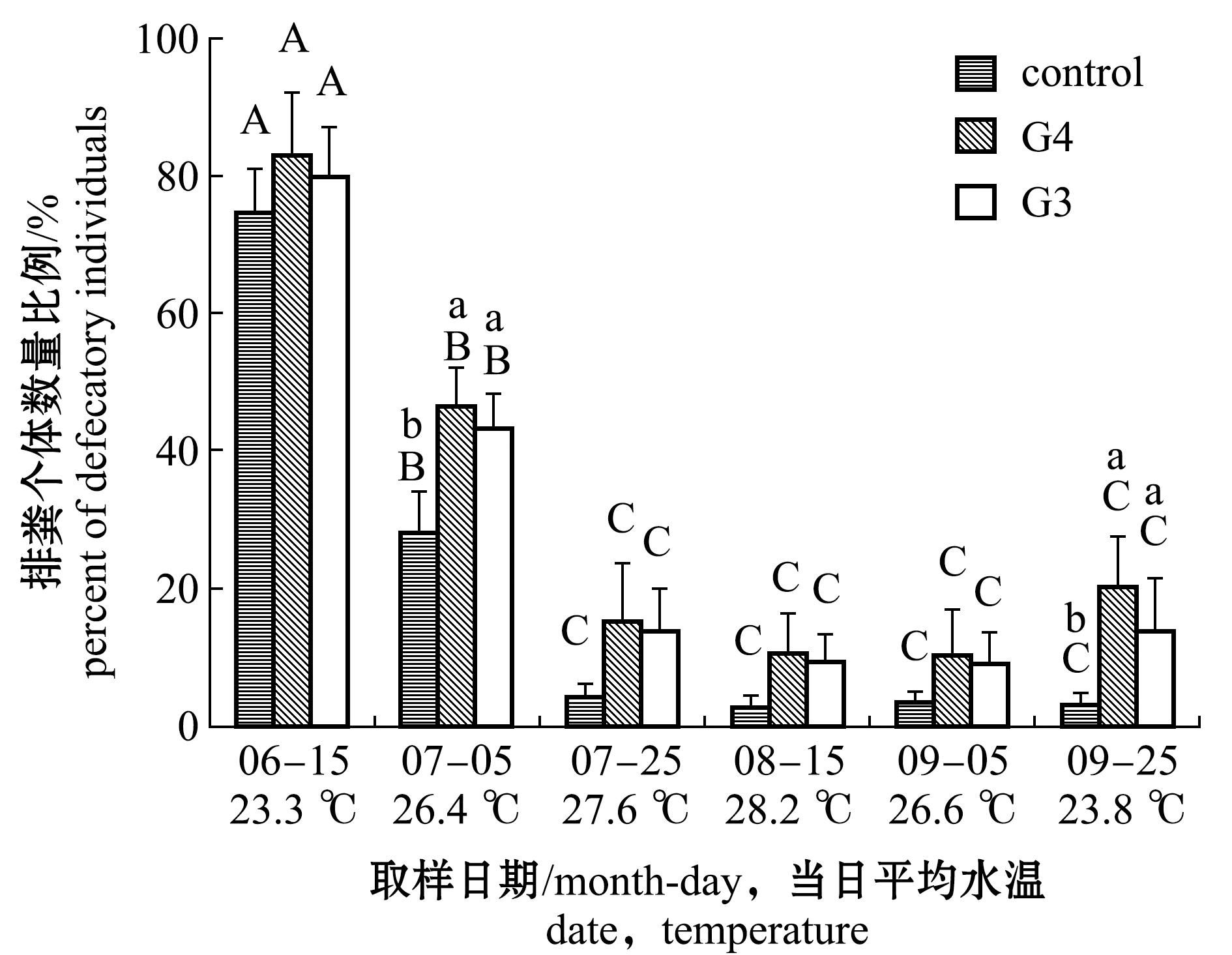
图3 不同时间段3组刺参排粪个体数量比例(2017年)
Fig.3 Percent of defecatory individuals of sea cucumber in the three groups in different dates(2017)
2.4 不同时间段3组刺参粪便相对质量
粪便相对质量反映了刺参肠道内含物的相对质量大小。从图4可见:当水温由23.3 ℃上升至28.2 ℃的过程中,同组刺参不同时间的粪便相对质量呈显著性下降趋势(P<0.05);当水温升至26.4 ℃时,G4、G3组粪便相对质量分别为0.015、0.013,对照组粪便相对质量为0.006;随后水温由28.2 ℃下降至23.8 ℃的过程中,同组刺参不同时间的粪便相对质量呈显著性上升趋势(P<0.05),当水温降至26.6 ℃时,G4、G3组粪便相对质量分别为0.010、0.008,对照组为0.004±0.001。相同时间下,G4、G3组粪便相对质量均显著高于对照组(P<0.05),G4组粪便相对质量始终高于G3,但仅7月5日(26.4 ℃)时呈显著性差异(P<0.05)。3组粪便相对质量与水温的关系符合回归方程y=ax2+bx+c,系数如表3所示,当粪便相对质量在0.001~0.020取值时,得到3组所对应的水温,如表4所示,水温值随着粪便相对质量取值的升高而降低,反映出刺参肠道内含物质量随水温降低而增加。在相同粪便相对质量情况下,其中G4组比对照组高0.37~2.48 ℃,G3组比对照组高0.30~2.18 ℃。当水温差值最大时,粪便相对质量取值为0.010,G4、G3组水温值分别为26.39、26.09 ℃,对照组水温值为23.91 ℃。
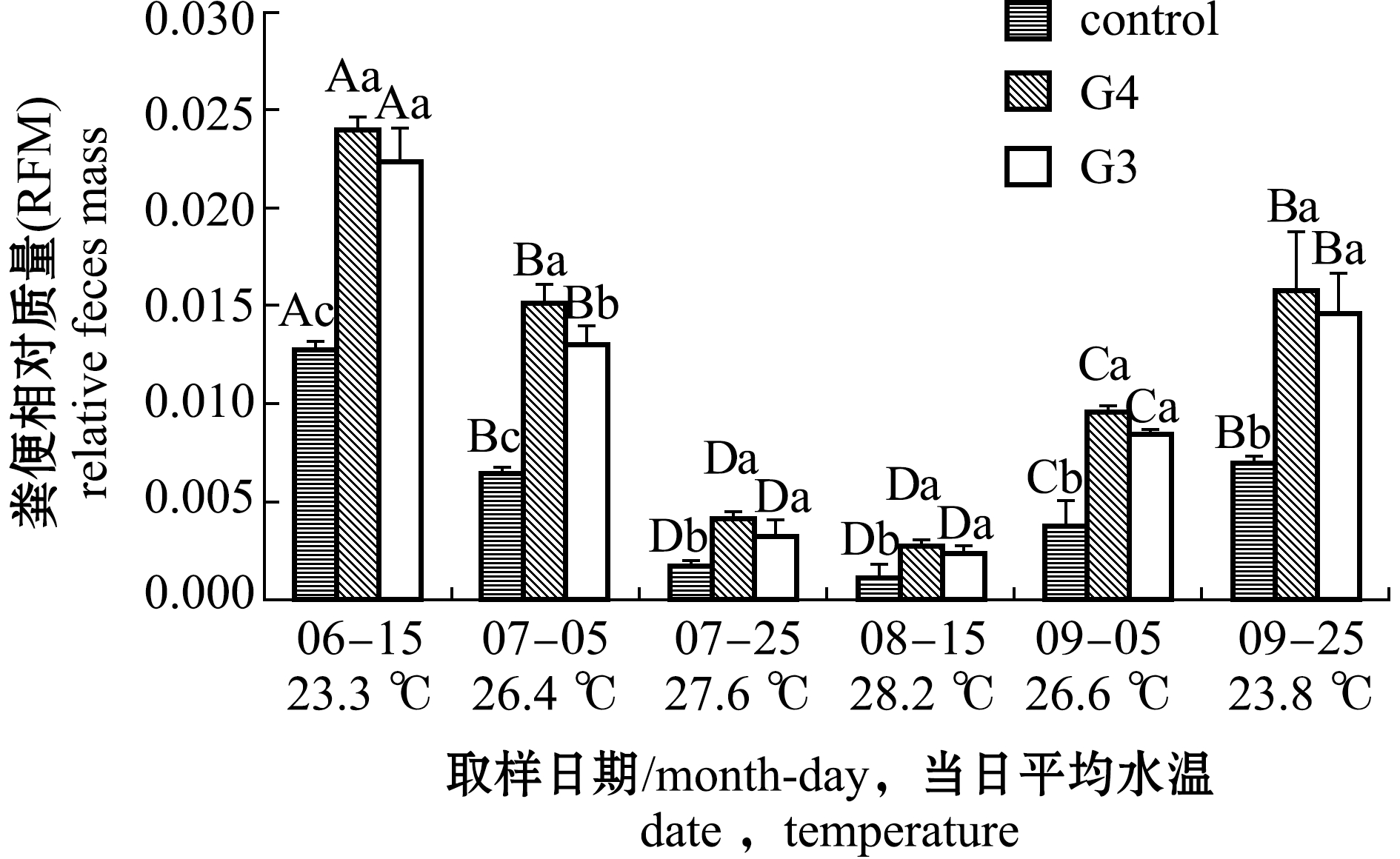
图4 不同时间段3组刺参粪便相对质量(2017年)
Fig.4 Relative feces mass (RFM) of sea cucumber in the three groups in different dates (2017)
表3 水温(y)与刺参粪便质量( x)的二元回归方程系数
Tab.3 Coefficients (a, b, c) of regression equation between temperature (y) and RFM (x)

组别 groupabcR2对照19685.00-683.7628.780.9562 G4345.56-237.3128.730.9656 G3964.65-269.1828.690.9610
表4 不同粪便相对质量对应的水温值
Tab.4 Responese of the different RFM to temperature
℃
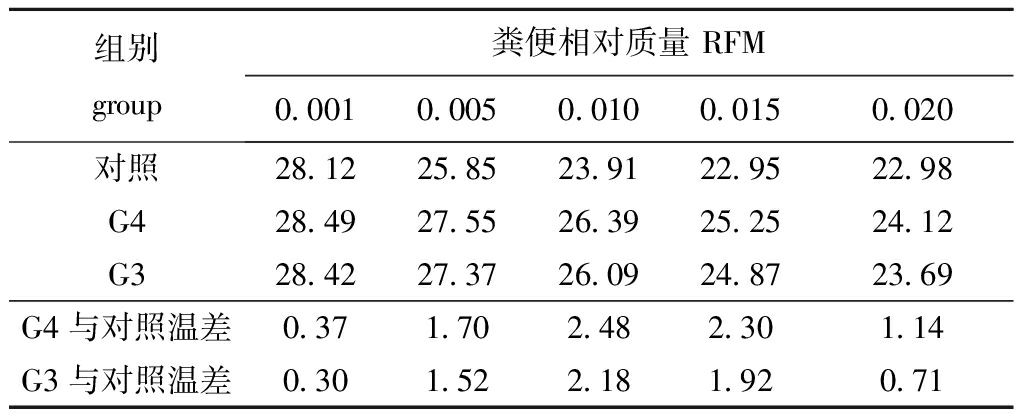
组别 group粪便相对质量 RFM0.0010.0050.0100.0150.020对照28.1225.8523.9122.9522.98G428.4927.5526.3925.2524.12G328.4227.3726.0924.8723.69G4与对照温差0.371.702.482.301.14G3与对照温差0.301.522.181.920.71
3 讨论
3.1 刺参速生耐高温品系生长性能分析
孟思远等[13]研究指出,刺参体长和体质量指标的遗传力属于中度,可以获得较快的遗传进展。而陈远等[14]研究结果显示,水温对海参增重有着显著性影响,因此,刺参生长速度取决于包括遗传性状、水温条件等多方面因素共同影响。通过对比3种不同刺参的体质量发现,当体质量低于20 g时,3组刺参的体质量增长趋势基本一致,这表明在刺参幼参阶段,选育品系刺参的生长优势并不比普通刺参突出。从12~14月龄开始,选育品系的两组刺参均表现出明显的快速生长特点,终末体质量显著高于普通刺参。分析原因,一是选育品系两组刺参在适宜生长的时期内增重率显著高于普通刺参,二是选育品系两组刺参在高温期进入夏眠晚、解除夏眠早,摄食时间更长,从而积累更多营养,这表明选育品系刺参在生长性能方面具有优势。由于本试验旨在对选育新品系进行测试分析,所选用的刺参为当年繁育的G4、G3幼参群体,在试验过程中未进行筛选分苗和高温淘汰,组内的个体差异较大,推测由此导致本试验结果中G4和G3代间未表现出显著性差异,但G4组体质量始终高于G3组,一定程度上表明经过累代定向选育,可使刺参的生长优势得到逐代积累和强化。
3.2 刺参速生耐高温品系高温期摄食性能分析
本研究中以刺参排粪个体数量比例和粪便相对质量为指标,表现出选育品系刺参在高温期保持摄食活动的个体数量更多,且摄食个体肠道内含物质量也显著高于普通刺参的优势。夏初水温升至26.4 ℃时,选育品系的两组刺参仍有超过40%数量的个体保持摄食,摄食个体的粪便相对质量均超过0.010,表明进入高温期后选育品系刺参保持摄食的数量和摄食量比普通刺参更多,摄食停止的时间更晚;同样结果也表现在夏末水温降至23.8 ℃的时期。分析原因可能与选育品系对高温的耐受能力增强有关。王青林[4]、刘石林等[15]、曹学顺[8]的研究均表明,刺参能够通过调节非特异性免疫酶活性,从而保护机体免受水温升高所造成的损害。Wang等[16]研究了不同水温下刺参生长、代谢及温度耐受性,指出在16 ℃时刺参生长率最高。当水温合适时,刺参会逐渐恢复正常生理状态,肠道再生并开始摄食[17-18]。值得注意的是,当水温同样为23 ℃左右时,3组刺参在9月15日时粪便相对质量均显著低于6月15日,分析原因是高温后期刺参逐渐解除夏眠,肠道的再生需要一段时期,因此摄食活动相对较弱。但选育品系的G4、G3组粪便相对质量在夏末水温降至26.6 ℃时即可达到0.010左右,普通刺参仅为0.004;同时回归分析显示,当粪便相对质量取0.010时,G4、G3的温度值均达到26 ℃以上,而普通刺参仅为23.91 ℃,表明水温因素限制选育品系刺参摄食活动的影响有所降低。Yang等[19]的研究指出,刺参成熟个体在水温超过20 ℃时将进入夏眠,而小个体刺参在25 ℃左右才进入夏眠,而本研究中发现,14~18月龄幼参在高温期仍保持生长增重,这一结果与前人研究结论一致。26~30月龄的刺参在水温升至26.6 ℃时,选育品系的两组刺参仍有超过40%的数量保持摄食,且粪便相对质量大于0.010,这可能与选育品系对高温耐受性增强有关。本研究中选育品系刺参和普通刺参在水温达到27.6 ℃后才普遍停止摄食,粪便相对质量降至0.005以下,这可能因为试验环境和自然环境有所差异。高菲[20]的研究中报道,即使在高温期刺参空肠率达到最高时,仍有20%以上的刺参个体处于摄食状态。这一结论在本试验中也有所体现,当水温达到27.6 ℃以上时,3组刺参排粪个体数量比例并不为零,且G4、G3组始终高于对照组。相同粪便相对质量时,选育品系刺参对应温度值总体高于普通刺参0.30~2.48 ℃,高温期的摄食性能明显提高。
[1] 廖玉麟.中国动物志 棘皮动物门 海参纲[M].北京:科学出版社,1997.
[2] 董云伟,董双林.刺参对温度适应的生理生态学研究进展[J].中国海洋大学学报,2009,39(5):908-912.
[3] 袁秀堂,杨红生,陈慕雁,等.刺参夏眠的研究进展[J].海洋科学,2007,31(8):88-90.
[4] 王青林.温度驯化对刺参(Apostichopus japonicus)生长及耐热性的影响及生理生态学机制[D].青岛:中国海洋大学,2012.
[5] 孙毅,唐日峰.虾池养殖刺参实用技术[J].中国水产,2002(6):52-53.
[6] 李保泉,杨红生,张涛,等.温度和体重对刺参呼吸和排泄的影响[J].海洋与湖沼,2002,33(2):182-187.
[7] 刘伟,常亚青,丁君.温度缓降和骤降对刺参“水院1号”和大连养殖群体非特异性免疫影响的初步研究[J].水产学报,2013,37(9):1342-1348.
[8] 曹学顺.温度对刺参的生长、生理及营养成分的影响研究[D].大连:大连海洋大学,2014.
[9] 杨建敏,宋志乐,王卫军,等.刺参“崆峒岛1号”[J].中国水产,2015(12):55-57.
[10] 孙明超.“高抗1号”新品系刺参的生产性状评价及抗高温机理研究[D].上海:上海海洋大学,2016.
[11] 刘石林.刺参耐高温品系选育及其性状评价的基础研究[D].青岛:中国海洋大学,2015.
[12] 赵欢,刘石林,杨红生,等.刺参高温定向选育群体子一代耐温性状的分析[J].海洋科学,2014,38(9):1-6.
[13] 孟思远,常亚青,李文东,等.仿刺参幼参阶段4个生长性状遗传力的估计[J].大连海洋大学学报,2010,25(6):475-479.
[14] 陈远,陈冲.刺参幼参冬季陆上养殖试验[J].水产科学,1992,11(4):1-3.
[15] 刘石林,茹小尚,徐勤增,等.高温胁迫对刺参耐高温群体和普通群体主要免疫酶活力的影响[J].中国水产科学,2016,23(2):344-351.
[16] Wang Q L,Dong Y W,Qin C X,et al.Effects of rearing temperature on growth,metabolism and thermal tolerance of juvenile sea cucumber,Apostichopus japonicus Selenka:critical thermal maximum (CTmax) and hsps gene expression[J].Aquaculture Research,2013,44(10):1550-1559.
[17] 李馥馨,刘永宏,宋本祥,等.刺参(Apostichopus japonicus Selenka)夏眠习性研究II—夏眠致因的探讨[J].中国水产科学,1996,3(2):50-58.
[18] Gao F,Yang H S,Xu Q,et al.Phenotypic plasticity of gut structure and function during periods of inactivity in Apostichopus japonicus[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2008,150(3):255-262.
[19] Yang H S,Yuan X T,Zhou Y,et al.Effects of body size and water temperature on food consumption and growth in the sea cucumber Apostichopus japonicus (Selenka) with special reference to aestivation[J].Aquaculture Research,2005,36(11):1085-1092.
[20] 高菲.刺参Apostichopus japonicus营养成分、食物来源及消化生理的季节变化[D].青岛:中国科学院研究生院(海洋研究所),2008.