2015年,四环素(TC)类抗生素被检测出是上海黄浦江上游主要污染物之一[1]。此前,在黄浦江流域的水产养殖场废水中,四环素类抗生素的检测值已达27.5 ng/L[2]。由于四环素类抗生素能够促进动物生长、提高饲料利用率,因此,在水产养殖中被广泛使用。然而抗生素在生物体内代谢率低(10%~40%),大部分以药物母体或代谢物形式随粪便排出体外[3],严重污染土壤和水源。其中最大的威胁是耐药菌随食物链迁移进入人体中,造成人类免疫系统功能降低,危害人类健康[4-5]。
常用的四环素污染处理方法有化学氧化法、光催化法[6]、膜处理法和吸附法等。吸附法因其操作流程简单、能耗低、降低二次污染等优势备受关注。常见的吸附材料有活性炭、碳素纤维、蒙脱石、沸石等[7-8]。中国天然沸石储量丰富、廉价易得。沸石具有分子筛性质,可以选择性吸附比其孔径小的分子,且交换能力强于活性炭,被广泛应用于环境污染物的吸附处理中。由于天然沸石表面Si-O结构亲水性较强,对废水中有机污染物的吸附能力不理想。因此,在使用前常对其进行改性处理[9]。由于有机污染物在有机相中的分配系数远大于溶剂相,更易溶解于有机溶剂中,故选择将天然沸石进行有机改性处理。目前,许多学者研究表明,天然沸石经十六烷基三甲基溴化铵(CTAB)改性后对水中菲、铬酸盐、三氯生等表现出良好的吸附性能[10-12]。
针对养殖废水四环素污染严重的问题,本研究中采用CTAB对天然沸石进行改性,考察四环素在CTAB改性沸石上的吸附行为,旨在为养殖废水中去除四环素类抗生素提供科学依据。
1 材料与方法
1.1 材料
试验用沸石为沈阳法库天然斜发沸石,经粉碎、过筛后达到颗粒大小为100目。试验试剂主要有盐酸四环素、CTAB(天津化学试剂有限公司生产),均为分析纯。试验仪器主要有SHA-CA型摇床、1010-B型烘箱、Quantachromem 3.0型BET分析仪、SU1510型电镜扫描仪、FT-IR650型红外扫描仪、SP-752型紫外分光光度计、3100型pH计。
1.2 方法
1.2.1 改性沸石的制备 称取5 g天然沸石(记为S0)放入锥形瓶中,分别加入浓度为5、10、15、20、25、30 mmol/L的CTAB溶液,放入摇床中水浴震荡1 h,控制温度为60 ℃。取出后用无水乙醇与去离子水清洗6次,85 ℃下烘干研磨后制得CTAB改性沸石[13],分别标记为S5、S10、S15、S20、S25、S30。
1.2.2 吸附试验 将50 mL模拟四环素污染废水与一定量CTAB改性沸石加入250 mL锥形瓶中,放入摇床反应1 h,控制温度为25 ℃,转速为150 r/min。模拟养殖废水为大连市黑石礁海域海水中添加盐酸四环素,配制成模拟四环素污染养殖废水。其中用于配制废水的海水理化指标如下:无机氮浓度为2.41~6.79 mg/L,活性磷酸盐浓度为0.340~2.52 μg/L,COD浓度为0.502~0.861 mg/L;石油类浓度为0.327~0.689 μg/L。具体试验条件如表1所示。
表1 试验条件
Tab.1 Experimental conditions
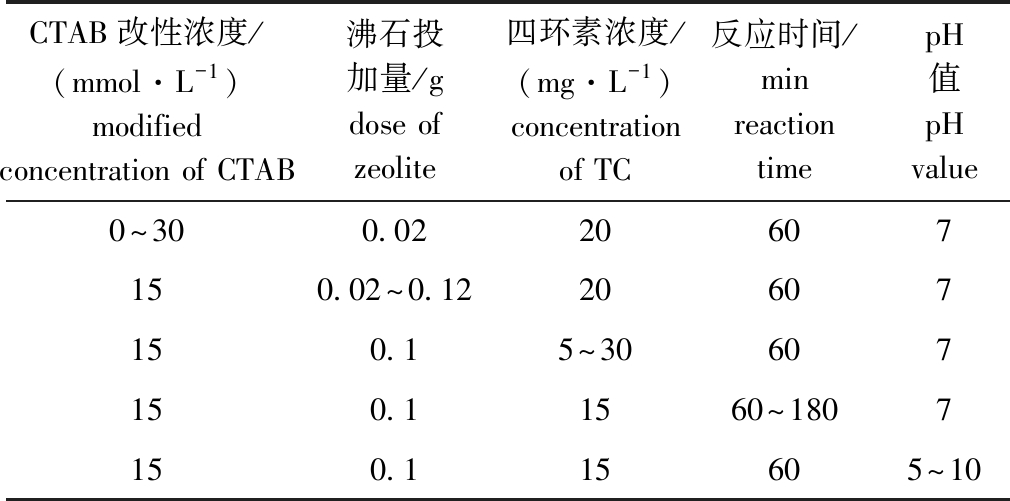
CTAB改性浓度/(mmol·L-1)modified concentration of CTAB沸石投加量/gdose of zeolite四环素浓度/(mg·L-1)concentration of TC反应时间/minreaction timepH值pHvalue0~300.0220607150.02~0.1220607150.15~30607150.11560~1807150.115605~10
吸附平衡后测定溶液中四环素浓度,理论吸附平衡量(qe,mg/g)计算公式如下:
qe=(C0-Ce)V/W。
(1)
其中:C0为四环素初始浓度(mg/L);Ce为四环素剩余浓度(mg/L);V为四环素溶液体积(L);W为改性沸石投加量(g)。
在优化条件下,分别配制离子浓度为100 mg/L的![]() 种模拟四环素污染养殖废水,研究干扰离子共存对改性沸石吸附四环素性能产生的影响。
种模拟四环素污染养殖废水,研究干扰离子共存对改性沸石吸附四环素性能产生的影响。
1.2.3 吸附动力学和热力学拟合模型
(1) 反应动力学方程。称取0.2 g CTAB改性沸石,分别加入到200 mL浓度为10、20、30 mg/L的四环素溶液后放入摇床中震荡,设置温度为25 ℃,转速为150 r/min,采用紫外分光光度法测定不同吸附时间下溶液中四环素浓度。为了解CTAB改性沸石对四环素的吸附过程,分别采用3种动力学模型进行数据拟合,表达式如下:
拟一级动力学方程 ln(qt-qe)=lnqe-K1t,
(2)
拟二级动力学方程![]()
(3)
颗粒内扩散 qt=K3t0.5+C。
(4)
其中:qt为t时刻的吸附平衡量(mg/g);qe为理论吸附平衡量(mg/g);K1为一级动力学吸附速率常数(min-1);K2为二级动力学吸附速率常数[g/(mg·min)];K3为颗粒内扩散速率常数[mg/(g·min)];C为经验常数;t0.5为半吸附时间(min)。
(2) 吸附等温线模型及热力学分析。配制浓度分别为10、20、30、40、50、100、200、400 mg/L的四环素溶液各50 mL,向各组加入0.1 g CTAB改性沸石,分别在298、308、318 K温度条件下置于摇床内水浴震荡3 h,控制转速为150 r/min。分别采用Langmuir和Freundlich吸附等温线模型对试验数据进行拟合,探讨CTAB改性沸石去除四环素的机理。Langmuir和Freundlich吸附等温方程如下:
Ce/qe=1/(KL×qm)+Ce/qm,
(5)
(6)
其中: qm为最大吸附量(mg/g);Ce为四环素剩余浓度(mg/L);KL为Langmuir吸附常数(L/mg);Kf为Freundlich吸附常数(L/g);n为特征常数。
热力学参数吉布斯自由能(ΔG,kJ/mol)、焓(ΔH,kJ/mol)、熵(ΔS,J/mol)被用来评估吸附过程中温度的改变对吸附效果产生的影响。Gibbs方程计算如下:
ΔG=-R·T lnKd,
(7)
ΔH= ΔG+T·ΔS,
(8)
lnKd=ΔS/R-ΔH/(R·T)。
(9)
其中: R为气体常数,取8.314 kJ/(mol·K);T为绝对温度(K);Kd为平衡常数。
2 结果与分析
2.1 CTAB改性沸石表征
2.1.1 红外扫描分析(FT-IR) 天然沸石(S0)与CTAB改性沸石(S15)经溴化钾压片后,在400~4000 cm-1波数范围内射谱结果如图1所示。在1470 cm-1处的吸收峰为CTAB改性剂中-CH2与-CH3对称和反对称伸缩振动产生的;在3429 cm-1附近由于N-H伸缩振动出现了明显的吸收峰,这表明CTAB已成功复合进入天然沸石[14]。
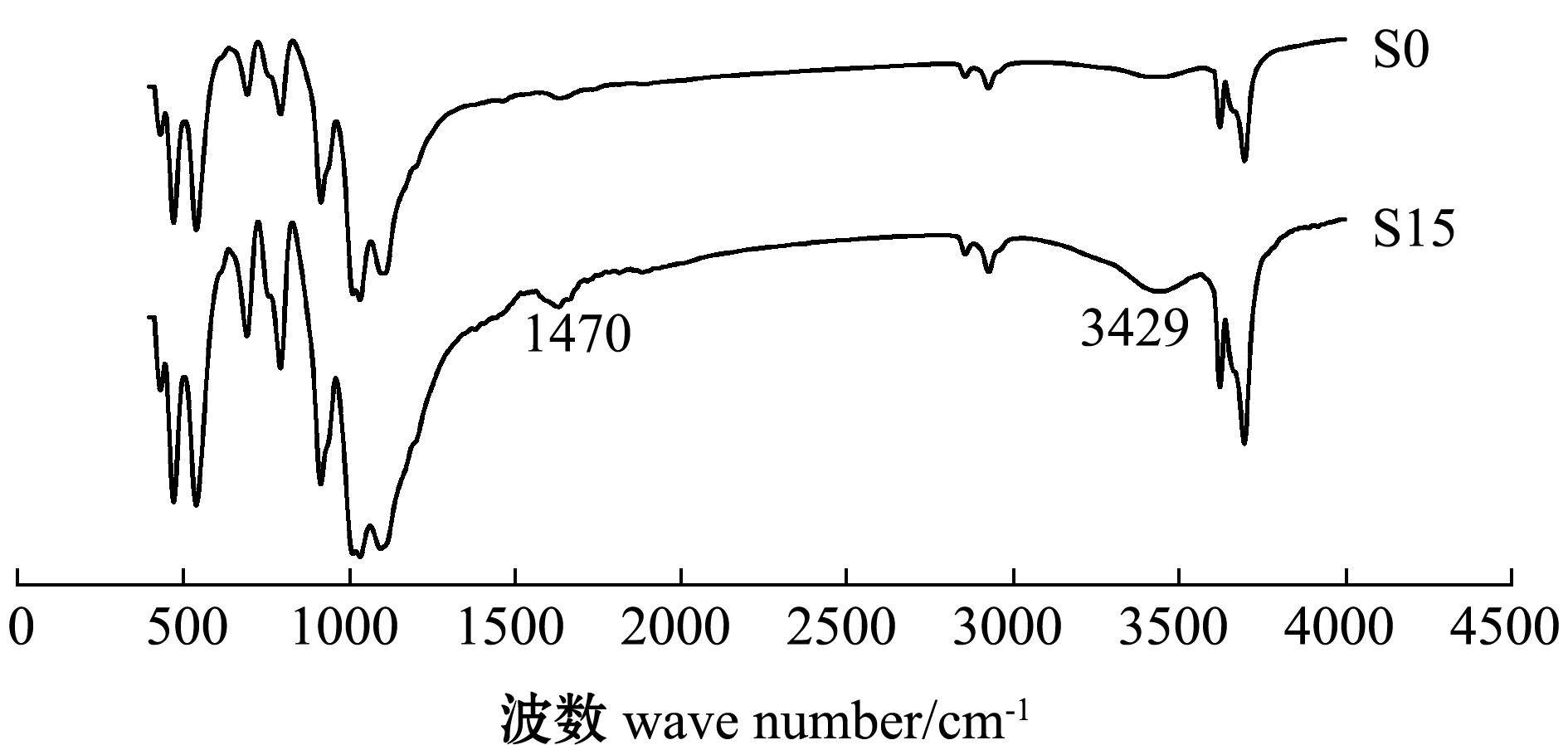
图1 天然沸石(S0)与CTAB改性沸石(S15)红外图谱
Fig.1 The intrared spectra of natural(S0) and modified CATB (S15) zeolites
2.1.2 电镜扫描分析(SEM) 从图2可见:天然沸石S0聚结成块,而改性沸石S15层状结构明显,表面粗糙且分布着较为规则的细碎颗粒,整体形态更为蓬松;天然沸石经CTAB改性后,表面覆盖了一层灰色物质。这表明CTAB已负载在天然沸石表面[15-16]。

图2 沸石改性前后的扫描电镜图
Fig.2 SEM of natural and modified zeolites
2.1.3 比表面分析(BET) 沸石改性前后BET参数见表2,天然沸石经CTAB改性后,比表面积、孔容和孔径均增加。这是由于经表面活性剂处理后,表面杂质减少,疏通了沸石的孔道,表面吸附位点增多,促进了改性沸石对四环素的吸附[11]。
表2 沸石的BET参数
Tab.2 The BET parameters of zeolites

样品sample比表面积/(m2·g-1) specific surface area孔容/(cm3·g-1)pore volume孔径/nmpore diameter天然沸石S0natural zeolite S07.9560.0723.057改性沸石S15modified zeolite S1513.0900.1073.828
2.1.4 氮气(N2)吸附等温线及孔径分析 如图3所示,根据BDDT分类,得出改性前后沸石的N2吸附等温线均为I形,图4显示孔径范围在2~50 nm,说明改性前后沸石都以介孔为主。

图3 N2吸附等温线
Fig.3 N2 adsorption isotherm
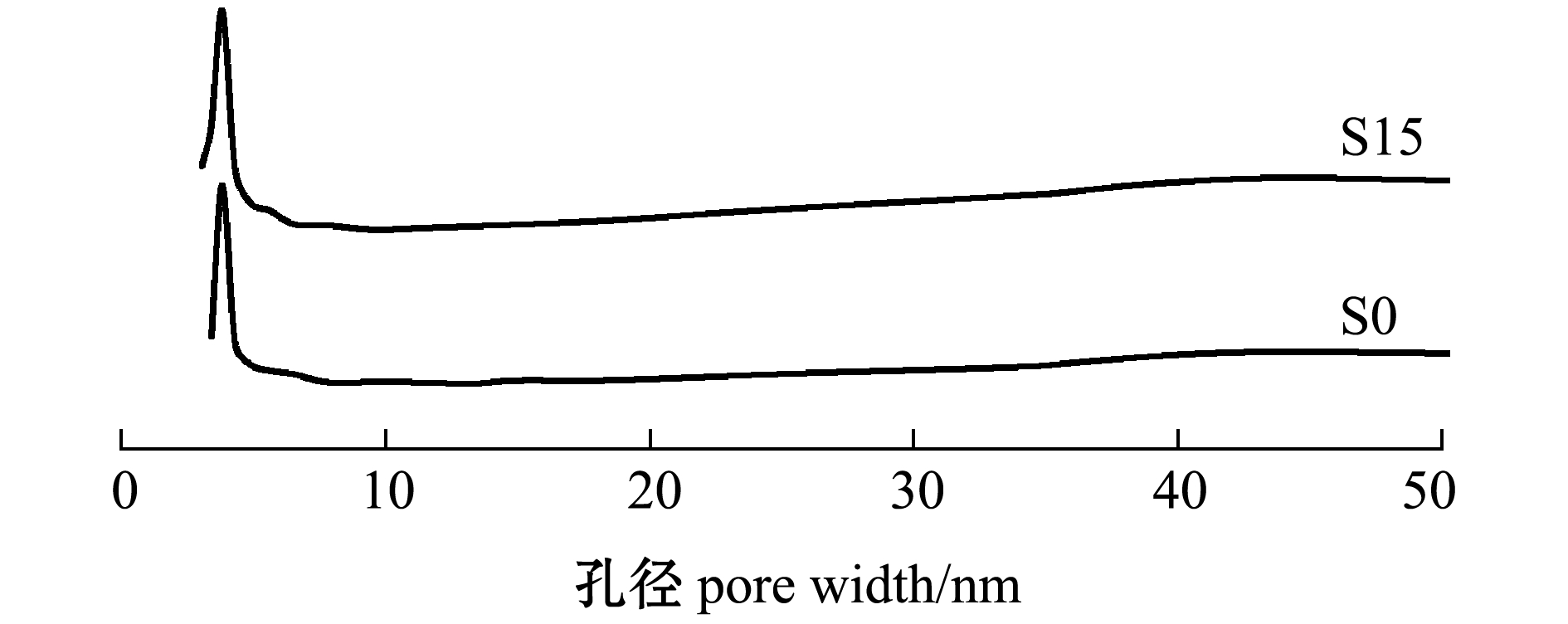
图4 孔径分析
Fig.4 Pore distribution analysis
2.2 改性沸石吸附四环素影响因素分析
2.2.1 CTAB改性浓度对吸附性能的影响 从图5可见,随CTAB浓度的增加,四环素去除率和单位吸附量都呈现先上升后下降的趋势。天然沸石经CTAB改性后,表面会形成有机溶剂相的有机层。根据相似相溶原理,有机污染物在CTAB有机相中的分配系数远大于溶剂相,更易溶解于有机溶剂中,故改性沸石对四环素的去除率与单位吸附量优于亲水性原沸石[11]。因此,选取改性浓度为15 mmol/L的沸石作为吸附剂进行后续试验。
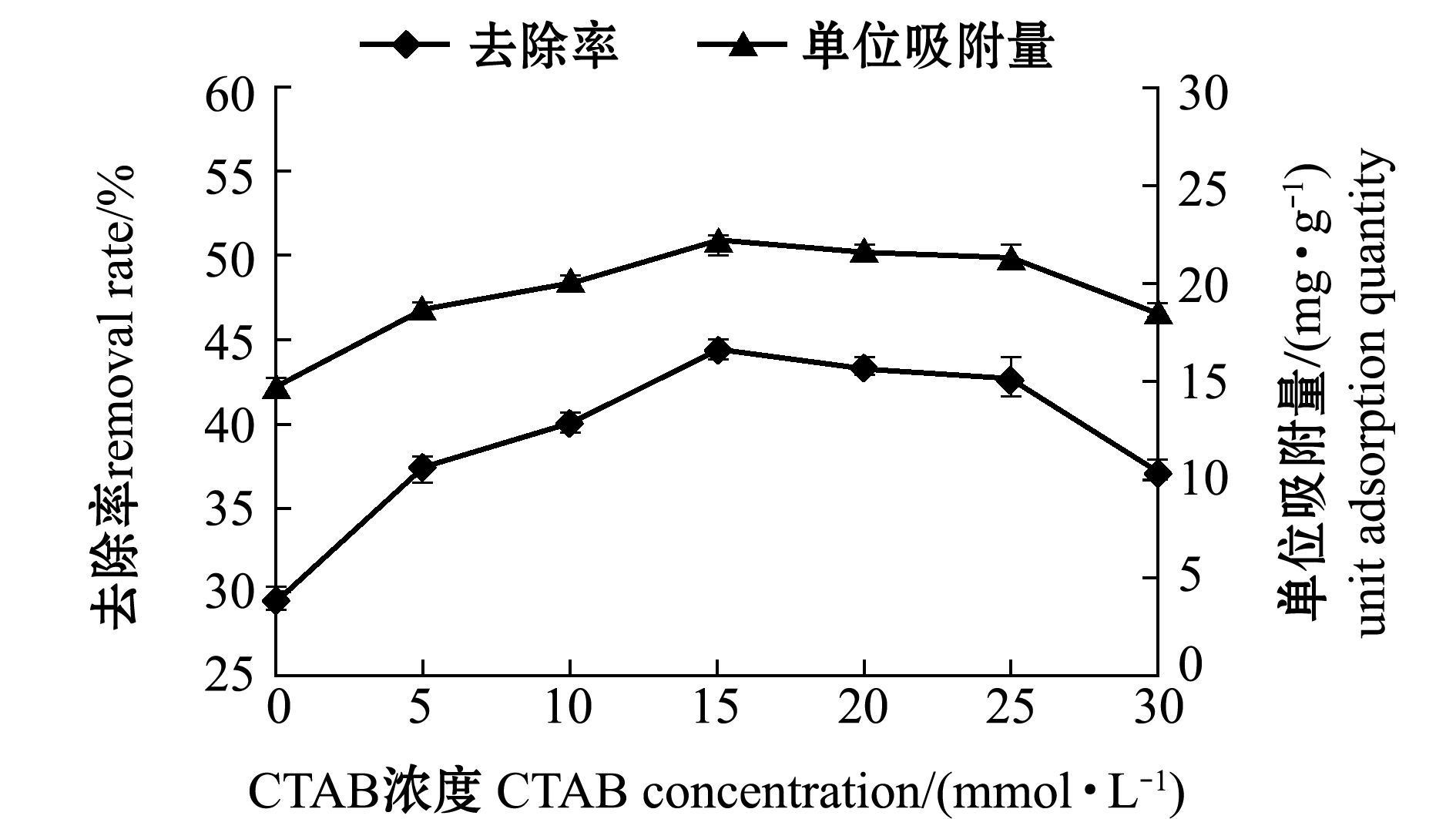
图5 改性CTAB浓度对吸附四环素的影响
Fig.5 Effects of modified CTAB concentration on adsorption of tetracycline(TC)
2.2.2 改性沸石投加量对吸附性能的影响 从图6可见,随着投加量的增加,四环素去除率不断上升,而单位吸附量呈下降趋势。但是投加量增多导致其比表面积增大,因而产生了更多的空位,溶液中多数离子被其中一部分空位吸附,而其他位点仍然处于不饱和状态,使得单位吸附量降低。其中有效吸附的比表面积减小归因于高吸附剂浓度下吸附剂的聚合与团聚。因此,综合考虑去除率与单位吸附量,选取沸石投加量范围应为0.10~0.12 g。
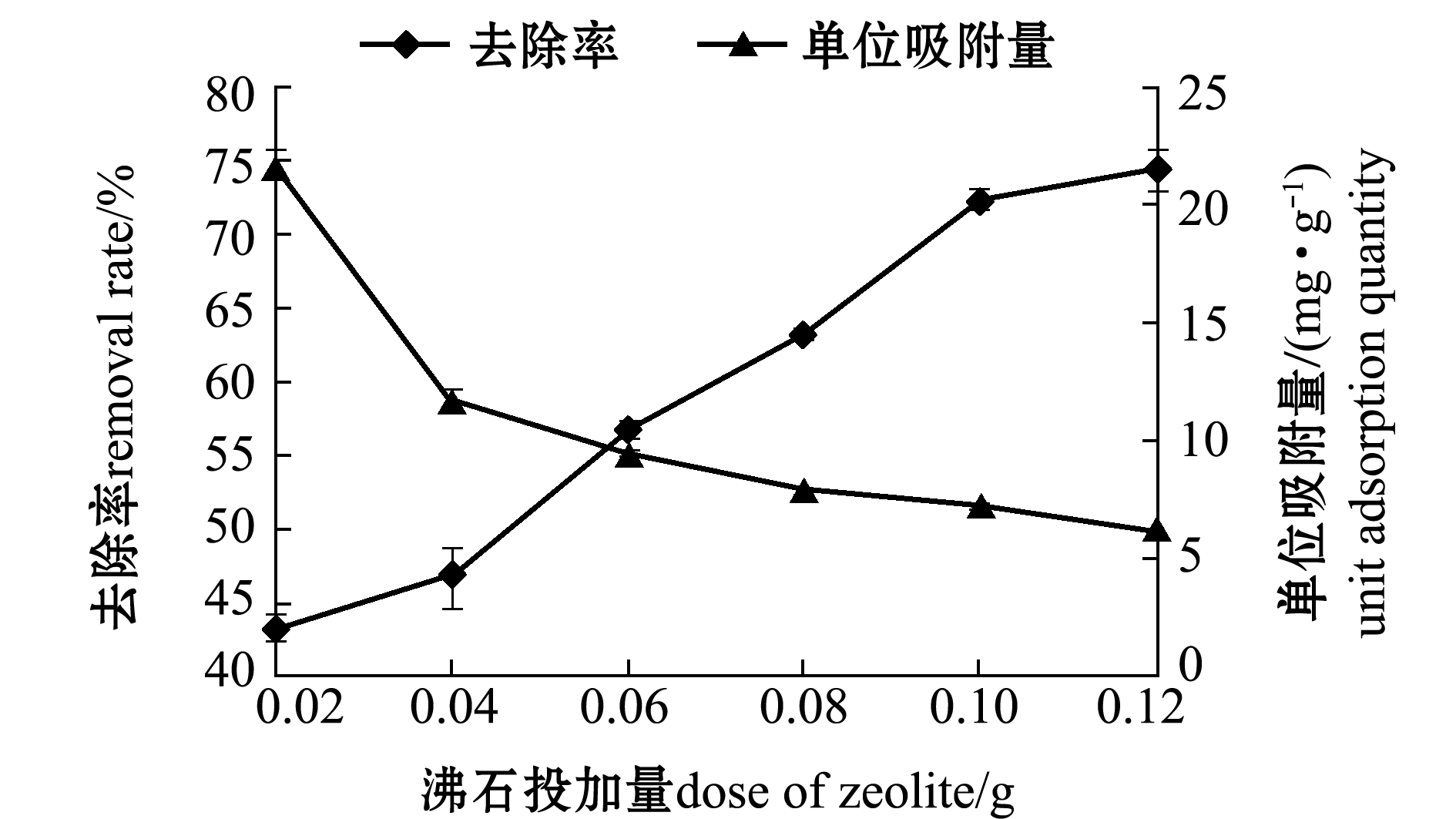
图6 沸石投加量对吸附四环素的影响
Fig.6 Effects of dose of zeolite on adsorption of tetracycline
2.2.3 四环素初始浓度对吸附性能的影响 从图7可见,随着四环素初始浓度的增加,水体中四环素去除率不断下降,而单位吸附量呈上升趋势。在反应体系中,吸附在改性沸石表面的有机污染物与体系中自由基发生反应进而被降解。由于四环素浓度不断增加,单位污染物与自由基接触量减少的同时反应的中间产物增多,对活性自由基产生竞争,导致四环素去除率下降。但随着四环素浓度的继续增大,强大的驱动力使得四环素分子与改性沸石之间碰撞几率增加,有效碰撞次数增多,因而单位吸附量有所增加。因此,综合考虑去除率与单位吸附量,选取四环素初始浓度范围应为10~15 mg/L。
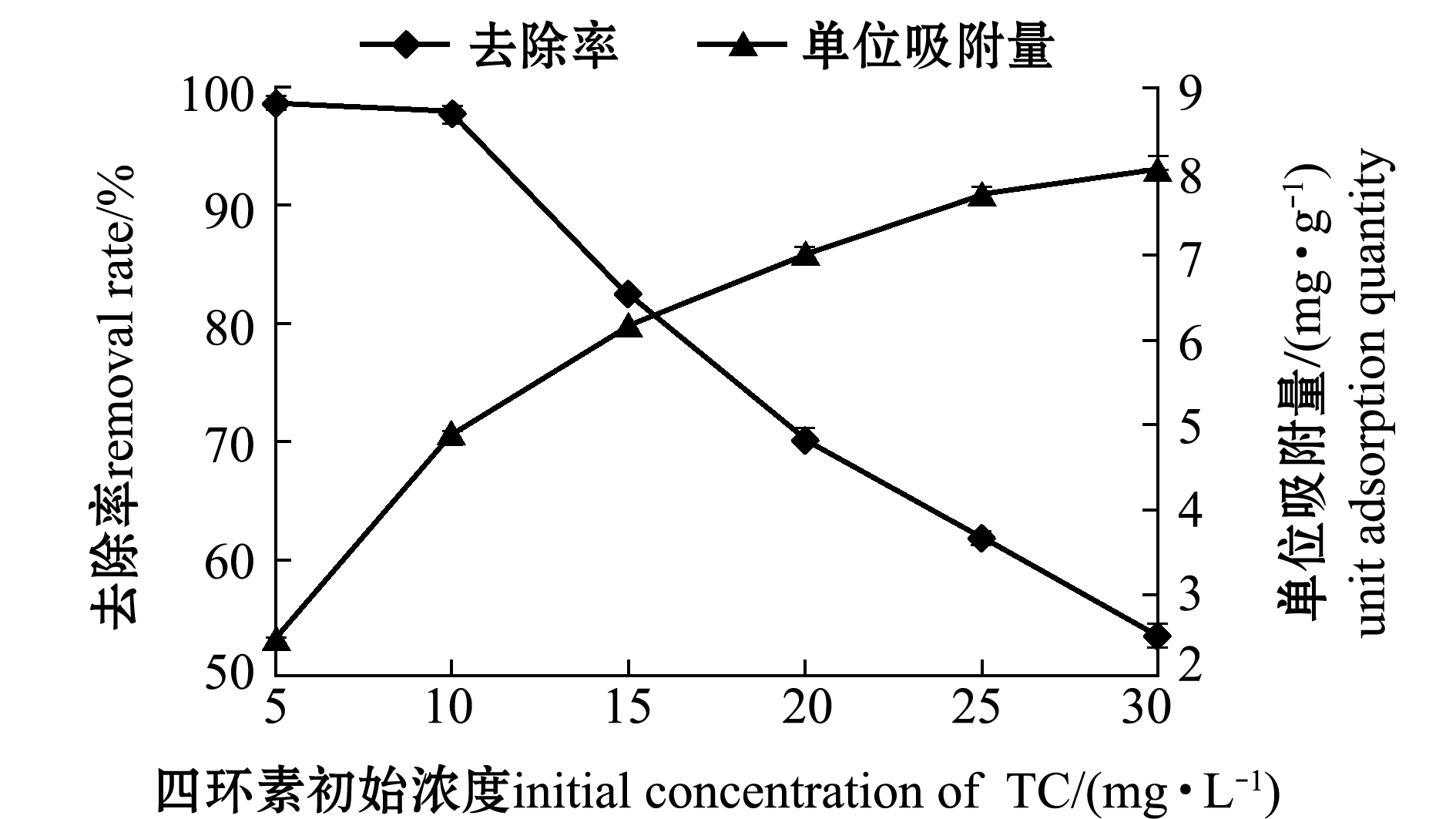
图7 四环素初始浓度对吸附四环素的影响
Fig.7 Effects of initial concentration of tetracycline on adsorption of tetracycline
2.2.4 反应时间对吸附性能的影响 从图8可见:随着反应时间的增加,去除率与单位吸附量均呈现先显著上升再趋于平缓的趋势;在反应60 min内,四环素的吸附速率较快,单位吸附量显著增加。这是由于反应初始阶段改性沸石表面存在较多的结合位点,加大了吸附效率。随着反应的进行,改性沸石表面吸附的四环素分子与溶液中的四环素分子间产生排斥力,使得表面剩余位点很难被占据,此时单位吸附量的增加趋于平缓,达到吸附饱和。因此,取反应时间为60 min较为适宜。
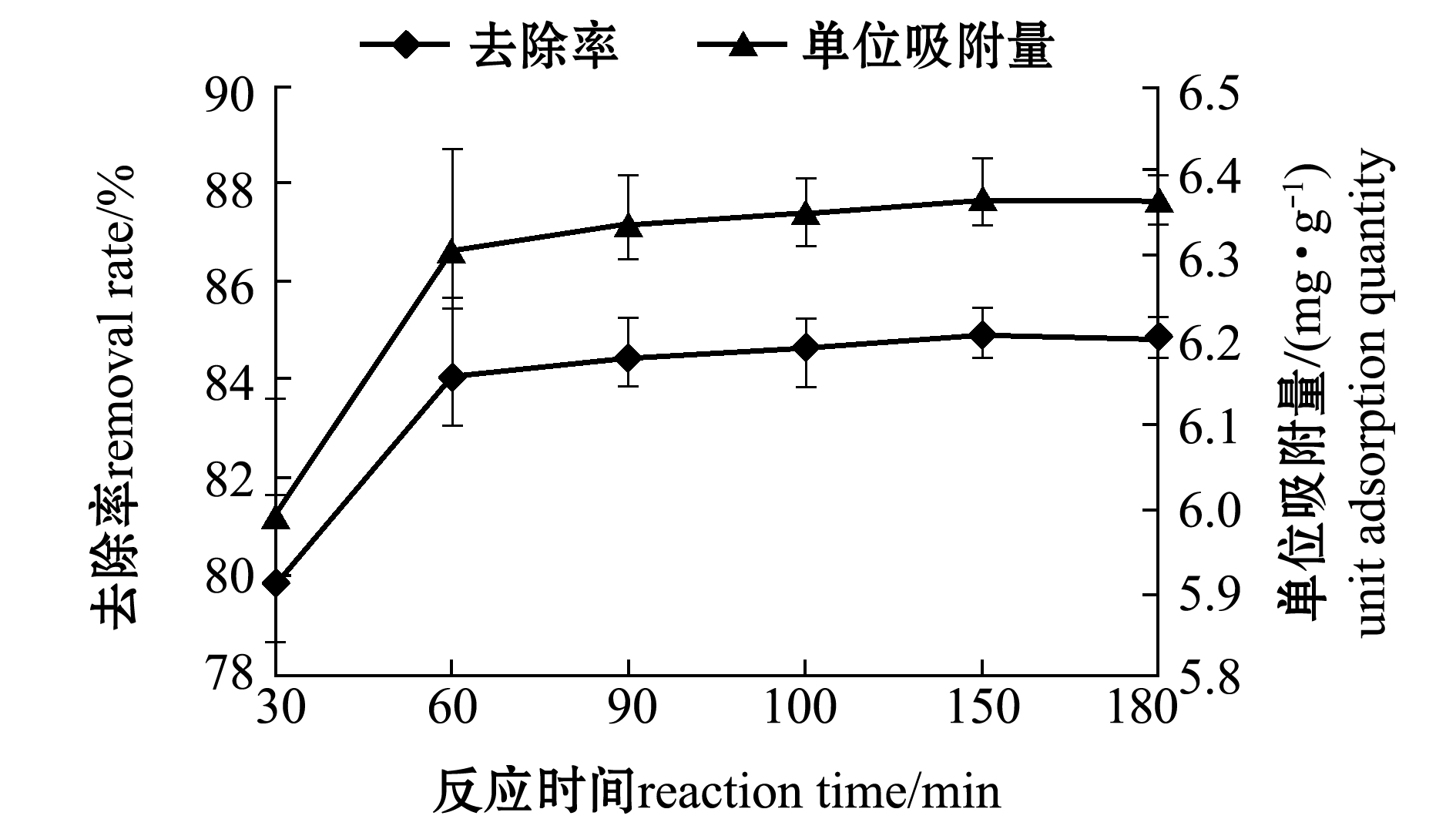
图8 反应时间对吸附四环素的影响
Fig.8 Effects of reaction time on adsorption of tetracycline
2.2.5 pH对吸附性能的影响 从图9可见,随着pH的升高,去除率与单位吸附量都呈现上升趋势。溶液pH作为一个重要因素,在吸附过程中同时对吸附剂的表面电荷和离子化过程产生影响。在酸性和碱性条件下,吸附剂的水合表面分布发生质子化和去质子化,反应方程为
Sur-OH+H+→Sur-OH+,
Sur-OH+OH-→Sur-O-+H2O。
H+和Sur-OH-之间的静电斥力使其在酸性条件下对阳离子的去除效果下降。四环素的电离平衡常数pKa1、pKa2、pKa3分别为3.30、7.69和9.69。pH<3.3时,四环素以TCH3+形式存在;pH=3.3~7.7时,四环素可看作是携带二甲氨基基团与一个负电荷酚羟基的兼性离子;pH>9时,四环素完全以阴离子状态存在。此时,天然沸石经CTAB改性后产生表面絮凝,表面携带正电荷[17]。当pH升高后,复合吸附剂表面带正电,通过静电吸引作用,增强了其对阴离子的吸附能力,故四环素去除率与单位吸附量随pH升高而增加。因此,本试验条件下pH为7~8时较为适宜。
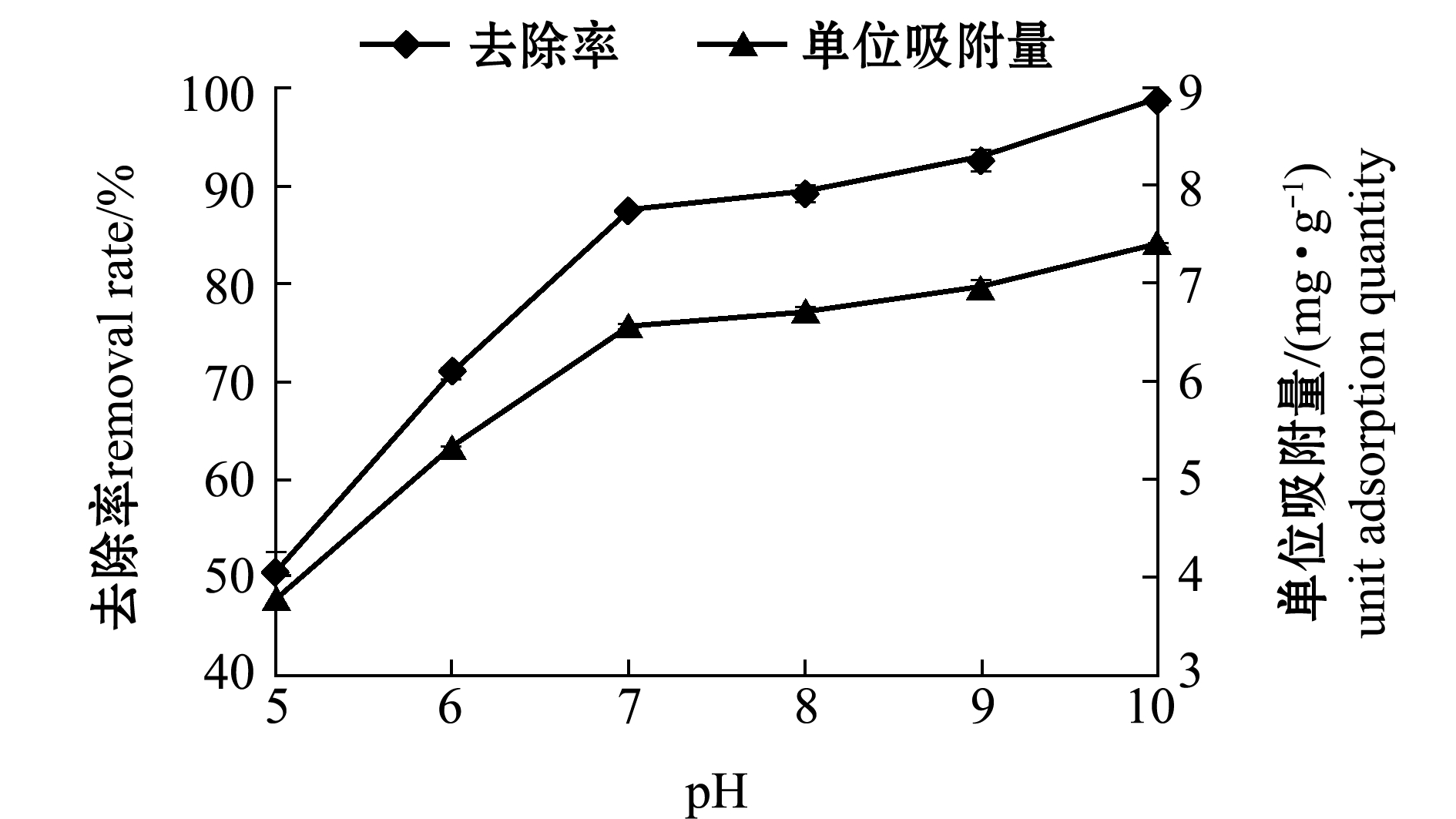
图9 pH对吸附四环素的影响
Fig.9 Effects of pH value on adsorption of tetracycline
综上所述,CTAB改性沸石对养殖废水中的四环素污染去除效果较好,综合考虑去除率与单位吸附量后,选择改性浓度为15 mmol/L、沸石投加量为0.10 g、四环素初始浓度为15 mg/L、反应时间为1 h、pH 8为本试验优化条件,此时水体四环素去除率可达89.28%。
2.2.6 干扰离子对吸附性能的影响 计算得出,在![]() 种共存干扰离子的影响下,CTAB改性沸石对四环素的吸附去除率分别为83.04%、82.03%、82.43%、81.23%、81.63%,与无干扰(去除率为83.64%)时相比影响较小。说明CTAB改性沸石对养殖废水中四环素的吸附有较好的选择性。
种共存干扰离子的影响下,CTAB改性沸石对四环素的吸附去除率分别为83.04%、82.03%、82.43%、81.23%、81.63%,与无干扰(去除率为83.64%)时相比影响较小。说明CTAB改性沸石对养殖废水中四环素的吸附有较好的选择性。
2.3 改性沸石吸附四环素的动力学分析
改性沸石对初始浓度分别为10、20、30 mg/L的四环素溶液的吸附动力学曲线与相关参数如图10~图12和表3所示。由表3可以看出,拟二级动力学模型计算得出的理论值qe2与根据公式(1)计算的试验值qe(8.69、12.38、16.13 mg/g)更为接近,而拟一级动力学计算出的理论值qe1误差较大,且拟二级动力学的R2明显高于拟一级动力学。因此,CTAB改性沸石的吸附动力学更符合拟二级动力学模型。
颗粒内扩散模型用于确定吸附过程中的速率控制阶段[18]。如图12所示,改性沸石对四环素的吸附可以分为两个阶段。第一阶段为快速吸附阶段,在0~60 min时(如图12横坐标半衰期t0.5=2~7 min时)吸附速率较大,吸附量与时间几乎成正比;第二阶段为缓慢吸附阶段,此时吸附曲线趋于平稳,达到动态吸附平衡[19]。这是由于在吸附初始阶段,沸石表面存在许多吸附位点,对四环素的吸附主要发生在沸石表面,使得吸附反应易于进行。此外,沸石表面与溶液中四环素的浓度产生强大的驱动力,加快吸附速率。当吸附反应进入第二阶段后,表面吸附位点趋于饱和,四环素进入沸石孔内的阻力增大,导致吸附速率减慢[20]。
2.4 改性沸石吸附四环素的吸附等温线分析
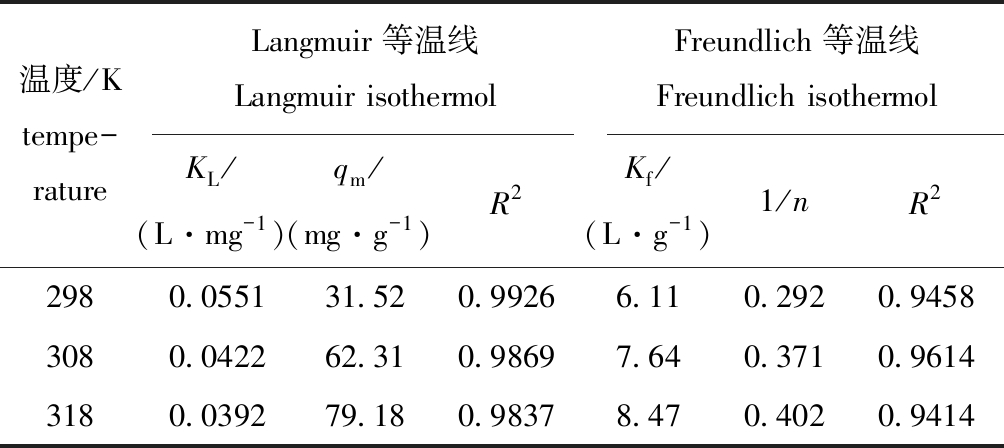
采用Langmuir和Freundlich吸附等温模型对CTAB改性沸石在298~318 K时吸附四环素的试验数据进行拟合(图13、图14),相关参数如表4所示。结果表明,Langmuir吸附等温线对试验数据拟合较好(R2>0.98),说明该吸附过程为发生在均匀表面的单分子层吸附;Langmuir吸附常数KL均小于0.5,表明改性沸石对四环素的吸附过程属于优惠吸附[21]。Freundlich方程中1/n均介于0~1之间,进一步证实了这点,且计算得出改性沸石对四环素的最大饱和吸附量为79.18 mg/g,与实际平衡吸附量接近。综上所述,CTAB改性沸石对四环素具有较强的吸附性能。
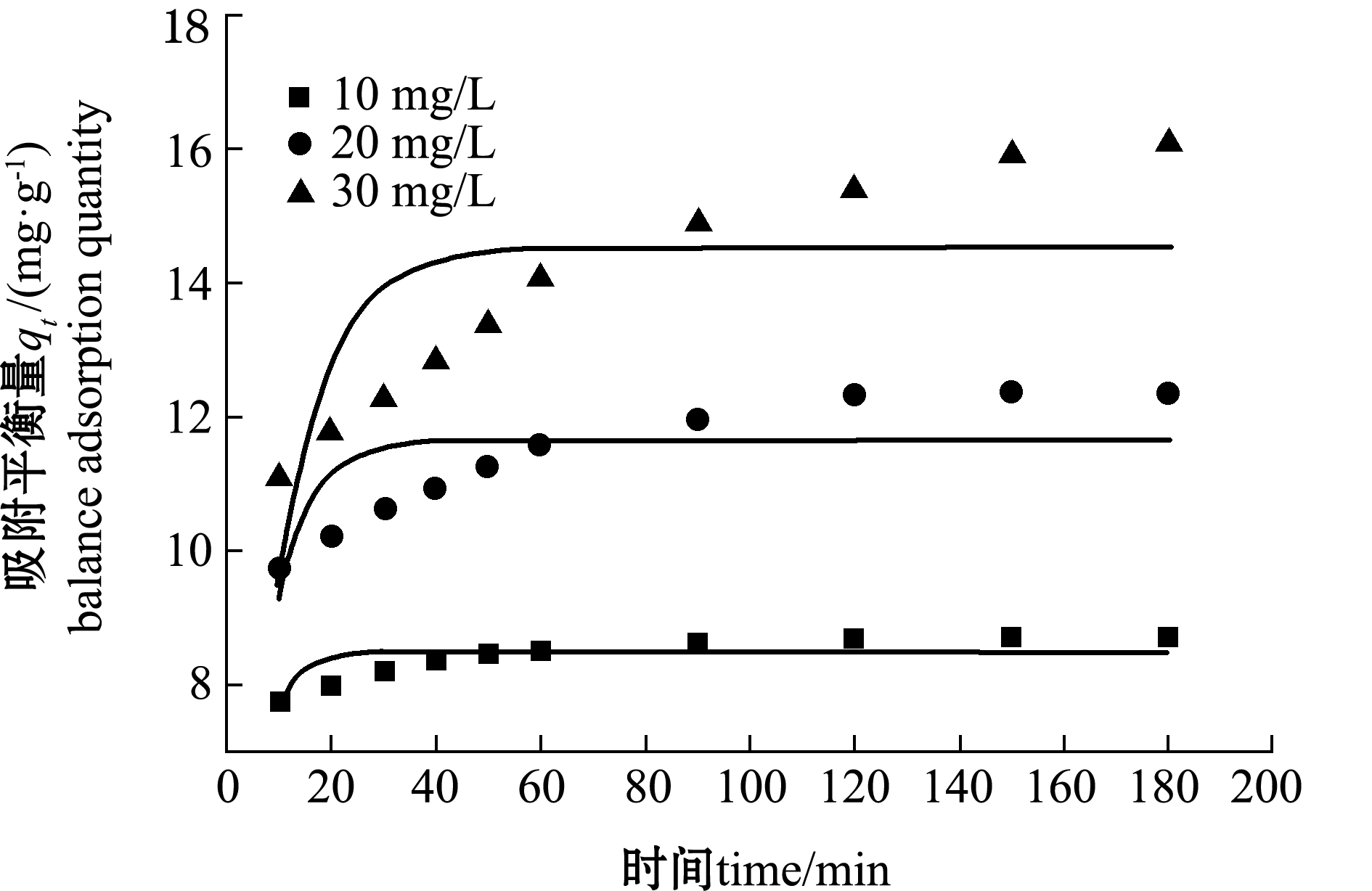
图10 拟一级动力学模型
Fig.10 Pseudo-first-order kinetic model
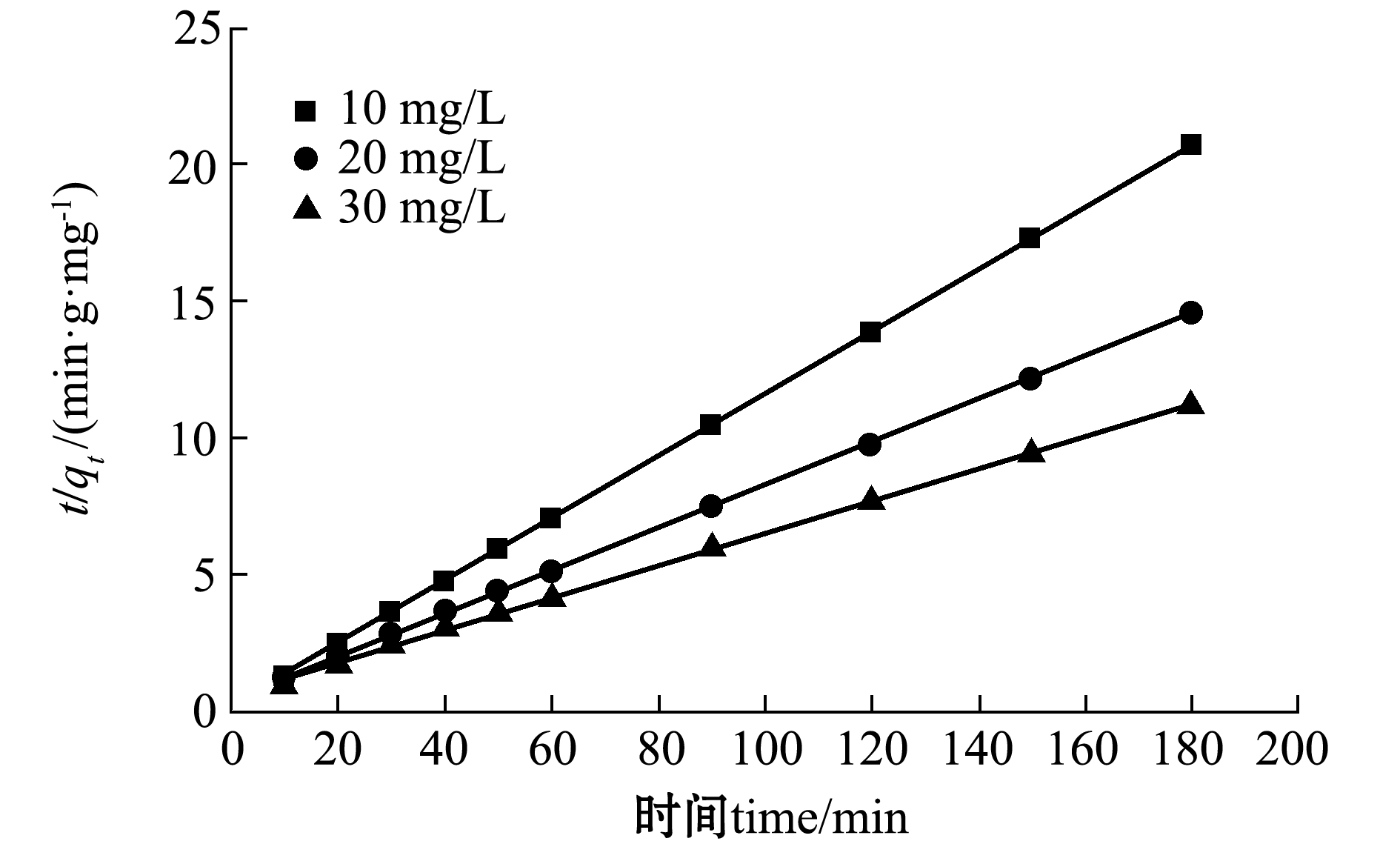
图11 拟二级动力学模型
Fig.11 Pseudo-second-order kinetic model
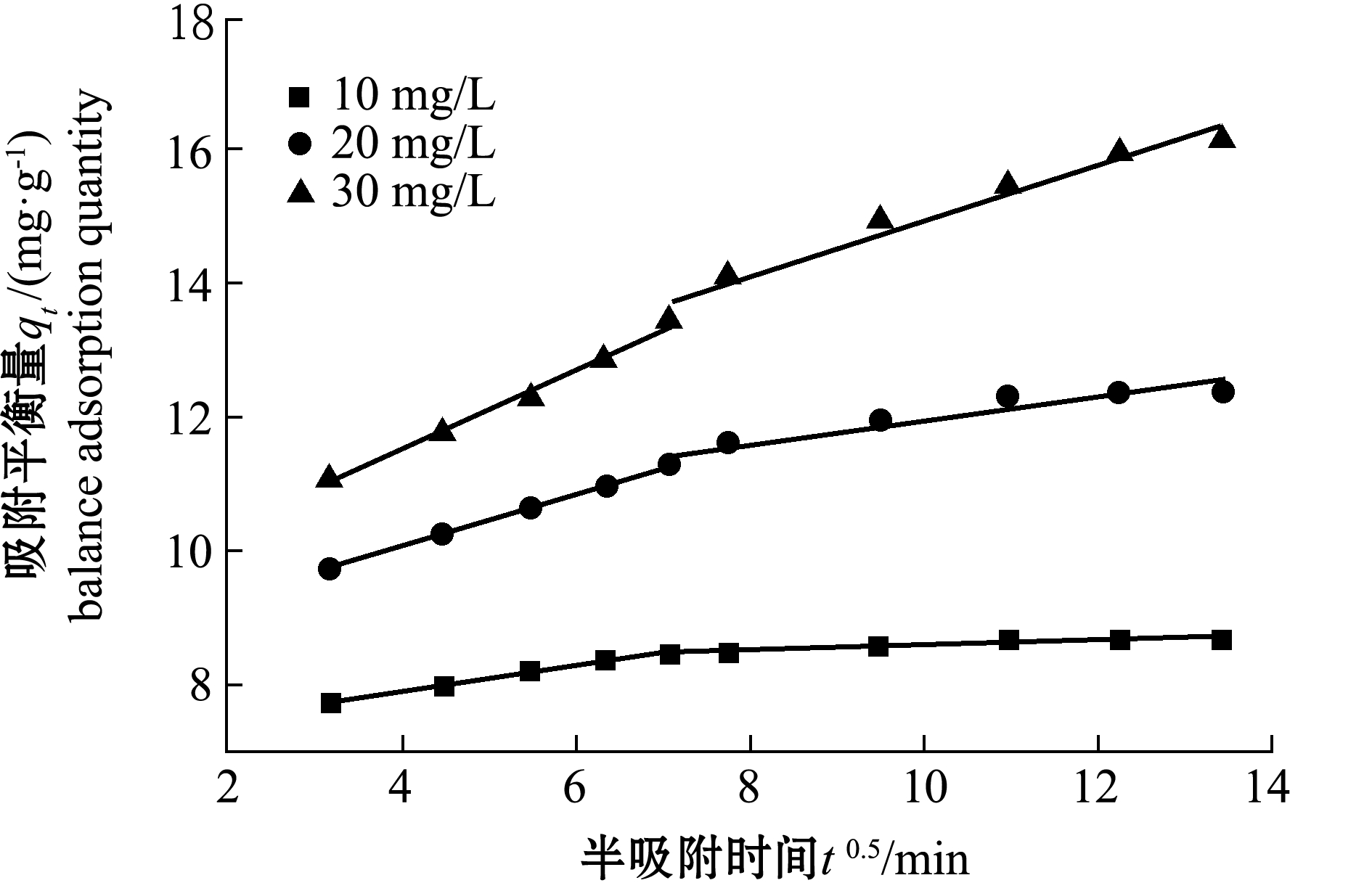
图12 内扩散动力学模型
Fig.12 Intraparticle diffusivity kinetic model
2.5 改性沸石吸附四环素的热力学研究
通过改变温度298~318 K,研究不同温度对改性沸石吸附四环素产生的影响,相关参数如表5所示,随着温度升高,ΔG的值减小,说明此吸附过程在高温条件下更易进行。ΔS>0表明随着反应进行,固液界面粒子的无规律性增加。但是因投加量较小,对吸附反应影响不大。由表5可以看出,ΔG的变化范围在-20~0 kJ/mol内,且ΔS>0,ΔH>0,表明该反应为自发吸热的物理吸附过程。
表3 四环素吸附动力学参数
Tab.3 Dynamic parameters for TC adsorption

动力学模型kinetic model拟一级动力学模型pseudo-first-order kinetic model拟二级动力学模型pseudo-second-order kinetic model内扩散动力学模型intraparticle diffusivity kinetic model四环素浓度/(mg·L-1)concentration of TCK1/min-1qe1/(mg·g-1)R2K2/(g·mg-1·min-1)qe2/(mg·g-1)R2K3/(mg·g-1·min-1)R2100.5448.470.51680.06128.780.99990.182 0.9929200.36411.650.42290.015112.760.99960.385 0.9997300.24414.530.40300.0057116.890.99800.582 0.9901
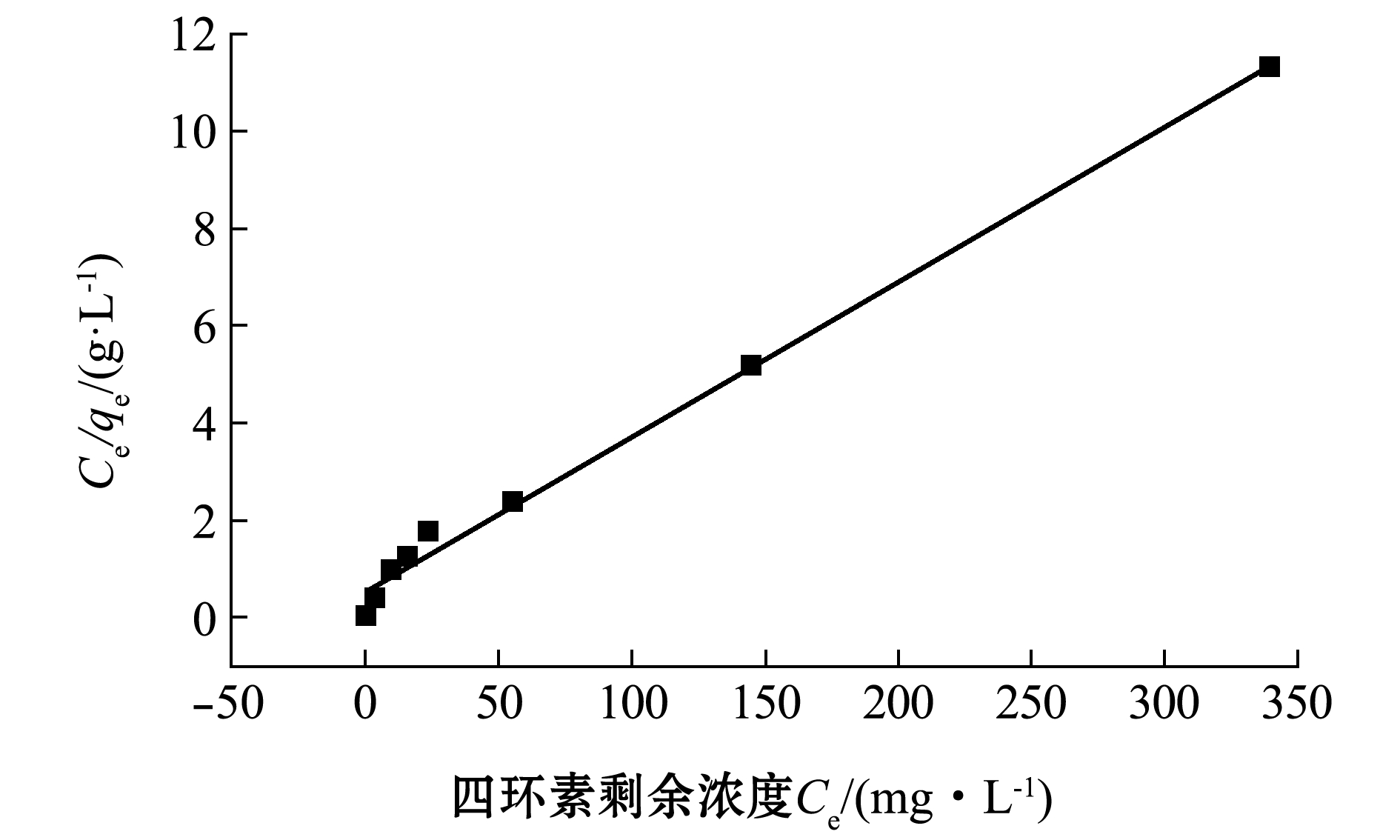
图13 Langmuir吸附等温线
Fig.13 Langmuir isothermol line

图14 Freundlich吸附等温线
Fig.14 Freundlich isothermol line
表4 四环素吸附等温线参数
Tab.4 Isothermal parameters for TC adsorption
温度/Ktempe- ratureLangmuir等温线 Langmuir isothermol Freundlich等温线 Freundlich isothermolKL/(L·mg-1)qm/(mg·g-1)R2Kf/(L·g-1)1/nR22980.055131.520.99266.110.2920.94583080.042262.310.98697.640.3710.96143180.039279.180.98378.470.4020.9414

3 结论
(1) 本研究中采用浸渍法制备了CTAB改性沸石。SEM及BET分析结果显示,与天然沸石相比,改性沸石的比表面积和孔容孔径均增加,改善了沸石的吸附性能,改性后的沸石能够有效地降解养殖废水中的四环素。
(2)当CTAB改性浓度为15 mmol/L、沸石投加量为0.10 g、四环素初始浓度为15 mg/L、反应时间为1 h、pH为8时,在此优化条件下CTAB改性沸石对养殖废水中的四环素污染去除效果较好,去除率可达89.28%。
(3) 改性沸石对养殖废水中四环素的吸附为发生在均匀表面的单分子层吸附,更符合Langmuir等温吸附模型,最大饱和吸附量高达79.18 mg/g。不同温度下的热力学参数表明,该反应为自发吸热的物理吸附过程。吸附动力学符合拟二级动力学模型及颗粒内扩散模型。
[1] 方龙飞,魏群山,王元宏,等.上海黄浦江上游典型抗生素来源及分布污染特征研究[J].环境污染与防治,2017,39(3):301-306.
[2] 姜蕾,陈书怡,杨蓉,等.长江三角洲地区典型废水中抗生素的初步分析[J].环境化学,2008,27(3):371-374.
[3] Watanabe N,Bergamaschi B A,Loftin K A,et al.Use and environmental occurrence of antibiotics in freestall dairy farms with manured forage fields[J].Environmental Science & Technology,2010,44(17):6591-6600.
[4] Akiyama T,Savin M C.Populations of antibiotic-resistant coliform bacteria change rapidly in a wastewater effluent dominated stream[J].Science of the Total Environment,2010,408(24):6192-6201.
[5] 姚圆,莫测辉,李彦文,等.固相萃取-高效液相色谱法分析蔬菜中四环素类抗生素[J].环境化学,2010,29(3):536-541.
[6] 于晓彩,刘京华,王力萍,等.纳米ZnO光催化剂处理养殖废水中盐酸土霉素污染的研究[J].大连海洋大学学报,2018,33(4):504-508.
[7] Gupta V K,Carrott P J M,Ribeiro M M L,et al.Low-cost adsorbents:growing approach to wastewater treatment—a review[J].Critical Reviews in Environmental Science and Technology,2009,39(10):783-842.
[8] 聂志伟,于晓彩,尹丹妮,等.碳素纤维在近岸海洋污染物亚硝酸盐、总氨态氮处理中的应用[J].大连海洋大学学报,2017,32(4):473-478.
[9] Guo J Y.Adsorption characteristics and mechanisms of high-levels of ammonium from swine wastewater using natural and MgO modified zeolites[J].Desalination and Water Treatment,2016,57(12):5452-5463.
[10] 李佳,林建伟,詹艳慧,等.溴化十六烷基吡啶改性沸石对水中菲的吸附作用[J].环境科学,2014,35(2):611-618.
[11] 张宏华,林建伟.HDTMA改性沸石对铬酸盐的吸附作用研究[J].浙江工业大学学报,2010,38(5):494-498.
[12] 何敏祯,胡勇有,雷超,等.HDTMA改性沸石对三氯生的吸附特性研究[J].环境科学学报,2013,33(1):20-29.
[13] 郭俊元,王彬.HDTMA改性沸石的制备及吸附废水中对硝基苯酚的性能和动力学[J].环境科学,2016,37(5):1852-1857.
[14] 张秀兰,栗印环,张灵芝,等.表面活性剂改性有机沸石对废水中亚甲基蓝的吸附行为[J].化学研究,2011,22(1):80-83.
[15] 张国珍,高小波,武福平,等.十六烷基三甲基溴化铵改性沸石对腐殖酸的吸附性能研究[J].环境污染与防治,2016,38(5):12-17.
[16] 谭文渊,徐曼,曾英.十六烷基三甲基溴化铵修饰P型沸石吸附水中直链烷基苯磺酸钠的研究[J].高等学校化学学报,2016,37(1):65-72.
![]() V,Dondur
V,Dondur ![]() L,et al.Improved materials for environmental application:surfactant-modified zeolites[J].Materials Science Forum,2006,518:223-228.
L,et al.Improved materials for environmental application:surfactant-modified zeolites[J].Materials Science Forum,2006,518:223-228.
[18] Ahn S,Werner D,Karapanagioti H K,et al.Phenanthrene and pyrene sorption and intraparticle diffusion in polyoxymethylene,coke,and activated carbon[J].Environmental Science & Technology,2005,39(17):6516-6526.
[19] 李文静,李军,张彦灼,等.NaCl改性沸石对水中氨氮的吸附机制[J].中国环境科学,2016,36(12):3567-3575.
[20] 齐景凯,张玉芬,于秀英,等.蓖麻秸秆对铅、汞、镍和镉的吸附特征[J].中国农业大学学报,2017,22(3):85-93.
[21] Hameed B H,Tan I A W,Ahmad A L.Adsorption isotherm,kinetic modeling and mechanism of 2,4,6-trichlorophenol on coconut husk-based activated carbon[J].Chemical Engineering Journal,2008,144(2):235-244.