循环水养殖具有可控、 高效、 环保和产品优质等优点,是水产养殖业发展的重要方向之一[1-3]。循环水养殖系统利用污水处理工艺,水体回用率高达96%以上[4],能有效减少养殖过程中对周围水环境的污染[5]。目前,海水养殖废水的处理方法主要包括物理、化学和生物方法,其中生物法应用最为广泛[6]。生物滤器作为循环水养殖系统的核心水处理单元[7],在养殖过程中至关重要。曝气生物滤器是一种新型的生物膜法污水处理技术,其工作原理是通过附着在生物载体或滤料表面的微生物,吸附、分解、转化养殖水体中对鱼类有害的有机污染物,从而实现水体的净化[8]。
循环水养殖系统在运行过程中,环境因素发生变化极易引起生物滤器水处理能力下降,导致养殖水体中氨氮(TAN)、亚硝酸盐氮![]() 浓度超标甚至出现亚硝酸盐氮积累现象,影响鱼类的正常生长甚至诱发鱼病,从而导致鱼类死亡并造成经济损失。同样,
浓度超标甚至出现亚硝酸盐氮积累现象,影响鱼类的正常生长甚至诱发鱼病,从而导致鱼类死亡并造成经济损失。同样,![]() 的氧化速率受硝化作用菌群和环境因素(底物浓度、温度、pH、溶解氧等)的影响,研究发现,温度和pH值会影响微生物的活性,对脱氮的效果起决定性作用[9]。其中,温度能够影响微生物酶的反应速度及基质向细胞的扩散速度[10],环境pH值能够改变细胞膜的通透性及表面带电性[11],且温度和pH值均能影响微生物的生长速度。氨氧化细菌(AOB)在高温条件下的生长速率要高于亚硝酸盐氧化菌(NOB)[12-13];亚硝化单胞菌在pH为7.9~8.2的环境中生长最快,硝化杆菌则在pH为7.2~7.6的环境中生长最快[14]。另外,水环境中的温度和pH值还能够影响游离氨(FA)的浓度,FA对AOB和NOB均存在不同程度的抑制作用,但NOB对FA浓度的变化更加敏感[15-16]。
的氧化速率受硝化作用菌群和环境因素(底物浓度、温度、pH、溶解氧等)的影响,研究发现,温度和pH值会影响微生物的活性,对脱氮的效果起决定性作用[9]。其中,温度能够影响微生物酶的反应速度及基质向细胞的扩散速度[10],环境pH值能够改变细胞膜的通透性及表面带电性[11],且温度和pH值均能影响微生物的生长速度。氨氧化细菌(AOB)在高温条件下的生长速率要高于亚硝酸盐氧化菌(NOB)[12-13];亚硝化单胞菌在pH为7.9~8.2的环境中生长最快,硝化杆菌则在pH为7.2~7.6的环境中生长最快[14]。另外,水环境中的温度和pH值还能够影响游离氨(FA)的浓度,FA对AOB和NOB均存在不同程度的抑制作用,但NOB对FA浓度的变化更加敏感[15-16]。
目前,国内对曝气生物滤器的研究主要集中在城市生活污水的处理中,而对高盐度、寡营养的海水养殖废水研究较少。本试验中,从温度和pH值变化的角度对海水曝气生物滤器的硝化性能展开研究,探究了不同环境条件下曝气生物滤器对海水养殖废水中![]() 的处理效果,并研究了不同环境条件下生物滤器中
的处理效果,并研究了不同环境条件下生物滤器中![]() 积累的情况,旨在为生物滤器的运行提供参数指导,从而促进生物滤器稳定高效运行,提高生物滤器的硝化能力,降低能耗,改善养殖水环境。
积累的情况,旨在为生物滤器的运行提供参数指导,从而促进生物滤器稳定高效运行,提高生物滤器的硝化能力,降低能耗,改善养殖水环境。
本研究中自行设计构建了实验室规模的生物滤器水处理系统(图1)。装置主要分为3部分:储水箱、生物滤器和水浴池。生物滤器为有机玻璃材质,高60 cm,内部直径为10 cm,有效体积约为4 L。生物填料已挂膜且熟化稳定,取自中国科学院海洋研究所稳定运行的大菱鲆循环水养殖系统。生物填料为直径为2.5 cm、厚度为0.4 cm的64孔环形塑料填料,有效表面积为1200 m2/m3左右。填料选购于浙江省桐乡市小老板特种塑料制品有限公司(代码为XLB-10)。生物滤器填充率为30%,水体温度通过加热棒控制。
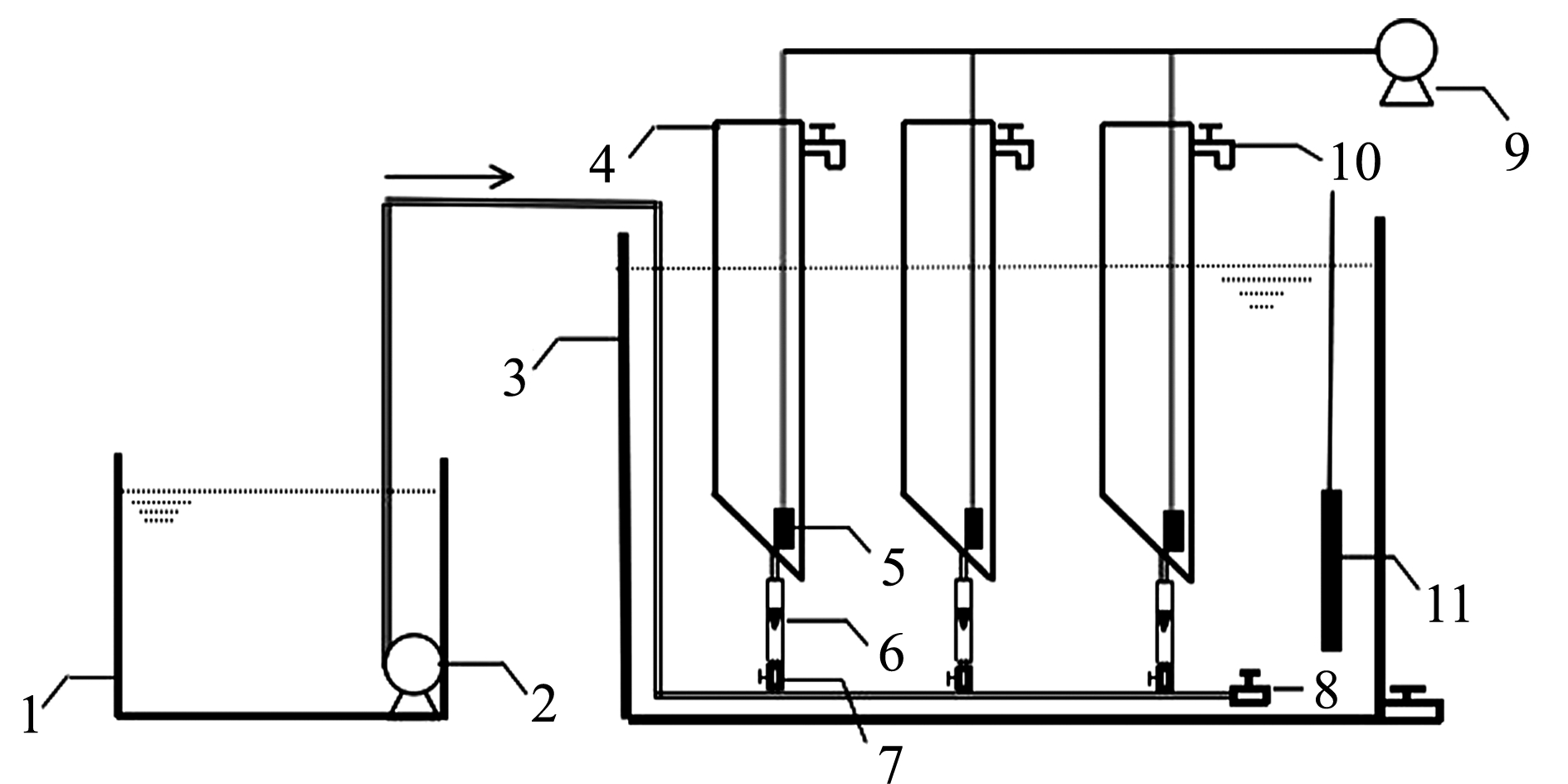
注:1为储水箱; 2为潜水泵; 3为水浴池; 4为生物滤器; 5为气石; 6为流量计; 7为流量计调节阀; 8为排污口; 9为曝气泵; 10为生物滤器出水口; 11为加热棒
Note: 1,water storage tank; 2,submersible pump; 3,water bath tank; 4,biological filter; 5,airstone; 6,flowmeter; 7,flowmeter control valve; 8,outfall; 9,aeration pump; 10,biological filter outlet; 11,heater
图1 试验装置示意图
Fig.1 Schematic diagram of experimental device
1.2.1 试验用水调制 试验采用人工模拟的海水养殖废水,用100 g晒干的大西洋鲑养殖过程中产生的残饵、粪便与其饵料按照质量比1∶1混合粉碎后,加入20 L新鲜海水,于阴暗处发酵3 d,再用300目筛绢过滤,最后用新鲜海水稀释得到试验用水[17]。试验用水的TAN初始负荷浓度控制在2.0 mg/L左右,COD初始浓度为4.0~5.0 mg/L,盐度为30左右。温度通过加热棒调节,pH值通过滴加1.0 mol/L的HCl溶液和1.0 mol/L的NaOH溶液控制。试验水体溶解氧(DO)控制在6.0~7.0 mg/L。
1.2.2 试验设计 试验设置7.0、7.5、7.7、8.0、8.5共5个pH处理组,以及10、15、20、25、30 ℃ 5个温度处理组。将不同pH值与不同温度两两组合,试验共设25个处理组,每个处理组设置3个平行,分批次(每个批次5个处理组,共5个批次)进行试验,研究不同pH值和温度组合条件对生物滤器硝化性能的影响。试验中每个处理组的生物填料均来自同一稳定运行的大菱鲆循环水养殖系统,生物填料不重复使用,试验前每个处理组的生物填料需在各自的试验条件下稳定1周。试验开始时启动图1系统潜水泵,待生物滤器水装满后,关闭潜水泵,打开曝气装置,生物滤器水力停留时间(HRT)为5 h。每隔15 min取一次水样,连续取样5 h,检测生物滤器水样中TAN及![]() 随时间的变化情况。
随时间的变化情况。
1.2.3 水质检测 参照海洋监测规范(GB 17378.4—2007)测定水质指标。其中,采用纳氏试剂比色法测定TAN含量,采用萘乙二胺分光光度法测定![]() 含量[18]。采用YSI-556多参数水质分析仪检测温度、pH、DO、盐度等指标。
含量[18]。采用YSI-556多参数水质分析仪检测温度、pH、DO、盐度等指标。
TAN去除速率计算公式为
η=(C0-C1)/Δt。
其中:△t为生物滤器工作时间(h);C0为生物滤器初始TAN的平均浓度(mg/L);C1为生物滤器工作结束时TAN的平均浓度(mg/L)。
试验结果以平均值±标准差(mean±S.D.)表示,采用SPSS 19.0软件进行单因素方差分析(One-way ANOVA),采用LSD法进行组间多重比较,显著性水平设为0.05。
从图2可见:不同pH条件下,各温度处理组TAN的浓度随时间变化均呈现不断降低的趋势。
从图3可见:在相同pH值条件下,温度对生物滤器TAN的去除速率有显著性影响(P<0.05);温度为10~25 ℃时,生物滤器对TAN的去除速率随着温度的升高不断增加,平均体积去除速率由(0.376 6±0.014 2)mg/(L·h)提高至(0.720 7±0.018 4)mg/(L·h),温度低于20 ℃时,生物滤器TAN的平均去除速率随温度的升高变化较小,温度由10 ℃上升至15、20 ℃时,TAN的平均去除速率分别提高了14.13%、35.95%;而温度高于20 ℃时,生物滤器对TAN的处理能力随温度变化明显;温度为25、30 ℃时,相比10 ℃时生物滤器对TAN的平均去除速率分别提高了91.38%、65.02%。

图2 不同温度和pH值下总氨氮随时间的变化
Fig.2 Changes in TAN levels at different temperatures and pH values with time
从图3还可见,当温度低于20 ℃(10、15 ℃)时,不同pH值处理组(除pH 7.0组外)对TAN的去除速率无显著性差异(P>0.05),其中,温度为10 ℃时,生物滤器TAN平均去除速率最高与最低的处理组相差4.6%,温度为15 ℃时两者相差6.7%;当温度高于20 ℃时,pH值变化对生物滤器去除TAN的影响比较明显,温度为20、25、30 ℃时,生物滤器TAN平均去除速率最高与最低的处理组分别相差22.3%、21.0%、24.1%,且pH为7.5~8.0时的处理组生物滤器对TAN的去除能力显著优于pH为7.0、8.5的处理组(P<0.05),pH为7.7时生物滤器对TAN的平均去除速率最高。
综合温度、pH两种因素对生物滤器处理TAN的影响发现,在温度为25 ℃、pH为7.7的条件下,生物滤器对TAN的去除能力最强,在135 min左右时可完成对水中TAN的去除,体积去除速率达到(0.7931±0.0231)mg/(L·h)。
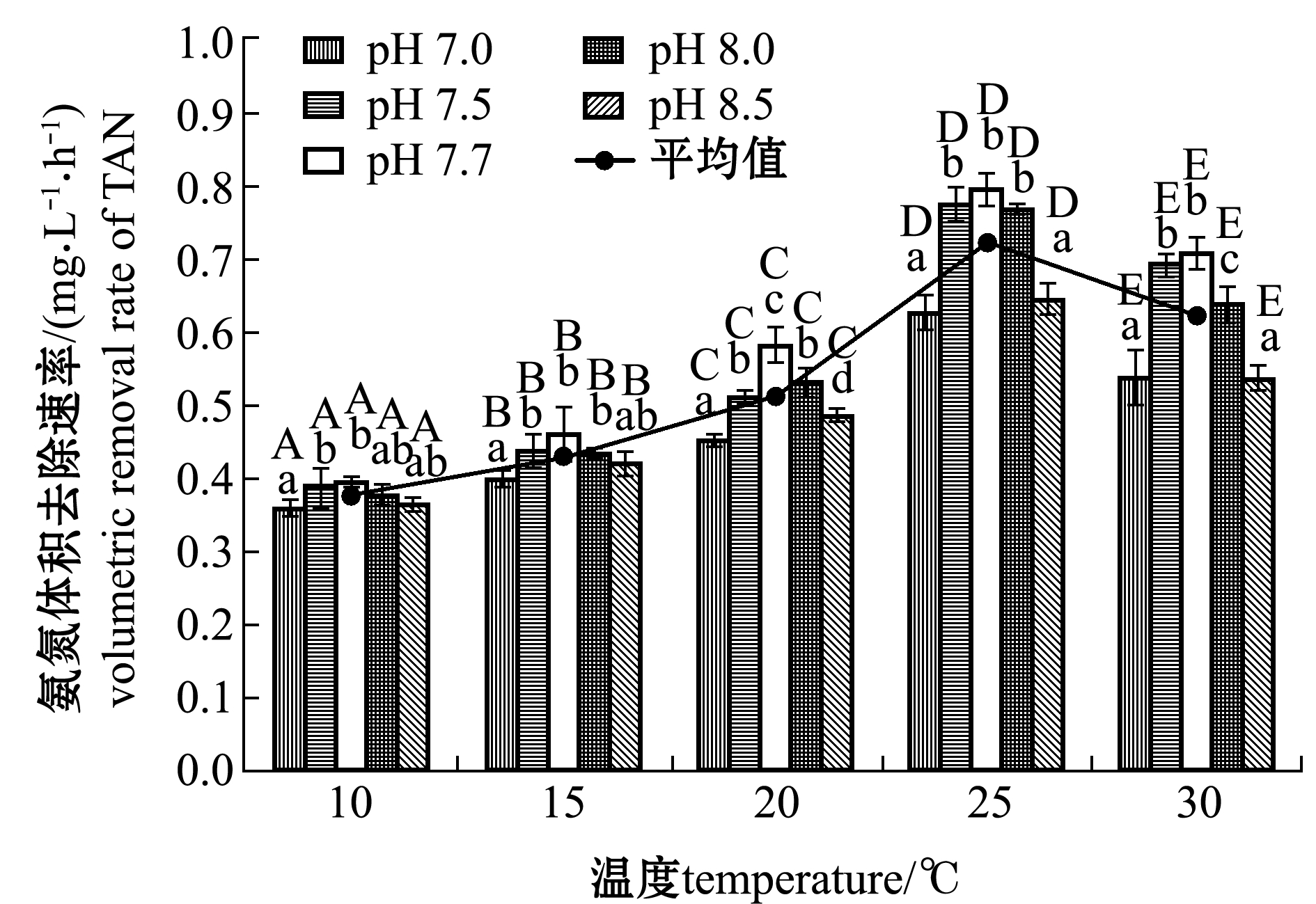
注:相同温度下,标有不同小写字母者表示不同pH值组间有显著性差异(P<0.05);相同pH值下,标有不同大写字母者表示不同温度组间有显著性差异(P<0.05);标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:Means with different superscripts at the same temperature are significantly different in different pH values (P<0.05); means with different superscripts at the same pH value are significantly different in different temperatures (P<0.05); means with the same letters are not significant differences(P>0.05), et sequentia
图3 不同温度和pH值下总氨氮的体积去除速率
Fig.3 Volumetric removal rate of TAN at different temperatures and pH values
不同温度和pH值条件下生物滤器中![]() 的去除情况如图4所示。从图4可见:生物滤器运行过程中
的去除情况如图4所示。从图4可见:生物滤器运行过程中![]() 的浓度呈先上升后下降的趋势;相同pH条件下,当温度为10~25 ℃时生物滤器对
的浓度呈先上升后下降的趋势;相同pH条件下,当温度为10~25 ℃时生物滤器对![]() 的去除能力随着温度的升高不断加强,在温度为25 ℃时生物滤器对
的去除能力随着温度的升高不断加强,在温度为25 ℃时生物滤器对![]() 去除速率最高,温度为30 ℃ 时生物滤器对
去除速率最高,温度为30 ℃ 时生物滤器对![]() 的去除速率仅次于25 ℃。
的去除速率仅次于25 ℃。
从图4还可见:相同温度条件下,pH为7.5时生物滤器对![]() 的去除效果最佳(最快150 min时完成对
的去除效果最佳(最快150 min时完成对![]() 的去除);pH为7.7时生物滤器对
的去除);pH为7.7时生物滤器对![]() 的去除效果仅次于pH为7.5时(最快用时165 min);pH为7.0与pH为8.5的处理组生物滤器对
的去除效果仅次于pH为7.5时(最快用时165 min);pH为7.0与pH为8.5的处理组生物滤器对![]() 的去除效果无显著性差异(P>0.05)(最快用时均为180 min)。当温度为10、15 ℃时,不同pH处理组生物滤器对
的去除效果无显著性差异(P>0.05)(最快用时均为180 min)。当温度为10、15 ℃时,不同pH处理组生物滤器对![]() 的去除速率无显著性差异(P>0.05)。由此可见,在温度为25 ℃、pH为7.5条件下,生物滤器对
的去除速率无显著性差异(P>0.05)。由此可见,在温度为25 ℃、pH为7.5条件下,生物滤器对![]() 的去除速率最快,在150 min左右完成对水中
的去除速率最快,在150 min左右完成对水中![]() 的去除。
的去除。
不同温度和pH值对生物滤器中![]() 积累的影响如图5所示。从图5可见:相同pH值条件下,在温度为10~25 ℃,温度对生物滤器
积累的影响如图5所示。从图5可见:相同pH值条件下,在温度为10~25 ℃,温度对生物滤器![]() 积累有显著性影响
积累有显著性影响![]() 的最大积累浓度随温度的升高而增加,平均最大积累浓度由(0.389 1±0.096 9)mg/L增加至(0.975 8±0.198 8)mg/L;温度为30 ℃时,各处理组
的最大积累浓度随温度的升高而增加,平均最大积累浓度由(0.389 1±0.096 9)mg/L增加至(0.975 8±0.198 8)mg/L;温度为30 ℃时,各处理组![]() 积累现象均有所下降,
积累现象均有所下降,![]() 平均最大积累浓度为(0.911 1±0.211 2)mg/L。
平均最大积累浓度为(0.911 1±0.211 2)mg/L。
从图5还可见:相同温度条件下,生物滤器中![]() 的最高积累浓度随着pH的升高而增加;在pH为8.5时生物滤器中
的最高积累浓度随着pH的升高而增加;在pH为8.5时生物滤器中![]() 的积累显著高于其他处理组(P<0.05)。由此可见,生物滤器在温度为25 ℃、pH为8.5时
的积累显著高于其他处理组(P<0.05)。由此可见,生物滤器在温度为25 ℃、pH为8.5时![]() 积累现象最严重。
积累现象最严重。
环境因子能够影响生物滤器中微生物的生长代谢及活性,从而影响生物滤器的水处理能力[19],而温度和pH是诸多环境因子中非常重要的两个因子[20]。故本研究中从温度和pH两个方面探讨环境因素对生物滤器硝化性能的影响。
养殖水体中TAN的去除是循环水养殖过程中十分重要的水处理环节,其关乎循环水养殖的成败[3]。本研究中发现,在温度为10~25 ℃时,生物滤器对TAN的去除速率随着温度的升高不断增加。这是由于温度会影响微生物的化学反应速度,一定的温度范围内微生物的新陈代谢随着温度的升高而加强[21] ,Zhang等[22]在温度为7.2~28.3 ℃时,同样发现生物滤器对TAN的去除速率随着温度的升高不断增大,Kim等[23]也得出类似的结论。本试验中温度为25 ℃时生物滤器对TAN的去除速率最高,这与王劼等[24]得出的温度为24 ℃时TAN的氧化速率最高的结论十分接近,与Balmelle等[25]、Yoo等[26]得出的氨氧化反应的最佳温度为25 ℃的结论也一致。本试验中温度由25 ℃升高至30 ℃时,生物滤器对TAN的去除速率下降,杨志强等[27]也有类似的发现(温度由28 ℃升高至32 ℃时,生物滤器对TAN的去除率下降)。合理的调控温度是生物滤器高效稳定运行的重要保证[20]。循环水系统养殖过程中,系统温度应在养殖对象温度生长特性的基础上,考虑温度对生物滤器水处理能力的影响做出适当的调节,在保证产量的同时降低能耗、优化系统水质环境。另外,本试验中温度由10 ℃增加至15、20、25、30 ℃时,生物滤器对TAN的去除速率分别提高14.13%、35.95%、91.38%、65.02%。研究表明,温度为20~35 ℃时有利于硝化反应[28],本研究中发现,当温度大于20 ℃时各试验组对TAN的去除速率明显增加,20 ℃是氨氧化反应的一个临界温度,Kim等[23]、王劼等[24]同样认为,20 ℃是生物滤器去除TAN的一个温度转折点。

图4 不同温度和pH值下![]() 随时间的变化情况
随时间的变化情况
Fig.4 Changes in nitrite levels at different temperatures and pH values with time
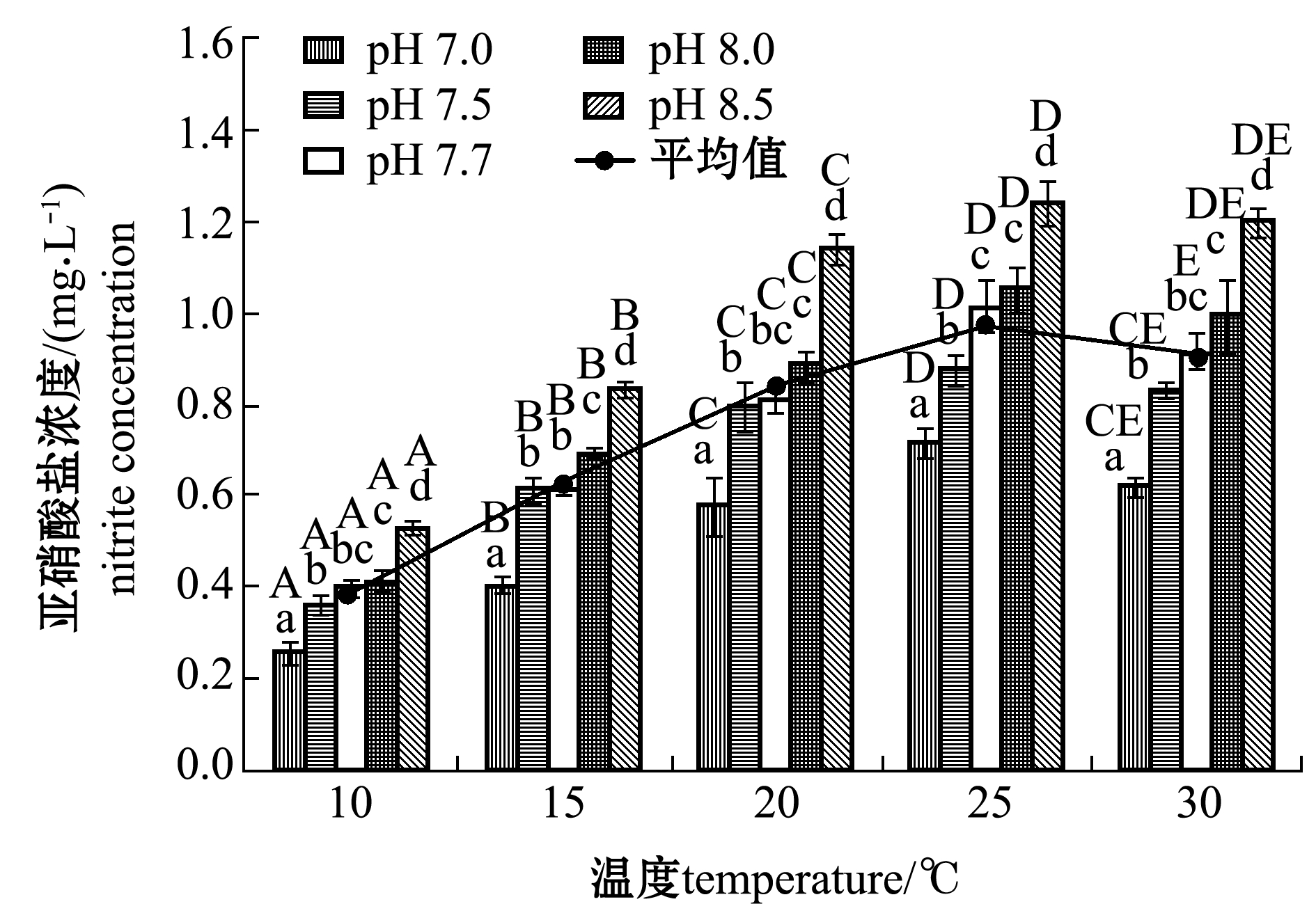
图5 不同温度和pH值下![]() 最大积累浓度
最大积累浓度
Fig.5 Maximum accumulation concentration of nitrite at different temperatures and pH values
pH值影响微生物的新陈代谢及其活性[29]。本试验结果显示,生物滤器在pH为7.0、8.5时对TAN的去除速率低于pH为7.5、7.7、8.0时,且在温度大于20 ℃时这种差距更为明显,证明在pH为7.5~8.0时有利于氨氧化反应[30]。徐婷等[31]研究发现,在短程硝化过程中pH为7.3~8.0时AOB浓度最大,氨氧化速率最高,与本试验结论十分接近。另外,本试验发现,在温度为25 ℃、pH为7.7时,生物滤器对TAN的去除速率最高。而Wang等[32]研究发现,在温度为30 ℃、pH为7.5时生物滤器对氨氮的去除速率最大;Bae等[33]研究发现,在温度为30 ℃、pH为8.1时生物滤器对氨氮的去除速率却最大,这可能是由于所处理的废水在盐度等方面的差异,导致生物滤器中的优势菌种不同引起的。循环水养殖过程中,由于硝化作用产生的H+和生物呼吸释放出的CO2,系统的pH呈现出下降的趋势,通过调控并维持系统稳定的pH环境,能够提高生物滤器的水处理能力,从而为养殖生物营造优良的水质环境。
本试验中还发现,温度为10、15 ℃时,不同pH处理组中TAN去除速率最高的组与最低的组,其处理速率相差较小(10 ℃时相差4.6%,15 ℃时相差6.7%),而在温度为20、25、30 ℃时,不同pH处理组中TAN去除速率最高的组与最低的组,其去除速度相差较大(20 ℃时相差22.3%,25 ℃时相差21.0%,30 ℃时相差24.1%)。这证明,在温度为10~30 ℃、pH为7.0~8.5时,相比pH,温度对生物滤器硝化性能的影响更大。
![]() 能够诱发鱼病[34],因此,控制养殖水体中
能够诱发鱼病[34],因此,控制养殖水体中![]() 的浓度对循环水养殖十分重要。本试验中发现,温度为10~25 ℃时,生物滤器对
的浓度对循环水养殖十分重要。本试验中发现,温度为10~25 ℃时,生物滤器对![]() 的去除速率随温度的升高不断增加。Zhang等[22]在温度为7.2~28.3 ℃的条件下,同样发现
的去除速率随温度的升高不断增加。Zhang等[22]在温度为7.2~28.3 ℃的条件下,同样发现![]() 的去除速率随温度的升高而增加,去除速率由
的去除速率随温度的升高而增加,去除速率由![]() 增加至
增加至![]() 温度能够影响NOB的活性,一定范围内温度升高,有利于亚硝酸盐氧化反应的进行[21]。养殖水体中的TAN在AOB的作用下转化为
温度能够影响NOB的活性,一定范围内温度升高,有利于亚硝酸盐氧化反应的进行[21]。养殖水体中的TAN在AOB的作用下转化为![]() 在NOB的作用下转化为
在NOB的作用下转化为![]() 本试验中废水的TAN浓度一致,因此,各处理组生物滤器氧化去除
本试验中废水的TAN浓度一致,因此,各处理组生物滤器氧化去除![]() 的总量相同;在温度为25 ℃、pH为7.5时,生物滤器中
的总量相同;在温度为25 ℃、pH为7.5时,生物滤器中![]() 的存在时间最短,证明在此条件下生物滤器对
的存在时间最短,证明在此条件下生物滤器对![]() 的转化去除能力最强,NOB的活性也最强。李娟英等[36]研究同样发现,在pH为7.5时,
的转化去除能力最强,NOB的活性也最强。李娟英等[36]研究同样发现,在pH为7.5时,![]() 的去除速率最大。
的去除速率最大。
控制并消除养殖水环境中![]() 的积累现象,对于水产养殖至关重要[29]。Kim等[23]研究发现,在温度为10、15 ℃时,生物滤器中
的积累现象,对于水产养殖至关重要[29]。Kim等[23]研究发现,在温度为10、15 ℃时,生物滤器中![]() 的积累量可以忽略不计,温度为20 ℃时,
的积累量可以忽略不计,温度为20 ℃时,![]() 开始积累,温度为25、30 ℃时,
开始积累,温度为25、30 ℃时,![]() 积累的现象十分明显。与Kim等[23]的研究结果不同,本研究中温度为10~30 ℃时,各处理组均存在不同程度的
积累的现象十分明显。与Kim等[23]的研究结果不同,本研究中温度为10~30 ℃时,各处理组均存在不同程度的![]() 积累现象;在温度为10~25 ℃时,
积累现象;在温度为10~25 ℃时,![]() 的最大积累量随温度的升高不断增大。Zhang等[22]在温度为7.2~28.3 ℃时,同样发现生物滤器中
的最大积累量随温度的升高不断增大。Zhang等[22]在温度为7.2~28.3 ℃时,同样发现生物滤器中![]() 的积累量随温度的升高不断增加。另外,本试验中还发现,生物滤器中
的积累量随温度的升高不断增加。另外,本试验中还发现,生物滤器中![]() 的积累量也随pH的升高不断增加。Glass等[37]在pH值为7.5~9.0的条件下同样发现,
的积累量也随pH的升高不断增加。Glass等[37]在pH值为7.5~9.0的条件下同样发现,![]() 的积累量随pH的升高逐渐增加。这是由于随着温度和pH的升高,生物滤器中AOB和NOB的活性发生不同程度的变化,导致
的积累量随pH的升高逐渐增加。这是由于随着温度和pH的升高,生物滤器中AOB和NOB的活性发生不同程度的变化,导致![]() 的净生成速率(单位时间内的生成速率减去去除速率)增加造成的,证明AOB对温度和pH的变化适应能力强于NOB。本试验中在温度为25 ℃、pH为8.5时,
的净生成速率(单位时间内的生成速率减去去除速率)增加造成的,证明AOB对温度和pH的变化适应能力强于NOB。本试验中在温度为25 ℃、pH为8.5时,![]() 的积累现象最严重,AOB与NOB的活性相差最大。
的积累现象最严重,AOB与NOB的活性相差最大。![]() 作为硝化反应的中间产物,其浓度受环境因素的影响容易出现波动,不易控制。循环水养殖过程中,由于生物摄食、排泄量增加等多方面的原因,极易出现
作为硝化反应的中间产物,其浓度受环境因素的影响容易出现波动,不易控制。循环水养殖过程中,由于生物摄食、排泄量增加等多方面的原因,极易出现![]() 积累的现象,通过合理的调控系统中的环境因素能够提高生物滤器的水处理能力,从而缓解并消除
积累的现象,通过合理的调控系统中的环境因素能够提高生物滤器的水处理能力,从而缓解并消除![]() 积累的现象,营造良好的水质环境。
积累的现象,营造良好的水质环境。
(1)温度和pH对曝气生物滤器的硝化性能影响较大。在试验条件(温度为10~30 ℃、pH为7.0~8.5)下,相较于pH值,氨氧化反应、亚硝酸盐氧化反应对温度的变化更加敏感。此外,相较于NOB,AOB对于环境温度、pH的变化适应能力更强。
(2)温度为10~25 ℃时,![]() 的去除速率随着温度的升高不断增加。在温度为25 ℃、pH为7.7时,生物滤器对TAN的去除速率最高,AOB的活性最强;温度为25 ℃、pH为7.5时,生物滤器对
的去除速率随着温度的升高不断增加。在温度为25 ℃、pH为7.7时,生物滤器对TAN的去除速率最高,AOB的活性最强;温度为25 ℃、pH为7.5时,生物滤器对![]() 的去除速率最高,NOB的活性最强。
的去除速率最高,NOB的活性最强。
(3)温度为10~25 ℃、pH为7.0~8.5时,![]() 积累的现象随着温度和pH的升高而不断加剧。生物滤器的硝化功能是硝化细菌共同发挥作用的结果,受环境因素影响较大。因此,适宜的温度及pH值是生物滤器高效稳定运行的保证。
积累的现象随着温度和pH的升高而不断加剧。生物滤器的硝化功能是硝化细菌共同发挥作用的结果,受环境因素影响较大。因此,适宜的温度及pH值是生物滤器高效稳定运行的保证。
[1] 赵越,刘鹰,李贤,等.工业化循环水养殖系统移动床生物膜反应器的设计[J].大连海洋大学学报,2018,33(5):639-643.
[2] 张业韡,吴凡,陈翔,等.基于易控的工业化循环水养殖系统[J].渔业现代化,2017,44(1):21-25.
[3] 张成林,顾川川,曹伟,等.基于循环水养殖系统的罗非鱼养殖效果分析[J].中国农学通报,2017,33(20):144-148.
[4] 刘鹰.封闭循环水养殖-新理念·新技术·新方法[M].北京:现代教育出版社,2009:22-24.
[5] 王媛,刘述锡.海水养殖对海岛生态系统脆弱性影响评估初探[J].大连海洋大学学报,2017,32(3):349-355.
[6] 张桐雨,唐选盼,李洪武,等.小球藻和双眉藻对虾塘养殖废水氮、磷的去除效果[J].广东农业科学,2013,40(18):169-171,185.
[7] 张海耿,张宇雷,张业韡,等.循环水养殖系统中流化床水处理性能及硝化动力学分析[J].环境工程学报,2014,8(11):4743-4751.
[8] 吴迪.MBBR在国内的工程应用与发展前景[J].中国给水排水,2018,34(16):22-31.
[9] 徐建平.几种环境因子对海水生物滤器硝化性能及亚硝酸盐积累的影响研究[D].青岛:青岛理工大学,2018.
[10] 霍保全,景长勇,王红芬.温度对悬浮载体流化床处理效能的影响[J].环境工程,2009,27(2):81-83.
[11] 王淑莹,李论,李凌云,等.快速启动短程硝化过程起始pH值对亚硝酸盐积累的影响[J].北京工业大学学报,2011,37(7):1067-1072.
[12] Randall CW,Buth D.Nitrite build-up in activated sludge resulting from temperature effects[J].J Water Pollut Control Federat,1984,56(9):1039-1044.
[13] Hellinga C,Schellen AAJC,Mulder J W,et al.The sharon process:an innovative method for nitrogen removal from ammonium-rich waste water[J].Water Sci Technol,1998,37(9):135-142.
[14] Alleman J E.Elevated nitrite occurrence in biological wastewater treatment systems[J].Water Sci Technol,1985,17(2-3):409-419.
[15] Anthonisen AC,Loehr RC,Prakasam TBS,et al.Inhibition of nitrification by ammonia and nitrous acid[J].J Water Pollut Control Fed,1976,48(5):835-852.
[16] Zhang Chaosheng,Zhang Shaoqing,Zhang Liqiu,et al.Effects of constant pH and unsteady pH at different free ammonia concentrations on shortcut nitrification for landfill leachate treatment[J].Appl Microbiol Biotechnol,2015,99(8):3707-3713.
[17] 罗荣强,侯沙沙,沈加正,等.海水生物滤器氨氮沿程转化规律模型[J].环境科学,2012,33(9):3189-3196.
[18] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB17378.4-2007 海洋监测规范第4部分:海水分析[S].北京:中国标准出版社,2008.
[19] 杨志强,朱建新,刘慧,等.环境因子对循环水养殖系统中生物膜净化效率影响综述[J].渔业现代化,2014,41(6):14-17,27.
[20] 鲍鹰,相建海.温度、盐度和pH对生物过滤器去除氨氮效率的影响[J].海洋科学,2001,25(6):42-43.
[21] 李迎全.曝气生物滤池运行过程中影响因素的研究[D].长春:吉林大学,2012.
[22] Zhang Shuangfu,Wang Yayi,He Weitao,et al.Impacts of temperature and nitrifying community on nitrification kinetics in a moving-bed biofilm reactor treating polluted raw water[J].Chem Eng J,2014,236:242-250.
[23] Kim J H,Guo Xuejun,Park H S.Comparison study of the effects of temperature and free ammonia concentration on nitrification and nitrite accumulation[J].Process Biochem,2008,43(2):154-160.
[24] 王劼,宫艳萍,白莹,等.BAF去除氨氮关键影响因素研究[J].环境科学与技术,2012,35(5):147-151.
[25] Balmelle B,Nguyen K M,Capdeville B,et al.Study of factors controlling nitrite build-up in biological processes for water nitrification[J].Water Sci Technol,1992,26(5-6):1017-1025.
[26] Yoo H,Ahn K H,Lee H J,et al.Nitrogen removal from synthetic wastewater by simultaneous nitrification and denitrification(SND) via nitrite in an intermittently-aerated reactor[J].Water Res,1999,33(1):145-154.
[27] 杨志强,朱建新,刘慧,等.几种环境因子对循环水养殖系统中生物膜净化效率的研究[J].渔业现代化,2015,42(3):17-22.
[28] 张晓丹,宋乾武,代晋国,等.温度及碳源对NPR工艺脱氮除磷效果的影响[J].环境科学研究,2007,20(4):125-129.
[29] Chen Shulin,Ling Jian,Blancheton J P.Nitrification kinetics of biofilm as affected by water quality factors[J].Aquacult Eng,2006,34(3):179-197.
[30] Tao Wendong,He Yuling,Wang Ziyuan,et al.Effects of pH and temperature on coupling nitritation and anammox in biofilters treating dairy wastewater[J].Ecol Eng,2012,47:76-82.
[31] 徐婷,王丽,吴军.不同pH条件下短程硝化序批实验和数学模拟[J].环境工程学报,2016,10(6):2840-2846.
[32] Wang Jianlong,Yang Ning.Partial nitrification under limited dissolved oxygen conditions[J].Process Biochem,2004,39(10):1223-1229.
[33] Bae W,Baek S,Chung J,et al.Optimal operational factors for nitrite accumulation in batch reactors[J].Biodegradation,2001,12(5):359-366.
[34] 李甍,宋协法,孙国祥,等.适宜牡蛎与龙须菜配比提高含氮养殖废水处理效果[J].农业工程学报,2015,31(11):243-248.
[35] Keller J,Yuan Z,Blackall L L.Integrating process engineering and microbiology tools to advance activated sludge wastewater treatment research and development[J].Reviews in Environmental Science and Biotechnology, 2002,1(1):83-97.
[36] 李娟英,赵庆祥.氨氮生物硝化过程影响因素研究[J].中国矿业大学学报,2006,35(1):120-124.
[37] Glass C,Silverstein J A.Denitrification kinetics of high nitrate concentration water:pH effect on inhibition and nitrite accumulation[J].Water Res,1998,32(3):831-839.