脊尾白虾Exopalaemon carinicauda俗称白虾、大白枪虾等,河口性种类,为中国特有种,黄海、东海、南海沿岸水域均有分布,主要分布在10 m水深以内的河口、港湾。春季在河口、港湾捕获量较大,是沿岸、河口区的主要经济虾类之一。脊尾白虾能适应低盐环境,春季当水温上升至11 ℃时开始脱壳生长。该虾生长快、繁殖能力强、营养价值高,是沿海主要养殖品种之一[1],随着脊尾白虾养殖规模不断扩大, 养殖方式也呈多样化,主要有池塘养殖、生态混养等[2]。目前,脊尾白虾已成为池塘单养及与鱼蟹贝类等混养的重要经济虾类。野生和人工养殖的脊尾白虾在营养上存在差别,饵料差异是造成这种差异的重要原因[3]。
n-3及n-6系列高不饱和脂肪酸是虾类正常生长和生存所必需脂肪酸,然而,海洋鱼类和甲壳类缺乏自身合成不饱和脂肪酸的能力[4-5],这些脂肪酸主要是从饵料中获得。因此,饵料中的营养成分直接影响虾肌肉中的脂肪酸组成。而作为生物体必需组成成分的脂肪酸,在生物体新陈代谢过程中比较稳定[6]。由于脂肪酸具有结构多样性,且能从食物链中的较低营养级向较高营养级进行保守传递,食物的脂肪酸信息在捕食者的脂肪酸组成中得以体现,并能够更为准确地在物种水平上反映捕食者在一段时期内的摄食情况[7-8],因此,研究动物的肪酸组成特点具有重要意义。目前,关于脊尾白虾生物学特性、发育、繁殖、养殖等方面已有一些研究[9-16],但关于脊尾白虾体长和脂肪酸含量间关系的研究尚未见报道,关于其食性的报道也较为有限[17-18]。为此,本研究中根据在海州湾采集到的脊尾白虾生物样品,对其脂肪酸组成特点及食性进行了探讨,以期为脊尾白虾的进一步研究和养殖提供理论参考,也为探讨海州湾食物网的能量流动提供基础数据。
1 材料与方法
1.1 材料
于 2017年5月在海州湾海域(34°51.000′~34°58.000′N,119°20.000′~119°34.800′E)用拖网采集脊尾白虾30尾,体长为6.3~9.8 cm,体质量为1.4~5.3 g。根据其体长(L)分为4组:6 cm≤L<7 cm归为6 cm组,7 cm≤L<8 cm归为7 cm组,8 cm≤L<9 cm归为8 cm组,9 cm≤L<10 cm归为9 cm组,各体长组间有显著性差异(P<0.05)。将脊尾白虾冷冻后带回实验室于冰箱(-20 ℃)中保存,待进一步处理。
试验试剂:三氯甲烷、甲醇氯化钠由国药集团提供,37种脂肪酸混标、十九烷酸甲酯标品、三氟化硼甲醇溶液和正己烷均购于上海安谱有限公司。
1.2 方法
将脊尾白虾解冻后去其头部和皮,取其腹部肌肉,用蒸馏水冲洗干净后装入冻存管,然后放入冷冻干燥机(Christ 1-4α),在-55 ℃下冷冻干燥24 h,所有肌肉样品使用混合型球磨仪(Retsch- MM440)粉碎,装入离心管待测。根据Folch法进行粗酯的提取[19]。
依据GB/T 17376—2008《动植物油脂脂肪酸甲酯制备》三氟化硼法进行脂肪酸甲酯化。以37种脂肪酸混标及内标十九烷酸甲酯标品作为标准,利用气相色谱-质谱联用仪(GC-MS 7890B, 美国Agilent)进行测试。采用面积归一法计算脂肪酸含量[20]。
1.3 数据处理
采用SPSS 17.0软件进行单因素方差分析,采用t检验对饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸之间的显著性进行分析,采用LSD法对不同体长组间脂肪酸含量的显著性进行分析。
2 结果与分析
2.1 生物学信息
本研究中所采用的脊尾白虾平均体长为(7.9±1.0)cm,平均体质量为(2.9±0.1)g,体长和体质量之间的线性关系式为W=0.991L-4.9436(R2=0.8801,P<0.001) (图1)。
2.2 不同体长脊尾白虾的粗脂肪含量
从表1可见:30尾脊尾白虾的平均粗脂肪含量为10.6%,当脊尾白虾体长为6~7 cm时,粗脂肪含量低于平均值;当脊尾白虾体长为8~9 cm时,粗脂肪含量高于平均值;当脊尾白虾体长为9 cm时,粗脂肪含量最高,平均为13.8%。对脊尾白虾体长与粗脂肪含量间进行方差分析发现,整体上脊尾白虾体长对粗脂肪含量无显著性影响(P>0.05)。对脊尾白虾体质量与粗脂肪含量间进行方差分析发现,整体上脊尾白虾体质量对粗脂肪含量有显著性影响(P=0.034)。
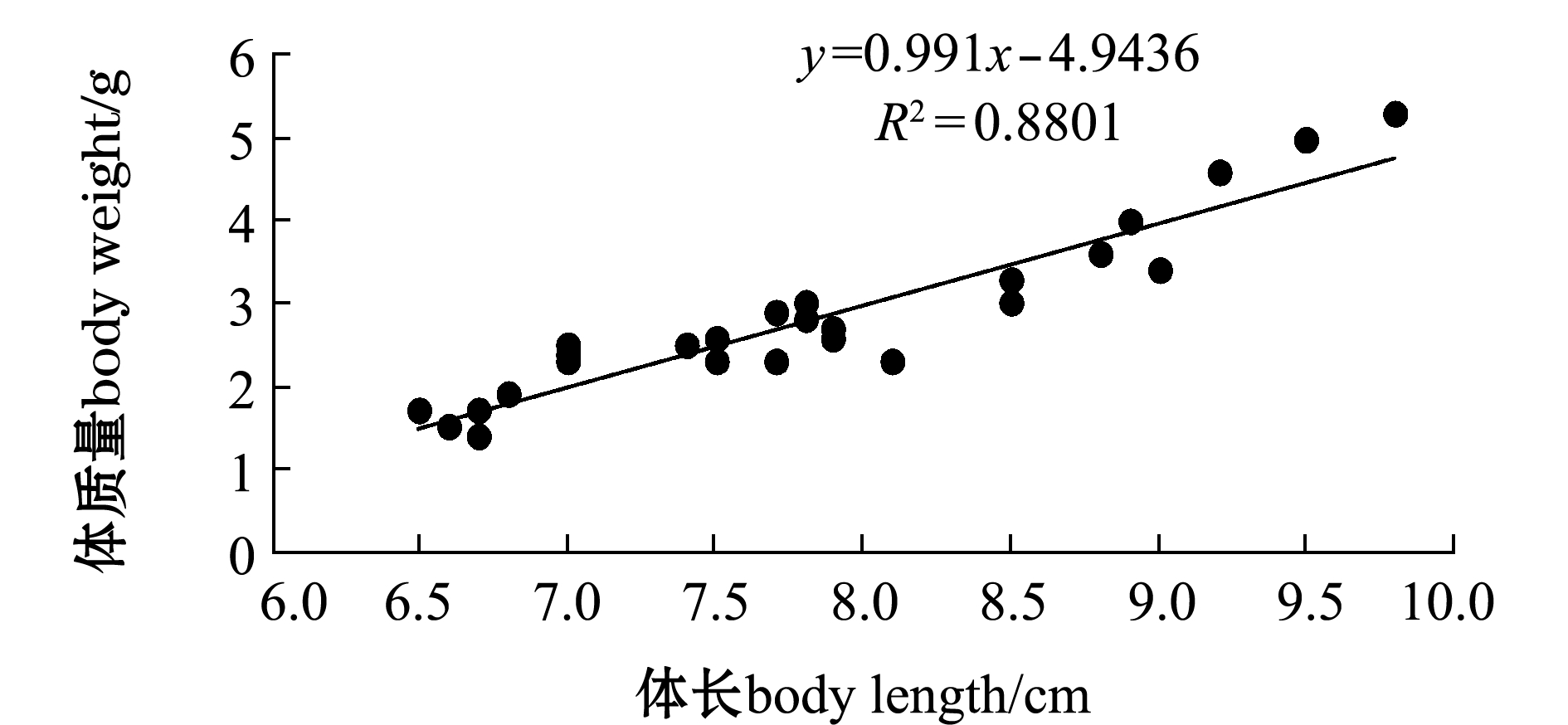
图1 脊尾白虾体长与体质量的关系
Fig.1 Weight-length relationship of ridgetail white prawn Exopalaemon carinicauda
表1 不同体长组脊尾白虾的粗脂肪含量
Tab.1 Crude lipid contents of ridgetail white prawn Exopalaemon carinicauda with different group of body length
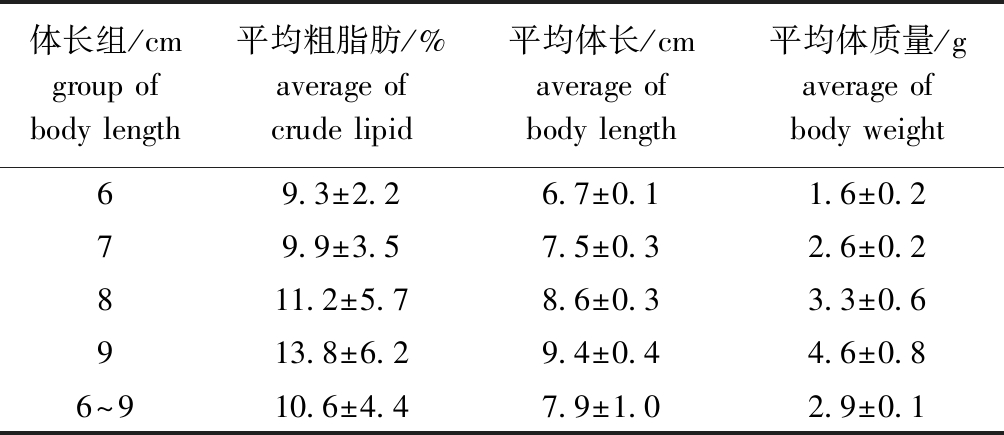
体长组/cmgroup of body length平均粗脂肪/%average of crude lipid平均体长/cmaverage of body length平均体质量/gaverage of body weight69.3±2.26.7±0.11.6±0.279.9±3.57.5±0.32.6±0.2811.2±5.78.6±0.33.3±0.6913.8±6.29.4±0.44.6±0.86~910.6±4.47.9±1.02.9±0.1
将体质量(W)分为1 g组(1.0 g≤W<2.0 g)、2 g组(2.0 g≤W<3.0 g)、3 g组(3.0 g≤W<4.0 g)、4 g组(4.0 g≤W<5.0 g)、5 g组(5.0 g≤W<6.0 g),通过对脊尾白虾不同体质量组间的显著性分析发现,1 g组、2 g组、3 g组均与5 g组有显著性差异(P=0.008,P=0.005,P=0.005),3 g组与4 g组也有显著性差异(P=0.047)。
2.3 脂肪酸组成
利用内标标准法对脊尾白虾脂肪酸进行定量分析,得到每种脂肪酸浓度后再计算得到单位干质量脊尾白虾肌肉中每种脂肪酸的含量(mg/g),进一步处理得到每种脂肪酸的相对百分比(%)。
从表2可见:脊尾白虾的主要脂肪酸共有27种,其中,饱和脂肪酸(SFA)有8种,占总脂肪酸含量的33.8%;单不饱和(MUFA)有8种,占20.4%;多不饱和脂肪酸(PUFA)有11种,占45.8%;含量较高的单种脂肪酸有C16:0、C18:0、C18:1n9c、C18:2n6t、C20:5n3、C22:6n3,分别占总脂肪酸含量的11.6%、7.1%、5.8%、6.2%、9.2%、10.2%,这6种脂肪酸共占总脂肪酸含量的50%以上;DHA+EPA含量占总脂肪酸含量的19.4%。PUFA平均含量最高,其次为SFA,MUFA含量最低,经t检验分析发现,三者之间存在显著性差异(P<0.05)。
表2 脊尾白虾肌肉主要脂肪酸组成
Tab.2 Main fatty acid composition of ridgetail white prawn Exopalaemon carinicauda
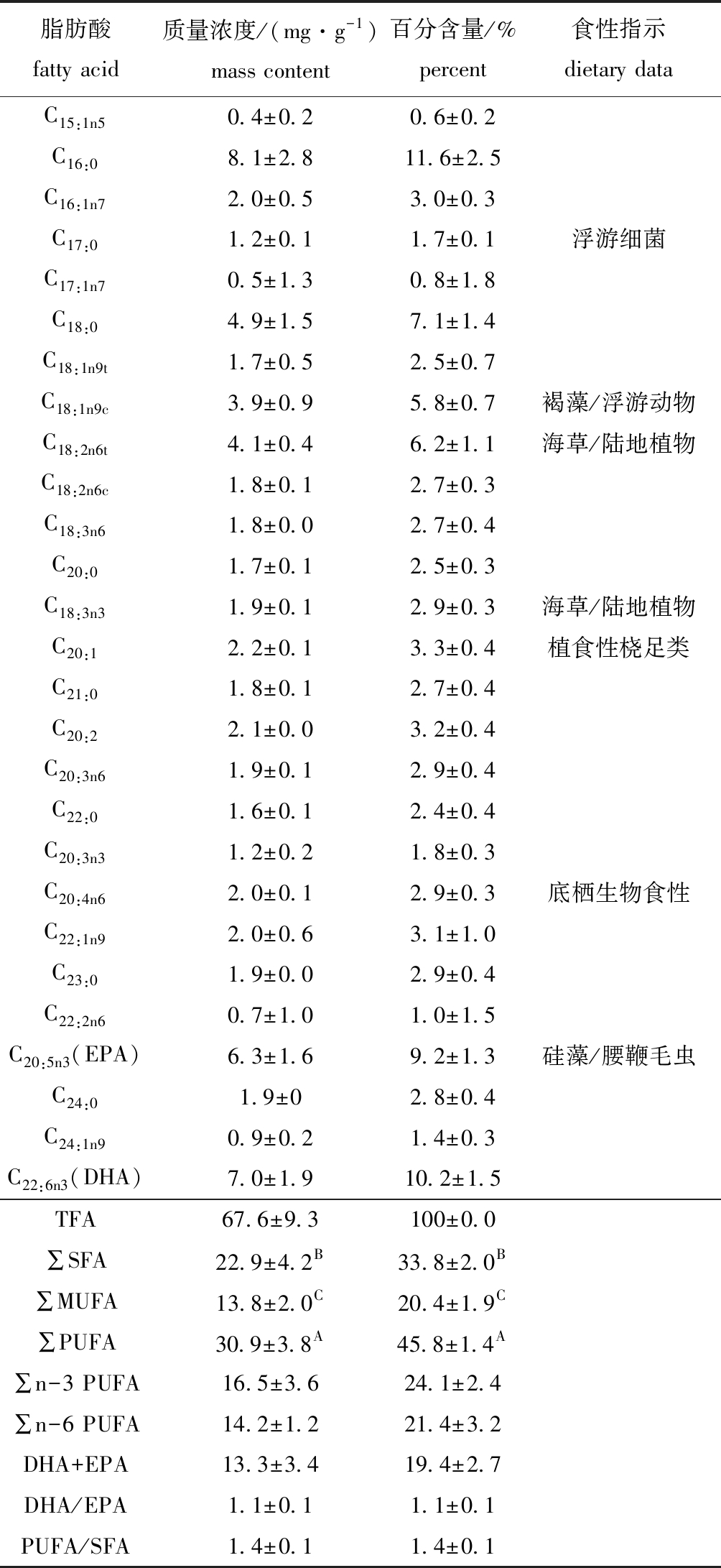
脂肪酸fatty acid质量浓度/(mg·g-1)mass content百分含量/%percent食性指示dietary dataC15:1n50.4±0.20.6±0.2C16:08.1±2.811.6±2.5C16:1n72.0±0.53.0±0.3C17:01.2±0.11.7±0.1浮游细菌C17:1n70.5±1.30.8±1.8C18:04.9±1.57.1±1.4C18:1n9t1.7±0.52.5±0.7C18:1n9c3.9±0.95.8±0.7褐藻/浮游动物C18:2n6t4.1±0.46.2±1.1海草/陆地植物C18:2n6c1.8±0.12.7±0.3C18:3n61.8±0.02.7±0.4C20:01.7±0.12.5±0.3C18:3n31.9±0.12.9±0.3海草/陆地植物C20:12.2±0.13.3±0.4植食性桡足类C21:01.8±0.12.7±0.4C20:22.1±0.03.2±0.4C20:3n61.9±0.12.9±0.4C22:01.6±0.12.4±0.4C20:3n31.2±0.21.8±0.3C20:4n62.0±0.12.9±0.3底栖生物食性C22:1n92.0±0.63.1±1.0C23:01.9±0.02.9±0.4C22:2n60.7±1.01.0±1.5C20:5n3(EPA)6.3±1.69.2±1.3硅藻/腰鞭毛虫C24:01.9±02.8±0.4C24:1n90.9±0.21.4±0.3C22:6n3(DHA)7.0±1.910.2±1.5TFA67.6±9.3100±0.0∑SFA22.9±4.2B33.8±2.0B∑MUFA13.8±2.0C20.4±1.9C∑PUFA30.9±3.8A45.8±1.4A∑n-3 PUFA16.5±3.624.1±2.4∑n-6 PUFA14.2±1.221.4±3.2DHA+EPA13.3±3.419.4±2.7DHA/EPA1.1±0.11.1±0.1PUFA/SFA1.4±0.11.4±0.1
注:TFA为总脂肪酸;SFA为饱和脂肪酸;MUFA为单不饱和脂肪酸;PUFA为多不饱和脂肪酸;同列中标有不同大写字母者或同行中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:TFA, total fatty acid;SFA, saturated fatty acid; MUFA, mono-unsaturated fatty acid; PUFA, poly-unsaturated fatty acid; The means with different capital letters within the same column or with different letters within the same line are significantly different in the groups at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
从表3可见:当脊尾白虾体长为6~8 cm时,随着脊尾白虾体长的增加,总脂肪酸含量呈先增加后减少的趋势,当脊尾白虾生长到8 cm时,其总脂肪酸含量达到最高,为70.8 mg/g,当其生长到9 cm时,总脂肪酸含量呈下降趋势;SFA、MUFA和PUFA、C16:0、C16:1n7、C20:5n3、C22:6n3、n-3PUFA、DHA+EPA含量的变化趋势同总脂肪酸含量一致。从总体上来看,各体长范围内脂肪酸含量均呈现出PUFA>SFA>MUFA,且PUFA含量均显著高于MUFA和SFA(P<0.05)。
3 讨论
3.1 粗脂肪含量随体长的变化
从30尾体长为6~9 cm的脊尾白虾粗脂肪含量结果来看,脊尾白虾体长和粗脂肪含量呈正相关,体长越长,相对应的粗脂肪含量就越高(表1),但在不同的体长范围内,粗脂肪含量增长速率不同。当6 cm≤L<7 cm时,体长平均每增长1 cm,粗脂肪含量平均增加约0.7%;当7 cm≤L<8 cm时,体长平均每增长1 cm,粗脂肪含量增加约1.2%;当8 cm≤L<9 cm时,体长平均每增长1 cm,粗脂肪含量增加约2.6%。可见,脊尾白虾粗脂肪含量随体长的增长而增加,且粗脂肪含量的增长速率随体长的增长也随之增大。
3.2 脂肪酸组成成分分析
本研究中脊尾白虾的脂肪酸种类与邵银文等[3]对野生脊尾白虾的研究有差异,本研究中脊尾白虾C18:0、C20:0、C20:1和C20:2含量略高,而C16:0、C20:5n3和C22:2n6含量略低,相同之处是饱和脂肪酸均以C16:0为主,脂肪酸含量最显著的特点均为不饱和脂肪酸含量显著高于饱和脂肪酸含量。邵银文等[3]的研究中,野生脊尾白虾的体长为7~10 cm,本研究中脊尾白虾的体长范围为6~9 cm,这可能是造成差异的原因之一,另外,生长区域、年龄、生理状况、所摄食物和生态环境因子不同也可能会对脂肪酸组成造成影响[20,22-23]。
Innis等[24]研究表明,不饱和脂肪酸的含量和必需脂肪酸的含量是衡量油脂营养价值高低的两个指标。本研究中脊尾白虾不饱和脂肪酸含量达66.2%(20.4%+45.8%),与中国对虾(66.2%)相当,高于南极磷虾Euphausia superba(52.76%)、安士白虾Euphausia annandalei(30.84%)和日本沼虾Macrobrachium nipponensis(57.54%)[25],略低于中华绒螯蟹 Eriocheir sinensis (73.68%)[26]、雄虾蛄(74.1%)和雌虾蛄(71.5%)[27],而n-3和n-6系列高不饱和肪酸含量共占总脂肪酸含量的45.5%,可见,脊尾白虾营养丰富,这也是其成为重要经济种和养殖品种的原因之一。
表3 不同体长组脊尾白虾脂肪酸含量
Tab.3 Main fatty acid contents of ridgetail white prawn Exopalaemon carinicauda with different body lengthmg/g

脂肪酸fatty acid体长body length/cm678 9C15:1n50.5±0.00.4±0.20.5±0.00.4±0.2C16:07.5±2.38.0±3.18.9±2.87.7±3.3C16:1n71.7±0.32.0±0.52.2±0.52.1±0.4C17:01.1±0.11.2±0.11.2±0.11.1±0.1C17:1n70.3±0.70.8±1.80.5±0.80.0±0.0C18:04.8±1.04.6±1.75.5±1.24.7±1.9C18:1n9t1.6±0.01.8±0.81.6±0.01.6±0.0C18:1n9c3.3±0.7a3.9±0.8b4.2±0.9c4.4±1.3dC18:2n6t4.2±0.14.0±0.74.2±0.04.2±0.0C18:2n6c1.8±0.11.8±0.11.8±0.11.8±0.1C18:3n61.8±0.01.8±0.01.8±0.01.8±0.0C20:01.7±0.01.7±0.11.7±0.01.7±0.0C18:3n31.9±0.12.0±0.11.9±0.01.9±0.1C20:12.2±0.02.2±0.12.2±0.02.2±0.0C21:01.8±0.01.8±0.11.8±0.01.8±0.0C20:22.1±0.02.1±0.12.1±0.02.1±0.0C20:3n61.9±0.01.9±0.11.9±0.01.9±0.0C22:01.6±0.01.6±0.21.6±0.01.6±0.0C20:3n31.1±0.11.2±0.31.2±0.11.1±0.1C20:4n61.9±0.22.0±0.22.0±0.12.0±0.1C22:1n92.2±0.01.8±0.92.2±0.02.2±0.0C23:01.9±0.01.9±0.01.9±0.01.9±0.0C22:2n60.4±0.90.5±0.91.0±1.11.0±1.2C20:5n3(EPA)5.7±1.96.4±1.86.5±1.26.3±1.6C24:01.9±0.01.9±0.01.9±0.01.9±0.0C24:1n91.0±0.01.0±0.00.8±0.41.0±0.0C22:6n3(DHA)6.5±2.17.0±1.87.7±1.96.7±2.1TFA64.4±7.167.4±10.070.8±8.967.3±12.1∑SFA22.3±3.5B22.7±4.6B24.4±4.1B22.4±5.3B∑MUFA12.7±0.4C13.9±2.5C14.2±1.6C13.9±1.8C∑PUFA29.4±3.3A30.8±3.9A32.3±3.4A31.0±5.1A∑n-3PUFA15.2±4.016.7±3.817.4±3.216.1±3.7∑n-6PUFA14.0±0.813.9±1.414.7±1.214.7±1.4DHA+EPA12.2±4.013.5±3.614.2±3.113.0±3.6DHA/EPA1.1±0.11.1±0.11.2±0.11.0±0.1PUFA/SFA1.3±0.11.4±0.11.3±0.11.4±0.1
3.3 脂肪酸组成与体长、体质量的关系
本研究中通过建立脊尾白虾各脂肪酸含量和体长间的相关关系发现,除C20:3n6、C18:3n6、C22:0、C18:2n6c、C17:1n7、DHA/EPA、C24:1n9、C15:1n5、C24:0 等与体长呈负相关外,其余脂肪酸与体长呈正相关,仅C18:1n9c与体长呈显著正相关关系(P<0.05)。
以体长(x)为自变量,以C18:1n9c含量为因变量(y)建立线性回归方程,即 y=0.433x+0.4851(P<0.05)。以体质量(x)为自变量,以C18:1n9c含量为因变量(y)建立回归方程发现,C18:1n9c与体质量的回归方程为y=0.4773x+4.4144(P<0.05)。这表明,C18:1n9c含量与体长、体质量呈显著正相关。
3.4 基于特征脂肪酸的食性分析
(1)细菌食性。脂肪酸作为生物体的重要组成成分在能量传递过程中比较稳定,故特征脂肪酸可以反映捕食者一段时期内的摄食情况[6,8,28]。众多研究中指出,C15:0、C17:0是食物网中浮游细菌的特征脂肪酸,指示捕食者对浮游细菌的摄食[29]。本研究中发现,脊尾白虾脂肪酸成分中有少量的C17:0,说明浮游细菌对脊尾白虾能量来源有一定的贡献,但是脊尾白虾其体内的C15:0、C17:0更有可能来自悬浮颗粒附着细菌或摄入的碎屑物质。在海州湾海域中悬浮颗粒物潜在碳源对消费者的贡献比例为8.4%[30],也说明了这一点。C16:0在脊尾白虾的脂肪酸含量中较高,但是C16:0是一种普遍存在的、有机体可以自身合成的脂肪酸,甚至其丰富度因物种而异,因此,很难给出具体的被捕食者的信息[31]。
(2)硅藻食性。C16:1n7、C20:5n3不能由生物体自身合成,众多研究者认为,C16:1n7、C20:5n3可以指示硅藻,硅藻是浮游动物、鱼虾类等水生生物所喜欢的食物,而且C20:5n3还可以指示腰鞭毛虫[32-35]。本研究中C16:1n7占脊尾白虾总脂肪酸含量的3.0%,说明其对硅藻有摄食。这可能是因为,海州湾海域的浮游植物种类以硅藻门为主,在生物量和浮游植物种类上都超过其他门类,为消费者提供了丰富的饵料,这与基于同位素技术研究得出的海州湾浮游植物对消费者有很高的贡献率一致[36]。
(3)浮游动物食性。浮游动物是海水中重要的生物类群,其种类多、分布广、繁殖力强、世代交替周期短,是游泳动物的饵料来源。在海州湾已经鉴定到的浮游动物种类有50种,从种类组成来看,优势种主要有强壮箭虫Sagittacrassa、中华哲水蚤Calanus sinicus、小拟哲水蚤Paracalanus parvus等。中华哲水蚤主要摄食浮游细菌、浮游植物、植食性桡足类[37],箭虫主要摄食浮游细菌、浮游植物、桡足类[37-38]。C20:1和C22:1可以指示植食性桡足类[39],本研究中脊尾白虾脂肪酸含量中C20:1占总脂肪酸含量的3.3%,说明脊尾白虾对植食性桡足类有直接或间接的摄食。
(4)陆源食性。C18:2n6+C18:3n3>2.5是陆地植物的标志物[40]。本研究中脊尾白虾脂肪酸含量中C18:2n6+C18:3n3>2.5,说明脊尾白虾的食物中有陆源成分,可能是因为海州湾有绣针河、龙王河、青口河、新沐河、蔷薇河等陆源河流入注带来丰富的饵料[41],其中包括陆地植物碎屑。C18:1n9是大多数海洋生物脂肪酸的主要脂肪酸,可以由C18:0转化而来,在底栖生态系统中被认为是多种食物来源,例如褐藻、红树林碎屑,在海洋生态系统中,被认为是肉食性的标志[31,42]。本研究中脊尾白虾的C18:1n9含量较高,说明脊尾白虾具有肉食性。
(5)底栖食性。底栖动物种类丰富,主要优势种有毛蚶Scapharca subcrenata、口虾蛄Squilla orarotia等[41]。C20:4n6可以由双壳类和甲壳类选择性的保留在体内或者自身合成[40,43-44],可以指示底栖食性。本研究中脊尾白虾C20:4n6占总脂肪酸含量的2.9%,说明其具有底栖食性,摄食甲壳类和双壳类、底栖虾类,以及其他无脊椎动物幼体和富含n-3及n-6系列高度不饱和脂肪酸的藻类。据1980—1983年的调查及有关文献记载,海州湾及其岛屿周围有84种固着性藻类,隶属5门57属。
综上所述,脊尾白虾具有底栖食性,摄食硅藻、甲壳、双壳类、陆源营养是其能量来源的一部分,具有杂食性。
[1] 宋海棠,俞存根,薛利建,等.东海经济虾蟹类[M].北京:海洋出版社,2006.
[2] 王兴强,曹梅,阎斌伦,等.脊尾白虾养殖技术研究[J].水产科技情报,2008,35(6):265-269.
[3] 邵银文,王春琳,励迪平,等.脊尾白虾自然群体与养殖群体的营养差异[J].水利渔业,2008,28(4):34-37.
[4] Colvin P M.The effect of selected seed oils on the fatty acid composition and growth of Penaeus indicus[J].Aquaculture,1976,8(1):81-89.
[5] Kanazawa A,Teshima S I,カナザワ ア,et al.Biosynthesis of fatty acids from acetate in the prawn,Penaeus japonicus[J].Memoirs of Faculty of Fisheries Kagoshima University,1977,26:49-53.
[6] 王娜.脂肪酸等生物标志物在海洋食物网研究中的应用——以长江口毗邻海域为例[D].上海:华东师范大学,2008.
[7] Dalsgaard J,John M S,Kattner G,et al.Fatty acid trophic markers in the pelagic marine environment[J].Advances in Marine Biology,2003,46:225-340.
[8] Stübing D,Hagen W.Fatty acid biomarker ratios—suitable trophic indicators in Antarctic euphausiids?[J].Polar Biology,2003,26(12):774-782.
[9] Zhang Chengsong,Li Fuhua,Xiang Jianhai.Effect of salinity on growth and first sexual maturity of Exopalaemon carinicauda (Holthuis,1950)[J].Chinese Journal of Oceanology and Limnology,2014,32(1):65-70.
[10] Zhang Chengsong,Li Zhiguo,Li Fuhua,et al.Effects of starvation on survival,growth and development of Exopalaemon carinicauda larvae[J].Aquaculture Research,2015,46(9):2289-2299.
[11] 施永海,张根玉,刘建忠,等.不同月份出生的脊尾白虾之生长及生殖特性[J].水产科技情报,2009,36(3):131-136.
[12] 梁象秋,李亚娟,周昭曼.脊尾白虾的幼体发育[J].水产学报,1988,12(2):157-168.
[13] 李志敏.脊尾白虾繁殖生物学研究[D].大连:大连海洋大学,2015.
[14] 梁俊平,李健,刘萍,等.脊尾白虾生物学特性与人工繁育的研究进展[J].中国农学通报,2012,28(17):109-116.
[15] 武文魁.脊尾白虾幼体发育的研究[J].海洋学报,1983(S1):953-964.
[16] 张成松,李富花,相建海.脊尾白虾形态性状对体质量影响的通径分析[J].水产学报,2013,37(6):809-815.
[17] 李明德.天津脊尾白虾Palaemon (Exopalaemon) carincauda Holthuis个体生态[J].现代渔业信息,2005,20(10):10,13.
[18] 王兴强,阎斌伦,马甡,等.脊尾白虾生物学及养殖生态学研究进展[J].齐鲁渔业,2005,22(8):21-23.
[19] Folch J,Lees M,Sloane Stanley G H.A simple method for the isolation and purification of total lipides from animal tissues[J].Journal of Biological Chemistry,1957,226(1):497-509.
[20] 杨清源,王少琴,朱国平,等.西南大西洋拉氏南美南极鱼脂肪酸组成及其食性研究[J].大连海洋大学学报,2017,32(1):86-92.
[21] 易翠平,钟春梅.鳡鱼的脂肪含量测定及脂肪酸成分分析[J].食品科学,2013,34(14):255-258.
[22] Ota T,Takagi T.A comparative study on the lipid class composition and the fatty acid composition of sweet smelt,Plecoglossus altivelis,from marine and fresh-water habitat[J].Bulletin of the Faculty of Fisheries Hokkaido University,1977,28(1):47-56.
[23] Stickney R R,Andrews J W.Effects of dietary lipids on growth,food conversion,lipid and fatty acid composition of channel catfish[J].Journal of Nutrition,1972,102(2):249-257.
[24] Innis S M.The role of dietary n-6 and n-3 fatty acids in the developing brain[J].Developmental Neuroscience,2000,22(5-6):474-480.
[25] 庄平,宋超,章龙珍.长江口安氏白虾与日本沼虾营养成分比较[J].动物学报,2008,54(5):822-829.
[26] Chen Dewei,Zhang Min,Shrestha S.Compositional characteristics and nutritional quality of Chinese mitten crab (Eriocheir sinensis)[J].Food Chemistry,2007,103(4):1343-1349.
[27] 张强,荆剂荣,刘雪梅.虾蛄脂肪酸分析[J].分析化学,2002,30(12):1473-1476.
[28] Rajendran N,Suwa Y,Urushigawa Y.Distribution of phospholipid ester-linked fatty acid biomarkers for bacteria in the sediment of Ise Bay,Japan[J].Marine Chemistry,1993,42(1):39-56.
[29] 谢斌,李云凯,张虎,等.基于稳定同位素技术的海州湾海洋牧场食物网基础及营养结构的季节性变化[J].应用生态学报,2017,28(7):2292-2298.
[30] Ga⊇l Le Croizier G S.Trophic ecology in uence on metal bioaccumulation in marine
uence on metal bioaccumulation in marine  sh inference from stable isotope and fatty acid analyses[J].Science of the Total Environment,2016,573:83-95.
sh inference from stable isotope and fatty acid analyses[J].Science of the Total Environment,2016,573:83-95.
[31] 李荷芳,周汉秋.海洋微藻脂肪酸组成的比较研究[J].海洋与湖沼,1999,30(1):34-40.
[32] 李春颖,仇雪梅.海洋微藻脂肪酸组成的研究进展[J].生物技术通报,2008(4):63-65.
[33] Richoux N B,Froneman P W.Trophic ecology of dominant zooplankton and macrofauna in a temperate,oligotrophic South African estuary:a fatty acid approach[J].Marine Ecology Progress,2008,357:121-137.
[34] Stowasser G,Pond D W,Collins M A.Using fatty acid analysis to elucidate the feeding habits of Southern Ocean mesopelagic fish[J].Marine Biology,2009,156(11):2289-2302.
[35] 谢斌.应用稳定同位素技术研究海州湾主要生物种类的营养结构[D].上海:上海海洋大学,2017.
[36] Tönnesson K,Tiselius P.Diet of the chaetognaths Sagitta setosa and S.elegans in relation to prey abundance and vertical distribution[J].Marine Ecology Progress,2005,289:177-190.
[37] 杨纪明,李军.渤海强壮箭虫摄食的初步研究[J].海洋科学,1995,19(6):38-42.
[38] Parrish C C.Determination of total lipid,lipid classes,and fatty acids in aquatic samples[M]//Arts M T,Wainman B C.Lipids in Freshwater Ecosystems.New York:Springer,1999.
[39] Budge S M,Parrish C C,Mckenzie C H.Fatty acid composition of phytoplankton,settling particulate matter and sediments at a sheltered bivalve aquaculture site[J].Marine Chemistry,2001,76(4):285-303.
[40] 朱孔文,孙满昌,张硕,等.海州湾海洋牧场:人工鱼礁建设[M].北京:中国农业出版社,2011.
[41] Kelly J R,Scheibling R E.Fatty acids as dietary tracers in benthic food webs[J].Marine Ecology Progress,2012,446:1-22.
[42] Cook E J,Bell M V,Black K D,et al.Fatty acid compositions of gonadal material and diets of the sea urchin,Psammechinus miliaris:trophic and nutritional implications[J].Journal of Experimental Marine Biology and Ecology,2000,255(2):261-274.
[43] Soudant P,Moal J,Marty Y,et al.Impact of the quality of dietary fatty acids on metabolism and the composition of polar lipid classes in female gonads of Pecten maximus (L.)[J].Journal of Experimental Marine Biology and Ecology,1996,205(1-2):149-163.
[44] Kelly J R,Scheibling R E,Iverson S J.Fatty acids tracers for native and invasive macroalgae in an experimental food web[J].Marine Ecology Progress,2009,391:53-63.