单环刺螠Urechis unicinctus隶属于螠虫动物门Echiura、螠纲Echiurida、无管螠目Xenopneusta、 刺螠科Urechidae、刺螠属Urechis, 是中国黄渤海沿岸潮间带和潮下带常见的底栖生物, 俗称海肠、海肠子[1-2]。单环刺螠浑身是宝, 具有较高的食用、药用和研究价值, 被称为“裸体海参”[3]。
水产品保鲜运输是水产养殖产业链中的重要一环,关系着养殖的成败及销售的价值。生产销售过程中,耐干露的品种多采用干运,但不同温度、不同水产动物规格下其耐受时间不同,需要分别研究。单环刺螠耐干露能力较强,7 ℃下经常淋水可耐受72 h不死亡[4],干运下亲体运输不超过28 h,这与其体表能分泌黏液,可保持机体水分有关[5]。但前期的许多研究中未表明所研究单环刺螠的规格大小,干露条件也较单一,亟待深入探索。单环刺螠体表黏液的主要成分为多糖[6]和蛋白质[7],其黏液分泌量及多糖和蛋白质含量在不同温度、不同规格和湿沙条件下是否随干露时间而变化也是研究的关键。水产动物的黏液除具有湿润皮肤及保护自身防止病害侵袭的作用外,多具有抗菌性[8-12]。单环刺螠的黏液是否具有抗菌性尚未见报道。近年来,过度捕捞和环境污染严重破坏了单环刺螠的自然资源,导致其采捕量急剧下降,价格一路飙升,单环刺螠极具养殖开发前景。随着人工育苗关键技术的突破[13], 其人工养殖势在必行,而苗种幼螠的运输问题成为首要解决的问题。本研究中,通过研究单环刺螠幼螠在不同温度、不同湿沙干露条件下的耐受性、体表黏液分泌量及多糖与蛋白质含量的变化,以及体表黏液对9种常见水产动物病原菌的抑菌性, 以期为开展单环刺螠的养殖与运输提供参考, 也为推动单环刺螠人工养殖的规模化和产业化奠定基础。
1 材料与方法
1.1 材料
试验用单环刺螠幼螠购自蓬莱海长生物技术有限公司,收缩状态下平均体长为3.50 cm,平均体质量为2.75 g(离水后,自然排掉直肠和肛门囊中积水),体质健康,规格基本整齐。试验前将单环刺螠放在塑料箱内暂养一周,正常投饵、充氧气、换水,使其适应小水体环境。正式试验时所用单环刺螠体长、体质量等因素基本相同。
试验用水以海水晶配制(盐度为30),试验用沙为烟台东泊子海域细沙(粒径为0.3 mm),使用前经过充分清洗和曝晒。
试验仪器:分光光度计(TU-1810,北京普析通用仪器有限责任公司)、离心机(TDL-50B,上海安亭科学仪器厂)、电子天平(FA1004N电子天平,上海精密科学仪器有限公司)、恒温培养箱(DPX-150,上海飞越实验仪器有限公司)。
试验试剂及药品:总蛋白(TP)测定试剂盒、乙醇、浓硫酸、盐酸和蒸馏水;NaCl、(NH4)2SO4粉末、纯氢氧化钠、标准葡聚糖、苯酚、15%与3%的TCA。
1.2 方法
1.2.1 黏液的采集 采用黏液沙离心管提取法,取单环刺螠身体表面及周围黏液黏附的细沙,让其带有少量的水分,在超速离心机下以3000 r/min离心15 min,将上层黏液收集至10 mL离心管中,储存于-4 ℃下保存备用。
1.2.2 不同条件下单环刺螠黏液量随干露时间的变化 设置15、20、25、30 ℃ 4个温度组,每个温度组设2个重复,使用16个500 mL的烧杯,每个烧杯放入10只单环刺螠,营造出湿沙有水和湿沙无水两种环境,每种环境8个烧杯。在1、10、30、60、90 min干露时间点分别用塑料勺收集黏液及黏液沙于离心管中,再用离心机离心。
不同温度条件的设置:根据李诺等[1]提出单环刺螠的适温范围为8~26 ℃,7 ℃下已有研究[4],而运输幼螠时正值高温期,运输水温度达28 ℃,故本研究中设置15、20、25、30 ℃ 4个温度区间可以研究较高温度的影响。由于实验室温度为25 ℃左右,测得养殖海水的温度为25 ℃,利用恒温培养箱使其温度保持在15、20、25、30 ℃。
湿沙无水和湿沙有水条件的设置:沙子提前用海水浸泡,倒掉多余的海水。湿沙无水是仅用一定量的湿沙,而湿沙有水则是添加了仅能淹没过单环刺螠身体的一层海水。
1.2.3 黏液中多糖的测定 采用苯酚-硫酸法,准确称取标准葡聚糖40 mg于1000 mL容量瓶中,加水至刻度,分别吸取0.2、0.4、0.6、0.8、1.0、1.2 mL,各以蒸馏水补至4.0 mL,然后加入6%苯酚2.0 mL及浓硫酸10.0 mL,摇匀冷却,沸水浴显色15 min后于490 nm下测定光密度值,以4.0 mL水按同样显色操作为空白,横坐标为多糖含量(μg/mL),纵坐标为光密度值,制作标准曲线。
黏液样品中多糖含量的测定:取不同干露时间(1、10、30、60、90 min)点的黏液1 g,加入3 mL 15% TCA溶液,再加入少许5%TCA溶液,总溶液不超出10 mL,向比色管中加入4 mL 6 mol/L 盐酸后摇匀,在96 ℃水浴锅中水浴2 h,用流水冷却后加入4 mL 6 mol/L 氢氧化钠摇匀,定容至50 mL的容量瓶中。吸取0.4 mL的样品液,以蒸馏补至4.0 mL,然后加入6%苯酚2.0 mL及浓硫酸10.0 mL,摇匀冷却后室温下放置20 min,于490 nm下测定光密度值,重复测定3次。以标准曲线计算多糖含量。
1.2.4 黏液中蛋白质含量的测定 采用总蛋白(TP)测定试剂盒(双缩脲法),干露时间分别设置为1、10、30、60、90 min。按照使用说明书分别设置空白管、标准管及对应不同干露时间的样品管共7只管。充分混合后,在37 ℃下水浴6 min后上机测定(波长为546 nm),将试剂空白调零,测定标准管和样品管的吸光度值。按照下列公式进行计算:
C样=A样/A标×C标。
其中:C样、C标分别为样品管和标准管中蛋白质的浓度(mg/mL);A样、A标分别为样品管和标准管的吸光度值。
1.2.5 黏液的抗菌性测定 采用抑菌圈法,将9种测试菌分别涂于平板上,然后在平板中央处用移液管滴上定量的黏液,培养一段时间等待菌落长出后观察抑菌圈直径的大小。测试菌包括金黄色葡萄球菌Staphylococcus aureus、灿烂弧菌Vibrio splendidus、奇艺变形杆菌Bacillus mirabilis、产气肠杆菌Enterobacter aerogenes、阴沟肠杆菌Aerobacter cloacae、哈维氏弧菌Vibrio harveyi、副溶血弧菌Vibrio parahaemolyticus、鳗弧菌Vibrio anguillarum和藤黄微球菌Micrococcus luteus。
2 结果与分析
2.1 不同条件下单环刺螠干露耐受性和黏液量的变化
不同温度的湿沙无水和湿沙有水条件下,单环刺螠体表黏液量随干露时间的变化如图1-A、B所示,其中,15 ℃时湿沙无水和湿沙有水条件下,分别在1 min(3.33 mL±0.05 mL)和10 min时(2.85 mL±0.04 mL)黏液量较多,随干露时间的延长黏液量整体呈下降趋势,湿沙无水型黏液量多于湿沙有水黏液量。
不同温度的湿沙有水和湿沙无水条件下,单环刺螠存活率随干露时间的变化如图1-C、D所示,其中存活率随温度的升高呈下降趋势。30 ℃时,湿沙无水组单环刺螠从30 min(存活率83.33%)、湿沙有水从10 min(存活率96.67%)后开始出现死亡现象,直到90 min时全部死亡;15、20 ℃时湿沙无水和湿沙有水组至90 min时均无死亡;25 ℃时湿沙无水和湿沙有水组 60 min时出现死亡,死亡率均为98.33%。90 min后继续观察试验组的存活情况,结果显示,15、20 ℃时湿沙无水组大多数单环刺螠存活时间可达到48 h,而湿沙有水组大多数单环刺螠存活时间可达到36 h,而25℃湿沙无水组至36 h时全部死亡,25 ℃湿沙有水组至30 h全部死亡。这表明15、20 ℃条件下,湿沙无水型较湿沙有水型干露单环刺螠耐受性强,单环刺螠对于高温干露的耐受性较差,湿沙能够延长其存活率,但有水环境会缩短其耐受时间。
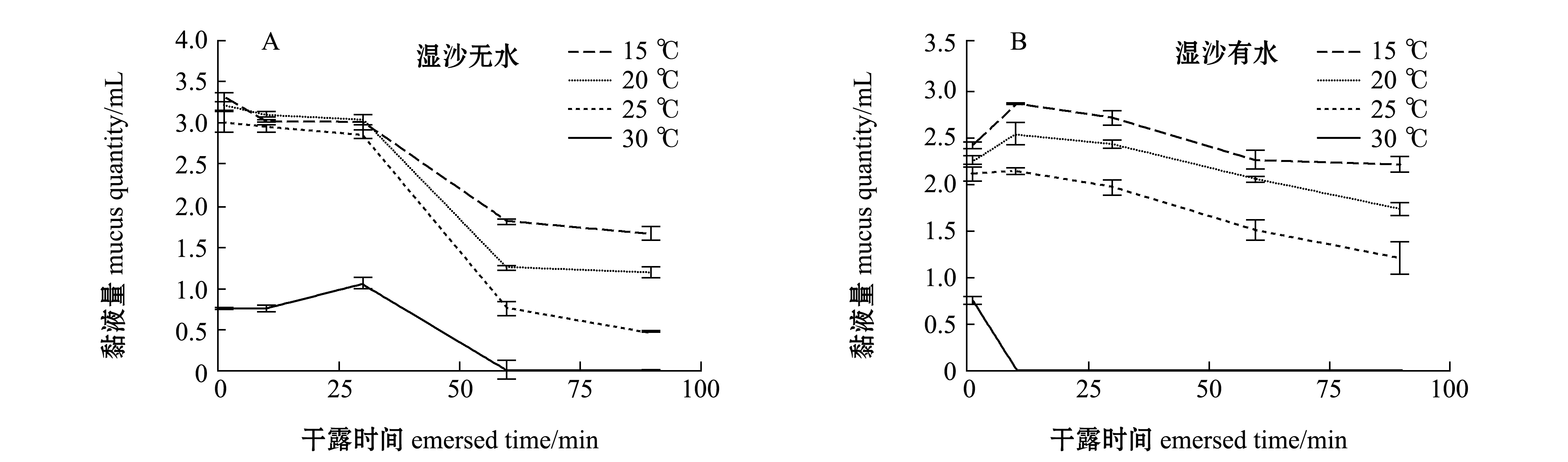

图1 不同温度湿沙无水和湿沙有水条件下单环刺螠体表黏液分泌量和存活率随干露时间的变化
Fig.1 Variations in mucus secretion and survival rate of echiuran worm Urechis unicinctus in wet sand without water and with water at different temperatures
2.2 黏液中多糖含量的变化
标准曲线测定结果略,其线性范围为0~1.2 μg/mL,线性方程为
y=0.3391x+0.0733(R2=0.9862)。
室温25 ℃时,湿沙无水条件下黏液中多糖含量随干露时间的变化如图2所示,多糖含量随干露时间的延长呈先升高后降低的趋势,在30 min时达到最大值(1.04 μg/mL±0.10 μg/mL)。
2.3 黏液中蛋白质含量的变化
室温25 ℃时,湿沙无水条件下黏液中蛋白质含量随干露时间的变化如图3所示,黏液中的蛋白质含量同多糖含量一样随干露时间的延长呈先升高后降低的变化趋势,在30 min时达到最大值(65.81±2.22)mg/mL,但在30 min前开始阶段蛋白质含量增幅较大,而多糖含量则增幅较小。

图2 湿沙无水条件下黏液中多糖含量随干露时间的变化
Fig.2 Variation in polysaccharide contents in mucus of echiuran worm Urechis unicinctus in wet sand without water with emersed time
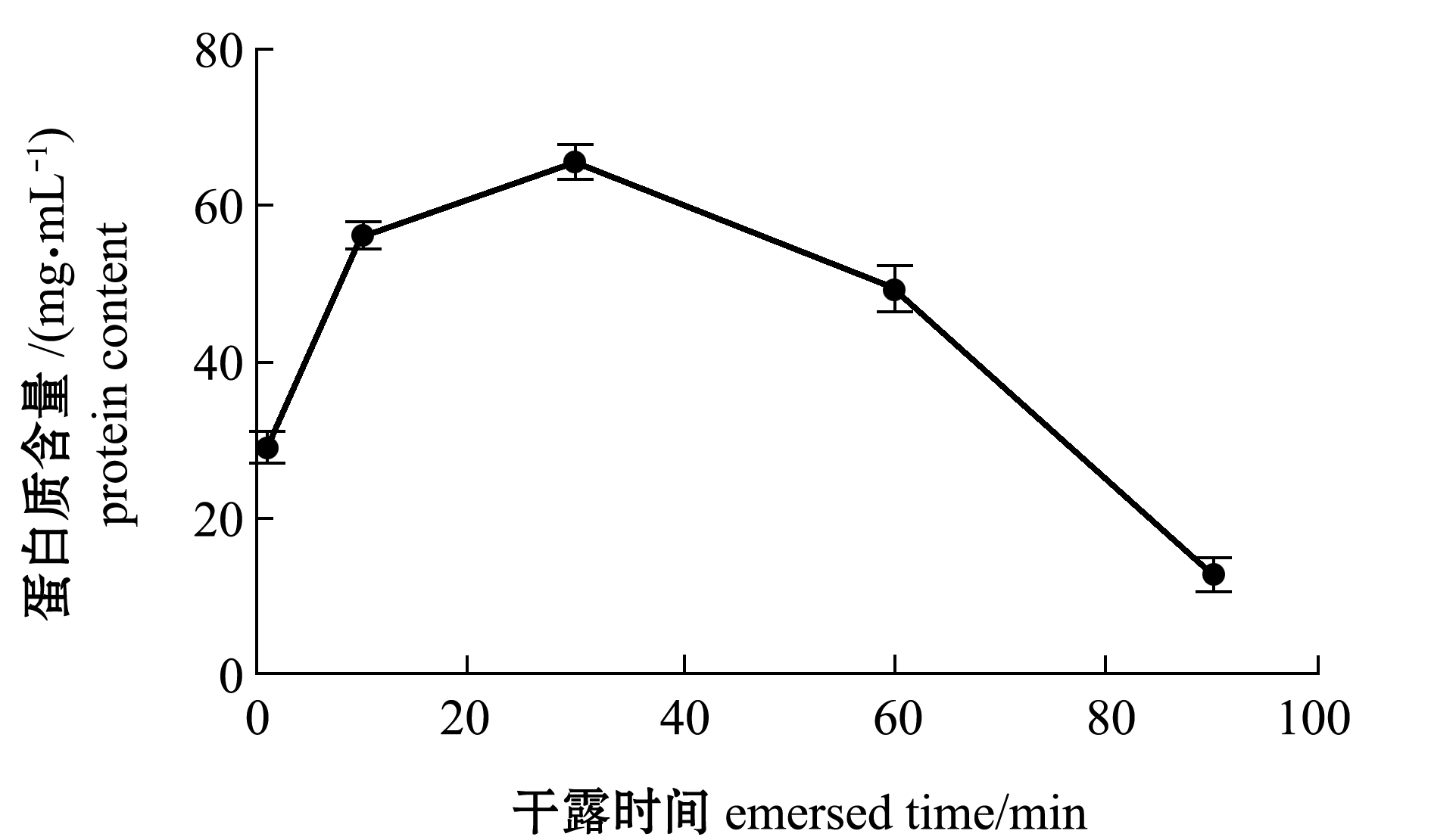
图3 湿沙无水条件下黏液中蛋白质含量随干露时间的变化
Fig.3 Variation in protein content in mucus of echiuran worm Urechis unicinctus in wet sand without water with emersed time
2.4 单环刺螠黏液的抗菌性
单环刺螠黏液对9种常见水产动物病原菌的抑菌性结果如图4所示,单环刺螠黏液对金黄色葡萄球菌Staphylococcus aureus、灿烂弧菌Vibriosplendidus、奇艺变形杆菌Bacillus mirabilis、产气肠杆菌Enterobacter aerogenes、阴沟肠杆菌Aerobacter cloacae、哈维氏弧菌Vibrio harveyi、副溶血弧菌Vibrio parahaemolyticus、鳗弧菌Vibrio anguillarum、藤黄微球菌Micrococcus luteus的抑菌圈直径均小于10 mm,均无抗菌性。
2.5 黏液采集过程中的排脏现象
在试验过程中,随着干露时间的延长,记录单环刺螠形态变化时发现一个特殊现象,部分单环刺螠会出现特殊的排脏现象(图5),但并不普遍,仅有一两个会发生这种现象,出现在干露后期。出现这种现象的单环刺螠无一例外均会死亡。单环刺螠在死亡前体壁蠕动缓慢或不动,出现异常,触动后有微弱收缩,体腔液集中于躯干前半部,躯干明显收缩僵硬,有些出现排脏现象。身体发白不动,触碰无反应,这可能是在采集黏液过程中损伤所致。此现象目前未见在单环刺螠上报道。

注:A为金黄色葡萄球菌; B为灿烂弧菌; C为奇艺变形杆菌;D为产气肠杆菌; E为阴沟肠杆菌; F哈维氏弧菌; G为副溶血弧菌; H为鳗弧菌; I为藤黄微球菌
Note:A,Staphylococcus aureus; B,Vibrio splendidus; C,Bacillus mirabilis;D,Enterobacter aerogenes; E,Aerobacter cloacae; F,Vibrio harveyi; G,Vibrio parahaemolyticus; H,Vibrio anguillarum; I,Micrococcus luteus
图4 单环刺螠黏液的抗菌特性
Fig.4 Antimicrobial properties of mucus from echiuran worm Urechis unicinctus
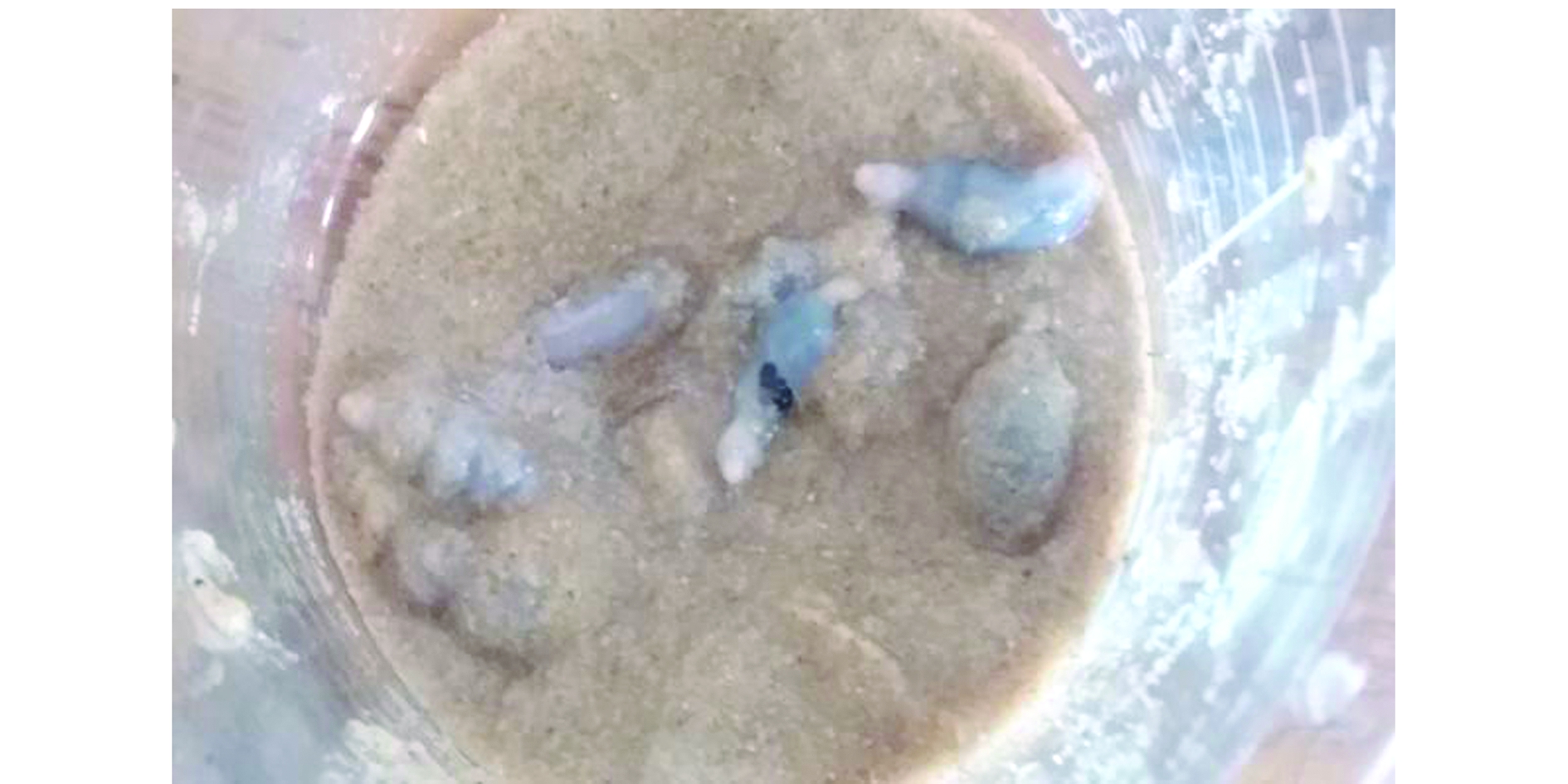
图5 单环刺螠的排脏现象
Fig.5 Phenomenon of evisceration from echiuran worm Urechis unicinctus
3 讨论
3.1 黏液的保存及干露时间间隔的设置
收集的黏液需要及时保存以避免温度过高而引起变质。本试验过程正处于7月份,外界温度较高,借鉴其他动物黏液的保存方法[14-16],离心后取上清液,放入冰箱恒温区(约4 ℃)保存,24 h内使用,或者于-20 ℃下冷冻保存,用时取出,室温解冻后使用,但时间不宜过长,两三天内使用最佳,否则黏液的活性会受到损害。
李诺等[4]研究表明,单环刺螠体壁含有发达的腺细胞,可以分泌黏液以保持体表湿润,在温度为7 ℃、相对湿度为69.7%下,干露时间可持续72 h。结合本试验过程中所用单环刺螠的个体为3 cm左右且质量较小,故在正式试验前首先进行了预试验,以观察所用单环刺螠的干露时间。在试验温度为24 ℃、相对湿度为51.2%下,干露时间可持续12 h,预试验中观察,在不同时间段刮取黏液时发现,90 min左右时黏液量产生甚少,因此,将时间设置为1、10、30、60、90 min 共5个时间段。
3.2 温度对黏液分泌量及干露耐受性的影响
单环刺螠在15 ℃时黏液分泌量最多,湿沙无水组达0.327 mL/只(图1-A、图1-B),在耐受温度范围内,分泌量随测试温度的升高而逐渐减少。单环刺螠在湿沙无水和湿沙有水条件下存活率随温度升高呈下降趋势(图1-C、图1-D),在所知的文献中未见湿沙无水和湿沙有水条件下是否不同的研究。与大多数鱼、贝类相比,单环刺螠在适宜温度下耐受时间较长(表1),15 ℃时单环刺螠在湿沙无水条件下干露耐受达48 h,属耐受能力较强的种类。
表1 水产动物耐干露的比较
Tab.1 Comparison of air exposure tolerance of aquatic animals reported in the literature
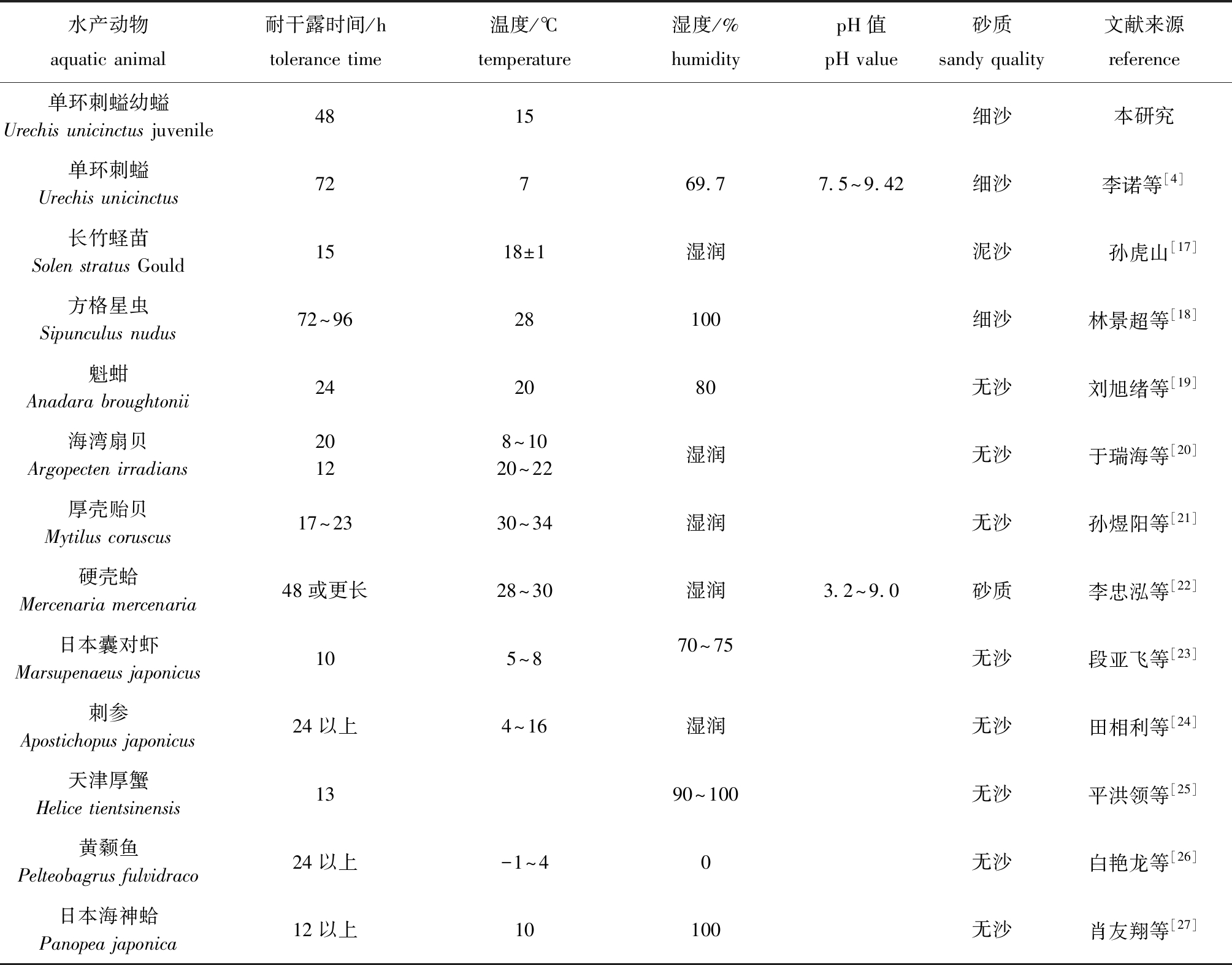
水产动物aquatic animal耐干露时间/htolerance time温度/℃temperature湿度/%humiditypH值pH value砂质sandy quality文献来源reference单环刺螠幼螠Urechis unicinctus juvenile4815细沙本研究单环刺螠Urechis unicinctus72769.77.5~9.42细沙李诺等[4]长竹蛏苗Solen stratus Gould1518±1湿润泥沙 孙虎山[17]方格星虫Sipunculus nudus72~9628100细沙林景超等[18]魁蚶Anadara broughtonii242080无沙刘旭绪等[19]海湾扇贝Argopecten irradians20128~1020~22湿润无沙于瑞海等[20]厚壳贻贝Mytilus coruscus17~2330~34湿润无沙孙煜阳等[21]硬壳蛤Mercenaria mercenaria48或更长28~30湿润3.2~9.0砂质李忠泓等[22]日本囊对虾Marsupenaeus japonicus105~870~75无沙段亚飞等[23]刺参Apostichopus japonicus24以上4~16湿润无沙田相利等[24]天津厚蟹Helice tientsinensis1390~100无沙平洪领等[25]黄颡鱼Pelteobagrus fulvidraco24以上-1~40无沙白艳龙等[26]日本海神蛤Panopea japonica12以上10100无沙肖友翔等[27]
注:表中条件为最适条件
Note:The optimal conditions are shown in the table
3.3 湿沙无水和湿沙有水对黏液分泌量及干露耐受性的影响
无论从黏液分泌量还是存活率上分析(图1),湿沙无水型要比湿沙有水型对单环刺螠的干露耐受性有利,故在运输过程中若采用塑料袋充氧水运时应降低温度。 Zhang等[28]研究表明,单环刺螠成螠已完全实施无水无沙干运,实现了技术上的突破。因此,借鉴此种技术进行了干运和湿沙干运的模拟试验,结果表明,仅针对此种体长为2~3 cm的幼螠,个体表面带有少量湿沙的存活率更高。考虑到要事先将单环刺螠从沙中挖出,分离单环刺螠和沙时易造成机械损伤,所以若直接将单环刺螠和沙一起运输时宜将水控干载运,且单环刺螠和沙一起运输能提高单环刺螠的载运密度,但缺点是增加了沙的载重,且未能准确计数苗种幼螠。基于上述情况仅针对本研究中的幼螠,建议运载量小且短途运输时采用湿沙干运,根据原池放养孔数状态及附着时分苗和日常工作记录等信息估算苗种幼螠数量。
3.4 黏液成分及其抗菌性
单环刺螠的黏液成分与许多水生生物相同,如鱼类[29]和泥鳅Pimelometopon pulchrum[30]等,均主要由蛋白质和多糖组成。本研究中,在湿沙无水干露条件下,多糖和蛋白质均呈现非线性变化,且值得注意的是,在30 min时检测所取黏液成分中二者均最多(图2、图3),说明此时刻机体分泌黏液以保护自身抵抗外来不良条件(本试验中则为干露)的效应最为强烈。黏液成分只是在蛋白质和多糖的种类上稍有差异。这里未能检测具体种类,对于总蛋白质含量单环刺螠(30 min时为65.81 mg/mL)比黄鳝Monopterus albus体表黏液含量(2.593 mg/mL)[31]高很多,而多糖含量则无较大差别。
水产动物黏液多具抗菌性,例如,松江鲈鱼Trachidermus fasciatus的表皮黏液对嗜水气单胞菌、表皮葡萄球菌等6种水产动物病原菌具有抗菌性[32];黄鳝皮肤黏液对嗜水气单胞菌、金黄色葡萄球菌、枯草芽孢杆菌有较强的抑菌作用[33];星斑川鲽Platichthys stellatus黏液提取物具有抗鳗弧菌、溶藻弧菌、副溶血弧菌和爱德华氏菌的活性[34]。本试验中单环刺螠黏液对水产动物常见的9种病原菌均无抗菌性(图4),对其他未检测病原菌是否有抗性有待进一步研究。
[1] 李诺,宋淑莲,唐永政.单环刺螠[J].生物学通报,1998,33(8):12-14.
[2] 刘峰,孙涛,纪元,等.单环刺螠生物学及生态学研究进展[J].海洋科学,2017,41(10):125-131.
[3] 杨桂文,安利国,孙忠军.单环刺螠营养成分分析[J].海洋科学,1999(6):13-14.
[4] 李诺,宋淑莲,唐永政,等.单环刺螠增养殖生物学的研究[J].齐鲁渔业,1998,15(1):11-14.
[5] 王力勇,胡丽萍,赵强,等.单环刺螠亲体运输及暂养技术研究[J].中国水产,2017(4):93-94.
[6] 杨玉品.单环刺螠(Urechis unicinctus)多糖的分离纯化和结构研究[D].青岛:中国海洋大学,2011:1-76.
[7] 李诺,宋淑莲,唐永政,等.单环刺螠体壁氨基酸组分与含量的分析[J].齐鲁渔业,2000,17(5):26-27.
[8] 张婷,史晋绒,宋柯,等.鱼类体表黏液分泌机制·组分与功能研究进展[J].安徽农业科学,2014,42(22):7445-7448,7458.
[9] Shephard K L.Functions for fish mucus[J].Reviews in Fish Biology and Fisheries,1994,4(4):401-429.
[10] Yuan Chunying,Liu Ping,Han Xu,et al.Hypoglycemic effects of glycosaminoglycan from Urechis unicinctus in diabetic mice[J].Journal of Medicinal Food,2015,18(2):190-194.
[11] Zamzow J,Losey G S.Ultraviolet radiation absorbance by coral reef fish mucus:photo-protection and visual communication[J].Environmental Biology of Fishes,2002,63(1):41-47.
[12] 潘高,刘念,许云,等.泥鳅黏液防生物污损作用研究[J].淡水渔业,2014,44(1):98-101.
[13] 许星鸿,霍伟,孟宵,等.单环刺螠人工育苗及养殖技术[J].科学养鱼,2016(2):53-55.
[14] Hidu H,Chapman S,Mook W.Overwintering American oyster seed by cold humid air storage[J].Journal of Shellfish Research,1988,7(1):47-50.
[15] Seaman M N L.Survival and aspects of metabolism in oysters,Crassostrea gigas,during and after prolonged air storage[J].Aquaculture,1991,93(4):389-395.
[16] Hemmerich S.Glycomics:coming of age across the globe[J].Drug Discovery Today,2005,10(5):307-309.
[17] 孙虎山.长竹蛏苗的潜沙及耐干露能力研究[J].烟台师范学院学报:自然科学版,1992,8(1-2):67-69,73.
[18] 林景超,刘旭佳,沈夏霜,等.方格星虫中培苗对温度、盐度和干露的耐受性试验[J].水产科学,2016,35(3):267-271.
[19] 刘旭绪,张秀梅,覃乐政,等.干露时长及温度对魁蚶幼贝潜沙行为及呼吸代谢的影响[J].中国海洋大学学报:自然科学版,2017,47(3):19-26.
[20] 于瑞海,辛荣,赵强,等.海湾扇贝不同发育阶段耐干露的研究[J].海洋科学,2007,31(6):6-9.
[21] 孙煜阳,童巧琼,王文,等.厚壳贻贝在不同温度下的干露耐受性研究[J].生物学杂志,2017,34(4):42-46.
[22] 李忠泓,王国栋.硬壳蛤稚贝对淡水浸泡、干露和低温的耐受能力[J].水产科学,2004,23(6):14-16.
[23] 段亚飞,董宏标,王芸,等.干露胁迫对日本囊对虾抗氧化酶活性的影响[J].南方水产科学,2015,11(4):102-108.
[24] 田相利,何瑞鹏,钱圆,等.干露胁迫对刺参体壁非特异性免疫的影响[J].河北渔业,2014(7):21-26,35.
[25] 平洪领,李玉全.干露对天津厚蟹水分代谢和死亡率的影响[J].湖北农业科学,2014,53(18):4377-4380.
[26] 白艳龙,谭昭仪,邸向乾,等.黄颡鱼无水保活技术研究[J].食品工业科技,2013,34(1):334-337.
[27] 肖友翔,霍忠明,张学开,等.干露对日本海神蛤稚贝生长和存活的影响[J].大连海洋大学学报,2016,31(5):482-487.
[28] Zhang Yongjun,Zhang Xiaoshuan,Nga M T T,et al.Development and evaluation of key ambient factors online monitoring system in live Urechis unicinctus transportation strategies[J].Computers and Electronics in Agriculture,2018,145:43-52.
[29] Winn H E.Formation of a mucous envelope at night by parrot fishes[J].Zoologica,1955(40):145-148.
[30] Wiley J W.Observations on the use of mucus envelopes by the California sheephead,Pimelometopon pulchrum,on Southern California rock reefs[J].Copeia,1974,1974(3):789-790.
[31] 尹绍武,周工健,刘筠.黄鳝血清和体表粘液蛋白的比较研究[J].激光生物学报,2003,12(2):128-131.
[32] 邱进,潘连德,张帅.松江鲈鱼体表黏液抑菌效果研究[J].生物技术通报,2014(9):195-200.
[33] 李联泰,安贤惠,胡江,等.黄鳝皮肤黏液抗菌肽的分离纯化及其部分特性研究[J].渔业科学进展,2011,32(2):27-33.
[34] 郑风荣,徐宗军,张永强,等.星斑川鲽免疫相关组织抗菌活性的研究[J].中国渔业质量与标准,2015,5(3):63-69.