大鳞副泥鳅Paramisgurnus dabryanus隶属于鲤形目Cypriniformes、鳅科Cobitidae、副泥鳅属Paramisgurnus,主要分布于长江中、下游及其附属水体中[1]。其具有生长速度快、适应能力强等优点[2],肉质鲜美、营养丰富[3],是一种优质的淡水养殖品种。近年来,随着市场需求量逐年上升,人工养殖规模不断扩大,泥鳅病害已成为制约规模化养殖生产的重要因素之一。
化学与抗生素药物虽然对防治病害起到一定作用,但同时也带来了药物残留、免疫力下降、环境污染等不容忽视的毒副作用[4-5]。近年来,中草药因其资源丰富、效果显著、加工方便、毒副作用小等优点,受到研究者的广泛关注[6]。已有研究表明,板蓝根Radix isatidis、大黄Chinese rhubarb、大青叶Folium isatidis、黄芪Astragalus membranaceus、黄柏Phellodendron amurense Rupr.、甘草Glycyrrhiza uralensis和五倍子Galla chinensis等具有抗病毒、抗氧化、抑制细菌、提高机体免疫力等作用[7-11]。目前,有关中草药在草鱼Ctenopharyngodon idellus[12]、真鲷Pagrosomus major[13]、施氏鲟Acipenser schrenckii[14]、克氏原螯虾Procambarus clarkii[15]等养殖中的作用已有研究,但在大鳞副泥鳅养殖应用中尚未见报道。本研究中,通过在基础饲料添加4种复方中草药,考察了其对试验鱼的生长性能、营养成分、组织消化酶和免疫因子活性的影响,以期为中草药在大鳞副泥鳅养殖中的应用提供数据资料。
1 材料与方法
1.1 材料
试验用大鳞副泥鳅购自山东省临沂市水产养殖场;中草药购自山东省药材有限公司,粉碎过80目筛后,于冰箱(-20 ℃)中保存备用;酶测定试剂盒购自南京建成生物工程研究所。
1.2 方法
1.2.1 试验设计 将泥鳅驯养15 d后开始正式试验。选取规格相近、体表健康、体质量为(8.42±0.13)g的泥鳅幼鱼450尾,随机放养于室内15个水箱(80 cm×80 cm×100 cm)中,每3个水箱为1个试验组,共分5组,分别记为对照组(不添加中草药)、复方Ⅰ(板蓝根、大黄)组、复方Ⅱ(大青叶、大黄)组、复方Ⅲ(黄芪、黄柏)组、复方Ⅳ(甘草、五倍子)组,各组饲料中复方配比均为1∶1,分别投喂对应饲料。将4种复方中草药以质量分数3‰的剂量添加至基础饲料中(表1),并加工成粒径为1.0 mm的沉性颗粒饲料。
试验采用饱食投喂方式,分别于每日8:00和16:00投喂,投喂3 min后捞出残饵,烘干后称重记录。试验期间采用自然光照周期,采样前24 h空腹,试验周期为60 d。试验期间水温为(23.5±1.8)℃,溶氧为(7.60±0.06)mg/L,pH为(7.19±0.01),氨氮浓度为(0.15±0.01) mg/L,亚硝酸盐浓度为(0.04±0.01)mg/L。
表1 基础饲料组成及营养成分(干质量)
Tab.1 Ingredient and approximate composition of the basic diet(dry weight)w/%

项目item成分ingredient含量content鱼粉 fish meal27.0豆粕soybean meal24.0菜籽粕 rapeseed meal10.0次粉 wheat middling22.0基础饲料豆油 soybean oil6.0basic diet小麦麸 wheat bran7.5磷酸二氢钙Ca(H2PO4)21.5预混料 premix1.0蛋氨酸 Met0.5赖氨酸 Lys0.5总计total100水分moisture10.98营养成分粗蛋白 crude protein36.29approximate composition 粗脂肪crude fat8.46粗灰分 crude ash5.78
1.2.2 生长指标及常规营养成分测定 试验结束后,饥饿24 h记录泥鳅数量与体质量,统计试验周期内饲料投喂总量。从每箱随机取4尾泥鳅,使用麻醉剂MS-222麻醉后处死,分别称重、烘干,待测全鱼体成分;从每箱再随机取4尾泥鳅,分别称量其体长、体质量后,解剖取内脏称重。相关指标计算公式为
增重率WGR=(Wt-W0)/W0×100%,
饲料转化率FCE= (Wt-W0)/F×100%,
特定生长率SGR=(lnWt-lnW0)/t×100%,
脏体指数VSI=Wv/Wt×100%,
肥满度CF=Wt/L3×100%。
其中:Wt和W0分别为试验结束和开始时泥鳅体质量(g);Wv为内脏质量(g);F为摄食量(g),即饱食投喂量-残饵量;t为试验时间(d);L为泥鳅体长(cm)。
1.2.3 组织消化酶测定 试验结束后,从每箱取3尾泥鳅,麻醉后置于冰盘上,解剖取其肠道与肝脏,剔除肠壁脂肪,用去离子水冲洗肠道后于冰箱(-20 ℃)中保存备用。使用试剂盒测定肠道与肝脏中的蛋白酶与脂肪酶活力。胰蛋白酶活性定义为:在pH 8.0、37 ℃条件下,每毫克蛋白中含有的胰蛋白酶每分钟使吸光度变化0.003即为1个酶活力单位。脂肪酶活性单位定义为:在37 ℃条件下,每克组织蛋白在本反应体系中与底物反应1 min,每消耗1 μmol底物为1个酶活性单位。
1.2.4 血清免疫因子活性的测定 从每箱取3尾泥鳅,用注射器从尾静脉采血,于-4 ℃下以3000 r/min冷冻离心10 min,所得血清置于冰箱(-20 ℃)中冷冻备用。用试剂盒测定其总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、碱性磷酸酶(AKP)活性和丙二醛(MDA)含量。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,采用SPSS 17.0软件进行单因素方差分析,用Duncan法进行多重比较,显著性水平设为0.05。
2 结果与分析
2.1 复方中草药对大鳞副泥鳅生长性能的影响
从表2可见:60 d试验后,各试验组成活率均为100%;复方Ⅰ组与复方Ⅲ组鱼体终末体质量显著高于其他各组(P<0.05),复方Ⅳ组显著低于对照组(P<0.05),复方Ⅱ组与对照组无显著性差异(P>0.05);复方Ⅰ组与复方Ⅲ组增重率、特定生长率均显著高于对照组和其他复方组(P<0.05),复方Ⅱ组和复方Ⅳ组与对照组无显著性差异(P>0.05);复方Ⅰ组饲料转化率除与复方Ⅲ组无显著性差异(P>0.05)外,均显著高于对照组和其他复方组(P<0.05);各复方组肥满度与对照组无显著性差异(P>0.05);各复方组泥鳅脏体指数均低于对照组,但无显著性差异(P>0.05)。
表2 复方中草药对大鳞副泥鳅生长性能的影响
Tab.2 Effect of compound Chinese herb medicines on growth performance of loach Paramisgurnus dabryanus
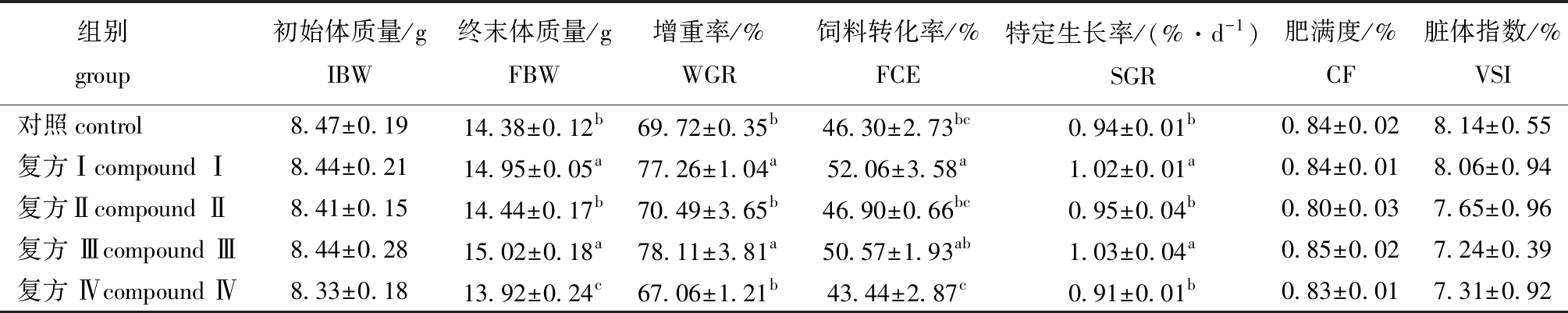
组别 group 初始体质量/gIBW终末体质量/gFBW增重率/%WGR饲料转化率/%FCE特定生长率/(%·d-1)SGR肥满度/%CF脏体指数/%VSI对照control 8.47±0.1914.38±0.12b69.72±0.35b46.30±2.73bc0.94±0.01b0.84±0.028.14±0.55复方Ⅰcompound Ⅰ8.44±0.2114.95±0.05a77.26±1.04a52.06±3.58a1.02±0.01a0.84±0.018.06±0.94复方Ⅱcompound Ⅱ8.41±0.1514.44±0.17b70.49±3.65b46.90±0.66bc0.95±0.04b0.80±0.037.65±0.96复方 Ⅲcompound Ⅲ8.44±0.2815.02±0.18a78.11±3.81a50.57±1.93ab1.03±0.04a0.85±0.027.24±0.39复方 Ⅳcompound Ⅳ8.33±0.1813.92±0.24c67.06±1.21b43.44±2.87c0.91±0.01b0.83±0.017.31±0.92
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
2.2 复方中草药对大鳞副泥鳅体成分的影响
从表3可见:4种复方中草药对大鳞副泥鳅全鱼中粗灰分含量无显著性影响(P>0.05);各中草药添加组水分含量均低于对照组,但各组间无显著性差异(P>0.05);复方Ⅰ组、复方Ⅱ组、复方Ⅳ组中粗蛋白质含量均高于对照组,但无显著性差异(P>0.05);复方Ⅰ组、复方Ⅱ组与复方Ⅲ组粗脂肪含量均显著高于对照组(P<0.05),复方Ⅳ组粗脂肪含量低于对照组(P>0.05)。
表3 复方中草药对大鳞副泥鳅全鱼营养成分的影响(干质量)
Tab.3 Effect of compound Chinese herb medicines on the whole body composition of loach Paramisgurnus dabryanus(dry weight)w/%
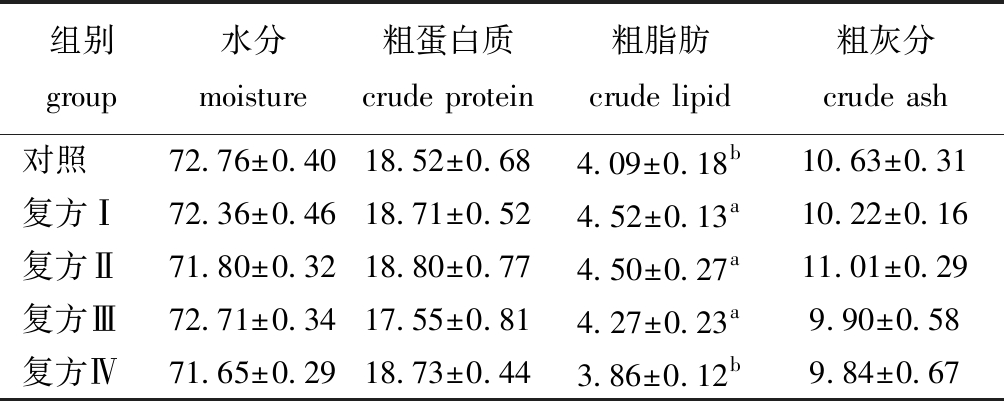
组别group水分moisture粗蛋白质crude protein粗脂肪crude lipid粗灰分crude ash对照72.76±0.4018.52±0.684.09±0.18b10.63±0.31复方Ⅰ72.36±0.4618.71±0.524.52±0.13a10.22±0.16复方Ⅱ71.80±0.3218.80±0.774.50±0.27a11.01±0.29复方Ⅲ72.71±0.3417.55±0.814.27±0.23a9.90±0.58复方Ⅳ 71.65±0.2918.73±0.443.86±0.12b9.84±0.67
2.3 复方中草药对大鳞副泥鳅消化酶的影响
从图1可见:大鳞副泥鳅肝胰腺中胰蛋白酶活力以复方Ⅲ组最高 (P<0.05),其余复方组肝胰腺胰蛋白酶活力与对照组无显著性差异(P>0.05);对照组肠道中胰蛋白酶活力显著低于复方组(P<0.05),复方Ⅰ组、复方Ⅱ组、复方Ⅲ组肠道酶活力无显著性差异(P>0.05),均显著高于复方Ⅳ组(P<0.05)。

注:标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母表示组间无显著性差异(P>0.05),下同
Note:The means with different letters in different tissues in the same time are significantly different at the 0.05 probability level,and the means with the same letters are not significant difference,et sequentia
图1 复方中草药对大鳞副泥鳅胰蛋白酶的影响
Fig.1 Effect of Chinese herb medicines on specific activity of trypsin in loach Paramisgurnus dabryanus
从图2可见:大鳞副泥鳅肝胰腺与肠道中脂肪酶活力均以复方Ⅲ组最高(P<0.05);复方Ⅰ组、复方Ⅱ组、复方Ⅳ组中肝胰腺和肠道脂肪酶活力均高于对照组,但仅复方Ⅱ组肠道脂肪酶活力与对照组有显著性差异(P<0.05)。大鳞副泥鳅肠道中胰蛋白酶与脂肪酶活力均高于肝胰腺中酶活力。
2.4 复方中草药对大鳞副泥鳅抗氧化能力的影响
从表4可见:复方Ⅰ组与复方Ⅲ组大鳞副泥鳅血清中T-AOC活力显著高于对照组(P<0.05),复方Ⅳ组显著低于其他组(P<0.05);复方Ⅰ组、复方Ⅱ组和复方Ⅲ组SOD活力均显著高于对照组(P<0.05),以复方Ⅲ组SOD活力最高(P<0.05);复方Ⅳ组与对照组AKP活力均显著低于其他复方组(P<0.05);对照组MDA含量显著高于其他复方组(P<0.05)。
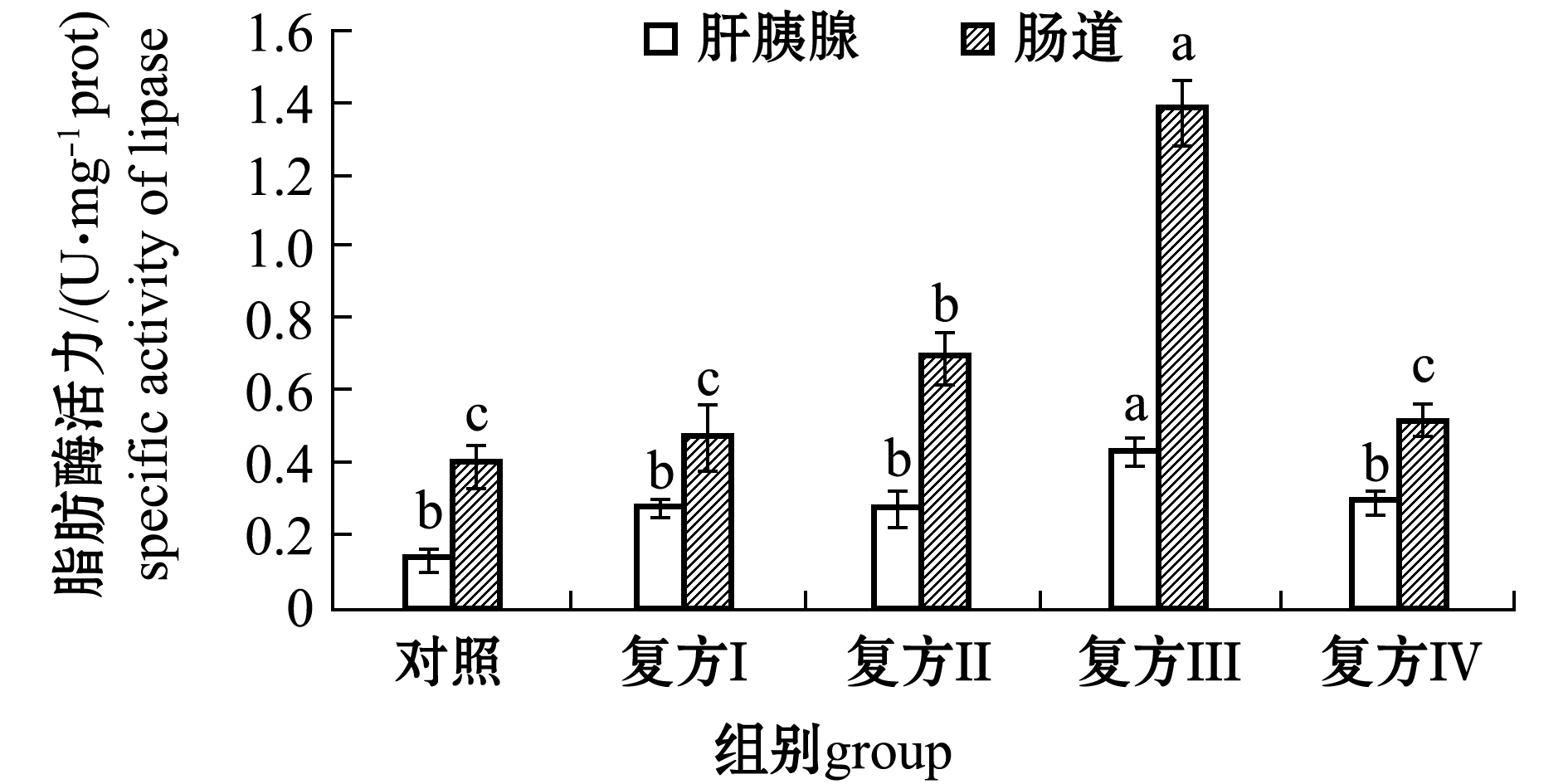
图2 复方中草药对大鳞副泥鳅脂肪酶的影响
Fig.2 Effect of Chinese herb medicines on specific activity of lipase in loach Paramisgurnus dabryanus
表4 复方中草药对大鳞副泥鳅血清中几种酶活性和丙二醛含量的影响
Tab.4 Effect of compound Chinese herb medicines on T-AOC, activities of SOD and AKP and MDA level in serum of loach Paramisgurnus dabryanus

组别group总抗氧化能力/(U·mL-1)T-AOC超氧化物歧化酶/(U·mL-1)SOD碱性磷酸酶/(U·mL-1)AKP丙二醛/(nmol·mL-1)MDA对照4.08±0.31b11.83±0.74d1.24±0.07b25.83±0.06a复方Ⅰ6.41±0.20a25.29±0.89b1.50±0.06a24.33±0.79b复方Ⅱ3.45±0.24c17.83±0.58c1.64±0.07a21.27±1.36b复方Ⅲ5.85±0.26a33.92±1.72a1.59±0.07a23.16±1.18bc复方Ⅳ2.40±0.19d13.73±1.56d1.21±0.07b21.15±1.46c
3 讨论
3.1 复方中草药对大鳞副泥鳅生长的影响
中草药中含有多种营养与生理活性物质,能有效促进机体代谢和蛋白质合成,提高动物的饲料利用与营养吸收,进而促进动物生长[16]。黄芪含黄芪多糖、皂苷类、黄酮类、氨基酸和多种微量元素,对机体免疫系统、循环系统等具有调节和保护作用[17]。大黄含有大黄素和大黄酚等蒽醌类衍生物,有保护肝脏、抗菌消毒的功效[18]。板蓝根有效成分为靛苷、棕榈素和氨基酸等,具有清热解毒、抑制细菌等功效[7]。
研究表明,闪光鲟Acipenser stellatus用黄芪饲喂一段时间后,增重率显著提高[19]。在基础饲料中添加少量复方中草药,奥尼罗非鱼Oreochromis niloticus×O.aureus[20]、斜带石斑鱼Epinphelus coioides[21]、黄颡鱼Pelteobagrus fulvidraco Richardson[22]、真鲷[13]的生长与饲料利用率显著高于基础饲料组。本试验中,复方Ⅰ组与复方Ⅲ组鱼体增重率、特定生长率较对照组显著提高,复方Ⅰ组、复方Ⅱ组与复方Ⅲ组饲料转化率均高于对照组。其机理可能是因为各复方组中几种中草药成分相互补充,相辅相成,有助于消化吸收,提高饲料利用,从而促进泥鳅生长。
3.2 复方中草药对大鳞副泥鳅营养成分的影响
鱼类营养价值与鱼肉品质直观体现于机体成分中。若水分含量高,粗蛋白质和粗脂肪含量就低,则鱼品质较差;若水分含量低,粗蛋白质和粗脂肪含量就高,则营养及品质较好[22]。已有研究显示,饲料中添加中草药可以改变部分鱼类的鱼体成分。孔江红[21]研究表明,斜带石斑鱼Epinephelus coioides在摄食含有13种复方中草药饲料42 d后,可以提高鱼体粗蛋白质、粗脂肪和粗灰分含量。邱小琮等[23]研究表明,异育银鲫Carassius auratus gibelio摄食添加山楂和麦芽的饲料后,鱼体粗脂肪含量显著高于对照组。本试验中,各中草药试验组鱼体水分含量均低于对照组,复方Ⅰ组、复方Ⅱ组和复方Ⅳ组中粗蛋白质含量高于对照组但不显著,复方Ⅰ组、复方Ⅱ组、复方Ⅲ组粗脂肪含量则显著高于对照组。这说明在本试验条件下,添加中草药在一定程度上可改变大鳞副泥鳅的鱼体成分。
3.3 复方中草药对大鳞副泥鳅相关组织中消化酶的影响
消化酶是由消化腺和消化系统分泌的一种催化机体生化反应的蛋白质[24]。消化酶活力可在一定程度上反映出机体的生长、消化吸收和饲料利用情况[25]。已有研究显示,饲料中添加中草药会影响水产动物的消化酶活力。陈辉辉等[26]研究表明,凡纳滨对虾Litopenaeus vannamei摄食复方中草药饲料28 d后,1.6%添加组肝胰腺中蛋白酶、脂肪酶活力显著高于对照组。何吉祥等[27]研究表明,异育银鲫饲料中添加中草药后,复方Ⅲ组和Ⅳ组肠蛋白酶活力显著高于对照组,脂肪酶活力无显著性差异。本试验中,各复方组泥鳅肠道中胰蛋白酶活力均高于对照组,各复方组泥鳅肝胰腺与肠道中脂肪酶活力均高于对照组。这说明饲料中添加复方中草药,有助于提高大鳞副泥鳅的消化吸收能力,此结果也与本试验中泥鳅的生长情况相符,也与王吉桥等[22]、丁贤等[25]得出的中草药通过影响消化酶的活性来促进水产动物生长的理论相一致。
3.4 复方中草药对大鳞副泥鳅抗氧化能力的影响
生物体的新陈代谢受到刺激时,细胞内会产生过多带有氧化性的自由基,打破原有的动态平衡,破坏机体的防御系统,导致蛋白质变性等一系列损伤[28]。为了抵御自由基的氧化侵害,生物体进化出一套防御系统,即抗氧化酶系统[29]。
SOD是抗氧化系统中的关键酶,是水产动物免疫调节网络的重要组成部分[30]。MDA是机体被自由基氧化后的分解物,其含量可体现机体的过氧化水平,反映组织细胞的受损程度[31]。本试验结果表明,复方Ⅲ组SOD活力最高,复方Ⅰ组、复方Ⅱ组、复方Ⅲ组SOD活力显著高于对照组,各中草药添加组MDA含量均显著低于对照组。这说明复方Ⅰ组、复方Ⅱ组、复方Ⅲ组中的复方中草药(板蓝根、大黄、大青叶、黄芪、黄柏),有助于提高大鳞副泥鳅体内抗氧化能力,降低组织损伤程度,对鱼体存在积极影响。AKP通过参与磷酸基团的转移来调控机体代谢,血清中的AKP主要来源于肝脏[21]。本试验中,复方Ⅰ、复方Ⅱ、复方Ⅲ大鳞副泥鳅摄食饲料后,血清中AKP活力显著高于对照组,此结果与大黄鱼Larimichthys crocea[32]、棕点石斑鱼Epinephelus fuscoguttatus[30]、齐口裂腹鱼Schizothorax prenanti[33]摄食中草药后AKP活力变化结果相似。T-AOC是用于反映机体抗氧化系统清除自由基情况的综合型指标[34]。虹鳟Oncorhynchus mykiss[35]饲料中添加板蓝根与金银花后,血清中T-AOC活性均高于对照组。本试验中,复方Ⅰ组、复方Ⅲ组血清中T-AOC活性显著高于对照组,这表明复方Ⅰ(板蓝根、大黄)、复方Ⅲ(黄芪、黄柏)中草药可提高大鳞副泥鳅抗氧化能力;而复方Ⅱ组、复方Ⅳ组T-AOC活力则低于对照组,推测鳅体可能被中草药毒性成分损伤,也可能是中草药配方与添加浓度所导致,具体原因仍需进一步探讨。
[1] 曾本和,廖增艳,吴双,等.饲料脂肪水平对大鳞副泥鳅幼鱼生长性能、消化酶活性及抗氧化能力的影响[J].动物营养学报,2016,28(4):1105-1113.
[2] 王敏,王卫民,鄢建龙.泥鳅和大鳞副泥鳅年龄与生长的比较研究[J].水利渔业,2001,21(1):7-9.
[3] 赵振山,高贵琴,印杰,等.泥鳅和大鳞副泥鳅营养成分分析[J].水利渔业,1999,19(2):16-17.
[4] Nayak S K.Probiotics and immunity:a fish perspective[J].Fish & Shellfish Immunology,2010,29(1):2-14.
[5] Bricknell I,Dalmo R A.The use of immunostimulants in fish larval aquaculture[J].Fish & Shellfish Immunology,2005,19(5):457-472.
[6] Jian Jichang,Wu Zaohe.Effects of traditional Chinese medicine on nonspecific immunity and disease resistance of large yellow croaker,Pseudosciaena crocea (Richardson)[J].Aquaculture,2003,218(1-4):1-9.
[7] 彭翔,夏磊,张洪玉,等.板蓝根对施氏鲟幼鱼抗氧化及免疫功能的影响[J].大连海洋大学学报,2013,28(6):573-577.
[8] 明建华,谢骏,徐跑,等.大黄素、维生素C及其配伍对团头鲂感染嗜水气单胞菌后生理生化指标的影响[J].中国水产科学,2011,18(3):588-601.
[9] 李中辉,魏跃钢.中药大青叶、黄柏、龙胆草对小鼠皮肤炎症反应的影响[J].中国麻风皮肤病杂志,2015,31(5):288-289,291.
[10] 线婷,王荻,刘红柏.黄芪、甘草、茯苓对施氏鲟非特异性免疫功能的影响[J].大连海洋大学学报,2018,33(3):365-369.
[11] 郭海燕,于丽娟,王川,等.五倍子对中华倒刺鲃幼鱼血液生理生化指标的影响[J].西南大学学报:自然科学版,2016,38(3):42-48.
[12] 李超,张其中,杨莹莹,等.不同剂量复方中草药免疫增强剂对草鱼生长性能和免疫功能的影响[J].上海海洋大学学报,2011,20(4):534-540.
[13] 姜志强,史会来,赵翀.中草药添加剂对真鲷幼鱼生长和蛋白质消化吸收的影响[J].大连水产学院学报,2008,23(1):63-67.
[14] 马玲巧,彭晓珍,李大鹏.复方中草药添加剂对施氏鲟肌肉营养成分及品质的影响[J].华中农业大学学报,2015,34(3):111-116.
[15] 唐宁,何晓瑾,何晓冬,等.复方中草药对克氏原螯虾生长和脱壳的影响[J].淡水渔业,2009,39(6):70-73.
[16] 冯全英,周永灿,谢珍玉,等.中草药及其在水产养殖中的应用[J].水产科技情报,2006,33(6):251-254.
[17] 索贞,任敏,周好田.黄芪的化学成分及现代药理[J].现代医院,2005,5(9):85-86.
[18] 唐铭坚,谭礼萍,刘争红,等.大黄的药理活性研究进展[J].中国热带医学,2012,12(7):886-889.
[19] 齐茜,刘洪柏,麦丽开,等.复方中草药对闪光鲟生长及血液生化指标的影响[J].江西农业大学学报,2016,38(1):160-167.
[20] 张照红.复方中草药对罗非鱼、草鱼生长性能和非特异免疫功能的影响[D].福州:福建农林大学,2011.
[21] 孔江红.复方中草药对斜带石斑鱼生长性能及非特异性免疫功能的影响[D].厦门:集美大学,2011.
[22] 王吉桥,祁彩霞,程爱香,等.黄芪、熟地和山楂等中草药对黄颡鱼生长和消化的影响[J].水产学杂志,2008,21(1):34-41.
[23] 邱小琮,周洪琪,横山雅仁,等.中草药添加剂对异育银鲫肌肉生化成分的影响[J].上海水产大学学报,2003,12(1):24-28.
[24] Ziaei-Nejad S,Rezaei M H,Takami G A,et al.The effect of Bacillus spp.Bacteria used as probiotics on digestive enzyme activity,survival and growth in the Indian white shrimp Fenneropenaeus indicus[J].Aquaculture,2006,252(2-4):516-524.
[25] 丁贤,李卓佳,陈永青,等.复合中草药对凡纳滨对虾生长和消化酶活力的影响[J].广东海洋大学学报,2007,27(1):22-26.
[26] 陈辉辉,涂晨凌,唐杨,等.复方中草药对凡纳滨对虾生长、消化酶和免疫因子活性及抗WSSV的影响[J].水产学报,2017,41(11):1766-1778.
[27] 何吉祥,李海洋,胡王,等.4种添加剂对异育银鲫生长、消化酶活性及抗氧化能力的影响[J].安徽农业大学学报,2012,39(2):189-194.
[28] 亢玉静,郎明远,赵文.水生生物体内抗氧化酶及其影响因素研究进展[J].微生物学杂志,2013,33(3):75-80.
[29] Pugh S Y,Diguiseppi J L,FridovichI.Induction of superoxide dismutases in Escherichia coli by manganese and iron[J].Journal of Bacteriology,1984,160(1):137-142.
[30] 孙晓飞.棕点石斑鱼中草药免疫增强剂的筛选及其非特异性免疫增强效果研究[D].海口:海南大学,2014.
[31] 张意敏,刘志刚,卢迈新,等.复方中草药对尼罗罗非鱼非特异性免疫功能的影响[J].淡水渔业,2015,45(1):67-72.
[32] 崔晓翠,王印庚,陈霞,等.槟榔、川楝子复方中草药对大黄鱼4种酶活性的影响及对刺激隐核虫的杀灭效果分析[J].中国水产科学,2017,24(2):362-373.
[33] 向枭,陈建,周兴华,等.黄芪多糖对齐口裂腹鱼生长、体组成和免疫指标的影响[J].水生生物学报,2011,35(2):291-299.
[34] 崔惟东,冷向军,李小勤,等.虾青素和角黄素对虹鳟肌肉着色和肝脏总抗氧化能力的影响[J].水产学报,2009,33(6):987-995.
[35] 孙裔雷,王荻,刘红柏.复方中草药对虹鳟抗氧化能力的影响[J].大连海洋大学学报,2015,30(2):170-174.